Method Article
İnsan pluripotent kök hücrelerinin besleyici hücreler üzerinde etilendiamintetraasetik asit aracılı yapışma ile hızlı, uygun maliyetli, enzimsiz geçişi
Bu Makalede
Özet
Besleyici hücrelerde kültürlenen insan embriyonik kök hücrelerinin (hESC'ler) ve insan kaynaklı pluripotent kök hücrelerin (hiPSC'ler) enzimatik veya mekanik geçişiyle ilişkili sınırlamalardan kaçınmak için, EDTA aracılı yapışma bozukluğu kullanılarak insan sünnet derisi fibroblastlarının besleyici hücre tabakasında tutulan hESC veya hiPSC kolonilerinin toplanması için hızlı, etkili, uygun maliyetli, yüksek verimli bir yöntem oluşturduk.
Özet
İnsan pluripotent kök hücreleri (insan embriyonik kök hücreleri, hESC'ler ve insan kaynaklı pluripotent kök hücreler, hiPSC'ler) orijinal olarak uzun süreli kültürde farklılaşmamış bir durumda bakım için farklı besleyici hücre türleri üzerinde kültürlendi. Bu yaklaşımın yerini büyük ölçüde besleyicisiz kültür protokolleri almıştır, ancak bunlar daha maliyetli reaktifler içerir ve hücrelerin farklılaşma kapasitesini kısıtlayan astarlanmış bir duruma geçişi teşvik edebilir. Hem besleyici hem de besleyicisiz koşullarda, geçiş için hESC veya hiPSC kolonilerinin hasat edilmesi, kültürlerin genişletilmesi için gerekli bir prosedürdür.
Besleyici hücrelerde kültürlenen hESC'lerin/hiPSC'lerin geçirilmesi için kolay ve yüksek verimli bir prosedür sağlamak için, kalsiyum şelatörü etilendiamintetraasetik asit (EDTA) tarafından ortaya çıkarılan yapışma bozukluğunu kullanan bir hasat yöntemi oluşturduk. Bu yaklaşımı, kolonilerin mikroskop altında bir neşter ile izole edildiği orijinal mekanik hasat yaklaşımıyla karşılaştırarak elde edilen pasajlı hücrelerin verimini ve kalitesini değerlendirdik (enzimatik hasatla ilişkili reaktif değişkenliğini önlemek için karşılaştırıcı olarak mekanik hasat seçilmiştir).
Bir dizi deneyde, insan sünnet derisi fibroblastlarının besleyici hücre tabakası üzerinde iki farklı hESC hattı korunmuştur. Her hat, EDTA bazlı veya mekanik hasat kullanılarak çoklu geçişlere tabi tutuldu ve koloni büyüklüğü ve morfolojisi, hücre yoğunluğu, kök belirteç ekspresyonu, embriyoid cisimlerdeki üç germ katmanına farklılaşma ve genomik sapmalar açısından değerlendirildi. Başka bir deney setinde, iki farklı hiPSC hattında EDTA bazlı hasat kullandık ve benzer sonuçlar elde ettik. EDTA'nın neden olduğu yapışma kesilmesi zamandan tasarruf sağladı ve mekanik hasada kıyasla daha uygun boyutta ve daha düzgün morfolojide daha yüksek koloni verimi verdi. Ayrıca enzimatik hasattan daha hızlıydı ve enzim parti değişkenliğine eğilimli değildi. EDTA kaynaklı yapışma giderme yöntemi, aşağı akış kullanımı ve analizi için istenirse, hESC/hiPSC hatlarının besleyici hücre bazlı kültürden besleyicisiz koşullara aktarılmasını da kolaylaştırır.
Giriş
HCESC'lerin ve hiPSC'lerin in vitro olarak uygun şekilde bakımı, insan hücresi ve gelişim biyolojisindeki çeşitli araştırma yolları için temel ve uygun bir metodolojidir. hESC'lerin ve hiPSC'lerin doğasında var olan farklılaşma dürtüsü nedeniyle, farklılaşmamış durumu in vitro olarak korumak özel bir özen ve dikkat gerektirir. Bu nedenle, hESC'lerin ve hiPSC'lerin bakımı ve geçişi için mümkün olduğunca az metodolojik değişkenlik ile uygun maliyetli protokoller geliştirmek büyük bir genel faydaya sahiptir.
Başlangıçta, hESC'ler ve hiPSC'ler, farklılaşmamış durumun 1,2,3 uzun süreli kültürüne ve korunmasına yardımcı olmak için farklı tipte besleyici hücreler üzerinde kültürlendi. Daha yakın zamanlarda, besleyici olmayan koşullar altında kültür, besleyici hücrelerle uğraşmaktan tamamen kaçındığı için norm haline gelmiştir4. Bununla birlikte, bazı laboratuvarlar ve çekirdek tesisler hala besleyici hücreler üzerinde hESC'leri veya hiPSC'leri kültürlemektedir. Besleyicisiz kültür daha pahalıdır, çünkü koloni yapışmasını sağlamak için özel bileşimlere sahip kültür ortamının ve kültür yüzeyinin bir tür kaplamasının kullanılmasını gerektirir (ana hücre dışı matris [ECM] bileşenleri veya ticari bir ECM bileşiği veya ticari olarak temin edilebilen kaplanmış plakalar kullanılarak). Masraf önemsiz değildir ve hESC veya hiPSC tabanlı araştırma ve geliştirme yapmakla ilgilenen bazı laboratuvarlar için potansiyel bir mali engel teşkil etmektedir. Ayrıca, besleyicisiz koşullar altında kültür, hESC'leri ve hiPSC'leri besleyici hücrelerde5 tutulandan daha az saf bir duruma getirme eğilimindedir ve bu, sonraki farklılaşmayı tehlikeye atabilir ve genetik varyasyonlarayol açabilir 6.
Tarihsel olarak, besleyici hücreler üzerinde kültürlenen hESC'lerin ve hiPSC'lerin pasajı, mikroskop altında kolonileri çıkarmak için bir neşter kullanarak mekanik hasadı içeriyordu7 - ancak bu daha sonra büyük ölçüde, kolonileri veya ayrışmış hücreleri izole etmek için hafif kazıma ile veya olmadan enzimatik sindirim ile desteklendi. Mekanik hasat sıkıcıdır ve hassas mikrocerrahi gerektirir. Enzimatik hasat, partiden partiye enzim farklılıkları nedeniyle verimlilik açısından değişebilir ve ROCK inhibitörleri 8,9 tarafından etkisiz hale getirilmedikçe hücre ölümünü teşvik eden ve anormal karyotiplerin9 insidansını artıran tam ayrışmayı destekleme eğilimindedir.
Mekanik ve enzimatik hasadın dezavantajlarından kaçınırken, besleyici hücrelerde hESC ve hiPSC'lerin kültürlenmesinin daha düşük masrafından ve daha fazla farklılaşma potansiyelinden yararlanmak için, EDTA aracılı yapışma bozukluğu kullanarak insan sünnet derisi fibroblastlarının besleyici tabakasında tutulan hESC ve hiPSC kolonilerinin hasadı için hızlı, etkili, uygun maliyetli, yüksek verimli bir yöntem oluşturduk. Verimi, değişkenliği ve kök hücre kalitesini mekanik hasatla elde edilenlerle karşılaştırdık (bu yaklaşımın gerektirdiği ek değişkenlik nedeniyle enzimatik sindirimle karşılaştırmadık). EDTA aracılı yapışma bozukluğunun, aşağı akış kullanımı ve analizler için istenirse, kolonileri besleyici bazlı kültürden besleyicisiz koşullara aktarmak için de iyi çalıştığını not ediyoruz. Bu yöntem, tutarlı bir pasaj yöntemi ile bir geçiş sağlar, çünkü EDTA kaynaklı yapışma bozukluğu, besleyici içermeyen kültürler için kullanılan popüler bir yaklaşımdır.
Protokol
Bu protokolde kullanılan tüm malzemeler, reaktifler ve aletler hakkında ayrıntılar için Malzeme Tablosuna bakın.
1. İnsan fibroblast hücrelerinin yetiştirilmesi ve besleyici hücre tabakasının hazırlanması
- Her bir T-75 kültür şişesi başına (ihtiyaç duyulduğunda şişe sayısı) 0.5 ×10 6 insan sünnet derisi fibroblastı (bundan böyle "besleyici hücreler" olarak anılacaktır) 20 mL Iscove's Modified Dulbecco's Medium (IMDM) ile (w/)% 10 fetal sığır serumu (FBS), bundan sonra "besleyici hücre ortamı" olarak adlandırılacaktır.
- Besleyici hücreler %90 birleşmeye ulaştığında, ortamı çıkarın ve ortamdaki faktörler tarafından tripsinin inhibisyonunu önlemek için şişe başına 10 mL Dulbecco'nun Fosfat Tamponlu Salin (DPBS) ile 3 kez yıkayın. Her şişeye 2 mL tripsin-EDTA ekleyin ve şişe(ler)i 37 °C/%5CO2 inkübatöre 5 dakika veya besleyici hücreler şişe(ler)den ayrılana kadar yerleştirin. Mikroskop altında hücrelerin ayrılmasını yüzen hücre kümeleri veya tek hücreler olarak gözlemleyin.
- Tripsin-EDTA'yı etkisiz hale getirmek için her şişeye 5 mL taze önceden ısıtılmış besleyici hücre ortamı ekleyin ve pipetleme yoluyla besleyici hücreleri nazikçe askıya alın.
- Besleyici hücreleri 15 mL'lik bir santrifüj tüpüne aktarın. Tüpü kapatın ve besleyici hücreleri 5 dakika boyunca 200 × g'da santrifüjleyerek peletleyin.
- Besleyici hücre peletini bozmadan süpernatanı dikkatlice çıkarın. Daha sonra, peleti 4 mL taze besleyici hücre ortamında dikkatlice yeniden süspanse edin. Bir hücre sayma odası veya başka bir hücre sayma aparatı kullanarak saymadan önce besleyici hücrelerin iyice yeniden süspanse edildiğinden emin olun.
- Genişleme için gerekli sayıda yeni T-75 kültür şişesine 0,5 ×10 6 besleyici hücre ekleyin ve her şişeye 20 mL taze besleyici hücre ortamı ekleyin. Besleyici hücreler %90 birleşmeye ulaşana kadar kültür şişelerini 37 °C/%5CO2 inkübatörde inkübe edin.
NOT: Besleyici hücreler en az 25. geçişe kadar kullanılabilir. - hESC'lerin/hiPSC'lerin kültürlenmesi için kullanılacak 35 mm'lik doku kültürü kaplarının sayısı için gereken besleyici hücre sayısını hesaplayın.
NOT: Genellikle, doku kültürü kabı başına 3.0 ×10 5 besleyici hücre, birleşik bir besleyici hücre tabakası oluşturmak için yeterlidir. - Besleyici hücrelerin çoğalmasını önlemek için, iki yoldan biriyle mitotik olarak tutuklandıklarından emin olun.
NOT: Her iki yöntem için, büyük miktarda mitotik olarak tutuklanmış besleyici hücreler oluşturulabilir ve daha sonra kullanılmak üzere alikotlarda dondurulabilir.- İhtiyaç duyulan tüm besleyici hücreleri 50 mL'lik bir santrifüj tüpüne aktararak ve besleyici hücre ortamı ile toplam 5 mL hacme kadar doldurarak gama ışınlaması ile mitotik tutuklama gerçekleştirin. Hemen oda sıcaklığında bir gama ışınlama makinesine taşıyın ve besleyici hücreleri mitotik olarak tutuklamak için ışınlayın (20 dakika boyunca 300 kV ve 10 mA).
NOT: Taşımadaki bir gecikme, besleyici hücrelerin 50 mL'lik santrifüj tüpünün duvarına istenmeyen şekilde bağlanmasına neden olabilir. Taşıma birkaç dakikadan fazla sürüyorsa, boruyu sürekli çalkalayarak besleme hücrelerinin taşıma sırasında askıda kalmasını sağlayın. - 5 mL besleyici hücre ortamında ihtiyaç duyulan tüm besleyici hücreleri 50 mL'lik bir santrifüj tüpüne aktararak mitomisin C kullanarak mitotik tutuklama gerçekleştirin ve ardından 20 μg/mL mitomisin C içeren 15 mL besleyici hücre ortamı ekleyin ve 37 °C /% 5 CO2 inkübatörde 3 saat inkübe edin. 20 mL 37 °C PBS ekleyin, hücreleri 5 dakika boyunca 200 × g'da santrifüjleme ile peletleyin, PBS yıkamasını iki kez daha tekrarlayın ve besleyici hücre ortamında yeniden süspanse edin.
- İhtiyaç duyulan tüm besleyici hücreleri 50 mL'lik bir santrifüj tüpüne aktararak ve besleyici hücre ortamı ile toplam 5 mL hacme kadar doldurarak gama ışınlaması ile mitotik tutuklama gerçekleştirin. Hemen oda sıcaklığında bir gama ışınlama makinesine taşıyın ve besleyici hücreleri mitotik olarak tutuklamak için ışınlayın (20 dakika boyunca 300 kV ve 10 mA).
- Besleyici hücreler mitotik olarak tutuklandıktan sonra, doku kültürü başlığına geri dönün ve besleyici hücreleri aşağıdaki gibi 35 mm doku kültürü kabı başına 3.0 ×10 5 hücrede plakalayın. Besleyici hücrelerin tamamen yeniden süspanse edildiğinden emin olun, mL başına 1.5 × 105'lik bir besleyici hücre konsantrasyonuna ulaşmak için besleyici hücre ortamı ekleyin ve her 35 mm'lik doku kültürü kabına bu besleyici hücre süspansiyonundan 2 mL ekleyin.
- Kültür kaplarını 37 °C/%5CO2 inkübatöre aktarın. Besleyici hücrelerin eşit dağılımını sağlamak için, kültür kaplarını inkübatör rafında yavaş ama sıkı bir şekilde 3x ileri ve geri hareket ettirin, ardından bir duraklama yapın ve ardından aynı işlemi soldan sağa 3x gerçekleştirin. Bulaşıkları tekrar hareket ettirmeyin ve inkübatör kapağını yavaşça kapatın.
- 24 saat sonra, besleyici hücre ortamından% 10 serum replasmanı (SR) ile IMDM'ye geçin. Bu ortamı daha sonra her üç günde bir değiştirin. Besleyici hücreler ilk 3 günden sonra kullanıma hazırdır.
2. hESC veya hiPSC kolonilerinin mekanik hasadı
- %80 Dulbecco'nun Modifiye Eagle's Medium (DMEM), %20 SR, 1 mM glutamin ikamesi 100x, 1 mM esansiyel olmayan amino asitler (NEAA), 1 mM penisilin/streptomisin (P/S), 0.1 mM 2-merkaptoetanol ve 10 ng/mL bazik fibroblast büyüme faktöründen (bFGF) oluşan hESC ortamını önceden ısıtın. hESC ortamı, besleyici hücrelerdeki hESC'lerin veya hiPSC'lerin kültürü için kullanılır.
- Mitotik olarak tutuklanmış besleyici hücreler içeren taze 35 mm'lik doku kültürü kaplarını alın ve hESC/hiPSC kolonilerinin transferinden en az 30 dakika önce besleyici hücre ortamını bFGF içeren 1,2 mL hESC ortamı ile değiştirin.
- Bir laminer akış başlığı içine yerleştirilmiş 10x büyütmeli bir mikroskop altında mitotik olarak tutuklanmış besleyici hücrelere hESC / hiPSC kolonileri içeren bir kültür kabı yerleştirin. Her koloninin çevresini dikkatlice kesmek için steril bir neşter kullanın ve ardından her koloniyi kabaca 5-6 eşit parçaya bölün. Koloni parçalarını neşter bıçağının ucuyla dikkatlice kaldırın, böylece besleyici hücre katmanından ayrılırlar ve ortamda serbestçe yüzerler.
- Bir koloni içindeki hESC'lere/hiPSC'lere kıyasla daha az belirgin çekirdeğe sahip daha küçük hücre adaları olarak görünen, farklılaşan hücreler içeren koloni bölgelerinden kaçınmaya çalışın.
- Serbestçe yüzen kolonileri 1 mL'lik bir pipetle besleyici hücreleri içeren yeni kültür kaplarına aktarın. Kolonileri ayrı tutmaya çalışın, böylece daha sonra birbirlerine dönüşmezler. Kültür kaplarını dikkatlice bir hücre inkübatörüne taşıyın ve ertesi güne kadar bulaşıkları rahatsız etmekten kaçının.
- Ertesi gün, bFGF içeren 600 μL hESC ortamını 1.8 mL'lik bir son hacme dikkatlice ekleyin. hESC + bFGF ortamını her gün bir sonraki geçişe kadar (genellikle 1 hafta sonra) değiştirin.
3. EDTA aracılı yapışma bozukluğu kullanılarak hESC veya hiPSC kolonilerinin toplanması
- Mitotik olarak tutuklanmış besleyici hücrelere sahip taze kültür kapları alın ve kolonilerin transferinden en az 30 dakika önce %10 SR ile IMDM'den 1,2 mL önceden ısıtılmış hESC + bFGF ortamına geçin.
- Bir seferde hESC veya hiPSC kolonileri içeren bir kültür kabı kullanın. hESC + bFGF ortamını çıkarın ve olası bağlanmamış hücreleri ve hücre kalıntılarını ortadan kaldırmak için kolonileri 1 mL oda sıcaklığında DPBS ile yıkayın. 1 mL 0,5 mM EDTA ekleyin ve 37 °C'de 1 dakika inkübe edin. Laminer akış başlığında bir ısıtma plakası varsa, daha iyi yapışma için bu adımı ve ısıtma plakası üzerindeki bölüm 4'teki adımları gerçekleştirin.
- 1 dakikalık inkübasyondan sonra, EDTA çözeltisini çıkarın ve 1 mL'lik bir pipet kullanarak dikkatlice 1 mL hESC + bFGF ortamı ekleyin. Kolonileri besleyici hücre katmanından serbest bırakmak için aynı pipetle hafifçe ezin. Besleyici hücre tabakası gevşeyip ayrı bir küme halinde kendi üzerine katlanana kadar dikkatlice ezmeye devam edin. Pipet ucuyla besleyici hücre katmanını çekin.
- Askıda olan hESC/hiPSC kolonilerini yeni bir 1 mL pipet ile besleyici hücreleri ve hESC + bFGF ortamını içeren yeni kültür kaplarına 1:5 oranında bölerek aktarın. Koloniler, her yeni kültür kabı içinde eşit olarak dağılma eğilimindedir, ancak çanağı nazikçe bir yandan diğer yana hareket ettirerek bunu kolaylaştırır. hESC + bFGF ortamını her gün bir sonraki geçişe kadar (genellikle 1 hafta sonra) değiştirin.
Sonuçlar
Aşağıda belgelenen tahlil ve karşılaştırmalarda, iki hESC hattı (sırasıyla WiCell ve Karolinska Enstitüsü'nden H9 ve HS429) ve iki hiPSC hattı (her ikisi de İnsan Pluripotent Kök Hücreleri için Norveç Çekirdek Tesisi tarafından üretilen NCS001 ve NCS002) kullandık. Şekil ve tablolarda sunulan veriler hESC hatlarından alınmıştır, ancak hiPSC hatlarından tamamen benzer sonuçlar elde edilmiştir.
Elimizde, mekanik hasat, kolonilerin ~200-250 μm çapında yaklaşık beş ila altı kümeye bölünmesine neden olurken, EDTA'nın neden olduğu yapışma ve ardından öğütme ile, her koloni ~60 μm çapında ~10-20 kümeye bölündü. EDTA ile hasat edilen her kümedeki hücre sayısının ~ 20 olduğunu tahmin ediyoruz. Bir koloniyi bir neşter ile bu büyüklükteki kümelere bölmek pratik olmadığından, bu bakımdan, EDTA'nın neden olduğu yapışma bozukluğu, koloni hücresinin hayatta kalması için daha elverişli boyutta kümeler oluşturduğundanüstündür 10,11.
EDTA kullanılarak hasat edilen hESC/hiPSC kolonileri, mekanik olarak hasat edilen kolonilere kıyasla boyut ve şekil olarak daha homojendi (Şekil 1A-F). Bunun nedeni, mekanik hasat için gereken kesimin düz olmayan kenarlar ve değişen yığın boyutları oluşturmasıdır. Bunu nicel olarak değerlendirmek için, ImageJ-win64 protokolünü12 kullanarak geçtikten 5 gün sonra koloni daireselliğini (koloni kenarlarının ne kadar yuvarlak olduğunun bir ölçüsü olarak; 1 değeri mükemmel bir daireyi gösterir) değerlendirdik. Mekanik olarak hasat edilen kolonilerde koloni döngüselliği önemli ölçüde daha düşüktü (mekanik hasat: 0.61 ± 0.10; EDTA bazlı hasat: 0.84 ± 0.01; n = 10, p < 0.001, Mann-Whitney U-testi, U = 10).
Koloni oluşumu sırasında hasat sonrası hücre-hücre etkileşimlerinin bir ölçüsü olan hasat edilen ve yeniden kaplanan kolonilerdeki hücre yoğunluğu, EDTA bazlı hasat ve mekanik hasat ile benzerdi (Tablo 1 ve Şekil 1G, H). Mekanik olarak hasat edilen koloniler, merkez bölgelerinde nekroz geliştirme eğilimi daha yüksekti (Şekil 1J). Bu muhtemelen şekildeki değişkenlikten ve özellikle mekanik olarak izole edilmiş hücre kümelerinin boyutundan kaynaklanıyordu, çünkü bu kümeler çok büyük olduğunda, yeni kültür kaplarına aktarılırken kolayca kendi üzerlerine katlanabilirler. Farklı kenarlara sahip yarı saydam bir görünüm sergileyen EDTA kullanılarak hasat edilen kolonilerde durum böyle değildi (Şekil 1I).
EDTA bazlı hasat kullanarak, esasen bir kuyuda kurulmuş olan tüm kolonileri 2-3 dakika içinde toplayabildik. Mekanik hasat kullanarak, tüm kolonileri bir kuyuda toplamak sıkıcı ve zaman alıcı olacaktır. Tipik olarak mekanik hasat kullanarak yalnızca ~%30 veya ~20-25 koloni toplamayı başardık ve bu ~20 dakika sürdü. Benzer şekilde, kollajenaz sindirimi ve ardından hafif kazıma kullanılarak, toplam prosedür sadece birkaç dakika sürmesine rağmen, tüm kolonileri hasat etmek tipik olarak zordu. Bu nedenle, EDTA bazlı hasat, enzimatik hasattan daha hızlı veya daha hızlıdır ve mekanik veya enzimatik hasattan daha verimlidir.
Farklı hasat yöntemlerinin saplılık ve pluripotentlik üzerindeki etkisini değerlendirmek için, önce EDTA bazlı veya mekanik hasat kullanılarak 20 geçişten sonra elde edilen kolonileri qPCR analizine (Şekil 2) ve saplılık belirteçleri için immünositokimyasal boyamaya (Şekil 3 ve Şekil 4) tabi tuttuk. Her iki yöntem kullanılarak elde edilen koloniler, hem mRNA hem de protein seviyelerinde stabil bir saplılık belirteçleri ekspresyonu sergiledi. Daha sonra embriyoid cisimlerdeki üç germ katmanına farklılaşarak pluripotentliği değerlendirdik (Şekil 5 ve Şekil 6). Her iki yöntem kullanılarak 20 geçişten sonra elde edilen hESC'lerden veya hiPSC'lerden üretilen embriyoid cisimler, ektoderm, mezoderm ve endoderm için yaygın olarak değerlendirilen belirteçleri eksprese eden bir hücre karışımı içeriyordu.
Son olarak, qPCR tabanlı genetik analiz kullanarak her bir yöntemle geçirilen hESC'lerde ve hiPSC'lerde genomik anormalliklerin insidansını değerlendirdik (bkz. Her iki hasat yöntemi kullanılarak 20 geçişten sonra elde edilen koloniler, bir referans diploid kromozomal modelden bazı mütevazı sapma örnekleri sergiledi (değerlendirilen anormallikler, genellikle hiPSC'lerin yeniden programlanmasıyla ilişkili olanlardı, ancak hESC'lerde de elde edilebilir) (Şekil 7). Bununla birlikte, bu sapmaların paterni, her iki hasat yönteminden sonra elde edilen kolonilerde esasen aynıydı ve bu da hasat yöntemiyle bağlantılı olmadıklarını gösteriyordu.
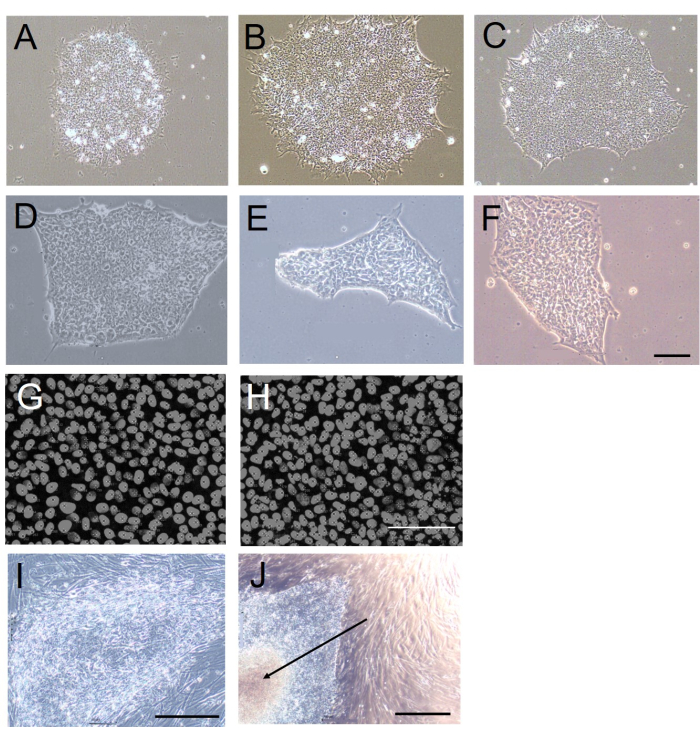
Şekil 1: EDTA bazlı veya mekanik hasadı takiben koloni morfolojisi ve hücre yoğunluğu. (AF) (A-F) EDTA bazlı veya (D-F) mekanik hasat kullanılarak 20 geçişten sonra 5 gün boyunca besleyicisiz kültürde kurulan H9 hESC kolonilerinin temsili parlak alan görüntüleri. (G,H) (G) EDTA bazlı veya (H) mekanik hasat kullanılarak 20 geçişten sonra oluşturulan H9 hESC kolonilerindeki hücre yoğunluğunun temsili floresan görüntüleri. Hücre çekirdekleri DAPI ile boyanır. (I,J) (I) EDTA bazlı veya (J) mekanik hasat kullanılarak 20 geçişten sonra kurulan H9 hESC kolonilerinin temsili parlak alan görüntüleri. Mekanik olarak hasat edilen kolonideki nekrotik merkezi bölgeye dikkat edin (J'deki ok). Tüm görüntüler 20. geçişten 5 gün sonra elde edildi. Ölçek çubukları = 100 μm. Kısaltmalar: hESC = insan embriyonik kök hücresi; EDTA = etilendiamintetraasetik asit; DAPI = 4',6-diamidino-2-fenilindol. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
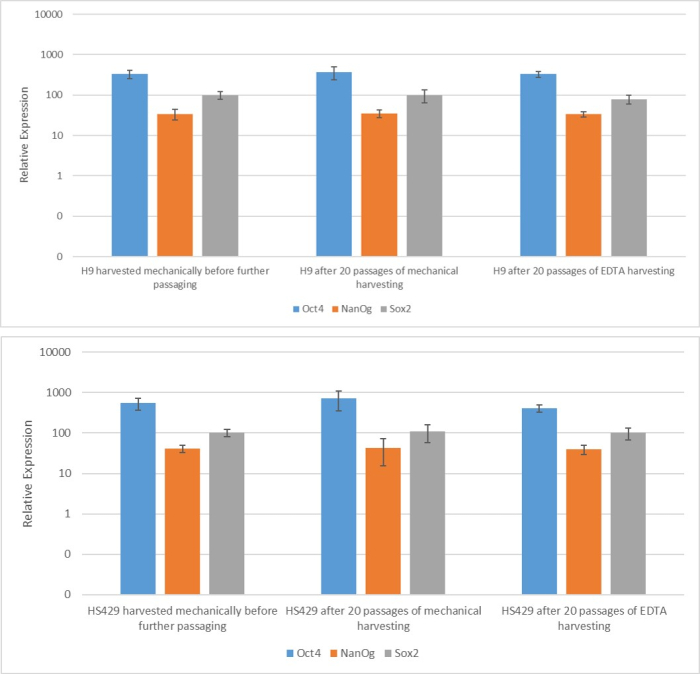
Şekil 2: EDTA bazlı veya mekanik hasattan sonra üretilen iki hESC hattında (H9 ve HS429) köklülük belirteci mRNA'nın ekspresyonu. H9 (üst panel) ve HS429 (alt panel) hESC'lerde belirtilen belirteçlerin kantitatif gerçek zamanlı polimeraz zincir reaksiyonu, mekanik hasat kullanılarak tek bir geçişten sonra, mekanik hasat kullanılarak 20 geçişten sonra ve EDTA bazlı hasat (1:5 seyreltme) kullanılarak 20 geçişten sonra. Ekspresyon seviyesi, temizlik geni ACCB'ninkine (beta-aktin) görecelidir. Hata çubukları standart sapmayı gösterir. Kısaltmalar: hESC = insan embriyonik kök hücresi; EDTA = etilendiamintetraasetik asit. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
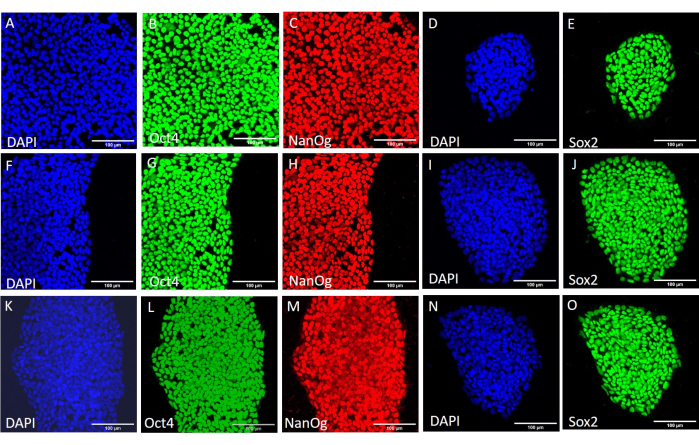
Şekil 3: Farklı hasat koşullarından sonra H9 hESC hattındaki saplılık işaretleyici proteinlerin ekspresyonu. Daha fazla geçişten önce mekanik olarak (AE), mekanik hasat kullanılarak 20 geçişten sonra (FJ) ve EDTA bazlı hasat kullanılarak 20 geçişten sonra (KO) hasat edilen H9 hESC kolonilerinin temsili immünofloresan boyama. Ölçek çubukları = 100 μm. Kısaltmalar: hESC = insan embriyonik kök hücresi; EDTA = etilendiamintetraasetik asit; DAPI = 4',6-diamidino-2-fenilindol. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
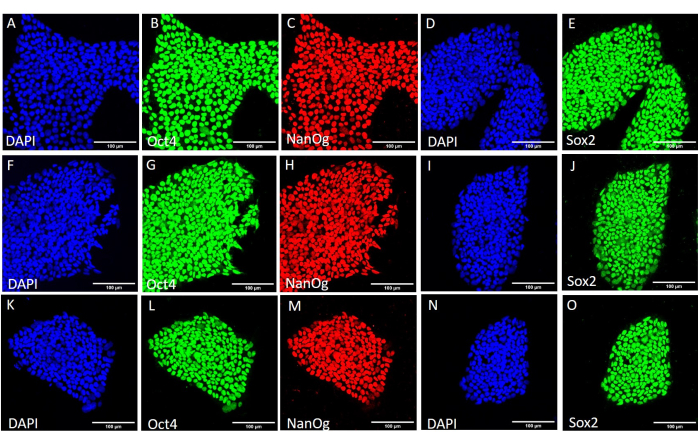
Şekil 4: Farklı hasat koşullarından sonra HS429 hESC hattındaki saplılık işaretleyici proteinlerin ekspresyonu. HS429 hESC kolonilerinin temsili immünofloresan boyaması, daha fazla pasajdan önce mekanik olarak (AE), mekanik hasat kullanılarak 20 geçişten sonra (FJ) ve EDTA bazlı hasat kullanılarak 20 geçişten sonra (KO). Ölçek çubukları = 100 μm. Kısaltmalar: hESC = insan embriyonik kök hücresi; EDTA = etilendiamintetraasetik asit; DAPI = 4',6-diamidino-2-fenilindol. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
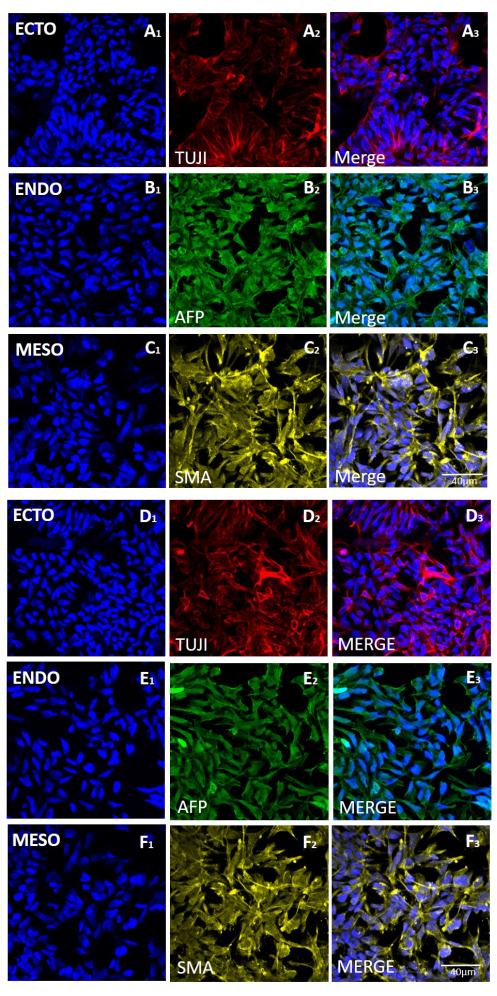
Şekil 5: Mekanik veya EDTA bazlı hasadı takiben H9 hESC hattından üretilen embriyoid cisimlerdeki üç germ tabakası için belirteçlerin ekspresyonu. (A ve D sıraları) ektoderm (ECTO, TUJI), (B ve E sıraları) endoderm (ENDO, AFP) ve (C ve F sıraları) mezoderm (MESO, SMA) için belirteçlerin temsili immünofloresan boyama. EB'ler, 20 mekanik hasat geçişinden sonra (AC) veya 20 EDTA bazlı hasattan sonra (DF) üretilir. Ölçek çubukları = 40 μm. Kısaltmalar: hESC = insan embriyonik kök hücresi; EDTA = etilendiamintetraasetik asit; EB'ler = embriyoid cisimler. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
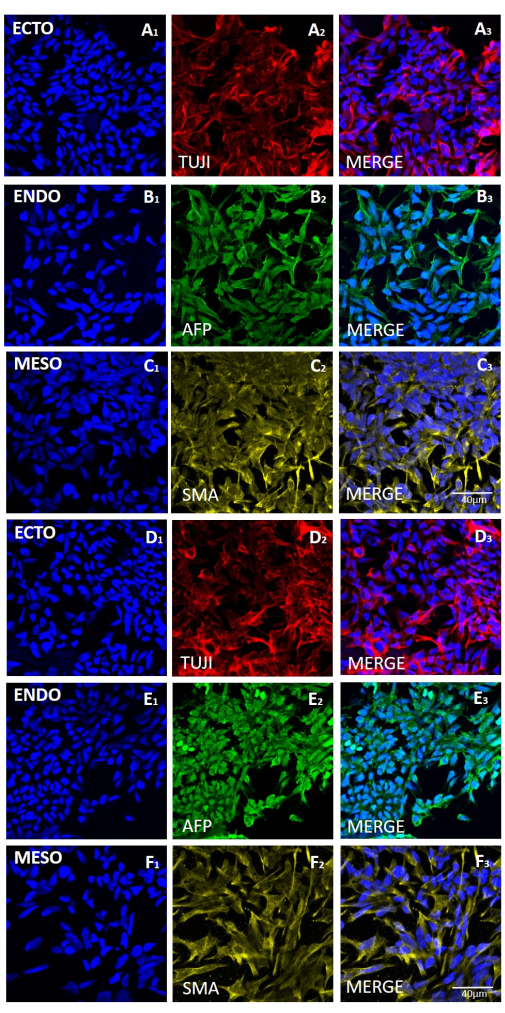
Şekil 6: Mekanik veya EDTA bazlı hasadı takiben HS429 hESC hattından üretilen embriyoid cisimlerdeki üç germ tabakası için belirteçlerin ekspresyonu. (A ve D sıraları) ektoderm (ECTO, TUJI), (B ve E sıraları) endoderm (ENDO, AFP) ve (C ve F sıraları) mezoderm (MESO, SMA) için belirteçlerin temsili immünofloresan boyama. 20 pasajlık mekanik hasattan sonra (A-C) veya 20 pasajlı EDTA bazlı hasattan sonra (D-F) üretilen EB'ler. Ölçek çubukları = 40 μm. Kısaltmalar: hESC = insan embriyonik kök hücresi; EDTA = etilendiamintetraasetik asit; EB'ler = embriyoid cisimler. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
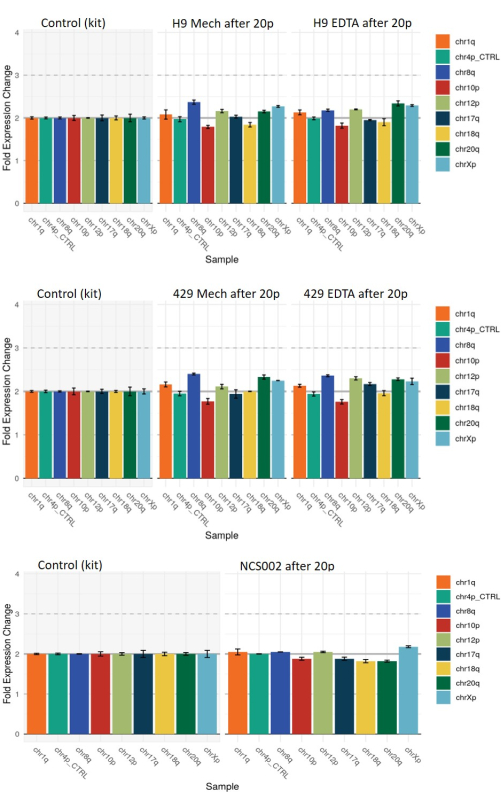
Şekil 7: Mekanik veya EDTA bazlı hasat kullanılarak 20 geçişi takip eden HS9 ve HS429 ESC hatlarında ve NCS002 iPSC hattında yaygın genomik anormalliklerin qPCR tabanlı genetik analizi. 2 değerindeki taban çizgisi, tüm kromozomal belirteçlerde normal diploidi temsil eder. 1 veya 3 değeri, tüm hücrelerde belirtilen kromozomal markörün sırasıyla kaybını veya kazancını temsil eder. 1 ile 2 arasındaki veya 2 ile 3 arasındaki ara değerler, hücrelerin bir kısmında belirtilen işaretleyicinin bir kaybının veya kazancının varlığını gösterir. Sapma modelinin iki hasat koşulunda benzer olduğuna dikkat edin. Kısaltmalar: ESC = embriyonik kök hücre; EDTA = etilendiamintetraasetik asit; iPSC = indüklenmiş pluripotent kök hücre. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
| Hücre yoğunluğu (hücre/mm2) | ||
| H9 Serisi | demek | stdev |
| Daha fazla geçişten önce mekanik hasat | 3918 | 263.3 |
| Mekanik hasat 20 kez | 3868 | 197.7 |
| EDTA hasadı 20 kez | 4080 | 127.8 |
| HS429 Serisi | demek | stdev |
| Daha fazla geçişten önce mekanik hasat | 5249 | 565.4 |
| Mekanik hasat 20 kez | 5247 | 726.3 |
| EDTA hasadı 20 kez | 4963 | 448.8 |
Tablo 1: EDTA bazlı veya mekanik hasattan sonra üretilen iki hESC hattından (H9 ve HS429) kolonilerdeki hücre yoğunluklarının karşılaştırılması. Hücre yoğunlukları, mekanik hasat kullanılarak tek bir geçişten sonra, mekanik hasat kullanılarak 20 geçişten sonra veya EDTA bazlı hasat kullanılarak 20 geçişten sonra (1: 5 seyreltmede) değerlendirildi. Her durumda, n = 5 koloni.
Tartışmalar
EDTA aracılı yapışma bozukluğu kullanılarak besleyici hücreler üzerinde kültürlenen hESC'lerin ve hiPSC'lerin hasat edilmesi için hızlı ve uygun maliyetli bir yöntem tanımladık ve bunu öncelikle bir neşter kullanarak geleneksel mekanik hasat yöntemiyle karşılaştırdık. Ayrıca, EDTA bazlı hasadı, yöntemin hızı açısından enzimatik hasatla karşılaştırdık, ancak ortaya çıkan koloni kalitesinin yönlerine göre karşılaştırmadık. Bunun nedeni, enzimatik hasadın doğası gereği daha değişken olması ve yöntemler arası farklılıkları gizleyebilecek daha yüksek bir genomik sapmaprevalansı 5 ile bağlantılı olmasıdır.
EDTA bazlı hasadın diğer yöntemlerden daha hızlı ve daha verimli olduğunu ve mekanik hasattan daha küçük ve morfolojik olarak daha homojen koloniler ürettiğini gösteriyoruz. Bu ikinci özellik, hücre sağkalımı açısından faydalıdır, çünkü mekanik hasatla elde edilen daha büyük kümeler merkezi nekroza eğilimlidir, enzimatik sindirim ise apoptoza daha yatkın olan ve hayatta kalmak için örneğin ROCK inhibitörleri ile ekstra tedavi gerektiren izole hESC'ler ve hiPSC'ler üretme eğilimindedir. EDTA bazlı hasat en az 20 geçiş için kullanılabilir. EDTA bazlı ve mekanik hasat yöntemleri, koloni hücre yoğunluğu, mRNA ve kök genlerinin protein ekspresyonu, embriyoid cisimlerdeki üç germ tabakasının farklılaşması ve genomik anormallikler söz konusu olduğunda karşılaştırılabilir. Amaç verimlilik, daha yüksek verim, daha az değişkenlik ve hESC'lerin ve hiPSC'lerin daha nazik kullanımı ise, EDTA bazlı hasat tercih edilir.
Ayrıca, besleyici hücrelerde kültürlenen hESC'lerin ve hiPSC'lerin EDTA bazlı hasadının, daha saf bir durumu korumanın ucuz bir yolu olduğunu ve bunun arzu edildiği durumlarda besleyici tabanlıdan besleyicisiz kültüre yumuşak bir geçiş sağladığını da not ediyoruz.
Protokol içindeki kritik adımlar
EDTA aracılı yapışmanın en kritik adımları, protokol bölüm 3 (EDTA çözeltisinde inkübasyon) ve bölüm 4'tür (öğütme). EDTA çözeltisine maruz kalma 1 dakikadan uzunsa, tek hücrelere tamamen ayrışma riski artar. Bu, öğütme çok uzun veya çok sertse de ortaya çıkabilir. İkincisi, pipet ucu boyutundan etkilenir. Burada açıklandığı gibi 1 mL hücre kültürü pipetlerinin kullanılması idealdir. Daha küçük uç çapına sahip farklı türde bir pipet kullanmak risklidir.
Sorun giderme
Besleyici hücreler çoğalmaya devam ederse, mitotik tutuklama etkili olmamıştır ve yeni bir parti alınmalı ve prosedür yeniden başlatılmalıdır. Koloniler besleyici hücre katmanından gevşemezse, EDTA'da Ca2 + olmadığından ve EDTA'yı eklemeden önce kalan hücre kültürü ortamını çıkarmak için kolonileri içeren kültür kabının PBS ile iyice durulandığından emin olunmalıdır. İzole edilmiş hücreler veya çok küçük hücre kümeleri oluşturan çok fazla ayrışma, aşırı yıpranma nedeniyle ortaya çıkabilir ve yeni kolonilerin kurulmasını tehlikeye atabilir. Ortaya çıkan hücre kümelerinin ~ 60 μm çapında olduğunu doğrulamak için protokolün deneme çalışmalarında öğütme derecesi ampirik olarak belirlenmelidir. Besleyici katman, özellikle hESC'ler/hiPSC'ler hasada hazır olmadan önce kültür kabından kendiliğinden ayrılırsa, bunun nedeni besleyici hücrelerin hazırlandıktan sonra ~7 gün içinde kullanılmamış olması olabilir. Bu nedenle, besleyici hücrelerin kullanım süresi dikkatle izlenmelidir. EDTA'ya maruz kalma sırasında besleyici katman ayrışırsa (burada kullanılan besleyici hücrelerde hiç gözlemlemediğimiz bir şey), besleyici hücrenin tipi veya kültür yöntemi değiştirilmelidir.
Tekniğin sınırlamaları
Tekniğin ana sınırlaması, başarılı bir sonuç elde etmek için yapışma işleminin görsel olarak incelenmesini gerektirmesidir. Bu, kullanıcıların, kolonilerin besleyici hücre katmanından ne zaman salındığını ve besleyici hücre katmanının alt tabakadan ne zaman gevşediğini nasıl belirleyeceklerini öğrenmeleri gerektiği anlamına gelir. Bununla birlikte, bu zor değildir ve deneyimlerimize göre, tekniğin yeni kullanıcıları birkaç denemede ustalaşabilir.
Hasat edilen hESC'lerin veya hiPSC'lerin birkaç besleyici hücre tarafından kontamine olma olasılığı da vardır. Amaç, besleyici olmayan koşullara geçmek veya tahliller için hESC'leri veya hiPSC'leri izole etmekse, bu tür kontaminasyon saflığı tehlikeye atacaktır. Burada kullanılan besleyici hücrelerle (insan sünnet derisi fibroblastları), enzimatik sindirimde bile besleyici hücre tabakasını ayırmanın son derece zor olduğunu not ediyoruz (gösterilmemiştir). Ayrışmamış besleyici hücre tabakası toto'da çıkarıldığından, hasat edilen hESC'lerin veya hiPSC'lerin kontaminasyonu muhtemelen ihmal edilebilir düzeydedir. Besleyici hücreler ayrıca mitotik olarak tutuklandığından, herhangi bir kontaminasyon, hESC'lerin veya hiPSC'lerin daha fazla geçmesiyle sonunda sıfıra inecektir.
Mevcut yöntemlere göre önemi
hESC'lerin ve hiPSC'lerin kültürlenmesi için mevcut norm, bunu geçiş için EDTA kullanımının yaygın olduğu besleyicisiz koşullar altında yapmaktır. Besleyicisiz kültür, yapışmayı sağlayan özel olarak formüle edilmiş ortam ve kültür substratlarının kullanımına bağlıdır. Bu reaktifler, bazı laboratuvar bütçelerini aşabilecek ek bir masraf gerektirir. Ek olarak, besleyicisiz koşullar altında kültür, besleyicisiz kültür ortamında spesifik faktörlerin olmaması ve bunun sonucunda saf durumdan astarlanmış duruma geçiş nedeniyle bozulmuş bir farklılaşma potansiyeli ile ilişkilendirilmiştir. Mitotik olarak tutuklanmış besleyici hücreler üzerindeki büyüme, bu geçişi önler ve genel maliyetleri yönetilebilir bir seviyeye indirebilir, böylece laboratuvar araştırmalarında pluripotent kök hücrelerin daha geniş kullanımını kolaylaştırır.
Açıklamalar
Joel C. Glover direktör ve Hege Brincker Fjerdingstad, Norveç İnsan Pluripotent Kök Hücreleri Çekirdek Tesisi'nin günlük yöneticisidir. Yazarların ifşa etmek için rekabet eden mali çıkarları veya diğer çıkar çatışmaları yoktur.
Teşekkürler
Ön deneyler sırasındaki yardımları için Lars Moen'e ve tesislerin kullanımı için Oslo Üniversitesi Hastanesi Norveç Kök Hücre Araştırma Merkezi'ndeki İnsan Pluripotent Kök Hücreleri için Norveç Çekirdek Tesisi'ne teşekkür ederiz. H9 hESC hattı WiCell'den, HS429 hESC hattı ise Karolinska Enstitüsü'ndeki Outi Hovatta'dan elde edildi. Her ikisi de Malzeme Transfer Anlaşmalarına uygun olarak kullanılmıştır. NCS001 ve NCS002 hiPSC hatları, İnsan Pluripotent Kök Hücreleri için Norveç Çekirdek Tesisi tarafından üretildi. Bu yeniden programlama ve burada bildirilen tüm çalışmalar, Güneydoğu Norveç Bölgesel Etik Komitesi'nin onayı ile gerçekleştirilmiştir (onay REK 2017/110).
Malzemeler
| Name | Company | Catalog Number | Comments |
| 0.5 M EDTA pH 8.0 | Invitrogen | 15575020 | |
| 15 mL centrifuge tubes | Sarstedt | 62.554.502 | |
| 2-mercaptoethanol | Gibco | 31350-010 | |
| 50 mL centrifuge tubes | Sarstedt | 62.547.254 | |
| Basic fibroblast growth factor (bFGF) | PeproTech | AF-100-18B-250UG | |
| Brand Bürker Chamber | Fisher Scientific | 10628431 | |
| Disposable scalpels no.15 | Susann-Morton | 505 | |
| DPBS (1x) without Ca/Mg | Gibco | 14190-094 | |
| Easy Grip tissue culture dish, 35 x 10 mm | Falcon | 353001 | |
| Eppendorf pipette 1 mL | Eppendorf | ||
| Eppendorf pipette 200 μL | Eppendorf | ||
| FBS (Fetal Bovine Serum) | Gibco | 10270-106 | |
| Filter tip 1,000 μL | Sarstedt | 70.1186.210 | |
| Filter tip 200 μL | Sarstedt | 70.760.211 | |
| Gamma Cell 3000 ELAN irradiation machine (alternatively, use Mitomycin C to arrest proliferation) | Best Theratronics | BT/MTS 8007 GC3000E | |
| Glutamax 100x | Gibco | 35050-038 | |
| Growth Factor Reduced Matrixgel | Corning | 734-0269 | |
| H9 hESC line | WiCell | WAe009-A | |
| hPSC Genetic Analysis Kit | Stem Cell Technologies | #07550 | |
| HS429 hESC line | ECACC | KIe024-A | |
| Human Foreskin Fibroblasts -CRL2429 line | ATTC | CRL2429 | |
| IMDM (1x) | Gibco | 21980-032 | |
| iPSC lines | Norwegian Core Facility for Human Pluripotent Stem Cells | NCS001 & NCS002 | |
| Knockout DMEM | Gibco | 10829-018 | |
| Laser Scanning Confocal Microscope or equivalent (we use the LSM 700 from Zeiss) | Zeiss | ||
| Microscope | CETI | ||
| Mitomycin C | Sigma Aldrich | M4287 | |
| Non-essential amino acids (NEAA) | Gibco | 11140.035 | |
| Pipettes, plastic 10 mL | Sarstedt | 86.1254.001 | |
| Pipettes, plastic, 5 mL | Sarstedt | 86.1253.001 | |
| Serum Replacement (SR) | Gibco | 10828-028 | |
| Sterile filters 0.22 um | Sarstedt | 83.1826.102 | |
| T-75 culture flask | ThermoScientific | 156499 | |
| Trypan Blue Stain (0.4 %) | Gibco | 15250-061 | |
| Trypsin-EDTA, 500 mL | Gibco | 25300062 |
Referanslar
- Skottman, H., Hovet, O. Culture conditions for human embryonic stem cells. Reproduction. 132 (5), 691-698 (2006).
- Hovatta, O., et al. A culture system using human foreskin fibroblasts as feeder cells allows production of human embryonic stem cells. Human Reproduction. 18 (7), 1404-1409 (2003).
- Desai, N., Rambhia, P., Gishto, A. Human embryonic stem cell cultivation: historical perspective and evolution of xeno-free culture systems. Reproductive Biology and Endocrinology. 13, 9(2015).
- Villa-Diaz, L. G., et al. Synthetic polymer coatings for long-term growth of human embryonic stem cells. Nature Biotechnology. 28 (6), 581-583 (2010).
- Watanabe, M., et al. TGFb superfamily signaling regulates the state of human stem cell pluripotency and capacity to create well-structured telencephalic organoids. Stem Cell Reports. 17 (10), 2220-2238 (2022).
- Garitaonandia, I., et al. Increased risk of genetic and epigenetic instability in human embryonic stem cells associated with specific culture conditions. PLoS One. 10 (2), e0118307(2015).
- Inzunza, J., et al. Derivation of human embryonic stem cell lines in serum replacement medium using postnatal human fibroblasts as feeder cells. Stem Cells. 23, 544-549 (2005).
- Watanabe, K., et al. A ROCK inhibitor permits survival of dissociated human embryonic stem cells. Nature Biotechnology. 25 (6), 681-686 (2007).
- Rivera, T., Zhao, Y., Ni, Y., Wang, J. Human-induced pluripotent stem cell culture methods under cGMP conditions. Current Protocols in Stem Cell Biology. 54 (1), 117(2020).
- Castro-Viñuelas, R., et al. Tips and tricks for successfully culturing and adapting human induced pluripotent stem cells. Molecular Therapy. Methods & Clinical Development. 23, 569-581 (2021).
- Meng, G., Rancourt, D. E. Derivation and maintenance of undifferentiated human embryonic stem cells. Methods in Molecular Biology. 873, 69-90 (2012).
- Schindelin, J., et al. Fiji: An open-source platform for biological-image analysis. Nature Methods. 9 (7), 676-682 (2012).
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiThis article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır