Method Article
העברה מהירה, חסכונית ונטולת אנזימים של תאי גזע פלוריפוטנטיים אנושיים על תאי הזנה על ידי דיס-היצמדות בתיווך חומצה אתילאנדיאנטית
In This Article
Summary
כדי להימנע מהמגבלות הקשורות למעבר אנזימטי או מכני של תאי גזע עובריים אנושיים (hESCs) ותאי גזע פלוריפוטנטיים המושרים על ידי בני אדם (hiPSCs) בתרבית על תאי הזנה, ביססנו שיטה מהירה, יעילה, חסכונית ובעלת תפוקה גבוהה לקצירת מושבות hESC או hiPSC המתוחזקות על שכבת תאי הזנה של פיברובלסטים אנושיים של עורלה באמצעות דיס-הדבקה בתיווך EDTA.
Abstract
תאי גזע פלוריפוטנטיים אנושיים (תאי גזע עובריים אנושיים, תאי גזע עובריים אנושיים ותאי גזע פלוריפוטנטיים המושרים על ידי בני אדם, hiPSCs) גודלו במקור בתרבית על סוגים שונים של תאי הזנה לצורך תחזוקה במצב בלתי ממוין בתרבית ארוכת טווח. גישה זו הוחלפה במידה רבה על ידי פרוטוקולי תרבית נטולי הזנה, אך אלה כרוכים בריאגנטים יקרים יותר ויכולים לקדם מעבר למצב ראשוני, המגביל את יכולת ההתמיינות של התאים. הן בתנאים מזינים והן בתנאים נטולי מזינים, קציר מושבות hESC או hiPSC למעבר הוא הליך הכרחי להרחבת התרביות.
כדי לספק הליך קל ובעל תפוקה גבוהה להעברת תאי גזע עובריים (HESCs/hiPSCs) בתרבית על תאי הזנה, ביססנו שיטת קציר באמצעות דיס-הידבקות המופקת על-ידי תצבית הסידן אתילאנדיאמין טטראצטי חומצה (EDTA). הערכנו את היבול והאיכות של התאים העוברים המתקבלים על ידי השוואת גישה זו לגישת הקציר המכנית המקורית, שבה מושבות מבודדות באמצעות אזמל תחת מיקרוסקופ (קציר מכני נבחר כמשווה כדי למנוע את השונות המגיבה הקשורה לקציר אנזימטי).
בסדרה אחת של ניסויים, שני קווי תאי גזע עובריים שונים נשמרו על שכבת תא הזנה של פיברובלסטים אנושיים של עורלה. כל שורה עברה מעברים מרובים באמצעות קציר מבוסס EDTA או מכני והוערכה עבור גודל המושבה והמורפולוגיה, צפיפות התא, ביטוי סמני גזע, התמיינות לשלוש שכבות הנבט בגופי העובר וסטיות גנומיות. בסדרת ניסויים אחרת, השתמשנו בקציר מבוסס EDTA בשני קווי hiPSC שונים והשגנו תוצאות דומות. דיס-היצמדות הנגרמת על ידי EDTA חסכה זמן ונתנה יבול גבוה יותר של מושבות בגודל נוח יותר ומורפולוגיה אחידה יותר בהשוואה לקציר מכני. הוא גם היה מהיר יותר מקציר אנזימטי ולא היה נוטה לשינויים באצווה של אנזימים. שיטת דיס-היצמדות הנגרמת על ידי EDTA גם מקלה על העברת קווי hESC/hiPSC מתרביות מבוססות תאי הזנה לתנאים נטולי מזין במידת הצורך לשימוש וניתוח במורד הזרם.
Introduction
תחזוקה נאותה של תאי גזע עובריים ותאי גזע עובריים במבחנה היא מתודולוגיה בסיסית ונוחה למספר כיווני מחקר בביולוגיה תאית והתפתחותית של התא האנושי. בשל הדחף המובנה של תאי גזע עובריים ו- hiPSCs להבדיל, שמירה על המצב הבלתי מובחן במבחנה דורשת טיפול ותשומת לב מיוחדים. לפיכך, פיתוח פרוטוקולים חסכוניים לתחזוקה והעברה של hESCs ו- hiPSCs עם שונות מתודולוגית קטנה ככל האפשר הוא בעל תועלת כללית רבה.
במקור, תאי גזע עובריים (תאי גזע עובריים) ו-hiPSCs גודלו בתרבית על סוגים שונים של תאי הזנה כדי לסייע בתרבית ארוכת טווח ובתחזוקה של המצב הבלתי ממוין 1,2,3. לאחרונה, תרבית בתנאים נטולי מזין הפכה לנורמה, מכיוון שהיא נמנעת לחלוטין מהתמודדות עם תאי הזנה4. עם זאת, חלק מהמעבדות ומתקני הליבה עדיין מתרביבים תאי גזע עובריים עובריים (HESCs) או hiPSCs על תאי הזנה. תרבית ללא הזנה יקרה יותר מכיוון שהיא דורשת שימוש באמצעי תרבית של קומפוזיציות מיוחדות וצורה כלשהי של ציפוי משטח התרבית כדי להבטיח היצמדות למושבה (רכיבי מטריצה חוץ-תאיים עיקריים [ECM] או תרכובת ECM מסחרית, או שימוש בלוחות מצופים זמינים מסחרית). ההוצאה אינה טריוויאלית ומהווה מכשול פיננסי פוטנציאלי עבור חלק מהמעבדות המעוניינות להמשיך במחקר ופיתוח מבוססי hESC או hiPSC. יתר על כן, תרבית בתנאים נטולי מזין נוטה להניע את תאי הגזע העובריים וה-hiPSCs למצב פחות נאיבי מזה שנשמר על תאי הזנה5, וזה יכול לפגוע בהתמיינות שלאחר מכן ולהוביל לשינויים גנטיים6.
מבחינה היסטורית, המעבר של תאי גזע עובריים (תאי גזע עובריים) ושל תאי גזע עובריים (hiPSCs) שגודלו בתרבית על תאי הזנה היה כרוך בקציר מכני – שימוש באזמל כדי לסלק מושבות תחת מיקרוסקופ7 – אך מאוחר יותר זה הוחלף במידה רבה על ידי עיכול אנזימטי עם או בלי גירוד עדין כדי לבודד מושבות או תאים מנותקים. קציר מכני הוא מייגע ודורש מיקרו-כירורגיה מדויקת. קציר אנזימטי יכול להשתנות ביעילותו עקב הבדלי אנזימים מאצווה לאצווה ונוטה להעדיף דיסוציאציה מוחלטת, המקדמת מוות תאי אלא אם כן מנוטרלת על ידי מעכבי ROCK 8,9 ומגדילה את השכיחות של קריוטיפים חריגים9.
כדי לנצל את ההוצאות הנמוכות יותר ואת פוטנציאל ההתמיינות הגדול יותר של גידול תאי גזע עובריים עובריים (תאי גזע עובריים) ו-hiPSCs על תאי הזנה תוך הימנעות מהחסרונות של קציר מכני ואנזימטי, ביססנו שיטה מהירה, יעילה, חסכונית ובעלת תפוקה גבוהה לקצירת מושבות hESC ו-hiPSC המתוחזקות על שכבת הזנה של פיברובלסטים אנושיים בעורלה באמצעות דיס-הדבקה בתיווך EDTA. השווינו את היבול, השונות ואיכות תאי הגזע לזו המתקבלת בקציר מכני (לא השווינו לעיכול אנזימטי בגלל השונות הנוספת הכרוכה בגישה זו). נציין כי דיס-היצמדות בתיווך EDTA פועלת היטב גם להעברת מושבות מתרבית מבוססת מזין לתנאים נטולי הזנה, אם רוצים בשימוש במורד הזרם ובניתוחים. שיטה זו מספקת מעבר עם שיטת מעבר עקבית, שכן דיס-הדבקה הנגרמת על ידי EDTA היא גישה פופולרית המשמשת לתרבויות ללא הזנה.
Protocol
עיין בטבלת החומרים לקבלת פרטים על כל החומרים, הריאגנטים והמכשירים המשמשים בפרוטוקול זה.
1. טיפוח תאי פיברובלסטים אנושיים והכנת שכבת תא ההזנה
- זרעים 0.5 × 106 פיברובלסטים של עורלה אנושית (להלן "תאי הזנה") לכל בקבוק תרבית T-75 (מספר צלוחיות לפי הצורך) עם 20 מ"ל של מדיום דולבקו (IMDM) של Iscove עם (w/) 10% נסיוב בקר עוברי (FBS), להלן "תווך תא הזנה".
- כאשר תאי ההזנה מגיעים למפגש של 90%, הסירו את המדיום ושטפו 3x עם 10 מ"ל של מלח חוצץ פוספט (DPBS) של דולבקו לכל בקבוק כדי למנוע עיכוב של טריפסין על ידי גורמים בתווך. הוסיפו 2 מ"ל של טריפסין-EDTA לכל בקבוקון, והניחו את הצלוחיות באינקובטור CO2 של 37°C/5% למשך 5 דקות או עד שתאי ההזנה התנתקו מהצלוחית. התבוננו בניתוק התאים תחת מיקרוסקופ כצברים צפים של תאים או תאים בודדים.
- הוסף 5 מ"ל של תווך תא מזין טרי שחומם מראש לכל בקבוק כדי להשבית את טריפסין-EDTA, ולהשהות בעדינות את תאי ההזנה על ידי pipetting.
- מעבירים את תאי ההזנה לצינור צנטריפוגה בנפח 15 מ"ל. מכסים את הצינור, ומשחררים את תאי ההזנה בצנטריפוגה ב 200 × גרם למשך 5 דקות.
- הסר בזהירות את supernatant מבלי להפריע את כדורית תא ההזנה. לאחר מכן, בזהירות להשעות את הגלולה ב 4 מ"ל של תא מזין טרי בינוני. ודא שתאי ההזנה מושהים מחדש ביסודיות לפני הספירה באמצעות תא ספירת תאים או מנגנון ספירת תאים אחר.
- הוסף 0.5 × 106 תאי הזנה למספר הנדרש של צלוחיות תרבית T-75 חדשות להרחבה, והוסף 20 מ"ל של תווך תא הזנה טרי לכל בקבוק. יש לדגור על צלוחיות התרבית באינקובטור CO2 של 37°C/5% עד שתאי ההזנה יגיעו למפגש של 90%.
הערה: ניתן להשתמש בתאי הזנה עד מעבר 25 לפחות. - חשב את מספר תאי ההזנה הדרושים למספר צלחות תרבית רקמה בקוטר 35 מ"מ שישמשו לגידול תאי גזע עובריים/hiPSCs.
הערה: בדרך כלל, 3.0 × 105 תאי הזנה לכל צלחת תרבית רקמה מספיקים כדי ליצור שכבה שוטפת של תאי הזנה. - כדי למנוע את התפשטות תאי ההזנה, ודא שהם נעצרים באופן מיטוטי באחת משתי דרכים.
הערה: עבור שתי השיטות, ניתן ליצור אצווה גדולה של תאי הזנה שנעצרו באופן מיטוטי ולהקפיא אותם באליציטוטים לשימוש מאוחר יותר.- בצע מעצר מיטוטי על ידי הקרנת גמא על ידי העברת כל תאי ההזנה הדרושים לצינור צנטריפוגה של 50 מ"ל ומילוי בתא מזין בינוני לנפח כולל של 5 מ"ל. יש להעביר מיד בטמפרטורת החדר למכונת הקרנת גמא, ולהקרין כדי לעצור באופן מיטוטי את תאי ההזנה (300 קילו-וולט ו-10 מיליאמפר למשך 20 דקות).
הערה: עיכוב בהובלה עלול להוביל לחיבור לא רצוי של תאי ההזנה לדופן צינור הצנטריפוגה 50 מ"ל. אם ההובלה דורשת יותר מכמה דקות, ודא שתאי ההזנה נשארים תלויים במהלך ההובלה על ידי תסיסה מתמשכת של הצינור. - בצע מעצר מיטוטי באמצעות מיטומיצין C על ידי העברת כל תאי ההזנה הדרושים ב 5 מ"ל של תווך תא מזין לצינור צנטריפוגה של 50 מ"ל, ולאחר מכן הוסף 15 מ"ל של תווך תא מזין המכיל 20 מיקרוגרם / מ"ל מיטומיצין C, ודגר באינקובטור CO2 של 37 ° C / 5% למשך 3 שעות. הוסף 20 מ"ל של PBS 37 ° C, גלולה את התאים על ידי צנטריפוגה ב 200 × גרם במשך 5 דקות, לחזור על שטיפת PBS פעמיים נוספות, והשהה מחדש בתווך תא ההזנה.
- בצע מעצר מיטוטי על ידי הקרנת גמא על ידי העברת כל תאי ההזנה הדרושים לצינור צנטריפוגה של 50 מ"ל ומילוי בתא מזין בינוני לנפח כולל של 5 מ"ל. יש להעביר מיד בטמפרטורת החדר למכונת הקרנת גמא, ולהקרין כדי לעצור באופן מיטוטי את תאי ההזנה (300 קילו-וולט ו-10 מיליאמפר למשך 20 דקות).
- לאחר שתאי ההזנה נעצרו באופן מיטוטי, חזרו למכסה המנוע של תרבית הרקמה, ופלטו את תאי ההזנה ב 3.0 × 105 תאים לכל צלחת תרבית רקמה 35 מ"מ, כדלקמן. ודא שתאי ההזנה מושהים מחדש במלואם, הוסף תווך תא מזין כדי להגיע לריכוז תאי הזנה של 1.5 × 105 למ"ל, והוסף 2 מ"ל של תרחיף תאי הזנה זה לכל צלחת תרבית רקמה של 35 מ"מ.
- מעבירים את מנות התרבית לחממה של 37°C/5% CO2 . כדי להבטיח פיזור אחיד של תאי ההזנה, הזיזו את צלחות התרבית לאט אך בחוזקה על מדף האינקובטור קדימה ואחורה 3x, ולאחר מכן הפסקה, ולאחר מכן בצעו את אותה פעולה משמאל לימין 3x. אל תזיזו שוב את הכלים וסגרו בעדינות את דלת האינקובטור.
- לאחר 24 שעות, עבור מתא מזין בינוני ל- IMDM עם 10% החלפת סרום (SR). החלף מדיום זה לאחר מכן כל יום שלישי. תאי ההזנה מוכנים לשימוש לאחר 3 הימים הראשונים.
2. קציר מכני של מושבות hESC או hiPSC
- מדיום נוירונים עובריים עובריים (HESC) טרום-חם המורכב מ-80% מדיום נשר מעובד (DMEM) של Dulbecco, 20% SR, 1 mM תחליף גלוטמין 100x, 1 mM חומצות אמינו לא חיוניות (NEAA), 1 mM פניצילין/סטרפטומיצין (P/S), 0.1 mM 2-מרקפטואתנול ו-10 ננוגרם/מ"ל גורם גדילה פיברובלסט בסיסי (bFGF). מדיום hESC משמש לתרבית של תאי גזע עובריים (hESC) או hiPSCs על תאי ההזנה.
- קח צלחות תרבית רקמה טריות בקוטר 35 מ"מ המכילות תאי הזנה שנעצרו באופן מיטוטי, והחלף את תווך תא ההזנה בתווך hESC בקוטר 1.2 מ"ל המכיל bFGF לפחות 30 דקות לפני העברת מושבות hESC/hiPSC.
- הניחו צלחת תרבית המכילה מושבות hESC/hiPSC על תאי הזנה שנעצרו מיטוטית תחת מיקרוסקופ עם הגדלה פי 10 הממוקמת בתוך מכסה מנוע זרימה למינרית. השתמש באזמל סטרילי כדי לחתוך בזהירות סביב ההיקף של כל מושבה ולאחר מכן לחתוך כל מושבה ל 5-6 חתיכות שוות פחות או יותר. הרימו בזהירות את חתיכות המושבה עם קצה להב האזמל כך שיתנתקו משכבת תא ההזנה ויצופו בחופשיות בתווך.
- נסו להימנע מאזורים במושבות המכילים תאים מתמיינים, המופיעים כאיים של תאים קטנים יותר עם גרעינים פחות מובחנים בהשוואה לתאי גזע עובריים/hiPSCs בתוך מושבה.
- מעבירים את המושבות הצפות בחופשיות עם פיפטה של 1 מ"ל לצלחות התרבית החדשות המכילות את תאי ההזנה. נסו לשמור על הפרדה בין המושבות כדי שלא יגדלו זו לזו מאוחר יותר. העבירו בזהירות את מנות התרבית לאינקובטור תא, והימנעו מלהפריע לכלים עד למחרת.
- למחרת, הוסף בזהירות 600 μL של תווך hESC המכיל bFGF לנפח סופי של 1.8 מ"ל. החלף את התווך hESC + bFGF בכל יום לאחר מכן עד לקטע הבא (בדרך כלל לאחר שבוע).
3. קצירת מושבות hESC או hiPSC באמצעות דיס-היצמדות בתיווך EDTA
- קח צלחות תרבית טריות עם תאי הזנה שנעצרו מיטוטית, ועבור מ- IMDM עם 10% SR ל- 1.2 מ"ל של hESC מחומם מראש + מדיום bFGF לפחות 30 דקות לפני העברת המושבות.
- טפל בצלחת תרבית אחת המכילה מושבות hESC או hiPSC בכל פעם. הסר את התווך hESC + bFGF, ושטוף את המושבות עם 1 מ"ל של DPBS בטמפרטורת החדר כדי לסלק תאים ופסולת תאים אפשריים. הוסף 1 מ"ל של 0.5 mM EDTA, ודגור במשך דקה אחת ב 37 ° C. אם למכסה המנוע של הזרימה הלמינרית יש פלטת חימום, בצע שלב זה ואת השלבים בסעיף 4 בלוח ההתחממות לדיס-הידבקות טובה יותר.
- לאחר הדגירה של 1 דקות, להסיר את הפתרון EDTA, בזהירות להוסיף 1 מ"ל של hESC + bFGF בינוני באמצעות פיפטה 1 מ"ל. טרטורים בעדינות עם אותה פיפטה כדי לשחרר את המושבות משכבת תא ההזנה. ממשיכים לטרטורציה בזהירות עד ששכבת תא ההזנה משתחררת ומתקפלת על עצמה בגוש נפרד. משכו את שכבת תא ההזנה בעזרת קצה הפיפטה.
- העבירו את מושבות hESC/hiPSC המרחפים עם פיפטה חדשה של 1 מ"ל לצלחות תרבית חדשות המכילות את תאי ההזנה ואת תווך hESC + bFGF, תוך פיצול ביחס של 1:5. המושבות נוטות להתחלק באופן שווה בתוך כל מנת תרבות חדשה, אך מאפשרות זאת על ידי הזזת המנה בעדינות מצד לצד. החלף את התווך hESC + bFGF בכל יום לאחר מכן עד לקטע הבא (בדרך כלל לאחר שבוע).
תוצאות
בבדיקות ובהשוואות המתועדות להלן, השתמשנו בשני קווי hESC (H9 ו-HS429, מ-WiCell וממכון קרולינסקה, בהתאמה) ובשני קווי hiPSC (NCS001 ו-NCS002, שניהם נוצרו על-ידי מתקן הליבה הנורבגי לתאי גזע פלוריפוטנטיים אנושיים). הנתונים המוצגים באיורים ובטבלאות הם מקווי hESC, אך תוצאות דומות לחלוטין התקבלו מקווי hiPSC.
בידינו, קציר מכני הביא לכך שהמושבות פוצלו לכחמישה עד שישה גושים בקוטר ~200-250 מיקרומטר, בעוד שעם דיס-היצמדות הנגרמת על ידי EDTA ואחריה טריטורציה, כל מושבה פוצלה ל~10-20 גושים בקוטר ~60 מיקרומטר. אנו מעריכים שמספר התאים בכל גוש שנקצר על ידי EDTA הוא ~20. מכיוון שאין זה מעשי לפצל מושבה לגושים בגודל זה באמצעות אזמל, מבחינה זו, דיס-הידבקות הנגרמת על ידי EDTA עדיפה, מכיוון שהיא יוצרת גושים בגודל נוח יותר להישרדות תאי מושבה10,11.
מושבות hESC/hiPSC שנקטפו באמצעות EDTA היו גם הומוגניות יותר בגודל ובצורה בהשוואה למושבות שנקטפו באופן מכני (איור 1A-F). הסיבה לכך היא שהחיתוך הנדרש לקציר מכני יוצר קצוות לא אחידים וגדלי גושים משתנים. כדי להעריך זאת כמותית, הערכנו את מעגליות המושבה (כמדד למידת העיגול של קצוות המושבה; ערך של 1 מציין עיגול מושלם) 5 ימים לאחר המעבר באמצעות פרוטוקול ImageJ-win6412. מעגליות המושבה הייתה נמוכה משמעותית במושבות שנקטפו באופן מכני (קציר מכני: 0.61 ± 0.10; קציר מבוסס EDTA: 0.84 ± 0.01; n = 10, p < 0.001, מבחן U-Mann-Whitney, U = 10).
צפיפות התאים במושבות שנקטפו וצויפו מחדש, שהיא מדד לאינטראקציות בין תאים לאחר הקציר במהלך היווצרות מושבות, הייתה דומה עם קציר מבוסס EDTA וקציר מכני (טבלה 1 ואיור 1G,H). למושבות שנקטפו באופן מכני הייתה נטייה גדולה יותר לפתח נמק באזורים המרכזיים שלהן (איור 1J). זה נבע ככל הנראה משונות בצורה, ובמיוחד בגודל גושי התאים המבודדים מכנית, שכן כאשר גושים אלה גדולים מדי, הם יכולים בקלות להתקפל על עצמם כאשר הם מועברים לצלחות תרבית חדשות. זה לא היה המקרה עם המושבות שנקטפו באמצעות EDTA, שהציגו מראה שקוף באופן אחיד עם קצוות ברורים (איור 1I).
באמצעות קציר מבוסס EDTA, הצלחנו לאסוף למעשה את כל המושבות שהוקמו בבאר תוך 2-3 דקות. באמצעות קציר מכני, איסוף כל המושבות בבאר יהיה מייגע וגוזל זמן. בדרך כלל הצלחנו לאסוף רק ~ 30%, או ~ 20-25 מושבות, באמצעות קציר מכני, וזה לקח ~ 20 דקות. כמו כן, באמצעות עיכול collagenase ואחריו גירוד עדין, זה היה בדרך כלל קשה לקצור את כל המושבות, אם כי ההליך הכולל לקח רק כמה דקות. לפיכך, קציר מבוסס EDTA הוא מהיר או מהיר יותר מקציר אנזימטי ויעיל יותר מקציר מכני או אנזימטי.
כדי להעריך את ההשפעה של שיטות הקציר השונות על גזעיות ופלוריפוטנטיות, חשפנו תחילה את המושבות שהתקבלו לאחר 20 מעברים באמצעות קציר מבוסס EDTA או מכני לניתוח qPCR (איור 2) וצביעה אימונוציטוכימית (איור 3 ואיור 4) עבור סמני גזע. המושבות שהתקבלו בשתי השיטות הציגו ביטוי יציב של סמני גזע הן ברמת ה-mRNA והן ברמת החלבון. לאחר מכן הערכנו פלוריפוטנציה על-ידי התמיינות לשלוש שכבות הנבט בגופי העובר (איור 5 ואיור 6). הגופים העובריים שנוצרו מתאי גזע עובריים עובריים (hESCs) או hiPSCs שהתקבלו לאחר 20 מעברים בשתי השיטות הכילו תערובת של תאים המבטאים סמנים מקובלים עבור אקטודרם, מזודרם ואנדודרם.
לבסוף, הערכנו את ההיארעות של סטיות גנומיות בתאי גזע עובריים (תאי גזע עובריים) ובתאי גזע עובריים (hiPSCs) בכל אחת מהשיטות באמצעות ניתוח גנטי מבוסס qPCR (ראו טבלת חומרים). המושבות שהתקבלו לאחר 20 מעברים בשתי שיטות הקציר הציגו כמה דוגמאות לסטייה צנועה מתבנית כרומוזומלית דיפלואידית ייחוס (החריגות שהוערכו היו אלה הקשורות בדרך כלל לתכנות מחדש של hiPSCs, אולם ניתן להשיג אותן גם בתאי גזע עובריים עובריים) (איור 7). עם זאת, דפוס הסטיות הללו היה זהה במהותו במושבות שהתקבלו לאחר שתי שיטות הקציר, מה שמעיד על כך שהן לא היו קשורות לשיטת הקציר.
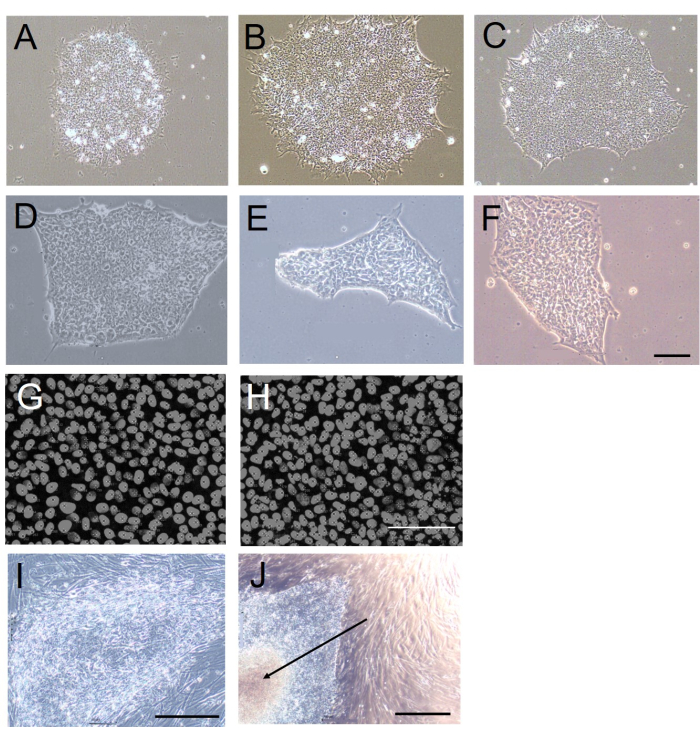
איור 1: מורפולוגיית מושבה וצפיפות תאים בעקבות קציר מבוסס EDTA או מכני. (A-F) תמונות שדה בהיר מייצגות של מושבות H9 hESC שהוקמו בתרבית נטולת מזין למשך 5 ימים לאחר 20 מעברים באמצעות קציר מכני (A-C) מבוסס EDTA או (D-F). (ז,ח) תמונות פלואורסצנטיות מייצגות של צפיפות התאים במושבות H9 hESC שנוצרו לאחר 20 מעברים באמצעות (G) מבוסס EDTA או (H) קציר מכני. גרעיני התא מוכתמים ב-DAPI. (ט,י) תמונות שדה בהיר מייצגות של מושבות H9 hESC שנוצרו לאחר 20 מעברים באמצעות (I) קציר מכני מבוסס EDTA או (J). שימו לב לאזור המרכזי הנמק במושבה שנקצר באופן מכני (חץ ב-J). כל התמונות נרכשו 5 ימים לאחר המעבר ה-20. פסי קנה מידה = 100 מיקרומטר. קיצורים: hESC = תא גזע עוברי אנושי; EDTA = חומצה ethylenediaminetetraacetic; DAPI = 4',6-diamidino-2-phenylindole. אנא לחץ כאן כדי להציג גרסה גדולה יותר של איור זה.
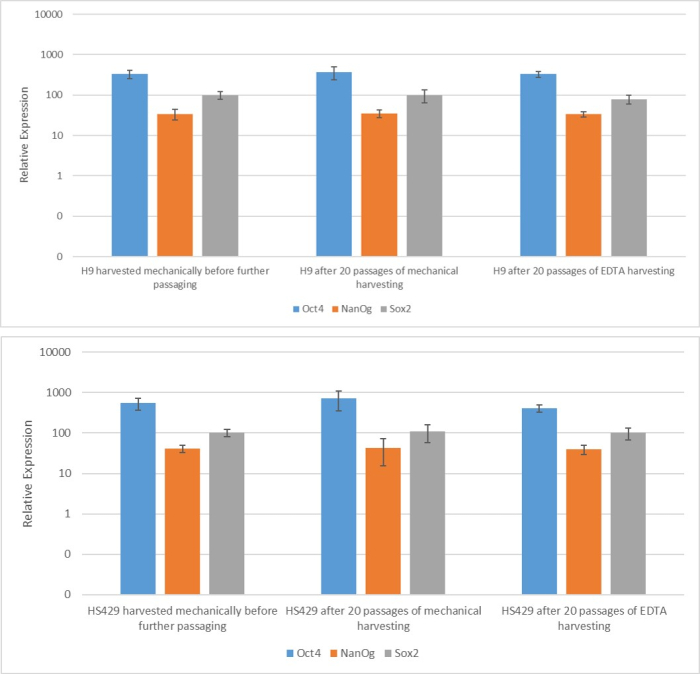
איור 2: ביטוי של mRNA של סמן גזע בשני קווי hESC (H9 ו-HS429) שנוצרו לאחר קציר מבוסס EDTA או מכני. תגובת שרשרת פולימראז כמותית בזמן אמת של הסמנים שצוינו בתאי גזע עובריים H9 (פאנל עליון) ו-HS429 (פאנל תחתון) לאחר מעבר יחיד באמצעות קציר מכני, לאחר 20 מעברים באמצעות קציר מכני, ולאחר 20 מעברים באמצעות קציר מבוסס EDTA (דילול 1:5). רמת הביטוי היא יחסית לזו של גן משק הבית ACTB (בטא-אקטין ). קווי השגיאה מציינים את סטיית התקן. קיצורים: hESC = תא גזע עוברי אנושי; EDTA = חומצה ethylenediaminetetraacetic. אנא לחץ כאן כדי להציג גרסה גדולה יותר של איור זה.
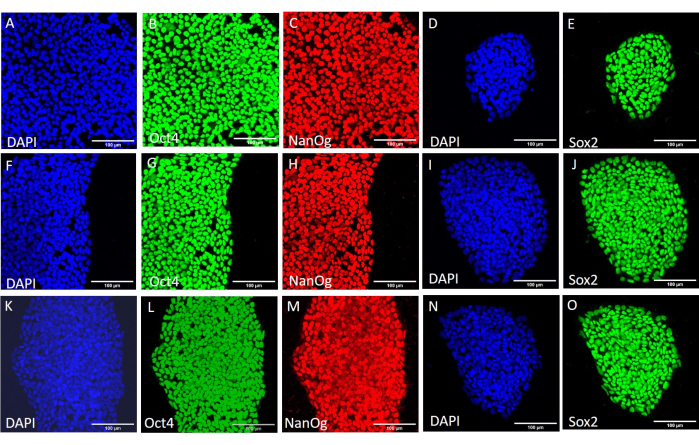
איור 3: ביטוי חלבוני סמן גזע בקו H9 hESC לאחר תנאי קציר שונים. צביעה אימונופלואורסצנטית מייצגת של מושבות H9 hESC שנקצרו באופן מכני (A-E) לפני מעבר נוסף, (F-J) לאחר 20 מעברים באמצעות קציר מכני, ו-(K-O) לאחר 20 מעברים באמצעות קציר מבוסס EDTA. פסי קנה מידה = 100 מיקרומטר. קיצורים: hESC = תא גזע עוברי אנושי; EDTA = חומצה ethylenediaminetetraacetic; DAPI = 4',6-diamidino-2-phenylindole. אנא לחץ כאן כדי להציג גרסה גדולה יותר של איור זה.
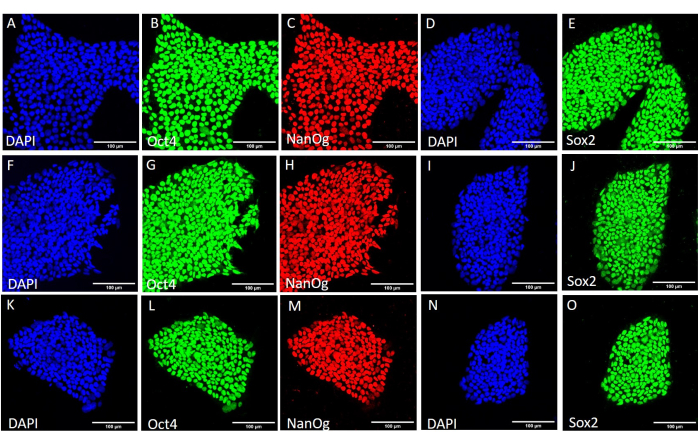
איור 4: ביטוי חלבוני סמן גזע בקו HS429 hESC לאחר תנאי קציר שונים. צביעה אימונופלואורסצנטית מייצגת של מושבות HS429 hESC שנקצרו באופן מכני (A-E) לפני מעבר נוסף, (F-J) לאחר 20 מעברים באמצעות קציר מכני, ו-(K-O) לאחר 20 מעברים באמצעות קציר מבוסס EDTA. פסי קנה מידה = 100 מיקרומטר. קיצורים: hESC = תא גזע עוברי אנושי; EDTA = חומצה ethylenediaminetetraacetic; DAPI = 4',6-diamidino-2-phenylindole. אנא לחץ כאן כדי להציג גרסה גדולה יותר של איור זה.
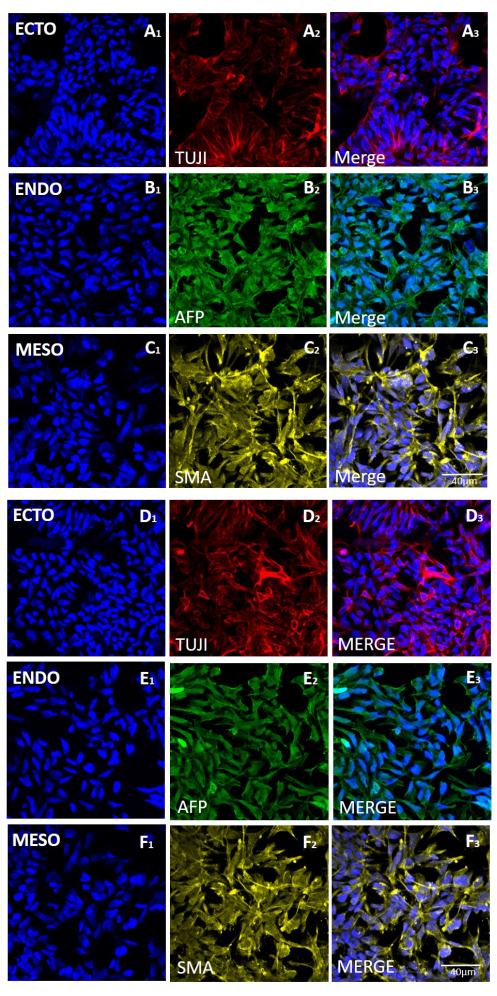
איור 5: ביטוי סמנים לשלוש שכבות הנבט בגופי עובר שנוצרו מקו H9 hESC לאחר קציר מכני או מבוסס EDTA. צביעה אימונופלואורסצנטית מייצגת של סמנים עבור (שורות A ו- D) אקטודרם (ECTO, TUJI), (שורות B ו- E) אנדודרם (ENDO, AFP), ו- (שורות C ו- F) מזודרם (MESO, SMA). EBs שנוצרו (A-C) לאחר 20 מעברים של קציר מכני או (D-F) לאחר 20 מעברים של קציר מבוסס EDTA. פסי קנה מידה = 40 מיקרומטר. קיצורים: hESC = תא גזע עוברי אנושי; EDTA = חומצה ethylenediaminetetraacetic; EBs = גופים עובריים. אנא לחץ כאן כדי להציג גרסה גדולה יותר של איור זה.
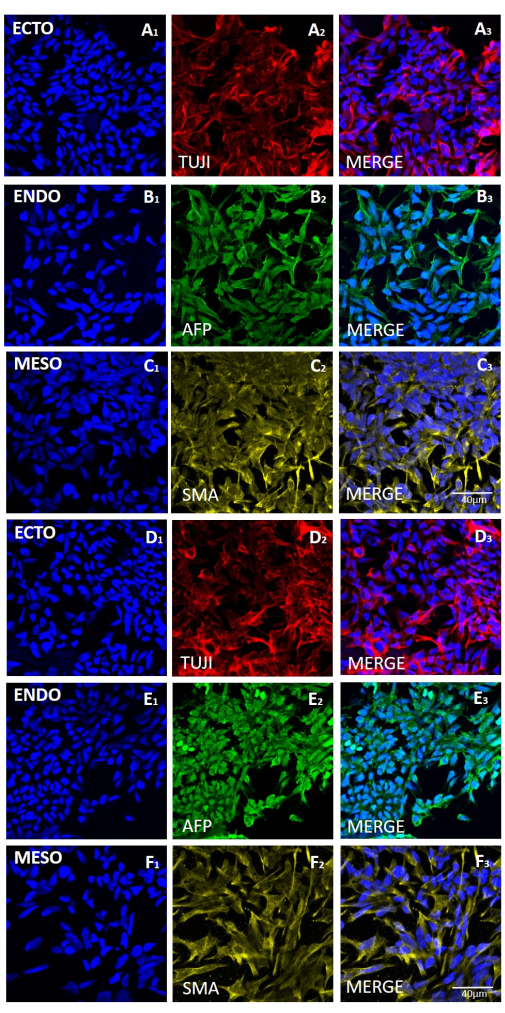
איור 6: ביטוי סמנים לשלוש שכבות הנבט בגופי עובר שנוצרו מקו HS429 hESC לאחר קציר מכני או מבוסס EDTA. צביעה אימונופלואורסצנטית מייצגת של סמנים עבור (שורות A ו- D) אקטודרם (ECTO, TUJI), (שורות B ו- E) אנדודרם (ENDO, AFP), ו- (שורות C ו- F) מזודרם (MESO, SMA). EBs שנוצרו (A-C) לאחר 20 מעברים של קציר מכני (A-C) או (D-F) לאחר 20 מעברים של קציר מבוסס EDTA. פסי קנה מידה = 40 מיקרומטר. קיצורים: hESC = תא גזע עוברי אנושי; EDTA = חומצה ethylenediaminetetraacetic; EBs = גופים עובריים. אנא לחץ כאן כדי להציג גרסה גדולה יותר של איור זה.
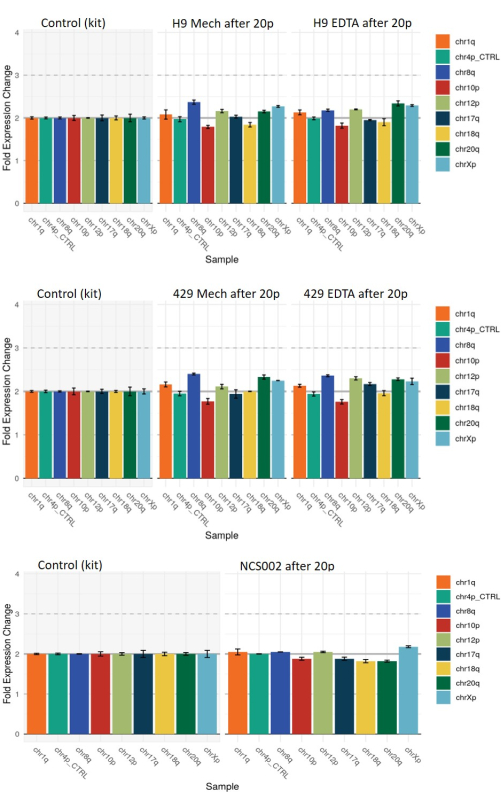
איור 7: ניתוח גנטי מבוסס qPCR של סטיות גנומיות נפוצות בקווי ESC HS9 ו-HS429 ובקו NCS002 iPSC לאחר 20 מעברים באמצעות קציר מכני או מבוסס EDTA. קו הבסיס בערך 2 מייצג דיפלואידיות תקינה בכל הסמנים הכרומוזומליים. ערך של 1 או 3 מייצג הפסד או רווח, בהתאמה, של הסמן הכרומוזומלי המצוין בכל התאים. ערכי ביניים בין 1 ל -2 או בין 2 ל -3 מצביעים על נוכחות של אובדן או רווח של הסמן המצוין בחלק קטן מהתאים. שימו לב שדפוס הסטיות דומה בשני תנאי הקציר. קיצורים: ESC = תא גזע עוברי; EDTA = חומצה ethylenediaminetetraacetic; iPSC = תא גזע פלוריפוטנטי מושרה. אנא לחץ כאן כדי להציג גרסה גדולה יותר של איור זה.
| צפיפות תאים (תאים/מ"מ2) | ||
| H9 | התכוון | סטדב |
| קציר מכני לפני מעבר נוסף | 3918 | 263.3 |
| קציר מכני 20 פעמים | 3868 | 197.7 |
| קציר EDTA 20 פעמים | 4080 | 127.8 |
| HS429 | התכוון | סטדב |
| קציר מכני לפני מעבר נוסף | 5249 | 565.4 |
| קציר מכני 20 פעמים | 5247 | 726.3 |
| קציר EDTA 20 פעמים | 4963 | 448.8 |
טבלה 1: השוואת צפיפות התאים במושבות משני קווי hESC (H9 ו-HS429) שנוצרו לאחר קציר מבוסס EDTA או מכני. צפיפות התאים הוערכה לאחר מעבר בודד באמצעות קציר מכני, לאחר 20 מעברים באמצעות קציר מכני, או לאחר 20 מעברים באמצעות קציר מבוסס EDTA (בדילול 1:5). בכל המקרים, n = 5 מושבות.
Discussion
תיארנו שיטה מהירה וחסכונית לקצירת תאי גזע עובריים עובריים (תאי גזע עובריים) ו-hiPSCs שגודלו בתרבית על תאי הזנה באמצעות דיס-היצמדות בתיווך EDTA, והשווינו זאת בעיקר לשיטה הקונבנציונלית של קציר מכני באמצעות אזמל. השווינו גם קציר מבוסס EDTA לקציר אנזימטי ביחס למהירות השיטה, אך לא היבטים של איכות המושבה המתקבלת. הסיבה לכך היא שהקציר האנזימטי מטבעו משתנה יותר ונקשר לשכיחות גבוהה יותר של סטיות גנומיות5, מה שעלול לטשטש את ההבדלים בין השיטות.
אנו מראים כי קציר מבוסס EDTA מהיר ויעיל יותר מכל אחת מהשיטות האחרות ומייצר מושבות קטנות יותר והומוגניות יותר מבחינה מורפולוגית מאשר קציר מכני. תכונה אחרונה זו מועילה ביחס להישרדות התא, שכן הגושים הגדולים יותר המתקבלים עם קציר מכני נוטים לנמק מרכזי, בעוד עיכול אנזימטי נוטה ליצור hESCs מבודדים hiPSCs, אשר נוטים יותר אפופטוזיס דורשים טיפול נוסף, למשל עם מעכבי רוק, כדי לשרוד. ניתן להשתמש בקציר מבוסס EDTA עבור לפחות 20 מעברים. שיטות הקציר המבוססות על EDTA ומכניות דומות בכל הנוגע לצפיפות תאי מושבה, mRNA וביטוי חלבונים של גנים גזעיים, התמיינות של שלוש שכבות הנבט בגופי עוברים, והפרעות גנומיות. אם המטרה היא יעילות, תפוקה גבוהה יותר, פחות שונות וטיפול עדין יותר בתאי גזע עובריים (HESC) וב-hiPSCs, עדיף קציר מבוסס EDTA.
כמו כן, נציין כי קציר מבוסס EDTA של תאי גזע עובריים (תאי גזע עובריים) ו-hiPSCs המתורבתים על תאי הזנה הוא דרך זולה לשמור על מצב נאיבי יותר ומספק מעבר חלק מתרבית מבוססת מזין לתרבית נטולת מזין היכן שהדבר רצוי.
שלבים קריטיים בתוך הפרוטוקול
השלבים הקריטיים ביותר של דיס-היצמדות בתיווך EDTA הם פרוטוקול סעיף 3 (אינקובציה בתמיסת EDTA) וסעיף 4 (טריטורציה). אם החשיפה לתמיסת EDTA ארוכה מדקה, הסיכון לדיסוציאציה מוחלטת לתאים בודדים עולה. זה יכול להתרחש גם אם הטריטורציה ממושכת מדי או קשה מדי. האחרון מושפע מגודל קצה הפיפטה. שימוש פיפטות תרבית תאים 1 מ"ל כמתואר כאן הוא אידיאלי. שימוש בסוג אחר של פיפטה עם קוטר קצה קטן יותר הוא מסוכן.
פתרון בעיות
אם תאי ההזנה ממשיכים להתרבות, מעצר מיטוטי לא היה יעיל, ויש לקחת אצווה חדשה ולהתחיל מחדש את ההליך. אם המושבות אינן משתחררות משכבת תא ההזנה, יש לוודא שאין Ca2+ ב- EDTA וכי צלחת התרבית המכילה את המושבות נשטפת היטב עם PBS כדי להסיר את כל אמצעי תרבית התאים שנותר לפני הוספת EDTA. דיסוציאציה רבה מדי, היוצרת תאים מבודדים או גושי תאים קטנים מדי, עלולה להיווצר עקב טריטורציה מוגזמת ופוגעת בהקמת מושבות חדשות. מידת הטריטורציה צריכה להיקבע אמפירית בריצות ניסוי של הפרוטוקול כדי לאשר כי גושי התאים המתקבלים הם ~ 60 מיקרומטר קוטר. אם שכבת ההזנה מתנתקת באופן ספונטני מצלחת התרבית, במיוחד לפני שהתאי הגזעיים העובריים / hiPSCs מוכנים לקטיף, זה יכול להיות בגלל שלא נעשה שימוש בתאי ההזנה תוך ~7 ימים לאחר שהוכנו. לכן, יש לעקוב בקפידה אחר מסגרת הזמן של השימוש בתאי ההזנה. אם שכבת ההזנה מתנתקת במהלך חשיפה ל-EDTA (דבר שמעולם לא ראינו עם תאי ההזנה המשמשים כאן), יש לשנות את סוג תא ההזנה או את שיטת התרבית שלהם.
מגבלות הטכניקה
המגבלה העיקרית של הטכניקה היא שהיא דורשת בדיקה חזותית של תהליך ההדבקה כדי להשיג תוצאה מוצלחת. משמעות הדבר היא שהמשתמשים חייבים ללמוד כיצד לזהות מתי המושבות משתחררות משכבת התא המזין ושכבת התא המזין משתחררת מהמצע. עם זאת, זה לא קשה, ומניסיוננו, משתמשים חדשים של הטכניקה יכולים לשלוט בו בתוך כמה ניסיונות.
קיימת גם אפשרות מובנית כי תאי גזע עובריים (תאי גזע עובריים) או hiPSCs שנקטפו עשויים להיות מזוהמים על ידי כמה תאי הזנה. אם הכוונה היא לעבור לתנאים שאינם מזינים או לבודד את תאי הגזע העובריים או ה-hiPSCs לצורך בדיקה, זיהום כזה יפגע בטוהר. נציין כי עם תאי ההזנה המשמשים כאן (פיברובלסטים של עורלה אנושית), קשה מאוד לנתק את שכבת תאי ההזנה, אפילו עם עיכול אנזימטי (לא מוצג). מכיוון ששכבת תאי ההזנה הבלתי מנותקים מוסרת בטוטו, זיהום של תאי גזע עובריים (תאי גזע עובריים) או hiPSCs שנקטפו צפוי להיות זניח. יתר על כן, מכיוון שתאי ההזנה נעצרים באופן מיטוטי, כל זיהום יצטמצם בסופו של דבר לאפס עם מעבר נוסף של תאי גזע עובריים (hESCs) או hiPSCs.
משמעויות ביחס לשיטות הקיימות
הנורמה הנוכחית לגידול תאי גזע עובריים ו-hiPSCs היא לעשות זאת בתנאים נטולי מזינים, שעבורם השימוש ב-EDTA למעבר הוא נפוץ. תרבות ללא הזנה תלויה בשימוש במצעי מדיה ותרבות שנוסחו במיוחד המבטיחים דבקות. ריאגנטים אלה כרוכים בהוצאה נוספת שעשויה לחרוג מתקציבי מעבדה מסוימים. בנוסף, תרבית בתנאים נטולי מזין נקשרה לפוטנציאל בידול מוטרד בשל היעדר גורמים ספציפיים במדיה התרבותית נטולת ההזנה וכתוצאה מכך מעבר מהמצב הנאיבי למצב הראשוני. גידול על תאי הזנה שנעצרו מיטוטית מונע מעבר זה ויכול להוריד את העלויות הכוללות לרמה הניתנת לניהול, ובכך להקל על השימוש הרחב יותר בתאי גזע פלוריפוטנטיים במחקר מעבדה.
Disclosures
ג'ואל גלובר הוא המנהל והגה ברינקר פיירדינגסטאד הוא המנהל היומי של מתקן הליבה הנורבגי לתאי גזע פלוריפוטנטיים אנושיים. למחברים אין אינטרסים כלכליים מתחרים או ניגודי אינטרסים אחרים לחשוף.
Acknowledgements
אנו מודים ללארס מון על הסיוע במהלך ניסויים ראשוניים ולמתקן הליבה הנורבגי לתאי גזע פלוריפוטנטיים אנושיים במרכז הנורבגי לחקר תאי גזע, בית החולים האוניברסיטאי של אוסלו, על השימוש במתקנים. קו H9 hESC התקבל מ- WiCell, וקו HS429 hESC התקבל מ- Outi Hovatta במכון קרולינסקה. שניהם שימשו בהתאם להסכמי העברה חומרית. קווי ה- hiPSC NCS001 ו- NCS002 נוצרו על ידי מתקן הליבה הנורבגי לתאי גזע פלוריפוטנטיים אנושיים. תכנות מחדש זה וכל העבודה המדווחת כאן בוצעו באישור ועדת האתיקה האזורית של דרום-מזרח נורבגיה (אישור REK 2017/110).
Materials
| Name | Company | Catalog Number | Comments |
| 0.5 M EDTA pH 8.0 | Invitrogen | 15575020 | |
| 15 mL centrifuge tubes | Sarstedt | 62.554.502 | |
| 2-mercaptoethanol | Gibco | 31350-010 | |
| 50 mL centrifuge tubes | Sarstedt | 62.547.254 | |
| Basic fibroblast growth factor (bFGF) | PeproTech | AF-100-18B-250UG | |
| Brand Bürker Chamber | Fisher Scientific | 10628431 | |
| Disposable scalpels no.15 | Susann-Morton | 505 | |
| DPBS (1x) without Ca/Mg | Gibco | 14190-094 | |
| Easy Grip tissue culture dish, 35 x 10 mm | Falcon | 353001 | |
| Eppendorf pipette 1 mL | Eppendorf | ||
| Eppendorf pipette 200 μL | Eppendorf | ||
| FBS (Fetal Bovine Serum) | Gibco | 10270-106 | |
| Filter tip 1,000 μL | Sarstedt | 70.1186.210 | |
| Filter tip 200 μL | Sarstedt | 70.760.211 | |
| Gamma Cell 3000 ELAN irradiation machine (alternatively, use Mitomycin C to arrest proliferation) | Best Theratronics | BT/MTS 8007 GC3000E | |
| Glutamax 100x | Gibco | 35050-038 | |
| Growth Factor Reduced Matrixgel | Corning | 734-0269 | |
| H9 hESC line | WiCell | WAe009-A | |
| hPSC Genetic Analysis Kit | Stem Cell Technologies | #07550 | |
| HS429 hESC line | ECACC | KIe024-A | |
| Human Foreskin Fibroblasts -CRL2429 line | ATTC | CRL2429 | |
| IMDM (1x) | Gibco | 21980-032 | |
| iPSC lines | Norwegian Core Facility for Human Pluripotent Stem Cells | NCS001 & NCS002 | |
| Knockout DMEM | Gibco | 10829-018 | |
| Laser Scanning Confocal Microscope or equivalent (we use the LSM 700 from Zeiss) | Zeiss | ||
| Microscope | CETI | ||
| Mitomycin C | Sigma Aldrich | M4287 | |
| Non-essential amino acids (NEAA) | Gibco | 11140.035 | |
| Pipettes, plastic 10 mL | Sarstedt | 86.1254.001 | |
| Pipettes, plastic, 5 mL | Sarstedt | 86.1253.001 | |
| Serum Replacement (SR) | Gibco | 10828-028 | |
| Sterile filters 0.22 um | Sarstedt | 83.1826.102 | |
| T-75 culture flask | ThermoScientific | 156499 | |
| Trypan Blue Stain (0.4 %) | Gibco | 15250-061 | |
| Trypsin-EDTA, 500 mL | Gibco | 25300062 |
References
- Skottman, H., Hovet, O. Culture conditions for human embryonic stem cells. Reproduction. 132 (5), 691-698 (2006).
- Hovatta, O., et al. A culture system using human foreskin fibroblasts as feeder cells allows production of human embryonic stem cells. Human Reproduction. 18 (7), 1404-1409 (2003).
- Desai, N., Rambhia, P., Gishto, A. Human embryonic stem cell cultivation: historical perspective and evolution of xeno-free culture systems. Reproductive Biology and Endocrinology. 13, 9 (2015).
- Villa-Diaz, L. G., et al. Synthetic polymer coatings for long-term growth of human embryonic stem cells. Nature Biotechnology. 28 (6), 581-583 (2010).
- Watanabe, M., et al. TGFb superfamily signaling regulates the state of human stem cell pluripotency and capacity to create well-structured telencephalic organoids. Stem Cell Reports. 17 (10), 2220-2238 (2022).
- Garitaonandia, I., et al. Increased risk of genetic and epigenetic instability in human embryonic stem cells associated with specific culture conditions. PLoS One. 10 (2), e0118307 (2015).
- Inzunza, J., et al. Derivation of human embryonic stem cell lines in serum replacement medium using postnatal human fibroblasts as feeder cells. Stem Cells. 23, 544-549 (2005).
- Watanabe, K., et al. A ROCK inhibitor permits survival of dissociated human embryonic stem cells. Nature Biotechnology. 25 (6), 681-686 (2007).
- Rivera, T., Zhao, Y., Ni, Y., Wang, J. Human-induced pluripotent stem cell culture methods under cGMP conditions. Current Protocols in Stem Cell Biology. 54 (1), 117 (2020).
- Castro-Viñuelas, R., et al. Tips and tricks for successfully culturing and adapting human induced pluripotent stem cells. Molecular Therapy. Methods & Clinical Development. 23, 569-581 (2021).
- Meng, G., Rancourt, D. E. Derivation and maintenance of undifferentiated human embryonic stem cells. Methods in Molecular Biology. 873, 69-90 (2012).
- Schindelin, J., et al. Fiji: An open-source platform for biological-image analysis. Nature Methods. 9 (7), 676-682 (2012).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved