需要订阅 JoVE 才能查看此. 登录或开始免费试用。
Method Article
使用交流介电泳分离非转移性(MCF-7)和非肿瘤(MCF-10A)乳腺癌细胞的微流体装置
摘要
与非肿瘤乳腺上皮细胞相比,乳腺癌细胞表现出不同的介电特性。据推测,基于介电特性的这种差异,可以出于免疫治疗目的将两个群体分开。为了支持这一点,我们模拟了一种微流体装置来分选MCF-7和MCF-10A细胞。
摘要
介电泳装置能够利用施加外部电场使样品体积中的癌细胞极化的原理,以无标记、经济高效、稳健和准确的方式检测和操纵癌细胞。本文演示了如何使用细胞混合物中的流体动力介电泳(HDEP)利用微流体平台对非转移性乳腺癌细胞(MCF-7)和非肿瘤乳腺上皮细胞(MCF-10A)进行高通量连续分选。通过在HDEP微流控芯片中并排放置的两个电极之间产生电场,它们之间有微米大小的间隙,非肿瘤乳腺上皮细胞(MCF-10A)可以被推开,在主通道内表现出负DEP,而非转移性乳腺癌细胞在悬浮在细胞培养基中时遵循其过程,由于电导率高于膜电导率。为了证明这一概念,对不同值的介质电导率进行了模拟,并研究了细胞的分选。进行了参数研究,发现合适的细胞混合物电导率为0.4 S/m。通过保持介质电导率固定,建立了足够的0.8 MHz交流频率,通过改变电场频率提供最大的分选效率。使用所演示的方法,在选择合适的细胞混合物悬浮介质电导率和施加的AC频率后,可以实现最大的分选效率。
引言
在乳腺组织内和乳腺组织周围发展的恶性肿瘤是全球女性乳腺癌的常见原因,导致严重的健康问题1。如果在早期发现,转移前的乳腺肿瘤可以通过手术治疗,但如果忽视,它们会扩散到他们的肺、脑和骨骼,对患者的生活产生严重影响。后期提供的治疗,如放射和化学疗法,具有严重的副作用2。最近的研究报告称,乳腺癌的早期诊断可将死亡率降低 60%3。因此,必须努力实现个性化的早期检测方法。为此,从事不同科学和技术领域的研究人员利用微流体技术开发了用于乳腺癌早期诊断的设备4。这些方法包括细胞亲和显微色谱、磁性激活微细胞分选仪、基于大小的癌细胞捕获和分离以及片上介电泳(DEP)5,6。文献中报道的这些微流体技术能够对定义明确的样品进行精确的细胞操作、实时监测和分类,这是许多诊断和治疗应用中的中间步骤5。这些分选机制与微流体的集成提供了对靶细胞7,8,9,10的灵活可靠的操作。这种集成的主要优点之一是能够处理纳升到微升体积的流体样品,并且还能够操纵样品流体的电特性。通过调节微流体装置内悬浮液的电导率,可以根据生物细胞的大小和介电特性的差异对生物细胞进行分类11,12。
在这些技术中,片上DEP通常是首选,因为它是一种利用生物样品电特性的无标记细胞分选技术。据报道,DEP 可以操纵生物样品,例如 DNA 13、RNA 14、蛋白质 15、细菌16、血细胞 17、循环肿瘤细胞 (CTC) 18 和干细胞 19。采用DEP分选生物样品的微流体装置已在文献20中广泛报道。据报道,基于储库的DEP微流体(rDEP)装置用于分选活菌和非活酵母细胞,可保护细胞免受电化学反应的不利影响21,22。Piacentini等人报道了一种卡斯特尔化微流体细胞分选机,该分选机以97%23的效率从血小板中分离红细胞。据报道,具有不对称孔和嵌入式电极的片上DEP器件也可以对活细胞和非活细胞进行分类24。Valero和Demierre等人通过在通道25,26的两侧引入两个微电极阵列来修改卡斯特尔式微流体细胞分选仪。这有助于将细胞聚焦在通道的中心。Zeynep等人提出了一种基于DEP的微流体装置,用于从白细胞27中分离和浓缩MCF7乳腺癌细胞。他们报告说,从白细胞中提取MCF7细胞的效率在74%-98%之间,频率为1 MHz,施加的电压范围为10-12 Vpp。补充表1表示基于DEP的微流体分选设备之间基于其设计,电极配置和操作参数(施加频率和电压)的定性和定量比较。
最近,研究人员试图测量微流控芯片28,29内乳腺上皮细胞(MCF-10A)和非转移性乳腺癌细胞(MCF-7)介电行为的差异。Jithin等人还使用频率在200 MHz和13.6 GHz30之间的开放式同轴探针技术表征了不同癌细胞系的介电响应。MCF-7和MCF-10A细胞系介电响应的这些差异可用于在运行时将它们分离,并可能导致个性化早期诊断设备的开发。
在本文中,我们使用交流介电泳模拟了非转移性乳腺癌细胞(MCF-7)和非肿瘤乳腺上皮细胞(MCF-10A)的受控分选。电场的变化区域会影响微流控芯片内部的分选。所提出的技术易于实现,并允许将分选技术集成到各种微流控芯片布局中。通过计算流体动力学(CFD)模拟,通过改变悬浮细胞的流体培养基的电导率,研究非转移性乳腺癌细胞和非肿瘤乳腺上皮细胞的分离。在这些模拟中,表明通过保持电导率恒定并改变施加的频率,可以控制癌细胞和健康细胞的分离。
Access restricted. Please log in or start a trial to view this content.
研究方案
注意:此处的实验方案使用 COMSOL(一种多物理场仿真软件)来模拟使用交流电泳对非转移性乳腺癌细胞 (MCF-7) 和非肿瘤乳腺上皮细胞 (MCF-10A) 进行受控分选。
1.芯片设计及参数选择
- 打开多物理场软件并选择 空白模型。右键单击 全局定义 ,然后选择 参数。将 表 1 中给出的参数作为文本文件导入全局定义中,或单独输入值。
- 从主页选项卡中选择 添加组件 并添加 2D 组件。右键单击几何图形,然后双击该文件导入模型文件。
- 选择空白材料并使用 表 1 中的材料属性。
- 从主页选项卡中选择 添加物理场 ,然后键入 AC/DC。在 AC/DC 节点下,选择电流作为电场和电流子节点下的 物理 。
- 右键单击电流并选择电流守恒、绝缘和电势子节点以绝缘通道壁,为电极分配电位。
- 从主页选项卡中选择添加物理场,然后在流体流动节点下,选择单相流子节点下的爬行流物理场。右键单击"单相流",并使用"墙"子节点将芯片边界渲染为墙。
- 右键单击 单相流 ,添加两个入口子节点和一个出口子节点。
- 使用入口子节点指定入口,并使用流 速 中的法线作为 边界条件。使用插座子节点分配插座。
- 从主页选项卡中选择添加物理场,然后在流体流节点下,选择粒子追踪子节点下的粒子追踪流物理场。
- 右键单击粒子追踪节点,添加子节点壁、双 粒子 属性子节点、两个入口子节点、一个出口子节点、两个介电泳力子节点和一个拖动力子节点。
- 使用"粒子属性"子节点设置 MCF-7 和 MCF-10A 单元格的粒子属性。从"全局定义"部分下的参数中选择粒子属性。
- 添加拖动力子节点以将介电泳 力 分配给两种类型的细胞。
- 在这种情况下,请从参数部分添加 粒子属性 。添加 Shell 子节点以模拟哺乳动物细胞。
- 从主页选项卡中,选择 添加 网格,然后选择 精细网格。从主页选项卡中选择构建网格以 构建网格 。
- 在主页选项卡中,单击添加研究以添加三个 研究 步骤。 研究步骤1 用于模拟频率响应;使用 频域 子节点。
- 要模拟爬行流,请选择 "稳态算例 "节点。添加两个随时间变化的步骤来模拟具有介电泳力和无介电泳力的条件。
- 对于无介电泳条件,选择 物理场和变量选择,选中研究步骤的 修改模型配置 框,然后禁用 介电泳步骤。对于介电泳条件,请勿禁用。保存文件并按 计算 以运行模拟。
注意:设计用于分选非转移性乳腺癌细胞(MCF-7)和非肿瘤乳腺上皮细胞(MCF-10A)的微流控芯片具有两个独立的入口,分别用于细胞混合物流和流体动力流聚焦,宽度分别为20μm和40μm,如补充 图1 和 补充图2所示。 - 在频域子节点下分配频率 (f0),并使用电势子节点将电压分配给沿分选室顶部侧壁放置的刨床电极(宽度为 295 μm)。在出口处,使用"冻结"壁条件来可视化分类的颗粒。
2. 数学模型与计算分析
- 通过建立计算流体动力学(CFD)研究,验证微流体装置内分离非转移性乳腺癌细胞和非肿瘤乳腺上皮细胞的操作参数。
注意:多物理场软件(AC/DC、微流体和 粒子跟踪 模块)用于此目的。控制方程和理论背景在 补充文件1中有详细说明。该模型通过使用文献31,32中报道的非转移性乳腺癌细胞(MCF7)和非肿瘤乳腺上皮细胞(MCF-10A)的介电特性进行测试,这些特性总结在 表1中。 - 通过在细胞混合物入口处以 1:1 的比例引入非转移性乳腺癌 (MCF7) 和非肿瘤乳腺上皮 (MCF-10A) 细胞系来执行 CFD 模拟。
- 首先,执行网格独立性研究以优化模拟的网格大小33.
注意:进行了网格独立性研究,以找到操作参数的最佳解决方案。选择了一组五种不同的网格尺寸来量化解决方案收敛的最佳单元尺寸。观察到,当定义网格的元素总数为635(较粗的网格)时,如补充图3A所示,分选效率最低,一些MCF7单元移动到底部出口,如补充图3B所示。当网格尺寸增加到精细时,定义网格的单元数量也增加到 2,288。在这种情况下,分选效率达到最高,MCF7和MCF-10A细胞都向各自的出口移动。还模拟了更精细的网格,定义网格的单元数量增加到 3,188 个。在此之后,分拣效率仍然不受影响。因此,我们可以肯定地说,细网眼尺寸在我们的案例中效果最好。 - 求解两组 CFD 算例。
- 对于第一组,右键单击 算例 1 并添加 参数化扫描 子节点。按 + 符号添加流体介质电导率"σm"作为扫描变量。对流体介质电导率σ m 范围从 0.01 S/m 到 2.5 S/m 执行参数扫描研究,保持应用频率 f (Hz) 恒定在 800 kHz 的值。
- 对于第二组,通过将施加的交流频率从 100 kHz 更改为 100 MHz,同时保持流体介质的电导率 σm,在每种情况下固定为 0.4 S/m,进行参数扫描研究。这个σm值是根据第一个CFD研究的结果选择的,因为在这个值下观察到MCF-7和MCF-10A之间的最大间隔。
- 施加在导电介质中介电球形颗粒上的介电泳(DEP)力FDEP (-)的强度由公式1T34给出:
FDEP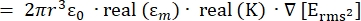 [1]
[1]
使用介电泳力子节点下的公式1。在等式 1 中, r 表示应用 FDEP的粒子的半径;K(-)被称为克劳修斯-莫索蒂因子; εm(-)表示介质的介电常数;E(V/m) 是电场的均方根值。 - 使用公式2表示介电泳力子节点下的球形颗粒。
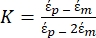 [2]
[2]
在公式2中,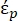 (-)显示了施加DEP力的粒子的复介电常数;
(-)显示了施加DEP力的粒子的复介电常数; 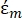 (-)显示了粒子周围流体的复介电常数。复介电常数
(-)显示了粒子周围流体的复介电常数。复介电常数 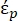 和
和 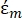 定义如下35:
定义如下35: - 使用公式3表示介电泳力子节点下的球形颗粒:
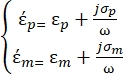 [3]
[3]
在公式3中,εp (-)表示粒子复介电常数的实部;εm (-)表示粒子周围流体复介电常数的真实部分;σp (S/m) 表示颗粒电导率;σ m (S/m ) 表示颗粒周围介质的电导率;ω (Hz) 是外加电场的频率。
注意: Re(K) 的符号决定了 FDEP 的极性。如果Re(K)的符号为负,则粒子经历负介电泳力(nDEP);与此相反,如果Re(K)的符号为正,则意味着正介电泳力(pDEP)。对于克劳修斯-莫索蒂因子 (K),变化在 -1 到 1 的范围内。
- 首先,执行网格独立性研究以优化模拟的网格大小33.
- 使用公式3的改进形式来模拟生物细胞,例如哺乳动物细胞,这些细胞更复杂且具有多层结构。
K (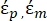 ) =
) = 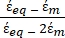 [4]
[4]
在公式4中,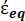 (-)包含细胞质的复介电常数(
(-)包含细胞质的复介电常数( 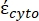 -)和细胞膜
-)和细胞膜 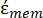 的复介电常数(-),给出如下:36
的复介电常数(-),给出如下:36 - 使用公式 5 求解 "
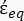 ":
":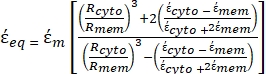 [5]
[5]
在公式5中,R cyto(m)和Rmem(m)分别显示了细胞质和细胞膜的半径。 - 然后,使用公式4绘制Re(K)作为癌症和健康细胞外加电场的函数。计算克劳修斯-莫索蒂(CM)因子Re(K)的实部,以量化粒子经历的介电泳力(DEP)。
- 右键单击 "结果 "节点,添加 "粒子评估 "子节点,然后在表达式部分中键入 fpt.deff1.K 以绘制粒子 1 的 CM 因子和粒子 2 的 fpt.deff2.K 。
注:正文中列出的所有协议步骤都可以在协议视频(视频1)中查看。
Access restricted. Please log in or start a trial to view this content.
结果
研究基于DEP对非转移性乳腺癌(MCF-7)和非肿瘤乳腺上皮(MCF-10A)细胞进行有效分选的最佳操作参数
为了在进行介电泳时成功分离具有不同介电特性的非转移性乳腺癌(MCF-7)和非肿瘤乳腺上皮(MCF-10A)细胞,它们的K因子应通过保持应用频率固定37,38来区分。使用公式4实现了非转移性乳腺癌细胞和非肿瘤乳腺上皮细胞在外加电场下的?...
Access restricted. Please log in or start a trial to view this content.
讨论
以前已经报道过用于细胞培养,捕获和分选的微流体装置47,52,53。在洁净室中制造这些设备是一个昂贵的过程,必须通过CFD仿真来量化所提出的微流体设备的输出和效率。本研究介绍了基于非转移性乳腺癌细胞(MCF-7)和非肿瘤乳腺上皮细胞(MCF-10A)介电特性的AC介电泳微流控装置的设计和模拟23。
Access restricted. Please log in or start a trial to view this content.
披露声明
作者声明没有潜在的利益冲突。
致谢
这项研究得到了巴基斯坦高等教育委员会的支持。
Access restricted. Please log in or start a trial to view this content.
材料
| Name | Company | Catalog Number | Comments |
| COMSOL | COMSOL | multiphysics simulation software |
参考文献
- Liang, L., et al. Microfluidic-based cancer cell separation using active and passive mechanisms. Microfluidics and Nanofluidics. 24 (4), 26(2020).
- Damiati, S., Kompella, U. B., Damiati, S. A., Kodzius, R. Microfluidic devices for drug delivery systems and drug screening. Genes. 9 (2), 103(2018).
- Pashayan, N., et al. Personalized early detection and prevention of breast cancer: ENVISION consensus statement. Nature Reviews Clinical Oncology. 17 (11), 687-705 (2020).
- Panesar, S., Neethirajan, S. Microfluidics: Rapid diagnosis for breast cancer. Nano-micro Letters. 8 (3), 204-220 (2016).
- Chen, J., Li, J., Sun, Y. Microfluidic approaches for cancer cell detection, characterization and separation. Lab on a Chip. 12 (10), 1753-1767 (2012).
- Beech, J. P., Holm, S. H., Adolfsson, K., Tegenfeldt, J. O. Sorting cells by size, shape and deformability. Lab on a Chip. 12 (6), 1048-1051 (2012).
- Kang, Y., Li, D. Electrokinetic motion of particles and cells in microchannels. Microfluidics and Nanofluidics. 6 (4), 431-460 (2009).
- Schmid, L., Weitz, D. A., Franke, T. Acoustic microfluidic fluorescence-activated cell sorter. Lab on a Chip. 14 (19), 3710-3718 (2014).
- Yu, B. Y., Elbuken, C., Shen, C., Huissoon, J. P., Ren, C. L. An integrated microfluidic device for the sorting of yeast cells using image processing. Scientific Reports. 8, 3550(2014).
- Asiaei, S., Darvishi, V., Davari, M. H., Zohrevandi, D., Moghadasi, H. Thermophoretic isolation of circulating tumor cells, numerical simulation and design of a microfluidic chip. Journal of Thermal Analysis and Calorimetry. 137 (3), 831-839 (2019).
- Song, Y., Li, M., Pan, X., Wang, Q., Li, D. Size-based cell sorting with a resistive pulse sensor and an electromagnetic pump in a microfluidic chip. Electrophoresis. 36 (3), 398-404 (2014).
- Giraud, G., et al. Dielectrophoretic manipulation of ribosomal RNA. Biomicrofluidics. 5 (2), 024116(2011).
- Valero, A., Braschler, T., Demierre, N., Renaud, P. A miniaturized continuous dielectrophoretic cell sorter and its applications. Biomicrofluidics. 4 (2), 022807(2010).
- Allahrabbi, N., Chia, Y. S. M., Saifullah, M. S. M., Lim, K. M., Lanry Yung, L. Y. A hybrid dielectrophoretic system for trapping of microorganisms from water. Biomicrofluidics. 9 (3), 034110(2015).
- Vykoukal, D. M., Gascoyne, P. R. C., Vykoukal, J. Dielectric characterization of complete mononuclear and polymorphonuclear blood cell subpopulations for label-free discrimination. Integrative Biology: Quantitative Biosciences from Nano to Macro. 1 (7), 477-484 (2009).
- Shim, S., et al. Antibody-independent isolation of circulating tumor cells by continuous-flow dielectrophoresis. Biomicrofluidics. 7 (1), 11807(2013).
- Jeon, H. J., Lee, H., Yoon, D. S., Kim, B. M. Dielectrophoretic force measurement of red blood cells exposed to oxidative stress using optical tweezers and a microfluidic chip. Biomedical Engineering Letters. 7 (4), 317-323 (2017).
- Song, H., et al. Continuous-flow sorting of stem cells and differentiation products based on dielectrophoresis. Lab on a Chip. 15 (5), 1320-1328 (2015).
- Tsai, S. L., Chiang, Y., Wang, M. H., Chen, M. K., Jang, L. S. Battery-powered portable instrument system for single-cell trapping, impedance measurements, and modeling analyses. Electrophoresis. 35 (16), 2392-2400 (2014).
- Chan, J. Y., et al. Dielectrophoresis-based microfluidic platforms for cancer diagnostics. Biomicrofluidics. 12 (1), 011503(2018).
- Patel, S., et al. Microfluidic separation of live and dead yeast cells using reservoir-based dielectrophoresis. Biomicrofluidics. 6 (3), 34102(2012).
- Yildizhan, Y., Erdem, N., Islam, M., Martinez-Duarte, R., Elitas, M. Dielectrophoretic separation of live and dead monocytes using 3D carbon-electrodes. Sensors. 17 (11), 2691-2704 (2017).
- Piacentini, N., Mernier, G., Tornay, R., Renaud, P. Separation of platelets from other blood cells in continuous-flow by dielectrophoresis field-flow-fractionation. Biomicrofluidics. 5 (3), 34122(2011).
- Zhao, K., Duncker, B. P., Li, D. Continuous cell characterization and separation by microfluidic alternating current dielectrophoresis. Analytical Chemistry. 91 (9), 6304-6314 (2019).
- Valero, A., et al. Tracking and synchronization of the yeast cell cycle using dielectrophoretic opacity. Lab on a Chip. 11 (10), 1754-1760 (2011).
- Demierre, N., Braschler, T., Muller, R., Renaud, P. Focusing and continuous separation Of cells in a microfluidic device using lateral dielectrophoresis. International Solid-State Sensors, Actuators and Microsystems Conference. 430 (98), 1777-1780 (2007).
- Arslan, Z. C., Yalçın, Y. D., Külah, H. Label-free enrichment of MCF7 breast cancer cells from leukocytes using continuous flow dielectrophoresis. Electrophoresis. 43 (13-14), 1531-1544 (2022).
- Turcan, I., Olariu, M. A. Dielectrophoretic manipulation of cancer cells and their electrical characterization. ACS Combinatorial Science. 22 (11), 554-578 (2020).
- Park, J., et al. Sequential cell-processing system by integrating hydrodynamic purification and dielectrophoretic trapping for analyses of suspended cancer cells. Micromachines. 11 (1), 47(2020).
- Hussein, M., et al. Breast cancer cells exhibits specific dielectric signature in vitro using the open-ended coaxial probe technique from 200 MHz to 13.6 GHz. Scientific Reports. 9, 4681(2019).
- Fornes-Leal, A., Garcia-Pardo, C., Frasson, M., Pons Beltrán, V., Cardona, N. Dielectric characterization of healthy and malignant colon tissues in the 0.5-18 GHz frequency band. Physics in Medicine and Biology. 61 (20), 7334-7346 (2016).
- Çetin, B., Li, D. Dielectrophoresis in microfluidics technology. Electrophoresis. 32 (18), 2410-2427 (2011).
- Khan, S., Khulief, Y. A., Al-Shuhail, A. A. Effects of reservoir size and boundary conditions on pore-pressure buildup and fault reactivation during CO2 injection in deep geological reservoirs. Environmental Earth Sciences. 79, 294(2020).
- Adams, T. N. G., Turner, P. A., Janorkar, A. V., Zhao, F., Minerick, A. R. Characterizing the dielectric properties of human mesenchymal stem cellsand the effects of charged elastin-like polypeptide copolymer treatment. Biomicrofluidics. 8 (5), 054109(2014).
- Lo, Y. J., et al. Measurement of the Clausius-Mossotti factor of generalized dielectrophoresis. Applied Physics Letters. 104, 083701(2014).
- Lo, Y. J., Lei, U. Measurement of the real part of the Clausius-Mossotti factor of dielectrophoresis for Brownian particles. Electrophoresis. 41 (1), 137-147 (2020).
- Ohta, A. T., et al. Optically controlled cell discrimination and trapping using optoelectronic Tweezers. IEEE Journal of Selected Topics in Quantum Electronics. 13 (2), 235-242 (2007).
- Sun, T., Morgan, H. Single-cell microfluidic Impedance cytometry. Microfluidics and Nanofluidics. 8 (4), 423-443 (2010).
- Weng, P. Y., et al. Size-dependent dielectrophoretic cross-over frequency of spherical particles. Biomicrofluidics. 10 (1), 1909-1921 (2016).
- Lu, Y. W., Sun, C., Kao, Y. C., Hung, C. L., Juang, J. Y. Dielectrophoretic cross-over frequency of single particles: Quantifying the effect of surface functional groups and electrohydrodynamic flow drag force. Nanomaterials. 10 (7), 1364(2020).
- Henslee, E. A., Sano, M. B., Rojas, A. D., Schmelz, E. M., Davalos, R. V. Selective concentration of human cancer cells using contactless dielectrophoresis. Electrophoresis. 32 (18), 2523-2529 (2011).
- Chan, J. Y., et al. Dielectrophoresis-based microfluidic platforms for cancer diagnostics. Biomicrofluidics. 12 (1), 11503-11525 (2018).
- Gascoyne, P. R. C., Shim, S. Isolation of circulating tumor cells by dielectrophoresis. Cancers. 6 (1), 545-579 (2014).
- Liang, W., et al. Determination of dielectric properties of cells using ac electrokinetic-based microfluidic platform. Micromachines. 11 (5), 513-537 (2020).
- Frusawa, H., et al. Frequency-modulated wave dielectrophoresis of vesicles and cells periodic U-turns at the crossover frequency. Nanoscale Research Letters. 13 (169), 2583-2589 (2018).
- Wei, M. T., Junio, J., Ou-Yang, D. H. Direct measurements of the frequency-dependent dielectrophoresis force. Biomicrofluidics. 3 (1), 12003(2009).
- Mustafa, A., Pedone, E., Marucci, L., Moschou, D., Lorenzo, M. D. A flow-through microfluidic chip for continuous dielectrophoretic separation of viable and non-viable human T-cells. Electrophoresis. 43 (3), 501-508 (2021).
- Wang, L., et al. Dual frequency dielectrophoresis with interdigitated sidewall electrodes for microfluidic flow-through separation of beads and cells. Electrophoresis. 30 (5), 782-791 (2021).
- Alazzam, A., Mathew, B., Alhammadi, F. Novel microfluidic device for the continuous separation of cancer cells using dielectrophoresis. Journal of Separation Science. 40 (5), 1193-1200 (2017).
- Yang, L., Banada, P. P., Bhunia, A. K., Bashir, R. Effects of dielectrophoresis on growth viability and immuno-reactivity of listeria monocytogenes. Journal of Biological Engineering. 2, 6(2008).
- Matbaechi, H., Soltani, P., Hölzel, R., Wenger, C. Dielectrophoretic immobilization of yeast cells using CMOS integrated microfluidics. Micromachines. 11 (5), 501-518 (2020).
- Mustafa, A., Pedone, E., La Regina, A., Erten, A. A., Marucci, L. Development of a single layer microfluidic device for dynamic stimulation, culture and imaging of mammalian cells. bioRxiv. , (2022).
- Mustafa, A., et al. Enhanced dissolution of liquid microdroplets in the extensional creeping flow of a hydrodynamic trap. Langmuir. 32 (37), 9460-9467 (2016).
- Chang, H. F., Chou, S. E., Cheng, J. Y. Electric-field-induced neural precursor cell differentiation in microfluidic devices. Journal of Visualized Experiments. (170), e61917(2021).
Access restricted. Please log in or start a trial to view this content.
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。