Se requiere una suscripción a JoVE para ver este contenido. Inicie sesión o comience su prueba gratuita.
Method Article
Dispositivo microfluídico para la separación de células de cáncer de mama no metastásico (MCF-7) y no tumoral (MCF-10A) mediante dielectroforesis AC
En este artículo
Resumen
Las células de cáncer de mama exhiben diferentes propiedades dieléctricas en comparación con las células epiteliales de mama no tumorales. Se ha planteado la hipótesis de que, en base a esta diferencia en las propiedades dieléctricas, las dos poblaciones pueden separarse con fines de inmunoterapia. Para apoyar esto, modelamos un dispositivo microfluídico para clasificar las células MCF-7 y MCF-10A.
Resumen
Los dispositivos dielectroforéticos son capaces de detectar y manipular células cancerosas de una manera sin etiquetas, rentable, robusta y precisa utilizando el principio de la polarización de las células cancerosas en el volumen de la muestra mediante la aplicación de un campo eléctrico externo. Este artículo demuestra cómo se puede utilizar una plataforma microfluídica para la clasificación continua de alto rendimiento de células de cáncer de mama no metastásico (MCF-7) y células epiteliales de mama no tumorales (MCF-10A) mediante dielectroforesis hidrodinámica (HDEP) de la mezcla celular. Al generar un campo eléctrico entre dos electrodos colocados uno al lado del otro con un espacio de tamaño micrométrico entre ellos en un chip microfluídico HDEP, las células epiteliales de mama no tumorales (MCF-10A) pueden ser expulsadas, exhibiendo DEP negativo dentro del canal principal, mientras que las células de cáncer de mama no metastásico siguen su curso sin verse afectadas cuando se suspenden en el medio celular debido a que tienen una conductividad mayor que la conductividad de la membrana. Para demostrar este concepto, se realizaron simulaciones para diferentes valores de conductividad media y se estudió la clasificación de las células. Se realizó un estudio paramétrico y se encontró una conductividad de mezcla celular adecuada de 0,4 S/m. Al mantener fija la conductividad del medio, se estableció una frecuencia de CA adecuada de 0,8 MHz, lo que proporciona la máxima eficiencia de clasificación, variando la frecuencia del campo eléctrico. Utilizando el método demostrado, después de elegir la conductividad del medio de suspensión de mezcla celular adecuada y la frecuencia de la CA aplicada, se puede lograr la máxima eficiencia de clasificación.
Introducción
Un tumor maligno que se desarrolla dentro y alrededor del tejido mamario es una causa frecuente de cáncer de mama en mujeres de todo el mundo, causando un problema de salud crítico1. Los tumores de mama antes de la metástasis se pueden tratar mediante cirugía si se detectan en una etapa temprana, pero si se ignoran, pueden tener graves implicaciones en la vida del paciente al propagarse a sus pulmones, cerebro y huesos. Los tratamientos ofrecidos en etapas posteriores, como la radiación y las terapias basadas en productos químicos, tienen efectos secundarios graves2. Estudios recientes han reportado que un diagnóstico precoz de cáncer de mama reduce la tasa de mortalidad en un 60%3. Por lo tanto, es imperativo trabajar hacia métodos personalizados de detección temprana. Con este fin, investigadores que trabajan en diferentes campos de la ciencia y la tecnología han utilizado la microfluídica para desarrollar dispositivos para el diagnóstico precoz del cáncer de mama4. Estos métodos incluyen microcromatografía de afinidad celular, clasificadores de microcélulas activadas magnéticamente, captura y separación de células cancerosas basadas en el tamaño y dielectroforesis en chip (DEP)5,6. Estas técnicas microfluídicas relatadas en la literatura permiten la manipulación celular precisa, el monitoreo en tiempo real y la clasificación de muestras bien definidas, que sirven como un paso intermedio en muchas aplicaciones diagnósticas y terapéuticas5. La integración de estos mecanismos de clasificación con microfluídica ofrece una manipulación flexible y fiable de las células diana 7,8,9,10. Una de las principales ventajas de tal integración es la capacidad de trabajar con muestras de fluido en volúmenes de nano a microlitros y también poder manipular las propiedades eléctricas del fluido de muestra. Al ajustar la conductividad del fluido en suspensión dentro de los dispositivos microfluídicos, las células biológicas se pueden clasificar en función de sus tamaños y diferencias en sus propiedades dieléctricas11,12.
Entre estas técnicas, a menudo se prefiere DEP en chip, ya que es una técnica de clasificación celular sin etiquetas que explota las propiedades eléctricas de las muestras biológicas. Se ha informado que la DEP manipula muestras biológicas como el ADN 13, el ARN 14, las proteínas 15, las bacterias16, las células sanguíneas 17, las células tumorales circulantes (CTC)18 y las células madre 19. Los dispositivos microfluídicos que emplean DEP para la clasificación de muestras biológicas han sido ampliamente descritos en la literatura20. Se han descrito dispositivos microfluídicos DEP (rDEP) basados en reservorios para clasificar células de levadura viables y no viables que protegen las células de los efectos adversos de las reacciones electroquímicas21,22. Piacentini et al. relataron un clasificador de células microfluídicas almenadas que separó los glóbulos rojos de las plaquetas con una eficiencia del 97%23. También se ha informado que los dispositivos DEP en chip con orificios asimétricos y electrodos integrados clasifican células viables y no viables24. Valero y Demierre et al. modificaron el clasificador de células microfluídicas almenadas introduciendo dos matrices de microelectrodos a ambos lados del canal25,26. Esto ayudó a enfocar las células en el centro del canal. Zeynep et al. presentaron un dispositivo microfluídico basado en DEP para separar y concentrar células de cáncer de mama MCF7 de leucocitos27. Informaron una eficiencia de extracción de células MCF7 de leucocitos entre 74% -98% con una frecuencia de 1 MHz y un voltaje aplicado que varía de 10-12 Vpp. La Tabla Suplementaria 1 representa una comparación cualitativa y cuantitativa entre los dispositivos de clasificación microfluídica basados en DEP en función de su diseño, configuración de electrodos y parámetros de funcionamiento (frecuencia y voltaje aplicados).
Más recientemente, los investigadores han tratado de medir las diferencias en el comportamiento dieléctrico de las células epiteliales de mama (MCF-10A) y las células de cáncer de mama no metastásico (MCF-7) dentro de un chip microfluídico28,29. Jithin et al. también caracterizaron las respuestas dieléctricas de diferentes líneas celulares de cáncer utilizando una técnica de sonda coaxial abierta con frecuencias entre 200 MHz y 13.6 GHz30. Estas diferencias en las respuestas dieléctricas de las líneas celulares MCF-7 y MCF-10A pueden explotarse para separarlas en tiempo de ejecución y pueden conducir al desarrollo de dispositivos de diagnóstico personalizados en etapa temprana.
En este artículo, simulamos la clasificación controlada de células de cáncer de mama no metastásico (MCF-7) y células epiteliales de mama no tumorales (MCF-10A) mediante dielectroforesis AC. La región de cambio en el campo eléctrico influye en la clasificación dentro del chip microfluídico. La técnica propuesta es fácil de implementar y permite la integración de la técnica de clasificación en varios diseños de chips microfluídicos. Se realizaron simulaciones de dinámica de fluidos computacional (CFD) para estudiar la separación de células de cáncer de mama no metastásico y células epiteliales de mama no tumorales variando la conductividad del medio fluido en el que se suspendieron las células. En estas simulaciones, se demuestra que, manteniendo la conductividad constante y cambiando la frecuencia aplicada, se puede controlar la separación de las células cancerosas y las células sanas.
Access restricted. Please log in or start a trial to view this content.
Protocolo
NOTA: El protocolo aquí utiliza COMSOL, un software de simulación multifísica, para simular la clasificación controlada de células de cáncer de mama no metastásico (MCF-7) y células epiteliales de mama no tumorales (MCF-10A) mediante dielectroforesis AC.
1. Diseño del chip y selección de parámetros
- Abra el software multifísico y seleccione Modelo en blanco. Haga clic con el botón derecho en Definiciones globales y seleccione Parámetros. Importe los parámetros indicados en la Tabla 1 en definiciones globales como un archivo de texto o introduzca los valores individualmente.
- Seleccione Agregar componente en la pestaña de inicio y agregue un componente 2D. Haga clic con el botón derecho en geometría e importe el archivo de modelo haciendo doble clic en el archivo.
- Elija un material en blanco y utilice las propiedades del material de la Tabla 1.
- Seleccione Agregar física en la pestaña de inicio y escriba AC/DC. En el nodo AC/DC, elija corrientes eléctricas como Física bajo el subnodo de campos eléctricos y corrientes.
- Haga clic derecho en los subnodos Corriente eléctrica y elija los subnodos Conservación de corriente, Aislar y Potencial eléctrico para aislar las paredes del canal para asignar potencial a los electrodos.
- Seleccione Agregar física en la pestaña de inicio y, en el nodo Flujo de fluidos , elija Física de flujo progresivo en el subnodo de Flujo monofásico. Haga clic con el botón derecho en Flujo monofásico y represente los límites del chip como paredes utilizando el subnodo Muro .
- Haga clic derecho en Flujo monofásico y agregue dos subnodos de entrada y un subnodo de salida.
- Asigne las entradas utilizando el subnodo de entrada y use normal en Velocidad de flujo como condición de límite. Asigne la salida utilizando el subnodo de salida.
- Seleccione Agregar física en la pestaña de inicio y, en el nodo Flujo de fluidos , elija Física de flujo de seguimiento de partículas en el subnodo de Trazado de partículas.
- Haga clic con el botón derecho en el nodo Seguimiento de partículas y agregue la pared de subnodos, los subnodos de propiedad de dos partículas, dos subnodos de entrada, un subnodo de salida, dos subnodos de fuerza de dielectroforesis y un subnodo de fuerza de arrastre.
- Establezca las propiedades de partícula para las celdas MCF-7 y MCF-10A utilizando el subnodo Propiedades de partículas. Elija las propiedades de partícula de los parámetros de la sección Definición global.
- Agregue el subnodo Fuerza de arrastre para asignar la fuerza dielectroforética a ambos tipos de celdas.
- Agregue propiedades de partícula en este caso desde la sección de parámetros. Agregue el subnodo Shell para modelar células de mamíferos.
- En la pestaña de inicio, elija Add Mesh (Agregar malla ) y seleccione Fine Mesh. Elija Build Mesh en la pestaña de inicio para crear una malla.
- Desde la pestaña de inicio, haga clic en Agregar estudio para agregar tres pasos de estudio . El paso 1 del estudio es para simular una respuesta de frecuencia; utilice un subnodo de dominio de frecuencia .
- Para simular el flujo progresivo, elija un nodo Estudio estacionario . Agregue dos pasos dependientes del tiempo para simular condiciones con fuerza dielectroforética y sin fuerza dielectroforética.
- Para la condición sin dielectroforética, elija Selección de física y variables, marque la casilla titulada Modificar configuración del modelo para el paso de estudio y deshabilite el paso dielectroforético. Para condiciones dielectroforéticas, no desactivar. Guarde el archivo y presione Computar para que se ejecute la simulación.
NOTA: El chip microfluídico diseñado para la clasificación de células de cáncer de mama no metastásico (MCF-7) y células epiteliales de mama no tumorales (MCF-10A) tiene dos entradas separadas para el flujo de mezcla celular y para el enfoque de flujo hidrodinámico, respectivamente, con anchos de 20 μm y 40 μm, respectivamente, como se muestra en la Figura suplementaria 1 y la Figura complementaria 2. - Asigne frecuencia (f0) bajo el subnodo del dominio de frecuencia y voltaje utilizando el subnodo de potencial eléctrico a los electrodos cepilladores (295 μm de ancho) colocados a lo largo de la pared lateral superior de la cámara de clasificación. En la salida, use la condición de pared de "congelación" para visualizar las partículas clasificadas.
2. Modelo matemático y análisis computacional
- Verifique los parámetros operativos para separar las células de cáncer de mama no metastásico y las células epiteliales de mama no tumorales dentro del dispositivo microfluídico mediante la creación de un estudio de dinámica de fluidos computacional (CFD).
NOTA: Para ello se utilizó software multifísico (módulos AC/DC, Microfluídica y Seguimiento de Partículas). Las ecuaciones rectoras y los antecedentes teóricos se detallan en el Archivo Suplementario 1. El modelo se probó utilizando las propiedades dieléctricas de las células de cáncer de mama no metastásico (MCF7) y las células epiteliales de mama no tumorales (MCF-10A) reportadas en la literatura31,32, que se resumen en la Tabla 1. - Realice las simulaciones CFD introduciendo líneas celulares de cáncer de mama no metastásico (MCF7) y epitelial de mama no tumoral (MCF-10A) con una proporción de 1:1 en la entrada de la mezcla celular.
- Inicialmente, realizar un estudio de independencia de malla para optimizar el tamaño de malla para las simulaciones33.
NOTA: Se realizó un estudio de independencia de malla para encontrar la mejor solución para los parámetros de operación. Se eligió un conjunto de cinco tamaños de malla diferentes para cuantificar el mejor tamaño de elemento posible para la convergencia de la solución. Se observó que, cuando el número total de elementos que definen una malla era 635 (malla más gruesa), como se muestra en la figura complementaria 3A, la eficiencia de clasificación estaba en su punto más bajo, con algunas de las celdas MCF7 moviéndose hacia la salida inferior, como se muestra en la figura complementaria 3B. Cuando el tamaño de la malla se aumentó a fino, el número de elementos que definen la malla también aumentó a 2.288. La eficiencia de clasificación fue máxima en este caso, con las células MCF7 y MCF-10A moviéndose hacia sus respectivas salidas. También se simuló la malla más fina, y el número de elementos que definen la malla aumentó a 3.188. La eficiencia de clasificación no se vio afectada más allá de este punto. Por lo tanto, podemos decir con seguridad que el tamaño de malla fina funciona mejor en nuestro caso. - Resuelve dos conjuntos de estudios CFD.
- Para el primer conjunto, haga clic derecho en Estudio 1 y agregue el subnodo Barrido paramétrico . Pulse el signo + para añadir la conductividad del medio fluido "σm" como variable de barrido. Realizar un estudio de barrido paramétrico para la conductividad del medio fluido σ m que oscile entre 0,01 S/m y 2,5 S/m , manteniendo constante la frecuencia aplicada, f (Hz), en un valor de 800 kHz.
- Para el segundo conjunto, realice un estudio de barrido paramétrico variando la frecuencia de CA aplicada de 100 kHz a 100 MHz manteniendo la conductividad del medio fluido, σ m, fija en 0,4 S /m para cada caso. Este valor de σm se eligió en función de los resultados del primer estudio de CFD, ya que se observó una separación máxima entre MCF-7 y MCF-10A en este valor.
- La fuerza de la fuerza de dielectroforesis (DEP), FDEP (-), ejercida sobre una partícula esférica dieléctrica en un medio conductor viene dada por la Ecuación 1T34:
FDEP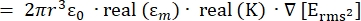 [1]
[1]
Utilice la ecuación 1 bajo el subnodo de fuerza dielectroforética. En la ecuación 1, r muestra el radio de la partícula sobre la que se aplica FDEP; K (-) se conoce como el factor Clausius-Mossotti; εm(-) muestra la permitividad dieléctrica del medio; y E(V/m) es el valor cuadrático medio del campo eléctrico. - Utilice la ecuación 2 para una partícula esférica bajo el subnodo de fuerza dielectroforética.
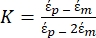 [2]
[2]
En la ecuación 2,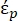 (-) muestra la permitividad compleja de la partícula sobre la que se aplica la fuerza DEP;
(-) muestra la permitividad compleja de la partícula sobre la que se aplica la fuerza DEP; 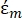 (-) muestra la permitividad compleja del fluido que rodea a la partícula. La permitividad
(-) muestra la permitividad compleja del fluido que rodea a la partícula. La permitividad 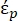 compleja y
compleja y 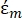 se definen de la siguiente manera35:
se definen de la siguiente manera35: - Utilice la ecuación 3 para una partícula esférica bajo el subnodo de fuerza dielectroforética:
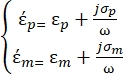 [3]
[3]
En la ecuación 3, εp (-) muestra la parte real de la permitividad compleja de la partícula; εm (-) muestra la parte real de la compleja permitividad del fluido que rodea la partícula; σp (S/m) muestra la conductividad de la partícula; σ m (S/m ) muestra la conductividad del medio que rodea la partícula; y ω (Hz) es la frecuencia del campo eléctrico aplicado.
NOTA: El signo de Re(K) determina la polaridad delDEP F. Si el signo de Re(K) es negativo, entonces la partícula experimenta una fuerza dielectroforética negativa (nDEP); contrariamente a esto, si el signo de Re(K) es positivo, implica una fuerza dielectroforética positiva (pDEP). Para el factor Clausius-Mossotti (K), la variación se encuentra dentro del rango de -1 a 1.
- Inicialmente, realizar un estudio de independencia de malla para optimizar el tamaño de malla para las simulaciones33.
- Utilice una forma modificada de la Ecuación 3 para modelar células biológicas como las células de mamíferos, que son más complejas y tienen una estructura de múltiples capas.
K (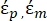 ) =
) = 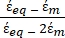 [4]
[4]
En la Ecuación 4, (-) incorpora tanto la permitividad compleja del citoplasma, (-), como la permitividad compleja de la membrana celular,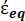
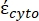
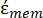 (-), y se da de la siguiente manera:36
(-), y se da de la siguiente manera:36 - Usa la ecuación 5 para resolver ""
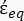 :
: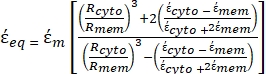 [5]
[5]
En la ecuación 5, R cyto (m) y Rmem (m) muestran el radio del citoplasma celular y la membrana celular, respectivamente. - Luego, use la Ecuación 4 para trazar Re(K) como una función del campo eléctrico aplicado tanto para el cáncer como para las células sanas. Calcule la parte real del factor Clausius-Mossotti (CM), Re(K), para cuantificar la fuerza dielectroforética (DEP) que experimenta la partícula.
- Haga clic con el botón secundario en el nodo Resultados, agregue el subnodo Evaluación de partículas y, en la sección de expresión, escriba fpt.deff1.K para trazar el factor CM para la partícula 1 y fpt.deff2.K para la partícula 2.
NOTA: Todos los pasos del protocolo enumerados en el texto principal se pueden ver en el video del protocolo (Video 1).
Access restricted. Please log in or start a trial to view this content.
Resultados
Investigar los parámetros operativos óptimos para la clasificación eficaz basada en DEP de células epiteliales de mama no metastásicas (MCF-7) y no tumorales (MCF-10A)
Para lograr una separación exitosa de las células epiteliales de mama no metastásicas (MCF-7) y no tumorales (MCF-10A) con propiedades dieléctricas divergentes cuando se someten a dielectroforesis, sus factores K deben ser distintos manteniendo fija la frecuencia aplicada37,38
Access restricted. Please log in or start a trial to view this content.
Discusión
Los dispositivos microfluídicos han sido reportados previamente para cultivo celular, captura y clasificación 47,52,53. La fabricación de estos dispositivos en la sala limpia es un proceso costoso, y es imperativo cuantificar la salida y la eficiencia de un dispositivo microfluídico propuesto a través de simulaciones CFD. Este estudio presenta el diseño y simulaciones de un dispositivo microfluídico AC-dielectroforético ...
Access restricted. Please log in or start a trial to view this content.
Divulgaciones
Los autores declaran no tener posibles conflictos de intereses.
Agradecimientos
Este estudio fue apoyado por la Comisión de Educación Superior de Pakistán.
Access restricted. Please log in or start a trial to view this content.
Materiales
| Name | Company | Catalog Number | Comments |
| COMSOL | COMSOL | multiphysics simulation software |
Referencias
- Liang, L., et al. Microfluidic-based cancer cell separation using active and passive mechanisms. Microfluidics and Nanofluidics. 24 (4), 26(2020).
- Damiati, S., Kompella, U. B., Damiati, S. A., Kodzius, R. Microfluidic devices for drug delivery systems and drug screening. Genes. 9 (2), 103(2018).
- Pashayan, N., et al. Personalized early detection and prevention of breast cancer: ENVISION consensus statement. Nature Reviews Clinical Oncology. 17 (11), 687-705 (2020).
- Panesar, S., Neethirajan, S. Microfluidics: Rapid diagnosis for breast cancer. Nano-micro Letters. 8 (3), 204-220 (2016).
- Chen, J., Li, J., Sun, Y. Microfluidic approaches for cancer cell detection, characterization and separation. Lab on a Chip. 12 (10), 1753-1767 (2012).
- Beech, J. P., Holm, S. H., Adolfsson, K., Tegenfeldt, J. O. Sorting cells by size, shape and deformability. Lab on a Chip. 12 (6), 1048-1051 (2012).
- Kang, Y., Li, D. Electrokinetic motion of particles and cells in microchannels. Microfluidics and Nanofluidics. 6 (4), 431-460 (2009).
- Schmid, L., Weitz, D. A., Franke, T. Acoustic microfluidic fluorescence-activated cell sorter. Lab on a Chip. 14 (19), 3710-3718 (2014).
- Yu, B. Y., Elbuken, C., Shen, C., Huissoon, J. P., Ren, C. L. An integrated microfluidic device for the sorting of yeast cells using image processing. Scientific Reports. 8, 3550(2014).
- Asiaei, S., Darvishi, V., Davari, M. H., Zohrevandi, D., Moghadasi, H. Thermophoretic isolation of circulating tumor cells, numerical simulation and design of a microfluidic chip. Journal of Thermal Analysis and Calorimetry. 137 (3), 831-839 (2019).
- Song, Y., Li, M., Pan, X., Wang, Q., Li, D. Size-based cell sorting with a resistive pulse sensor and an electromagnetic pump in a microfluidic chip. Electrophoresis. 36 (3), 398-404 (2014).
- Giraud, G., et al. Dielectrophoretic manipulation of ribosomal RNA. Biomicrofluidics. 5 (2), 024116(2011).
- Valero, A., Braschler, T., Demierre, N., Renaud, P. A miniaturized continuous dielectrophoretic cell sorter and its applications. Biomicrofluidics. 4 (2), 022807(2010).
- Allahrabbi, N., Chia, Y. S. M., Saifullah, M. S. M., Lim, K. M., Lanry Yung, L. Y. A hybrid dielectrophoretic system for trapping of microorganisms from water. Biomicrofluidics. 9 (3), 034110(2015).
- Vykoukal, D. M., Gascoyne, P. R. C., Vykoukal, J. Dielectric characterization of complete mononuclear and polymorphonuclear blood cell subpopulations for label-free discrimination. Integrative Biology: Quantitative Biosciences from Nano to Macro. 1 (7), 477-484 (2009).
- Shim, S., et al. Antibody-independent isolation of circulating tumor cells by continuous-flow dielectrophoresis. Biomicrofluidics. 7 (1), 11807(2013).
- Jeon, H. J., Lee, H., Yoon, D. S., Kim, B. M. Dielectrophoretic force measurement of red blood cells exposed to oxidative stress using optical tweezers and a microfluidic chip. Biomedical Engineering Letters. 7 (4), 317-323 (2017).
- Song, H., et al. Continuous-flow sorting of stem cells and differentiation products based on dielectrophoresis. Lab on a Chip. 15 (5), 1320-1328 (2015).
- Tsai, S. L., Chiang, Y., Wang, M. H., Chen, M. K., Jang, L. S. Battery-powered portable instrument system for single-cell trapping, impedance measurements, and modeling analyses. Electrophoresis. 35 (16), 2392-2400 (2014).
- Chan, J. Y., et al. Dielectrophoresis-based microfluidic platforms for cancer diagnostics. Biomicrofluidics. 12 (1), 011503(2018).
- Patel, S., et al. Microfluidic separation of live and dead yeast cells using reservoir-based dielectrophoresis. Biomicrofluidics. 6 (3), 34102(2012).
- Yildizhan, Y., Erdem, N., Islam, M., Martinez-Duarte, R., Elitas, M. Dielectrophoretic separation of live and dead monocytes using 3D carbon-electrodes. Sensors. 17 (11), 2691-2704 (2017).
- Piacentini, N., Mernier, G., Tornay, R., Renaud, P. Separation of platelets from other blood cells in continuous-flow by dielectrophoresis field-flow-fractionation. Biomicrofluidics. 5 (3), 34122(2011).
- Zhao, K., Duncker, B. P., Li, D. Continuous cell characterization and separation by microfluidic alternating current dielectrophoresis. Analytical Chemistry. 91 (9), 6304-6314 (2019).
- Valero, A., et al. Tracking and synchronization of the yeast cell cycle using dielectrophoretic opacity. Lab on a Chip. 11 (10), 1754-1760 (2011).
- Demierre, N., Braschler, T., Muller, R., Renaud, P. Focusing and continuous separation Of cells in a microfluidic device using lateral dielectrophoresis. International Solid-State Sensors, Actuators and Microsystems Conference. 430 (98), 1777-1780 (2007).
- Arslan, Z. C., Yalçın, Y. D., Külah, H. Label-free enrichment of MCF7 breast cancer cells from leukocytes using continuous flow dielectrophoresis. Electrophoresis. 43 (13-14), 1531-1544 (2022).
- Turcan, I., Olariu, M. A. Dielectrophoretic manipulation of cancer cells and their electrical characterization. ACS Combinatorial Science. 22 (11), 554-578 (2020).
- Park, J., et al. Sequential cell-processing system by integrating hydrodynamic purification and dielectrophoretic trapping for analyses of suspended cancer cells. Micromachines. 11 (1), 47(2020).
- Hussein, M., et al. Breast cancer cells exhibits specific dielectric signature in vitro using the open-ended coaxial probe technique from 200 MHz to 13.6 GHz. Scientific Reports. 9, 4681(2019).
- Fornes-Leal, A., Garcia-Pardo, C., Frasson, M., Pons Beltrán, V., Cardona, N. Dielectric characterization of healthy and malignant colon tissues in the 0.5-18 GHz frequency band. Physics in Medicine and Biology. 61 (20), 7334-7346 (2016).
- Çetin, B., Li, D. Dielectrophoresis in microfluidics technology. Electrophoresis. 32 (18), 2410-2427 (2011).
- Khan, S., Khulief, Y. A., Al-Shuhail, A. A. Effects of reservoir size and boundary conditions on pore-pressure buildup and fault reactivation during CO2 injection in deep geological reservoirs. Environmental Earth Sciences. 79, 294(2020).
- Adams, T. N. G., Turner, P. A., Janorkar, A. V., Zhao, F., Minerick, A. R. Characterizing the dielectric properties of human mesenchymal stem cellsand the effects of charged elastin-like polypeptide copolymer treatment. Biomicrofluidics. 8 (5), 054109(2014).
- Lo, Y. J., et al. Measurement of the Clausius-Mossotti factor of generalized dielectrophoresis. Applied Physics Letters. 104, 083701(2014).
- Lo, Y. J., Lei, U. Measurement of the real part of the Clausius-Mossotti factor of dielectrophoresis for Brownian particles. Electrophoresis. 41 (1), 137-147 (2020).
- Ohta, A. T., et al. Optically controlled cell discrimination and trapping using optoelectronic Tweezers. IEEE Journal of Selected Topics in Quantum Electronics. 13 (2), 235-242 (2007).
- Sun, T., Morgan, H. Single-cell microfluidic Impedance cytometry. Microfluidics and Nanofluidics. 8 (4), 423-443 (2010).
- Weng, P. Y., et al. Size-dependent dielectrophoretic cross-over frequency of spherical particles. Biomicrofluidics. 10 (1), 1909-1921 (2016).
- Lu, Y. W., Sun, C., Kao, Y. C., Hung, C. L., Juang, J. Y. Dielectrophoretic cross-over frequency of single particles: Quantifying the effect of surface functional groups and electrohydrodynamic flow drag force. Nanomaterials. 10 (7), 1364(2020).
- Henslee, E. A., Sano, M. B., Rojas, A. D., Schmelz, E. M., Davalos, R. V. Selective concentration of human cancer cells using contactless dielectrophoresis. Electrophoresis. 32 (18), 2523-2529 (2011).
- Chan, J. Y., et al. Dielectrophoresis-based microfluidic platforms for cancer diagnostics. Biomicrofluidics. 12 (1), 11503-11525 (2018).
- Gascoyne, P. R. C., Shim, S. Isolation of circulating tumor cells by dielectrophoresis. Cancers. 6 (1), 545-579 (2014).
- Liang, W., et al. Determination of dielectric properties of cells using ac electrokinetic-based microfluidic platform. Micromachines. 11 (5), 513-537 (2020).
- Frusawa, H., et al. Frequency-modulated wave dielectrophoresis of vesicles and cells periodic U-turns at the crossover frequency. Nanoscale Research Letters. 13 (169), 2583-2589 (2018).
- Wei, M. T., Junio, J., Ou-Yang, D. H. Direct measurements of the frequency-dependent dielectrophoresis force. Biomicrofluidics. 3 (1), 12003(2009).
- Mustafa, A., Pedone, E., Marucci, L., Moschou, D., Lorenzo, M. D. A flow-through microfluidic chip for continuous dielectrophoretic separation of viable and non-viable human T-cells. Electrophoresis. 43 (3), 501-508 (2021).
- Wang, L., et al. Dual frequency dielectrophoresis with interdigitated sidewall electrodes for microfluidic flow-through separation of beads and cells. Electrophoresis. 30 (5), 782-791 (2021).
- Alazzam, A., Mathew, B., Alhammadi, F. Novel microfluidic device for the continuous separation of cancer cells using dielectrophoresis. Journal of Separation Science. 40 (5), 1193-1200 (2017).
- Yang, L., Banada, P. P., Bhunia, A. K., Bashir, R. Effects of dielectrophoresis on growth viability and immuno-reactivity of listeria monocytogenes. Journal of Biological Engineering. 2, 6(2008).
- Matbaechi, H., Soltani, P., Hölzel, R., Wenger, C. Dielectrophoretic immobilization of yeast cells using CMOS integrated microfluidics. Micromachines. 11 (5), 501-518 (2020).
- Mustafa, A., Pedone, E., La Regina, A., Erten, A. A., Marucci, L. Development of a single layer microfluidic device for dynamic stimulation, culture and imaging of mammalian cells. bioRxiv. , (2022).
- Mustafa, A., et al. Enhanced dissolution of liquid microdroplets in the extensional creeping flow of a hydrodynamic trap. Langmuir. 32 (37), 9460-9467 (2016).
- Chang, H. F., Chou, S. E., Cheng, J. Y. Electric-field-induced neural precursor cell differentiation in microfluidic devices. Journal of Visualized Experiments. (170), e61917(2021).
Access restricted. Please log in or start a trial to view this content.
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoExplorar más artículos
This article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados