Bu içeriği görüntülemek için JoVE aboneliği gereklidir. Oturum açın veya ücretsiz deneme sürümünü başlatın.
Method Article
Metastatik Olmayan (MCF-7) ve Tümörsüz (MCF-10A) Meme Kanseri Hücrelerinin AC Dielektroforez Kullanılarak Ayrılması için Mikroakışkan Cihaz
Bu Makalede
Özet
Meme kanseri hücreleri, tümör dışı meme epitel hücrelerine kıyasla farklı dielektrik özellikler gösterir. Dielektrik özelliklerdeki bu farklılığa dayanarak, iki popülasyonun immünoterapi amacıyla ayrılabileceği varsayılmıştır. Bunu desteklemek için, MCF-7 ve MCF-10A hücrelerini sıralamak için mikroakışkan bir cihaz modelliyoruz.
Özet
Dielektroforetik cihazlar, harici bir elektrik alanı uygulayarak numune hacmindeki kanser hücrelerinin polarizasyonu prensibini kullanarak etiketsiz, uygun maliyetli, sağlam ve doğru bir şekilde kanser hücrelerinin tespitini ve manipülasyonunu yapabilir. Bu makalede, mikroakışkan bir platformun, hücre karışımından hidrodinamik dielektroforez (HDEP) kullanılarak metastatik olmayan meme kanseri hücrelerinin (MCF-7) ve tümör dışı meme epitel hücrelerinin (MCF-10A) yüksek verimli sürekli sıralanması için nasıl kullanılabileceği gösterilmektedir. Bir HDEP mikroakışkan çipinde aralarında mikron büyüklüğünde bir boşluk ile yan yana yerleştirilmiş iki elektrot arasında bir elektrik alanı oluşturarak, tümör dışı meme epitel hücreleri (MCF-10A), ana kanal içinde negatif DEP sergileyerek, uzaklaştırılabilirken, metastatik olmayan meme kanseri hücreleri, membran iletkenliğinden daha yüksek iletkenliğe sahip olmaları nedeniyle hücre ortamında askıya alındığında etkilenmeden seyrini takip eder. Bu kavramı göstermek için, farklı ortam iletkenlik değerleri için simülasyonlar yapıldı ve hücrelerin sıralanması incelendi. Parametrik bir çalışma yapılmış ve uygun hücre karışımı iletkenliği 0.4 S/m olarak bulunmuştur. Orta iletkenliği sabit tutarak, elektrik alan frekansını değiştirerek maksimum sıralama verimliliği sağlayan 0,8 MHz'lik yeterli bir AC frekansı oluşturuldu. Gösterilen yöntem kullanılarak, uygulanan AC'nin uygun hücre karışımı süspansiyon ortamı iletkenliği ve frekansı seçildikten sonra, maksimum ayıklama verimliliği elde edilebilir.
Giriş
Meme dokusu içinde ve çevresinde gelişen malign bir tümör, dünya çapında kadınlarda meme kanserinin sık görülen bir nedenidir ve kritik bir sağlık sorununa nedenolmaktadır 1. Metastaz öncesi meme tümörleri erken bir aşamada tespit edilirse cerrahi yoluyla tedavi edilebilir, ancak göz ardı edilirse, akciğerlerine, beyinlerine ve kemiklerine yayılarak hastanın yaşamı üzerinde ciddi etkileri olabilir. Radyasyon ve kimyasal bazlı tedaviler gibi daha sonraki aşamalarda sunulan tedavilerin ciddi yan etkileri vardır2. Son zamanlarda yapılan çalışmalar, meme kanserinin erken teşhisinin mortalite oranını %60 oranında azalttığını bildirmiştir3. Bu nedenle, kişiselleştirilmiş erken teşhis yöntemlerine yönelik çalışmak zorunludur. Bu amaçla, bilim ve teknolojinin farklı alanlarında çalışan araştırmacılar, meme kanserinin erken teşhisi için cihazlar geliştirmek için mikroakışkanlar kullanmışlardır4. Bu yöntemler arasında hücre afinitesi mikro-kromatografisi, manyetik aktive mikro hücre ayıklayıcıları, boyut bazlı kanser hücresi yakalama ve ayırma ve çip üstü dielektroforez (DEP)5,6 bulunur. Literatürde bildirilen bu mikroakışkan teknikler, birçok tanısal ve terapötik uygulamada bir ara adım görevi gören hassas hücre manipülasyonu, gerçek zamanlı izleme ve iyi tanımlanmış örneklerin sıralanmasını sağlar5. Bu ayıklama mekanizmalarının mikroakışkanlarla entegrasyonu, hedef hücrelerin esnek ve güvenilir manipülasyonunu sağlar 7,8,9,10. Böyle bir entegrasyonun ana avantajlarından biri, nanodan mikrolitreye kadar hacimlerde sıvı numunelerle çalışabilme ve ayrıca numune sıvısının elektriksel özelliklerini manipüle edebilme yeteneğidir. Mikroakışkan cihazların içindeki askı sıvısının iletkenliğini ayarlayarak, biyolojik hücreler boyutlarına ve dielektrik özelliklerindeki farklılıklara göre sıralanabilir11,12.
Bu teknikler arasında, çip üstü DEP, biyolojik numunelerin elektriksel özelliklerinden yararlanan etiketsiz bir hücre sıralama tekniği olduğu için sıklıkla tercih edilir. DEP'nin DNA 13, RNA 14, proteinler 15, bakteri16, kan hücreleri17, dolaşımdaki tümör hücreleri (CTC'ler)18 ve kök hücreler 19 gibi biyo-örnekleri manipüle ettiği bildirilmiştir. Biyolojik numunelerin sıralanması için DEP kullanan mikroakışkan cihazlar literatür20'de kapsamlı olarak bildirilmiştir. Canlı ve canlı olmayan maya hücrelerini sıralamak için rezervuar bazlı DEP mikroakışkan (rDEP) cihazlarının, hücreleri elektrokimyasal reaksiyonların olumsuz etkilerinden koruduğu bildirilmiştir21,22. Piacentini ve ark., kırmızı kan hücrelerini trombositlerden% 97 verimlilikle ayıran bir kastellenmiş mikroakışkan hücre sıralayıcısı bildirmiştir 23. Asimetrik deliklere ve gömülü elektrotlara sahip çip üstü DEP cihazlarının da canlı ve canlı olmayan hücreleri sıraladığı bildirilmiştir24. Valero ve Demierre ve ark.,25,26 kanalının her iki tarafına iki mikroelektrot dizisi ekleyerek kastellenmiş mikroakışkan hücre sıralayıcısını değiştirdi. Bu, kanalın merkezindeki hücrelerin odaklanmasına yardımcı oldu. Zeynep ve ark., MCF7 meme kanseri hücrelerini lökositlerden ayırmak ve konsantre etmek için DEP tabanlı bir mikroakışkan cihaz sunmuşlardır27. MCF7 hücrelerini lökositlerden% 74-98 arasında, 1 MHz frekansında ve 10-12 Vpp arasında değişen bir voltajla ekstrakte etme verimliliğini bildirdiler. Ek Tablo 1, DEP tabanlı mikroakışkan ayıklama cihazları arasında tasarımlarına, elektrot konfigürasyonlarına ve çalışma parametrelerine (uygulanan frekans ve voltaj) göre nitel ve nicel bir karşılaştırmayı temsil etmektedir.
Daha yakın zamanlarda, araştırmacılar mikroakışkan bir çip28,29 içindeki meme epitel hücrelerinin (MCF-10A) ve metastatik olmayan meme kanseri hücrelerinin (MCF-7) dielektrik davranışlarındaki farklılıkları ölçmeye çalışmışlardır. Jithin ve ark. ayrıca, 200 MHz ile 13.6 GHz30 arasındaki frekanslara sahip açık uçlu bir koaksiyel prob tekniği kullanarak farklı kanser hücre hatlarının dielektrik yanıtlarını karakterize etmişlerdir. MCF-7 ve MCF-10A hücre hatlarının dielektrik yanıtlarındaki bu farklılıklar, bunları çalışma zamanında ayırmak için kullanılabilir ve kişiselleştirilmiş erken evre tanı cihazlarının geliştirilmesine yol açabilir.
Bu makalede, metastatik olmayan meme kanseri hücrelerinin (MCF-7) ve tümör dışı meme epitel hücrelerinin (MCF-10A) AC dielektroforezi kullanılarak kontrollü olarak sıralanmasını simüle ediyoruz. Elektrik alanındaki değişim bölgesi, mikroakışkan çipin içindeki sıralamayı etkiler. Önerilen tekniğin uygulanması kolaydır ve sıralama tekniğinin çeşitli mikroakışkan çip düzenlerine entegre edilmesine izin verir. Metastatik olmayan meme kanseri hücrelerinin ve tümör dışı meme epitel hücrelerinin ayrılmasını, hücrelerin askıya alındığı sıvı ortamın iletkenliğini değiştirerek incelemek için hesaplamalı akışkanlar dinamiği (CFD) simülasyonları gerçekleştirilmiştir. Bu simülasyonlarda, iletkenliği sabit tutarak ve uygulanan frekansı değiştirerek, kanser hücreleri ile sağlıklı hücrelerin ayrılmasının kontrol edilebileceği gösterilmiştir.
Access restricted. Please log in or start a trial to view this content.
Protokol
NOT: Buradaki protokol, AC dielektroforezi kullanarak metastatik olmayan meme kanseri hücrelerinin (MCF-7) ve tümör dışı meme epitel hücrelerinin (MCF-10A) kontrollü sıralamasını simüle etmek için bir multifizik simülasyon yazılımı olan COMSOL'u kullanır.
1. Talaş tasarımı ve parametre seçimi
- Multifizik yazılımını açın ve Boş Model'i seçin. Genel Tanımlar'a sağ tıklayın ve Parametreler'i seçin. Tablo 1'de verilen parametreleri genel tanımlara metin dosyası olarak alın veya değerleri tek tek girin.
- Giriş sekmesinden Bileşen Ekle'yi seçin ve bir 2B Bileşen ekleyin. Geometriye sağ tıklayın ve dosyaya çift tıklayarak model dosyasını içe aktarın.
- Boş bir malzeme seçin ve Tablo 1'deki malzeme özelliklerini kullanın.
- Giriş sekmesinden Fizik Ekle'yi seçin ve AC/DC yazın. AC / DC düğümü altında, elektrik akımlarını, elektrik alanlarının ve akımlarının alt düğümü altında Fizik olarak seçin.
- Elektrik Akımına sağ tıklayın ve elektrotlara potansiyel atamak üzere kanal duvarlarını yalıtmak için Akım Koruma, Yalıtma ve Elektrik Potansiyeli alt düğümlerini seçin.
- Giriş sekmesinden Fizik Ekle'yi seçin ve Akışkan Akışı düğümü altında, Tek Fazlı Akış alt düğümü altında Sürünen Akış Fiziği'ni seçin. Tek Fazlı Akış'a sağ tıklayın ve Duvar alt düğümünü kullanarak çip sınırlarını duvar olarak oluşturun.
- Tek Fazlı Akış'a sağ tıklayın ve iki giriş alt düğümü ve bir çıkış alt düğümü ekleyin.
- Giriş alt düğümünü kullanarak girişleri atayın ve Akış Hızı'nda Sınır Koşulu olarak normali kullanın. Çıkış alt düğümünü kullanarak çıkışı atayın.
- Giriş sekmesinden Fizik Ekle'yi seçin ve Akışkan Akışı düğümü altında, Parçacık İzleme alt düğümü altında Parçacık İzleme Akış Fiziği'ni seçin.
- Parçacık İzleme düğümüne sağ tıklayın ve alt düğümler duvarı, iki parçacık özelliği alt düğümü, iki giriş alt düğümü, bir çıkış alt düğümü, iki dielektroforez kuvveti alt düğümü ve bir sürükleme kuvveti alt düğümünü ekleyin.
- Parçacık Özellikleri alt düğümünü kullanarak hem MCF-7 hem de MCF-10A hücreleri için Partikül Özellikleri'ni ayarlayın. Global Definition (Genel Tanım) bölümünün altındaki parametrelerden partikül özelliklerini seçin.
- Dielektroforetik kuvveti her iki hücre türüne de atamak için Sürükleme Kuvveti alt düğümünü ekleyin.
- Bu durumda parametre bölümünden Parçacık Özellikleri ekleyin. Memeli hücrelerini modellemek için Shell alt düğümünü ekleyin.
- Giriş sekmesinden Mesh Ekle'yi ve ardından İnce Mesh'i seçin. Bir ağ oluşturmak için giriş sekmesinden Mesh Oluştur'u seçin.
- Ana sayfa sekmesinden, üç etüt adımı eklemek için Etüt Ekle'ye tıklayın. Çalışma Adım 1 , bir frekans tepkisini simüle etmek içindir; bir Frekans Etki Alanı alt düğümü kullanın.
- Sürünen akışı simüle etmek için bir Sabit Etüt düğümü seçin. Dielektroforetik kuvvetle ve dielektroforetik kuvvet olmadan koşulları simüle etmek için zamana bağlı iki adım ekleyin.
- Dielektroforetik olmayan koşul için Fizik ve Değişken Seçimi'ni seçin, etüt adımı için Model Yapılandırmasını Değiştir başlıklı kutuyu işaretleyin ve Dielektroforetik Adım'ı devre dışı bırakın. Dielektroforetik koşullar için devre dışı bırakmayın. Dosyayı kaydedin ve simülasyonun çalışması için Hesaplama'ya basın.
NOT: Metastatik olmayan meme kanseri hücrelerinin (MCF-7) ve tümör dışı meme epitel hücrelerinin (MCF-10A) sıralanması için tasarlanan mikroakışkan çip, Ek Şekil 1 ve Ek Şekil 2'de gösterildiği gibi, sırasıyla 20 μm ve 40 μm genişliklerde hücre karışımı akışı ve hidrodinamik akış odaklama için iki ayrı girişe sahiptir. - Frekans Alanı alt düğümü altında frekans (f0) ve Elektrik Potansiyeli alt düğümünü kullanarak sıralama odasının üst yan duvarı boyunca yerleştirilen planya elektrotlarına (295 μm genişliğinde) voltaj atayın. Çıkışta, sıralanmış parçacıkları görselleştirmek için "donma" duvar koşulunu kullanın.
2. Matematiksel model ve hesaplamalı analiz
- Bir hesaplamalı akışkan dinamiği (CFD) çalışması ayarlayarak mikroakışkan cihaz içindeki metastatik olmayan meme kanseri hücrelerini ve tümör olmayan meme epitel hücrelerini ayırmak için çalışma parametrelerini doğrulayın.
NOT: Bu amaçla Multifizik yazılımı (AC/DC, Microfluidics ve Particle Tracking modülleri) kullanılmıştır. Yönetim denklemleri ve teorik arka plan Ek Dosya 1'de ayrıntılı olarak verilmiştir. Model, Tablo 1'de özetlenen literatür 31,32'de bildirilen metastatik olmayan meme kanseri hücrelerinin (MCF7) ve tümör dışı meme epitel hücrelerinin (MCF-10A) dielektrik özellikleri kullanılarak test edilmiştir. - Metastatik olmayan meme kanseri (MCF7) ve tümör dışı meme epiteli (MCF-10A) hücre hatlarını hücre karışımı girişinde 1: 1 oranında tanıtarak CFD simülasyonlarını gerçekleştirin.
- Başlangıçta, simülasyonlar33 için ağ boyutunu optimize etmek üzere bir ağ bağımsızlığı etüdü gerçekleştirin.
NOT: Çalışma parametreleri için en iyi çözümü bulmak amacıyla bir ağ bağımsızlığı çalışması yapılmıştır. Çözümün yakınsaması için mümkün olan en iyi eleman boyutunu ölçmek üzere beş farklı örgü boyutundan oluşan bir set seçildi. Ek Şekil 3A'da gösterildiği gibi, bir ağı tanımlayan toplam eleman sayısı 635 (daha kaba ağ) olduğunda, sıralama verimliliğinin en düşük seviyede olduğu, MCF7 hücrelerinin bir kısmının Ek Şekil 3B'de gösterildiği gibi alt çıkışa hareket ettiği gözlenmiştir. Örgü boyutu ince olacak şekilde artırıldığında, ağı tanımlayan elemanların sayısı da 2.288'e yükseldi. Bu durumda ayıklama verimliliği maksimumdaydı, hem MCF7 hem de MCF-10A hücreleri kendi çıkışlarına doğru hareket ediyordu. Daha ince ağ da simüle edildi ve ağı tanımlayan elemanların sayısı 3.188'e yükseldi. Ayıklama verimliliği bu noktadan sonra da etkilenmedi. Bu nedenle, ince ağ boyutunun bizim durumumuzda en iyi şekilde çalıştığını güvenle söyleyebiliriz. - İki CFD etüdü setini çözün.
- İlk set için, Etüt 1'e sağ tıklayın ve Parametrik Süpürme alt düğümünü ekleyin. Süpürme değişkeni olarak akışkan ortam iletkenliği "σm" eklemek için + işaretine basın. Akışkan ortam iletkenliği σ için 0,01 S/m ile 2,5 S/m arasında değişen parametrik bir süpürme etüdü gerçekleştirin ve uygulanan frekansı, f (Hz)'yi 800 kHz değerinde sabit tutun.
- İkinci set için, uygulanan AC frekansını 100 kHz'den 100 MHz'e değiştirerek bir Parametrik Süpürme çalışması yürütün ve akışkan ortamın iletkenliğini, σ m, her durum için 0,4 S /m'de sabit tutun. Bu σm değeri, ilk CFD çalışmasının sonuçlarına dayanarak seçilmiştir, çünkü bu değerde MCF-7 ve MCF-10A arasında maksimum bir ayrım gözlenmiştir.
- İletken bir ortamda dielektrik küresel bir parçacık üzerinde uygulanan dielektroforez (DEP) kuvvetinin, FDEP'nin (-) kuvveti, Denklem 1T34 tarafından verilir:
FDEP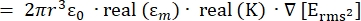 [1]
[1]
Dielektroforetik kuvvet alt düğümü altında Denklem 1'i kullanın. Denklem 1'de r, F DEP'nin uygulandığı parçacığınyarıçapınıgösterir; K (-) Clausius-Mossotti faktörü olarak bilinir; εm(-) ortamın dielektrik geçirgenliğini gösterir; ve E (V / m), elektrik alanının kök ortalama kare değeridir. - Dielektroforetik kuvvet alt düğümü altındaki küresel bir parçacık için Denklem 2'yi kullanın.
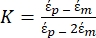 [2]
[2]
Denklem 2'de,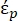 (-) DEP kuvvetinin uygulandığı parçacığın karmaşık geçirgenliğini gösterir;
(-) DEP kuvvetinin uygulandığı parçacığın karmaşık geçirgenliğini gösterir; 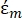 (-) parçacığı çevreleyen sıvının karmaşık geçirgenliğini gösterir. Karmaşık geçirgenlik
(-) parçacığı çevreleyen sıvının karmaşık geçirgenliğini gösterir. Karmaşık geçirgenlik 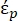 ve
ve 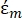 35 aşağıdaki gibi tanımlanmıştır:
35 aşağıdaki gibi tanımlanmıştır: - Dielektroforetik kuvvet alt düğümü altındaki küresel bir parçacık için Denklem 3'ü kullanın:
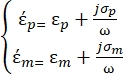 [3]
[3]
Denklem 3'te,p (-) ε, parçacığın karmaşık geçirgenliğinin gerçek kısmını gösterir; εm (-), parçacığı çevreleyen sıvının karmaşık geçirgenliğinin gerçek kısmını gösterir; σp (S/m) parçacık iletkenliğini gösterir; σ m (S /m ), parçacığı çevreleyen ortamın iletkenliğini gösterir; ve ω (Hz), uygulanan elektrik alanının frekansıdır.
NOT: Re(K) işareti, FDEP'nin polaritesini belirler. Eğer Re(K) işareti negatifse, parçacık negatif bir dielektroforetik kuvvet (nDEP) yaşar; Bunun aksine, Re(K) işareti pozitifse, pozitif bir dielektroforetik kuvvet (pDEP) anlamına gelir. Clausius-Mossotti faktörü (K) için, varyasyon -1 ila 1 aralığındadır.
- Başlangıçta, simülasyonlar33 için ağ boyutunu optimize etmek üzere bir ağ bağımsızlığı etüdü gerçekleştirin.
- Daha karmaşık ve çok katmanlı bir yapıya sahip olan memeli hücreleri gibi biyolojik hücreleri modellemek için Denklem 3'ün değiştirilmiş bir formunu kullanın.
K (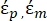 ) =
) = 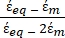 [4]
[4]
Denklem 4'te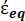 (-) hem sitoplazmanın karmaşık geçirgenliğini,
(-) hem sitoplazmanın karmaşık geçirgenliğini, 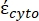 (-) hem de hücre zarının
(-) hem de hücre zarının 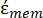 karmaşık geçirgenliğini (-) içerir ve aşağıdaki gibi verilir:36
karmaşık geçirgenliğini (-) içerir ve aşağıdaki gibi verilir:36 - "
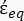 " çözmek için Denklem 5'i kullanın:
" çözmek için Denklem 5'i kullanın: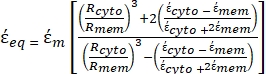 [5]
[5]
Denklem 5'te, R sitosu (m) ve Rmem (m) sırasıyla hücre sitoplazmasının ve hücre zarının yarıçapını gösterir. - Ardından, hem kanser hem de sağlıklı hücreler için uygulanan elektrik alanının bir fonksiyonu olarak Re(K)'yi çizmek için Denklem 4'ü kullanın. Parçacığın deneyimlediği dielektroforetik kuvveti (DEP) ölçmek için Clausius-Mossotti (CM) faktörünün gerçek kısmı olan Re (K) 'yi hesaplayın.
- Sonuçlar düğümüne sağ tıklayın, Parçacık Değerlendirme alt düğümünü ekleyin ve parçacık 1 için CM faktörünü çizmek üzere ifade bölümüne fpt.deff1.K ve parçacık 2 için fpt.deff2.K yazın.
NOT: Ana metinde listelenen tüm protokol adımları protokol videosunda görüntülenebilir (Video 1).
Access restricted. Please log in or start a trial to view this content.
Sonuçlar
Metastatik olmayan meme kanseri (MCF-7) ve tümör dışı meme epitelyal (MCF-10A) hücrelerinin DEP tabanlı etkili bir şekilde sıralanması için optimal operasyonel parametrelerin araştırılması
Dielektroforez sırasında metastatik olmayan meme kanseri (MCF-7) ve tümör dışı meme epitelyal (MCF-10A) hücrelerinin dielektroforez sırasında farklı dielektrik özelliklere sahip başarılı bir şekilde ayrılmasını sağlamak için, uygulanan frekans37,38
Access restricted. Please log in or start a trial to view this content.
Tartışmalar
Mikroakışkan cihazlar daha önce hücre kültürü, yakalama ve sıralama 47,52,53 için bildirilmiştir. Bu cihazların temiz odada üretilmesi pahalı bir işlemdir ve CFD simülasyonları yoluyla önerilen bir mikroakışkan cihazın çıktısını ve verimliliğini ölçmek zorunludur. Bu çalışma, metastatik olmayan meme kanseri hücrelerinin (MCF-7) ve tümör dışı meme epitel hücrelerinin (MCF-10A) dielektrik öze...
Access restricted. Please log in or start a trial to view this content.
Açıklamalar
Yazarlar potansiyel çıkar çatışması olmadığını beyan ederler.
Teşekkürler
Bu çalışma Pakistan Yüksek Öğretim Komisyonu tarafından desteklenmiştir.
Access restricted. Please log in or start a trial to view this content.
Malzemeler
| Name | Company | Catalog Number | Comments |
| COMSOL | COMSOL | multiphysics simulation software |
Referanslar
- Liang, L., et al. Microfluidic-based cancer cell separation using active and passive mechanisms. Microfluidics and Nanofluidics. 24 (4), 26(2020).
- Damiati, S., Kompella, U. B., Damiati, S. A., Kodzius, R. Microfluidic devices for drug delivery systems and drug screening. Genes. 9 (2), 103(2018).
- Pashayan, N., et al. Personalized early detection and prevention of breast cancer: ENVISION consensus statement. Nature Reviews Clinical Oncology. 17 (11), 687-705 (2020).
- Panesar, S., Neethirajan, S. Microfluidics: Rapid diagnosis for breast cancer. Nano-micro Letters. 8 (3), 204-220 (2016).
- Chen, J., Li, J., Sun, Y. Microfluidic approaches for cancer cell detection, characterization and separation. Lab on a Chip. 12 (10), 1753-1767 (2012).
- Beech, J. P., Holm, S. H., Adolfsson, K., Tegenfeldt, J. O. Sorting cells by size, shape and deformability. Lab on a Chip. 12 (6), 1048-1051 (2012).
- Kang, Y., Li, D. Electrokinetic motion of particles and cells in microchannels. Microfluidics and Nanofluidics. 6 (4), 431-460 (2009).
- Schmid, L., Weitz, D. A., Franke, T. Acoustic microfluidic fluorescence-activated cell sorter. Lab on a Chip. 14 (19), 3710-3718 (2014).
- Yu, B. Y., Elbuken, C., Shen, C., Huissoon, J. P., Ren, C. L. An integrated microfluidic device for the sorting of yeast cells using image processing. Scientific Reports. 8, 3550(2014).
- Asiaei, S., Darvishi, V., Davari, M. H., Zohrevandi, D., Moghadasi, H. Thermophoretic isolation of circulating tumor cells, numerical simulation and design of a microfluidic chip. Journal of Thermal Analysis and Calorimetry. 137 (3), 831-839 (2019).
- Song, Y., Li, M., Pan, X., Wang, Q., Li, D. Size-based cell sorting with a resistive pulse sensor and an electromagnetic pump in a microfluidic chip. Electrophoresis. 36 (3), 398-404 (2014).
- Giraud, G., et al. Dielectrophoretic manipulation of ribosomal RNA. Biomicrofluidics. 5 (2), 024116(2011).
- Valero, A., Braschler, T., Demierre, N., Renaud, P. A miniaturized continuous dielectrophoretic cell sorter and its applications. Biomicrofluidics. 4 (2), 022807(2010).
- Allahrabbi, N., Chia, Y. S. M., Saifullah, M. S. M., Lim, K. M., Lanry Yung, L. Y. A hybrid dielectrophoretic system for trapping of microorganisms from water. Biomicrofluidics. 9 (3), 034110(2015).
- Vykoukal, D. M., Gascoyne, P. R. C., Vykoukal, J. Dielectric characterization of complete mononuclear and polymorphonuclear blood cell subpopulations for label-free discrimination. Integrative Biology: Quantitative Biosciences from Nano to Macro. 1 (7), 477-484 (2009).
- Shim, S., et al. Antibody-independent isolation of circulating tumor cells by continuous-flow dielectrophoresis. Biomicrofluidics. 7 (1), 11807(2013).
- Jeon, H. J., Lee, H., Yoon, D. S., Kim, B. M. Dielectrophoretic force measurement of red blood cells exposed to oxidative stress using optical tweezers and a microfluidic chip. Biomedical Engineering Letters. 7 (4), 317-323 (2017).
- Song, H., et al. Continuous-flow sorting of stem cells and differentiation products based on dielectrophoresis. Lab on a Chip. 15 (5), 1320-1328 (2015).
- Tsai, S. L., Chiang, Y., Wang, M. H., Chen, M. K., Jang, L. S. Battery-powered portable instrument system for single-cell trapping, impedance measurements, and modeling analyses. Electrophoresis. 35 (16), 2392-2400 (2014).
- Chan, J. Y., et al. Dielectrophoresis-based microfluidic platforms for cancer diagnostics. Biomicrofluidics. 12 (1), 011503(2018).
- Patel, S., et al. Microfluidic separation of live and dead yeast cells using reservoir-based dielectrophoresis. Biomicrofluidics. 6 (3), 34102(2012).
- Yildizhan, Y., Erdem, N., Islam, M., Martinez-Duarte, R., Elitas, M. Dielectrophoretic separation of live and dead monocytes using 3D carbon-electrodes. Sensors. 17 (11), 2691-2704 (2017).
- Piacentini, N., Mernier, G., Tornay, R., Renaud, P. Separation of platelets from other blood cells in continuous-flow by dielectrophoresis field-flow-fractionation. Biomicrofluidics. 5 (3), 34122(2011).
- Zhao, K., Duncker, B. P., Li, D. Continuous cell characterization and separation by microfluidic alternating current dielectrophoresis. Analytical Chemistry. 91 (9), 6304-6314 (2019).
- Valero, A., et al. Tracking and synchronization of the yeast cell cycle using dielectrophoretic opacity. Lab on a Chip. 11 (10), 1754-1760 (2011).
- Demierre, N., Braschler, T., Muller, R., Renaud, P. Focusing and continuous separation Of cells in a microfluidic device using lateral dielectrophoresis. International Solid-State Sensors, Actuators and Microsystems Conference. 430 (98), 1777-1780 (2007).
- Arslan, Z. C., Yalçın, Y. D., Külah, H. Label-free enrichment of MCF7 breast cancer cells from leukocytes using continuous flow dielectrophoresis. Electrophoresis. 43 (13-14), 1531-1544 (2022).
- Turcan, I., Olariu, M. A. Dielectrophoretic manipulation of cancer cells and their electrical characterization. ACS Combinatorial Science. 22 (11), 554-578 (2020).
- Park, J., et al. Sequential cell-processing system by integrating hydrodynamic purification and dielectrophoretic trapping for analyses of suspended cancer cells. Micromachines. 11 (1), 47(2020).
- Hussein, M., et al. Breast cancer cells exhibits specific dielectric signature in vitro using the open-ended coaxial probe technique from 200 MHz to 13.6 GHz. Scientific Reports. 9, 4681(2019).
- Fornes-Leal, A., Garcia-Pardo, C., Frasson, M., Pons Beltrán, V., Cardona, N. Dielectric characterization of healthy and malignant colon tissues in the 0.5-18 GHz frequency band. Physics in Medicine and Biology. 61 (20), 7334-7346 (2016).
- Çetin, B., Li, D. Dielectrophoresis in microfluidics technology. Electrophoresis. 32 (18), 2410-2427 (2011).
- Khan, S., Khulief, Y. A., Al-Shuhail, A. A. Effects of reservoir size and boundary conditions on pore-pressure buildup and fault reactivation during CO2 injection in deep geological reservoirs. Environmental Earth Sciences. 79, 294(2020).
- Adams, T. N. G., Turner, P. A., Janorkar, A. V., Zhao, F., Minerick, A. R. Characterizing the dielectric properties of human mesenchymal stem cellsand the effects of charged elastin-like polypeptide copolymer treatment. Biomicrofluidics. 8 (5), 054109(2014).
- Lo, Y. J., et al. Measurement of the Clausius-Mossotti factor of generalized dielectrophoresis. Applied Physics Letters. 104, 083701(2014).
- Lo, Y. J., Lei, U. Measurement of the real part of the Clausius-Mossotti factor of dielectrophoresis for Brownian particles. Electrophoresis. 41 (1), 137-147 (2020).
- Ohta, A. T., et al. Optically controlled cell discrimination and trapping using optoelectronic Tweezers. IEEE Journal of Selected Topics in Quantum Electronics. 13 (2), 235-242 (2007).
- Sun, T., Morgan, H. Single-cell microfluidic Impedance cytometry. Microfluidics and Nanofluidics. 8 (4), 423-443 (2010).
- Weng, P. Y., et al. Size-dependent dielectrophoretic cross-over frequency of spherical particles. Biomicrofluidics. 10 (1), 1909-1921 (2016).
- Lu, Y. W., Sun, C., Kao, Y. C., Hung, C. L., Juang, J. Y. Dielectrophoretic cross-over frequency of single particles: Quantifying the effect of surface functional groups and electrohydrodynamic flow drag force. Nanomaterials. 10 (7), 1364(2020).
- Henslee, E. A., Sano, M. B., Rojas, A. D., Schmelz, E. M., Davalos, R. V. Selective concentration of human cancer cells using contactless dielectrophoresis. Electrophoresis. 32 (18), 2523-2529 (2011).
- Chan, J. Y., et al. Dielectrophoresis-based microfluidic platforms for cancer diagnostics. Biomicrofluidics. 12 (1), 11503-11525 (2018).
- Gascoyne, P. R. C., Shim, S. Isolation of circulating tumor cells by dielectrophoresis. Cancers. 6 (1), 545-579 (2014).
- Liang, W., et al. Determination of dielectric properties of cells using ac electrokinetic-based microfluidic platform. Micromachines. 11 (5), 513-537 (2020).
- Frusawa, H., et al. Frequency-modulated wave dielectrophoresis of vesicles and cells periodic U-turns at the crossover frequency. Nanoscale Research Letters. 13 (169), 2583-2589 (2018).
- Wei, M. T., Junio, J., Ou-Yang, D. H. Direct measurements of the frequency-dependent dielectrophoresis force. Biomicrofluidics. 3 (1), 12003(2009).
- Mustafa, A., Pedone, E., Marucci, L., Moschou, D., Lorenzo, M. D. A flow-through microfluidic chip for continuous dielectrophoretic separation of viable and non-viable human T-cells. Electrophoresis. 43 (3), 501-508 (2021).
- Wang, L., et al. Dual frequency dielectrophoresis with interdigitated sidewall electrodes for microfluidic flow-through separation of beads and cells. Electrophoresis. 30 (5), 782-791 (2021).
- Alazzam, A., Mathew, B., Alhammadi, F. Novel microfluidic device for the continuous separation of cancer cells using dielectrophoresis. Journal of Separation Science. 40 (5), 1193-1200 (2017).
- Yang, L., Banada, P. P., Bhunia, A. K., Bashir, R. Effects of dielectrophoresis on growth viability and immuno-reactivity of listeria monocytogenes. Journal of Biological Engineering. 2, 6(2008).
- Matbaechi, H., Soltani, P., Hölzel, R., Wenger, C. Dielectrophoretic immobilization of yeast cells using CMOS integrated microfluidics. Micromachines. 11 (5), 501-518 (2020).
- Mustafa, A., Pedone, E., La Regina, A., Erten, A. A., Marucci, L. Development of a single layer microfluidic device for dynamic stimulation, culture and imaging of mammalian cells. bioRxiv. , (2022).
- Mustafa, A., et al. Enhanced dissolution of liquid microdroplets in the extensional creeping flow of a hydrodynamic trap. Langmuir. 32 (37), 9460-9467 (2016).
- Chang, H. F., Chou, S. E., Cheng, J. Y. Electric-field-induced neural precursor cell differentiation in microfluidic devices. Journal of Visualized Experiments. (170), e61917(2021).
Access restricted. Please log in or start a trial to view this content.
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiDaha Fazla Makale Keşfet
This article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır