Un abonnement à JoVE est nécessaire pour voir ce contenu. Connectez-vous ou commencez votre essai gratuit.
Method Article
Dispositif microfluidique pour la séparation de cellules cancéreuses du sein non métastatiques (MCF-7) et non tumorales (MCF-10A) par diélectrophorèse AC
Dans cet article
Résumé
Les cellules cancéreuses du sein présentent des propriétés diélectriques différentes de celles des cellules épithéliales mammaires non tumorales. On a émis l’hypothèse que, sur la base de cette différence de propriétés diélectriques, les deux populations peuvent être séparées à des fins d’immunothérapie. Pour ce faire, nous modélisons un dispositif microfluidique pour trier les cellules MCF-7 et MCF-10A.
Résumé
Les dispositifs diélectrophorétiques sont capables de détecter et de manipuler des cellules cancéreuses d’une manière non étiquetée, rentable, robuste et précise en utilisant le principe de la polarisation des cellules cancéreuses dans le volume de l’échantillon en appliquant un champ électrique externe. Cet article démontre comment une plateforme microfluidique peut être utilisée pour le tri continu à haut débit des cellules cancéreuses du sein non métastatiques (MCF-7) et des cellules épithéliales mammaires non tumorales (MCF-10A) à l’aide de la diélectrophorèse hydrodynamique (HDEP) du mélange cellulaire. En générant un champ électrique entre deux électrodes placées côte à côte avec un espace de la taille d’un micron entre elles dans une puce microfluidique HDEP, les cellules épithéliales mammaires non tumorales (MCF-10A) peuvent être repoussées, présentant une DEP négative à l’intérieur du canal principal, tandis que les cellules cancéreuses du sein non métastatiques suivent leur cours sans être affectées lorsqu’elles sont suspendues dans le milieu cellulaire en raison de leur conductivité supérieure à la conductivité membranaire. Pour démontrer ce concept, des simulations ont été effectuées pour différentes valeurs de conductivité du milieu, et le tri des cellules a été étudié. Une étude paramétrique a été réalisée et une conductivité appropriée du mélange cellulaire s’est avérée être de 0,4 S/m. En maintenant la conductivité du milieu fixe, une fréquence AC adéquate de 0,8 MHz a été établie, donnant une efficacité de tri maximale, en faisant varier la fréquence du champ électrique. En utilisant la méthode démontrée, après avoir choisi la conductivité appropriée du milieu de suspension du mélange cellulaire et la fréquence du courant alternatif appliqué, une efficacité de tri maximale peut être atteinte.
Introduction
Une tumeur maligne qui se développe dans et autour du tissu mammaire est une cause fréquente de cancer du sein chez les femmes du monde entier, causant un problème de santé critique1. Les tumeurs du sein avant les métastases peuvent être traitées par chirurgie si elles sont détectées à un stade précoce, mais si elles sont ignorées, elles peuvent avoir de graves implications sur la vie du patient en se propageant à leurs poumons, à leur cerveau et à leurs os. Les traitements proposés à des stades ultérieurs, tels que la radiothérapie et les thérapies chimiques, ont des effets secondaires graves2. Des études récentes ont rapporté qu’un diagnostic précoce de cancer du sein réduit le taux de mortalité de 60 %3. Par conséquent, il est impératif de travailler à des méthodes de détection précoce personnalisées. À cette fin, des chercheurs travaillant dans différents domaines de la science et de la technologie ont utilisé la microfluidique pour développer des dispositifs de diagnostic précoce du cancer du sein4. Ces méthodes comprennent la microchromatographie d’affinité cellulaire, les trieurs de microcellules activés magnétiquement, la capture et la séparation des cellules cancéreuses basées sur la taille et la diélectrophorèse sur puce (DEP)5,6. Ces techniques microfluidiques rapportées dans la littérature permettent une manipulation cellulaire précise, un suivi en temps réel et le tri d’échantillons bien définis, qui servent d’étape intermédiaire dans de nombreuses applications diagnostiques et thérapeutiques5. L’intégration de ces mécanismes de tri avec la microfluidique offre une manipulation flexible et fiable des cellules cibles 7,8,9,10. L’un des principaux avantages d’une telle intégration est la possibilité de travailler avec des échantillons de fluide dans des volumes nano à microlitres et de pouvoir manipuler les propriétés électriques du fluide de l’échantillon. En ajustant la conductivité du fluide en suspension à l’intérieur des dispositifs microfluidiques, les cellules biologiques peuvent être triées en fonction de leurs tailles et des différences de leurs propriétés diélectriques11,12.
Parmi ces techniques, la DEP sur puce est souvent préférée car il s’agit d’une technique de tri cellulaire sans marquage qui exploite les propriétés électriques des échantillons biologiques. Il a été rapporté que la DEP manipulait des échantillons biologiques tels que l’ADN 13, l’ARN 14, les protéines15, les bactéries 16, les cellules sanguines 17, les cellules tumorales circulantes (CTC)18 et les cellules souches 19. Les dispositifs microfluidiques qui utilisent le DEP pour trier les échantillons biologiques ont été largement rapportés dans la littérature20. Des dispositifs microfluidiques DEP (rDEP) à base de réservoir pour le tri des cellules de levure viables et non viables ont été signalés qui protègent les cellules contre les effets néfastes des réactions électrochimiques21,22. Piacentini et coll. ont signalé un trieur de cellules microfluidiques crénelées qui séparait les globules rouges des plaquettes avec une efficacité de 97 %23. Des dispositifs DEP sur puce avec orifices asymétriques et électrodes intégrées ont également été signalés pour trier les cellules viables et non viables24. Valero et Demierre et al. ont modifié le trieur de cellules microfluidiques crénelées en introduisant deux réseaux de microélectrodes des deux côtés du canal25,26. Cela a aidé à concentrer les cellules au centre du canal. Zeynep et al. ont présenté un dispositif microfluidique à base de DEP pour séparer et concentrer les cellules cancéreuses du sein MCF7 des leucocytes27. Ils ont rapporté une efficacité d’extraction des cellules MCF7 des leucocytes entre 74% et 98% avec une fréquence de 1 MHz et une tension appliquée allant de 10 à 12 Vpp. Le tableau supplémentaire 1 présente une comparaison qualitative et quantitative entre les dispositifs de tri microfluidique basés sur DEP en fonction de leur conception, de la configuration des électrodes et des paramètres de fonctionnement (fréquence et tension appliquées).
Plus récemment, des chercheurs ont tenté de mesurer les différences dans le comportement diélectrique des cellules épithéliales du sein (MCF-10A) et des cellules cancéreuses du sein non métastatiques (MCF-7) à l’intérieur d’une puce microfluidique28,29. Jithin et coll. ont également caractérisé les réponses diélectriques de différentes lignées cellulaires cancéreuses à l’aide d’une technique de sonde coaxiale ouverte avec des fréquences comprises entre 200 MHz et 13,6 GHz30. Ces différences dans les réponses diélectriques des lignées cellulaires MCF-7 et MCF-10A peuvent être exploitées pour les séparer en cours d’exécution et peuvent conduire au développement de dispositifs de diagnostic personnalisés à un stade précoce.
Dans cet article, nous simulons le tri contrôlé des cellules cancéreuses du sein non métastatiques (MCF-7) et des cellules épithéliales mammaires non tumorales (MCF-10A) à l’aide de la diélectrophorèse AC. La région de changement dans le champ électrique influence le tri à l’intérieur de la puce microfluidique. La technique proposée est facile à mettre en œuvre et permet l’intégration de la technique de tri dans diverses configurations de puces microfluidiques. Des simulations de dynamique des fluides numérique (CFD) ont été réalisées pour étudier la séparation des cellules cancéreuses du sein non métastatiques et des cellules épithéliales mammaires non tumorales en faisant varier la conductivité du milieu fluide dans lequel les cellules étaient suspendues. Dans ces simulations, il est démontré qu’en maintenant la conductivité constante et en modifiant la fréquence appliquée, la séparation des cellules cancéreuses et des cellules saines peut être contrôlée.
Access restricted. Please log in or start a trial to view this content.
Protocole
REMARQUE: Le protocole utilise COMSOL, un logiciel de simulation multiphysique, pour simuler le tri contrôlé des cellules cancéreuses du sein non métastatiques (MCF-7) et des cellules épithéliales du sein non tumorales (MCF-10A) à l’aide de la diélectrophorèse AC.
1. Conception de la puce et sélection des paramètres
- Ouvrez le logiciel multiphysique et sélectionnez Modèle vierge. Cliquez avec le bouton droit sur les définitions globales et sélectionnez Paramètres. Importez les paramètres indiqués dans le tableau 1 dans les définitions globales sous forme de fichier texte ou entrez les valeurs individuellement.
- Sélectionnez Ajouter un composant dans l’onglet Accueil et ajoutez un composant 2D. Cliquez avec le bouton droit sur la géométrie et importez le fichier de modèle en double-cliquant sur le fichier.
- Choisissez un matériau vierge et utilisez les propriétés du matériau du tableau 1.
- Sélectionnez Ajouter une physique dans l’onglet d’accueil et tapez AC/DC. Sous le nœud AC/DC, choisissez Courants électriques comme Physique sous le sous-nœud des champs et courants électriques.
- Cliquez avec le bouton droit de la souris sur le courant électrique et choisissez les sous-nœuds Conservation du courant, Isoler et Potentiel électrique pour isoler les parois du canal afin d’attribuer un potentiel aux électrodes.
- Sélectionnez Ajouter de la physique dans l’onglet d’accueil, puis sous le nœud Flux de fluide , choisissez Physique de l’écoulement rampant sous le sous-nœud Flux monophasé. Cliquez avec le bouton droit sur Flux monophasé et affichez les limites de la puce sous forme de murs à l’aide du sous-nœud Mur .
- Faites un clic droit sur Single-Phase Flow et ajoutez deux sous-nœuds d’entrée et un sous-nœud de sortie.
- Affectez les entrées à l’aide du sous-nœud d’entrée et utilisez normal dans Vitesse d’écoulement comme condition aux limites. Attribuez la prise à l’aide du sous-nœud de sortie.
- Sélectionnez Ajouter une physique dans l’onglet d’accueil, puis sous le nœud Flux de fluide , choisissez Particle Tracing Flow Physics sous le sous-nœud de Particle Tracing.
- Cliquez avec le bouton droit sur le nœud de traçage des particules et ajoutez le mur des sous-nœuds, les sous-nœuds de propriété de deux particules, deux sous-nœuds d’entrée, un sous-nœud de sortie, deux sous-nœuds de force de diélectrophorèse et un sous-nœud de force de glissement.
- Définissez les propriétés des particules pour les cellules MCF-7 et MCF-10A à l’aide du sous-nœud Propriétés des particules. Choisissez les propriétés des particules dans les paramètres de la section Définition globale.
- Ajoutez le sous-nœud Drag Force pour affecter la force diélectrophorétique aux deux types de cellules.
- Ajoutez les propriétés des particules dans ce cas à partir de la section des paramètres. Ajoutez le sous-nœud Shell pour modéliser les cellules de mammifères.
- Dans l’onglet d’accueil, choisissez Ajouter un maillage et sélectionnez Maillage fin. Choisissez Construire un maillage dans l’onglet Accueil pour créer un maillage.
- Dans l’onglet d’accueil, cliquez sur Ajouter une étude pour ajouter trois étapes d’étude. L’étape 1 de l’étude consiste à simuler une réponse en fréquence; utiliser un sous-nœud du domaine fréquentiel .
- Pour simuler un écoulement rampant, choisissez un nœud d’étude stationnaire . Ajouter deux étapes dépendantes du temps pour simuler des conditions avec une force diélectrophorétique et sans force diélectrophorétique.
- Pour la condition non diélectrophorétique, choisissez Physique et sélection des variables, cochez la case intitulée Modifier la configuration du modèle pour l’étape d’étude et désactivez l’étape diélectrophorétique. Pour les conditions diélectrophorétiques, ne pas désactiver. Enregistrez le fichier et appuyez sur Calculer pour que la simulation s’exécute.
REMARQUE : La puce microfluidique conçue pour le tri des cellules cancéreuses du sein non métastatiques (MCF-7) et des cellules épithéliales mammaires non tumorales (MCF-10A) comporte deux entrées distinctes pour l’écoulement du mélange cellulaire et pour la focalisation du flux hydrodynamique, respectivement, avec des largeurs de 20 μm et 40 μm, respectivement, comme le montrent la figure supplémentaire 1 et la figure supplémentaire 2. - Attribuer la fréquence (f0) sous le sous-nœud du domaine fréquentiel et la tension à l’aide du sous-nœud de potentiel électrique aux électrodes de rabotage (295 μm de largeur) placées le long de la paroi latérale supérieure de la chambre de tri. À la sortie, utilisez la condition de paroi « gel » pour visualiser les particules triées.
2. Modèle mathématique et analyse informatique
- Vérifiez les paramètres de fonctionnement pour séparer les cellules cancéreuses du sein non métastatiques et les cellules épithéliales mammaires non tumorales à l’intérieur du dispositif microfluidique en mettant en place une étude de dynamique des fluides numérique (CFD).
REMARQUE : Un logiciel multiphysique (modules AC/DC, microfluidique et suivi des particules) a été utilisé à cette fin. Les équations directrices et le contexte théorique sont donnés en détail dans le dossier supplémentaire 1. Le modèle a été testé en utilisant les propriétés diélectriques des cellules cancéreuses du sein non métastatiques (MCF7) et des cellules épithéliales mammaires non tumorales (MCF-10A) rapportées dans la littérature31,32, qui sont résumées dans le tableau 1. - Effectuez les simulations CFD en introduisant des lignées cellulaires de cancer du sein non métastatique (MCF7) et d’épithélium mammaire non tumoral (MCF-10A) avec un rapport de 1:1 à l’entrée du mélange cellulaire.
- Dans un premier temps, réaliser une étude d’indépendance du maillage afin d’optimiser la taille du maillage pour les simulations33.
REMARQUE: Une étude d’indépendance du maillage a été réalisée pour trouver la meilleure solution pour les paramètres de fonctionnement. Un ensemble de cinq tailles de mailles différentes a été choisi pour quantifier la meilleure taille d’élément possible pour la convergence de la solution. Il a été observé que, lorsque le nombre total d’éléments définissant un maillage était de 635 (maille plus grossière), comme le montre la figure supplémentaire 3A, l’efficacité de tri était la plus faible, certaines des cellules MCF7 se déplaçant vers la sortie inférieure, comme le montre la figure supplémentaire 3B. Lorsque la taille du maillage a été augmentée à fine, le nombre d’éléments définissant le maillage a également augmenté à 2 288. L’efficacité de tri était à son maximum dans ce cas, les cellules MCF7 et MCF-10A se déplaçant vers leurs sorties respectives. Le maillage plus fin a également été simulé, le nombre d’éléments définissant le maillage passant à 3 188. L’efficacité du tri n’a pas été affectée au-delà de ce point. Par conséquent, nous pouvons dire en toute sécurité que la taille des mailles fines fonctionne le mieux dans notre cas. - Résolvez deux séries d’études CFD.
- Pour le premier ensemble, cliquez avec le bouton droit de la souris sur l’étude 1 et ajoutez le sous-nœud Parametric Sweep . Appuyez sur le signe + pour ajouter la conductivité du milieu fluide « σm » comme variable de balayage. Effectuer une étude de balayage paramétrique pour la conductivité du milieu fluide σm allant de 0,01 S/m à 2,5 S/m, en maintenant la fréquence appliquée, f (Hz), constante à une valeur de 800 kHz.
- Pour la deuxième série, effectuer une étude de balayage paramétrique en faisant varier la fréquence AC appliquée de 100 kHz à 100 MHz tout en maintenant la conductivité du milieu fluide, σ m, fixée à 0,4 S/m pour chaque cas. Cette valeur de σm a été choisie sur la base des résultats de la première étude CFD, car une séparation maximale entre MCF-7 et MCF-10A a été observée à cette valeur.
- La force de la force de diélectrophorèse (DEP), FDEP (-), exercée sur une particule sphérique diélectrique en milieu conducteur est donnée par l’équation 1T34:
FDEP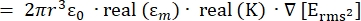 [1]
[1]
Utilisez l’équation 1 sous le sous-nœud de force diélectrophorétique. Dans l’équation 1, r montre le rayon de la particule sur laquelle FDEPest appliqué; K (-) est connu sous le nom de facteur de Clausius-Mossotti; εm(-) montre la permittivité diélectrique du milieu; et E(V/m) est la valeur quadratique moyenne du champ électrique. - Utilisez l’équation 2 pour une particule sphérique sous le sous-nœud de force diélectrophorétique.
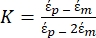 [2]
[2]
Dans l’équation 2,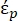 (-) montre la permittivité complexe de la particule sur laquelle la force DEP est appliquée;
(-) montre la permittivité complexe de la particule sur laquelle la force DEP est appliquée; 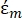 (-) montre la permittivité complexe du fluide entourant la particule. La permittivité
(-) montre la permittivité complexe du fluide entourant la particule. La permittivité 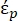 complexe et
complexe et 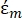 sont définis comme suit35:
sont définis comme suit35: - Utilisez l’équation 3 pour une particule sphérique sous le sous-nœud de force diélectrophorétique:
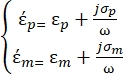 [3]
[3]
Dans l’équation 3, εp (-) montre la partie réelle de la permittivité complexe de la particule; εm (-) montre la partie réelle de la permittivité complexe du fluide entourant la particule; σp (S/m) montre la conductivité des particules; σm (S/m) montre la conductivité du milieu entourant la particule; et ω (Hz) est la fréquence du champ électrique appliqué.
NOTE: Le signe de Re(K) détermine la polarité duDEP F. Si le signe de Re(K) est négatif, alors la particule subit une force diélectrophorétique négative (nDEP); Au contraire, si le signe de Re(K) est positif, il implique une force diélectrophorétique positive (pDEP). Pour le facteur de Clausius-Mossotti (K), la variation se situe dans la plage de -1 à 1.
- Dans un premier temps, réaliser une étude d’indépendance du maillage afin d’optimiser la taille du maillage pour les simulations33.
- Utilisez une forme modifiée de l’équation 3 pour modéliser des cellules biologiques telles que les cellules de mammifères, qui sont plus complexes et ont une structure multicouche.
K (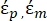 ) =
) = 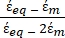 [4]
[4]
Dans l’équation 4, (-) incorpore à la fois la permittivité complexe du cytoplasme, (-), et la permittivité complexe de la membrane cellulaire,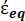
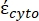
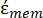 (-), et est donnée comme suit:36
(-), et est donnée comme suit:36 - Utilisez l’équation 5 pour résoudre «
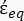 »:
»: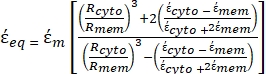 [5]
[5]
Dans l’équation 5, R cyto (m) et Rmem (m) montrent respectivement le rayon du cytoplasme cellulaire et de la membrane cellulaire. - Ensuite, utilisez l’équation 4 pour tracer Re(K) en fonction du champ électrique appliqué pour les cellules cancéreuses et saines. Calculez la partie réelle du facteur de Clausius-Mossotti (CM), Re(K), pour quantifier la force diélectrophorétique (DEP) subie par la particule.
- Cliquez avec le bouton droit sur le nœud Résultats, ajoutez le sous-nœud Évaluation des particules et, dans la section expression, tapez fpt.deff1.K pour tracer le facteur CM pour la particule 1 et fpt.deff2.K pour la particule 2.
REMARQUE: Toutes les étapes de protocole énumérées dans le texte principal peuvent être visualisées dans la vidéo de protocole (vidéo 1).
Access restricted. Please log in or start a trial to view this content.
Résultats
Étudier les paramètres opérationnels optimaux pour un tri efficace basé sur la DEP des cellules du cancer du sein non métastatique (MCF-7) et de l’épithélium du sein non tumoral (MCF-10A)
Pour obtenir une séparation réussie des cellules du cancer du sein non métastatique (MCF-7) et de l’épithélium du sein non tumoral (MCF-10A) ayant des propriétés diélectriques divergentes lors de la diélectrophorèse, leurs facteurs K doivent être distincts en maintenant la fréquence appliquée ...
Access restricted. Please log in or start a trial to view this content.
Discussion
Des dispositifs microfluidiques ont déjà été signalés pour la culture cellulaire, le piégeage et le tri 47,52,53. La fabrication de ces dispositifs en salle blanche est un processus coûteux, et il est impératif de quantifier le rendement et l’efficacité d’un dispositif microfluidique proposé grâce à des simulations CFD. Cette étude présente la conception et les simulations d’un dispositif microfluidique AC-di...
Access restricted. Please log in or start a trial to view this content.
Déclarations de divulgation
Les auteurs ne déclarent aucun conflit d’intérêts potentiel.
Remerciements
Cette étude a été soutenue par la Commission de l’enseignement supérieur du Pakistan.
Access restricted. Please log in or start a trial to view this content.
matériels
| Name | Company | Catalog Number | Comments |
| COMSOL | COMSOL | multiphysics simulation software |
Références
- Liang, L., et al. Microfluidic-based cancer cell separation using active and passive mechanisms. Microfluidics and Nanofluidics. 24 (4), 26(2020).
- Damiati, S., Kompella, U. B., Damiati, S. A., Kodzius, R. Microfluidic devices for drug delivery systems and drug screening. Genes. 9 (2), 103(2018).
- Pashayan, N., et al. Personalized early detection and prevention of breast cancer: ENVISION consensus statement. Nature Reviews Clinical Oncology. 17 (11), 687-705 (2020).
- Panesar, S., Neethirajan, S. Microfluidics: Rapid diagnosis for breast cancer. Nano-micro Letters. 8 (3), 204-220 (2016).
- Chen, J., Li, J., Sun, Y. Microfluidic approaches for cancer cell detection, characterization and separation. Lab on a Chip. 12 (10), 1753-1767 (2012).
- Beech, J. P., Holm, S. H., Adolfsson, K., Tegenfeldt, J. O. Sorting cells by size, shape and deformability. Lab on a Chip. 12 (6), 1048-1051 (2012).
- Kang, Y., Li, D. Electrokinetic motion of particles and cells in microchannels. Microfluidics and Nanofluidics. 6 (4), 431-460 (2009).
- Schmid, L., Weitz, D. A., Franke, T. Acoustic microfluidic fluorescence-activated cell sorter. Lab on a Chip. 14 (19), 3710-3718 (2014).
- Yu, B. Y., Elbuken, C., Shen, C., Huissoon, J. P., Ren, C. L. An integrated microfluidic device for the sorting of yeast cells using image processing. Scientific Reports. 8, 3550(2014).
- Asiaei, S., Darvishi, V., Davari, M. H., Zohrevandi, D., Moghadasi, H. Thermophoretic isolation of circulating tumor cells, numerical simulation and design of a microfluidic chip. Journal of Thermal Analysis and Calorimetry. 137 (3), 831-839 (2019).
- Song, Y., Li, M., Pan, X., Wang, Q., Li, D. Size-based cell sorting with a resistive pulse sensor and an electromagnetic pump in a microfluidic chip. Electrophoresis. 36 (3), 398-404 (2014).
- Giraud, G., et al. Dielectrophoretic manipulation of ribosomal RNA. Biomicrofluidics. 5 (2), 024116(2011).
- Valero, A., Braschler, T., Demierre, N., Renaud, P. A miniaturized continuous dielectrophoretic cell sorter and its applications. Biomicrofluidics. 4 (2), 022807(2010).
- Allahrabbi, N., Chia, Y. S. M., Saifullah, M. S. M., Lim, K. M., Lanry Yung, L. Y. A hybrid dielectrophoretic system for trapping of microorganisms from water. Biomicrofluidics. 9 (3), 034110(2015).
- Vykoukal, D. M., Gascoyne, P. R. C., Vykoukal, J. Dielectric characterization of complete mononuclear and polymorphonuclear blood cell subpopulations for label-free discrimination. Integrative Biology: Quantitative Biosciences from Nano to Macro. 1 (7), 477-484 (2009).
- Shim, S., et al. Antibody-independent isolation of circulating tumor cells by continuous-flow dielectrophoresis. Biomicrofluidics. 7 (1), 11807(2013).
- Jeon, H. J., Lee, H., Yoon, D. S., Kim, B. M. Dielectrophoretic force measurement of red blood cells exposed to oxidative stress using optical tweezers and a microfluidic chip. Biomedical Engineering Letters. 7 (4), 317-323 (2017).
- Song, H., et al. Continuous-flow sorting of stem cells and differentiation products based on dielectrophoresis. Lab on a Chip. 15 (5), 1320-1328 (2015).
- Tsai, S. L., Chiang, Y., Wang, M. H., Chen, M. K., Jang, L. S. Battery-powered portable instrument system for single-cell trapping, impedance measurements, and modeling analyses. Electrophoresis. 35 (16), 2392-2400 (2014).
- Chan, J. Y., et al. Dielectrophoresis-based microfluidic platforms for cancer diagnostics. Biomicrofluidics. 12 (1), 011503(2018).
- Patel, S., et al. Microfluidic separation of live and dead yeast cells using reservoir-based dielectrophoresis. Biomicrofluidics. 6 (3), 34102(2012).
- Yildizhan, Y., Erdem, N., Islam, M., Martinez-Duarte, R., Elitas, M. Dielectrophoretic separation of live and dead monocytes using 3D carbon-electrodes. Sensors. 17 (11), 2691-2704 (2017).
- Piacentini, N., Mernier, G., Tornay, R., Renaud, P. Separation of platelets from other blood cells in continuous-flow by dielectrophoresis field-flow-fractionation. Biomicrofluidics. 5 (3), 34122(2011).
- Zhao, K., Duncker, B. P., Li, D. Continuous cell characterization and separation by microfluidic alternating current dielectrophoresis. Analytical Chemistry. 91 (9), 6304-6314 (2019).
- Valero, A., et al. Tracking and synchronization of the yeast cell cycle using dielectrophoretic opacity. Lab on a Chip. 11 (10), 1754-1760 (2011).
- Demierre, N., Braschler, T., Muller, R., Renaud, P. Focusing and continuous separation Of cells in a microfluidic device using lateral dielectrophoresis. International Solid-State Sensors, Actuators and Microsystems Conference. 430 (98), 1777-1780 (2007).
- Arslan, Z. C., Yalçın, Y. D., Külah, H. Label-free enrichment of MCF7 breast cancer cells from leukocytes using continuous flow dielectrophoresis. Electrophoresis. 43 (13-14), 1531-1544 (2022).
- Turcan, I., Olariu, M. A. Dielectrophoretic manipulation of cancer cells and their electrical characterization. ACS Combinatorial Science. 22 (11), 554-578 (2020).
- Park, J., et al. Sequential cell-processing system by integrating hydrodynamic purification and dielectrophoretic trapping for analyses of suspended cancer cells. Micromachines. 11 (1), 47(2020).
- Hussein, M., et al. Breast cancer cells exhibits specific dielectric signature in vitro using the open-ended coaxial probe technique from 200 MHz to 13.6 GHz. Scientific Reports. 9, 4681(2019).
- Fornes-Leal, A., Garcia-Pardo, C., Frasson, M., Pons Beltrán, V., Cardona, N. Dielectric characterization of healthy and malignant colon tissues in the 0.5-18 GHz frequency band. Physics in Medicine and Biology. 61 (20), 7334-7346 (2016).
- Çetin, B., Li, D. Dielectrophoresis in microfluidics technology. Electrophoresis. 32 (18), 2410-2427 (2011).
- Khan, S., Khulief, Y. A., Al-Shuhail, A. A. Effects of reservoir size and boundary conditions on pore-pressure buildup and fault reactivation during CO2 injection in deep geological reservoirs. Environmental Earth Sciences. 79, 294(2020).
- Adams, T. N. G., Turner, P. A., Janorkar, A. V., Zhao, F., Minerick, A. R. Characterizing the dielectric properties of human mesenchymal stem cellsand the effects of charged elastin-like polypeptide copolymer treatment. Biomicrofluidics. 8 (5), 054109(2014).
- Lo, Y. J., et al. Measurement of the Clausius-Mossotti factor of generalized dielectrophoresis. Applied Physics Letters. 104, 083701(2014).
- Lo, Y. J., Lei, U. Measurement of the real part of the Clausius-Mossotti factor of dielectrophoresis for Brownian particles. Electrophoresis. 41 (1), 137-147 (2020).
- Ohta, A. T., et al. Optically controlled cell discrimination and trapping using optoelectronic Tweezers. IEEE Journal of Selected Topics in Quantum Electronics. 13 (2), 235-242 (2007).
- Sun, T., Morgan, H. Single-cell microfluidic Impedance cytometry. Microfluidics and Nanofluidics. 8 (4), 423-443 (2010).
- Weng, P. Y., et al. Size-dependent dielectrophoretic cross-over frequency of spherical particles. Biomicrofluidics. 10 (1), 1909-1921 (2016).
- Lu, Y. W., Sun, C., Kao, Y. C., Hung, C. L., Juang, J. Y. Dielectrophoretic cross-over frequency of single particles: Quantifying the effect of surface functional groups and electrohydrodynamic flow drag force. Nanomaterials. 10 (7), 1364(2020).
- Henslee, E. A., Sano, M. B., Rojas, A. D., Schmelz, E. M., Davalos, R. V. Selective concentration of human cancer cells using contactless dielectrophoresis. Electrophoresis. 32 (18), 2523-2529 (2011).
- Chan, J. Y., et al. Dielectrophoresis-based microfluidic platforms for cancer diagnostics. Biomicrofluidics. 12 (1), 11503-11525 (2018).
- Gascoyne, P. R. C., Shim, S. Isolation of circulating tumor cells by dielectrophoresis. Cancers. 6 (1), 545-579 (2014).
- Liang, W., et al. Determination of dielectric properties of cells using ac electrokinetic-based microfluidic platform. Micromachines. 11 (5), 513-537 (2020).
- Frusawa, H., et al. Frequency-modulated wave dielectrophoresis of vesicles and cells periodic U-turns at the crossover frequency. Nanoscale Research Letters. 13 (169), 2583-2589 (2018).
- Wei, M. T., Junio, J., Ou-Yang, D. H. Direct measurements of the frequency-dependent dielectrophoresis force. Biomicrofluidics. 3 (1), 12003(2009).
- Mustafa, A., Pedone, E., Marucci, L., Moschou, D., Lorenzo, M. D. A flow-through microfluidic chip for continuous dielectrophoretic separation of viable and non-viable human T-cells. Electrophoresis. 43 (3), 501-508 (2021).
- Wang, L., et al. Dual frequency dielectrophoresis with interdigitated sidewall electrodes for microfluidic flow-through separation of beads and cells. Electrophoresis. 30 (5), 782-791 (2021).
- Alazzam, A., Mathew, B., Alhammadi, F. Novel microfluidic device for the continuous separation of cancer cells using dielectrophoresis. Journal of Separation Science. 40 (5), 1193-1200 (2017).
- Yang, L., Banada, P. P., Bhunia, A. K., Bashir, R. Effects of dielectrophoresis on growth viability and immuno-reactivity of listeria monocytogenes. Journal of Biological Engineering. 2, 6(2008).
- Matbaechi, H., Soltani, P., Hölzel, R., Wenger, C. Dielectrophoretic immobilization of yeast cells using CMOS integrated microfluidics. Micromachines. 11 (5), 501-518 (2020).
- Mustafa, A., Pedone, E., La Regina, A., Erten, A. A., Marucci, L. Development of a single layer microfluidic device for dynamic stimulation, culture and imaging of mammalian cells. bioRxiv. , (2022).
- Mustafa, A., et al. Enhanced dissolution of liquid microdroplets in the extensional creeping flow of a hydrodynamic trap. Langmuir. 32 (37), 9460-9467 (2016).
- Chang, H. F., Chou, S. E., Cheng, J. Y. Electric-field-induced neural precursor cell differentiation in microfluidic devices. Journal of Visualized Experiments. (170), e61917(2021).
Access restricted. Please log in or start a trial to view this content.
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationExplorer plus d’articles
This article has been published
Video Coming Soon