Zum Anzeigen dieser Inhalte ist ein JoVE-Abonnement erforderlich. Melden Sie sich an oder starten Sie Ihre kostenlose Testversion.
Method Article
Mikrofluidisches Gerät zur Trennung von nicht-metastasierten (MCF-7) und nicht-tumoralen (MCF-10A) Brustkrebszellen mittels AC-Dielektrophorese
In diesem Artikel
Zusammenfassung
Brustkrebszellen zeigen unterschiedliche dielektrische Eigenschaften im Vergleich zu Nicht-Tumor-Brustepithelzellen. Es wurde die Hypothese aufgestellt, dass aufgrund dieses Unterschieds in den dielektrischen Eigenschaften die beiden Populationen für Immuntherapiezwecke getrennt werden können. Um dies zu unterstützen, modellieren wir ein mikrofluidisches Gerät zur Sortierung von MCF-7- und MCF-10A-Zellen.
Zusammenfassung
Dielektrophoretische Geräte sind in der Lage, Krebszellen markierungsfrei, kostengünstig, robust und genau nach dem Prinzip der Polarisation der Krebszellen im Probenvolumen durch Anlegen eines externen elektrischen Feldes zu detektieren und zu manipulieren. Dieser Artikel zeigt, wie eine mikrofluidische Plattform für die kontinuierliche Hochdurchsatzsortierung von nicht-metastasierten Brustkrebszellen (MCF-7) und Nicht-Tumor-Brustepithelzellen (MCF-10A) unter Verwendung hydrodynamischer Dielektrophorese (HDEP) aus der Zellmischung verwendet werden kann. Durch die Erzeugung eines elektrischen Feldes zwischen zwei Elektroden, die nebeneinander mit einem mikrometergroßen Spalt zwischen ihnen in einem mikrofluidischen HDEP-Chip angeordnet sind, können Nicht-Tumor-Brustepithelzellen (MCF-10A) weggedrückt werden, die im Hauptkanal eine negative DEP aufweisen, während die nicht-metastasierten Brustkrebszellen ihrem Verlauf unbeeinflusst folgen, wenn sie im Zellmedium suspendiert sind, da die Leitfähigkeit höher ist als die Membranleitfähigkeit. Um dieses Konzept zu demonstrieren, wurden Simulationen für verschiedene Werte der Medienleitfähigkeit durchgeführt und die Sortierung von Zellen untersucht. Eine parametrische Studie wurde durchgeführt, und eine geeignete Zellmischungsleitfähigkeit wurde mit 0,4 S / m gefunden. Durch Festhalten der Medienleitfähigkeit wurde eine adäquate Wechselstromfrequenz von 0,8 MHz hergestellt, die durch Variation der elektrischen Feldfrequenz eine maximale Sortiereffizienz ergibt. Unter Verwendung des demonstrierten Verfahrens kann nach Auswahl des geeigneten Zellmischsuspensionsmediums Leitfähigkeit und Frequenz des angelegten AC eine maximale Sortiereffizienz erreicht werden.
Einleitung
Ein bösartiger Tumor, der sich in und um das Brustgewebe entwickelt, ist eine häufige Ursache für Brustkrebs bei Frauen weltweit und verursacht ein kritisches Gesundheitsproblem1. Brusttumoren vor Metastasen können durch eine Operation behandelt werden, wenn sie in einem frühen Stadium erkannt werden, aber wenn sie ignoriert werden, können sie schwerwiegende Auswirkungen auf das Leben des Patienten haben, indem sie sich auf Lunge, Gehirn und Knochen ausbreiten. Die Behandlungen, die in späteren Stadien angeboten werden, wie Bestrahlung und chemische Therapien, haben schwere Nebenwirkungen2. Neuere Studien haben berichtet, dass eine frühzeitige Diagnose von Brustkrebs die Sterblichkeitsrate um 60% senkt3. Daher ist es unerlässlich, auf personalisierte Früherkennungsmethoden hinzuarbeiten. Zu diesem Zweck haben Forscher aus verschiedenen Bereichen der Wissenschaft und Technologie die Mikrofluidik genutzt, um Geräte zur Früherkennung von Brustkrebs zu entwickeln4. Zu diesen Methoden gehören Zellaffinitätsmikrochromatographie, magnetisch aktivierte Mikrozellsortierer, größenbasierte Krebszellerfassung und -trennung sowie On-Chip-Dielektrophorese (DEP)5,6. Diese in der Literatur beschriebenen mikrofluidischen Techniken ermöglichen eine präzise Zellmanipulation, Echtzeitüberwachung und Sortierung genau definierter Proben, die als Zwischenschritt in vielen diagnostischen und therapeutischen Anwendungen dienen5. Die Integration dieser Sortiermechanismen mit der Mikrofluidik ermöglicht eine flexible und zuverlässige Manipulation der Zielzellen 7,8,9,10. Einer der Hauptvorteile einer solchen Integration ist die Möglichkeit, mit flüssigen Proben in Nano- bis Mikrolitervolumina zu arbeiten und auch die elektrischen Eigenschaften der Probenflüssigkeit manipulieren zu können. Durch Einstellung der Leitfähigkeit der suspendierenden Flüssigkeit in mikrofluidischen Vorrichtungen können die biologischen Zellen nach ihrer Größe und Unterschieden in ihren dielektrischen Eigenschaften sortiert werden11,12.
Unter diesen Techniken wird häufig die On-Chip-DEP bevorzugt, da es sich um eine markierungsfreie Zellsortiertechnik handelt, die die elektrischen Eigenschaften der biologischen Proben nutzt. Es wurde berichtet, dass DEP Bioproben wie DNA 13, RNA 14, Proteine 15, Bakterien16, Blutzellen 17, zirkulierende Tumorzellen (CTCs)18 und Stammzellen 19 manipuliert. Mikrofluidische Geräte, die DEP zur Sortierung biologischer Proben verwenden, wurden in der Literaturausführlich berichtet 20. Es wurde über reservoirbasierte DEP-Mikrofluidik-Geräte (rDEP) zur Sortierung lebensfähiger und nicht lebensfähiger Hefezellen berichtet, die die Zellen vor den nachteiligen Auswirkungen elektrochemischer Reaktionen schützen21,22. Piacentini et al. berichteten über einen zinnenförmigen mikrofluidischen Zellsortierer, der rote Blutkörperchen von Blutplättchen mit einer Effizienz von 97% trennte23. Es wurde auch berichtet, dass On-Chip-DEP-Geräte mit asymmetrischen Öffnungen und eingebetteten Elektroden lebensfähige und nicht lebensfähige Zellen sortieren24. Valero und Demierre et al. modifizierten den kastellierten mikrofluidischen Zellsortierer, indem sie zwei Arrays von Mikroelektroden auf beiden Seiten des Kanals25,26 einführten. Dies half bei der Fokussierung der Zellen in der Mitte des Kanals. Zeynep et al. präsentierten ein DEP-basiertes mikrofluidisches Gerät zur Trennung und Konzentration von MCF7-Brustkrebszellen aus Leukozyten27. Sie berichteten über eine Effizienz bei der Extraktion von MCF7-Zellen aus Leukozyten zwischen 74% -98% mit einer Frequenz von 1 MHz und einer angelegten Spannung von 10-12 Vpp. Die ergänzende Tabelle 1 stellt einen qualitativen und quantitativen Vergleich zwischen den DEP-basierten mikrofluidischen Sortiergeräten anhand ihres Designs, ihrer Elektrodenkonfiguration und ihrer Betriebsparameter (angelegte Frequenz und Spannung) dar.
In jüngerer Zeit haben Forscher versucht, die Unterschiede im dielektrischen Verhalten von Brustepithelzellen (MCF-10A) und nicht-metastasierten Brustkrebszellen (MCF-7) in einem mikrofluidischen Chip28,29 zu messen. Jithin et al. charakterisierten auch die dielektrischen Reaktionen verschiedener Krebszelllinien mit einer offenen koaxialen Sondentechnik mit Frequenzen zwischen 200 MHz und 13,6 GHz30. Diese Unterschiede in den dielektrischen Antworten von MCF-7- und MCF-10A-Zelllinien können ausgenutzt werden, um sie in der Laufzeit zu trennen und zur Entwicklung personalisierter Frühdiagnosegeräte zu führen.
In diesem Artikel simulieren wir die kontrollierte Sortierung von nicht-metastasierten Brustkrebszellen (MCF-7) und nicht-tumoralen Brustepithelzellen (MCF-10A) mittels AC-Dielektrophorese. Der Bereich der Änderung des elektrischen Feldes beeinflusst die Sortierung innerhalb des mikrofluidischen Chips. Die vorgeschlagene Technik ist einfach zu implementieren und ermöglicht die Integration der Sortiertechnik in verschiedene mikrofluidische Chiplayouts. Computational Fluid Dynamics (CFD) Simulationen wurden durchgeführt, um die Trennung von nicht-metastasierten Brustkrebszellen und Nicht-Tumor-Brustepithelzellen zu untersuchen, indem die Leitfähigkeit des flüssigen Mediums, in dem Zellen suspendiert waren, variiert wurde. In diesen Simulationen wird gezeigt, dass durch konstante Leitfähigkeit und durch Veränderung der angelegten Frequenz die Trennung von Krebszellen und gesunden Zellen gesteuert werden kann.
Protokoll
HINWEIS: Das Protokoll hier verwendet COMSOL, eine Multiphysik-Simulationssoftware, um die kontrollierte Sortierung von nicht-metastasierten Brustkrebszellen (MCF-7) und Nicht-Tumor-Brustepithelzellen (MCF-10A) mittels AC-Dielektrophorese zu simulieren.
1. Chipdesign und Parameterauswahl
- Öffnen Sie die Multiphysik-Software und wählen Sie Leeres Modell. Klicken Sie mit der rechten Maustaste auf die globalen Definitionen und wählen Sie Parameter. Importieren Sie die in Tabelle 1 angegebenen Parameter als Textdatei in globale Definitionen oder geben Sie die Werte einzeln ein.
- Wählen Sie auf der Registerkarte Start die Option Komponente hinzufügen und fügen Sie eine 2D-Komponente hinzu. Klicken Sie mit der rechten Maustaste auf Geometrie und importieren Sie die Modelldatei durch Doppelklick auf die Datei.
- Wählen Sie ein leeres Material aus, und verwenden Sie die Materialeigenschaften aus Tabelle 1.
- Wählen Sie auf der Registerkarte Start die Option Physik hinzufügen aus, und geben Sie AC/DC ein. Wählen Sie unter dem AC/DC-Knoten elektrische Ströme als Physik unter dem Unterknoten Elektrische Felder und Ströme aus.
- Klicken Sie mit der rechten Maustaste auf den elektrischen Strom und wählen Sie die Unterknoten Stromerhaltung, Isolierung und elektrisches Potential, um die Kanalwände zu isolieren, um den Elektroden ein Potential zuzuweisen.
- Wählen Sie auf der Registerkarte Start die Option Physik hinzufügen aus, und wählen Sie unter dem Knoten Fluid Flow die Option Creeping Flow Physics unter dem Unterknoten Single-Phase Flow aus. Klicken Sie mit der rechten Maustaste auf Single-Phase Flow und rendern Sie die Chipgrenzen mithilfe des Unterknotens Wall als Wände.
- Klicken Sie mit der rechten Maustaste auf Single-Phase Flow und fügen Sie zwei Einlassunterknoten und einen Ausgangsunterknoten hinzu.
- Weisen Sie die Einlässe mithilfe des Einlassunterknotens zu und verwenden Sie die Normale in Strömungsgeschwindigkeit als Randbedingung. Weisen Sie den Ausgang über den Ausgangsunterknoten zu.
- Wählen Sie auf der Registerkarte Start die Option Physik hinzufügen aus, und wählen Sie unter dem Knoten Fluid Flow unter dem Unterknoten Partikelverfolgung die Option Particle Tracing Flow Physics aus.
- Klicken Sie mit der rechten Maustaste auf den Partikelverfolgungsknoten und fügen Sie die Unterknotenwand, Unterknoten mit zwei Partikeleigenschaften, zwei Einlassunterknoten, einen Auslassunterknoten, zwei Unterknoten der Dielektrophoresekraft und einen Unterknoten für die Widerstandskraft hinzu.
- Legen Sie Partikeleigenschaften für MCF-7- und MCF-10A-Zellen mithilfe des Unterknotens Partikeleigenschaften fest. Wählen Sie die Partikeleigenschaften aus den Parametern im Abschnitt Globale Definition aus.
- Fügen Sie den Unterknoten Drag Force hinzu, um beiden Zelltypen die dielektrophoretische Kraft zuzuweisen.
- Fügen Sie in diesem Fall Partikeleigenschaften aus dem Parameterabschnitt hinzu. Fügen Sie den Unterknoten Shell hinzu, um Säugetierzellen zu modellieren.
- Wählen Sie auf der Registerkarte Start die Option Netz hinzufügen und dann Feinnetz aus. Wählen Sie auf der Registerkarte Start die Option Netz erstellen, um ein Netz zu erstellen.
- Klicken Sie auf der Registerkarte Start auf Studie hinzufügen, um drei Studienschritte hinzuzufügen. Studienschritt 1 dient der Simulation eines Frequenzgangs; Verwenden Sie einen Frequenzdomänen-Unterknoten.
- Um die kriechende Strömung zu simulieren, wählen Sie einen stationären Studienknoten aus. Fügen Sie zwei zeitabhängige Schritte hinzu, um Bedingungen mit dielektrophoretischer Kraft und ohne dielektrophoretische Kraft zu simulieren.
- Wählen Sie für die Bedingung no dielectrophoretic (keine dielektrophoretische Bedingung) die Option Physics and Variables Selection (Physik- und Variablenauswahl), aktivieren Sie das Kontrollkästchen Modellkonfiguration für den Studienschritt ändern, und deaktivieren Sie den dielektrophoretischen Schritt. Bei dielektrophoretischen Bedingungen nicht deaktivieren. Speichern Sie die Datei und drücken Sie Berechnen , damit die Simulation ausgeführt wird.
HINWEIS: Der mikrofluidische Chip, der für die Sortierung von nicht-metastasierten Brustkrebszellen (MCF-7) und Nicht-Tumor-Brustepithelzellen (MCF-10A) ausgelegt ist, verfügt über zwei separate Einlässe für den Zellmischungsfluss bzw. für die hydrodynamische Strömungsfokussierung mit Breiten von 20 μm bzw. 40 μm, wie in der ergänzenden Abbildung 1 und der ergänzenden Abbildung 2 gezeigt. - Weisen Sie den Hobelelektroden (295 μm Breite), die entlang der oberen Seitenwand der Sortierkammer angebracht sind, die Frequenz (f0) unter dem Unterknoten Frequenzbereich und die Spannung unter Verwendung des Unterknotens " Elektrisches Potential " zu. Verwenden Sie am Auslass die Wandbedingung "Freeze", um die sortierten Partikel zu visualisieren.
2. Mathematische Modell- und Computeranalyse
- Überprüfen Sie die Betriebsparameter für die Trennung von nicht-metastasierten Brustkrebszellen und Nicht-Tumor-Brustepithelzellen innerhalb des mikrofluidischen Geräts, indem Sie eine CFD-Studie (Computational Fluid Dynamics) einrichten.
HINWEIS: Zu diesem Zweck wurde Multiphysik-Software (AC / DC-, Mikrofluidik- und Partikelverfolgungsmodule) verwendet. Die maßgeblichen Gleichungen und der theoretische Hintergrund sind im Zusatzdossier 1 ausführlich wiedergegeben. Das Modell wurde unter Verwendung der dielektrischen Eigenschaften von nicht-metastasierten Brustkrebszellen (MCF7) und nicht-tumoralen Brustepithelzellen (MCF-10A) getestet, die in Literatur31,32 berichtet werden und in Tabelle 1 zusammengefasst sind. - Führen Sie die CFD-Simulationen durch, indem Sie nicht-metastasierende Brustkrebs- (MCF7) und nicht-tumor-Brustepithelzelllinien (MCF-10A) mit einem Verhältnis von 1:1 am Zellmischeinlass einführen.
- Führen Sie zunächst eine Netzunabhängigkeitsstudie durch, um die Maschenweite für die Simulationenzu optimieren 33.
HINWEIS: Es wurde eine Netzunabhängigkeitsstudie durchgeführt, um die beste Lösung für die Betriebsparameter zu finden. Ein Satz von fünf verschiedenen Maschenweiten wurde ausgewählt, um die bestmögliche Elementgröße für die Konvergenz der Lösung zu quantifizieren. Es wurde beobachtet, dass, wenn die Gesamtzahl der Elemente, die ein Netz definieren, 635 (gröbere Maschen) betrug, wie in der ergänzenden Abbildung 3A gezeigt, die Sortiereffizienz am niedrigsten war, wobei sich einige der MCF7-Zellen zum unteren Auslass bewegten, wie in der ergänzenden Abbildung 3B dargestellt. Wenn die Maschenweite auf fein erhöht wurde, erhöhte sich auch die Anzahl der Elemente, die das Netz definieren, auf 2.288. Die Sortiereffizienz war in diesem Fall maximal, wobei sich sowohl MCF7- als auch MCF-10A-Zellen in Richtung ihrer jeweiligen Ausgänge bewegten. Das feinere Netz wurde ebenfalls simuliert, wobei die Anzahl der Elemente, die das Netz definieren, auf 3.188 erhöht wurde. Die Sortiereffizienz blieb über diesen Zeitpunkt hinaus unbeeinflusst. Daher können wir mit Sicherheit sagen, dass die feine Maschenweite in unserem Fall am besten funktioniert. - Lösen Sie zwei Sätze von CFD-Studien.
- Klicken Sie für den ersten Satz mit der rechten Maustaste auf Studie 1 und fügen Sie den Unterknoten Parametric Sweep hinzu. Drücken Sie das + -Zeichen, um die Leitfähigkeit des Flüssigkeitsmediums "σm" als Sweep-Variable hinzuzufügen. Führen Sie eine parametrische Sweep-Studie für die Leitfähigkeit des Fluidmediums σ m im Bereich von 0,01 S/m bis 2,5 S/m durch, wobei die angelegte Frequenz f (Hz) konstant bei einem Wert von 800 kHz gehalten wird.
- Führen Sie für den zweiten Satz eine parametrische Sweep-Studie durch, indem Sie die angelegte Wechselfrequenz von 100 kHz bis 100 MHz variieren, während die Leitfähigkeit des Flüssigkeitsmediums σ m für jeden Fall auf 0,4 S /m festgelegt wird. Dieser σm-Wert wurde basierend auf den Ergebnissen der ersten CFD-Studie gewählt, da bei diesem Wert ein maximaler Abstand zwischen MCF-7 und MCF-10A beobachtet wurde.
- Die Stärke der Dielektrophorese (DEP)-Kraft, FDEP (-), die auf ein dielektrisches sphärisches Teilchen in einem leitfähigen Medium ausgeübt wird, ist in Gleichung 1T34 angegeben:
FDEP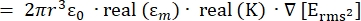 [1]
[1]
Verwenden Sie Gleichung 1 unter dem Unterknoten dielektrophoretische Kraft. In Gleichung 1 zeigt r den Radius des Teilchens, auf das FDEPangewendet wird; K (-) ist als Clausius-Mossotti-Faktor bekannt; εm(-) zeigt die dielektrische Dielektrizitätskonstante des Mediums; und E(V/m) ist der quadratische Mittelwert des elektrischen Feldes. - Verwenden Sie Gleichung 2 für ein sphärisches Teilchen unter dem dielektrophoretischen Kraftunterknoten.
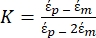 [2]
[2]
In Gleichung 2 zeigt (-) die komplexe Permittivität des Partikels, auf das die DEP-Kraft angewendet wird;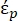
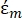 (-) zeigt die komplexe Dielektrizitätskonstante der das Partikel umgebenden Flüssigkeit. Die komplexe Dielektrizitätskonstante
(-) zeigt die komplexe Dielektrizitätskonstante der das Partikel umgebenden Flüssigkeit. Die komplexe Dielektrizitätskonstante 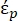 und
und 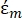 sind wie folgt definiert35:
sind wie folgt definiert35: - Verwenden Sie Gleichung 3 für ein sphärisches Teilchen unter dem dielektrophoretischen Kraftunterknoten:
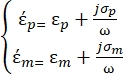 [3]
[3]
In Gleichung 3 zeigt εp (-) den Realteil der komplexen Dielektrizitätskonstante des Teilchens; εm (-) zeigt den realen Teil der komplexen Dielektrizitätskonstante der das Partikel umgebenden Flüssigkeit; σp (S/m) zeigt die Partikelleitfähigkeit; σ m (S/m ) zeigt die Leitfähigkeit des Mediums, das das Partikel umgibt; und ω (Hz) ist die Frequenz des angelegten elektrischen Feldes.
HINWEIS: Das Vorzeichen von Re(K) bestimmt die Polarität derF-DEP. Wenn das Vorzeichen von Re(K) negativ ist, erfährt das Teilchen eine negative dielektrophoretische Kraft (nDEP); Im Gegensatz dazu impliziert das Vorzeichen von Re(K) eine positive dielektrophoretische Kraft (pDEP). Für den Clausius-Mossotti-Faktor (K) liegt die Variation im Bereich von -1 bis 1.
- Führen Sie zunächst eine Netzunabhängigkeitsstudie durch, um die Maschenweite für die Simulationenzu optimieren 33.
- Verwenden Sie eine modifizierte Form von Gleichung 3, um biologische Zellen wie Säugetierzellen zu modellieren, die komplexer sind und eine mehrschichtige Struktur haben.
K (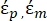 ) =
) = 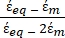 [4]
[4]
In Gleichung 4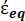 beinhaltet (-) sowohl die komplexe Permittivität des Zytoplasmas
beinhaltet (-) sowohl die komplexe Permittivität des Zytoplasmas 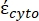 (-) als auch die komplexe Permittivität der Zellmembran
(-) als auch die komplexe Permittivität der Zellmembran 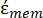 (-) und wird wie folgt angegeben:36
(-) und wird wie folgt angegeben:36 - Verwenden Sie Gleichung 5, um ""
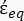 zu lösen:
zu lösen: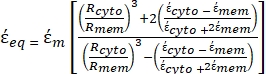 [5]
[5]
In Gleichung 5 zeigen R cyto (m) und Rmem (m) den Radius des Zellzytoplasmas bzw. der Zellmembran. - Verwenden Sie dann Gleichung 4, um Re (K) als Funktion des angelegten elektrischen Feldes sowohl für Krebs als auch für gesunde Zellen darzustellen. Berechnen Sie den realen Teil des Clausius-Mossotti (CM)-Faktors, Re(K), um die dielektrophoretische Kraft (DEP) zu quantifizieren, die das Teilchen erfährt.
- Klicken Sie mit der rechten Maustaste auf den Knoten Ergebnisse, fügen Sie den Unterknoten Partikelauswertung hinzu, und geben Sie im Ausdrucksabschnitt fpt.deff1.K ein, um den CM-Faktor für Partikel 1 und fpt.deff2.K für Partikel 2 darzustellen.
HINWEIS: Alle im Haupttext aufgeführten Protokollschritte können im Protokollvideo (Video 1) angezeigt werden.
Ergebnisse
Untersuchung der optimalen operativen Parameter für eine effektive DEP-basierte Sortierung von nicht-metastasierten Brustkrebs- (MCF-7) und nicht-tumoralen Brustepithelzellen (MCF-10A)
Um eine erfolgreiche Trennung von nicht-metastasierendem Brustkrebs (MCF-7) und nicht-tumoralem Brustepithel (MCF-10A) Zellen mit divergenten dielektrischen Eigenschaften während der Dielektrophorese zu erreichen, sollten ihre K-Faktoren unterschieden werden, indem die angewandte Frequenzfest 37,38
Diskussion
Mikrofluidische Geräte wurden zuvor für Zellkultur, Fangen und Sortieren berichtet 47,52,53. Die Herstellung dieser Geräte im Reinraum ist ein teurer Prozess, und es ist unerlässlich, die Leistung und Effizienz eines vorgeschlagenen mikrofluidischen Geräts durch CFD-Simulationen zu quantifizieren. Diese Studie präsentiert das Design und die Simulationen eines AC-dielektrophoretischen mikrofluidischen Geräts zur kontinuier...
Offenlegungen
Die Autoren erklären keine potenziellen Interessenkonflikte.
Danksagungen
Diese Studie wurde von der Higher Education Commission of Pakistan unterstützt.
Materialien
| Name | Company | Catalog Number | Comments |
| COMSOL | COMSOL | multiphysics simulation software |
Referenzen
- Liang, L., et al. Microfluidic-based cancer cell separation using active and passive mechanisms. Microfluidics and Nanofluidics. 24 (4), 26 (2020).
- Damiati, S., Kompella, U. B., Damiati, S. A., Kodzius, R. Microfluidic devices for drug delivery systems and drug screening. Genes. 9 (2), 103 (2018).
- Pashayan, N., et al. Personalized early detection and prevention of breast cancer: ENVISION consensus statement. Nature Reviews Clinical Oncology. 17 (11), 687-705 (2020).
- Panesar, S., Neethirajan, S. Microfluidics: Rapid diagnosis for breast cancer. Nano-micro Letters. 8 (3), 204-220 (2016).
- Chen, J., Li, J., Sun, Y. Microfluidic approaches for cancer cell detection, characterization and separation. Lab on a Chip. 12 (10), 1753-1767 (2012).
- Beech, J. P., Holm, S. H., Adolfsson, K., Tegenfeldt, J. O. Sorting cells by size, shape and deformability. Lab on a Chip. 12 (6), 1048-1051 (2012).
- Kang, Y., Li, D. Electrokinetic motion of particles and cells in microchannels. Microfluidics and Nanofluidics. 6 (4), 431-460 (2009).
- Schmid, L., Weitz, D. A., Franke, T. Acoustic microfluidic fluorescence-activated cell sorter. Lab on a Chip. 14 (19), 3710-3718 (2014).
- Yu, B. Y., Elbuken, C., Shen, C., Huissoon, J. P., Ren, C. L. An integrated microfluidic device for the sorting of yeast cells using image processing. Scientific Reports. 8, 3550 (2014).
- Asiaei, S., Darvishi, V., Davari, M. H., Zohrevandi, D., Moghadasi, H. Thermophoretic isolation of circulating tumor cells, numerical simulation and design of a microfluidic chip. Journal of Thermal Analysis and Calorimetry. 137 (3), 831-839 (2019).
- Song, Y., Li, M., Pan, X., Wang, Q., Li, D. Size-based cell sorting with a resistive pulse sensor and an electromagnetic pump in a microfluidic chip. Electrophoresis. 36 (3), 398-404 (2014).
- Giraud, G., et al. Dielectrophoretic manipulation of ribosomal RNA. Biomicrofluidics. 5 (2), 024116 (2011).
- Valero, A., Braschler, T., Demierre, N., Renaud, P. A miniaturized continuous dielectrophoretic cell sorter and its applications. Biomicrofluidics. 4 (2), 022807 (2010).
- Allahrabbi, N., Chia, Y. S. M., Saifullah, M. S. M., Lim, K. M., Lanry Yung, L. Y. A hybrid dielectrophoretic system for trapping of microorganisms from water. Biomicrofluidics. 9 (3), 034110 (2015).
- Vykoukal, D. M., Gascoyne, P. R. C., Vykoukal, J. Dielectric characterization of complete mononuclear and polymorphonuclear blood cell subpopulations for label-free discrimination. Integrative Biology: Quantitative Biosciences from Nano to Macro. 1 (7), 477-484 (2009).
- Shim, S., et al. Antibody-independent isolation of circulating tumor cells by continuous-flow dielectrophoresis. Biomicrofluidics. 7 (1), 11807 (2013).
- Jeon, H. J., Lee, H., Yoon, D. S., Kim, B. M. Dielectrophoretic force measurement of red blood cells exposed to oxidative stress using optical tweezers and a microfluidic chip. Biomedical Engineering Letters. 7 (4), 317-323 (2017).
- Song, H., et al. Continuous-flow sorting of stem cells and differentiation products based on dielectrophoresis. Lab on a Chip. 15 (5), 1320-1328 (2015).
- Tsai, S. L., Chiang, Y., Wang, M. H., Chen, M. K., Jang, L. S. Battery-powered portable instrument system for single-cell trapping, impedance measurements, and modeling analyses. Electrophoresis. 35 (16), 2392-2400 (2014).
- Chan, J. Y., et al. Dielectrophoresis-based microfluidic platforms for cancer diagnostics. Biomicrofluidics. 12 (1), 011503 (2018).
- Patel, S., et al. Microfluidic separation of live and dead yeast cells using reservoir-based dielectrophoresis. Biomicrofluidics. 6 (3), 34102 (2012).
- Yildizhan, Y., Erdem, N., Islam, M., Martinez-Duarte, R., Elitas, M. Dielectrophoretic separation of live and dead monocytes using 3D carbon-electrodes. Sensors. 17 (11), 2691-2704 (2017).
- Piacentini, N., Mernier, G., Tornay, R., Renaud, P. Separation of platelets from other blood cells in continuous-flow by dielectrophoresis field-flow-fractionation. Biomicrofluidics. 5 (3), 34122 (2011).
- Zhao, K., Duncker, B. P., Li, D. Continuous cell characterization and separation by microfluidic alternating current dielectrophoresis. Analytical Chemistry. 91 (9), 6304-6314 (2019).
- Valero, A., et al. Tracking and synchronization of the yeast cell cycle using dielectrophoretic opacity. Lab on a Chip. 11 (10), 1754-1760 (2011).
- Demierre, N., Braschler, T., Muller, R., Renaud, P. Focusing and continuous separation Of cells in a microfluidic device using lateral dielectrophoresis. International Solid-State Sensors, Actuators and Microsystems Conference. 430 (98), 1777-1780 (2007).
- Arslan, Z. C., Yalçın, Y. D., Külah, H. Label-free enrichment of MCF7 breast cancer cells from leukocytes using continuous flow dielectrophoresis. Electrophoresis. 43 (13-14), 1531-1544 (2022).
- Turcan, I., Olariu, M. A. Dielectrophoretic manipulation of cancer cells and their electrical characterization. ACS Combinatorial Science. 22 (11), 554-578 (2020).
- Park, J., et al. Sequential cell-processing system by integrating hydrodynamic purification and dielectrophoretic trapping for analyses of suspended cancer cells. Micromachines. 11 (1), 47 (2020).
- Hussein, M., et al. Breast cancer cells exhibits specific dielectric signature in vitro using the open-ended coaxial probe technique from 200 MHz to 13.6 GHz. Scientific Reports. 9, 4681 (2019).
- Fornes-Leal, A., Garcia-Pardo, C., Frasson, M., Pons Beltrán, V., Cardona, N. Dielectric characterization of healthy and malignant colon tissues in the 0.5-18 GHz frequency band. Physics in Medicine and Biology. 61 (20), 7334-7346 (2016).
- Çetin, B., Li, D. Dielectrophoresis in microfluidics technology. Electrophoresis. 32 (18), 2410-2427 (2011).
- Khan, S., Khulief, Y. A., Al-Shuhail, A. A. Effects of reservoir size and boundary conditions on pore-pressure buildup and fault reactivation during CO2 injection in deep geological reservoirs. Environmental Earth Sciences. 79, 294 (2020).
- Adams, T. N. G., Turner, P. A., Janorkar, A. V., Zhao, F., Minerick, A. R. Characterizing the dielectric properties of human mesenchymal stem cellsand the effects of charged elastin-like polypeptide copolymer treatment. Biomicrofluidics. 8 (5), 054109 (2014).
- Lo, Y. J., et al. Measurement of the Clausius-Mossotti factor of generalized dielectrophoresis. Applied Physics Letters. 104, 083701 (2014).
- Lo, Y. J., Lei, U. Measurement of the real part of the Clausius-Mossotti factor of dielectrophoresis for Brownian particles. Electrophoresis. 41 (1), 137-147 (2020).
- Ohta, A. T., et al. Optically controlled cell discrimination and trapping using optoelectronic Tweezers. IEEE Journal of Selected Topics in Quantum Electronics. 13 (2), 235-242 (2007).
- Sun, T., Morgan, H. Single-cell microfluidic Impedance cytometry. Microfluidics and Nanofluidics. 8 (4), 423-443 (2010).
- Weng, P. Y., et al. Size-dependent dielectrophoretic cross-over frequency of spherical particles. Biomicrofluidics. 10 (1), 1909-1921 (2016).
- Lu, Y. W., Sun, C., Kao, Y. C., Hung, C. L., Juang, J. Y. Dielectrophoretic cross-over frequency of single particles: Quantifying the effect of surface functional groups and electrohydrodynamic flow drag force. Nanomaterials. 10 (7), 1364 (2020).
- Henslee, E. A., Sano, M. B., Rojas, A. D., Schmelz, E. M., Davalos, R. V. Selective concentration of human cancer cells using contactless dielectrophoresis. Electrophoresis. 32 (18), 2523-2529 (2011).
- Chan, J. Y., et al. Dielectrophoresis-based microfluidic platforms for cancer diagnostics. Biomicrofluidics. 12 (1), 11503-11525 (2018).
- Gascoyne, P. R. C., Shim, S. Isolation of circulating tumor cells by dielectrophoresis. Cancers. 6 (1), 545-579 (2014).
- Liang, W., et al. Determination of dielectric properties of cells using ac electrokinetic-based microfluidic platform. Micromachines. 11 (5), 513-537 (2020).
- Frusawa, H., et al. Frequency-modulated wave dielectrophoresis of vesicles and cells periodic U-turns at the crossover frequency. Nanoscale Research Letters. 13 (169), 2583-2589 (2018).
- Wei, M. T., Junio, J., Ou-Yang, D. H. Direct measurements of the frequency-dependent dielectrophoresis force. Biomicrofluidics. 3 (1), 12003 (2009).
- Mustafa, A., Pedone, E., Marucci, L., Moschou, D., Lorenzo, M. D. A flow-through microfluidic chip for continuous dielectrophoretic separation of viable and non-viable human T-cells. Electrophoresis. 43 (3), 501-508 (2021).
- Wang, L., et al. Dual frequency dielectrophoresis with interdigitated sidewall electrodes for microfluidic flow-through separation of beads and cells. Electrophoresis. 30 (5), 782-791 (2021).
- Alazzam, A., Mathew, B., Alhammadi, F. Novel microfluidic device for the continuous separation of cancer cells using dielectrophoresis. Journal of Separation Science. 40 (5), 1193-1200 (2017).
- Yang, L., Banada, P. P., Bhunia, A. K., Bashir, R. Effects of dielectrophoresis on growth viability and immuno-reactivity of listeria monocytogenes. Journal of Biological Engineering. 2, 6 (2008).
- Matbaechi, H., Soltani, P., Hölzel, R., Wenger, C. Dielectrophoretic immobilization of yeast cells using CMOS integrated microfluidics. Micromachines. 11 (5), 501-518 (2020).
- Mustafa, A., Pedone, E., La Regina, A., Erten, A. A., Marucci, L. Development of a single layer microfluidic device for dynamic stimulation, culture and imaging of mammalian cells. bioRxiv. , (2022).
- Mustafa, A., et al. Enhanced dissolution of liquid microdroplets in the extensional creeping flow of a hydrodynamic trap. Langmuir. 32 (37), 9460-9467 (2016).
- Chang, H. F., Chou, S. E., Cheng, J. Y. Electric-field-induced neural precursor cell differentiation in microfluidic devices. Journal of Visualized Experiments. (170), e61917 (2021).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenWeitere Artikel entdecken
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten