Для просмотра этого контента требуется подписка на Jove Войдите в систему или начните бесплатную пробную версию.
Method Article
Микрофлюидное устройство для разделения неметастатических (MCF-7) и неопухолевых (MCF-10A) клеток рака молочной железы с использованием диэлектрофореза AC
В этой статье
Резюме
Клетки рака молочной железы проявляют различные диэлектрические свойства по сравнению с неопухолевыми эпителиальными клетками молочной железы. Было выдвинуто предположение, что, основываясь на этой разнице в диэлектрических свойствах, две популяции могут быть разделены для целей иммунотерапии. Чтобы поддержать это, мы моделируем микрофлюидное устройство для сортировки клеток MCF-7 и MCF-10A.
Аннотация
Диэлектрофоретические устройства способны обнаруживать и манипулировать раковыми клетками без меток, экономически эффективным, надежным и точным способом, используя принцип поляризации раковых клеток в объеме образца путем применения внешнего электрического поля. В этой статье показано, как микрофлюидная платформа может быть использована для высокопроизводительной непрерывной сортировки неметастатических клеток рака молочной железы (MCF-7) и неопухолевых эпителиальных клеток молочной железы (MCF-10A) с использованием гидродинамического диэлектрофореза (HDEP) из клеточной смеси. Генерируя электрическое поле между двумя электродами, расположенными бок о бок с микронным промежутком между ними в микрофлюидном чипе HDEP, неопухолевые эпителиальные клетки молочной железы (MCF-10A) могут быть оттолкнуты, демонстрируя отрицательный DEP внутри основного канала, в то время как неметастатические клетки рака молочной железы следуют своему курсу незатронутыми при суспендировании в клеточной среде из-за проводимости выше, чем проводимость мембраны. Чтобы продемонстрировать эту концепцию, были выполнены симуляции для различных значений проводимости среды, а также изучена сортировка клеток. Было проведено параметрическое исследование, и было установлено, что проводимость подходящей клеточной смеси составляет 0,4 См/м. Сохраняя фиксированную проводимость среды, была установлена адекватная частота переменного тока 0,8 МГц, дающая максимальную эффективность сортировки, путем изменения частоты электрического поля. Используя показанный способ, после выбора подходящей ячейки смеси суспензии среды проводимости и частоты применяемого переменного тока может быть достигнута максимальная эффективность сортировки.
Введение
Злокачественная опухоль, которая развивается в ткани молочной железы и вокруг нее, является частой причиной рака молочной железы у женщин во всем мире, вызывая критическую проблему со здоровьем1. Опухоли молочной железы до метастазирования можно лечить хирургическим путем, если они обнаружены на ранней стадии, но если их игнорировать, они могут иметь серьезные последствия для жизни пациента, распространяясь на легкие, мозг и кости. Методы лечения, предлагаемые на более поздних стадиях, такие как лучевая и химическая терапия, имеют серьезные побочные эффекты2. Недавние исследования показали, что ранняя диагностика рака молочной железы снижает смертность на 60%3. Следовательно, крайне важно работать над персонализированными методами раннего обнаружения. С этой целью исследователи, работающие в различных областях науки и техники, использовали микрофлюидику для разработки устройств для ранней диагностики рака молочной железы4. Эти методы включают микрохроматографию клеточного сродства, магнитно-активированные сортировщики микроклеточных клеток, захват и разделение раковых клеток на основе размера и диэлектрофорез на кристалле (DEP)5,6. Эти микрофлюидные методы, описанные в литературе, позволяют проводить точные манипуляции с клетками, мониторинг в режиме реального времени и сортировку четко определенных образцов, которые служат промежуточным этапом во многих диагностических и терапевтических приложениях5. Интеграция этих механизмов сортировки с микрофлюидикой обеспечивает гибкое и надежное манипулированиеклетками-мишенями 7,8,9,10. Одним из основных преимуществ такой интеграции является возможность работы с образцами жидкости в нано-микролитрных объемах, а также возможность манипулировать электрическими свойствами образца жидкости. Регулируя проводимость суспендирующей жидкости внутри микрофлюидных устройств, биологические клетки могут быть отсортированы на основе их размеров и различий в их диэлектрических свойствах11,12.
Среди этих методов часто предпочтительным является микросхема DEP, поскольку это метод сортировки клеток без меток, который использует электрические свойства биологических образцов. Сообщалось, что DEP манипулирует биообразцами, такими как ДНК13, РНК14, белки15, бактерии16, клетки крови17, циркулирующие опухолевые клетки (CTC)18 и стволовые клетки19. Микрофлюидные устройства, использующие DEP для сортировки биологических образцов, широко освещались в литературе20. Сообщалось о микрофлюидных (rDEP) устройствах DEP на основе резервуаров для сортировки жизнеспособных и нежизнеспособных дрожжевых клеток, которые защищают клетки от неблагоприятного воздействия электрохимическихреакций 21,22. Piacentini et al. сообщили о кастелированном сортировщике микрофлюидных клеток, который отделял эритроциты от тромбоцитов с эффективностью 97%23. Сообщалось также, что встроенные устройства DEP с асимметричными отверстиями и встроенными электродами сортируют жизнеспособные и нежизнеспособные ячейки24. Valero and Demierre et al. модифицировали кастелированный сортировщик микрофлюидных клеток, введя два массива микроэлектродов по обе стороны канала25,26. Это помогло сфокусировать клетки в центре канала. Zeynep et al. представили микрофлюидное устройство на основе DEP для отделения и концентрирования клеток рака молочной железы MCF7 из лейкоцитов27. Они сообщили об эффективности извлечения клеток MCF7 из лейкоцитов между 74%-98% с частотой 1 МГц и приложенным напряжением в пределах 10-12 Вpp. Дополнительная таблица 1 представляет собой качественное и количественное сравнение микрофлюидных сортировочных устройств на основе DEP на основе их конструкции, конфигурации электродов и рабочих параметров (применяемая частота и напряжение).
Совсем недавно исследователи попытались измерить различия в диэлектрическом поведении эпителиальных клеток молочной железы (MCF-10A) и неметастатических клеток рака молочной железы (MCF-7) внутри микрофлюидного чипа28,29. Jithin et al. также охарактеризовали диэлектрические реакции различных линий раковых клеток с использованием метода коаксиального зонда с открытым концом с частотами от 200 МГц до 13,6 ГГц30. Эти различия в диэлектрических реакциях клеточных линий MCF-7 и MCF-10A могут быть использованы для их разделения во время выполнения и могут привести к разработке персонализированных диагностических устройств на ранней стадии.
В этой статье мы моделируем контролируемую сортировку неметастатических клеток рака молочной железы (MCF-7) и неопухолевых эпителиальных клеток молочной железы (MCF-10A) с использованием диэлектрофореза AC. Область изменения электрического поля влияет на сортировку внутри микрофлюидного чипа. Предлагаемая методика проста в реализации и позволяет интегрировать технику сортировки в различные микрофлюидные макеты чипов. Моделирование вычислительной гидродинамики (CFD) было проведено для изучения разделения неметастатических клеток рака молочной железы и неопухолевых эпителиальных клеток молочной железы путем изменения проводимости жидкой среды, в которой были взвешены клетки. В этих симуляциях показано, что, сохраняя постоянную проводимость и изменяя применяемую частоту, можно контролировать разделение раковых клеток и здоровых клеток.
Access restricted. Please log in or start a trial to view this content.
протокол
ПРИМЕЧАНИЕ: Протокол здесь использует COMSOL, программное обеспечение для мультифизического моделирования, для моделирования контролируемой сортировки неметастатических клеток рака молочной железы (MCF-7) и неопухолевых эпителиальных клеток молочной железы (MCF-10A) с использованием диэлектрофореза AC.
1. Конструкция чипа и выбор параметров
- Откройте мультифизическое программное обеспечение и выберите Пустая модель. Щелкните правой кнопкой мыши глобальные определения и выберите Параметры. Импортируйте параметры, приведенные в таблице 1 , в глобальные определения в виде текстового файла или введите значения по отдельности.
- Выберите Добавить компонент на главной вкладке и добавьте 2D-компонент. Щелкните правой кнопкой мыши по геометрии и импортируйте файл модели, дважды щелкнув файл.
- Выберите пустой материал и используйте свойства материала из таблицы 1.
- Выберите Добавить физику на главной вкладке и введите AC/DC. Под узлом AC/DC выберите электрические токи как Физика под подузлом электрических полей и токов.
- Щелкните правой кнопкой мыши на электрическом токе и выберите подузлы «Сохранение тока», «Изоляция» и «Электрический потенциал », чтобы изолировать стенки канала для присвоения потенциала электродам.
- Выберите Добавить физику на главной вкладке и в узле Поток жидкости выберите Физика ползучего потока в подузле Однофазный поток. Щелкните правой кнопкой мыши однофазный поток и отобразите границы чипа в виде стен с помощью подузла Wall .
- Щелкните правой кнопкой мыши однофазный поток и добавьте два входных подузла и один выходной подузел.
- Назначьте входные отверстия с помощью входного подузла и используйте normal в Flow Velocity в качестве граничного условия. Назначьте розетку с помощью подузла розетки.
- Выберите Добавить физику на главной вкладке и в узле Поток жидкости выберите Физика потока трассировки частиц в подузле Трассировка частиц.
- Щелкните правой кнопкой мыши узел трассировки частиц и добавьте стенку подузлов, подузлы свойств двух частиц, два входных подузла, один выходной подузел, два подузла силы диэлектрофореза и один подузел силы перетаскивания.
- Задайте свойства частиц для ячеек MCF-7 и MCF-10A с помощью подузла Свойства частиц . Выберите свойства частиц из параметров в разделе Глобальное определение .
- Добавьте подузел Drag Force , чтобы назначить диэлектрофоретическую силу обоим типам ячеек.
- Добавьте свойства частиц в этом случае из раздела параметров. Добавьте подузел Shell для моделирования клеток млекопитающих.
- На вкладке «Главная» выберите «Добавить сетку» и выберите « Тонкая сетка». Выберите «Построить сетку » на вкладке «Главная», чтобы создать сетку.
- На вкладке «Главная» нажмите « Добавить исследование», чтобы добавить три шага исследования. Этап исследования 1 предназначен для моделирования частотной характеристики; использовать подузел частотной области .
- Чтобы смоделировать ползучий поток, выберите узел Стационарное исследование . Добавьте два зависящих от времени шага для моделирования условий с диэлектрофоретической силой и без диэлектрофоретической силы.
- Для параметра отсутствие диэлектрофоретического состояния выберите «Физика и выбор переменных», установите флажок « Изменить конфигурацию модели » для этапа исследования и отключите диэлектрофоретический шаг. Для диэлектрофоретических состояний не отключайте. Сохраните файл и нажмите Compute для запуска моделирования.
ПРИМЕЧАНИЕ: Микрофлюидный чип, предназначенный для сортировки неметастатических клеток рака молочной железы (MCF-7) и неопухолевых эпителиальных клеток молочной железы (MCF-10A), имеет два отдельных входа для потока клеточной смеси и для гидродинамической фокусировки потока, соответственно, шириной 20 мкм и 40 мкм соответственно, как показано на дополнительном рисунке 1 и дополнительном рисунке 2. - Назначьте частоту (f0) под подузлом частотной области и напряжение с помощью подузла «Электрический потенциал » на строгальные электроды (шириной 295 мкм), размещенные вдоль верхней боковой стенки сортировочной камеры. На выходе используйте условие стенки «заморозки» для визуализации отсортированных частиц.
2. Математическая модель и вычислительный анализ
- Проверьте рабочие параметры для разделения неметастатических клеток рака молочной железы и неопухолевых эпителиальных клеток молочной железы внутри микрофлюидного устройства, организовав вычислительное гидродинамическое исследование (CFD).
ПРИМЕЧАНИЕ: Для этой цели использовалось программное обеспечение Multiphysics (ac/DC, microfluidics и модули отслеживания частиц). Управляющие уравнения и теоретические основы подробно изложены в Дополнительном файле 1. Модель была протестирована с использованием диэлектрических свойств неметастатических клеток рака молочной железы (MCF7) и неопухолевых эпителиальных клеток молочной железы (MCF-10A), о которых сообщается в литературе31,32, которые обобщены в таблице 1. - Выполните моделирование CFD путем введения неметастатического рака молочной железы (MCF7) и неопухолевых эпителиальных (MCF-10A) клеточных линий с соотношением 1:1 на входе клеточной смеси.
- Первоначально выполните исследование независимости сетки для оптимизации размера ячеек для моделирования33.
ПРИМЕЧАНИЕ: Было проведено исследование независимости сетки для поиска наилучшего решения для рабочих параметров. Набор из пяти различных размеров ячеек был выбран для количественной оценки наилучшего возможного размера элемента для конвергенции решения. Было отмечено, что, когда общее число элементов, определяющих сетку, составляло 635 (более грубая сетка), как показано на дополнительном рисунке 3А, эффективность сортировки была самой низкой, причем некоторые ячейки MCF7 перемещались в нижнее выходное отверстие, как показано на дополнительном рисунке 3B. Когда размер ячеек был увеличен до мелкого, количество элементов, определяющих сетку, также увеличилось до 2 288. Эффективность сортировки в этом случае была на максимуме, причем ячейки MCF7 и MCF-10A двигались к своим соответствующим выходам. Также была смоделирована более тонкая сетка, при этом количество элементов, определяющих сетку, увеличилось до 3 188. Эффективность сортировки оставалась неизменной и после этого момента. Следовательно, мы можем смело сказать, что мелкий размер сетки работает лучше всего в нашем случае. - Решите два набора исследований CFD.
- Для первого набора щелкните правой кнопкой мыши исследование 1 и добавьте подузел Параметрическая очистка . Нажмите знак + , чтобы добавить проводимость жидкой среды «σм» в качестве переменной развертки. Выполнить параметрическое разверточное исследование проводимости текучей среды σм в диапазоне от 0,01 См/м до 2,5 См/м, сохранив приложенную частоту, f (Гц), постоянной при значении 800 кГц.
- Для второго набора провести параметрическое исследование развертки , изменяя применяемую частоту переменного тока от 100 кГц до 100 МГц, сохраняя при этом проводимость текучей среды, σм, зафиксированную на уровне 0,4 См/м для каждого случая. Это значение σm было выбрано на основе результатов первого исследования CFD, поскольку при этом значении наблюдалось максимальное разделение между MCF-7 и MCF-10A.
- Сила силы диэлектрофореза (DEP), FDEP (-), оказываемой на диэлектрическую сферическую частицу в проводящей среде, задается уравнением 1T34:
ФДЭП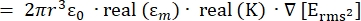 [1]
[1]
Используйте уравнение 1 под подузлом диэлектрофоретической силы. В уравнении 1 r показывает радиус частицы, к которой применяется FDEP; K (-) известен как фактор Клаузиуса-Моссотти; εm(-) показывает диэлектрическую проницаемость среды; и E(V/m) — среднеквадратичное значение электрического поля. - Используйте уравнение 2 для сферической частицы под подузлом диэлектрофоретической силы.
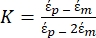 [2]
[2]
В уравнении 2 (-) показывает комплексную диэлектрическую проницаемость частицы,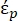 к которой приложена сила DEP;
к которой приложена сила DEP; 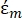 (-) показывает комплексную диэлектрическую проницаемость жидкости, окружающей частицу. Комплекс диэлектрических проницаемости
(-) показывает комплексную диэлектрическую проницаемость жидкости, окружающей частицу. Комплекс диэлектрических проницаемости 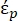 определяется следующим
определяется следующим 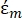 образом35:
образом35: - Используйте уравнение 3 для сферической частицы под подузлом диэлектрофоретической силы:
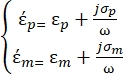 [3]
[3]
В уравнении 3 εp (-) показывает действительную часть комплексной диэлектрической проницаемости частицы; εm (-) показывает реальную часть комплексной диэлектрической проницаемости жидкости, окружающей частицу; σp (S/m) показывает проводимость частиц; σм (S/m) показывает проводимость среды, окружающей частицу; и ω (Гц) — частота приложенного электрического поля.
ПРИМЕЧАНИЕ: Знак Re(K) определяет полярность FDEP. Если знак Re(K) отрицательный, то частица испытывает отрицательную диэлектрофоретическую силу (nDEP); вопреки этому, если знак Re(K) положительный, он подразумевает положительную диэлектрофоретическую силу (pDEP). Для фактора Клаузиуса-Моссотти (K) вариация находится в диапазоне от -1 до 1.
- Первоначально выполните исследование независимости сетки для оптимизации размера ячеек для моделирования33.
- Используйте модифицированную форму уравнения 3 для моделирования биологических клеток, таких как клетки млекопитающих, которые являются более сложными и имеют многослойную структуру.
К (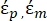 ) =
) = 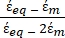 [4]
[4]
В уравнении 4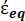 (-) включает в себя как комплексную диэлектрическую проницаемость цитоплазмы,
(-) включает в себя как комплексную диэлектрическую проницаемость цитоплазмы, 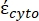 (-), так и комплексную диэлектрическую проницаемость клеточной мембраны (
(-), так и комплексную диэлектрическую проницаемость клеточной мембраны ( 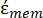 -) и дается следующим образом:36
-) и дается следующим образом:36 - Используйте формулу 5 для решения "
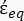 ":
":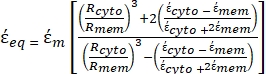 [5]
[5]
В уравнении 5 Rцито (m) и Rmem (m) показывают радиус цитоплазмы клетки и клеточной мембраны соответственно. - Затем используйте уравнение 4 для построения Re(K) как функции приложенного электрического поля как для раковых, так и для здоровых клеток. Рассчитайте действительную часть фактора Клаузиуса-Моссотти (CM), Re(K), чтобы количественно оценить диэлектрофоретическую силу (DEP), которую испытывает частица.
- Щелкните правой кнопкой мыши узел Результаты , добавьте подузел Оценка частиц и в разделе выражений введите fpt.deff1.K , чтобы построить коэффициент CM для частицы 1 и fpt.deff2.K для частицы 2.
ПРИМЕЧАНИЕ: Все шаги протокола, перечисленные в основном тексте, можно посмотреть в видео протокола (Видео 1).
Access restricted. Please log in or start a trial to view this content.
Результаты
Исследование оптимальных операционных параметров для эффективной сортировки на основе DEP неметастатических клеток рака молочной железы (MCF-7) и неопухолевых эпителиальных клеток молочной железы (MCF-10A)
Для достижения успешного разделения неметастатических клеток рака молоч?...
Access restricted. Please log in or start a trial to view this content.
Обсуждение
Ранее сообщалось о микрофлюидных устройствах для клеточной культуры, улавливания и сортировки 47,52,53. Изготовление этих устройств в чистом помещении является дорогостоящим процессом, и крайне важно количественно оценить производител?...
Access restricted. Please log in or start a trial to view this content.
Раскрытие информации
Авторы заявляют об отсутствии потенциальных конфликтов интересов.
Благодарности
Это исследование было поддержано Комиссией по высшему образованию Пакистана.
Access restricted. Please log in or start a trial to view this content.
Материалы
| Name | Company | Catalog Number | Comments |
| COMSOL | COMSOL | multiphysics simulation software |
Ссылки
- Liang, L., et al. Microfluidic-based cancer cell separation using active and passive mechanisms. Microfluidics and Nanofluidics. 24 (4), 26(2020).
- Damiati, S., Kompella, U. B., Damiati, S. A., Kodzius, R. Microfluidic devices for drug delivery systems and drug screening. Genes. 9 (2), 103(2018).
- Pashayan, N., et al. Personalized early detection and prevention of breast cancer: ENVISION consensus statement. Nature Reviews Clinical Oncology. 17 (11), 687-705 (2020).
- Panesar, S., Neethirajan, S. Microfluidics: Rapid diagnosis for breast cancer. Nano-micro Letters. 8 (3), 204-220 (2016).
- Chen, J., Li, J., Sun, Y. Microfluidic approaches for cancer cell detection, characterization and separation. Lab on a Chip. 12 (10), 1753-1767 (2012).
- Beech, J. P., Holm, S. H., Adolfsson, K., Tegenfeldt, J. O. Sorting cells by size, shape and deformability. Lab on a Chip. 12 (6), 1048-1051 (2012).
- Kang, Y., Li, D. Electrokinetic motion of particles and cells in microchannels. Microfluidics and Nanofluidics. 6 (4), 431-460 (2009).
- Schmid, L., Weitz, D. A., Franke, T. Acoustic microfluidic fluorescence-activated cell sorter. Lab on a Chip. 14 (19), 3710-3718 (2014).
- Yu, B. Y., Elbuken, C., Shen, C., Huissoon, J. P., Ren, C. L. An integrated microfluidic device for the sorting of yeast cells using image processing. Scientific Reports. 8, 3550(2014).
- Asiaei, S., Darvishi, V., Davari, M. H., Zohrevandi, D., Moghadasi, H. Thermophoretic isolation of circulating tumor cells, numerical simulation and design of a microfluidic chip. Journal of Thermal Analysis and Calorimetry. 137 (3), 831-839 (2019).
- Song, Y., Li, M., Pan, X., Wang, Q., Li, D. Size-based cell sorting with a resistive pulse sensor and an electromagnetic pump in a microfluidic chip. Electrophoresis. 36 (3), 398-404 (2014).
- Giraud, G., et al. Dielectrophoretic manipulation of ribosomal RNA. Biomicrofluidics. 5 (2), 024116(2011).
- Valero, A., Braschler, T., Demierre, N., Renaud, P. A miniaturized continuous dielectrophoretic cell sorter and its applications. Biomicrofluidics. 4 (2), 022807(2010).
- Allahrabbi, N., Chia, Y. S. M., Saifullah, M. S. M., Lim, K. M., Lanry Yung, L. Y. A hybrid dielectrophoretic system for trapping of microorganisms from water. Biomicrofluidics. 9 (3), 034110(2015).
- Vykoukal, D. M., Gascoyne, P. R. C., Vykoukal, J. Dielectric characterization of complete mononuclear and polymorphonuclear blood cell subpopulations for label-free discrimination. Integrative Biology: Quantitative Biosciences from Nano to Macro. 1 (7), 477-484 (2009).
- Shim, S., et al. Antibody-independent isolation of circulating tumor cells by continuous-flow dielectrophoresis. Biomicrofluidics. 7 (1), 11807(2013).
- Jeon, H. J., Lee, H., Yoon, D. S., Kim, B. M. Dielectrophoretic force measurement of red blood cells exposed to oxidative stress using optical tweezers and a microfluidic chip. Biomedical Engineering Letters. 7 (4), 317-323 (2017).
- Song, H., et al. Continuous-flow sorting of stem cells and differentiation products based on dielectrophoresis. Lab on a Chip. 15 (5), 1320-1328 (2015).
- Tsai, S. L., Chiang, Y., Wang, M. H., Chen, M. K., Jang, L. S. Battery-powered portable instrument system for single-cell trapping, impedance measurements, and modeling analyses. Electrophoresis. 35 (16), 2392-2400 (2014).
- Chan, J. Y., et al. Dielectrophoresis-based microfluidic platforms for cancer diagnostics. Biomicrofluidics. 12 (1), 011503(2018).
- Patel, S., et al. Microfluidic separation of live and dead yeast cells using reservoir-based dielectrophoresis. Biomicrofluidics. 6 (3), 34102(2012).
- Yildizhan, Y., Erdem, N., Islam, M., Martinez-Duarte, R., Elitas, M. Dielectrophoretic separation of live and dead monocytes using 3D carbon-electrodes. Sensors. 17 (11), 2691-2704 (2017).
- Piacentini, N., Mernier, G., Tornay, R., Renaud, P. Separation of platelets from other blood cells in continuous-flow by dielectrophoresis field-flow-fractionation. Biomicrofluidics. 5 (3), 34122(2011).
- Zhao, K., Duncker, B. P., Li, D. Continuous cell characterization and separation by microfluidic alternating current dielectrophoresis. Analytical Chemistry. 91 (9), 6304-6314 (2019).
- Valero, A., et al. Tracking and synchronization of the yeast cell cycle using dielectrophoretic opacity. Lab on a Chip. 11 (10), 1754-1760 (2011).
- Demierre, N., Braschler, T., Muller, R., Renaud, P. Focusing and continuous separation Of cells in a microfluidic device using lateral dielectrophoresis. International Solid-State Sensors, Actuators and Microsystems Conference. 430 (98), 1777-1780 (2007).
- Arslan, Z. C., Yalçın, Y. D., Külah, H. Label-free enrichment of MCF7 breast cancer cells from leukocytes using continuous flow dielectrophoresis. Electrophoresis. 43 (13-14), 1531-1544 (2022).
- Turcan, I., Olariu, M. A. Dielectrophoretic manipulation of cancer cells and their electrical characterization. ACS Combinatorial Science. 22 (11), 554-578 (2020).
- Park, J., et al. Sequential cell-processing system by integrating hydrodynamic purification and dielectrophoretic trapping for analyses of suspended cancer cells. Micromachines. 11 (1), 47(2020).
- Hussein, M., et al. Breast cancer cells exhibits specific dielectric signature in vitro using the open-ended coaxial probe technique from 200 MHz to 13.6 GHz. Scientific Reports. 9, 4681(2019).
- Fornes-Leal, A., Garcia-Pardo, C., Frasson, M., Pons Beltrán, V., Cardona, N. Dielectric characterization of healthy and malignant colon tissues in the 0.5-18 GHz frequency band. Physics in Medicine and Biology. 61 (20), 7334-7346 (2016).
- Çetin, B., Li, D. Dielectrophoresis in microfluidics technology. Electrophoresis. 32 (18), 2410-2427 (2011).
- Khan, S., Khulief, Y. A., Al-Shuhail, A. A. Effects of reservoir size and boundary conditions on pore-pressure buildup and fault reactivation during CO2 injection in deep geological reservoirs. Environmental Earth Sciences. 79, 294(2020).
- Adams, T. N. G., Turner, P. A., Janorkar, A. V., Zhao, F., Minerick, A. R. Characterizing the dielectric properties of human mesenchymal stem cellsand the effects of charged elastin-like polypeptide copolymer treatment. Biomicrofluidics. 8 (5), 054109(2014).
- Lo, Y. J., et al. Measurement of the Clausius-Mossotti factor of generalized dielectrophoresis. Applied Physics Letters. 104, 083701(2014).
- Lo, Y. J., Lei, U. Measurement of the real part of the Clausius-Mossotti factor of dielectrophoresis for Brownian particles. Electrophoresis. 41 (1), 137-147 (2020).
- Ohta, A. T., et al. Optically controlled cell discrimination and trapping using optoelectronic Tweezers. IEEE Journal of Selected Topics in Quantum Electronics. 13 (2), 235-242 (2007).
- Sun, T., Morgan, H. Single-cell microfluidic Impedance cytometry. Microfluidics and Nanofluidics. 8 (4), 423-443 (2010).
- Weng, P. Y., et al. Size-dependent dielectrophoretic cross-over frequency of spherical particles. Biomicrofluidics. 10 (1), 1909-1921 (2016).
- Lu, Y. W., Sun, C., Kao, Y. C., Hung, C. L., Juang, J. Y. Dielectrophoretic cross-over frequency of single particles: Quantifying the effect of surface functional groups and electrohydrodynamic flow drag force. Nanomaterials. 10 (7), 1364(2020).
- Henslee, E. A., Sano, M. B., Rojas, A. D., Schmelz, E. M., Davalos, R. V. Selective concentration of human cancer cells using contactless dielectrophoresis. Electrophoresis. 32 (18), 2523-2529 (2011).
- Chan, J. Y., et al. Dielectrophoresis-based microfluidic platforms for cancer diagnostics. Biomicrofluidics. 12 (1), 11503-11525 (2018).
- Gascoyne, P. R. C., Shim, S. Isolation of circulating tumor cells by dielectrophoresis. Cancers. 6 (1), 545-579 (2014).
- Liang, W., et al. Determination of dielectric properties of cells using ac electrokinetic-based microfluidic platform. Micromachines. 11 (5), 513-537 (2020).
- Frusawa, H., et al. Frequency-modulated wave dielectrophoresis of vesicles and cells periodic U-turns at the crossover frequency. Nanoscale Research Letters. 13 (169), 2583-2589 (2018).
- Wei, M. T., Junio, J., Ou-Yang, D. H. Direct measurements of the frequency-dependent dielectrophoresis force. Biomicrofluidics. 3 (1), 12003(2009).
- Mustafa, A., Pedone, E., Marucci, L., Moschou, D., Lorenzo, M. D. A flow-through microfluidic chip for continuous dielectrophoretic separation of viable and non-viable human T-cells. Electrophoresis. 43 (3), 501-508 (2021).
- Wang, L., et al. Dual frequency dielectrophoresis with interdigitated sidewall electrodes for microfluidic flow-through separation of beads and cells. Electrophoresis. 30 (5), 782-791 (2021).
- Alazzam, A., Mathew, B., Alhammadi, F. Novel microfluidic device for the continuous separation of cancer cells using dielectrophoresis. Journal of Separation Science. 40 (5), 1193-1200 (2017).
- Yang, L., Banada, P. P., Bhunia, A. K., Bashir, R. Effects of dielectrophoresis on growth viability and immuno-reactivity of listeria monocytogenes. Journal of Biological Engineering. 2, 6(2008).
- Matbaechi, H., Soltani, P., Hölzel, R., Wenger, C. Dielectrophoretic immobilization of yeast cells using CMOS integrated microfluidics. Micromachines. 11 (5), 501-518 (2020).
- Mustafa, A., Pedone, E., La Regina, A., Erten, A. A., Marucci, L. Development of a single layer microfluidic device for dynamic stimulation, culture and imaging of mammalian cells. bioRxiv. , (2022).
- Mustafa, A., et al. Enhanced dissolution of liquid microdroplets in the extensional creeping flow of a hydrodynamic trap. Langmuir. 32 (37), 9460-9467 (2016).
- Chang, H. F., Chou, S. E., Cheng, J. Y. Electric-field-induced neural precursor cell differentiation in microfluidic devices. Journal of Visualized Experiments. (170), e61917(2021).
Access restricted. Please log in or start a trial to view this content.
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеСмотреть дополнительные статьи
This article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены