Method Article
荧光激活神经元核负分选结合单核RNA测序研究海马神经源性生态位
摘要
这里介绍的是从小鼠齿状回分离的单个细胞核测序的方法,该方法通过荧光激活细胞核(FAN)分选排除大多数神经元。这种方法可生成高质量的表达谱,并促进对生态位中代表的大多数其他细胞类型的研究,包括神经干细胞等稀缺群体。
摘要
成人海马神经发生(AHN)包括终生维持齿状回(DG)亚颗粒区(SGZ)内的增殖和静止神经干细胞(NSC),以及它们从新生神经元分化为颗粒细胞层中的颗粒细胞,已在众多研究中得到充分验证。使用转基因动物,特别是啮齿动物,是研究调节AHN的信号通路和研究构成海马神经源性生态位的每种细胞类型的作用的宝贵工具。为了解决后者,将单核分离与下一代测序相结合的方法在AHN领域产生了重大影响,以识别每个细胞群的基因特征。然而,需要进一步完善这些技术,以对DG内更稀有的细胞群进行表型分析。在这里,我们提出了一种方法,该方法利用荧光激活细胞核分选(FANS)从新鲜解剖的DG中分离的单个细胞核悬浮液中排除大多数神经元群,方法是为NeuN抗原选择未染色的细胞核,以便进行单核RNA测序(snRNA-seq)。这种方法是进一步研究AHN的细胞间调节和发现跨物种的新细胞标志物和机制的潜在垫脚石。
引言
成年期海马神经元的连续生成,也称为成人海马神经发生(AHN),与学习、记忆获取/清除和模式分离等认知功能有关,似乎是衰老和神经退行性疾病中预防认知缺陷的恢复力的重要机制1,2,3.啮齿动物一直是使用多种方法研究AHN的首选模型,包括免疫细胞化学和下一代测序(NGS)方法。将这些结果转化为其他物种仍然存在争议。事实上,AHN已经在大多数物种中观察到,但它在一生中持续存在的程度,特别是在人类4,5,6,7,8中,经常引起争论。
迄今为止,已经确认了各种内在和外在信号通路来调节AHN1。然而,细胞间通讯对AHN的影响才刚刚出现9。这可能首先归因于目前已知的细胞标记物的特异性不足,无法对转基因动物进行 体内 分析。事实上,许多研究依赖于在多种细胞类型中表达的双皮质素或神经胶质原纤维酸性蛋白(GFAP)等标志物1。其次,成年海马生态位10 的复杂性和高度的细胞多样性为分析每种细胞类型带来了技术挑战。对于生物信息学分析尤其如此,在不同人群(例如 NSC 或神经胶质细胞)的分析管道中使用重叠的细胞标记物,在评估 AHN7,11 时导致有争议的结论。第三,大量的神经元破坏了对不太丰度的细胞群的研究,如星形胶质细胞、少突胶质细胞或室管膜细胞,尽管它们在AHN微调调节中的作用正变得越来越突出9。总之,这些限制影响了将啮齿动物的结果转化为其他物种的能力。由于难以在 体外 概括复杂组织(例如海马神经源性生态位)以及获取高质量组织的许多障碍以及在涉及人体组织的研究中缺乏标准化的组织处理方案,这尤其被放大了12,13。因此,开发新的方法来分析细胞群并鉴定齿状回(DG)内的新细胞标志物至关重要,最终将更好地了解每种细胞类型对AHN调节的不同贡献。
为了实现这一目标,单细胞(sc)和单核(sn)分离与RNA测序相结合已成为研究复杂组织(如DG14)的工具。因此,从小鼠成年海马生态位中分离单细胞的细胞富集策略主要用于检查NSC15,16。通过对 GluR1/Cd24 双阴性单细胞进行测序,应用了一种从 DG 富集非神经元细胞的有趣策略,在生物信息学分析后,1,408 个细胞被测序,星形胶质细胞和 NSC 之间没有明显的簇17。这可能是由于单细胞制备所需的苛刻酶消化会破坏细胞完整性和RNA。为了绕过这一技术问题,已经开发了几种使用单核分离的方法,这些方法特别适用于复杂的组织11,18。然而,DG内神经元的优势或更广泛的海马内嗅系统内神经元的优势会产生采样偏差,以研究这些大脑区域内存在的全部细胞群。此外,用于制备单细胞文库的上样细胞数量有限,这突出了测序单核分析管道中主要细胞群的存在。事实上,大型神经元簇经常被注释和分析,而其他细胞群则代表性不足或遗漏5,11。
为了克服这些偏差并能够分析小鼠DG中存在的神经元以外的细胞类型,本研究使用荧光激活细胞核分选(FANS)18 的原理设计了一种方法,该方法通过阴性选择带有神经元核抗原(NeuN, 也称为 Rbfox3)。这种抗原的选择受到将NeuN描述为可靠神经元标志物19 的文献的指导,并且有必要使用核蛋白进行这种方法。然后将NeuN阴性FACS分选的细胞准备在10x基因组学平台上进行RNA测序。结果表明,排除表达NeuN的细胞可以对神经胶质和稀有细胞群进行细胞类型特异性,高质量的转录组学分析。
研究方案
动物护理和实验程序是根据弗朗西斯·克里克研究所的指导方针以及英国内政部的指导方针和法律进行的。
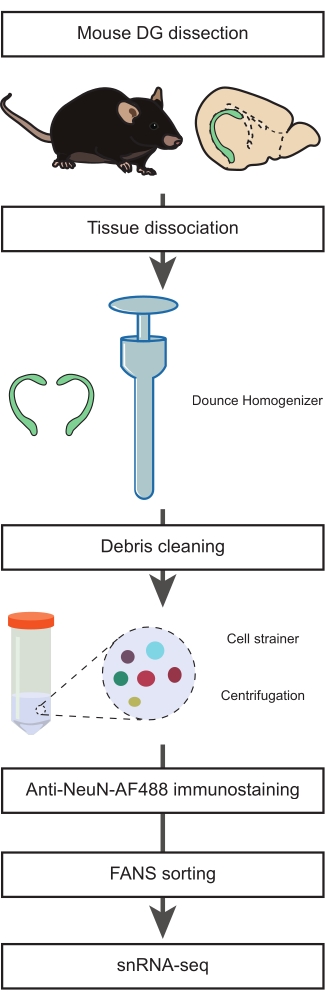
图 1:从成年小鼠解剖的 DG 制备用于非神经元群体 snRNA-seq 的单个细胞核悬液。 流程图描述了协议的主要步骤,包括解剖小鼠DG,制备单核悬浮液,NeuN免疫染色和阴性NeuN-FANS分选,然后再进行snRNA-seq。 请点击此处查看此图的大图。
1. 危险品解剖(时间:15分钟)
- 制备细胞核分离介质 1 和 2(NIM1 和 NIM2)、匀浆缓冲液 (HB) 和洗涤培养基 (WM)(补充表 1)。将所有缓冲液、培养基、试剂和工具放在冰上,直到需要为止。在制备过程中将Dounce均质机(见 材料表) 放在冰上(均质步骤前至少1小时)。
注意:NIM1可以制备并在4°C下储存长达6个月。NIM2、HB 和 WM 应新鲜制备。
注意:小心操作DTT,蛋白酶抑制剂和Triton X-100。这些化合物对皮肤和眼睛有刺激性,有剧毒,对水生环境有害。使用这些化学品时,请戴上防护手套、衣服、眼睛和面部防护装置,处理后彻底洗手,并避免释放到环境中。 - 按照内政部附表 1 程序对 22 个月大的雄性 C57Bl/6J 小鼠实施颈椎脱位安乐死20.
注意:有关在本研究中使用22个月大的小鼠的基本原理,请参阅讨论。但是,该协议可以在整个生命周期中的任何年龄执行。 - 从安乐死小鼠中解剖大脑,并将其转移到装有冰冷的1x PBS的10厘米培养皿中(图1)。将培养皿放在冰上。用手术刀切除小脑,在两个半球之间(沿着矢状轴)将大脑切成两半。
- 用冰冷的PBS填充一个新的10厘米培养皿,并将其放在冰上。将大脑的一半转移到新的培养皿中。使用双筒望远镜解剖出DG并重复此步骤,从大脑的后半部分获得第二个DG。
注意:这些步骤(步骤1.2-1.4)改编自先前描述的过程21。重要的是在这个阶段尽快进行,以保持细胞的完整性。 - 将两个 DG 转移到预冷的 Dounce 均质器中,并加入 1 mL 冷 HB。
2.组织解离,单核分离和抗NeuN免疫染色(时间:2小时)
- 用松散的"A"杵10笔使组织匀浆,然后用紧密的"B"杵敲击15次。
注意:应用砂浆在冰上轻轻敲击进行弹跳均质,以减少摩擦和起泡引起的热量。在手术过程中,所有缓冲液和设备都应预冷并保持在冰上。 - 将匀浆转移到预冷的 15 mL 管中;用 1 mL 冷 HB 冲洗 Dounce 均质器,并合并到同一管中。向 15 mL 管中加入 3 mL HB,并在冰上孵育 5 分钟。轻轻倒置试管混合 2 倍。
- 在 50 mL 试管上用 0.5 mL HB 预润湿 70 μm 过滤器帽。通过将 15 mL 管轻轻翻倒到细胞过滤器中来过滤步骤 2.2 中的细胞核悬浮液。用 0.5 mL HB 洗涤细胞过滤器。
- 取出细胞过滤器并使用水平桶离心机在4°C下以500× g 离心试管5分钟。弃去上清液。
注意:过滤匀浆将有助于减少碎片,这对于流式细胞术和snRNA-seq下游步骤至关重要。 - 使用 P1000 移液管将沉淀轻轻重悬于 4 mL HB 中。在冰上孵育5分钟。在4°C下以500× g 旋转10分钟。 弃去上清液并将沉淀重悬于3mL WM中。
- 在含有 0.5 mL WM 的 15 mL 试管上预润湿 35 μm 滤网帽。 通过细胞过滤器过滤步骤 2.5 中的细胞核悬浮液,使用 P1000 移液器一次轻轻移液 0.5 mL。
- 用 0.5 mL WM 清洗滤网帽,然后将试管放在冰上。将滤液转移到新的15mL管中,并在500× g下离心5分钟和4°C。弃去上清液并将沉淀重悬于3mL WM中。
- 在4°C下以500× g 旋转5分钟。 弃去上清液,用小鼠抗NeuN,Alexa Fluor 488偶联抗体(抗NeuN-AF488,1:32,000)和1μg/ mL DAPI将沉淀重悬于1 mL WM中。在黑暗中在冰上孵育45分钟。
注意:为了优化分离细胞核的免疫染色,建议滴定抗体以确定流式细胞术分析和分选的最佳稀释度。然后,运行足够的对照以确认染色条件是最佳的。例如,对于偶联的抗NeuN-AF488抗体,运行阴性对照(即不添加抗体,补充图1A)和阳性对照(即用抗体染色,补充图1B)以评估未染色和染色群体的分离。 开始使用AF488偶联抗体时,建议运行AF488偶联同种型对照以评估特异性。如果使用非偶联抗体,则可能需要额外的控制,例如仅将二抗添加到细胞核制剂中,以评估二抗的非特异性结合。
3. 荧光激活细胞核分选 (FANS) 以排除神经元群(时间:45 分钟)
- 将免疫染色的细胞核悬浮液转移到 5 mL 试管中,并将其放在冰上,直到流式细胞术程序开始。
注意:如果处理的组织块大于两个小鼠DG,则可能需要用WM缓冲液进一步稀释,以避免在溶液中的细胞核密度变高时堵塞FACS。 - 在将试管放入FACS仪器之前,以低速涡旋样品3秒(见 材料表)。
注意:(FACS 设置)分拣机需要在程序开始时按照制造商的建议与校准颗粒对齐。根据FACS模型,用珠子或微球(见 材料表)校准液滴延迟。样品在纯度模式下在4°C下分选。为了减少收集体积,细胞核在流式细胞仪的推荐压力下通过70 μm喷嘴进行分选。将细胞核分选到含有50 μL WM的1.5 mL低结合管(参见 材料表)中。所有收集管均在4°C下涂覆PBS + 5%BSA过夜,以降低细胞核粘附在管壁上的风险。 - 要从染色的细胞核悬浮液样品中获取数据,请将门设置为DAPI高度和DAPI区域,以排除细胞碎片和聚集的细胞核(图2A)。此外,通过在对数侧向散射(SSC)区域和对数前向散射(FCS)区域中设置门,将单个细胞核与任何剩余的DAPI染色聚集体或细胞碎片分开(图2B)。
- 设置抗NeuN-AF488和FSC区域的门,以隔离NeuN-AF488阴性群体,如图 2C所示。
- 分析后,使用上述门控策略,在装有 50 μL WM 的 1.5 mL 收集管中对 NeuN-AF488 阴性群体进行分类。
注意:按照上述门控策略和解剖程序将DG从成年小鼠的大脑中分离出来,NeuN-AF488阴性群体预计将占单核的~14%。
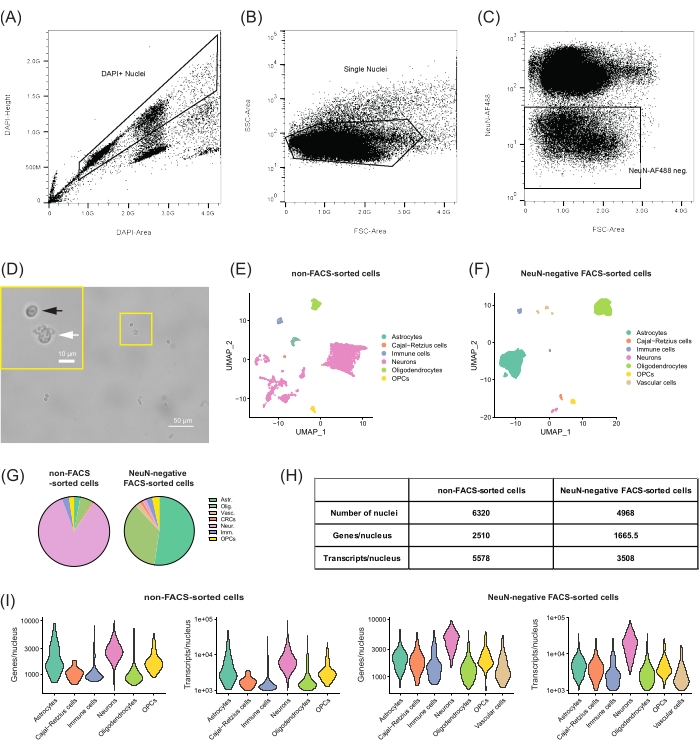
图2:从DG中分离和转录组学分析非神经元细胞群。 (A-C)分离NeuN-AF488阴性单核并排除细胞碎片的门控策略。(A) 分离细胞核代表性样品的 FANS 点图,描绘了选择 DAPI+ 细胞核和排除细胞碎片和聚集体的门设置。(B)使用FSC区域和SSC区域进一步选择相关的单核。(C)NeuN-AF488的门排除阳性群体并排序为负单核。(D)与劣质细胞核(白色箭头)相比,具有最少碎片量和更高比例的优质细胞核(圆形,黑色箭头)的良好单核悬浮液的显微照片。比例尺 = 50 μm, 10 μm(插图)。(中、女)分析snRNA-seq数据并分析从22个月大的C57BL / 6J雄性小鼠的DG中分离的不同细胞群。来自 (E) 非 FACS 分选细胞和 (F) NeuN 阴性 FACS 分选细胞的单核轮廓的统一流形近似和降维投影 (UMAP) 图,按细胞类型着色。(G)饼图比较两个样本中识别的细胞类型的频率。(H)测序样本的相应指标:细胞核数,基因中位数和每个细胞核的转录本。(I)小提琴图,显示两种样本中每种细胞类型检测到的基因和转录本数量的分布。阿斯特。=星形胶质细胞,奥利格。=少突胶质细胞,Vasc。= 血管细胞,CRC = Cajal-Retzius 细胞,神经。 = 神经元,Imm。=免疫细胞,OPCs=少突胶质细胞前体细胞。请点击此处查看此图的大图。
4. 制备单核悬浮液以进行单核RNA测序(时间:30分钟)
- 分选后,向收集管中加入1mL含有1%BSA的PBS,以收集管壁上的液滴,并在4°C下以500× g 旋转5分钟。 弃去上清液,留下50μL。
注意:小心处理离心的细胞核,因为可能很难观察到管底部的任何沉淀。使用摆动桶离心机将有助于丢弃上清液而不会破坏沉淀。 - 轻轻移液以重悬离心细胞核。在 0.5 mL 微管中将 5 μL 细胞核悬浮液加入 5 μL 台盼蓝中。
注意:小心处理台盼蓝,因为它对健康有害,可能导致癌症,并怀疑会损害生育能力或未出生的孩子。戴防护手套、衣服以及眼睛和面部防护装置。在阅读并理解所有安全预防措施之前,请勿处理。 - 使用血细胞计数器或自动细胞计数器测量浓度并评估单细胞悬液的活力(参见 材料表)。按照步骤5中的说明对细胞核进行文库制备和测序。
注意:被认为具有良好的测序质量的样品在显微镜下显示出圆形和规则的细胞核形状,没有细胞碎片(图2D)。核膜周围存在光晕或多个细胞核聚集在一起是细胞核受损的迹象,不应考虑snRNA-seq的这种细胞悬液(图2D)。测量的细胞核浓度在300-700个细胞核/μL的范围内。
5. 文库制备和测序
注意:以下步骤的描述基于本研究中使用的内部测序平台(见 材料表)。因此,使用其他平台时,某些设置可能会有所不同。在这里,仅描述了关键步骤,并且应根据所选制造商的指导和协议确定每个参数,尽管在首次使用前进行了优化。确保在浓缩分选的细胞核悬浮液后尽快进行文库制备至关重要,以避免RNA降解并确保最佳的测序质量。
- 将 7,000 到 10,000 个细胞核加载到微流体单细胞芯片中。
- 使用提供的控制器和所选供应商的试剂以纳升级液滴对加载的细胞核进行分区。在每个液滴内裂解细胞核并逆转录RNA。
注意:在液滴内,所有产生的cDNA共享相同的细胞条形码。 - 按照所选供应商的指南制备 snRNA-seq 文库,并确保与测序平台的兼容性。使用电泳、荧光测定或基于 qPCR 的方法检查最终文库的质量和浓度,如果适用,在测序前将它们等摩尔合并。
- Denature汇集了3'基因表达文库,并根据制造商的建议进行稀释。
- 在下一代测序平台上执行配对端、单索引或双索引测序,每个细胞的测序深度为 50,000 个读对。
结果
这里介绍的方案描述了一种制备从DG分离的非神经元单核悬浮液以执行snRNA-seq的方法。有或没有FANS,生物信息学聚类揭示了与DG内已知细胞类型相对应的分离良好的细胞核组(图2E,F)。在非FACS分选的样品中,测序的大多数高质量细胞核由三组神经元组成(该样品占总细胞核的84.9%, 图2E,G,H)。考虑到DG中最具代表性的细胞群是颗粒神经元,其他兴奋性神经元(标记的兴奋性神经元)和抑制性神经元10,这样的结果是预期的。鉴定的非神经元簇主要由神经胶质细胞类型(11.1%)组成,包括星形胶质细胞、少突胶质细胞和少突胶质细胞前体细胞(OPCs)、免疫细胞(3.3%)和Cajal-Retzius细胞(0.6%)。当进行 FANS 以排除 NeuN 阳性群体(NeuN 阴性 FACS 分类样品; 图2F,G,H),神经胶质细胞簇占主导地位(81.3%)。分离更多数量的神经胶质细胞核可以更好地分割不同的种群,这些种群将在没有FANS的情况下聚集在一起。事实上,在重新聚类和分析在NSCs或星形胶质细胞中表达的特定基因时,分离出四个亚簇(补充图2A,B)。观察更特异性的细胞标志物并评估不同细胞类型的基因表达水平,检测到一小簇NSCs与主要星形胶质细胞群体分开分离,Hopx和Notch2表达较高,Aldh1a1或Aqp4几乎没有表达(补充图2C)。然而,由于星形胶质细胞和NSC之间的基因表达重叠,需要进一步的分析来特异性分析和鉴定不同的细胞亚型。此外,NeuN阴性FANS样品具有标记为血管细胞(2.3%)的其他簇,当交叉引用细胞特异性标志物表达时,这些簇包含内皮细胞,周细胞和血管软脑膜细胞(数据未显示)。
按照所选方案的指导生成测序文库,无论是否使用FANS,均可获得高质量的表达谱。对于以 50,000 个读数/细胞核测序的样品,在过滤掉低质量的细胞核后,非 FACS 分类样品(5,578 个转录本,图 2H)平均每个细胞核检测到 2,510 个基因,NeuN 阴性 FANS 样品平均每个细胞核检测到 1,665.5 个基因(3,508 个转录本)(图 2H,I)。这些指标证实,该协议可生成与使用不同方法的研究相当的高质量单核转录组学分析22,23,并且FACS分选过程不会破坏后续snRNA-seq的细胞核。值得注意的是,两个样本之间每个细胞核的基因和转录本数量的差异不是由于数据质量较低,而是由于非FACS分类样本中神经元的比例高(84.9%,而NeuN阴性FANS样本为1.7%),其转录活性(非FACS分选样本中的2,660个基因/细胞核和6,170个转录本/细胞核)高于所有非神经元细胞类型(1,090个基因/细胞核和1,785 转录本/细胞核,图2I)。
总之,这些代表性的结果表明,使用FANS选择NeuN阴性细胞核是从新鲜解剖的脑组织中分离低丰度细胞类型并通过snRNA-seq方法 对这些 不同细胞群进行高质量单核转录组学分析的有力工具。
补充图1:FANS免疫染色的验证。 将细胞核悬浮液孵育(A)没有抗NeuN-AF 488抗体作为阴性对照,或(B)孵育抗体并通过FACS分选机以验证免疫染色条件。 请点击此处下载此文件。
补充图2:星形胶质细胞簇的基因表达分析和重新聚类。 (A) 统一流形近似和降维投影 (UMAP) 图,显示基于 图 2F 中全基因组表达谱的 4968 个细胞核的聚类。细胞类型调用是基于细胞类型标记完成的。(B)星形胶质细胞簇由从(A)中选择的2579个细胞核组成,用于进一步的亚组以研究潜在的细胞亚型。通过修拉(0-3)聚类检测到4个亚型,用不同的颜色表示。(C)四种细胞类型中特定细胞标志物的基因表达水平。所有图均使用修拉R包24获得。简而言之,每个细胞的RNA-seq计数通过总表达量归一化,并乘以比例因子(10,000)。然后对日志转换此结果。在应用 UMAP 计算嵌入之前,变换后的值在每个单元格内缩放(方差缩放为 1)并居中(平均值设置为零),这些嵌入用作 x 轴和 y 轴上的值。图形表示二维散点图上降维技术的输出,其中每个点表示一个基于归约技术确定的单元嵌入具有相应 x 和 y 坐标的单元格。具有相似基因特征的细胞通过嵌入物彼此靠近放置。 请点击此处下载此文件。
补充图3:神经源性谱系中NeuN的基因表达分析。 (A) UMAP图显示了来自公开数据集15的神经源性谱系的聚类。UMAP的生成如 补充图2所示。(B)神经源性谱系中特定细胞标记物的基因表达水平,显示星形胶质细胞(水通道蛋白4 = Aqp4),NSC(仅同源域蛋白= Hopx),NeuN / Rbfox3(NSC和中间祖细胞[IPC])和循环细胞(细胞周期蛋白依赖性激酶6 = Cdk6)。 请点击此处下载此文件。
补充表1:研究中使用的培养基和缓冲液的组成。请点击此处下载此文件。
讨论
为了成功执行该协议,DG的解剖是第一个关键步骤,这需要一些练习以保持其不受损坏并限制周围组织的污染。根据经验,熟练的研究人员可以非常快速地从海马体中分离DG,然后他们可以改进他们的技术以提高解剖的速度,从而提高组织的新鲜度以产生高质量的数据。同样,单核的制备和重悬要求在单个实验中使用的不同条件下保持一致,但也要避免过度移液,这可能会破坏核膜释放环境RNA,从而偏倚测序结果。除了前面提到的制备高质量细胞核的建议外,在进行测序之前,还需要考虑单核悬浮液的浓度。事实上,根据制造商的指南,应稀释浓度高于 1,200 nuc/μL 的制剂,因为这种水平的细胞核浓度形成多重物的风险更高,影响下游生物信息学分析。值得注意的是,由于涉及的成本,对细胞核浓度低于 500 nuc/μL 的样品进行测序可能不值得。还建议遵循高级FACS用户的建议来设置所有设门,并与样品和生物重复的设置保持一致。同样,RNA测序文库的制备需要一些培训才能获得高质量的结果,大多数供应商都有很好的支持来有效地实现这一目标。在这项研究中,该方法仅用新鲜组织进行了测试;然而,FANS 也用冷冻组织进行了 25.因此,可以合理地假设该协议可以用冷冻组织执行,尽管进行了轻微的优化。
该协议的开发考虑了特定的下游应用,即研究海马神经源性生态位内神经元以外的细胞群。事实上,越来越多的证据表明,AHN在衰老中的损害可归因于生态位1,2,3,9内的周围细胞。特别是,星形胶质细胞和少突胶质细胞成为AHN的关键调节因子;然而,它们与DG的分离与RNA测序相结合产生了不同的结果,使得用该技术评估这一假设具有挑战性1,17。与未进行FACS分选的样品相比,这种FACS分选NeuN阴性细胞核的方法允许分离更多的星形胶质细胞和少突胶质细胞,从而实现更好的生物信息学分析。该协议适用于整个生命周期的所有年龄段,这里提供的具有代表性的老年动物组织数据提供了一个概念证明,证明该方法对于研究衰老的海马神经源性生态位是稳健的。为了扩大该方法的使用并使其适应不同的生物学问题,重要的是要考虑其他神经元核膜抗原可以与对这些标志物的最佳验证抗体进行彻底滴定一起进行测试。例如,当研究DG中NSC的神经元分化过程时,一些细胞类型(例如2型细胞或神经母细胞)开始表达NeuN(补充图3)。因此,需要另一种抗原来专门研究这些细胞类型。相反,在NeuN阴性FACS分选后,本研究中仍然鉴定出一些神经元,这可能是由于NeuN在这些人群中的表达低或没有表达(例如,皮质Cajal-Retzius神经元19)。此外,据报道,NeuN在少突胶质细胞26的亚群中表达,如果这些亚群感兴趣,可能会产生偏倚的结果。因此,在开始使用FANS时应仔细考虑抗原的选择,以避免包含或排除细胞群,从而排除对特定生物学问题的准确答案。与此一致,还建议在用该协议验证或反驳测试假设之前,通过正交测定(例如,免疫组织化学或RNA范围)进一步验证每个测序结果。最后,涉及FANS的步骤可以进一步发展,以包括一种以上的抗体,并具有更详细的分选策略,以排除和/或包括所需的细胞群。
最终,该协议中描述的技术在与其他物种一起使用时可能会有一些限制。例如,啮齿动物中生态位的定义非常明确,存在增殖和静止的NSC或限制在DG特定亚区域内的新生神经元,但仍然不清楚如何在其他物种中描绘海马神经源性生态位。事实上,增殖细胞在非人灵长类动物和人类的DG连续区域内并不对齐,而是分散在其周围,也可能存在于杏仁核7中。因此,解剖和隔离比其他物种的DG更广泛的区域可能会影响该协议的使用。特别是,在处理较大的组织块27,28时,需要优化用于制备组织的解离和研磨步骤。关于生物信息学分析,虽然近亲繁殖的啮齿动物具有非常同质且注释良好的基因组,但人类基因组的遗传变异性加上细胞标记数量不足,无法清楚地区分不同的细胞群(例如,NSCs和星形胶质细胞)需要大量的归一化进行分析,当识别出一小簇细胞时,可能导致不同的结论7,11.在这种情况下,细胞富集可能仍然是首选,或者应与其他策略一起使用以提高分析能力。
尽管如此,目前的方法可以研究研究不足但潜在重要的细胞群在AHN调节中的作用。星形胶质细胞群体尤其如此,星形胶质细胞在神经退行性疾病的发作和进展中起着核心作用29,30。这项研究表明,只需排除DG中存在的绝大多数神经元,就可以鉴定和分析星形胶质细胞和其他稀有细胞群。使用不同方法的其他研究无法从相同范围的细胞群中实现类似的细胞核回收率5,11,17。此外,这项研究的结果表明,使用这种方法可以在不对该细胞群进行特异性富集的情况下分离NSC簇15。
总之,遵循和改进该方法将是解决与海马神经源性生态位在调节AHN中的上下文作用相关的悬而未决问题的一步。特别是,它可以为与AHN9调节相关的细胞群中衰老和患病大脑中的基因表达水平带来新的见解,支持鉴定NSC1 的潜在异质性或解决脉管系统在AHN中的作用。最终,这种方法可以适用于具有类似问题和问题的其他成体干细胞生态位。
披露声明
SG,TL和SK是Merck Sharp & Dohme LLC的员工,Merck Sharp & Dohme LLC是Merck & Co., Inc.的子公司,位于美国新泽西州Rahway,在美国和加拿大以外被称为MSD。SG是Merck & Co., Inc.(位于美国新泽西州Rahway)的股东。
致谢
作者要感谢Lachlan Harris和Piero Rigo的技术支持,感谢Jason M. Uslaner和Ditte Lovatt对手稿的反馈。这项工作得到了MRC的赠款支持以及与MSD,弗朗西斯克里克研究所的竞争前研究合作的支持,该研究所获得了英国癌症研究中心(FC0010089),英国医学研究委员会(FC0010089),威康信托基金会(FC0010089)的资助,并获得了FG的威康信托研究员奖(106187 / Z / 14 / Z)。我们向许多作者道歉,由于篇幅有限,我们无法讨论和引用他们的作品。
材料
| Name | Company | Catalog Number | Comments |
| 0.5ml microtube | Eppendorf | 30124537 | |
| 10.00µm Flouresbrite YG Carboxylate Microspheres | Polysciences | 15700-10 | |
| 15 mL polypropylene centrifuge tubes | Corning | 430052 | |
| 2 pairs of sterile Dumont #5 forceps | Fine Science Tools | 11252-30 | |
| 4′,6-diamidino-2-phenylindole (DAPI) | Sigma Aldrich | D9564-10MG | |
| 4150 TapeStation System | Agilent | N/A | |
| 5 mL round bottom high clarity polypropylene test tube with snap cap | Falcon | 352063 | |
| 5 mL round bottom polystyrene test tube with cell strainer snap cap | Falcon | 352235 | |
| 50 mL polypropylene centrifuge tubes | Corning | 430829 | |
| 70 µm cell strainer | Falcon | 352350 | |
| 8 peak SPHERO Rainbow Calibration Particles | BD Biosciences | RCP-30-5A | |
| Accudrop Beads | BD Biosciences | N/A | |
| Allegra X-30R Centrifuge | Beckman Coulter | N/A | |
| Anti-NeuN antibody, clone A60, Alexa Fluor 488 conjugated | Millipore | MAB377X | |
| BD FACSAria Fusion Flow Cytometer | BD Biosciences | N/A | |
| Beckman Coulter MoFlo XDP | Beckman Coulter | N/A | |
| Chromium Controller | 10x Genomics | N/A | |
| Chromium Next GEM Single Cell 3' Reagent Kits v3.1 | 10x Genomics | PN-1000121; PN-1000120; PN-1000213 | |
| BSA 7.5% | Gibco | 15260037 | |
| Dithiothreitol (DTT) | Thermo Scientific | R0861 | |
| Dounce tissue grinder set: mortar, loose pestle (A) and tight pestle (B) | KIMBLE | D8938-1SET | |
| Eppendorf Tubes Protein LoBind 1.5ml | Eppendorf | 30108116 | |
| Halt, 100x Protease inhibitor | ThermoFisher | 78429 | |
| HiSeq 4000 Sequencing System | Illumina | N/A | Sequencing configuration: 28-8-0-91 |
| KCl | Any chemical supplier | Laboratory made | |
| LUNA-FX7 Automated Cell counter | Logos Biosystems | N/A | |
| MgCl2 | Any chemical supplier | Laboratory made | |
| N°10 guarded sterile disposable scalpels | Swann-Morton | 6601 | |
| Nuclease-free water | Sigma Aldrich | W4502-1L | |
| Pair of sterile student surgical scissors | Fine Science Tools | 91401-12 | |
| PBS | Any chemical supplier | Laboratory made | |
| RNase Inhibitor 40 U µl-1 | Ambion | AM2684 | |
| RNasin 40 U µl-1 | Promega | N211A | |
| Sterile Petri dish | Corning | 430167 | |
| Sucrose | Sigma Aldrich | 59378-500G | |
| Tris buffer, pH 8.0 | Any chemical supplier | Laboratory made | |
| Triton X-100 10% (v/v) | Sigma Aldrich | T8787-250ML | |
| Trypan blue | Invitrogen | T10282 |
参考文献
- Gillotin, S. Targeting impaired adult hippocampal neurogenesis in ageing leveraging intrinsic mechanisms regulating neural stem cell activity. Ageing Research Reviews. 71, 101447 (2021).
- Urban, N., Blomfield, I. M., Guillemot, F. Quiescence of adult mammalian neural stem cells: A highly regulated rest. Neuron. 104 (5), 834-848 (2019).
- Hanspal, M. A., Gillotin, S. A new age in understanding adult hippocampal neurogenesis in Alzheimer's disease. Neural Regeneration Research. 17 (12), 2615-2618 (2022).
- Zhang, H., et al. Single-nucleus transcriptomic landscape of primate hippocampal aging. Protein & Cell. 12 (9), 695-716 (2021).
- Franjic, D., et al. Transcriptomic taxonomy and neurogenic trajectories of adult human, macaque, and pig hippocampal and entorhinal cells. Neuron. 110 (3), 452-469 (2022).
- Moreno-Jimenez, E. P., Terreros-Roncal, J., Flor-Garcia, M., Rabano, A., Llorens-Martin, M. Evidences for adult hippocampal neurogenesis in humans. Journal of Neuroscience. 41 (12), 2541-2553 (2021).
- Sorrells, S. F., et al. Positive controls in adults and children support that very few, if any, new neurons are born in the adult human hippocampus. Journal of Neuroscience. 41 (12), 2554-2565 (2021).
- Zhou, Y., et al. Molecular landscapes of human hippocampal immature neurons across lifespan. Nature. 607, 527-533 (2022).
- Bonafina, A., Paratcha, G., Ledda, F. Deciphering new players in the neurogenic adult hippocampal niche. Frontiers in Cell and Developmental Biology. 8, 548 (2020).
- Amaral, D. G., Scharfman, H. E., Lavenex, P. The dentate gyrus: fundamental neuroanatomical organization (dentate gyrus for dummies). Progress in Brain Research. 163, 3-22 (2007).
- Habib, N., et al. Massively parallel single-nucleus RNA-seq with DroNc-seq. Nature Methods. 14 (10), 955-958 (2017).
- Flor-Garcia, M., et al. Unraveling human adult hippocampal neurogenesis. Nature Protocols. 15 (2), 668-693 (2020).
- Moreno-Jimenez, E. P., et al. Adult hippocampal neurogenesis is abundant in neurologically healthy subjects and drops sharply in patients with Alzheimer's disease. Nature Medicine. 25 (4), 554-560 (2019).
- Kalinina, A., Lagace, D. Single-cell and single-nucleus RNAseq analysis of adult neurogenesis. Cells. 11 (10), 1633 (2022).
- Harris, L., et al. Coordinated changes in cellular behavior ensure the lifelong maintenance of the hippocampal stem cell population. Cell Stem Cell. 28 (5), 863-876 (2021).
- Shin, J., et al. Single-cell RNA-seq with Waterfall reveals molecular cascades underlying adult neurogenesis. Cell Stem Cell. 17 (3), 360-372 (2015).
- Artegiani, B., et al. A single-cell RNA sequencing study reveals cellular and molecular dynamics of the hippocampal neurogenic niche. Cell Reports. 21 (11), 3271-3284 (2017).
- Nott, A., Schlachetzki, J. C. M., Fixsen, B. R., Glass, C. K. Nuclei isolation of multiple brain cell types for omics interrogation. Nature Protocols. 16 (3), 1629-1646 (2021).
- Sarnat, H. B., Nochlin, D., Born, D. E. Neuronal nuclear antigen (NeuN): a marker of neuronal maturation in early human fetal nervous system. Brain Development. 20 (2), 88-94 (1998).
- . Guidance on the Operation of ASPA Available from: https://assets.publishing.service.gov.uk/government/uploads/system/uploads/attachment_dat/file/662364/Guidance_on_the_Operation_of_ASPA.pdf (2022)
- Hagihara, H., Toyama, K., Yamasaki, N., Miyakawa, T. Dissection of hippocampal dentate gyrus from adult mouse. Journal of Visualized Experiments. (33), e1543 (2009).
- Habib, N., et al. Disease-associated astrocytes in Alzheimer's disease and aging. Nature Neuroscience. 23 (6), 701-706 (2020).
- Ding, J., et al. Systematic comparison of single-cell and single-nucleus RNA-sequencing methods. Nature Biotechnology. 38 (6), 737-746 (2020).
- Hao, Y., et al. Integrated analysis of multimodal single-cell data. Cell. 184 (13), 3573-3587 (2021).
- Mussa, Z., Tome-Garcia, J., Jiang, Y., Akbarian, S., Tsankova, N. M. Isolation of adult human astrocyte populations from fresh-frozen cortex using fluorescence-activated nuclei sorting. Journal of Visualized Experiments. (170), e62405 (2021).
- Zhang, Y., et al. An RNA-sequencing transcriptome and splicing database of glia, neurons, and vascular cells of the cerebral cortex. Journal of Neuroscience. 34 (36), 11929-11947 (2014).
- Marti-Mengual, U., Varea, E., Crespo, C., Blasco-Ibanez, J. M., Nacher, J. Cells expressing markers of immature neurons in the amygdala of adult humans. European Journal of Neuroscience. 37 (1), 10-22 (2013).
- Zhang, X. M., et al. Doublecortin-expressing cells persist in the associative cerebral cortex and amygdala in aged nonhuman primates. Frontiers in Neuroanatomy. 3, 17 (2009).
- Ding, Z. B., et al. Astrocytes: a double-edged sword in neurodegenerative diseases. Neural Regeneration Research. 16 (9), 1702-1710 (2021).
- Phatnani, H., Maniatis, T. Astrocytes in neurodegenerative disease. Cold Spring Harbor Perspectives in Biology. 7 (6), 020628 (2015).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。