Method Article
해마 신경인성 틈새를 연구하기 위해 단일 핵 RNA 시퀀싱과 결합된 뉴런의 형광 활성화 핵 음성 분류
요약
여기에 제시된 것은 형광 활성화 핵 (FAN) 분류를 통해 대부분의 뉴런을 배제하는 마우스 치아 이랑에서 분리 된 단일 핵을 서열화하는 방법입니다. 이 접근법은 고품질 발현 프로필을 생성하고 신경 줄기 세포와 같은 희소 한 집단을 포함하여 틈새 시장에서 대표되는 대부분의 다른 세포 유형에 대한 연구를 용이하게합니다.
초록
치아 이랑 (DG)의 하위 과립 영역 (SGZ) 내에서 증식 및 정지 신경 줄기 세포 (NSC)의 평생 유지와 새로 태어난 뉴런에서 과립 세포층의 과립 세포로의 분화로 구성된 성체 해마 신경 발생 (AHN)은 수많은 연구에서 잘 검증되었습니다. 유전자 변형 동물, 특히 설치류를 사용하는 것은 AHN을 조절하는 신호 전달 경로를 조사하고 해마 신경성 틈새를 구성하는 각 세포 유형의 역할을 연구하는 데 유용한 도구입니다. 후자를 해결하기 위해 단일 핵 분리와 차세대 시퀀싱을 결합하는 방법은 각 세포 집단에 대한 유전자 서명을 식별하기 위해 AHN 분야에서 상당한 영향을 미쳤습니다. 그러나 DG 내에서 더 희귀한 세포 집단을 표현형으로 프로파일링하기 위해서는 이러한 기술의 추가 개선이 필요합니다. 여기에서는 단일 핵 RNA 시퀀싱(snRNA-seq)을 수행하기 위해 NeuN 항원에 대해 염색되지 않은 핵을 선택하여 새로 해부된 DG에서 분리된 단일 핵 현탁액에서 대부분의 뉴런 집단을 배제하기 위해 형광 활성화 핵 분류(FANS)를 활용하는 방법을 제시합니다. 이 방법은 AHN의 세포 간 조절을 추가로 조사하고 종 전반에 걸쳐 새로운 세포 마커 및 메커니즘을 밝히기위한 잠재적 인 디딤돌입니다.
서문
성인 해마 신경 발생(AHN)이라고도 하는 성인기에 해마 뉴런의 지속적인 생성은 학습, 기억 획득/정리 및 패턴 분리와 같은 인지 기능과 관련이 있으며 인지 결핍을 예방하기 위한 노화 및 신경퇴행성 질환에서 회복력의 중요한 메커니즘으로 보입니다.1,2,3 . 설치류는 면역세포화학 및 차세대 염기서열분석(NGS) 방법을 포함한 여러 방법을 사용하여 AHN을 연구하기 위해 선택한 모델이었습니다. 이 결과를 다른 종으로 번역하는 것은 여전히 논란의 여지가 있습니다. 실제로 AHN은 대부분의 종에서 관찰되었지만 평생 동안, 특히 인간 4,5,6,7,8에서 지속되는 정도는 정기적으로 논의되고 있습니다.
현재까지 다양한 내인성 및 외인성 신호 전달 경로가 AHN1을 조절하는 것으로 확인되었습니다. 그러나 AHN에 대한 세포 간 통신의 영향은 이제 막 나타나고 있습니다9. 이것은 먼저 유전자 변형 동물로 생체 내 분석을 수행하기에 현재 알려진 세포 마커의 불충분한 특이성에 기인할 수 있습니다. 실제로, 많은 연구에서 여러 세포 유형1에서 발현되는 이중 코르틴 또는 신경교 섬유소 산성 단백질(GFAP)과 같은 마커에 의존해 왔습니다. 둘째, 성체 해마 틈새(10)에서의 복잡성 및 높은 수준의 세포 다양성은 모든 세포 유형을 프로파일링하기 위한 기술적 도전을 야기한다. 이것은 특히 NSC 또는 신경교 세포와 같은 다양한 집단에 대한 분석 파이프 라인에 사용되는 겹치는 세포 마커가있는 생물 정보학 분석의 경우이며, AHN 7,11을 평가할 때 논란의 여지가있는 결론을 초래합니다. 셋째, 방대한 수의 뉴런은 AHN의 미세 조정 조절에서 그들의 역할이 두드러지고 있음에도 불구하고 성상 세포, 희소돌기아교세포 또는 상반신 세포와 같이 덜 풍부한 세포 집단에 대한 조사를 훼손합니다9. 함께, 이러한 한계는 설치류의 결과를 다른 종으로 번역하는 능력에 영향을 미칩니다. 이것은 특히 해마 신경성 틈새와 같은 복잡한 조직을 시험관 내에서 요약하는 것이 어렵고 인간 조직과 관련된 연구에서 조직 처리를 위한 표준화된 프로토콜의 부족과 함께 고품질 조직에 접근하기 위한 많은 장애물로 인해 증폭됩니다12,13. 따라서 세포 집단을 프로파일링하고 치아 이랑(DG) 내에서 새로운 세포 마커를 식별하기 위한 새로운 접근 방식을 개발하여 궁극적으로 AHN 조절에 대한 각 세포 유형의 다양한 기여를 더 잘 이해하는 것이 중요합니다.
이를 달성하기 위해 RNA 시퀀싱과 결합된 단일 세포(sc) 및 단일 핵(sn) 분리는 DG14와 같은 복잡한 조직을 조사하는 데 중요한 역할을 했습니다. 이와 같이, 마우스 성체 해마 틈새로부터 단일 세포를 분리하기 위한 세포 농축 전략은 주로 NSC15,16을 조사하기 위해 수행되었다. DG로부터 비뉴런 세포를 풍부하게 하는 흥미로운 전략은 GluR1/Cd24 이중 음성 단일 세포를 시퀀싱하여 적용되었으며, 그 결과 생물정보학적 분석 후 성상세포와 NSC 사이에 뚜렷한 클러스터 없이 1,408개의 세포가 시퀀싱되었습니다17. 이는 세포 무결성과 RNA를 손상시키는 단일 세포 준비에 필요한 가혹한 효소 소화 때문일 수 있습니다. 이러한 기술적 문제를 우회하기 위해, 대신에 단일 핵 분리를 사용하는 여러 방법이 개발되었고, 특히 복잡한 조직(11,18)에 적합하다. 그러나 DG 내 또는 해마-내 후각 시스템 내에서보다 광범위하게 뉴런의 우세는 이러한 뇌 영역 내에 존재하는 전체 세포 집단을 연구하기위한 샘플링 편향을 생성합니다. 또한, 단일 세포 라이브러리의 준비를 위해 로딩할 세포의 제한된 수는 서열화된 단일 핵의 분석 파이프라인에서 주요 세포 집단의 존재를 강조합니다. 실제로, 큰 신경 클러스터는 종종 주석을 달고 분석하는 반면 다른 세포 집단은 과소 대표되거나 누락됩니다 5,11.
이러한 편향을 극복하고 마우스 DG에 존재하는 뉴런 이외의 세포 유형을 프로파일링할 수 있도록 하기 위해 이 연구에서는 뉴런 핵항원(NeuN, Rbfox3라고도 함). 이러한 항원의 선택은 NeuN을 신뢰할 수 있는 뉴런 마커19로 기술하는 문헌 및 이러한 접근법을 위해 핵 단백질을 사용할 필요성에 의해 안내되었다. 그런 다음 NeuN 음성 FACS 분류 세포를 10x 유전체학 플랫폼에서 RNA 시퀀싱을 위해 준비했습니다. 결과는 NeuN 발현 세포의 배제가 신경교 및 희귀 세포 집단의 세포 유형 특이적 고품질 전사체 프로파일링을 허용한다는 것을 보여줍니다.
프로토콜
동물 관리 및 실험 절차는 Francis Crick Institute의 지침과 영국 내무부 지침 및 법률에 따라 수행되었습니다.
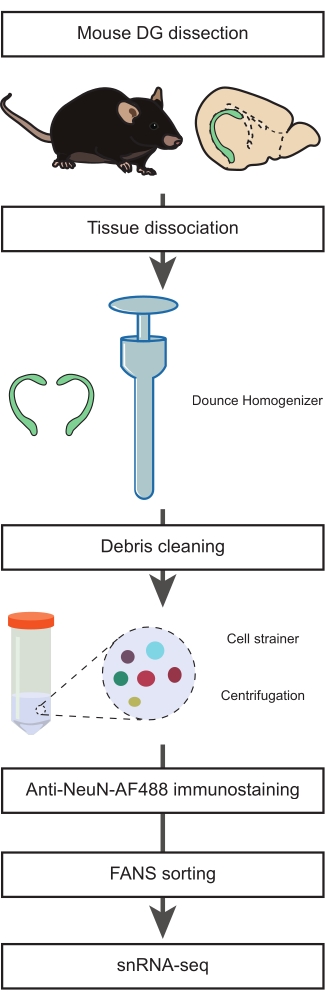
그림 1: 비뉴런 집단의 snRNA-seq에 대한 성체 마우스의 해부된 DG로부터 단일 핵 현탁액의 제조. snRNA-seq를 진행하기 전에 마우스 DG의 해부, 단일 핵의 현탁액 준비, NeuN 면역염색 및 음성 NeuN-FANS-분류를 포함하는 프로토콜의 주요 단계를 설명하는 흐름도. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
1. DG의 해부 (타이밍 : 15 분)
- 핵 분리 배지 1 및 2(NIM1 및 NIM2), 균질화 완충액(HB) 및 세척 배지(WM)를 준비합니다(보충 표 1). 필요할 때까지 모든 완충액, 배지, 시약 및 도구를 얼음 위에 놓습니다. Dounce 균질화기( 재료 표 참조)를 준비 중(균질화 단계 최소 1시간 전)에 얼음 위에 놓습니다.
참고: NIM1은 4°C에서 최대 6개월 동안 준비 및 보관할 수 있습니다. NIM2, HB 및 WM은 새로 준비해야합니다.
주의 : DTT, 프로테아제 억제제 및 트리톤 X-100을주의해서 조작하십시오. 이 화합물은 피부와 눈을 자극하고 급성 독성이 있으며 수생 환경에 유해합니다. 이러한 화학 물질을 사용하는 동안 보호 장갑, 의복, 눈 및 얼굴 보호구를 착용하고 취급 후에는 손을 철저히 씻고 환경으로 방출되지 않도록하십시오. - 22개월 된 수컷 C57Bl/6J 마우스를 내무부 스케줄 1 절차20에 따른 자궁경부 탈구로 안락사시킨다.
참고: 이 연구에서 22개월 된 마우스 사용에 관한 근거는 토론을 참조하십시오. 그러나이 프로토콜은 평생 동안 모든 연령대에서 수행 할 수 있습니다. - 안락사된 마우스에서 뇌를 해부하고 얼음처럼 차가운 1x PBS로 채워진 10cm 페트리 접시에 옮깁니다(그림 1). 페트리 접시를 얼음 위에 놓습니다. 메스를 사용하여 소뇌를 제거하고 두 반구 사이 (시상 축을 따라) 뇌를 반으로 자릅니다.
- 얼음처럼 차가운 PBS로 새로운 10cm 페트리 접시를 채우고 얼음 위에 놓습니다. 뇌의 절반을 새로운 페트리 접시로 옮깁니다. 쌍안경을 사용하여 DG를 해부하고이 단계를 반복하여 뇌의 후반부에서 두 번째 DG를 얻습니다.
참고: 이러한 단계(단계 1.2-1.4)는 이전에 설명된 절차21에서 조정되었습니다. 세포의 완전성을 보존하기 위해이 단계에서 가능한 한 빨리 진행하는 것이 중요합니다. - 두 DG를 사전 냉각 된 Dounce 균질 기로 옮기고 차가운 HB 1mL를 추가합니다.
2. 조직 해리, 단일 핵 분리 및 항 NeuN 면역 염색 (타이밍 : 2 시간)
- 느슨한 "A"유봉을 10 회 스트로크 한 다음 단단한 "B"유봉을 15 스트로크하여 조직을 균질화하십시오.
알림: Dounce 균질화는 마찰과 거품으로 인한 열을 줄이기 위해 부드러운 스트로크로 얼음 위의 모르타르로 수행해야합니다. 모든 완충액과 장비는 절차 중에 사전 냉각되고 얼음 위에 보관되어야합니다. - 균질액을 사전 냉각된 15mL 튜브로 옮깁니다. Dounce 균질화기를 1mL의 차가운 HB로 헹구고 동일한 튜브에 결합합니다. 3mL 튜브에 HB 15mL를 넣고 얼음 위에서 5분 동안 배양합니다. 튜브를 부드럽게 뒤집어 2x 혼합합니다.
- 70mL 스트레이너 캡을 50mL 시험관 위에 0.5mL의 HB로 미리 적십니다. 15mL 튜브를 세포 여과기 안으로 부드럽게 기울여 단계 2.2의 핵 현탁액을 변형시킵니다. 0.5mL의 HB로 세포 여과기를 세척하십시오.
- 셀 스트레이너를 제거하고 스윙 버킷 원심분리기를 사용하여 4°C에서 5분 동안 시험관을 500 x g 에서 원심분리합니다. 상청액을 폐기하십시오.
참고: 균질액을 변형시키면 파편을 줄이는 데 도움이 되며, 이는 유세포분석 및 snRNA-seq 다운스트림 단계에 중요합니다. - P1000 피펫을 사용하여 4mL의 HB에 펠릿을 부드럽게 재현탁합니다. 얼음 위에서 5분 동안 배양합니다. 4°C에서 10분 동안 500 x g 로 회전합니다. 상청액을 버리고 펠릿을 3mL의 WM에 재현탁합니다.
- 15mL 시험관 위에 35μm 스트레이너 캡을 0.5mL의 WM으로 미리 적십니다. 2.5단계의 핵 현탁액을 세포 스트레이너를 통해 변형시키고 P1000 피펫을 사용하여 한 번에 0.5mL씩 부드럽게 피펫팅합니다.
- 0.5mL의 WM으로 여과기 캡을 씻고 튜브를 얼음 위에 놓습니다. 여액을 새 15mL 튜브로 옮기고 500 x g에서 5분 및 4°C 동안 원심분리합니다. 상청액을 버리고 펠릿을 3mL의 WM에 재현탁합니다.
- 4°C에서 5분 동안 500 x g 로 회전합니다. 상청액을 버리고 마우스 항-NeuN, Alexa Fluor 488-접합 항체(항-NeuN-AF488, 1:32,000) 및 1μg/mL DAPI와 함께 1mL의 WM에 펠릿을 재현탁합니다. 어둠 속에서 얼음 위에서 45 분 동안 배양하십시오.
참고: 분리된 핵의 면역염색을 최적화하려면 항체를 적정하여 유세포분석 및 분류를 위한 최적의 희석을 결정하는 것이 좋습니다. 그런 다음 적절한 대조군을 실행하여 염색 조건이 최적인지 확인합니다. 예를 들어, 접합된 항-NeuN-AF488 항체를 사용하여 음성 대조군(즉, 항체의 무첨가, 보충 그림 1A) 및 양성 대조군(즉, 항체로 염색, 보충 그림 1B)을 실행하여 염색되지 않은 개체군과 염색된 개체군의 분리를 평가했습니다. AF488 접합 항체로 작업을 시작할 때 특이성을 평가하기 위해 AF488 접합 이소타입 대조군을 실행하는 것이 좋습니다. 비접합 항체가 사용되는 경우, 2차 항체의 비특이적 결합을 평가하기 위해 핵 제제에만 2차 항체를 첨가하는 것과 같은 추가 제어가 필요할 수 있습니다.
3. 뉴런 집단을 배제하기 위한 형광 활성화 핵 분류(FANS)(타이밍: 45분)
- 면역 염색 핵 현탁액을 5mL 시험관으로 옮기고 유세포 분석 절차가 시작될 때까지 얼음 위에 보관하십시오.
참고: 두 개의 마우스 DG보다 더 큰 조직 조각으로 작업하는 경우 용액의 핵 밀도가 높아지면 FACS가 막히는 것을 방지하기 위해 WM 버퍼로 추가 희석이 필요할 수 있습니다. - 튜브를 FACS 기기에 넣기 전에 저속으로 샘플을 3초 동안 소용돌이합니다( 재료 표 참조).
알림: (FACS 설정) 선별 기계는 제조업체의 권장 사항에 따라 교정 입자로 절차 시작 시 정렬해야 합니다. 낙하 지연은 FACS 모델에 따라 비드 또는 마이크로스피어( 재료 표 참조)로 보정되었습니다. 샘플은 순도 모드 상에서 4°C에서 분류하였다. 수집 부피를 줄이기 위해, 핵을 유세포분석기에 대한 권장 압력에서 70μm 노즐을 통해 분류하였다. 핵은 50μL의 WM을 포함하는 1.5mL 저결합 튜브( 재료 표 참조)로 분류되었습니다. 모든 수집 튜브는 튜브의 벽에 핵이 달라붙는 위험을 줄이기 위해 밤새 4°C에서 PBS + 5% BSA로 코팅되었습니다. - 염색된 핵 현탁액의 샘플에서 데이터를 수집하려면 세포 파편과 응집된 핵을 제외하기 위해 DAPI 높이 및 DAPI 영역에 게이트를 설정합니다(그림 2A). 또한 로그 측면 산란(SSC) 영역과 로그 전방 산란(FCS) 영역에 게이트를 설정하여 남아 있는 DAPI 염색 응집체 또는 세포 파편에서 단일 핵을 분리합니다(그림 2B).
- 그림 488과 같이 NeuN-AF488 및 FSC 영역에 대한 게이트를 설정하여 NeuN-AF488 음성 집단을 분리합니다( 그림 2C).
- 분석 후, 위에서 설명한 게이팅 전략을 사용하여 50μL의 WM으로 채워진 1.5mL 수집 튜브에서 NeuN-AF488 음성 집단을 분류합니다.
참고: 위에서 설명한 게이팅 전략과 성인 마우스의 뇌에서 DG를 분리하는 해부 절차에 따라 NeuN-AF488 음성 집단은 단일 핵의 ~14%를 나타낼 것으로 예상됩니다.
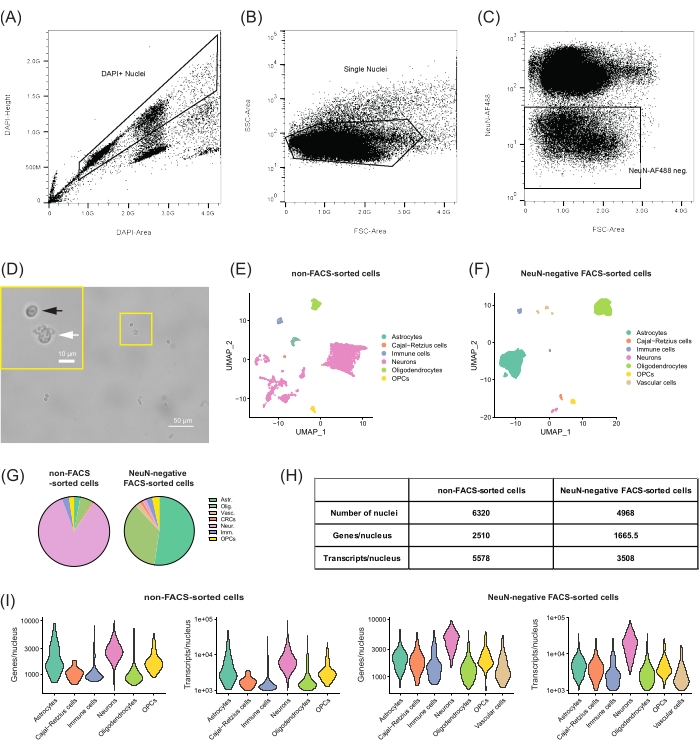
그림 2: NeuN-AF488 음성 단일 핵을 분리하고 세포 파편을 배제하기 위한 DG. (A-C) 게이팅 전략에서 비신경 세포 집단의 분리 및 전사체 프로파일링. (A) DAPI+ 핵의 선택과 세포 파편 및 응집체의 배제를 위한 게이트 설정을 묘사하는 분리된 핵의 대표적인 샘플의 FANS 점도표. (B) FSC 영역 및 SSC 영역을 사용한 관련 단일 핵의 추가 선택. (C) NeuN-AF488이 양성 집단을 배제하고 음의 단일 핵을 분류하는 게이트. (D) 나쁜 품질의 핵 (흰색 화살표)에 비해 파편이 최소량이고 양질의 핵 (둥근 모양, 검은 색 화살표)의 비율이 높은 양호한 단일 핵 현탁액의 현미경 사진. 스케일 바 = 50 μm, 10 μm (삽입). (E, F) snRNA-seq 데이터 분석 및 22개월 된 C57BL/6J 수컷 마우스의 DG로부터 분리된 별개의 세포 집단의 프로파일링. (E) 비 FACS 분류 세포 및 (F) NeuN 음성 FACS 정렬 세포의 단일 핵 프로파일의 UMAP (차원 감소를위한 균일 한 매니 폴드 근사 및 투영) 플롯, 세포 유형별로 색상. (G) 두 샘플에서 확인된 세포 유형의 빈도를 비교하는 파이 차트. (H) 시퀀싱된 샘플에 대한 각각의 메트릭: 핵 수, 유전자 중앙값 수 및 핵당 전사체. (I) 두 샘플에서 각 세포 유형에 대해 검출된 유전자 및 전사체의 수의 분포를 보여주는 바이올린 플롯. 아스트. = 성상 세포, 올리그. = 희소돌기아교세포, Vasc. = 혈관 세포, CRC = Cajal-Retzius 세포, 신경. = 뉴런, Imm. = 면역 세포, OPCs = 희소돌기아교세포 전구체 세포. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
4. 단일 핵 RNA 시퀀싱을 수행하기 위한 단일 핵 현탁액의 제조 (타이밍: 30분)
- 분류 후 1% BSA를 함유한 PBS 1mL를 수집 튜브에 추가하여 튜브 벽에 액적을 수집하고 4°C에서 5분 동안 500 x g 로 회전합니다. 상청액을 버리고 50 μL를 남깁니다.
알림: 원심분리된 핵은 튜브 바닥에서 펠릿을 관찰하기 어려울 수 있으므로 주의해서 다루십시오. 스윙 버킷 원심 분리기를 사용하면 펠릿을 방해하지 않고 상청액을 버리는 데 도움이됩니다. - 원심분리된 핵을 재부유시키기 위해 부드럽게 피펫. 0.5mL 마이크로튜브의 트리판 블루 5μL에 5μL의 핵 현탁액을 추가합니다.
주의 : Trypan blue는 건강에 해롭고 암을 유발할 수 있으며 생식력이나 태아를 손상시킬 것으로 의심되므로 주의해서 다루십시오. 보호 장갑, 의복, 눈 및 얼굴 보호구를 착용하십시오. 모든 안전 예방 조치를 읽고 이해할 때까지 취급하지 마십시오. - 농도를 측정하고 혈구계 또는 자동 세포 계수기를 사용하여 단일 세포 현탁액의 생존력을 평가합니다( 재료 표 참조). 5단계에 설명된 대로 핵의 라이브러리 준비 및 시퀀싱을 수행합니다.
참고: 시퀀싱에 좋은 품질로 간주된 샘플은 세포 파편이 없는 현미경 아래에서 둥글고 규칙적인 핵 모양을 보여주었습니다(그림 2D). 핵막 주위에 후광이 존재하거나 여러 핵이 함께 응집되는 것은 손상된 핵의 징후이며 이러한 세포 현탁액은 snRNA-seq에 대해 고려되어서는 안 됩니다(그림 2D). 측정된 핵 농도는 300-700 핵/μL 범위 내에 있었습니다.
5. 도서관 준비 및 순서 지정
참고: 다음 단계에 대한 설명은 이 연구에 사용된 사내 시퀀싱 플랫폼을 기반으로 합니다( 재료 표 참조). 따라서 다른 플랫폼을 사용하는 경우 일부 설정이 다를 수 있습니다. 여기에서는 주요 단계만 설명하며 각 매개변수는 처음 사용하기 전에 최적화를 통해 선택한 제조업체의 지침과 프로토콜에 따라 결정되어야 합니다. RNA 분해를 방지하고 최적의 시퀀싱 품질을 보장하기 위해 분류된 핵 현탁액을 농축한 후 가능한 한 빨리 라이브러리 준비를 수행하는 것이 중요합니다.
- 7,000에서 10,000 사이의 핵을 미세 유체 단일 세포 칩에로드합니다.
- 제공된 컨트롤러와 선택한 공급업체의 시약을 사용하여 나노리터 규모의 액적으로 로딩된 핵을 분할합니다. 각 액적 내의 핵을 용해시키고 RNA를 역전사합니다.
참고: 액적 내에서 생성된 모든 cDNA는 동일한 세포 바코드를 공유했습니다. - 선택한 공급업체의 지침에 따라 snRNA-seq용 라이브러리를 준비하고 시퀀싱 플랫폼과의 호환성을 보장합니다. 전기영동, 형광 측정 또는 qPCR 기반 방법을 사용하여 최종 라이브러리의 품질과 농도를 확인하고, 해당되는 경우 시퀀싱 전에 등몰로 풀링합니다.
- 변성은 3' 유전자 발현 라이브러리를 풀링하고 제조업체의 권장 사항에 따라 희석합니다.
- 차세대 시퀀싱 플랫폼에서 쌍단, 단일 또는 이중 인덱싱 시퀀싱을 수행하고 셀당 50,000개의 판독 쌍을 사용합니다.
결과
여기에 제시된 프로토콜은 snRNA-seq를 수행하기 위해 DG로부터 분리된 비뉴런 단일 핵의 현탁액을 제조하는 방법을 설명합니다. FANS의 유무에 관계없이 생물 정보학 클러스터링은 DG 내에서 알려진 세포 유형에 해당하는 잘 분리 된 핵 그룹을 나타 냈습니다 (그림 2E, F). FACS로 분류되지 않은 샘플 내에서 시퀀싱된 고품질 핵의 대부분은 세 그룹의 뉴런(이 샘플에 대한 전체 핵의 84.9%, 그림 2E,G,H)으로 구성되었습니다. DG에서 가장 대표적인 세포 집단이 과립 뉴런, 다른 흥분성 뉴런(표지된 흥분성 뉴런) 및 억제 뉴런(10)이라는 점을 고려하면 이러한 결과가 예상된다. 확인 된 비 신경 세포는 대부분 성상 세포, 희소 돌기 아교 세포 및 희소 돌기 아교 세포 전구체 세포 (OPC), 면역 세포 (3.3 %) 및 Cajal-Retzius 세포 (0.6 %)를 포함한 신경교 세포 유형 (11.1 %)으로 구성되었습니다. NEUN 양성 모집단을 제외하기 위해 FANS를 수행할 때(NeuN-음성 FACS 정렬 샘플; 그림 2F, G, H), 신경교 세포 클러스터가 우세했습니다 (81.3 %). 더 많은 수의 신경교 핵을 분리하면 FANS없이 함께 모이는 서로 다른 개체군을 더 잘 분할 할 수 있습니다. 실제로, NSC 또는 성상 세포에서 발현되는 특정 유전자를 재 클러스터링하고 분석 할 때 4 개의 하위 클러스터가 분리되었습니다 (보충 그림 2A, B). 보다 구체적인 세포 마커를 살펴보고 세포 유형 전반에 걸친 유전자 발현 수준을 평가한 결과, Hopx 및 Notch2의 발현이 더 높고 Aldh1a1 또는 Aqp4의 발현이 거의 없는 주요 성상세포 집단과 별도로 분리된 NSC의 작은 클러스터가 검출되었습니다(보충 그림 2C). 그러나 성상 세포와 NSC 사이의 유전자 발현이 겹치기 때문에 세포의 다른 하위 유형을 구체적으로 프로파일 링하고 식별하기 위해서는 추가 분석이 필요합니다. 또한, NeuN- 음성 FANS 샘플은 세포 특이 적 마커의 발현을 위해 상호 참조 될 때 내피 세포, 혈관 주위 세포 및 혈관 leptomeningeal 세포를 포함하는 혈관 세포 (2.3 %)로 표지 된 추가 클러스터를 가졌다 (데이터는 표시되지 않음).
시퀀싱을 위한 라이브러리를 생성하기 위해 선택한 프로토콜에 대한 지침에 따라, FANS의 유무에 관계없이 고품질 발현 프로필을 얻었습니다. 50,000회 판독/핵에서 시퀀싱된 샘플의 경우, 저품질 핵을 필터링한 후 FACS로 분류되지 않은 샘플(5,578개의 전사체, 그림 2H)의 경우 핵당 평균 2,510개의 유전자가 검출되었고 NeuN 음성 FANS 샘플의 경우 1,665.5개의 유전자(3,508개의 전사체)가 검출되었습니다(그림 2H, I). 이러한 메트릭은 이 프로토콜이 다른 접근법22,23을 사용하는 연구에 필적하는 단일 핵의 고품질 전사체 프로파일링을 생성하고 FACS 분류 프로세스가 후속 snRNA-seq에 대한 핵을 손상시키지 않는다는 것을 확인합니다. 특히, 두 샘플 사이의 핵 당 유전자 및 전사체 수의 차이는 데이터 품질이 낮기 때문이 아니라 모든 비 신경 세포 유형 (1,090 개의 유전자 / 핵 및 1,785 개의 유전자)의 평균 전사 활성보다 더 높은 전사 활성 (비 FACS 정렬 샘플에서 2,660 개의 유전자 / 핵 및 6,170 개의 전사체 / 핵)을 갖는 비 FACS 정렬 샘플의 뉴런 비율이 높기 때문입니다 (NeuN 음성 FANS 샘플의 1.7 %에 비해 84.9 %) 전사체/핵, 그림 2I).
함께, 이러한 대표적인 결과는 FANS를 사용한 NeuN 음성 핵의 선택이 새로 해부된 뇌 조직에서 낮은 존재비 세포 유형을 분리하고 snRNA-seq 방법을 통해 이러한 별개의 세포 집단에 대한 고품질 단일 핵 전사체 프로파일링을 수행하는 강력한 도구임을 보여줍니다.
보충 그림 1: FANS에 대한 면역염색의 검증. 핵 현탁액을 (A) 음성 대조군으로서 항-NeuN-AF 488 항체 없이 또는 (B) 항체와 함께 인큐베이션하고 면역염색 조건을 검증하기 위해 FACS 분류기를 통과하였다. 이 파일을 다운로드하려면 여기를 클릭하십시오.
보충 그림 2: 성상세포 클러스터의 유전자 발현 분석 및 재클러스터링. (A) 그림 2F의 게놈 전체 발현 프로필을 기반으로 한 4968 개의 핵의 클러스터링을 보여주는 UMAP (Uniform Manifold Approximation and Projection for Dimension Reduction) 플롯. 세포-유형 호출은 세포-유형 마커에 기초하여 수행되었다. (B) 잠재적인 세포 하위형을 조사하기 위한 추가 하위설정을 위해 (A)로부터 선택된 2579개의 핵으로 구성된 성상세포 클러스터. 4개의 하위 유형은 쇠라(0-3) 클러스터링에 의해 검출되었으며, 상이한 색상으로 표시되었다. (c) 4가지 세포 유형에 걸친 특정 세포 마커의 유전자 발현 수준. 모든 플롯은 쇠라 R 패키지24를 사용하여 얻어졌다. 간략하게, RNA-seq 카운트는 총 발현에 의해 각 세포에 대해 정규화되고 스케일 팩터 (10,000)로 곱해졌습니다. 이 결과는 로그로 변환되었습니다. 변환된 값은 UMAP이 적용되기 전에 각 셀 내에서 스케일링(분산이 1로 스케일링)되고 중심화(평균이 0으로 설정됨)되었으며, 이는 x축과 y축의 값으로 사용되었습니다. 그래프는 2D 산점도에서 차원 감소 기술의 출력을 나타내며, 여기서 각 점은 감소 기술에 의해 결정된 셀 임베딩을 기반으로 각각의 x 및 y 좌표가 있는 셀을 나타냅니다. 유사한 유전자 시그너처를 갖는 세포는 임베딩에 의해 서로 가깝게 위치한다. 이 파일을 다운로드하려면 여기를 클릭하십시오.
보충 그림 3: 신경인성 계통에서 NeuN의 유전자 발현 분석. (A) 공개적으로 이용 가능한 데이터 세트15로부터의 신경인성 계통의 클러스터링을 보여주는 UMAP 플롯. UMAP는 보충 그림 2와 같이 생성되었습니다. (B) 성상 세포 (아쿠아 포린 4 = Aqp4), NSC (호모 도메인 전용 단백질 = Hopx), NeuN / Rbfox3 (NSC 및 중간 전구 세포 [IPC]) 및 사이클링 세포 (사이클린 의존성 키나아제 6 = Cdk6). 이 파일을 다운로드하려면 여기를 클릭하십시오.
보충 표 1: 연구에 사용된 배지 및 완충액의 조성. 이 파일을 다운로드하려면 여기를 클릭하십시오.
토론
이 프로토콜을 성공적으로 실행하려면 DG의 해부가 첫 번째 중요한 단계이며, 손상되지 않은 상태로 유지하고 주변 조직의 오염을 제한하기 위해 약간의 연습이 필요합니다. 경험을 통해 DG와 해마의 분리는 숙련된 연구원이 매우 빠르게 획득할 수 있으며, 숙련된 연구원은 해부의 신속성을 높이고 조직의 신선도를 개선하여 고품질 데이터를 생성하기 위해 기술을 개선할 수 있습니다. 비슷한 맥락에서 단일 핵의 준비 및 재현탁은 단일 실험에 사용된 다양한 조건에서 일관성을 요구하지만 시퀀싱 결과를 편향시킬 주변 RNA를 방출하는 핵막을 방해할 수 있는 과도한 피펫팅을 피해야 합니다. 고품질 핵을 준비하기 위해 앞서 언급한 권장 사항 외에도 시퀀싱을 진행하기 전에 단일 핵 현탁액의 농도도 고려해야 합니다. 실제로 제조업체의 지침에 따르면 1,200 nuc / μL보다 높은 농도의 제제는 희석되어야하며,이 수준의 핵 농도는 다운 스트림 생물 정보학 분석에 영향을 미치는 다중 형성 위험이 더 높기 때문입니다. 참고로, 핵 농도가 500nuc/μL 미만인 샘플을 시퀀싱하는 것은 관련 비용으로 인해 가치가 없을 수 있습니다. 또한 고급 FACS 사용자의 조언에 따라 모든 게이팅을 설정하고 샘플 및 생물학적 복제에서 설정과 일관성을 유지하는 것이 좋습니다. 마찬가지로 RNA 시퀀싱을 위한 라이브러리 준비에는 고품질 결과를 얻기 위한 몇 가지 교육이 수반되며 대부분의 공급업체는 이를 효율적으로 달성하기 위한 탁월한 지원을 제공합니다. 이 방법은이 연구에서 신선한 조직으로 만 테스트되었습니다. 그러나, FANS는 또한 동결 조직25로 수행되었다. 따라서이 프로토콜은 약간의 최적화에도 불구하고 냉동 조직으로 수행 될 수 있다고 가정하는 것이 합리적입니다.
이 프로토콜은 해마 신경성 틈새 내에서 뉴런 이외의 세포 집단을 조사하는 특정 다운스트림 응용 프로그램을 염두에 두고 개발되었습니다. 실제로, 증가하는 증거는 노화에서 AHN의 손상이 틈새 1,2,3,9 내의 주변 세포에 기인 할 수 있음을 나타냅니다. 특히, 성상 세포와 희소 돌기 아교 세포는 AHN의 주요 조절자로 등장합니다. 그러나 RNA 시퀀싱과 결합 된 DG로부터의 분리는 혼합 된 결과를 생성하여이 가설을이 기술 1,17로 평가하기가 어렵습니다. FACS 분류 NeuN 음성 핵의 이러한 접근 방식은 FACS 분류되지 않은 샘플에 비해 더 많은 성상 세포 및 희소 돌기 아교 세포의 분리를 허용하여 더 나은 생물 정보학 분석을 가능하게합니다. 이 프로토콜은 평생 동안 모든 연령대에 적용 할 수 있으며 오래된 동물의 조직과 함께 여기에 제시된 대표 데이터는이 방법이 노화 된 해마 신경성 틈새 시장을 조사하는 데 강력하다는 개념 증명을 제공합니다. 이 방법의 사용을 확장하고 다양한 생물학적 질문에 적용하려면 다른 신경 핵막 항원을 이러한 마커에 대해 가장 잘 검증된 항체의 철저한 적정과 함께 테스트할 수 있다는 점을 고려하는 것이 중요합니다. 예를 들어, DG에서 NSC로부터 뉴런 분화 과정을 연구할 때 제2형 세포 또는 신경모세포와 같은 일부 세포 유형은 NeuN을 발현하기 시작합니다(보충 그림 3). 따라서 이러한 세포 유형을 특이적으로 조사하기 위해서는 다른 항원이 필요합니다. 반대로, 일부 뉴런은 NeuN-음성 FACS-분류 후에도 이들 집단에서 NeuN의 발현이 낮거나 전혀 없기 때문에 여전히 확인되었다(예를 들어, 피질 Cajal-Retzius 뉴런19). 또한, NeuN은 희소돌기아교세포26의 하위집단에서 발현되는 것으로 보고되었으며, 이는 이들 하위집단이 관심의 대상이라면 편향된 결과를 줄 수 있다. 따라서 FANS를 사용하기 시작할 때 항원의 선택은 특정 생물학적 질문에 대한 정확한 답변을 배제하는 세포 집단의 포함 또는 배제를 피하기 위해 신중하게 고려되어야합니다. 이와 일치하여, 이 프로토콜로 테스트된 가설을 검증하거나 반박하기 전에 직교 분석(예: 면역조직화학 또는 RNA 범위)에 의해 각 시퀀싱 결과를 추가로 검증하는 것이 좋습니다. 마지막으로, FANS를 포함하는 단계는 원하는 세포 집단을 배제 및/또는 포함하기 위해 보다 정교한 분류 전략을 갖는 하나 이상의 항체를 포함하도록 추가로 개발될 수 있다.
궁극적으로이 프로토콜에 설명 된 기술은 다른 종과 함께 사용될 때 몇 가지 제한이있을 수 있습니다. 예를 들어, 틈새 시장은 증식 및 정지 NSC 또는 DG의 특정 하위 영역 내에서 제한된 새로 태어난 뉴런의 존재가있는 설치류에서 매우 잘 정의되어 있지만 해마 신경 인성 틈새가 다른 종에서 어떻게 묘사되어야하는지는 아직 명확하지 않습니다. 실제로, 증식 세포는 인간이 아닌 영장류와 인간에서 DG의 연속 영역 내에 정렬되지 않고 오히려 그 주위에 흩어져 있으며 편도체7에도 존재할 수 있습니다. 따라서 다른 종의 DG보다 더 넓은 영역을 해부하고 분리하면 잠재적으로 이 프로토콜의 사용에 영향을 미칠 수 있습니다. 특히, 조직의 제조를 위한 해리 및 분쇄 단계는 더 큰 조직 조각(27, 28)으로 작업하는 동안 최적화될 필요가 있을 것이다. 생물 정보학 분석과 관련하여, 근친 교배 사육 설치류는 매우 균질하고 매우 잘 주석이 달린 게놈을 가지고 있지만, 인간 게놈의 유전 적 가변성은 다른 세포 집단 (예 : NSC 및 성상 세포)을 명확하게 구별하기에 불충분 한 수의 세포 마커와 결합 된 분석을 위해 많은 정규화를 필요로하며, 이는 세포의 작은 클러스터가 식별 될 때 다른 결론을 이끌어 낼 수 있습니다7, 11. 이러한 상황에서 세포 농축은 여전히 선호되는 옵션이거나 분석 능력을 높이기 위해 다른 전략과 함께 사용해야 할 수 있습니다.
그럼에도 불구하고, 현재의 접근법은 AHN의 조절에서 잠재적으로 중요한 세포 집단에도 불구하고 충분히 연구되지 않은 역할에 대한 조사를 가능하게 할 수 있습니다. 이것은 특히 신경 퇴행성 질환의 발병 및 진행에 중심적인 역할을하는 성상 세포 집단의 경우 일 수 있습니다29,30. 이 연구는 성상 세포 및 기타 희귀 세포 집단이 DG 내에 존재하는 대다수의 뉴런을 배제함으로써 단순히 식별되고 프로파일 링 될 수 있음을 입증했습니다. 다른 접근법을 사용하는 다른 연구는 동일한 범위의 세포 집단 5,11,17에서 유사한 핵 회수를 달성 할 수 없었다. 더욱이, 이 연구의 결과는 이 접근법을 사용하여 이 세포 집단(15)의 특이적 농축 없이 NSC 클러스터를 분리하는 것이 가능하다는 것을 입증한다.
결론적으로,이 방법을 따르고 개선하는 것은 AHN의 조절을위한 해마 신경성 틈새의 맥락 적 역할과 관련된 현저한 질문을 해결하기위한 단계가 될 것입니다. 특히, AHN9의 조절과 관련된 세포 집단의 노화 및 병든 뇌의 유전자 발현 수준에 대한 새로운 통찰력을 제공하고, NSCs1 의 잠재적 이질성을 식별하거나 AHN에서 혈관구조의 역할을 다룰 수 있습니다. 궁극적으로이 방법은 유사한 질문과 문제가있는 다른 성체 줄기 세포 틈새에 적용될 수 있습니다.
공개
SG, TL 및 SK는 미국 및 캐나다 이외의 지역에서 MSD로 알려진 미국 뉴저지주 라웨이에 소재한 Merck & Co., Inc.의 자회사인 Merck Sharp & Dohme LLC의 직원입니다. SG는 Merck & Co., Inc., Rahway, NJ, USA의 주주입니다.
감사의 말
저자는 기술 지원을 해준 Lachlan Harris와 Piero Rigo, 원고에 대한 피드백을 제공한 Jason M. Uslaner와 Ditte Lovatt에게 감사드립니다. 이 연구는 MRC의 보조금 지원과 MSD, Cancer Research UK (FC0010089), UK Medical Research Council (FC0010089), Wellcome Trust (FC0010089) 및 FG (106187 / Z / 14 / Z)에 대한 Wellcome Trust Investigator Award의 자금을받는 Francis Crick Institute와의 사전 경쟁 연구 협력으로 지원되었습니다. 지면이 부족하여 토론하고 인용할 수 없었던 많은 저자들에게 사과드립니다.
자료
| Name | Company | Catalog Number | Comments |
| 0.5ml microtube | Eppendorf | 30124537 | |
| 10.00µm Flouresbrite YG Carboxylate Microspheres | Polysciences | 15700-10 | |
| 15 mL polypropylene centrifuge tubes | Corning | 430052 | |
| 2 pairs of sterile Dumont #5 forceps | Fine Science Tools | 11252-30 | |
| 4′,6-diamidino-2-phenylindole (DAPI) | Sigma Aldrich | D9564-10MG | |
| 4150 TapeStation System | Agilent | N/A | |
| 5 mL round bottom high clarity polypropylene test tube with snap cap | Falcon | 352063 | |
| 5 mL round bottom polystyrene test tube with cell strainer snap cap | Falcon | 352235 | |
| 50 mL polypropylene centrifuge tubes | Corning | 430829 | |
| 70 µm cell strainer | Falcon | 352350 | |
| 8 peak SPHERO Rainbow Calibration Particles | BD Biosciences | RCP-30-5A | |
| Accudrop Beads | BD Biosciences | N/A | |
| Allegra X-30R Centrifuge | Beckman Coulter | N/A | |
| Anti-NeuN antibody, clone A60, Alexa Fluor 488 conjugated | Millipore | MAB377X | |
| BD FACSAria Fusion Flow Cytometer | BD Biosciences | N/A | |
| Beckman Coulter MoFlo XDP | Beckman Coulter | N/A | |
| Chromium Controller | 10x Genomics | N/A | |
| Chromium Next GEM Single Cell 3' Reagent Kits v3.1 | 10x Genomics | PN-1000121; PN-1000120; PN-1000213 | |
| BSA 7.5% | Gibco | 15260037 | |
| Dithiothreitol (DTT) | Thermo Scientific | R0861 | |
| Dounce tissue grinder set: mortar, loose pestle (A) and tight pestle (B) | KIMBLE | D8938-1SET | |
| Eppendorf Tubes Protein LoBind 1.5ml | Eppendorf | 30108116 | |
| Halt, 100x Protease inhibitor | ThermoFisher | 78429 | |
| HiSeq 4000 Sequencing System | Illumina | N/A | Sequencing configuration: 28-8-0-91 |
| KCl | Any chemical supplier | Laboratory made | |
| LUNA-FX7 Automated Cell counter | Logos Biosystems | N/A | |
| MgCl2 | Any chemical supplier | Laboratory made | |
| N°10 guarded sterile disposable scalpels | Swann-Morton | 6601 | |
| Nuclease-free water | Sigma Aldrich | W4502-1L | |
| Pair of sterile student surgical scissors | Fine Science Tools | 91401-12 | |
| PBS | Any chemical supplier | Laboratory made | |
| RNase Inhibitor 40 U µl-1 | Ambion | AM2684 | |
| RNasin 40 U µl-1 | Promega | N211A | |
| Sterile Petri dish | Corning | 430167 | |
| Sucrose | Sigma Aldrich | 59378-500G | |
| Tris buffer, pH 8.0 | Any chemical supplier | Laboratory made | |
| Triton X-100 10% (v/v) | Sigma Aldrich | T8787-250ML | |
| Trypan blue | Invitrogen | T10282 |
참고문헌
- Gillotin, S. Targeting impaired adult hippocampal neurogenesis in ageing leveraging intrinsic mechanisms regulating neural stem cell activity. Ageing Research Reviews. 71, 101447 (2021).
- Urban, N., Blomfield, I. M., Guillemot, F. Quiescence of adult mammalian neural stem cells: A highly regulated rest. Neuron. 104 (5), 834-848 (2019).
- Hanspal, M. A., Gillotin, S. A new age in understanding adult hippocampal neurogenesis in Alzheimer's disease. Neural Regeneration Research. 17 (12), 2615-2618 (2022).
- Zhang, H., et al. Single-nucleus transcriptomic landscape of primate hippocampal aging. Protein & Cell. 12 (9), 695-716 (2021).
- Franjic, D., et al. Transcriptomic taxonomy and neurogenic trajectories of adult human, macaque, and pig hippocampal and entorhinal cells. Neuron. 110 (3), 452-469 (2022).
- Moreno-Jimenez, E. P., Terreros-Roncal, J., Flor-Garcia, M., Rabano, A., Llorens-Martin, M. Evidences for adult hippocampal neurogenesis in humans. Journal of Neuroscience. 41 (12), 2541-2553 (2021).
- Sorrells, S. F., et al. Positive controls in adults and children support that very few, if any, new neurons are born in the adult human hippocampus. Journal of Neuroscience. 41 (12), 2554-2565 (2021).
- Zhou, Y., et al. Molecular landscapes of human hippocampal immature neurons across lifespan. Nature. 607, 527-533 (2022).
- Bonafina, A., Paratcha, G., Ledda, F. Deciphering new players in the neurogenic adult hippocampal niche. Frontiers in Cell and Developmental Biology. 8, 548 (2020).
- Amaral, D. G., Scharfman, H. E., Lavenex, P. The dentate gyrus: fundamental neuroanatomical organization (dentate gyrus for dummies). Progress in Brain Research. 163, 3-22 (2007).
- Habib, N., et al. Massively parallel single-nucleus RNA-seq with DroNc-seq. Nature Methods. 14 (10), 955-958 (2017).
- Flor-Garcia, M., et al. Unraveling human adult hippocampal neurogenesis. Nature Protocols. 15 (2), 668-693 (2020).
- Moreno-Jimenez, E. P., et al. Adult hippocampal neurogenesis is abundant in neurologically healthy subjects and drops sharply in patients with Alzheimer's disease. Nature Medicine. 25 (4), 554-560 (2019).
- Kalinina, A., Lagace, D. Single-cell and single-nucleus RNAseq analysis of adult neurogenesis. Cells. 11 (10), 1633 (2022).
- Harris, L., et al. Coordinated changes in cellular behavior ensure the lifelong maintenance of the hippocampal stem cell population. Cell Stem Cell. 28 (5), 863-876 (2021).
- Shin, J., et al. Single-cell RNA-seq with Waterfall reveals molecular cascades underlying adult neurogenesis. Cell Stem Cell. 17 (3), 360-372 (2015).
- Artegiani, B., et al. A single-cell RNA sequencing study reveals cellular and molecular dynamics of the hippocampal neurogenic niche. Cell Reports. 21 (11), 3271-3284 (2017).
- Nott, A., Schlachetzki, J. C. M., Fixsen, B. R., Glass, C. K. Nuclei isolation of multiple brain cell types for omics interrogation. Nature Protocols. 16 (3), 1629-1646 (2021).
- Sarnat, H. B., Nochlin, D., Born, D. E. Neuronal nuclear antigen (NeuN): a marker of neuronal maturation in early human fetal nervous system. Brain Development. 20 (2), 88-94 (1998).
- . Guidance on the Operation of ASPA Available from: https://assets.publishing.service.gov.uk/government/uploads/system/uploads/attachment_dat/file/662364/Guidance_on_the_Operation_of_ASPA.pdf (2022)
- Hagihara, H., Toyama, K., Yamasaki, N., Miyakawa, T. Dissection of hippocampal dentate gyrus from adult mouse. Journal of Visualized Experiments. (33), e1543 (2009).
- Habib, N., et al. Disease-associated astrocytes in Alzheimer's disease and aging. Nature Neuroscience. 23 (6), 701-706 (2020).
- Ding, J., et al. Systematic comparison of single-cell and single-nucleus RNA-sequencing methods. Nature Biotechnology. 38 (6), 737-746 (2020).
- Hao, Y., et al. Integrated analysis of multimodal single-cell data. Cell. 184 (13), 3573-3587 (2021).
- Mussa, Z., Tome-Garcia, J., Jiang, Y., Akbarian, S., Tsankova, N. M. Isolation of adult human astrocyte populations from fresh-frozen cortex using fluorescence-activated nuclei sorting. Journal of Visualized Experiments. (170), e62405 (2021).
- Zhang, Y., et al. An RNA-sequencing transcriptome and splicing database of glia, neurons, and vascular cells of the cerebral cortex. Journal of Neuroscience. 34 (36), 11929-11947 (2014).
- Marti-Mengual, U., Varea, E., Crespo, C., Blasco-Ibanez, J. M., Nacher, J. Cells expressing markers of immature neurons in the amygdala of adult humans. European Journal of Neuroscience. 37 (1), 10-22 (2013).
- Zhang, X. M., et al. Doublecortin-expressing cells persist in the associative cerebral cortex and amygdala in aged nonhuman primates. Frontiers in Neuroanatomy. 3, 17 (2009).
- Ding, Z. B., et al. Astrocytes: a double-edged sword in neurodegenerative diseases. Neural Regeneration Research. 16 (9), 1702-1710 (2021).
- Phatnani, H., Maniatis, T. Astrocytes in neurodegenerative disease. Cold Spring Harbor Perspectives in Biology. 7 (6), 020628 (2015).
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기더 많은 기사 탐색
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유