需要订阅 JoVE 才能查看此. 登录或开始免费试用。
Method Article
用于重组G蛋白偶联受体高通量筛选的"双加法"钙荧光测定
摘要
在这项工作中,描述了一种用于384孔板的高通量细胞内钙荧光测定,以筛选重组G蛋白偶联受体(GPCR)上的小分子文库。靶标是来自牛瘟蜱的激肽受体, Rhipicephalus microplus, 在CHO-K1细胞中表达。该测定法在一个"双重添加"测定中使用相同的细胞识别激动剂和拮抗剂。
摘要
G蛋白偶联受体(GPCR)是受体的最大超家族,是许多人类药物的靶标。针对GPCR的随机小分子文库的高通量筛选(HTS)被制药行业用于靶标特异性药物发现。在这项研究中,使用HTS鉴定无脊椎动物特异性神经肽GPCRs的新型小分子配体,作为致命人类和兽医病原体载体生理研究的探针。
选择无脊椎动物特异性激肽受体作为靶标,因为它调节无脊椎动物的许多重要生理过程,包括利尿、摄食和消化。此外,许多无脊椎动物GPCR的药理学特征不佳或根本没有表征;因此,这些受体组相对于其他后生动物,特别是人类中的相关GPCR的差异药理学,为GPCR作为一个超家族的结构 - 活性关系增加了知识。为384孔板中的细胞开发了一种HTS测定法,用于从牛热蜱或南方牛蜱, Rhipicephalus microplus中发现激肽受体的配体。蜱激肽受体在CHO-K1细胞中稳定表达。
激肽受体被内源性激肽神经肽或其他小分子激动剂激活时,触发钙储存的Ca2+ 释放到细胞质中。这种钙荧光测定与"双重添加"方法相结合,可以检测同一测定板中的功能激动剂和拮抗剂"命中"分子。每次测定都是使用携带320个随机小分子阵列的药物板进行的。获得可靠的 Z' 因子为 0.7,当 HTS 处于 2 μM 终浓度时,鉴定出 3 个激动剂和 2 个拮抗剂命中分子。此处报告的钙荧光测定可以适用于筛选激活Ca2+ 信号级联的其他GPCR。
引言
G蛋白偶联受体(GPCRs)存在于酵母到人类,是许多生物体中最大的受体超家族1。它们在调节动物几乎所有生物过程中起着关键作用。节肢动物的基因组中有50-200个GPCR,这意味着它们代表了最大的膜受体超家族2。它们根据序列相似性和功能分为六大类,A-F3。GPCR转导各种细胞外信号,例如激素,神经肽,生物胺,谷氨酸,质子,脂糖蛋白和光子的信号4。GPCR与异源三聚体G蛋白(Gα,Gβ和Gγ)偶联以传递下游信号。与Gαs 或Gαi / o 蛋白偶联的GPCR通过激活或抑制腺苷环化酶分别增加或降低细胞内3',5'-环磷酸腺苷(cAMP)水平。与Gαq/11 偶联的GPCR通过激活磷脂酶C(PLC)-肌醇-1,4,5-三磷酸(IP3)途径,诱导钙从内质网钙储存中释放。与Gα12/13 偶联的GPCR激活RhoGTP酶核苷酸交换因子5,6。GPCR是超过50%的人类药物和杀螨剂amitraz4的靶标。由于GPCR转导了如此多样化的信号,它们是开发破坏无脊椎动物特异性生理功能的新型杀虫剂的有希望的目标。
HTS的目标是识别可以调节受体功能的命中分子。HTS 涉及检测开发、小型化和自动化7。节肢动物神经肽GPCR参与大多数生理功能,如发育、蜕皮和蜕皮、排泄、能量动员和繁殖4。节肢动物和后生动物的大多数神经肽GPCR通过钙信号级联反应2,6,8,9,10发出信号,例如在黑腿蜱肩突硬蜱的肌抑制肽和SIFamide受体中;它们的配体在后肠运动测定中具有拮抗作用,SIF引起收缩,MIP抑制收缩11,12。黄热病蚊子的NPY样受体埃及伊蚊调节雌性宿主寻找13。与其他替代钙动员测定(例如水杉钙生物发光测定14)相比,钙荧光测定易于执行,不需要转染其他重组钙检测蛋白,并且具有成本效益。与在水杉钙生物发光测定中获得的快速动力学信号相比,钙荧光测定产生更长的信号14,15.
在这里的示例中,来自牛瘟蜱的激 肽受体Rhipicephalus microplus在CHO-K1细胞系中重组表达并用于钙荧光测定。在 R. microplus中仅发现一个激肽受体基因;受体通过Gq蛋白依赖性信号通路发出信号,并触发Ca2+ 从钙储存到细胞内空间的外排16。该过程可以通过荧光团进行检测和定量,荧光团在结合钙离子时引发荧光信号(图1)。
激肽受体是无脊椎动物特异性GPCR,属于A类视紫红质样受体。激肽是一种古老的信号神经肽,存在于软体动物、甲壳纲、昆虫和螨科4,17,18 中。鞘翅目动物(甲虫)缺乏激肽信号系统;在蚊子埃及伊蚊中,只有一个激肽受体结合三个伊蚊素,而黑腹果蝇有一个激肽受体,果蓿素作为独特的配体19,20,21。脊椎动物中没有同源激肽或激肽受体。虽然激肽的确切功能在蜱中尚不清楚,但激肽受体RNAi沉默的雌性R. microplus显示出显着降低的生殖适应性22。激肽是昆虫中的多效性肽。在黑腹果蝇中,它们参与中枢和周围神经系统调节系统23,蜕皮前期24,喂养25,代谢26和睡眠活动模式26,27,以及幼虫运动28。激肽调节蚊子埃及伊蚊的后肠收缩、利尿和摄食 29,30,31。激肽具有保守的C端五肽Phe-X1-X2-Trp-Gly-NH2,这是生物活性所需的最小序列32。节肢动物的特异性、内源性配体的小尺寸(使其易于小分子干扰)以及昆虫中的多效性功能使激肽受体成为害虫防治的有希望的靶标4。
"双重加成"测定(图2)允许在同一HTS测定15中鉴定激动剂或拮抗剂。它改编自制药行业中通常用于药物发现的"双重添加"测定33。简而言之,与溶剂对照的应用相比,首次将药物添加到细胞板中允许在检测到更高的荧光信号时鉴定化学库中的潜在激动剂。用这些小分子孵育5分钟后,将已知的激动剂(激肽)施用于所有孔。与在第一次添加中接受溶剂的对照孔相比,那些从药物板随机接受拮抗剂的孔在加入激动剂时显示出较低的荧光信号。然后,该测定允许鉴定具有相同细胞的潜在激动剂和拮抗剂。在标准的HTS项目中,这些命中分子将通过剂量反应测定和额外的生物活性测定进一步验证,此处未显示。
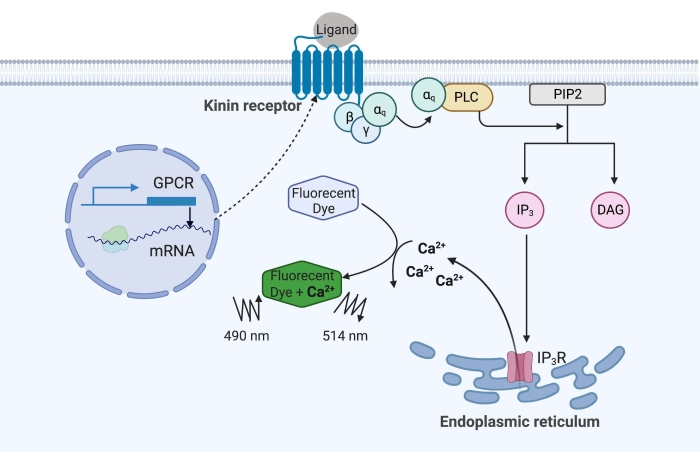
图1:钙荧光测定机理图示。Gq蛋白触发细胞内钙信号通路。激肽受体(G蛋白偶联受体)在CHO-K1细胞中重组表达。当激动剂配体与受体结合时,与激肽受体相关的Gq蛋白激活PLC,从而催化PIP2分子转化为IP3和DAG。然后,IP 3 与内质网表面的 IP3 R 结合,导致 Ca 2+ 释放到细胞质中,其中Ca 2+ 离子与荧光团结合并引发荧光信号。荧光信号可以通过在490nm处激发并在514nm处检测获得。缩写:GPCR = G蛋白偶联受体;PLC = 磷脂酶 C;PIP2 = 磷脂酰肌醇 4,5-二磷酸;IP3 = 肌醇三磷酸;DAG = 二酰基甘油;IP3 R = IP3 受体。用 BioRender.com 创建。请点击此处查看此图的大图。
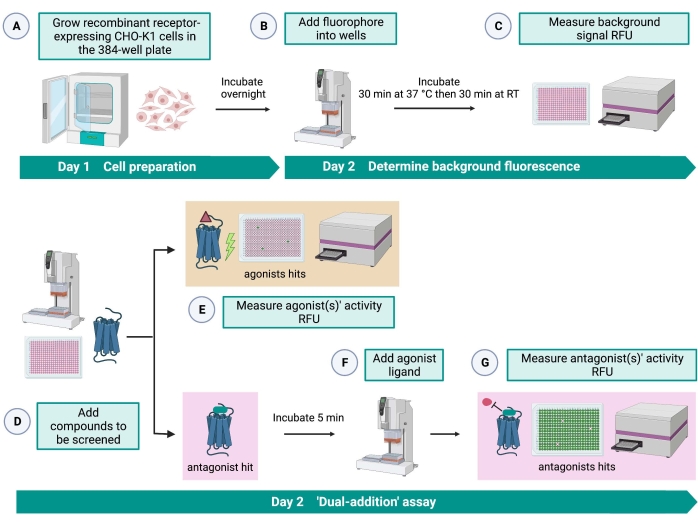
图 2:在 CHO-K1 细胞中表达的 G 蛋白偶联受体上高通量筛选小分子的工作流程。 (A)使用液体处理系统(25μL/孔)将稳定表达激肽受体的重组CHO-K1细胞添加到384孔板(10,000个细胞/孔)中,并在加湿的CO2培养箱中孵育12-16小时。)使用液体处理系统将含有荧光染料(25μL/孔)的测定缓冲液加入细胞板中。将板在37°C下孵育30分钟30分钟,并在室温下再平衡30分钟。 (C)用读板器测量每个孔中细胞的背景荧光信号。(D) 使用液体处理系统将来自 384 孔文库板和空白溶剂(均为 0.5 μL/孔)的药物溶液添加到细胞测定板中。(E)加入药物溶液后立即用酶标仪测量细胞钙荧光反应;引起高于平均水平荧光信号的化合物被挑选出来作为激动剂命中。在步骤G期间加入肽激动剂后,揭示了阻断GPCR的拮抗剂命中(下图)。(F)在同一测定板中,将细胞与筛选化合物孵育5分钟后,将蜱激肽受体的内源性激动剂肽Rhimi-K-1(QFSPWGamide)加入到每个孔(1μM)中。(G)加入激动剂肽后立即用酶标仪测量细胞荧光反应。选择抑制荧光信号的化合物作为拮抗剂命中。缩写:GPCR = G蛋白偶联受体;RT = 室温;RFU = 相对荧光单位。用 BioRender.com 创建。请点击此处查看此图的大图。
研究方案
1. 电池维护
注意:一种稳定表达来自 R. MICROPLUS的激肽受体的CHO-K1细胞系,名为BMLK3,由Holmes等人开发16。细胞系开发的细节详见其他专题14。以下所有步骤均在无菌条件下在II类生物安全柜中进行。
- 在选择性培养基(含有 10% 胎牛血清 [FBS] 和 800 μg/mL G418 硫酸盐的 F-12K 培养基)中培养重组细胞系,以确保靶受体的表达。将稳定表达受体的细胞储存在 1 mL 冷冻培养基(90% FBS 和 10% 二甲基亚砜 [DMSO])中,在 -80 °C 冰箱中的 2 mL 冷冻管中。
注意:为了长期储存冷冻细胞,请将它们储存在液氮中。 - 在细胞培养前预热所有培养基。在生物安全柜中,将 13 mL 预热的选择性培养基(含有 10% FBS 和 800 μg/mL G418 硫酸盐的 F-12K 培养基)转移到 T-75 烧瓶中,并将其保存在生物安全柜中。在37°C水浴中解冻一瓶冷冻的BMLK 3细胞(~1.5×106细胞)2-3分钟。将解冻的细胞转移到T-75烧瓶中。除非另有说明,否则将细胞保持在37°C和5%CO2的加湿培养箱中。
- 当细胞达到90%汇合度(1-2天)时,将所有培养基预热至37°C,但Dulbecco的磷酸盐缓冲盐水(DPBS)除外,其保持在室温下。在生物安全柜中,从T-75烧瓶中取出用过的培养基,轻轻旋转烧瓶,用10mL DPBS洗涤细胞5秒,然后用血清移液管取出DPBS。
注意:90%汇合度的CHO-K1细胞的图像显示在Lu等人14中。 - 通过加入2mL的0.25%胰蛋白酶-EDTA将细胞从T-75烧瓶中分离,并在培养箱中于37°C孵育3-5分钟。然后,加入 8 mL 选择性培养基,并用相同的血清移液器移液并轻轻释放 2x-3x 充分混合。
- 将步骤 1.4 中的 2 mL 细胞悬液(~1 × 106 个细胞)转移到含有 10 mL 温选择性培养基的新 T-75 烧瓶中。将细胞在培养箱中培养1-2天,直到它们达到90%汇合度。
- 按照后续步骤使用细胞进行测定,或在测定中使用细胞之前重复步骤1.4-1.5一次或两次。
注意:不要超过三到四代,因为某些细胞系的测定信号可能会随着进一步传代而变弱。
2. 钙荧光测定
- 涂覆细胞板。
- 使用放置在生物安全柜内的液体处理系统进行384孔板中的所有移液步骤。创建用于移液到384孔板31 (补充表S1)中的自定义程序。提前涂覆无菌384孔板。在生物安全柜中,将 10 μL/孔的聚-D-赖氨酸 (PDL) 水溶液以 0.05 mg/mL 加载到每个板中,并在室温下孵育 5 分钟。
- 通过快速倒置盘子并在无菌纸巾上轻轻吸干来清空盘子。然后,用 10 μL 水冲洗每个孔,清空板,并将板在没有盖子的情况下在生物安全柜中干燥过夜。盖上盘子,并在4°C的冰箱中储存。
注意:涂层板可以在4°C下储存长达6个月。
- 第一天
- 取出储存在-20°C冰箱中的药物板(100μM在90%DPBS + 10%DMSO中,HTS孔中的最终浓度为2μM),并将其置于室温下。
注意:药板布局:每个384孔板(24列x 16行)包含320个具有不同库化合物的孔和64个具有空白溶剂的孔(DPBS含有10%DMSO),它们排列成四列,每侧边缘有两列。有关板布局,请参阅 补充表S2 。 - 当细胞在T-75烧瓶中达到~70%-90%汇合度时,如下所述将细胞从T-75烧瓶中分离。将所有培养基预热至37°C,DPBS(室温)除外。
- 取出用过的培养基,用 10 mL DPBS 洗涤细胞,然后取出 DPBS。在培养箱中,使用2mL的0.25%胰蛋白酶-EDTA从T-75烧瓶中分离细胞3-5分钟,加入8mL选择性培养基,并将细胞悬液转移到15mL锥形管中,以1,000× g 离心3分钟。
- 弃去上清液,并将细胞沉淀重悬于含有 1% FBS 和 400 μg/mL G418 硫酸盐的 10 mL F-12K 培养基中。在确定细胞计数时将悬浮液保存在生物安全柜中。
- 确定悬浮液的细胞密度以进一步稀释:将 20 μL 细胞悬液混合到 20 μL 0.4% 台盼蓝中,然后将 20 μL 混合物加载到细胞计数室中,由细胞计数器读取细胞密度。
- 将细胞悬液稀释在同一培养基(含有 1% FBS 和 400 μg/mL G418 硫酸盐的 F-12K 培养基)中,以 4 × 105 个细胞/mL 的密度稀释至至少 15 mL 的最终体积。
- 将细胞接种在PDL包被的384孔板中。将上述 15 mL 细胞悬液(4 × 105 个细胞/mL)转移到 150 mL 自动友好型试剂储液槽中。使用液体处理系统分两步将 25 μL 细胞悬液(~10,000 个细胞/孔)分配到板的 384 个孔的每个孔中。将 384/12.5 μL 低保留吸头加载到液体处理器头上,从储液槽中吸出 12.5 μL(速度 5.2 μL/s),然后分配到每个孔中(速度:3.1 μL/s)。
- 按照上一步2.2.5重复移液,达到每孔25μL。然后,将板在37°C和5%CO2 在加湿培养箱中孵育过夜(14-16小时)。
注意:由于该特定头的最大移液体积为12.5 μL,因此分两步进行25 μL移液。
- 取出储存在-20°C冰箱中的药物板(100μM在90%DPBS + 10%DMSO中,HTS孔中的最终浓度为2μM),并将其置于室温下。
- 第二天
- 第二天早上,在显微镜下检查覆盖的细胞板;如果不汇合,请等到细胞达到90%汇合。
- 制备荧光染料储备溶液:将冻干的荧光染料重悬于100μLDMSO中,并避免在储备溶液上直射光。用铝箔包裹管子以防止光漂白。
注意:对于每个平板测定,可以将原液等分成 15 μL 等分试样,以避免反复冷冻和解冻;等分试样可以在-80°C下储存长达1个月。 - 在熄灯的生物安全柜中,在用铝箔包裹的 15 mL 锥形管中制备上样染料 (1x),将 15 μL 荧光染料储备溶液(来自步骤 2.3.2)和其余预热试剂盒组分 (37 °C):13.5 mL 1x HHBS(汉克缓冲液,20 mM HEPES)和 1.5 mL 试剂 B(染料外排抑制剂)。
注意:在此步骤中,房间灯亮起。 - 关闭试管并通过轻轻倒置试管几次(通常为 3-5x)充分混合。
注意:保持在室温下,并在30分钟内使用加载染料混合物。 - 当细胞达到90%汇合度时,通过快速倒置板并在无菌纸巾上轻轻吸干,从384孔测定板上除去用过的培养基;重复此动作2x-3x以除去板中的所有液体。丢弃湿毛巾。
- 关闭房间内的大多数人工直射灯(保持柔和,昏暗的台灯打开或类似以允许可见的工作条件)和生物安全柜中的所有步骤,直到测定结束(约1.5小时)。
- 将步骤 2.3.3 中的 15 mL 上样染料 (1x) 放入 150 mL 自动友好型储液槽中。
- 使用具有 384/12.5 μL 低保留吸头的液体处理系统将 25 μL 上样染料 (1x) 从储液器转移到每个孔中,方法是将 12.5 μL 分配到板的每个孔中(吸液和分液速度:3.8 μL/s)。
- 重复2.3.7.1中的移液步骤,以在板的每个孔中达到25μL的最终体积。用铝箔覆盖并包裹板,以保护其免受环境光照射。
- 将覆盖的细胞板在CO2 加湿培养箱中于37°C孵育30分钟,将其从培养箱中取出,并在读板器内或工作台上的室温下平衡,保持板盖并用箔纸包裹再30分钟。然后将细胞准备好进行高通量筛选(HTS)。
- 化学制备:将步骤2.2.1中的药物板在室温下在平板离心机中以1,200× g 旋转1分钟。
- 通过将 10 nmole 冻干肽重悬于 10 mL 含有 0.1% DMSO 的 1x HHBS 中,制备 Rhimi-K-1 (QFSPWGamide) (10 μM) 的 10 倍激动剂肽溶液,并将溶液转移到 150 mL 自动友好型储液槽中。
- 测量背景信号:对于酶标仪中的整个HTS测定,在 协议下,选择 终点荧光模式。
注意:荧光信号从板底部以495nm/525nm的激发/发射波长读取。- 将细胞板插入读板器。在仪表板中,选择调整增益,在板上选择一个随机孔,将其分配为最大可测量荧光值的5%-10%,然后选择调整(读数)高度。
- 单击 开始测量 以读取整个板的背景荧光信号(以相对荧光单位 (RFU) 为单位)。
- "双重加法"检测
- 使用带有 384/12.5 μL 吸头的液体处理系统,在药板的每个孔中混合药物溶液,上下移液 3 倍 10 μL 药物溶液(在含有 10% DMSO 的 DPBS 中)(移液速度:5.2 μL/s),并从药板的每个孔中"吸出"1.5 μL(吸液速度:1.0 μL/s)。
- 将 0.5 μL 化合物"分配"到细胞测定板中(移液速度:1 μL/s),以在 0.2% DMSO 中达到 2 μM 的终浓度。
- 加入筛选化合物后,立即将测定板放入酶标仪中。在正向和反向读取方向上读取同一板。要获得这些读数,请定义一个程序以从"井 1-384"读取,并立即从"384-1"读取。
注意:两个方向的读数总共需要 2 分钟。这种读出设计是为了补偿在每个方向上读取板时发生的信号强度下降。有关读出分析,请参阅步骤3.1。 - 将吸头浸入含有 ~50 mL DPBS 的 150 mL 废液槽中(分液速度:1.0 μL/s),将吸头中剩余的 1 μL 药物溶液丢弃在吸头中。
- 将筛选化合物与细胞一起在室温下在生物安全柜中孵育总共5分钟(包括2分钟的板读数),并关闭灯。使用液体处理系统(分液速度:3.1 μL/s)和 384/12.5 μL 吸头,从储液器中加入 3 μL 激动剂肽 Rhimi-K-1 (QFSPWGamide)(抽吸速度:3.1 μL/s)。
- 加入激动剂肽后立即将板放入读板器中。使用与步骤2.3.12.3相同的程序在正向和反向方向上读取板
3. 数据分析
- 使用与安装在计算机上的酶标仪关联的分析软件,计算第一次添加化合物后两个读数的细胞荧光响应(在RFU中)(第一次读取; RFU前[补充表S2])和激动剂添加步骤后(第二次读取= RFU蚂蚁 [补充表S2])。每个读数分别通过分别从步骤2.3.12.3和步骤2.3.12.6的正向和反向板读数获得的两个值(未显示)求平均值来获得。
注:RFU前,RFU蚂蚁分别指潜在激动剂命中(在步骤2.3.12.3中读取)和潜在拮抗剂命中(在步骤2.3.12.6中读取)的相对荧光单位。 - 将所有三组数据(RFUbg、RFU ago和RFUant)从分析软件导出到三个单独的电子表格中。每个电子表格只有两列:井位和原始RFU(此处未显示的文件)。
注意: RFUbg 是指在步骤 2.3.11.2 中读取的背景 RFU。 - 格式化三个电子表格中的数据,并将上述数据组织在一个 csv 文件中(请参阅补充表 S2 中的示例)。分别减去从RFU前和RFU蚂蚁读取的背景信号(补充表S2中的G和H列)。
- 将csv文件导入市售的"在线HTS数据平台"(见 材料表)进行下游数据分析(表1)和存储。
- 使用公式(1)手动计算每个板测定质量控制的Z'因子:
等式(1):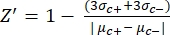 (1)
(1)
注意:μc-和μc+表示相同孔读数的平均RFU,在加入溶剂后第一次添加时用作阴性对照(空白溶剂,n = 64;补充表S2中的蓝色数字),并在加入激动剂(空白溶剂+激动剂,n = 64;洋红色数字)后作为阳性对照, 分别。此外,σc- 和 σ c+ 表示其相应的标准偏差 (SD)。 - 从"在线HTS数据平台"的热图中手动选择命中分子,并使用公式(2)和等式(3)计算激动剂命中和拮抗剂命中的归一化活化百分比(NPA)和抑制活性(Io):
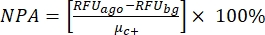 (二)
(二)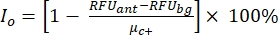 (三)
(三)
结果
以320个随机小分子组成的内部药物板(SAC2-34-6170)为例,用于演示该HTS测定。HTS具有出色的检测质量,Z'因子为0.7(表1)。该Z'因子反映了独立于测试化合物34的测定质量。Z′因子为0.5或更大表示阳性对照和阴性对照的RFU之间的测定信号动态范围良好。Z'因子小于0.5的检测具有次优的信号动态范围,通常无法为命中选择提供信息,因此被丢弃。阳性对...
讨论
HTS的目标是通过筛选大量小分子来识别命中分子。因此,本例的结果仅代表常规HTS实验的一小部分。此外,鉴定出的命中分子需要在下游检测中验证,例如在同一重组细胞系和仅携带空载体的 CHO-K1 细胞系上进行剂量依赖性检测,可以同时进行以保存小分子。细胞毒性测定将有助于证明第二次添加时缺乏反应不是由于细胞死亡率。应进行其他生物测定以验证 体外分离组织中的活性,或者通?...
披露声明
作者没有需要披露的利益冲突。
致谢
这项工作得到了美国农业部-NIFA-AFRI动物健康和福祉奖(奖项编号2022-67015-36336,PVP [项目总监])的支持,以及德克萨斯州A&M AgriLife研究昆虫媒介疾病资助计划(FY'22-23)的竞争性资金给P.V.P. TAMU农业与生命科学学院的A.W.E.S.O.M.E.教师小组因帮助编辑手稿而受到认可。 补充表S2 包含来自德克萨斯A&M大学James Sacchettini博士实验室和德克萨斯A&M AgriLife Research的内部随机小分子库的数据。
材料
| Name | Company | Catalog Number | Comments |
| 0.25% trypsin-EDTA | Gibco Invitrogen | 15050-065 | with phenol red |
| 0.4% trypan blue | MilliporeSigma | T8154 | liquid, sterile |
| 1.5 mL microcentrifuge tubes | Thermo Fisher | AM12400 | RNase-free Microfuge Tubes |
| 5 mL serological pipette | Corning | 29443-045 | Corning Costar Stripette individually wrapped |
| 10 mL serological pipette | Corning | 29443-047 | Corning Costar Stripette individually wrapped |
| 15 mL conical tubes | Falcon | 352196 | sterile |
| 20 µL filter tips | USA Scientifc Inc. | P1121 | sterile, barrier |
| 25 mL serological pipette | Corning | 29443-049 | Corning Costar Stripette individually wrapped |
| 50 mL conical tubes | Corning | 430828 | graduated, sterile |
| 150 mL auto-friendly reservior | Integra Bioscience | 6317 | sterile, individually wrapped for cell seeding in day 1 |
| 150 mL auto-friendly reservior | Integra Bioscience | 6318 | sterile, stacked, for loading dye in day 2 |
| 384/ 12.5 µL low retention tips | Integra Bioscience | 6405 | long, sterile filter |
| 384/ 12.5 µL tips | Integra Bioscience | 6404 | long, sterile filter |
| 384-well plate | Greiner | 781091 | CELLSTAR, clear polystyrene, µClear, Black/Flat |
| Aluminum plate seals | Axygen Scientific | PCR-AS-200 | polyester-based |
| Aluminum foil wrap | Walmart | ||
| Biosafty cabinet II | NuAire | NU-540-300 | |
| Cell counter | Nexcelom | AutoT4 | |
| cell counting slides | Nexcelom | SD-100 | 20 µL chamber |
| CO2 humidified incubator | Thermo Fisher | Forma Series II | |
| Desk Lamp | SunvaleeyTEK | RS1000B | |
| Dimethyl sulfoxide | MilliporeSigma | 276855 | anhydous, >99.9% |
| Drug plate | Corning | 3680 | |
| Dulbecco's phosphate-buffered saline | Corning | 21-031-CV | DPBS, 1x without calcium amd magnesium |
| Ethanol | Koptec | 2000 | |
| F-12K Nutrient Mixture | Corning | 45000-354 | (Kaighn's Mod.) with L-glutamine |
| Fetal bovine serum | Equitech-Bio | SFBU30 | |
| Fluorescent calcium assay kit | ENZO Lifescience | ENZ-51017 | 10x96 tests |
| G418 sulfate | Gibco Invitrogen | 10131-027 | Geneticin selective antibiotic 50 mg/mL |
| Hank's buffer | MilliporeSigma | 55037C | HBSS modified, with calcium, with magnesium, without phenol read |
| HEPES buffer | Gibco Invitrogen | 15630-080 | 1 Molar |
| HTS data storage plateform | CDD vault | https://www.collaborativedrug.com/ | |
| Liquid handling system | Integra Bioscience | Viaflo | 384/12.5 µL |
| Plate centrifuge | Thermo Fisher | Sorvall ST8 | |
| Plate reader | BMG technology | Clariostar | |
| Poly-D-lysine | MilliporeSigma | P6407 | |
| Rhimi-K-1 agonist peptide | Genscript | custom order | QFSPWGamide |
| T-75 flask | Falcon | 353136 |
参考文献
- Hanlon, C. D., Andrew, D. J. Outside-in signaling - A brief review of GPCR signaling with a focus on the Drosophila GPCR family. Journal of Cell Science. 128 (19), 3533-3542 (2015).
- Liu, N., Li, T., Wang, Y., Liu, S. G-protein coupled receptors (GPCRs) in insects-A potential target for new insecticide development. Molecules. 26 (10), 2993 (2021).
- Pierce, K. L., Premont, R. T., Lefkowitz, R. J. Seven-transmembrane receptors. Nature Reviews Molecular Cell Biology. 3, 639-650 (2002).
- Pietrantonio, P. V., Xiong, C., Nachman, R. J., Shen, Y. G protein-coupled receptors in arthropod vectors: Omics and pharmacological approaches to elucidate ligand-receptor interactions and novel organismal functions. Current Opinion in Insect Science. 29, 12-20 (2018).
- Hilger, D., Masureel, M., Kobilka, B. K. Structure and dynamics of GPCR signaling complexes. Nature Structural & Molecular Biology. 25 (1), 4-12 (2018).
- Liu, N., Wang, Y., Li, T., Feng, X. G-protein coupled receptors (GPCRs): Signaling pathways, characterization, and functions in insect physiology and toxicology. International Journal of Molecular Sciences. 22 (10), 5260 (2021).
- Hansen, K. B., Bräuner-Osborne, H., Leifert, W. FLIPR® assays of intracellular calcium in GPCR drug discovery. G Protein-Coupled Receptors in Drug Discovery. , (2009).
- Bauknecht, P., Jekely, G. Large-scale combinatorial deorphanization of Platynereis neuropeptide GPCRs. Cell Reports. 12 (4), 684-693 (2015).
- Frooninckx, L., et al. Neuropeptide GPCRs in C. elegans. Frontiers in Endocrinology. 3, 167 (2012).
- Caers, J., et al. More than two decades of research on insect neuropeptide GPCRs: An overview. Frontiers in Endocrinology. 3, 151 (2012).
- Šimo, L., Koči, J., Park, Y. Receptors for the neuropeptides, myoinhibitory peptide and SIFamide, in control of the salivary glands of the blacklegged tick Ixodes scapularis. Insect Biochemistry and Molecular Biology. 43 (4), 376-387 (2013).
- Šimo, L., Park, Y. Neuropeptidergic control of the hindgut in the black-legged tick Ixodes scapularis. International Journal for Parasitology. 44 (11), 819-826 (2014).
- Liesch, J., Bellani, L. L., Vosshall, L. B. Functional and genetic characterization of neuropeptide Y-like receptors in Aedes aegypti. PLoS Neglected Tropical Diseases. 7 (10), 2486 (2013).
- Lu, H. L., Kersch, C. N., Taneja-Bageshwar, S., Pietrantonio, P. V. A calcium bioluminescence assay for functional analysis of mosquito (Aedes aegypti) and tick (Rhipicephalus microplus) G protein-coupled receptors. Journal of Visualized Experiments. (50), e2732 (2011).
- Xiong, C., Baker, D., Pietrantonio, P. V. The cattle fever tick, Rhipicephalus microplus, as a model for forward pharmacology to elucidate kinin GPCR function in the Acari. Frontiers in Physiology. 10, 1008 (2019).
- Holmes, S. P., Barhoumi, R., Nachman, R. J., Pietrantonio, P. V. Functional analysis of a G protein-coupled receptor from the Southern cattle tick Boophilus microplus (Acari: Ixodidae) identifies it as the first arthropod myokinin receptor. Insect Molecular Biology. 12 (1), 27-38 (2003).
- Cox, K. J., et al. Cloning, characterization, and expression of a G-protein-coupled receptor from Lymnaea stagnalis and identification of a leucokinin-like peptide, PSFHSWSamide, as its endogenous ligand. Journal of Neuroscience. 17 (4), 1197-1205 (1997).
- Dircksen, H., Kastin, A. J. Chapter 32 - Crustacean bioactive peptides. Handbook of Biologically Active Peptides (Second Edition). , 209-221 (2013).
- Halberg, K. A., Terhzaz, S., Cabrero, P., Davies, S. A., Dow, J. A. Tracing the evolutionary origins of insect renal function. Nature Communications. 6, 6800 (2015).
- Pietrantonio, P. V., Jagge, C., Taneja-Bageshwar, S., Nachman, R. J., Barhoumi, R. The mosquito Aedes aegypti (L.) leucokinin receptor is a multiligand receptor for the three Aedes kinins. Insect Molecular Biology. 14 (1), 55-67 (2005).
- Radford, J. C., Davies, S. A., Dow, J. A. Systematic G-protein-coupled receptor analysis in Drosophila melanogaster identifies a leucokinin receptor with novel roles. Journal of Biological Chemistry. 277 (41), 38810-38817 (2002).
- Brock, C. M., et al. The leucokinin-like peptide receptor from the cattle fever tick, Rhipicephalus microplus, is localized in the midgut periphery and receptor silencing with validated double-stranded RNAs causes a reproductive fitness cost. International Journal for Parasitology. 49 (3-4), 287-299 (2019).
- Nässel, D. R. Leucokinin and associated neuropeptides regulate multiple aspects of physiology and behavior in Drosophila. International Journal of Molecular Sciences. 22 (4), 1940 (2021).
- Kim, Y. -. J., et al. Central peptidergic ensembles associated with organization of an innate behavior. Proceedings of the National Academy of Sciences of the United States of America. 103 (38), 14211-14216 (2006).
- Al-Anzi, B., et al. The leucokinin pathway and its neurons regulate meal size in Drosophila. Current Biology. 20 (11), 969-978 (2010).
- Yurgel, M. E., et al. A single pair of leucokinin neurons are modulated by feeding state and regulate sleep-metabolism interactions. PLoS Biology. 17 (2), 2006409 (2019).
- Nässel, D. R., Zandawala, M. Recent advances in neuropeptide signaling in Drosophila, from genes to physiology and behavior. Progress in Neurobiology. 179, 101607 (2019).
- Okusawa, S., Kohsaka, H., Nose, A. Serotonin and downstream leucokinin neurons modulate larval turning behavior in Drosophila. Journal of Neuroscience. 34 (7), 2544-2558 (2014).
- Kersch, C. N., Pietrantonio, P. V. Mosquito Aedes aegypti (L.) leucokinin receptor is critical for in vivo fluid excretion post blood feeding. FEBS letters. 585 (22), 3507-3512 (2011).
- Kwon, H., et al. Leucokinin mimetic elicits aversive behavior in mosquito Aedes aegypti (L.) and inhibits the sugar taste neuron. Proceedings of the National Academy of Sciences of the United States of America. 113 (25), 6880-6885 (2016).
- Xiong, C., Baker, D., Pietrantonio, P. V. A random small molecule library screen identifies novel antagonists of the kinin receptor from the cattle fever tick, Rhipicephalus microplus (Acari: Ixodidae). Pest Management Science. 77 (5), 2238-2251 (2021).
- Torfs, P., et al. The kinin peptide family in invertebrates. Annals of the New York Academy of Sciences. 897 (1), 361-373 (1999).
- Ma, Q., Ye, L., Liu, H., Shi, Y., Zhou, N. An overview of Ca2+ mobilization assays in GPCR drug discovery. Expert Opinion on Drug Discovery. 12 (5), 511-523 (2017).
- Zhang, J. -. H., Chung, T. D., Oldenburg, K. R. A simple statistical parameter for use in evaluation and validation of high throughput screening assays. Journal of Biomolecular Screening. 4 (2), 67-73 (1999).
- Zhang, R., Xie, X. Tools for GPCR drug discovery. Acta Pharmacologica Sinica. 33 (3), 372-384 (2012).
- Offermanns, S., Simon, M. I. Gα15 and Gα16 couple a wide variety of receptors to phospholipase C. Journal of Biological Chemistry. 270 (25), 15175-15180 (1995).
- Murgia, M. V., et al. High-content phenotypic screening identifies novel chemistries that disrupt mosquito activity and development. Pesticide Biochemistry and Physiology. 182, 105037 (2022).
- Lismont, E., et al. Can BRET-based biosensors be used to characterize G-protein mediated signaling pathways of an insect GPCR, the Schistocerca gregaria CRF-related diuretic hormone receptor. Insect Biochemistry and Molecular Biology. 122, 103392 (2020).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。