É necessária uma assinatura da JoVE para visualizar este conteúdo. Faça login ou comece sua avaliação gratuita.
Method Article
Um ensaio de fluorescência de cálcio de "dupla adição" para a triagem de alto rendimento de receptores acoplados à proteína G recombinante
Neste Artigo
Resumo
Neste trabalho, um ensaio de fluorescência de cálcio intracelular de alto rendimento para placas de 384 poços para rastrear pequenas bibliotecas de moléculas em receptores acoplados à proteína G recombinante (GPCRs) é descrito. O alvo, o receptor de cinina do carrapato da febre do gado, Rhipicephalus microplus, é expresso em células CHO-K1. Este ensaio identifica agonistas e antagonistas usando as mesmas células em um ensaio de "adição dupla".
Resumo
Os receptores acoplados à proteína G (GPCRs) representam a maior superfamília de receptores e são os alvos de inúmeras drogas humanas. A triagem de alto rendimento (HTS) de bibliotecas aleatórias de pequenas moléculas contra GPCRs é usada pela indústria farmacêutica para a descoberta de medicamentos específicos do alvo. Neste estudo, um HTS foi empregado para identificar novos ligantes de moléculas pequenas de neuropeptídeos específicos de invertebrados GPCRs como sondas para estudos fisiológicos de vetores de patógenos humanos e veterinários mortais.
O receptor de cinina específico para invertebrados foi escolhido como alvo porque regula muitos processos fisiológicos importantes em invertebrados, incluindo diurese, alimentação e digestão. Além disso, a farmacologia de muitos GPCRs de invertebrados é mal caracterizada ou não é caracterizada; portanto, a farmacologia diferencial desses grupos de receptores em relação aos GPCRs relacionados em outros metazoários, especialmente humanos, acrescenta conhecimento às relações estrutura-atividade dos GPCRs como uma superfamília. Um ensaio HTS foi desenvolvido para células em placas de 384 poços para a descoberta de ligantes do receptor de cinina do carrapato da febre do gado, ou carrapato do gado do sul, Rhipicephalus microplus. O receptor de cinina do carrapato foi expresso de forma estável em células CHO-K1.
O receptor de cinina, quando ativado por neuropeptídeos endógenos de cinina ou outros agonistas de moléculas pequenas, desencadeia a liberação de Ca2+ das reservas de cálcio no citoplasma. Este ensaio de fluorescência de cálcio combinado com uma abordagem de "adição dupla" pode detectar moléculas de "impacto" de agonistas funcionais e antagonistas na mesma placa de ensaio. Cada ensaio foi conduzido usando placas de drogas carregando uma matriz de 320 pequenas moléculas aleatórias. Um fator Z confiável de 0,7 foi obtido, e três moléculas de ataque agonista e dois antagonistas foram identificados quando o HTS estava em uma concentração final de 2 μM. O ensaio de fluorescência de cálcio relatado aqui pode ser adaptado para rastrear outros GPCRs que ativam a cascata de sinalização Ca2 +.
Introdução
Os receptores acoplados à proteína G (GPCRs), que estão presentes desde a levedura até os seres humanos, representam a maior superfamília de receptores em muitos organismos1. Eles desempenham papéis críticos na regulação de quase todos os processos biológicos em animais. Existem 50-200 GPCRs no genoma dos artrópodes, o que significa que eles representam a maior superfamília de receptores de membrana2. Eles são classificados em seis classes principais, A-F, com base em sua similaridade de sequência e funções3. Os GPCRs transduziram vários sinais extracelulares, como os de hormônios, neuropeptídeos, aminas biogênicas, glutamato, prótons, lipoglicoproteínas e fótons4. Os GPCRs se acoplam às proteínas G heterotrímeras (Gα, Gβ e Gγ) para transmitir sinais a jusante. Os GPCRs acoplados às proteínas Gαs ou Gαi/o aumentam ou diminuem, respectivamente, os níveis intracelulares de 3', 5'-monofosfato cíclico de adenosina (cAMP) ativando ou inibindo a adenilil ciclase. GPCRs acoplados a Gαq/11 induzem a liberação de cálcio dos estoques de cálcio do retículo endoplasmático ativando a via fosfolipase C (PLC)-inositol-1,4,5-trifosfato (IP3). GPCRs acoplados a Gα12/13 ativam fatores de troca de nucleotídeos RhoGTPase 5,6. Os GPCRs são alvo de mais de 50% dos medicamentos humanos e de um acaricida, o amitraz4. À medida que os GPCRs transduzem sinais tão diversos, eles são alvos promissores para o desenvolvimento de novos pesticidas que interrompem as funções fisiológicas específicas dos invertebrados.
O objetivo do HTS é identificar moléculas de sucesso que podem modular as funções do receptor. A HTS envolve o desenvolvimento de ensaios, miniaturização e automação7. Os GPCRs neuropeptídicos artrópodes estão envolvidos na maioria das funções fisiológicas, como desenvolvimento, muda e ecdise, excreção, mobilização de energia e reprodução4. A maioria dos GPCRs neuropeptídicos de artrópodes e metazoários sinaliza através da cascata de sinalização de cálcio 2,6,8,9,10, como nos receptores de peptídeo mioinibitório e SIFamida do carrapato Ixodes scapularis; seus ligantes são antagônicos nos ensaios de motilidade do intestino traseiro, com o SIF provocando contração e a PImáx inibindo-a11,12. Um receptor do mosquito da febre amarela, semelhante ao NPY, o Aedes aegypti, regula a busca de hospedeiros fêmeas13. Em comparação com outros ensaios alternativos de mobilização de cálcio, como o ensaio de bioluminescência de cálcio aequorina14, o ensaio de fluorescência de cálcio é fácil de executar, não requer a transfecção de outras proteínas recombinantes de detecção de cálcio e é econômico. O ensaio de fluorescência de cálcio produz um sinal prolongado em comparação com o sinal cinético rápido obtido no ensaio de bioluminescência de cálcio de aequorina14,15.
No exemplo aqui, o receptor de cinina do carrapato da febre bovina, Rhipicephalus microplus, foi expresso recombinantemente na linhagem celular CHO-K1 e usado para o ensaio de fluorescência de cálcio. Existe apenas um gene receptor de cinina encontrado em R. microplus; o receptor sinaliza através de uma via de sinalização dependente da proteína Gq e desencadeia o efluxo de Ca2+ das reservas de cálcio para o espaço intracelular16. Esse processo pode ser detectado e quantificado por um fluoróforo, que provoca um sinal de fluorescência ao se ligar a íons cálcio (Figura 1).
O receptor de cinina é um GPCR específico de invertebrados, que pertence aos receptores de classe A do tipo rodopsina. A cinina é um antigo neuropeptídeo sinalizador presente em Mollusca, Crustacea, Insecta e Acari 4,17,18. Os coleópteros (besouros) não possuem o sistema de sinalização de cinina; no mosquito Aedes aegypti, há apenas um receptor de cinina que se liga a três aedeskininas, enquanto a Drosophila melanogaster possui um receptor de cinina com drosocinina como ligante único 19,20,21. Não existem cininas homólogas ou receptores de cinina em vertebrados. Embora a função exata da cinina seja desconhecida em carrapatos, as fêmeas silenciadas pelo RNAi do receptor de cinina de R. microplus apresentam aptidão reprodutiva significativamente reduzida22. As cininas são peptídeos pleotrópicos em insetos. Em Drosophila melanogaster, estão envolvidos nos sistemas reguladores nervosos central e periférico 23, pré-ecdise24, alimentação 25, metabolismo 26 e padrões de atividade do sono26,27, bem como locomoção larval 28. As cininas regulam a contração do intestino traseiro, a diurese e a alimentação do mosquito A. aegypti 29,30,31. Os peptídeos de cinina possuem um pentapeptídeo C-terminal conservado Phe-X1-X2-Trp-Gly-NH2, que é a sequência mínima necessária para a atividade biológica32. A especificidade dos artrópodes, o pequeno tamanho do ligante endógeno, que os torna passíveis de interferência de moléculas pequenas, e as funções pleiotrópicas em insetos tornam o receptor de cinina um alvo promissor para o controle de pragas4.
O ensaio de "dupla adição" (Figura 2) permite a identificação de agonistas ou antagonistas no mesmo ensaio de HTS15. É adaptado de um ensaio de "dupla adição" que é comumente usado na indústria farmacêutica para a descoberta de medicamentos33. Em resumo, a primeira adição de fármacos na placa celular permite a identificação de potenciais agonistas na biblioteca química quando um sinal de fluorescência mais alto é detectado em comparação com a aplicação do controle de solvente. Após 5 minutos de incubação com essas pequenas moléculas, um agonista conhecido (peptídeo cinina) é aplicado a todos os poços. Os poços que receberam aleatoriamente um antagonista da placa de droga exibem um sinal de fluorescência mais baixo após a adição de agonista em comparação com os poços de controle que receberam o solvente na primeira adição. Este ensaio permite então a identificação de potenciais agonistas e antagonistas com as mesmas células. Em um projeto HTS padrão, essas moléculas atingidas seriam validadas através de ensaios de dose-resposta e por ensaios adicionais de atividade biológica, que não são mostrados aqui.
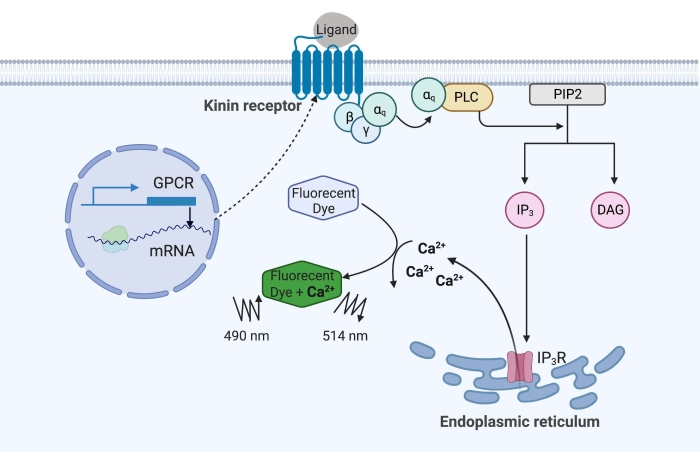
Figura 1: Ilustração do mecanismo de ensaio de fluorescência de cálcio. A proteína Gq desencadeia a via de sinalização de cálcio intracelular. O receptor de cinina (receptor acoplado à proteína G) foi expresso recombinantemente em células CHO-K1. Quando o ligante agonista se liga ao receptor, a proteína Gq associada ao receptor de cinina ativa o PLC, que catalisa a conversão de uma molécula PIP2 em IP3 e DAG. O IP 3 então se liga ao IP3R na superfície do retículo endoplasmático, levando à liberação de Ca 2+ no citoplasma, onde os íons Ca2+ se ligam aos fluoróforos e provocam um sinal de fluorescência. O sinal de fluorescência pode ser obtido por excitação a 490 nm e detectado a 514 nm. Abreviaturas: GPCR = receptor acoplado à proteína G; PLC = fosfolipase C; PIP2 = fosfatidilinositol 4,5-bisfosfato; IP3 = trisfosfato de inositol; DAG = diacilglicerol; IP3 R = receptor IP3. Criado com BioRender.com. Por favor, clique aqui para ver uma versão maior desta figura.
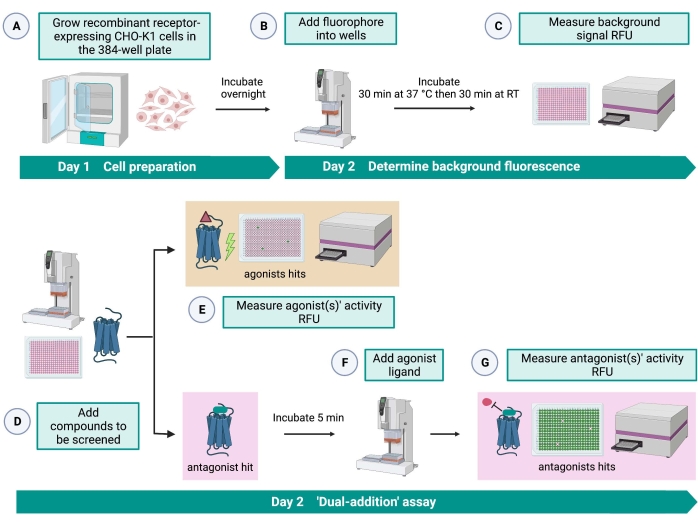
Figura 2: O fluxo de trabalho para a triagem de alto rendimento de pequenas moléculas em um receptor acoplado à proteína G expresso em células CHO-K1. (A) Células CHO-K1 recombinantes expressando de forma estável o receptor de cinina foram adicionadas à placa de 384 poços (10.000 células/poço) usando um sistema de manuseio de líquidos (25 μL/poço) e incubadas em uma incubadora de CO2 umidificada por 12-16 h. (B ) O tampão de ensaio contendo o corante fluorescente (25 μL/poço) foi adicionado à placa celular utilizando um sistema de manuseio de líquidos. A placa foi incubada por 30 min a 37 °C por 30 min e equilibrada em RT por mais 30 min. (C) O sinal de fluorescência de fundo das células em cada poço foi medido com um leitor de placas. (D) Soluções medicamentosas de uma placa de biblioteca de 384 poços e solvente em branco (todos a 0,5 μL/poço) foram adicionados à placa de ensaio celular usando um sistema de manuseio de líquidos. (E) As respostas celulares de fluorescência de cálcio foram medidas com o leitor de placas imediatamente após a adição das soluções medicamentosas; composto(s) que provocaram sinais de fluorescência acima da média foram escolhidos como a(s) agonista(s) atingida(s). Golpes antagonistas que bloqueiam o GPCR (ícone abaixo) foram revelados após a adição do agonista peptídico durante a etapa G. (F) Na mesma placa de ensaio, após 5 min de incubação das células com compostos de triagem, um peptídeo agonista endógeno Rhimi-K-1 (QFSPWGamida) do receptor de cinina do carrapato foi adicionado a cada poço (1 μM). (G) As respostas de fluorescência celular após a adição do peptídeo agonista foram medidas pelo leitor de placas imediatamente. O(s) composto(s) inibidor(es) do sinal de fluorescência foram selecionados como antagonista(s) hit(s). Abreviaturas: GPCR = receptor acoplado à proteína G; RT = temperatura ambiente; RFU = unidades de fluorescência relativa. Criado com BioRender.com. Por favor, clique aqui para ver uma versão maior desta figura.
Protocolo
1. Manutenção celular
NOTA: UMA LINHAGEM CELULAR CHO-K1 que expressa de forma estável o receptor de cinina de R. microplus, denominada BMLK3, foi desenvolvida por Holmes et al.16. Os detalhes do desenvolvimento da linhagem celular são apresentados em outro lugar14. Todas as etapas a seguir são realizadas em condições estéreis em um gabinete de biossegurança de classe II.
- Cultivar a linhagem celular recombinante em meio seletivo (meio F-12K contendo 10% de soro fetal bovino [FBS] e 800 μg/mL de sulfato G418) para garantir a expressão do receptor alvo. Armazenar as células expressando de forma estável o receptor em 1 mL de meio de congelamento (90% FBS e 10% de dimetilsulfóxido [DMSO]) em um criovial de 2 mL em um freezer de -80 °C.
NOTA: Para armazenamento a longo prazo das células congeladas, armazene-as em nitrogênio líquido. - Pré-aqueça todos os meios antes da cultura celular. Em um armário de biossegurança, transfira 13 mL de meio seletivo pré-aquecido (meio F-12K contendo 10% de FBS e 800 μg/mL de sulfato G418) para um frasco T-75 e mantenha-o no gabinete de biossegurança. Descongele um frasco para injetáveis das células BMLK 3 congeladas (~1,5 × 106 células) num banho-maria de 37 °C durante2-3 min. Transferir as células descongeladas para o balão T-75. Manter as células numa incubadora humidificada a 37 °C e 5% de CO2, salvo especificação em contrário.
- Quando as células atingirem 90% de confluência (1-2 dias), pré-aqueça todos os meios a 37 °C, exceto a solução salina tamponada com fosfato (DPBS) da Dulbecco, que é mantida à temperatura ambiente. Num armário de biossegurança, retirar o meio gasto do balão T-75, lavar as células durante 5 s com 10 ml de DPBS rodopiando suavemente o balão e, em seguida, retirar o DPBS com uma pipeta serológica.
NOTA: Uma imagem de células CHO-K1 com 90% de confluência é mostrada em Lu et al.14. - Retirar as células do balão de T-75 adicionando 2 ml de tripsina-EDTA a 0,25% e incubar durante 3-5 min a 37 °C na incubadora. Em seguida, adicione 8 mL de meio seletivo e misture bem pipetando e liberando suavemente 2x-3x com a mesma pipeta sorológica.
- Transferir 2 ml da suspensão celular (~1 × 106 células) do passo 1.4 para um novo balão T-75 contendo 10 ml de meio seletivo quente. Cultive as células por 1-2 dias na incubadora até atingirem 90% de confluência.
- Use as células para o ensaio seguindo as próximas etapas ou repita as etapas 1.4-1.5 uma ou duas vezes antes de usar as células no ensaio.
NOTA: Não exceda três a quatro passagens, pois o sinal de ensaio com certas linhas celulares pode se tornar mais fraco com outras passagens.
2. Ensaio de fluorescência de cálcio
- Revestir a placa celular.
- Use um sistema de manuseio de líquidos colocado dentro de um gabinete de biossegurança para todas as etapas de pipetagem nas placas de 384 poços. Crie programas personalizados para pipetagem nas placas de 384 poços31 (Tabela Suplementar S1). Revesti as placas estéreis de 384 poços com antecedência. Em um gabinete de biossegurança, carregar 10 μL/poço de uma solução aquosa de poli-D-lisina (PDL) a 0,05 mg/mL em cada placa e incubar por 5 min à temperatura ambiente.
- Esvazie o prato invertendo-o rapidamente e apagando-o suavemente em toalhas de papel estéreis. Em seguida, lave cada poço com 10 μL de água, esvazie a placa e deixe a placa secar no armário de biossegurança durante a noite sem a tampa. Feche a placa com a tampa e guarde a 4 °C no frigorífico.
NOTA: As placas revestidas podem ser armazenadas a 4 °C por até 6 meses.
- Dia 1
- Retire a placa do fármaco (100 μM em 90% DPBS + 10% DMSO, a concentração final no poço para HTS será de 2 μM) armazenada no congelador a -20 °C e coloque-a à temperatura ambiente.
NOTA: Layout da placa de droga: Cada placa de 384 poços (24 colunas x 16 linhas) contém 320 poços com diferentes compostos de biblioteca e 64 poços com solvente em branco (DPBS contendo 10% de DMSO), que estão dispostos em quatro colunas, com duas colunas na borda de cada lado. Consulte Tabela Suplementar S2 para o layout da placa. - Quando as células atingirem uma confluência de ~70%-90% no balão T-75, desprenda as células do frasco T-75, conforme descrito abaixo. Pré-aqueça todos os meios a 37 °C, com excepção do DPBS (temperatura ambiente).
- Remova o meio gasto, lave as células com 10 mL de DPBS e, em seguida, remova o DPBS. Descole as células do balão T-75 utilizando 2 ml de tripsina-EDTA a 0,25% durante 3-5 min a 37 °C na incubadora, adicione 8 ml de meio seletivo e transfira a suspensão celular para um tubo cónico de 15 ml para centrifugar a 1.000 × g durante 3 min.
- Descarte o sobrenadante e ressuspenda o pellet celular em 10 mL de meio F-12K contendo 1% de FBS e 400 μg/mL de sulfato G418. Mantenha a suspensão no gabinete de biossegurança enquanto determina a contagem de células.
- Determinar a densidade celular da suspensão para posterior diluição: Misture 20 μL de suspensão celular em 20 μL de azul de tripano a 0,4% e, em seguida, carregue 20 μL da mistura numa câmara de contagem de células para ser lida por um contador de células para a densidade celular.
- Diluir a suspensão celular no mesmo meio (meio F-12K contendo 1% de FBS e 400 μg/mL de sulfato G418) até um volume final de pelo menos 15 mL a uma densidade de 4 × 105 células/mL.
- Semeia as células na placa de 384 poços revestida com PDL. Transfira 15 mL da suspensão celular acima (4 × 105 células/mL) para um reservatório de reagente auto-amigável de 150 mL. Dispensar 25 μL da suspensão celular (~10.000 células/poço) em cada poço dos 384 poços da placa usando um sistema de manuseio de líquidos em duas etapas. Carregue as pontas de baixa retenção de 384/12,5 μL na cabeça do manipulador de líquidos, aspirar 12,5 μL do reservatório (velocidade 5,2 μL/s) e dispensar em cada poço (velocidade: 3,1 μL/s).
- Repita a pipetagem como no passo anterior 2.2.5 para atingir 25 μL por poço. Em seguida, incubar a placa durante a noite (14-16 h) a 37 °C e 5% de CO2 na incubadora umidificada.
NOTA: Como o volume máximo de pipetagem é de 12,5 μL para esta cabeça específica, a pipetagem para 25 μL é realizada em duas etapas.
- Retire a placa do fármaco (100 μM em 90% DPBS + 10% DMSO, a concentração final no poço para HTS será de 2 μM) armazenada no congelador a -20 °C e coloque-a à temperatura ambiente.
- Dia 2
- Na manhã seguinte, verifique a placa celular coberta sob um microscópio; se não for confluente, espere até que as células atinjam 90% de confluência.
- Preparar uma solução-mãe de corante fluorescente: Ressuscite o corante fluorescente liofilizado em 100 μL de DMSO e evite a luz direta na solução-mãe. Envolva o tubo com papel alumínio para evitar o fotobranqueamento.
NOTA: O estoque pode ser alíquotado em alíquotas de 15 μL para cada ensaio de placa, a fim de evitar congelamento e descongelamento repetidos; as alíquotas podem ser armazenadas a -80 °C por até 1 mês. - No armário de biossegurança com as luzes apagadas, preparar o corante de carga (1x) em um tubo cônico de 15 mL envolto com folha de alumínio, combinando 15 μL da solução-mãe de corante fluorescente (a partir da etapa 2.3.2) e o restante dos componentes do kit pré-aquecido (37 °C): 13,5 mL de 1x HHBS (tampão de Hank com HEPES de 20 mM) e 1,5 mL de reagente B (inibidor de efluxo de corante).
NOTA: A luz da sala está acesa durante esta etapa. - Feche o tubo e misture bem invertendo suavemente o tubo várias vezes (normalmente 3-5x).
NOTA: Manter à temperatura ambiente e utilizar a mistura de corante de carga no prazo de 30 minutos. - Quando as células atingirem 90% de confluência, remova o meio gasto da placa de ensaio de 384 poços, invertendo rapidamente a placa e apagando suavemente em toalhas de papel estéreis; repita este movimento 2x-3x para remover todo o líquido da placa. Descarte as toalhas molhadas.
- Desligue a maioria das luzes diretas artificiais na sala (deixando uma lâmpada de mesa macia e fraca acesa ou semelhante para permitir condições de trabalho visíveis) e no armário de biossegurança para todas as etapas até o final do ensaio (aproximadamente por 1,5 h).
- Coloque 15 mL do corante de carga (1x) da etapa 2.3.3 em um reservatório auto-amigável de 150 mL.
- Transferir 25 μL do corante de carga (1x) do reservatório para cada poço usando um sistema de manuseio de líquidos com pontas de baixa retenção de 384/12,5 μL, dispensando 12,5 μL em cada poço da placa (velocidade de aspiração e dispensação: 3,8 μL/s).
- Repetir a etapa de pipetagem como indicado no ponto 2.3.7.1 para atingir um volume final de 25 μL em cada alvéolo da placa. Cubra e envolva a placa com papel alumínio para protegê-la da luz ambiente.
- Incubar a placa celular coberta a 37 °C na incubadora humidificada de CO2 durante 30 min, retirá-la da incubadora e equilibrá-la à temperatura ambiente no interior do leitor de placas ou no banco, mantendo a placa coberta e envolvida com papel alumínio durante mais 30 minutos. As células estão então prontas para a triagem de alto rendimento (HTS).
- Preparação química: Gire a placa do fármaco a partir da etapa 2.2.1 a 1.200 × g em uma centrífuga de placa por 1 min à temperatura ambiente.
- Preparar uma solução de peptídeo agonista 10x de Rhimi-K-1 (QFSPWGamida) (10 μM) ressuspendendo 100 nmoles de peptídeo liofilizado em 10 mL de 1x HHBS contendo 0,1% de DMSO e transferir a solução para um reservatório auto-amigável de 150 mL.
- Medir o sinal de fundo: Para todo o ensaio HTS no leitor de placas, em Protocolos, escolha o modo de fluorescência do ponto final.
NOTA: O sinal fluorescente é lido a partir da parte inferior da placa em comprimentos de onda de excitação/emissão de 495 nm/525 nm.- Insira a placa celular no leitor de placas. No painel de instrumentos, selecione ajustar ganho, selecionar um poço aleatório na placa, atribuí-lo como 5% a 10% do valor máximo mensurável de fluorescência e selecione ajustar (leitura) altura.
- Clique em iniciar medição para ler toda a placa para o sinal de fluorescência de fundo em unidades de fluorescência relativa (RFU).
- Ensaio de "adição dupla"
- Usando o sistema de manuseio de líquidos com pontas de 384/12,5 μL, para misturar a solução de droga em cada poço da placa de droga, pipetar 3x para cima e para baixo 10 μL da solução de droga (em DPBS contendo 10% de DMSO) (velocidade de pipetagem: 5,2 μL/s) e "aspirar" 1,5 μL de cada poço da placa de droga (velocidade de aspiração: 1,0 μL/s).
- "Dispensar" 0,5 μL dos compostos na placa de ensaio celular (velocidade de pipetagem: 1 μL/s) para atingir uma concentração final de 2 μM em DMSO a 0,2%.
- Coloque a placa de ensaio imediatamente no leitor de placas depois de adicionar os compostos de peneiramento. Leia a mesma placa nas direções de leitura para frente e para trás. Para obter essas leituras, defina um programa para ler do "poço 1-384" e imediatamente de "384-1".
NOTA: A leitura em ambas as direções leva 2 minutos no total. Este projeto de leitura é para compensar a diminuição na intensidade do sinal que ocorre durante a leitura da placa em cada direção. Consulte a etapa 3.1 para obter as análises de leitura. - Descarte o restante 1 μL de solução medicamentosa nas pontas imergindo as pontas em um reservatório de resíduos de 150 mL contendo ~50 mL de DPBS (velocidade de dispensação: 1,0 μL/s).
- Incubar os compostos de triagem com as células por um total de 5 min (inclui os 2 min de leitura da placa) à temperatura ambiente no gabinete de biossegurança com as luzes apagadas. Adicionar 3 μL do peptídeo agonista, Rhimi-K-1 (QFSPWGamida), do reservatório (velocidade de aspiração: 3,1 μL/s) para a placa de ensaio utilizando o sistema de manuseamento de líquidos (velocidade de distribuição: 3,1 μL/s) com pontas de 384/12,5 μL.
- Coloque a placa no leitor de placas imediatamente após a adição do peptídeo agonista. Leia a placa nas direções dianteira e inversa usando o mesmo programa da etapa 2.3.12.3
3. Análise dos dados
- Usando o software de análise associado ao leitor de placas instalado em um computador, calcule as respostas de fluorescência celular (em RFU) para ambas as leituras após a primeira adição do composto (Primeira leitura; RFUago [Tabela Suplementar S2]) e após as etapas de adição do agonista (Segunda leitura = formiga RFU [Tabela Suplementar S2]). Cada leitura é obtida pela média dos dois valores obtidos (não indicados) pelas leituras das chapas para a frente e para trás das etapas 2.3.12.3 e 2.3.12.6, respectivamente.
NOTA: RFU atrás, RFUant referem-se às unidades de fluorescência relativa dos potenciais agonistas atingidos (leia na etapa 2.3.12.3) e os potenciais antagonistas atingidos (lidos na etapa 2.3.12.6), respectivamente. - Exporte todos os três conjuntos de dados, RFU bg, RFU ago e RFUant, do software de análise em três planilhas separadas. Cada planilha terá apenas duas colunas: posição do poço e RFU bruta (arquivos não mostrados aqui).
NOTA: RFU bg refere-se à RFU do plano de fundo lido na etapa 2.3.11.2. - Formate os dados das três planilhas e organize os dados acima em um arquivo csv (consulte o exemplo na Tabela Suplementar S2). Subtraia o sinal de fundo lido da RFUago e daformiga RFU, respectivamente (colunas G e H na Tabela Suplementar S2).
- Importe o arquivo csv para uma "plataforma de dados HTS on-line" comercialmente disponível (consulte a Tabela de Materiais) para análise de dados a jusante (Tabela 1) e armazenamento.
- Calcular manualmente o fator Z' para o controle de qualidade de cada ensaio de placa usando a equação (1):
equação (1):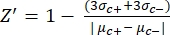 (1)
(1)
NOTA: μ c- e μc+ representam as RFUs médias das leituras dos mesmos poços, que servem como controles negativos na primeira adição após a adição do solvente (solvente em branco, n = 64; números em azul na Tabela Suplementar S2) e servem como controles positivos após a adição do agonista (solvente em branco + agonista, n = 64; números em magenta), respectivamente. Além disso, σ c- e σc+ representam seus desvios-padrão (DPs) correspondentes. - Selecione manualmente as moléculas de impacto dos mapas de calor na "plataforma de dados HTS on-line" e calcule a ativação percentual normalizada (NPA) e a atividade inibitória (Io) para os acertos agonistas e antagonistas usando a equação (2) e a equação (3):
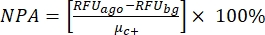 (2)
(2)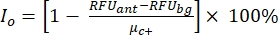 (3)
(3)
Resultados
Uma placa de fármaco interna (SAC2-34-6170) composta por 320 pequenas moléculas aleatórias foi utilizada para demonstrar este ensaio de HTS como exemplo. O HTS apresentou excelente qualidade do ensaio com fator Z' de 0,7 (Tabela 1). Esse fator Z' reflete a qualidade do ensaio independente dos compostos testados34. Um fator Z′ de 0,5 ou superior indica uma boa faixa dinâmica de sinal de ensaio entre as RFUs dos controles positivos e os controles negativo...
Discussão
O objetivo do HTS é identificar moléculas atingidas através da triagem de um grande número de moléculas pequenas. Portanto, os resultados deste exemplo representam apenas uma pequena parte de um experimento HTS convencional. Além disso, as moléculas atingidas identificadas precisam ser validadas em ensaios a jusante, como um ensaio dose-dependente na mesma linhagem celular recombinante e em uma linhagem celular CHO-K1 carregando apenas o vetor vazio, que pode ser realizado simultaneamente para salvar pequenas mol?...
Divulgações
Os autores não têm conflito de interesses a divulgar.
Agradecimentos
Este trabalho foi apoiado pelo Prêmio USDA-NIFA-AFRI Saúde Animal e Bem-Estar (número do Prêmio 2022-67015-36336, PVP [Diretor do Projeto]) e de fundos competitivos do Programa de Concessão de Doenças Vetoriais de Insetos de Pesquisa da Texas A & M AgriLife Research (FY'22-23) para P.V.P. O grupo de professores da A.W.E.S.O.M.E. da Faculdade de Agricultura e Ciências da Vida, TAMU, é reconhecido por ajudar a editar o manuscrito. A Tabela Suplementar S2 contém dados de uma biblioteca interna, aleatória e de pequenas moléculas obtida do laboratório do Dr. James Sachettini na Texas A & M University e Texas A & M AgriLife Research.
Materiais
| Name | Company | Catalog Number | Comments |
| 0.25% trypsin-EDTA | Gibco Invitrogen | 15050-065 | with phenol red |
| 0.4% trypan blue | MilliporeSigma | T8154 | liquid, sterile |
| 1.5 mL microcentrifuge tubes | Thermo Fisher | AM12400 | RNase-free Microfuge Tubes |
| 5 mL serological pipette | Corning | 29443-045 | Corning Costar Stripette individually wrapped |
| 10 mL serological pipette | Corning | 29443-047 | Corning Costar Stripette individually wrapped |
| 15 mL conical tubes | Falcon | 352196 | sterile |
| 20 µL filter tips | USA Scientifc Inc. | P1121 | sterile, barrier |
| 25 mL serological pipette | Corning | 29443-049 | Corning Costar Stripette individually wrapped |
| 50 mL conical tubes | Corning | 430828 | graduated, sterile |
| 150 mL auto-friendly reservior | Integra Bioscience | 6317 | sterile, individually wrapped for cell seeding in day 1 |
| 150 mL auto-friendly reservior | Integra Bioscience | 6318 | sterile, stacked, for loading dye in day 2 |
| 384/ 12.5 µL low retention tips | Integra Bioscience | 6405 | long, sterile filter |
| 384/ 12.5 µL tips | Integra Bioscience | 6404 | long, sterile filter |
| 384-well plate | Greiner | 781091 | CELLSTAR, clear polystyrene, µClear, Black/Flat |
| Aluminum plate seals | Axygen Scientific | PCR-AS-200 | polyester-based |
| Aluminum foil wrap | Walmart | ||
| Biosafty cabinet II | NuAire | NU-540-300 | |
| Cell counter | Nexcelom | AutoT4 | |
| cell counting slides | Nexcelom | SD-100 | 20 µL chamber |
| CO2 humidified incubator | Thermo Fisher | Forma Series II | |
| Desk Lamp | SunvaleeyTEK | RS1000B | |
| Dimethyl sulfoxide | MilliporeSigma | 276855 | anhydous, >99.9% |
| Drug plate | Corning | 3680 | |
| Dulbecco's phosphate-buffered saline | Corning | 21-031-CV | DPBS, 1x without calcium amd magnesium |
| Ethanol | Koptec | 2000 | |
| F-12K Nutrient Mixture | Corning | 45000-354 | (Kaighn's Mod.) with L-glutamine |
| Fetal bovine serum | Equitech-Bio | SFBU30 | |
| Fluorescent calcium assay kit | ENZO Lifescience | ENZ-51017 | 10x96 tests |
| G418 sulfate | Gibco Invitrogen | 10131-027 | Geneticin selective antibiotic 50 mg/mL |
| Hank's buffer | MilliporeSigma | 55037C | HBSS modified, with calcium, with magnesium, without phenol read |
| HEPES buffer | Gibco Invitrogen | 15630-080 | 1 Molar |
| HTS data storage plateform | CDD vault | https://www.collaborativedrug.com/ | |
| Liquid handling system | Integra Bioscience | Viaflo | 384/12.5 µL |
| Plate centrifuge | Thermo Fisher | Sorvall ST8 | |
| Plate reader | BMG technology | Clariostar | |
| Poly-D-lysine | MilliporeSigma | P6407 | |
| Rhimi-K-1 agonist peptide | Genscript | custom order | QFSPWGamide |
| T-75 flask | Falcon | 353136 |
Referências
- Hanlon, C. D., Andrew, D. J. Outside-in signaling - A brief review of GPCR signaling with a focus on the Drosophila GPCR family. Journal of Cell Science. 128 (19), 3533-3542 (2015).
- Liu, N., Li, T., Wang, Y., Liu, S. G-protein coupled receptors (GPCRs) in insects-A potential target for new insecticide development. Molecules. 26 (10), 2993 (2021).
- Pierce, K. L., Premont, R. T., Lefkowitz, R. J. Seven-transmembrane receptors. Nature Reviews Molecular Cell Biology. 3, 639-650 (2002).
- Pietrantonio, P. V., Xiong, C., Nachman, R. J., Shen, Y. G protein-coupled receptors in arthropod vectors: Omics and pharmacological approaches to elucidate ligand-receptor interactions and novel organismal functions. Current Opinion in Insect Science. 29, 12-20 (2018).
- Hilger, D., Masureel, M., Kobilka, B. K. Structure and dynamics of GPCR signaling complexes. Nature Structural & Molecular Biology. 25 (1), 4-12 (2018).
- Liu, N., Wang, Y., Li, T., Feng, X. G-protein coupled receptors (GPCRs): Signaling pathways, characterization, and functions in insect physiology and toxicology. International Journal of Molecular Sciences. 22 (10), 5260 (2021).
- Hansen, K. B., Bräuner-Osborne, H., Leifert, W. FLIPR® assays of intracellular calcium in GPCR drug discovery. G Protein-Coupled Receptors in Drug Discovery. , (2009).
- Bauknecht, P., Jekely, G. Large-scale combinatorial deorphanization of Platynereis neuropeptide GPCRs. Cell Reports. 12 (4), 684-693 (2015).
- Frooninckx, L., et al. Neuropeptide GPCRs in C. elegans. Frontiers in Endocrinology. 3, 167 (2012).
- Caers, J., et al. More than two decades of research on insect neuropeptide GPCRs: An overview. Frontiers in Endocrinology. 3, 151 (2012).
- Šimo, L., Koči, J., Park, Y. Receptors for the neuropeptides, myoinhibitory peptide and SIFamide, in control of the salivary glands of the blacklegged tick Ixodes scapularis. Insect Biochemistry and Molecular Biology. 43 (4), 376-387 (2013).
- Šimo, L., Park, Y. Neuropeptidergic control of the hindgut in the black-legged tick Ixodes scapularis. International Journal for Parasitology. 44 (11), 819-826 (2014).
- Liesch, J., Bellani, L. L., Vosshall, L. B. Functional and genetic characterization of neuropeptide Y-like receptors in Aedes aegypti. PLoS Neglected Tropical Diseases. 7 (10), 2486 (2013).
- Lu, H. L., Kersch, C. N., Taneja-Bageshwar, S., Pietrantonio, P. V. A calcium bioluminescence assay for functional analysis of mosquito (Aedes aegypti) and tick (Rhipicephalus microplus) G protein-coupled receptors. Journal of Visualized Experiments. (50), e2732 (2011).
- Xiong, C., Baker, D., Pietrantonio, P. V. The cattle fever tick, Rhipicephalus microplus, as a model for forward pharmacology to elucidate kinin GPCR function in the Acari. Frontiers in Physiology. 10, 1008 (2019).
- Holmes, S. P., Barhoumi, R., Nachman, R. J., Pietrantonio, P. V. Functional analysis of a G protein-coupled receptor from the Southern cattle tick Boophilus microplus (Acari: Ixodidae) identifies it as the first arthropod myokinin receptor. Insect Molecular Biology. 12 (1), 27-38 (2003).
- Cox, K. J., et al. Cloning, characterization, and expression of a G-protein-coupled receptor from Lymnaea stagnalis and identification of a leucokinin-like peptide, PSFHSWSamide, as its endogenous ligand. Journal of Neuroscience. 17 (4), 1197-1205 (1997).
- Dircksen, H., Kastin, A. J. Chapter 32 - Crustacean bioactive peptides. Handbook of Biologically Active Peptides (Second Edition). , 209-221 (2013).
- Halberg, K. A., Terhzaz, S., Cabrero, P., Davies, S. A., Dow, J. A. Tracing the evolutionary origins of insect renal function. Nature Communications. 6, 6800 (2015).
- Pietrantonio, P. V., Jagge, C., Taneja-Bageshwar, S., Nachman, R. J., Barhoumi, R. The mosquito Aedes aegypti (L.) leucokinin receptor is a multiligand receptor for the three Aedes kinins. Insect Molecular Biology. 14 (1), 55-67 (2005).
- Radford, J. C., Davies, S. A., Dow, J. A. Systematic G-protein-coupled receptor analysis in Drosophila melanogaster identifies a leucokinin receptor with novel roles. Journal of Biological Chemistry. 277 (41), 38810-38817 (2002).
- Brock, C. M., et al. The leucokinin-like peptide receptor from the cattle fever tick, Rhipicephalus microplus, is localized in the midgut periphery and receptor silencing with validated double-stranded RNAs causes a reproductive fitness cost. International Journal for Parasitology. 49 (3-4), 287-299 (2019).
- Nässel, D. R. Leucokinin and associated neuropeptides regulate multiple aspects of physiology and behavior in Drosophila. International Journal of Molecular Sciences. 22 (4), 1940 (2021).
- Kim, Y. -. J., et al. Central peptidergic ensembles associated with organization of an innate behavior. Proceedings of the National Academy of Sciences of the United States of America. 103 (38), 14211-14216 (2006).
- Al-Anzi, B., et al. The leucokinin pathway and its neurons regulate meal size in Drosophila. Current Biology. 20 (11), 969-978 (2010).
- Yurgel, M. E., et al. A single pair of leucokinin neurons are modulated by feeding state and regulate sleep-metabolism interactions. PLoS Biology. 17 (2), 2006409 (2019).
- Nässel, D. R., Zandawala, M. Recent advances in neuropeptide signaling in Drosophila, from genes to physiology and behavior. Progress in Neurobiology. 179, 101607 (2019).
- Okusawa, S., Kohsaka, H., Nose, A. Serotonin and downstream leucokinin neurons modulate larval turning behavior in Drosophila. Journal of Neuroscience. 34 (7), 2544-2558 (2014).
- Kersch, C. N., Pietrantonio, P. V. Mosquito Aedes aegypti (L.) leucokinin receptor is critical for in vivo fluid excretion post blood feeding. FEBS letters. 585 (22), 3507-3512 (2011).
- Kwon, H., et al. Leucokinin mimetic elicits aversive behavior in mosquito Aedes aegypti (L.) and inhibits the sugar taste neuron. Proceedings of the National Academy of Sciences of the United States of America. 113 (25), 6880-6885 (2016).
- Xiong, C., Baker, D., Pietrantonio, P. V. A random small molecule library screen identifies novel antagonists of the kinin receptor from the cattle fever tick, Rhipicephalus microplus (Acari: Ixodidae). Pest Management Science. 77 (5), 2238-2251 (2021).
- Torfs, P., et al. The kinin peptide family in invertebrates. Annals of the New York Academy of Sciences. 897 (1), 361-373 (1999).
- Ma, Q., Ye, L., Liu, H., Shi, Y., Zhou, N. An overview of Ca2+ mobilization assays in GPCR drug discovery. Expert Opinion on Drug Discovery. 12 (5), 511-523 (2017).
- Zhang, J. -. H., Chung, T. D., Oldenburg, K. R. A simple statistical parameter for use in evaluation and validation of high throughput screening assays. Journal of Biomolecular Screening. 4 (2), 67-73 (1999).
- Zhang, R., Xie, X. Tools for GPCR drug discovery. Acta Pharmacologica Sinica. 33 (3), 372-384 (2012).
- Offermanns, S., Simon, M. I. Gα15 and Gα16 couple a wide variety of receptors to phospholipase C. Journal of Biological Chemistry. 270 (25), 15175-15180 (1995).
- Murgia, M. V., et al. High-content phenotypic screening identifies novel chemistries that disrupt mosquito activity and development. Pesticide Biochemistry and Physiology. 182, 105037 (2022).
- Lismont, E., et al. Can BRET-based biosensors be used to characterize G-protein mediated signaling pathways of an insect GPCR, the Schistocerca gregaria CRF-related diuretic hormone receptor. Insect Biochemistry and Molecular Biology. 122, 103392 (2020).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoExplore Mais Artigos
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados