Method Article
使用荧光测定法或流式细胞术测量半胱天冬酶活性
摘要
本协议描述了两种使用流式细胞术或分光荧光计通过荧光底物测量半胱天冬酶活性的方法。
摘要
半胱氨酸蛋白酶的活化,称为半胱天冬酶,仍然是多种形式的细胞死亡的重要过程。半胱天冬酶是细胞凋亡的关键启动剂和刽子手,细胞凋亡是研究最多的程序性细胞死亡形式。细胞凋亡发生在发育过程中,是组织稳态的必要事件。焦亡是利用半胱天冬酶的另一种细胞死亡形式,是通过激活炎症小体激活免疫系统的关键过程,导致白细胞介素-1(IL-1)家族成员的释放。为了评估半胱天冬酶活性,可以评估目标底物。然而,在检查单个细胞或低水平活性时,灵敏度可能是一个问题。我们展示了荧光底物如何与基于群体的测定或通过流式细胞术进行单细胞测定一起使用。通过适当的控制,可以使用不同的氨基酸序列来识别哪些半胱天冬酶是活跃的。使用这些测定,已经确定了肿瘤坏死因子(TNF)刺激时凋亡蛋白抑制剂的同时丢失,这主要诱导巨噬细胞凋亡而不是其他形式的细胞死亡。
引言
半胱天冬酶参与几种形式的程序性细胞死亡。细胞凋亡是研究最多的程序性细胞死亡形式,与半胱天冬酶活性1有关。所有半胱天冬酶都有一个大大小小的催化亚基。半胱天冬酶-1、半胱天冬酶-4、半胱天冬酶-5、半胱天冬酶-9和半胱天冬酶-11具有半胱天冬酶活化和募集结构域(CARD),半胱天冬酶-8和半胱天冬酶-10含有死亡效应结构域(DED)2,3,4,5(表1)。细胞凋亡可以通过两种主要途径启动:外在途径和内在途径。外在凋亡途径由死亡受体触发,死亡受体是肿瘤坏死因子超家族(TNFSF)的一部分。死亡受体具有DED结构域,促进半胱天冬酶-8活性6。内在凋亡途径涉及细胞凋亡形成后半胱天冬酶-9的激活,需要释放细胞色素c和Apaf-17。引发剂半胱天冬酶,半胱天冬酶-8或半胱天冬酶-9的激活导致刽子手半胱天冬酶的切割和随后的激活,即半胱天冬酶-3,半胱天冬酶-6和半胱天冬酶-7。确定刽子手半胱天冬酶是活跃的表明细胞正在经历细胞凋亡,这种激活被认为是定义细胞死亡模式的重要因素。
半胱天冬酶活化也是调节炎症和诱导程序性细胞死亡替代形式的关键时刻。例如,半胱天冬酶-1活化导致白细胞介素-1家族8的促炎细胞因子的成熟。该家族细胞因子的释放和活化,特别是IL-1β和IL-18,是由质膜9,10处的加斯皮明D切割和孔形成引起的。胃皮素D孔的膜修复不足可导致一种称为焦亡11的细胞死亡。此外,半胱天冬酶-8活性导致半胱天冬酶非依赖性细胞死亡的抑制,称为坏死性凋亡12。受体相互作用的丝氨酸/苏氨酸蛋白激酶1(RIPK1)是坏死性凋亡和驱动NF-kB调节的炎症的关键因素之一。 模型显示,RIPK1被半胱天冬酶-8切割,导致限制NF-kB信号传导,细胞凋亡和坏死性凋亡13,14。因此,鉴定不同半胱天冬酶的活性有助于了解由此产生的炎症和细胞死亡方式。
与半胱天冬酶调节细胞死亡模式的功能无关,半胱天冬酶活性还可以调节其他细胞因子家族,如干扰素(IFN),以响应感染15,16。此外,半胱天冬酶参与非细胞死亡功能,包括细胞命运决定、组织修复和再生、通过 DNA 修复的肿瘤发生和神经元突触功能。半胱天冬酶在这些非致死性作用中的活性被认为受到细胞定位和半胱天冬酶数量的限制。因此,量化半胱天冬酶活性水平可以很好地定义细胞是否经历细胞死亡或半胱天冬酶是否在非细胞死亡功能中发挥作用4,17,18。
半胱天冬酶活性可以通过多种方法评估。裂解半胱天冬酶及其底物的蛋白质印迹已被用作活性指标,但这些测定充其量是定性的。为了确定半胱天冬酶活性是否与细胞死亡有关,定量测量是理想的。由于半胱天冬酶在由四个氨基酸组成的识别位点切割底物,因此已经开发了比色法、发光法或荧光法。然而,半胱天冬酶在其底物识别中似乎具有可塑性19,20。识别序列与蛋白质结构域无关(表1)。然而,四肽序列DEVD可用于检测半胱天冬酶-3和半胱天冬酶-7活性20,21。
Smac模拟物是靶向细胞凋亡蛋白(IAP)抑制剂的化合物。在癌细胞子集中使用Smac模拟物会导致细胞对TNF诱导的细胞死亡变得敏感22。在原代巨噬细胞中,Smac模拟物在没有外源性添加TNF23,24的情况下引起细胞死亡。Smac模拟诱导的降解导致cIAP1的损失导致TNF的产生。如果检测到半胱天冬酶活性,这意味着细胞不是通过坏死性凋亡而死亡,而是以凋亡的方式死亡。在该方法中,切割的DEVD底物的检测用于鉴定半胱天冬酶-3/半胱天冬酶-7活性。确认凋亡细胞死亡的进一步实验已在24之前发表。
研究方案
本研究是在苏黎世大学动物伦理委员会(#ZH149/19)的批准和指导方针下进行的。本研究使用8-16周龄的雄性C57Bl / 6J小鼠,在特定无病原体(SPF)条件下繁殖和饲养。完整的骨骼可以保存在带有2%热灭活胎牛血清(FBS)的无菌Hank缓冲盐水溶液(HBSS)中的冰上。分化当天从小鼠25 的股骨和胫骨收集骨髓。评估半胱天冬酶活性的两种方法都可用于其他细胞类型,包括原代细胞和转化细胞。
1. 区分骨髓来源巨噬细胞(BMDM)
注意:在组织培养层流罩中执行所有步骤,并使用无菌无菌技术。
- 用21 G针头准备1 mL注射器。
- 将 5 mL HBSS + 2% FBS 加入 15 mL 管中。
- 使用无菌镊子,取出切除的股骨,然后将针头插入股骨开口。将股骨保持在HBSS + 2%FBS中,冲洗骨髓,直到骨骼变白。以同样的方式冲洗胫骨。继续冲洗溶液以获得单细胞悬液。
- 在室温(RT)下以200× g 离心单细胞悬液4分钟。
- 使用真空吸液器除去上清液。轻拍试管以轻轻重悬沉淀。加入 1 mL 红细胞裂解缓冲液(参见 材料表),用 P1,000 移液管轻轻混合。在室温下孵育1分钟。
- 加入 10 mL HBSS + 2% FBS,并在室温下以 200 x g 离心 4 分钟。
- 除去上清液,重悬于10 mL骨髓来源巨噬细胞(BMDM)培养基中。
注意:BMDM培养基由低葡萄糖DMEM组成,并添加10%FBS,20ng / ml M-CSF,青霉素(50 U / mL)和链霉素(50μg/ mL)(参见 材料表)。或者,可以用 20% L929 条件培养基代替 M-CSF。 - 将 15 mL BMDM 培养基加入两个 15 cm 培养皿中。向每个板中加入 5 mL 单细胞溶液。
注意:请勿使用组织培养处理的板。组织培养处理的平板限制了分化。 - 将培养皿置于37°C,5%CO2下6天。
注意:BMDM可以在5-7天后收获。更长的分化孵育时间导致抗凋亡蛋白表达增加26。
2. 细胞的收获、接种和处理
注意:在组织培养层流罩中执行所有步骤,并使用无菌无菌技术。完全分化的巨噬细胞粘附在平板上,易于分离,而漂浮的细胞可以丢弃。磷酸盐缓冲盐水 (PBS) 可与 Ca 2+ 和 Mg2+ 一起使用或不使用。
- 孵育6天后,使用吸气器从平板中取出漂浮细胞和培养基。
- 向每个 15 cm 平板中加入 5 mL PBS。使用吸气器从板上取出PBS。
- 向每个板中加入2mL胰蛋白酶(参见 材料表)。孵育板,直到轻轻敲击板使细胞移位。取 5 mL BMDM 培养基,并从平板上收获细胞。
- 转移到第二个15厘米板上,并从平板上收获细胞。将细胞悬液从平板中取出到 50 mL 管中。再取 5 mL BMDM 培养基,并清洗两个板以确保收集所有细胞。将细胞悬液放入相同的 50 mL 管中。
- 取 10 μL 细胞悬液,使用血细胞计数器使用台盼蓝 1:1 稀释液计数。
注意:根据巨噬细胞的大小进行校准时,也可以使用自动细胞计数器。 - 以 1 x 106 个细胞/mL 的密度接种巨噬细胞。在 6 孔板中以 2 x 106 个细胞/孔接种的 BMDM 可提供约 2 mg/mL 的总蛋白。在处理前让细胞粘附在板上至少6小时。
注意:对于其他细胞类型,必须确定最佳浓度。 - 用Smac模拟物(化合物A,参见 材料表)22 在250nM和500nM下处理巨噬细胞16小时。
注意:包括阳性对照以诱导细胞凋亡和半胱天冬酶-3切割,以确保测定有效。常见的细胞凋亡诱导剂包括星形孢素和依托泊苷。对于许多细胞系进行细胞凋亡,0.1-10μM刺激16小时就足够了。
3. 从处理过的细胞制备细胞裂解物
注意:此步骤必须在冰上完成,并且试剂和材料必须预冷。
- 将含有处理细胞的板转移到冰上。将细胞培养物中的培养基收集到1.5mL管中,在4°C下以300× g 离心5分钟,吸出培养基,然后将管放在冰上。这允许收集已从板上分离的细胞。
- 向细胞培养板中加入 1 mL 冷 PBS 以洗涤细胞,并吸出所有 PBS。向细胞中加入 100 μL 胰蛋白酶(如果使用 6 孔培养皿)。让胰蛋白酶将细胞从平板上提起,并将它们收集到 1.5 mL 管中。使用 1 mL 冷 PBS 确保收集所有细胞。
注意:如果使用悬浮细胞,请将培养基和细胞轻轻转移到 1.5 mL 管中。 - 在4°C下以300× g 离心细胞5分钟。 除去上清液,重悬于100μL DISC裂解缓冲液(150mM氯化钠,2mM EDTA,1%Triton X-100,10%甘油,20mM Tris,pH 7.5,参见 材料表)。
- 将样品在冰上孵育20分钟。
- 将裂解物在4°C下以~12,000× g 离心10分钟以沉淀不溶性部分。
- 将 25 μL 裂解物转移到白色平底 96 孔板中,用于半胱天冬酶-3/半胱天冬酶-7 活性测定(步骤 5)。
注意:不要打扰颗粒。这是细胞裂解物的不溶性部分。 - 将 10 μL 剩余裂解物转移到透明的平底 96 孔板中,用于二辛可宁酸 (BCA) 测定(步骤 4)。这将用于样本的归一化。
- 将两个板放在冰上以便进一步处理。
注意:在此阶段,可以用粘合剂盖密封板并在-20°C下储存约4周。
4. 使用支链氨基酸测定法进行蛋白质定量
注意:其他试剂或测定可用于定量每个样品中的蛋白质量。在基于群体的测定中,可以通过标准化测定中使用的蛋白质量来比较样品。
- 用牛血清白蛋白 (BSA) 制备 0 μg/mL 和 2,000 μg/mL(0 μg/mL、25 μg/mL、125 μg/mL、250 μg/mL、500 μg/mL、750 μg/mL、100 μg/mL、1,500 μg/mL、2,000 μg/mL)的标准蛋白质浓度。仅用裂解缓冲液制备空白。
- 将每种标准品的10 μL加入包含样品的平底96孔板中,如步骤3.7中所述。
- 以50:1的比例将BCA试剂1与BCA试剂2混合(参见 材料表)。向每个样品和标准品中加入 200 μL 混合 BCA 试剂。
- 在37°C孵育30分钟。
- 在荧光仪器上测量562nm处的吸光度,并用标准曲线定量蛋白质浓度。
5. 基于人群的半胱天冬酶-3/半胱天冬酶-7活性测定
注意:不要让板中的细胞裂解物在冰上放置超过3小时。如果存在半胱天冬酶活性,尽管样品在冰上,但这种活性会随着时间的推移而增加。如果样品被冷冻,则在冰上解冻,并在裂解物解冻后立即进行。
- 启动荧光仪器(见 材料表)并将机器加热至37°C。 按上述方式准备脚本:
- 每分钟进行一次单独的读数,持续40分钟,以确定反应的动力学。
- 将激发设置为 360 nm,将发射设置为 465 nm。每孔十次闪光就足够了。
- 准备重组半胱天冬酶-3的阳性对照(见 材料表)。将 1 U 重组半胱天冬酶-3 酶混合在 50 μL 裂解缓冲液(管 1)中。向另外三个试管中加入 25 μL 裂解缓冲液。将 25 μL 从试管 1 转移到试管 2。通过移液混合。
- 对管3和管4重复。试管 5 仅包含 50 μL 裂解缓冲液。将 25 μL 每种标准品加入白色平底 96 孔板中,用于步骤 3.6 中提到的半胱天冬酶-3 活性测定。
- 准备用于冰上半胱天冬酶活性测定的主反应混合物。对于一个反应,混合 50 μL 2x 半胱天冬酶裂解缓冲液(0.2M HEPES pH 7.5;20% 蔗糖或 PEG;0.2% CHAPS)、5 μL 1 mM DEVD-AMC(半胱天冬酶-3 四肽底物)、2 μL 500 mM DTT 和 18 μL 去离子水(参见 材料表)。
- 向每个样品和标准品中加入 75 μL 的反应混合物,以获得 100 μL 的总反应体积。
- 立即使用步骤5.1中设置的荧光仪器测量荧光。
- 对于每次荧光测量,从样品的荧光中减去空白(仅限裂解缓冲液)的荧光读数。通过除以样品的蛋白质浓度(在步骤4.5中计算)27来标准化读数:
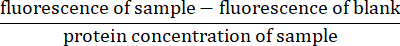
- 通过确定y轴上归一化荧光的斜率和x轴上的时间来计算半胱天冬酶活性的速率。
6. 半胱天冬酶-3/半胱天冬酶-7活性的单细胞测定(流式细胞术分析)
- 如第2节所述接种细胞。
- 将细胞收获到 5 mL 聚苯乙烯管中。如果使用贴壁细胞,则将培养基收集到 5 mL 管中。向细胞培养板中加入 1 mL 冷 PBS,并将 PBS 收集到 5 mL 管中。向细胞中加入胰蛋白酶(如果使用 6 孔培养皿,则为 100 μL)。让胰蛋白酶将细胞从平板上提起,并收集到 5 mL 管中。使用 1 mL 冷 PBS 确保收集所有细胞。
注意:如果使用悬浮细胞,请将培养基和细胞轻轻转移到 5 mL 管中。 - 将样品以300× g 离心5分钟,4°C。 使用真空吸液器除去上清液。
- 准备染色混合物。最佳染色浓度为 50 μL 中的 1 x 106-2 x 106 个 细胞。按照制造商的说明稀释荧光底物(参见 材料表,流式细胞术)。取 1 μL 原液底物,并在 150 μL PBS 中稀释。每个样品添加 50 uL。
- 将样品在37°C避光孵育30分钟,每15分钟混合一次。
- 使用本研究中使用的流式细胞仪,使用640 nm的红色激光,并使用675 / 25 nm进行检测。首先运行未染色的对照样品,并获取至少10,000个所需群体的事件。使用FSC-A和SSC-A点图上的门(P1)排除碎片。
- 使用直方图显示P1门中的事件和半胱天冬酶底物(y轴)的检测来确定中位荧光强度(MFI)。
注意:该方法中描述的半胱天冬酶底物需要在590nm处激发并在628nm处发射。
- 使用直方图显示P1门中的事件和半胱天冬酶底物(y轴)的检测来确定中位荧光强度(MFI)。
结果
原代小鼠巨噬细胞分化6天。6天后,收获细胞,计数并接种。使用以下处理:不处理和Smac模拟物(化合物A)22 在250nM和500nM下16小时(图1)。该实验一式两份进行,以允许通过基于群体的测定或使用流式细胞术的单细胞分析来评估半胱天冬酶-3 / caspase-7活化。
使用BCA测定法定量细胞裂解物的蛋白质浓度(补充表1)。这对于确保半胱天冬酶-3/半胱天冬酶-7活性测定中使用的蛋白质量在样品之间是相同的是必要的。在这种基于人群的测定中,数据可以通过两种方式呈现。第一种是通过绘制调整后的荧光(y轴)与时间(x轴)的关系来显示动力学(图2A)。或者,可以计算斜率以直接比较样品(图2B)。基于具有多重比较的普通单因素方差分析,500 nM Smac模拟处理的斜率增加并不显着(Dunnett的多重比较检验28)。
为了使用流式细胞术分析半胱天冬酶-3/半胱天冬酶-7活性,收获细胞和上清液。使用未染色细胞或荧光减1作为阴性对照,以及未处理的细胞。通过流式细胞术收集的细胞的直方图显示,与未处理的细胞相比,用Smac模拟物处理的细胞的荧光发生了变化(图2C)。数据可以显示为中位数荧光强度(图2D)或未处理细胞的倍数变化(图2E)。

图1:研究流程图。 (A)从C57Bl / 6小鼠中切除股骨和胫骨。将骨头冲洗并在20 ng / mL m-CSF中分化6天。(B)在第6天,收获巨噬细胞并重新播种进行处理。收获一组细胞用于裂解物并通过荧光活性进行评估,而另一组则收获,与荧光底物一起孵育,并通过流式细胞术进行评估。请点击此处查看此图的大图。
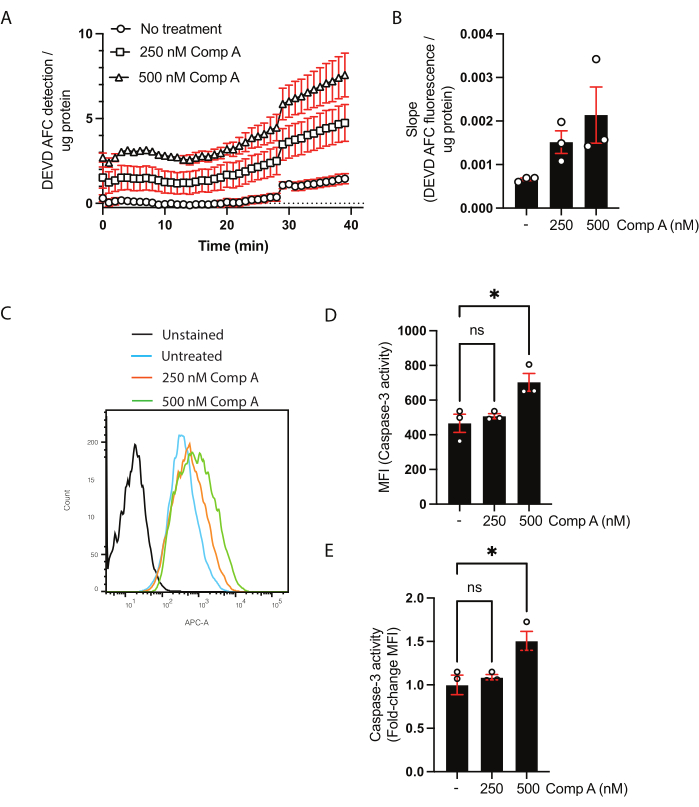
图2:通过流式细胞术测定半胱天冬酶-3/半胱天冬酶-7活性和底物切割的动力学测定。 (A,B)半胱天冬酶-3/半胱天冬酶-7活性(C-E)和流式细胞术底物切割的动力学测定的代表性数据。用两种浓度的Smac模拟物(化合物A;250nM和500nM)处理巨噬细胞16小时。 (A)随着时间的推移检测裂解的DEVD AFC底物。将数据归一化为样品中的蛋白质浓度。(B)将每个样品的DEVD AFC的切割速率(斜率)归一化为未处理的斜率,并表示为未处理细胞的倍数变化。(C)与半胱天冬酶-3底物一起孵育的细胞的流式细胞术直方图。(D,E)与未处理的样品相比,MFI中的MFI比较和倍数变化。每个数据点代表一个独立的样本;显示平均值±平均值的标准误差;*p < 0.05,使用单因素方差分析和多重比较检验(邓内特多重比较检验)。请点击此处查看此图的大图。
| 半胱天冬酶 | 物种 | 基板序列 | 蛋白质结构域 | ||
| 半胱天冬酶-1 | 高,毫米 | (宽/长)EHD | 卡,大域,小催化域 | ||
| 半胱天冬酶-2 | 高,毫米 | 德克斯德 | 卡,大域,小催化域 | ||
| 半胱天冬酶-4 | 房 协 | (宽/长)EHD | 卡,大域,小催化域 | ||
| 半胱天冬酶-5 | 房 协 | (宽/长)EHD | 卡,大域,小催化域 | ||
| 半胱天冬酶-9 | 高,毫米 | (I/V/L)E(H/T)D | 卡,大域,小催化域 | ||
| 半胱天冬酶-11 | 毫米 | (宽/长)EHD | 卡,大域,小催化域 | ||
| 半胱天冬酶-12 | 毫米 | ATAD | 卡,大域,小催化域 | ||
| 半胱天冬酶-8 | 高,毫米 | (I/V/L)E(H/T)D | DED,大结构域,小催化域 | ||
| 半胱天冬酶-10 | 房 协 | (I/V/L)E(H/T)D | DED,大结构域,小催化域 | ||
| 半胱天冬酶-3 | 高,毫米 | 德克斯德 | 大域,小催化域 | ||
| 半胱天冬酶-6 | 高,毫米 | (I/V/L)E(H/T)D | 大域,小催化域 | ||
| 半胱天冬酶-7 | 高,毫米 | 德克斯德 | 大域,小催化域 | ||
| 半胱天冬酶-14 | 高秒,毫米 | (宽/长)EHD | 大域,小催化域 | ||
| 卡 | 半胱天冬酶活化和募集领域 | ||||
| 德德 | 死亡效应域 | ||||
| 房 协 | 智人 | ||||
| 毫米 | 肌肉肌肉 | ||||
表1:底物特异性和半胱天冬酶的蛋白质结构域。 该表改编自McStay等人20;沙利尼等人3;和范奥登博斯和兰坎菲4.
补充表1:DEVD动力学分析。请按此下载此表格。
讨论
在该方法中,荧光底物用于基于群体的测定或单细胞分析以测量半胱天冬酶-3 / 半胱天冬酶-7活性。两种方法都基于底物的裂解以定量方式测量半胱天冬酶活性。一个优点是能够将这些方法用于大量样品。使用这些方法,在用Smac模拟物处理的原代巨噬细胞中检测到半胱天冬酶-3 / caspase-7活性。
基于群体的荧光测定的一个关键方面是从裂解到读取荧光的时间。在整个过程中,样品必须保持在冰上,特别是在"读取"测定之前。这可以防止底物过早裂解和荧光。使用基于群体的测定,可能需要较少的优化。测定中使用的蛋白质量被标准化,允许直接比较样品。需要注意的是,在凋亡细胞死亡的晚期,总蛋白质量减少;因此,可能无法检测半胱天冬酶活性。建议使用不同的动力学或不同的治疗剂量来规避这个问题。此外,除了该方法中描述的软件之外,其他软件可用于准确评估半胱天冬酶活性的速率。
对于流式细胞术测定,需要足够的事件或细胞来自信地浇灌群体。此外,可能需要对基于流动的测定进行更多优化,以实现底物与细胞数的最佳比例。然而,使用流式细胞术,该方法有助于测量其他参数,例如用于细胞类型鉴定的细胞表面标志物。
群体和单细胞方法都可用于其他半胱天冬酶。然而,重要的是要记住,识别序列对其他半胱天冬酶的区分较少。因此,必须使用其他半胱天冬酶活性方法。这包括抑制半胱天冬酶活性,CRISPR或敲低特定半胱天冬酶,以及蛋白质印迹以检测已知底物的裂解。
检测半胱天冬酶活性的一种替代方法是延时成像。相同的可渗透半胱天冬酶底物可以与其他活力标志物(如膜联蛋白V)一起使用,以提供有关细胞死亡动力学的信息。成像还可以分离半胱天冬酶活性和细胞存活,从而可以检测细胞群中亚致死量的半胱天冬酶活性。半胱天冬酶-3/半胱天冬酶-7的非致死功能与先天免疫细胞29中的抗病毒调节有关,特别是通过线粒体DNA释放15,16激活I型IFN。因此,这些测量半胱天冬酶活性的测定对于识别不同的细胞死亡模式至关重要,并且可能有助于评估非细胞死亡功能。
披露声明
作者没有利益冲突需要披露。
致谢
W.W.W.由Clöetta医学研究员资助,S.R.由CanDoc UZH Forschungskredit支持,J.T.由中国国家留学基金委支持。
材料
| Name | Company | Catalog Number | Comments |
| 1.5 mL microfuge tubes | Sarstedt | 72.706.400 | |
| 15 cm Petri plates | Sarstedt | 82.1184.500 | |
| 37 degree incubator shaker | IKA shaker KS 4000i | 97014-816 | distributed by VWR |
| 6-well cell culture dish | Sarstedt | 83.392 | |
| 96 well flat bottom, white polystyrene, non-sterile | Sigma | CLS3600 | |
| 96 well flat plate | Sarstedt | 82.1581 | |
| Ac-DEVD-AFC | Enzo Life Sciences | ALX-260-032-M005 | Caspase-3 substrate |
| BD Fortessa | BD | any flow cytometer with the appropriate excitation and emission detector will work | |
| b-glycerolphosphate | Sigma | G9422-10G | |
| caspase-3 recombinant | Enzo Life Sciences | ALX-201-059-U025 | |
| CHAPS | Sigma | 1.11662 | |
| DMEM, low glucose, pyruvate | Thermoscientific | 31885023 | |
| DMSO | Sigma | D8418-250ML | |
| EDTA | Sigma | 03685-1KG | |
| EGTA | Sigma | 324626-25GM | |
| Etoposide | MedChem Express | HY-13629 | |
| FBS | Thermoscientific | 26140 | |
| Flow cytometry tubes | Falcon | 352008 | |
| Flowjo | Flowjo | A license in required but any program that can analyze .fcs files will suffice | |
| Glycerol | Sigma | G5516-500ML | |
| HEPES | Sigma | H4034 | |
| Magic Red caspase-3/7 assay kit; flow cytometry or imaging | Immunochemistry Technologies | 935 | |
| M-CSF | ebioscience | 14-8983-80 | now a subsidiary of Thermoscientific |
| M-Plex | Tecan | any fluorometric reader will work with the appropriate excitation and emission detectors | |
| NaCl | Roth | 3957.1 | |
| PBS pH 7.4 | Thermoscientific | 10010023 | |
| Penicillin-Streptomycin-Glutamine (100X) | Thermoscientific | 10378016 | |
| Pierce BCA Protein Assay Kit | ThermoFisher Scientific | 23225 | protein concentration assay |
| protease inhibitors | Biomol | P9070.100 | |
| Smac mimetic, Compound A | Tetralogics | also known as 12911; structure shown in supplementary figures of Vince et al., Cell 2007 | |
| Sodium Fluoride | Sigma | S7920-100G | |
| sodium orthovanadate | Sigma | S6508-10G | |
| sodium pyrophosphate | Sigma | P8010-500G | |
| Staurosporine | MedChem Express | HY-15141 | |
| sucrose | Sigma | 1.07687 | |
| Tris Base | Sigma | T1503-1KG | |
| Triton X100 | Sigma | T8787-50ML | |
| TrypLE | Thermoscientific | A1285901 | In the protocol, it is listed as Trypsin |
参考文献
- Ramirez, M. L. G., Salvesen, G. S. A primer on caspase mechanisms. Seminars in Cell and Developmental Biology. 82, 79-85 (2018).
- Nicholson, D. W., Thornberry, N. A. Caspases: Killer proteases. Trends in Biochemical Sciences. 22 (8), 299-306 (1997).
- Shalini, S., Dorstyn, L., Dawar, S., Kumar, S. Old, new and emerging functions of caspases. Cell Death and Differentiation. 22 (4), 526-539 (2014).
- Van Opdenbosch, N., Lamkanfi, M. Caspases in cell death, inflammation, and disease. Immunity. 50 (6), 1352-1364 (2019).
- Kesavardhana, S., Malireddi, R. K. S., Kanneganti, T. -. D. Caspases in cell death, inflammation, and pyroptosis. Annual Review of Immunology. 38, 567-595 (2020).
- Fu, T. -. M., et al. Cryo-EM structure of caspase-8 tandem DED filament reveals assembly and regulation mechanisms of the death-inducing signaling complex. Molecular Cell. 64 (2), 236-250 (2016).
- Jiang, X., Wang, X. Cytochrome c promotes caspase-9 activation by inducing nucleotide binding to Apaf-1. Journal of Biological Chemistry. 275 (40), 31199-31203 (2000).
- Christgen, S., Place, D. E., Kanneganti, T. -. D. Toward targeting inflammasomes: Insights into their regulation and activation. Cell Research. 30 (4), 315-327 (2020).
- Shi, J., et al. Cleavage of GSDMD by inflammatory caspases determines pyroptotic cell death. Nature. 526 (7575), 660-665 (2015).
- Sborgi, L., et al. GSDMD membrane pore formation constitutes the mechanism of pyroptotic cell death. EMBO Journal. 35 (16), 1766-1778 (2016).
- Rühl, S., et al. ESCRT-dependent membrane repair negatively regulates pyroptosis downstream of GSDMD activation. Science. 362 (6417), 956-960 (2018).
- Declercq, W., Takahashi, N., Vandenabeele, P. Dual face apoptotic machinery: From initiator of apoptosis to guardian of necroptosis. Immunity. 35 (4), 493-495 (2011).
- Newton, K., et al. Cleavage of RIPK1 by caspase-8 is crucial for limiting apoptosis and necroptosis. Nature. 574, 428-431 (2019).
- Fritsch, M., et al. Caspase-8 is the molecular switch for apoptosis, necroptosis and pyroptosis. Nature. 575, 683-687 (2019).
- White, M. J., et al. Apoptotic caspases suppress mtDNA-induced STING-mediated type I IFN production. Cell. 159 (7), 1549-1562 (2014).
- Rongvaux, A., et al. Apoptotic caspases prevent the induction of type I interferons by mitochondrial DNA. Cell. 159 (7), 1563-1577 (2014).
- Nakajima, Y. -. I., Kuranaga, E. Caspase-dependent non-apoptotic processes in development. Cell Death and Differentiation. 24, 1422-1430 (2017).
- Kumar, S., Dorstyn, L., Lim, Y. The role of caspases as executioners of apoptosis. Biochemical Society Transactions. 50 (1), 33-45 (2022).
- Agniswamy, J., Fang, B., Weber, I. T. Plasticity of S2-S4 specificity pockets of executioner caspase-7 revealed by structural and kinetic analysis. FEBS Journal. 274 (18), 4752-4765 (2007).
- McStay, G. P., Salvesen, G. S., Green, D. R. Overlapping cleavage motif selectivity of caspases: implications for analysis of apoptotic pathways. Cell Death and Differentiation. 15 (2), 322-331 (2008).
- Thornberry, N. A., et al. A combinatorial approach defines specificities of members of the caspase family and granzyme B. Functional relationships established for key mediators of apoptosis. Journal of Biological Chemistry. 272 (29), 17907-17911 (1997).
- Vince, J. E., et al. IAP antagonists target cIAP1 to induce TNFalpha-dependent apoptosis. Cell. 131 (4), 682-693 (2007).
- McComb, S., et al. cIAP1 and cIAP2 limit macrophage necroptosis by inhibiting Rip1 and Rip3 activation. Cell Death and Differentiation. 19 (11), 1791-1801 (2012).
- Wong, W. W. -. L., et al. cIAPs and XIAP regulate myelopoiesis through cytokine production in an RIPK1- and RIPK3-dependent manner. Blood. 123 (16), 2562-2572 (2014).
- Liu, X., Quan, N. Immune cell isolation from mouse femur bone marrow. Bio-Protocol. 5 (20), e1631 (2015).
- Lin, H., Chen, C., Chen, B. D. Resistance of bone marrow-derived macrophages to apoptosis is associated with the expression of X-linked inhibitor of apoptosis protein in primary cultures of bone marrow cells. Biochemical Journal. 353 (Pt 2), 299-306 (2001).
- . Caspase activity assay buffer. Cold Spring Harbor Protocols. , (2015).
- Mackridge, A., Rowe, P. One-way analysis of variance (ANOVA) - Including Dunnett's and Tukey's follow up tests. Practical Approach to Using Statistics in Health Research: From Planning to Reporting. , 93-103 (2018).
- Chen, H., Ning, X., Jiang, Z. Caspases control antiviral innate immunity. Cellular and Molecular Immunology. 14 (9), 736-747 (2017).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。