Method Article
Medición de la actividad de las caspasas mediante un ensayo fluorométrico o citometría de flujo
En este artículo
Resumen
El presente protocolo describe dos métodos para medir la actividad de las caspasas a través de un sustrato fluorogénico utilizando citometría de flujo o un espectrofluorómetro.
Resumen
La activación de las proteasas de cisteína, conocidas como caspasas, sigue siendo un proceso importante en múltiples formas de muerte celular. Las caspasas son iniciadores críticos y verdugos de la apoptosis, la forma más estudiada de muerte celular programada. La apoptosis ocurre durante los procesos de desarrollo y es un evento necesario en la homeostasis tisular. La piroptosis es otra forma de muerte celular que utiliza caspasas y es un proceso crítico en la activación del sistema inmune a través de la activación del inflamasoma, lo que resulta en la liberación de miembros de la familia de la interleucina-1 (IL-1). Para evaluar la actividad de las caspasas, se pueden evaluar los sustratos objetivo. Sin embargo, la sensibilidad puede ser un problema al examinar células individuales o actividad de bajo nivel. Demostramos cómo se puede usar un sustrato fluorogénico con un ensayo basado en la población o un ensayo de una sola célula mediante citometría de flujo. Con los controles adecuados, se pueden usar diferentes secuencias de aminoácidos para identificar qué caspasas están activas. Usando estos ensayos, se ha identificado la pérdida simultánea de los inhibidores de las proteínas de apoptosis en la estimulación del factor de necrosis tumoral (TNF), que induce principalmente la apoptosis en macrófagos en lugar de otras formas de muerte celular.
Introducción
Las caspasas están involucradas en varias formas de muerte celular programada. La apoptosis es la forma más estudiada de muerte celular programada y está asociada a la actividad de la caspasa1. Todas las caspasas poseen una subunidad catalítica grande y pequeña. La caspasa-1, la caspasa-4, la caspasa-5, la caspasa-9 y la caspasa-11 poseen un dominio de activación y reclutamiento de caspasas (CARD), y la caspasa-8 y la caspasa-10 contienen dominios efectores de muerte (DED)2,3,4,5 (Tabla 1). La apoptosis puede iniciarse por dos vías principales: la vía extrínseca y la vía intrínseca. La vía apoptótica extrínseca es desencadenada por los receptores de muerte, que forman parte de la superfamilia del factor de necrosis tumoral (TNFSF). Los receptores de muerte poseen dominios DED, facilitando la actividad de la caspasa-86. La vía apoptótica intrínseca implica la activación de la caspasa-9 después de la formación del apoptosoma, requiriendo la liberación del citocromo c y Apaf-17. La activación de cualquiera de las caspasas iniciadoras, caspasa-8 o caspasa-9, conduce a la escisión y posterior activación de las caspasas verdugo, que son caspasa-3, caspasa-6 y caspasa-7. La identificación de que las caspasas verdugos están activas indica que las células están sufriendo apoptosis, y esta activación se considera un factor importante en la definición del modo de muerte celular.
La activación de la caspasa también es una coyuntura crítica para regular la inflamación y la inducción de formas alternativas de muerte celular programada. Por ejemplo, la activación de la caspasa-1 conduce a la maduración de citoquinas proinflamatorias de la familia de la interleucina-18. La liberación y activación de citoquinas de esta familia, particularmente IL-1β e IL-18, resultan de la escisión de la gasdermina D y la formación de poros en la membrana plasmática 9,10. La reparación inadecuada de la membrana de los poros de la gasdermina D puede resultar en un tipo de muerte celular conocida como piroptosis11. Además, la actividad de la caspasa-8 resulta en la inhibición de una muerte celular independiente de la caspasa conocida como necroptosis12. La proteína quinasa 1 de serina/treonina que interactúa con el receptor (RIPK1) es uno de los factores críticos en la necroptosis y en la conducción de la inflamación regulada por NF-kB. Los modelos han demostrado que RIPK1 es escindido por caspasa-8, lo que resulta en la limitación de la señalización de NF-kB, la apoptosis y la necroptosis13,14. Por lo tanto, identificar la actividad de diferentes caspasas puede ayudar a comprender la modalidad resultante de inflamación y muerte celular.
Independientemente de la función de las caspasas en la regulación de las modalidades de muerte celular, la actividad de las caspasas también puede regular otras familias de citoquinas, como el interferón (IFN), en respuesta a la infección15,16. Además, las caspasas están involucradas en funciones de muerte no celular, incluidas las decisiones de destino celular, la reparación y regeneración de tejidos, la tumorigénesis a través de la reparación del ADN y la función de la sinapsis neuronal. Se cree que la actividad de las caspasas en estas funciones no letales está limitada por la localización celular y la cantidad de caspasas. Por lo tanto, la cuantificación del nivel de actividad de la caspasa bien puede definir si una célula sufre muerte celular o si la caspasa desempeña un papel en una función de muerte no celular 4,17,18.
La actividad de la caspasa se puede evaluar mediante múltiples métodos. La Western blot para caspasas hendidas y sus sustratos se ha utilizado como un indicador de actividad, pero estos ensayos son cualitativos en el mejor de los casos. Para determinar si la actividad de la caspasa está asociada con la muerte celular, una medición cuantitativa es ideal. Dado que las caspasas escinden sustratos en un sitio de reconocimiento que consta de cuatro aminoácidos, se han desarrollado métodos colorimétricos, luminiscentes o fluorométricos. Sin embargo, las caspasas parecen tener plasticidad en su reconocimiento de sustrato19,20. La secuencia de reconocimiento no está asociada a los dominios proteicos (Tabla 1). La secuencia tetrapeptídica DEVD, sin embargo, puede ser utilizada para detectar la actividad de caspasa-3 y caspasa-720,21.
Los miméticos de Smac son compuestos dirigidos a los inhibidores de las proteínas de apoptosis (PIA). El uso de miméticos de Smac en un subconjunto de células cancerosas hace que las células se vuelvan sensibles a la muerte celular inducida por TNF22. En macrófagos primarios, los miméticos de Smac causan la muerte celular sin la adición exógena de TNF23,24. La pérdida de cIAP1 por degradación inducida por mimética Smac da como resultado la producción de TNF. Si se detecta actividad de caspasa, esto significa que las células no murieron por necroptosis sino de manera apoptótica. En este método, la detección del sustrato DEVD escindido se utiliza para identificar la actividad de caspasa-3/caspasa-7. Otros experimentos para confirmar la muerte celular apoptótica se han publicado previamente24.
Protocolo
El presente estudio se realizó con la aprobación y siguiendo las directrices del comité de ética animal de la Universidad de Zúrich (#ZH149/19). Para el presente estudio se utilizaron ratones machos C57Bl / 6J de 8 a 16 semanas, criados y alojados en condiciones específicas libres de patógenos (SPF). Los huesos intactos se pueden mantener en hielo en la solución salina tamponada estéril de Hank (HBSS) con suero bovino fetal inactivado por calor (FBS) al 2%. La médula ósea se recogió del fémur y la tibia del ratón25 el día de la diferenciación. Ambos métodos para evaluar la actividad de las caspasas se pueden utilizar para otros tipos de células, incluidas las primarias y transformadas.
1. Diferenciación de macrófagos derivados de médula ósea (BMDM)
NOTA: Realice todos los pasos en una campana de flujo laminar de cultivo de tejidos y utilice técnicas asépticas estériles.
- Prepare una jeringa de 1 ml con una aguja de 21 G.
- Agregue 5 ml de HBSS + 2% de FBS a un tubo de 15 ml.
- Con fórceps estériles, tome un fémur extirpado e inserte la aguja en la abertura del fémur. Sosteniendo el fémur en el HBSS + 2% FBS, enjuague la médula ósea hasta que el hueso esté blanco. Enjuague la tibia de la misma manera. Continúe enjuagando la solución para obtener una suspensión de una sola célula.
- Centrifugar la suspensión unicelular a 200 x g durante 4 min a temperatura ambiente (RT).
- Retire el sobrenadante con un aspirador de vacío. Golpee el tubo para resuspender suavemente el pellet. Agregue 1 ml de tampón de lisis de glóbulos rojos (consulte la Tabla de materiales) y mezcle suavemente con una pipeta P1,000. Incubar a RT durante 1 min.
- Añadir 10 ml de HBSS + 2% FBS, y centrifugar a 200 x g durante 4 min a RT.
- Retire el sobrenadante y vuelva a suspender en 10 ml de medio de cultivo de macrófagos derivados de la médula ósea (BMDM).
NOTA: El medio de cultivo de DMOM consiste en DMEM bajo en glucosa con la adición de FBS al 10%, 20 ng/ml de M-CSF, penicilina (50 U/ml) y estreptomicina (50 μg/ml) (ver Tabla de materiales). Alternativamente, el medio acondicionado L929 al 20% puede ser sustituido por el M-CSF. - Añadir 15 ml de medio de cultivo BMDM en dos placas de Petri de 15 cm. Agregue 5 ml de la solución de una sola célula a cada placa.
NOTA: No utilice placas tratadas con cultivo de tejidos. Las placas tratadas con cultivo de tejidos limitan la diferenciación. - Colocar los platos a 37 °C, 5%CO2, durante 6 días.
NOTA: Los BMDM se pueden cosechar después de 5-7 días. Los tiempos de incubación más largos para la diferenciación conducen a una mayor expresión de proteínas antiapoptóticas26.
2. Recolección, siembra y tratamiento de células
NOTA: Realice todos los pasos en una campana de flujo laminar de cultivo de tejidos y utilice técnicas asépticas estériles. Los macrófagos totalmente diferenciados se adhieren a la placa, lo que permite una fácil separación, mientras que las células flotantes se pueden descartar. La solución salina tamponada con fosfato (PBS) se puede usar con o sin Ca 2+ y Mg2+.
- Después de 6 días de incubación, retire las células flotantes y el medio de la placa con un aspirador.
- Agregue 5 ml de PBS a cada placa de 15 cm. Retire el PBS de la placa con un aspirador.
- Agregue 2 ml de tripsina (consulte la Tabla de materiales) a cada placa. Incubar la placa hasta que el golpeteo suave de la placa desaloje las células. Tome 5 ml de medio de cultivo de BMDM y extraiga las células de la placa.
- Transfiera a la segunda placa de 15 cm y recoja las células de la placa. Retire la suspensión celular de la placa en un tubo de 50 ml. Tome 5 ml adicionales de medio de cultivo de DMO y lave ambas placas para asegurarse de que se hayan recolectado todas las células. Coloque la suspensión celular en el mismo tubo de 50 ml.
- Tome 10 μL de la suspensión celular y cuente con un hemacitómetro con una dilución 1:1 con azul de tripano.
NOTA: Los contadores automáticos de celdas también se pueden usar cuando se calibran para el tamaño de los macrófagos. - Sembrar los macrófagos a una densidad de 1 x 106 células/ml. Las DMOO sembradas a 2 x 106 células/pocillo en una placa de 6 pocillos proporcionan aproximadamente 2 mg/ml de proteína total. Permita que las células se adhieran a la placa durante un mínimo de 6 h antes del tratamiento.
NOTA: Para otros tipos de células, se debe determinar la concentración óptima. - Tratar los macrófagos con Smac mimético (Compuesto A, ver Tabla de Materiales)22 a 250 nM y 500 nM durante 16 h.
NOTA: Incluya un control positivo para inducir la apoptosis y la escisión de la caspasa-3 para garantizar que el ensayo esté funcionando. Los inductores comunes de la apoptosis incluyen estaurosporina y etopósido. Para que muchas líneas celulares sufran apoptosis, 0.1-10 μM durante 16 h de estimulación es suficiente.
3. Preparación de lisados celulares a partir de células tratadas
NOTA: Este paso debe realizarse en hielo, y los reactivos y materiales deben ser pre-enfriados.
- Transfiera las placas que contienen las células tratadas al hielo. Recoger el medio del cultivo celular en un tubo de 1,5 ml, centrifugar a 300 x g durante 5 min a 4 °C, aspirar el medio y poner el tubo en hielo. Esto permite la recolección de las células que se han desprendido de la placa.
- Agregue 1 ml de PBS frío a la placa de cultivo celular para lavar las células y aspire todo el PBS. Agregue 100 μL de tripsina a las células (si trabaja con un plato de 6 pocillos). Permita que la tripsina levante las células de la placa y recójalas en el tubo de 1.5 ml. Use 1 ml de PBS frío para asegurarse de que se hayan recolectado todas las células.
NOTA: Si trabaja con células de suspensión, transfiera suavemente el medio y las células a un tubo de 1,5 ml. - Centrifugar las células a 300 x g durante 5 min a 4 °C. Retirar el sobrenadante y resuspender en tampón de lisis DISC de 100 μL (cloruro de sodio de 150 mM, EDTA 2 mM, Triton X-100 al 1%, glicerol al 10%, Tris al 20 mM, pH 7,5, ver Tabla de materiales).
- Incubar las muestras en hielo durante 20 min.
- Centrifugar los lisados a ~12.000 x g durante 10 min a 4 °C para granular la fracción insoluble.
- Transfiera 25 μL del lisado a una placa blanca de fondo plano de 96 pocillos para el ensayo de actividad caspasa-3/caspasa-7 (paso 5).
NOTA: No perturbe el pellet. Esta es la fracción insoluble del lisado celular. - Transfiera 10 μL del lisado restante a una placa transparente de fondo plano de 96 pocillos para el ensayo de ácido bicinchonínico (BCA) (paso 4). Esto se utilizará para la normalización de las muestras.
- Mantenga ambas placas en hielo para su posterior procesamiento.
NOTA: En esta etapa, las placas pueden sellarse con una cubierta adhesiva y almacenarse a -20 °C durante aproximadamente 4 semanas.
4. Cuantificación de proteínas mediante el ensayo BCA
NOTA: Se pueden usar otros reactivos o ensayos para cuantificar la cantidad de proteína en cada muestra. En el ensayo basado en la población, las muestras se pueden comparar normalizando la cantidad de proteína utilizada en el ensayo.
- Preparar concentraciones proteicas estándar entre 0 μg/ml y 2.000 μg/ml (0 μg/ml, 25 μg/ml, 125 μg/ml, 250 μg/ml, 500 μg/ml, 750 μg/ml, 100 μg/ml, 1.500 μg/ml, 2.000 μg/ml) con albúmina sérica bovina (BSA). Prepare espacios en blanco solo con el búfer de lisis.
- Añadir 10 μL de cada patrón en la placa de fondo plano de 96 pocillos que contiene las muestras, mencionadas en el paso 3.7.
- Mezcle el reactivo BCA 1 con el reactivo BCA 2 en una proporción de 50:1 (consulte la Tabla de materiales). Añadir 200 μL de reactivo BCA mixto a cada muestra y estándar.
- Incubar a 37 °C durante 30 min.
- Mida la absorbancia a 562 nm en un instrumento fluorométrico y cuantifique la concentración de proteína con la curva estándar.
5. Ensayo poblacional para la actividad de caspasa-3/caspasa-7
NOTA: No permita que los lisados celulares en la placa se asienten sobre hielo durante más de 3 h. Si la actividad de la caspasa está presente, esto aumenta con el tiempo a pesar de que la muestra esté en hielo. Si las muestras estaban congeladas, descongelarlas en hielo y proceder inmediatamente una vez que los lisados se hayan descongelado.
- Arranque el instrumento fluorométrico (ver Tabla de materiales) y caliente la máquina a 37 °C. Prepare el guión como se mencionó:
- Realice lecturas individuales cada minuto durante 40 minutos para determinar la cinética de la reacción.
- Ajuste la excitación a 360 nm y la emisión a 465 nm. Diez destellos por pocillo son suficientes.
- Preparar el control positivo de la caspasa-3 recombinante (ver Tabla de Materiales). Mezclar 1 U de la enzima caspasa-3 recombinante en 50 μL de tampón de lisis (tubo 1). Agregue 25 μL de tampón de lisis a tres tubos adicionales. Transfiera 25 μL del tubo 1 al tubo 2. Mezclar por pipeteo.
- Repita para el tubo 3 y el tubo 4. El tubo 5 contendrá solo 50 μL de tampón de lisis. Añadir 25 μL de cada patrón en la placa blanca de fondo plano de 96 pocillos para el ensayo de actividad de caspasa-3, mencionado en el paso 3.6.
- Prepare una mezcla de reacción maestra para el ensayo de actividad de caspasa en hielo. Para una reacción, mezcle 50 μL de 2x tampón de escisión de caspasa (0.2M HEPES pH 7.5; 20% sacarosa o PEG; 0.2% CHAPS), 5 μL de 1 mM DEVD-AMC (sustrato tetrapeptídico caspasa-3), 2 μL de 500 mM DTT y 18 μL de agua desionizada (ver Tabla de materiales).
- Añadir 75 μL de la mezcla de reacción a cada muestra y patrón para obtener un volumen de reacción total de 100 μL.
- Mida inmediatamente la fluorescencia utilizando el instrumento fluorométrico configurado en el paso 5.1.
- Para cada medición fluorescente, reste la lectura de fluorescencia para el espacio en blanco (solo tampón de lisis) de la fluorescencia de la muestra. Normalizar la lectura dividiendo por la concentración proteica de la muestra (calculada en el paso 4.5)27:
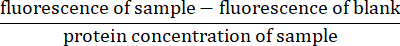
- Calcule la tasa de actividad de las caspasas determinando la pendiente de la fluorescencia normalizada en el eje y y el tiempo en el eje x.
6. Ensayo unicelular (análisis de citometría de flujo) para la actividad de caspasa-3/caspasa-7
- Sembrar las células como se describe en la sección 2.
- Cosechar las células en un tubo de poliestireno de 5 ml. Si trabaja con células adherentes, recoja el medio en el tubo de 5 ml. Agregue 1 ml de PBS frío a la placa de cultivo celular y recoja el PBS en el tubo de 5 ml. Agregue tripsina a las células (100 μL si se trabaja con platos de 6 pocillos). Permita que la tripsina levante las células de la placa y se acumule en el tubo de 5 ml. Use 1 ml de PBS frío para asegurarse de que se hayan recolectado todas las células.
NOTA: Si trabaja con células de suspensión, transfiera suavemente el medio y las células a un tubo de 5 ml. - Centrifugar las muestras a 300 x g durante 5 min, 4 °C. Retire el sobrenadante con un aspirador de vacío.
- Prepare la mezcla de tinción. La concentración óptima de tinción es de 1 x 10 6-2 x 106 células en 50 μL. Diluir el sustrato fluorogénico según las instrucciones del fabricante (ver Tabla de materiales, citometría de flujo). Tomar 1 μL del sustrato madre y diluir en 150 μL de PBS. Añadir 50 uL por muestra.
- Incubar las muestras a 37 °C durante 30 min protegidas de la luz, mezclando cada 15 min.
- Con el citómetro de flujo utilizado en este estudio, use el láser rojo a 640 nm y detecte usando 675/25 nm. Ejecute primero la muestra de control sin teñir y adquiera un mínimo de 10,000 eventos de la población deseada. Excluya los desechos utilizando una puerta (P1) en un diagrama de puntos FSC-A y SSC-A.
- Utilice un histograma que muestre los eventos en la puerta P1 y la detección del sustrato de caspasa (eje y) para determinar la intensidad media de fluorescencia (MFI).
NOTA: El sustrato de caspasa descrito en este método requiere una excitación a 590 nm y emite a 628 nm.
- Utilice un histograma que muestre los eventos en la puerta P1 y la detección del sustrato de caspasa (eje y) para determinar la intensidad media de fluorescencia (MFI).
Resultados
Los macrófagos primarios de ratón se diferenciaron durante 6 días. Después de 6 días, las células fueron cosechadas, contadas y sembradas. Se utilizaron los siguientes tratamientos: ningún tratamiento y Smac mimético (Compuesto A)22 a 250 nM y 500 nM durante 16 h (Figura 1). El experimento se realizó por duplicado para permitir que la activación de caspasa-3/caspasa-7 se evaluara mediante un ensayo basado en la población o un análisis de células individuales mediante citometría de flujo.
La concentración proteica de los lisados celulares se cuantificó mediante el ensayo BCA (Tabla suplementaria 1). Esto es necesario para garantizar que la cantidad de proteína utilizada en el ensayo de actividad de caspasa-3/caspasa-7 sea la misma entre las muestras. En este ensayo basado en la población, los datos se pueden presentar de dos maneras. El primero es mostrar la cinética trazando la fluorescencia ajustada (eje y) versus el tiempo (eje x) (Figura 2A). Alternativamente, la pendiente se puede calcular para comparar directamente las muestras (Figura 2B). El aumento en la pendiente sobre el tratamiento mimético Smac de 500 nM no fue significativo en base a un ANOVA unidireccional ordinario con comparaciones múltiples (prueba de comparación múltiple de Dunnett28).
Para el análisis de la actividad de caspasa-3/caspasa-7 mediante citometría de flujo, se recolectaron las células y el sobrenadante. Las células no teñidas o fluorescencia menos una se utilizaron como control negativo, así como las células no tratadas. Un histograma de las células recogidas por citometría de flujo mostró un cambio en la fluorescencia de las células tratadas con miméticos de Smac en comparación con las células no tratadas (Figura 2C). Los datos se pueden mostrar como intensidad de fluorescencia mediana (Figura 2D) o como un cambio de pliegue sobre las células no tratadas (Figura 2E).

Figura 1: Diagrama de flujo del estudio . (A) Se extirparon fémures y tibias de ratones C57Bl/6. Los huesos se enjuagaron y diferenciaron en 20 ng/mL M-CSF durante 6 días. (B) El día 6, los macrófagos fueron cosechados y resembrados para su tratamiento. Un conjunto de células se recolectó para lisados y se evaluó mediante actividad fluorogénica, mientras que el otro conjunto se recolectó, se incubó con el sustrato fluorogénico y se evaluó mediante citometría de flujo. Haga clic aquí para ver una versión más grande de esta figura.
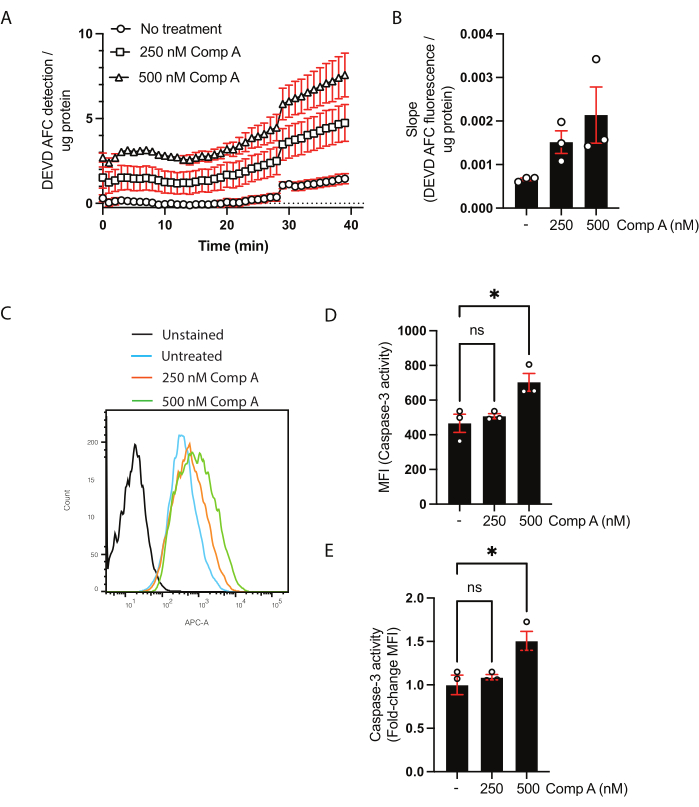
Figura 2: Ensayo cinético para la actividad de caspasa-3/caspasa-7 y escisión del sustrato por citometría de flujo. (A,B) Datos representativos del ensayo cinético para la actividad caspasa-3/caspasa-7 (C-E) y escisión del sustrato por citometría de flujo. Los macrófagos fueron tratados con dos concentraciones de Smac miméticos (Compuesto A; 250 nM y 500 nM) durante 16 h. (A) Detección del sustrato DEVD AFC escindido a lo largo del tiempo. Los datos se normalizaron a la concentración de proteína en la muestra. (B) La velocidad de escisión (pendiente) de DEVD AFC para cada muestra se normalizó a la pendiente no tratada y se presentó como el cambio de pliegue sobre las células no tratadas. (C) Histogramas citométricos de flujo de las células incubadas con el sustrato de caspasa-3. (D,E) Comparación de MFI y cambio de pliegue en la MFI en comparación con la muestra no tratada. Cada punto de datos representa una muestra independiente; se muestran la media ± error estándar de la media; *p < 0,05 usando un ANOVA unidireccional y pruebas de comparación múltiple (prueba de comparación múltiple de Dunnett). Haga clic aquí para ver una versión más grande de esta figura.
| Caspasa | Especie | Secuencia de sustrato | Dominios proteicos | ||
| Caspasa-1 | Hs, Mm | (A/L) EHD | CARD, dominio grande, dominio catalítico pequeño | ||
| Caspasa-2 | Hs, Mm | DEXD | CARD, dominio grande, dominio catalítico pequeño | ||
| Caspasa-4 | Hs | (A/L) EHD | CARD, dominio grande, dominio catalítico pequeño | ||
| Caspasa-5 | Hs | (A/L) EHD | CARD, dominio grande, dominio catalítico pequeño | ||
| Caspasa-9 | Hs, Mm | (I/V/L) E(H/T)D | CARD, dominio grande, dominio catalítico pequeño | ||
| Caspasa-11 | Milímetro | (A/L) EHD | CARD, dominio grande, dominio catalítico pequeño | ||
| Caspasa-12 | Milímetro | ATAD | CARD, dominio grande, dominio catalítico pequeño | ||
| Caspasa-8 | Hs, Mm | (I/V/L) E(H/T)D | DED, dominio grande, dominio catalítico pequeño | ||
| Caspasa-10 | Hs | (I/V/L) E(H/T)D | DED, dominio grande, dominio catalítico pequeño | ||
| Caspasa-3 | Hs, Mm | DEXD | Dominio grande, dominio catalítico pequeño | ||
| Caspasa-6 | Hs, Mm | (I/V/L) E(H/T)D | Dominio grande, dominio catalítico pequeño | ||
| Caspasa-7 | Hs, Mm | DEXD | Dominio grande, dominio catalítico pequeño | ||
| Caspasa-14 | HS, mm | (A/L) EHD | Dominio grande, dominio catalítico pequeño | ||
| TARJETA | Dominio de activación y reclutamiento de Caspasa | ||||
| DED | Dominio efector de muerte | ||||
| Hs | Homo sapien | ||||
| Milímetro | mus musculus | ||||
Tabla 1: Especificidad del sustrato y dominios proteicos de las caspasas. La tabla está adaptada de McStay et al.20; Shalini et al.3; y van Opdenbosch y Lamkanfi4.
Tabla complementaria 1: Análisis cinético de DEVD. Haga clic aquí para descargar esta tabla.
Discusión
En este método, se utiliza un sustrato fluorogénico en un ensayo poblacional o análisis unicelular para medir la actividad de la caspasa-3/caspasa-7. Ambos métodos miden la actividad de la caspasa de una manera cuantitativa basada en la escisión de un sustrato. Una ventaja es la capacidad de utilizar estos métodos para numerosas muestras. Con estos métodos, la actividad de caspasa-3/caspasa-7 se detecta en macrófagos primarios tratados con miméticos de Smac.
Un aspecto crítico del ensayo fluorométrico basado en la población es el tiempo desde la lisis hasta la lectura de la fluorescencia. Las muestras deben mantenerse en hielo durante todo el procedimiento, particularmente antes de "leer" el ensayo. Esto evita la escisión prematura y la fluorescencia del sustrato. Usando el ensayo basado en la población, es posible que se requiera menos optimización. La cantidad de proteína utilizada en el ensayo se normaliza, lo que permite comparar directamente las muestras. Una advertencia es que en una etapa tardía de la muerte celular apoptótica, la cantidad total de proteína se reduce; Por lo tanto, la detección de la actividad de la caspasa puede no ser posible. Se recomiendan diferentes cinéticas o diferentes dosis de tratamiento para evitar este problema. Además, se puede utilizar otro software para evaluar con precisión la tasa de actividad de la caspasa además del software descrito en este método.
Para el ensayo de citometría de flujo, se requieren suficientes eventos o células para bloquear a las poblaciones con confianza. Además, puede ser necesaria una mayor optimización en el ensayo basado en el flujo para lograr la relación óptima entre sustrato y número de células. Sin embargo, con la citometría de flujo, este método se presta para medir parámetros adicionales, como marcadores de superficie celular para la identificación del tipo de célula.
Tanto la población como los métodos unicelulares podrían usarse para otras caspasas. Sin embargo, es importante recordar que la secuencia de reconocimiento es menos discriminada para otras caspasas. Como tal, se deben utilizar otros métodos para la actividad de la caspasa. Esto incluye la inhibición de la actividad de las caspasas, CRISPR o derribo de caspasas específicas y western blot para detectar la escisión de sustratos conocidos.
Un método alternativo para detectar la actividad de la caspasa son las imágenes de lapso de tiempo. El mismo sustrato permeable de caspasa podría utilizarse junto con otros marcadores de viabilidad, como la anexina V, para proporcionar información sobre la cinética de la muerte celular. Las imágenes también separarían la actividad de la caspasa y la supervivencia celular, permitiendo la detección de cantidades subletales de actividad de caspasa en una población celular. Las funciones no letales de la caspasa-3/caspasa-7 están relacionadas a la regulación antiviral en las células inmunes innatas29, particularmente la activación del IFN tipo I a través de la liberación de ADN mitocondrial15,16. Por lo tanto, estos ensayos para medir la actividad de las caspasas son críticos para identificar diferentes modos de muerte celular y pueden ser útiles para evaluar las funciones de muerte no celular.
Divulgaciones
Los autores no tienen conflictos de intereses que revelar.
Agradecimientos
W.W.W. cuenta con el apoyo de la beca Clöetta Medical Research Fellow, S.R. cuenta con el apoyo de CanDoc UZH Forschungskredit y J.T. cuenta con el apoyo del Consejo Chino de Becas.
Materiales
| Name | Company | Catalog Number | Comments |
| 1.5 mL microfuge tubes | Sarstedt | 72.706.400 | |
| 15 cm Petri plates | Sarstedt | 82.1184.500 | |
| 37 degree incubator shaker | IKA shaker KS 4000i | 97014-816 | distributed by VWR |
| 6-well cell culture dish | Sarstedt | 83.392 | |
| 96 well flat bottom, white polystyrene, non-sterile | Sigma | CLS3600 | |
| 96 well flat plate | Sarstedt | 82.1581 | |
| Ac-DEVD-AFC | Enzo Life Sciences | ALX-260-032-M005 | Caspase-3 substrate |
| BD Fortessa | BD | any flow cytometer with the appropriate excitation and emission detector will work | |
| b-glycerolphosphate | Sigma | G9422-10G | |
| caspase-3 recombinant | Enzo Life Sciences | ALX-201-059-U025 | |
| CHAPS | Sigma | 1.11662 | |
| DMEM, low glucose, pyruvate | Thermoscientific | 31885023 | |
| DMSO | Sigma | D8418-250ML | |
| EDTA | Sigma | 03685-1KG | |
| EGTA | Sigma | 324626-25GM | |
| Etoposide | MedChem Express | HY-13629 | |
| FBS | Thermoscientific | 26140 | |
| Flow cytometry tubes | Falcon | 352008 | |
| Flowjo | Flowjo | A license in required but any program that can analyze .fcs files will suffice | |
| Glycerol | Sigma | G5516-500ML | |
| HEPES | Sigma | H4034 | |
| Magic Red caspase-3/7 assay kit; flow cytometry or imaging | Immunochemistry Technologies | 935 | |
| M-CSF | ebioscience | 14-8983-80 | now a subsidiary of Thermoscientific |
| M-Plex | Tecan | any fluorometric reader will work with the appropriate excitation and emission detectors | |
| NaCl | Roth | 3957.1 | |
| PBS pH 7.4 | Thermoscientific | 10010023 | |
| Penicillin-Streptomycin-Glutamine (100X) | Thermoscientific | 10378016 | |
| Pierce BCA Protein Assay Kit | ThermoFisher Scientific | 23225 | protein concentration assay |
| protease inhibitors | Biomol | P9070.100 | |
| Smac mimetic, Compound A | Tetralogics | also known as 12911; structure shown in supplementary figures of Vince et al., Cell 2007 | |
| Sodium Fluoride | Sigma | S7920-100G | |
| sodium orthovanadate | Sigma | S6508-10G | |
| sodium pyrophosphate | Sigma | P8010-500G | |
| Staurosporine | MedChem Express | HY-15141 | |
| sucrose | Sigma | 1.07687 | |
| Tris Base | Sigma | T1503-1KG | |
| Triton X100 | Sigma | T8787-50ML | |
| TrypLE | Thermoscientific | A1285901 | In the protocol, it is listed as Trypsin |
Referencias
- Ramirez, M. L. G., Salvesen, G. S. A primer on caspase mechanisms. Seminars in Cell and Developmental Biology. 82, 79-85 (2018).
- Nicholson, D. W., Thornberry, N. A. Caspases: Killer proteases. Trends in Biochemical Sciences. 22 (8), 299-306 (1997).
- Shalini, S., Dorstyn, L., Dawar, S., Kumar, S. Old, new and emerging functions of caspases. Cell Death and Differentiation. 22 (4), 526-539 (2014).
- Van Opdenbosch, N., Lamkanfi, M. Caspases in cell death, inflammation, and disease. Immunity. 50 (6), 1352-1364 (2019).
- Kesavardhana, S., Malireddi, R. K. S., Kanneganti, T. -. D. Caspases in cell death, inflammation, and pyroptosis. Annual Review of Immunology. 38, 567-595 (2020).
- Fu, T. -. M., et al. Cryo-EM structure of caspase-8 tandem DED filament reveals assembly and regulation mechanisms of the death-inducing signaling complex. Molecular Cell. 64 (2), 236-250 (2016).
- Jiang, X., Wang, X. Cytochrome c promotes caspase-9 activation by inducing nucleotide binding to Apaf-1. Journal of Biological Chemistry. 275 (40), 31199-31203 (2000).
- Christgen, S., Place, D. E., Kanneganti, T. -. D. Toward targeting inflammasomes: Insights into their regulation and activation. Cell Research. 30 (4), 315-327 (2020).
- Shi, J., et al. Cleavage of GSDMD by inflammatory caspases determines pyroptotic cell death. Nature. 526 (7575), 660-665 (2015).
- Sborgi, L., et al. GSDMD membrane pore formation constitutes the mechanism of pyroptotic cell death. EMBO Journal. 35 (16), 1766-1778 (2016).
- Rühl, S., et al. ESCRT-dependent membrane repair negatively regulates pyroptosis downstream of GSDMD activation. Science. 362 (6417), 956-960 (2018).
- Declercq, W., Takahashi, N., Vandenabeele, P. Dual face apoptotic machinery: From initiator of apoptosis to guardian of necroptosis. Immunity. 35 (4), 493-495 (2011).
- Newton, K., et al. Cleavage of RIPK1 by caspase-8 is crucial for limiting apoptosis and necroptosis. Nature. 574, 428-431 (2019).
- Fritsch, M., et al. Caspase-8 is the molecular switch for apoptosis, necroptosis and pyroptosis. Nature. 575, 683-687 (2019).
- White, M. J., et al. Apoptotic caspases suppress mtDNA-induced STING-mediated type I IFN production. Cell. 159 (7), 1549-1562 (2014).
- Rongvaux, A., et al. Apoptotic caspases prevent the induction of type I interferons by mitochondrial DNA. Cell. 159 (7), 1563-1577 (2014).
- Nakajima, Y. -. I., Kuranaga, E. Caspase-dependent non-apoptotic processes in development. Cell Death and Differentiation. 24, 1422-1430 (2017).
- Kumar, S., Dorstyn, L., Lim, Y. The role of caspases as executioners of apoptosis. Biochemical Society Transactions. 50 (1), 33-45 (2022).
- Agniswamy, J., Fang, B., Weber, I. T. Plasticity of S2-S4 specificity pockets of executioner caspase-7 revealed by structural and kinetic analysis. FEBS Journal. 274 (18), 4752-4765 (2007).
- McStay, G. P., Salvesen, G. S., Green, D. R. Overlapping cleavage motif selectivity of caspases: implications for analysis of apoptotic pathways. Cell Death and Differentiation. 15 (2), 322-331 (2008).
- Thornberry, N. A., et al. A combinatorial approach defines specificities of members of the caspase family and granzyme B. Functional relationships established for key mediators of apoptosis. Journal of Biological Chemistry. 272 (29), 17907-17911 (1997).
- Vince, J. E., et al. IAP antagonists target cIAP1 to induce TNFalpha-dependent apoptosis. Cell. 131 (4), 682-693 (2007).
- McComb, S., et al. cIAP1 and cIAP2 limit macrophage necroptosis by inhibiting Rip1 and Rip3 activation. Cell Death and Differentiation. 19 (11), 1791-1801 (2012).
- Wong, W. W. -. L., et al. cIAPs and XIAP regulate myelopoiesis through cytokine production in an RIPK1- and RIPK3-dependent manner. Blood. 123 (16), 2562-2572 (2014).
- Liu, X., Quan, N. Immune cell isolation from mouse femur bone marrow. Bio-Protocol. 5 (20), e1631 (2015).
- Lin, H., Chen, C., Chen, B. D. Resistance of bone marrow-derived macrophages to apoptosis is associated with the expression of X-linked inhibitor of apoptosis protein in primary cultures of bone marrow cells. Biochemical Journal. 353 (Pt 2), 299-306 (2001).
- . Caspase activity assay buffer. Cold Spring Harbor Protocols. , (2015).
- Mackridge, A., Rowe, P. One-way analysis of variance (ANOVA) - Including Dunnett's and Tukey's follow up tests. Practical Approach to Using Statistics in Health Research: From Planning to Reporting. , 93-103 (2018).
- Chen, H., Ning, X., Jiang, Z. Caspases control antiviral innate immunity. Cellular and Molecular Immunology. 14 (9), 736-747 (2017).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoExplorar más artículos
This article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados