Method Article
Измерение активности каспазы с помощью флуорометрического анализа или проточной цитометрии
В этой статье
Резюме
Настоящий протокол описывает два метода измерения активности каспазы через фторогенный субстрат с использованием проточной цитометрии или спектрофлуорометра.
Аннотация
Активация цистеиновых протеаз, известных как каспазы, остается важным процессом при множественных формах гибели клеток. Каспазы являются критическими инициаторами и палачами апоптоза, наиболее изученной формы запрограммированной гибели клеток. Апоптоз возникает во время процессов развития и является необходимым событием в тканевом гомеостазе. Пироптоз является еще одной формой гибели клеток, которая использует каспазы и является критическим процессом в активации иммунной системы путем активации инфламмасомы, что приводит к высвобождению членов семейства интерлейкина-1 (IL-1). Для оценки активности каспазы могут быть оценены целевые субстраты. Тем не менее, чувствительность может быть проблемой при исследовании отдельных клеток или низкоуровневой активности. Мы демонстрируем, как фторгенный субстрат может быть использован с популяционным анализом или одноклеточным анализом с помощью проточной цитометрии. При правильном контроле различные аминокислотные последовательности могут быть использованы для определения того, какие каспазы активны. С помощью этих анализов была выявлена одновременная потеря ингибиторов белков апоптоза при стимуляции фактора некроза опухоли (TNF), которая в первую очередь индуцирует апоптоз в макрофагах, а не другие формы гибели клеток.
Введение
Каспазы участвуют в нескольких формах запрограммированной гибели клеток. Апоптоз является наиболее изученной формой запрограммированной гибели клеток и связан с активностью каспазы1. Все каспазы обладают большой и малой каталитической субъединицей. Каспаза-1, каспаза-4, каспаза-5, каспаза-9 и каспаза-11 обладают доменом активации и рекрутирования каспазы (CARD), а каспаза-8 и каспаза-10 содержат эффекторные домены смерти (DED)2,3,4,5 (таблица 1). Апоптоз может быть инициирован двумя основными путями: внешним путем и внутренним путем. Внешний апоптотический путь запускается рецепторами смерти, которые являются частью суперсемейства фактора некроза опухоли (TNFSF). Рецепторы смерти обладают доменами DED, облегчающими активность каспазы-86. Внутренний апоптотический путь включает активацию каспазы-9 после образования апоптосомы, требующей высвобождения цитохрома c и Apaf-17. Активация либо инициатора каспазы, каспазы-8, либо каспазы-9, приводит к расщеплению и последующей активации каспаз палача, которыми являются каспаза-3, каспаза-6 и каспаза-7. Выявление того, что каспазы палача активны, указывает на то, что клетки подвергаются апоптозу, и эта активация считается важным фактором в определении режима гибели клеток.
Активация каспазы также является критическим моментом для регулирования воспаления и индукции альтернативных форм запрограммированной гибели клеток. Например, активация каспазы-1 приводит к созреванию провоспалительных цитокинов семейства интерлейкинов-18. Высвобождение и активация цитокинов из этого семейства, в частности IL-1β и IL-18, являются результатом расщепления гасдермина D и образования пор на плазматической мембране 9,10. Неадекватная мембранная репарация пор гасдермина D может привести к типу гибели клеток, известному как пироптоз11. Кроме того, активность каспазы-8 приводит к ингибированию казпазо-независимой гибели клеток, известной как некроптоз12. Рецептор-взаимодействующая серин/треонин протеинкиназа 1 (RIPK1) является одним из критических факторов в некроптозе и в управлении воспалением, регулируемым NF-kB. Модели показали, что RIPK1 расщепляется каспазой-8, что приводит к ограничению передачи сигналов NF-kB, апоптоза и некроптоза13,14. Таким образом, идентификация активности различных каспаз может помочь в понимании результирующей формы воспаления и гибели клеток.
Независимо от функции каспаз в регулировании модальностей гибели клеток, активность каспазы может также регулировать другие семейства цитокинов, такие как интерферон (IFN), в ответ на инфекцию15,16. Кроме того, каспазы участвуют в функциях неклеточной гибели, включая решения о судьбе клеток, восстановление и регенерацию тканей, опухолевый генез через репарацию ДНК и функцию нейронального синапса. Считается, что активность каспаз в этих нелетальных ролях ограничена клеточной локализацией и количеством каспаз. Таким образом, количественная оценка уровня активности каспазы вполне может определить, подвергается ли клетка гибели клеток или же каспаза играет роль в функции неклеточной гибели 4,17,18.
Активность каспазы может быть оценена несколькими методами. Вестерн-блоттинг для расщепленных каспаз и их субстратов использовался в качестве индикатора активности, но эти анализы в лучшем случае качественные. Чтобы определить, связана ли активность каспазы с гибелью клеток, идеально подходит количественное измерение. Поскольку каспазы расщепляют субстраты в месте распознавания, состоящем из четырех аминокислот, были разработаны колориметрические, люминесцентные или флуорометрические методы. Тем не менее, каспазы, по-видимому, имеют пластичность в распознавании подложки19,20. Последовательность распознавания не связана с белковыми доменами (табл. 1). Тетрапептидная последовательность DEVD, однако, может быть использована для обнаружения активности каспазы-3 и каспазы-7 20,21.
Миметики Smac представляют собой соединения, нацеленные на ингибиторы белков апоптоза (IAP). Использование миметиков Smac в подмножестве раковых клеток приводит к тому, что клетки становятся чувствительными к гибели клеток, индуцированной TNF22. В первичных макрофагах миметики Smac вызывают гибель клеток без экзогенного добавления TNF23,24. Потеря cIAP1 в результате деградации, вызванной миметикой Smac, приводит к образованию TNF. Если обнаружена активность каспазы, это означает, что клетки погибли не некроптозом, а апоптотическим способом. В этом методе обнаружение расщепленного СУБСТРАТА DEVD используется для идентификации активности каспазы-3/каспазы-7. Дальнейшие эксперименты по подтверждению апоптотической гибели клеток были опубликованы ранее24.
протокол
Настоящее исследование было проведено с одобрения и в соответствии с руководящими принципами комитета по этике животных Цюрихского университета (#ZH149/19). Для настоящего исследования использовались самцы мышей C57Bl/6J в возрасте 8-16 недель, выведенные и размещенные в специфических условиях без патогенов (SPF). Неповрежденные кости могут храниться на льду в стерильном буферном физиологическом растворе Хэнка (HBSS) с 2% термоинактивированной фетальной бычьей сывороткой (FBS). Костный мозг собирали из бедренной и большеберцовойкостей мыши 25 в день дифференцировки. Оба метода оценки активности каспазы могут быть использованы для других типов клеток, включая как первичные, так и трансформированные.
1. Дифференциация макрофагов, полученных из костного мозга (BMDM)
ПРИМЕЧАНИЕ: Выполните все шаги в ламинарной вытяжке культуры тканей и используйте стерильные асептические методы.
- Приготовьте шприц объемом 1 мл с иглой 21 г.
- Добавьте 5 мл HBSS + 2% FBS в пробирку объемом 15 мл.
- Используя стерильные щипцы, возьмите иссеченную бедренную кость и вставьте иглу в отверстие бедренной кости. Удерживая бедренную кость в HBSS + 2% FBS, вымывайте костный мозг до тех пор, пока кость не станет белой. Промывайте большеберцовую кость таким же образом. Продолжайте промывать раствор до получения одноклеточной суспензии.
- Центрифугируют одноэлементную суспензию при 200 х г в течение 4 мин при комнатной температуре (RT).
- Удалите супернатант с помощью вакуумного аспиратора. Постучите по тюбику, чтобы аккуратно повторно суспендировать гранулу. Добавьте 1 мл буфера лизиса красных клеток (см. Таблицу материалов) и аккуратно перемешайте с пипеткой P1000. Инкубировать в RT в течение 1 мин.
- Добавьте 10 мл HBSS + 2% FBS и центрифугу при 200 х г в течение 4 мин при RT.
- Удалите супернатант и повторно суспендируйте в 10 мл питательной среды макрофагов, полученных из костного мозга (BMDM).
ПРИМЕЧАНИЕ: Культуральная среда BMDM состоит из низкоглюкообразного DMEM с добавлением 10% FBS, 20 нг/мл M-CSF, пенициллина (50 ЕД/мл) и стрептомицина (50 мкг/мл) (см. Таблицу материалов). Альтернативно, 20% кондиционированная среда L929 может быть заменена M-CSF. - Добавьте 15 мл питательной среды BMDM в две чашки Петри по 15 см. Добавьте 5 мл одноэлементного раствора на каждую пластину.
ПРИМЕЧАНИЕ: Не используйте пластины, обработанные культурой тканей. Пластины, обработанные культурой тканей, ограничивают дифференцировку. - Поместите посуду при температуре 37 °C, 5% CO2, на 6 дней.
ПРИМЕЧАНИЕ: БМДМ могут быть собраны через 5-7 дней. Более длительное время инкубации для дифференцировки приводит к увеличению экспрессии антиапоптотического белка26.
2. Сбор, посев и обработка клеток
ПРИМЕЧАНИЕ: Выполните все шаги в ламинарной вытяжке культуры тканей и используйте стерильные асептические методы. Полностью дифференцированные макрофаги прилипают к пластине, что позволяет легко разделять, в то время как плавающие клетки могут быть отброшены. Фосфат-буферный физиологический раствор (PBS) можно использовать с Ca2+ и Mg2+ или без них.
- После 6 дней инкубации удалите плавающие клетки и среду с пластины с помощью аспиратора.
- Добавьте 5 мл PBS на каждую пластину размером 15 см. Снимите PBS с пластины с помощью аспиратора.
- Добавьте 2 мл трипсина (см. Таблицу материалов) на каждую пластину. Инкубируйте пластину до тех пор, пока мягкое постукивание по пластине не вытеснит клетки. Возьмите 5 мл BMDM питательной среды и соберите клетки с тарелки.
- Переложите на вторую 15-сантиметровую пластину и соберите клетки с тарелки. Извлеките клеточную суспензию из пластины в пробирку объемом 50 мл. Возьмите дополнительно 5 мл питательной среды BMDM и промыте обе пластины, чтобы убедиться, что все клетки собраны. Поместите клеточную суспензию в ту же пробирку объемом 50 мл.
- Возьмите 10 мкл клеточной суспензии и подсчитайте с помощью гемацитометра, используя разведение 1:1 с трипан-синим.
ПРИМЕЧАНИЕ: Автоматические счетчики клеток также могут использоваться при калибровке по размеру макрофагов. - Засейте макрофаги плотностью 1 х 106 клеток/мл. БМДМ, посеянные в 2 x 106 клеток/лунку в 6-луночной пластине, обеспечивают приблизительно 2 мг/мл общего белка. Дайте клеткам прилипнуть к пластине минимум за 6 ч до начала лечения.
ПРИМЕЧАНИЕ: Для других типов клеток должна быть определена оптимальная концентрация. - Обрабатывайте макрофаги миметикой Smac (соединение А, см. Таблицу материалов)22 при 250 нМ и 500 нМ в течение 16 ч.
ПРИМЕЧАНИЕ: Включите положительный контроль, чтобы вызвать апоптоз и расщепление каспазы-3, чтобы убедиться, что анализ работает. Общие индукторы апоптоза включают ставроспорин и этопозид. Для того, чтобы многие клеточные линии подверглись апоптозу, достаточно 0,1-10 мкМ в течение 16 ч стимуляции.
3. Получение клеточных лизатов из обработанных клеток
ПРИМЕЧАНИЕ: Этот шаг должен быть сделан на льду, а реагенты и материалы должны быть предварительно охлаждены.
- Переложите пластины, содержащие обработанные клетки, на лед. Соберите среду из клеточной культуры в пробирку объемом 1,5 мл, центрифугу при 300 х г в течение 5 мин при 4 °C, аспирируйте среду и положите трубку на лед. Это позволяет собирать ячейки, которые отделились от пластины.
- Добавьте 1 мл холодного PBS в пластину для посева клеток для промывки клеток и аспирируйте весь PBS. Добавьте в клетки 100 мкл трипсина (при работе с 6-луночной посудой). Позвольте трипсину поднять клетки с пластины и собрать их в трубку объемом 1,5 мл. Используйте 1 мл холодного PBS, чтобы убедиться, что все клетки были собраны.
ПРИМЕЧАНИЕ: При работе с суспензионными клетками осторожно перенесите среду и клетки в трубку объемом 1,5 мл. - Центрифугировать ячейки при 300 х г в течение 5 мин при 4 °C. Удаляют супернатант и повторно суспендируют в буфере лизиса DISC 100 мкл (150 мМ натрия хлорида, 2 мМ ЭДТА, 1% тритона X-100, 10% глицерина, 20 мМ Tris, рН 7,5, см. Таблицу материалов).
- Инкубировать образцы на льду в течение 20 мин.
- Центрифугируйте лизаты при ~12 000 х г в течение 10 мин при 4 °C, чтобы гранулировать нерастворимую фракцию.
- Перенесите 25 мкл лизата в белую плоскодонную 96-луночную пластину для анализа активности каспазы-3/каспазы-7 (этап 5).
ПРИМЕЧАНИЕ: Не беспокойте гранулы. Это нерастворимая фракция лизата клетки. - Перенесите 10 мкл оставшегося лизата в прозрачную плоскодонную 96-луночную пластину для анализа бицинхониновой кислоты (BCA) (стадия 4). Это будет использовано для нормализации образцов.
- Держите обе пластины на льду для дальнейшей обработки.
ПРИМЕЧАНИЕ: На этом этапе пластины могут быть запечатаны клеевой крышкой и храниться при температуре −20 °C в течение примерно 4 недель.
4. Количественная оценка белка с использованием анализа BCA
ПРИМЕЧАНИЕ: Другие реагенты или анализы могут быть использованы для количественной оценки количества белка в каждом образце. В популяционном анализе образцы можно сравнить, нормализовав количество белка, используемого в анализе.
- Приготовьте стандартные концентрации белка от 0 мкг/мл до 2 000 мкг/мл (0 мкг/мл, 25 мкг/мл, 125 мкг/мл, 250 мкг/мл, 500 мкг/мл, 750 мкг/мл, 100 мкг/мл, 1 500 мкг/мл, 2 000 мкг/мл) с бычьим сывороточным альбумином (BSA). Подготовьте заготовки только с буфером лизиса.
- Добавить 10 мкл каждого стандарта в плоскодонную 96-луночную пластину, содержащую образцы, упомянутые на этапе 3.7.
- Смешайте реагент BCA 1 с реагентом BCA 2 в соотношении 50:1 (см. Таблицу материалов). Добавьте 200 мкл смешанного реагента BCA к каждому образцу и стандарту.
- Инкубировать при 37 °C в течение 30 мин.
- Измерьте поглощение при 562 нм на флуорометрическом приборе и количественно оцените концентрацию белка с помощью стандартной кривой.
5. Популяционный анализ активности каспазы-3/каспазы-7
ПРИМЕЧАНИЕ: Не позволяйте лизатам клеток в пластине сидеть на льду более 3 ч. Если активность каспазы присутствует, она увеличивается с течением времени, несмотря на то, что образец находится на льду. Если образцы были заморожены, разморозьте их на льду и немедленно приступайте к работе, как только лизаты оттаяли.
- Запустите флуорометрический прибор (см. Таблицу материалов) и нагрейте машину до 37 °C. Подготовьте сценарий, как уже упоминалось:
- Выполняйте индивидуальные показания каждую минуту в течение 40 минут, чтобы определить кинетику реакции.
- Установите возбуждение на 360 нм и излучение на 465 нм. Достаточно десяти вспышек на лунку.
- Получают положительный контроль рекомбинантной каспазы-3 (см. Таблицу материалов). Смешать 1 ЕД рекомбинантного фермента каспазы-3 в 50 мкл лизисного буфера (пробирка 1). Добавьте 25 мкл лизисного буфера в дополнительные три пробирки. Переведите 25 мкл из пробирки 1 в пробирку 2. Перемешать путем пипетки.
- Повторите для трубки 3 и трубки 4. Трубка 5 будет содержать только 50 мкл лизисного буфера. Добавьте 25 мкл каждого стандарта в белую плоскодонную 96-луночную пластину для анализа активности каспазы-3, упомянутого на этапе 3.6.
- Приготовьте мастер-реакционную смесь для анализа активности каспазы на льду. Для одной реакции смешайте 50 мкл 2x буфера расщепления каспазы (0,2M HEPES pH 7,5; 20% сахарозы или PEG; 0,2% CHAPS), 5 мкл 1 мМ DEVD-AMC (субстрат тетрапептида каспазы-3), 2 мкл 500 мМ DTT и 18 мкл деионизированной воды (см. Таблицу материалов).
- Добавляют 75 мкл реакционной смеси к каждому образцу и стандарту для получения общего реакционного объема 100 мкл.
- Немедленно измерьте флуоресценцию с помощью флуорометрического прибора, установленного на шаге 5.1.
- Для каждого флуоресцентного измерения вычтите показания флуоресценции для заготовки (только буфер лизиса) из флуоресценции образца. Нормализовать показания путем деления на концентрацию белка образца (рассчитывается на этапе 4.5)27:
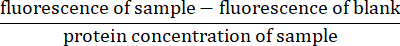
- Рассчитайте скорость активности каспазы путем определения наклона нормализованной флуоресценции по оси Y и времени по оси X.
6. Одноклеточный анализ (анализ проточной цитометрии) на активность каспазы-3/каспазы-7
- Засейте клетки, как описано в разделе 2.
- Соберите ячейки в полистирольную трубку объемом 5 мл. При работе с адгезивными клетками соберите среду в трубку объемом 5 мл. Добавьте 1 мл холодного PBS в пластину клеточной культуры и соберите PBS в пробирку объемом 5 мл. Добавьте в клетки трипсин (100 мкл при работе с 6-луночными блюдами). Позвольте трипсину поднять клетки с пластины и собрать в трубку объемом 5 мл. Используйте 1 мл холодного PBS, чтобы убедиться, что все клетки были собраны.
ПРИМЕЧАНИЕ: При работе с суспензионными клетками осторожно перенесите среду и клетки в трубку объемом 5 мл. - Центрифугирование образцов при 300 х г в течение 5 мин, 4 °C. Удалите супернатант с помощью вакуумного аспиратора.
- Приготовьте окрашивающую смесь. Оптимальная концентрация окрашивания составляет 1 х 106-2 х 106 клеток в 50 мкл. Разбавляют фторогенный субстрат в соответствии с инструкциями производителя (см. Таблицу материалов, проточную цитометрию). Взять 1 мкл запасного субстрата и развести в 150 мкл PBS. Добавьте 50 мкЛ на образец.
- Инкубируйте образцы при 37 °C в течение 30 мин, защищенных от света, с перемешиванием каждые 15 мин.
- С проточным цитометром, используемым в этом исследовании, используйте красный лазер на 640 нм и обнаруживайте, используя 675/25 нм. Сначала запустите неиспорченную контрольную выборку и получите не менее 10 000 событий нужной популяции. Исключите мусор с помощью затвора (P1) на точечном графике FSC-A и SSC-A.
- Используйте гистограмму, отображающую события в затворе P1 и обнаружение для подложки каспазы (ось Y), чтобы определить среднюю интенсивность флуоресценции (MFI).
ПРИМЕЧАНИЕ: Каспазная подложка, описанная в данном способе, требует возбуждения при 590 нм и испускает при 628 нм.
- Используйте гистограмму, отображающую события в затворе P1 и обнаружение для подложки каспазы (ось Y), чтобы определить среднюю интенсивность флуоресценции (MFI).
Результаты
Первичные мышиные макрофаги дифференцировали в течение 6 дней. Через 6 дней клетки собирали, подсчитывали и сеяли. Использовались следующие методы лечения: без лечения и миметика Smac (соединение A)22 при 250 нМ и 500 нМ в течение 16 ч (рисунок 1). Эксперимент проводили в двух экземплярах, чтобы можно было оценить активацию каспазы-3/каспазы-7 либо с помощью популяционного анализа, либо с помощью одноклеточного анализа с использованием проточной цитометрии.
Концентрация белка в клеточных лизатах была количественно определена с использованием анализа BCA (дополнительная таблица 1). Это необходимо для обеспечения того, чтобы количество белка, используемого в анализе активности каспазы-3/каспазы-7, было одинаковым между образцами. В этом популяционном анализе данные могут быть представлены двумя способами. Первый заключается в том, чтобы показать кинетику путем построения скорректированной флуоресценции (ось Y) по отношению ко времени (ось x) (рисунок 2A). В качестве альтернативы, наклон может быть рассчитан для непосредственного сравнения образцов (рисунок 2B). Увеличение уклона при 500 нМ миметической обработки Smac не было значительным на основе обычной односторонней ANOVA с несколькими сравнениями (множественный сравнительный тест Даннетта28).
Для анализа активности каспазы-3/каспазы-7 с помощью проточной цитометрии собирали клетки и надводный веществ. В качестве отрицательного контроля использовали неокрашенные клетки или флуоресценцию минус один, а также необработанные клетки. Гистограмма клеток, собранных с помощью проточной цитометрии, показала сдвиг флуоресценции для клеток, обработанных миметиками Smac, по сравнению с необработанными клетками (рисунок 2C). Данные могут быть показаны либо как средняя интенсивность флуоресценции (рисунок 2D), либо как изменение складки над необработанными клетками (рисунок 2E).

Рисунок 1: Блок-схема исследования. (A) Бедренные и большеберцовые кости были вырезаны у мышей C57Bl/6. Кости были промыты и дифференцированы в 20 нг/мл M-CSF в течение 6 дней. (B) На 6-й день макрофаги были собраны и пересеяны для лечения. Один набор клеток собирали для лизатов и оценивали по фторогенной активности, в то время как другой набор собирали, инкубировали с фторогенным субстратом и оценивали с помощью проточной цитометрии. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
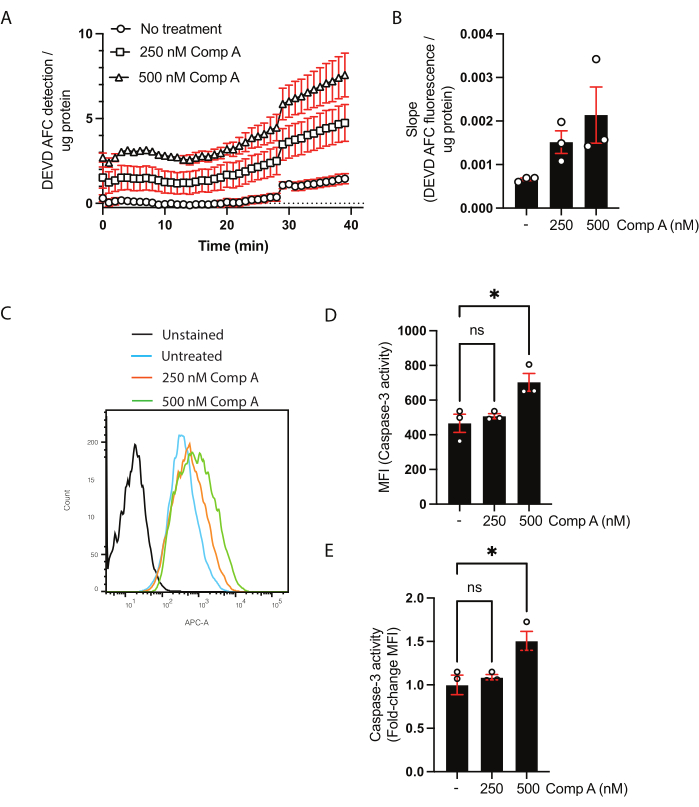
Рисунок 2: Кинетический анализ активности каспазы-3/каспазы-7 и расщепления субстрата методом проточной цитометрии. (A,B) Репрезентативные данные кинетического анализа активности каспазы-3/каспазы-7 (C-E) и расщепления субстрата методом проточной цитометрии. Макрофаги обрабатывали двумя концентрациями миметика Smac (соединение A; 250 нМ и 500 нМ) в течение 16 ч. (A) Обнаружение расщепленного СУБСТРАТа DEVD AFC с течением времени. Данные были нормализованы до концентрации белка в образце. (B) Скорость расщепления (наклона) DEVD AFC для каждого образца была нормализована до необработанного наклона и представлена как изменение складки над необработанными клетками. (C) Проточные цитометрические гистограммы клеток, инкубированных с субстратом каспазы-3. (Д,Д) Сравнение МФО и изменение складок в МФО по сравнению с необработанным образцом. Каждая точка данных представляет собой независимую выборку; показаны средние ± стандартной погрешности среднего значения; *p < 0,05 с использованием одностороннего ANOVA и нескольких сравнительных тестов (множественный сравнительный тест Даннетта). Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
| Каспаза | Вид | Последовательность подложки | Белковые домены | ||
| Каспаза-1 | Hs, Мм | (Ш/Л) ЭХД | CARD, большой домен, малый каталитический домен | ||
| Каспаза-2 | Hs, Мм | ДЕКСД | CARD, большой домен, малый каталитический домен | ||
| Каспаза-4 | Хс | (Ш/Л) ЭХД | CARD, большой домен, малый каталитический домен | ||
| Каспаза-5 | Хс | (Ш/Л) ЭХД | CARD, большой домен, малый каталитический домен | ||
| Каспаза-9 | Hs, Мм | (I/V/L) E(H/T)D | CARD, большой домен, малый каталитический домен | ||
| Каспаза-11 | Миллиметр | (Ш/Л) ЭХД | CARD, большой домен, малый каталитический домен | ||
| Каспаза-12 | Миллиметр | АВАД | CARD, большой домен, малый каталитический домен | ||
| Каспаза-8 | Hs, Мм | (I/V/L) E(H/T)D | DED, большой домен, малый каталитический домен | ||
| Каспаза-10 | Хс | (I/V/L) E(H/T)D | DED, большой домен, малый каталитический домен | ||
| Каспаза-3 | Hs, Мм | ДЕКСД | большой домен, малый каталитический домен | ||
| Каспаза-6 | Hs, Мм | (I/V/L) E(H/T)D | большой домен, малый каталитический домен | ||
| Каспаза-7 | Hs, Мм | ДЕКСД | большой домен, малый каталитический домен | ||
| каспаза-14 | чс, мм | (Ш/Л) ЭХД | большой домен, малый каталитический домен | ||
| КАРТОЧКА | Домен активации и вербовки каспазы | ||||
| ДЭД | домен эффектора смерти | ||||
| Хс | homo sapien | ||||
| Миллиметр | мускулатурный | ||||
Таблица 1: Субстратная специфичность и белковые домены каспаз. Таблица адаптирована из McStay et al.20; Шалини и др.3; и ван Опденбош и Ламканфи4.
Дополнительная таблица 1: Кинетический анализ DEVD. Пожалуйста, нажмите здесь, чтобы загрузить эту таблицу.
Обсуждение
В этом методе фторогенный субстрат используется в популяционном анализе или одноклеточном анализе для измерения активности каспазы-3/каспазы-7. Оба метода количественно измеряют активность каспазы на основе расщепления субстрата. Одним из преимуществ является возможность использования этих методов для многочисленных образцов. С помощью этих методов активность каспазы-3/каспазы-7 обнаруживается в первичных макрофагах, обработанных миметиками Smac.
Критическим аспектом популяционного флуорометрического анализа является время от лизиса до считывания флуоресценции. Образцы должны храниться на льду на протяжении всей процедуры, особенно перед «чтением» анализа. Это предотвращает преждевременное расщепление и флуоресценцию субстрата. При использовании популяционного анализа может потребоваться меньшая оптимизация. Количество белка, используемого в анализе, нормализуется, что позволяет напрямую сравнивать образцы. Одно из предостережений заключается в том, что на поздней стадии апоптотической гибели клеток общее количество белка уменьшается; следовательно, обнаружение активности каспазы может быть невозможным. Для обхода этой проблемы рекомендуется разная кинетика или разные дозы лечения. Кроме того, для точной оценки скорости активности каспазы может использоваться другое программное обеспечение, помимо программного обеспечения, описанного в этом методе.
Для цитометрического анализа потока требуется достаточно событий или клеток, чтобы уверенно охватить популяции. Кроме того, для достижения оптимального соотношения количества субстрата и количества ячеек может потребоваться дополнительная оптимизация в анализе на основе потока. Однако при проточной цитометрии этот метод позволяет измерять дополнительные параметры, такие как маркеры поверхности клеток для идентификации типа клеток.
Как популяционный, так и одноклеточный методы могут быть использованы для других каспаз. Однако важно помнить, что последовательность распознавания менее дискриминируется для других каспаз. Таким образом, должны использоваться другие методы активности каспазы. Это включает в себя ингибирование активности каспазы, CRISPR или сбивание конкретных каспаз и западное блоттинг для обнаружения расщепления известных субстратов.
Одним из альтернативных методов обнаружения активности каспазы является покадровая визуализация. Тот же проницаемый подложек каспазы может быть использован вместе с другими маркерами жизнеспособности, такими как аннексин V, для предоставления информации о кинетике гибели клеток. Визуализация также будет разделять активность каспазы и выживаемость клеток, что позволяет обнаруживать сублетальные количества активности каспазы в клеточной популяции. Нелетальные функции каспазы-3/каспазы-7 связаны с противовирусной регуляцией во врожденных иммунных клетках29, в частности с активацией ИФН типа I через высвобождение митохондриальной ДНК15,16. Таким образом, эти анализы для измерения активности каспазы имеют решающее значение для выявления различных режимов гибели клеток и могут быть полезны при оценке функций неклеточной гибели.
Раскрытие информации
У авторов нет конфликта интересов для раскрытия.
Благодарности
W.W.W. поддерживается грантом Clöetta Medical Research Fellow, S.R. поддерживается CanDoc UZH Forschungskredit, а J.T. поддерживается Китайским советом по стипендиям.
Материалы
| Name | Company | Catalog Number | Comments |
| 1.5 mL microfuge tubes | Sarstedt | 72.706.400 | |
| 15 cm Petri plates | Sarstedt | 82.1184.500 | |
| 37 degree incubator shaker | IKA shaker KS 4000i | 97014-816 | distributed by VWR |
| 6-well cell culture dish | Sarstedt | 83.392 | |
| 96 well flat bottom, white polystyrene, non-sterile | Sigma | CLS3600 | |
| 96 well flat plate | Sarstedt | 82.1581 | |
| Ac-DEVD-AFC | Enzo Life Sciences | ALX-260-032-M005 | Caspase-3 substrate |
| BD Fortessa | BD | any flow cytometer with the appropriate excitation and emission detector will work | |
| b-glycerolphosphate | Sigma | G9422-10G | |
| caspase-3 recombinant | Enzo Life Sciences | ALX-201-059-U025 | |
| CHAPS | Sigma | 1.11662 | |
| DMEM, low glucose, pyruvate | Thermoscientific | 31885023 | |
| DMSO | Sigma | D8418-250ML | |
| EDTA | Sigma | 03685-1KG | |
| EGTA | Sigma | 324626-25GM | |
| Etoposide | MedChem Express | HY-13629 | |
| FBS | Thermoscientific | 26140 | |
| Flow cytometry tubes | Falcon | 352008 | |
| Flowjo | Flowjo | A license in required but any program that can analyze .fcs files will suffice | |
| Glycerol | Sigma | G5516-500ML | |
| HEPES | Sigma | H4034 | |
| Magic Red caspase-3/7 assay kit; flow cytometry or imaging | Immunochemistry Technologies | 935 | |
| M-CSF | ebioscience | 14-8983-80 | now a subsidiary of Thermoscientific |
| M-Plex | Tecan | any fluorometric reader will work with the appropriate excitation and emission detectors | |
| NaCl | Roth | 3957.1 | |
| PBS pH 7.4 | Thermoscientific | 10010023 | |
| Penicillin-Streptomycin-Glutamine (100X) | Thermoscientific | 10378016 | |
| Pierce BCA Protein Assay Kit | ThermoFisher Scientific | 23225 | protein concentration assay |
| protease inhibitors | Biomol | P9070.100 | |
| Smac mimetic, Compound A | Tetralogics | also known as 12911; structure shown in supplementary figures of Vince et al., Cell 2007 | |
| Sodium Fluoride | Sigma | S7920-100G | |
| sodium orthovanadate | Sigma | S6508-10G | |
| sodium pyrophosphate | Sigma | P8010-500G | |
| Staurosporine | MedChem Express | HY-15141 | |
| sucrose | Sigma | 1.07687 | |
| Tris Base | Sigma | T1503-1KG | |
| Triton X100 | Sigma | T8787-50ML | |
| TrypLE | Thermoscientific | A1285901 | In the protocol, it is listed as Trypsin |
Ссылки
- Ramirez, M. L. G., Salvesen, G. S. A primer on caspase mechanisms. Seminars in Cell and Developmental Biology. 82, 79-85 (2018).
- Nicholson, D. W., Thornberry, N. A. Caspases: Killer proteases. Trends in Biochemical Sciences. 22 (8), 299-306 (1997).
- Shalini, S., Dorstyn, L., Dawar, S., Kumar, S. Old, new and emerging functions of caspases. Cell Death and Differentiation. 22 (4), 526-539 (2014).
- Van Opdenbosch, N., Lamkanfi, M. Caspases in cell death, inflammation, and disease. Immunity. 50 (6), 1352-1364 (2019).
- Kesavardhana, S., Malireddi, R. K. S., Kanneganti, T. -. D. Caspases in cell death, inflammation, and pyroptosis. Annual Review of Immunology. 38, 567-595 (2020).
- Fu, T. -. M., et al. Cryo-EM structure of caspase-8 tandem DED filament reveals assembly and regulation mechanisms of the death-inducing signaling complex. Molecular Cell. 64 (2), 236-250 (2016).
- Jiang, X., Wang, X. Cytochrome c promotes caspase-9 activation by inducing nucleotide binding to Apaf-1. Journal of Biological Chemistry. 275 (40), 31199-31203 (2000).
- Christgen, S., Place, D. E., Kanneganti, T. -. D. Toward targeting inflammasomes: Insights into their regulation and activation. Cell Research. 30 (4), 315-327 (2020).
- Shi, J., et al. Cleavage of GSDMD by inflammatory caspases determines pyroptotic cell death. Nature. 526 (7575), 660-665 (2015).
- Sborgi, L., et al. GSDMD membrane pore formation constitutes the mechanism of pyroptotic cell death. EMBO Journal. 35 (16), 1766-1778 (2016).
- Rühl, S., et al. ESCRT-dependent membrane repair negatively regulates pyroptosis downstream of GSDMD activation. Science. 362 (6417), 956-960 (2018).
- Declercq, W., Takahashi, N., Vandenabeele, P. Dual face apoptotic machinery: From initiator of apoptosis to guardian of necroptosis. Immunity. 35 (4), 493-495 (2011).
- Newton, K., et al. Cleavage of RIPK1 by caspase-8 is crucial for limiting apoptosis and necroptosis. Nature. 574, 428-431 (2019).
- Fritsch, M., et al. Caspase-8 is the molecular switch for apoptosis, necroptosis and pyroptosis. Nature. 575, 683-687 (2019).
- White, M. J., et al. Apoptotic caspases suppress mtDNA-induced STING-mediated type I IFN production. Cell. 159 (7), 1549-1562 (2014).
- Rongvaux, A., et al. Apoptotic caspases prevent the induction of type I interferons by mitochondrial DNA. Cell. 159 (7), 1563-1577 (2014).
- Nakajima, Y. -. I., Kuranaga, E. Caspase-dependent non-apoptotic processes in development. Cell Death and Differentiation. 24, 1422-1430 (2017).
- Kumar, S., Dorstyn, L., Lim, Y. The role of caspases as executioners of apoptosis. Biochemical Society Transactions. 50 (1), 33-45 (2022).
- Agniswamy, J., Fang, B., Weber, I. T. Plasticity of S2-S4 specificity pockets of executioner caspase-7 revealed by structural and kinetic analysis. FEBS Journal. 274 (18), 4752-4765 (2007).
- McStay, G. P., Salvesen, G. S., Green, D. R. Overlapping cleavage motif selectivity of caspases: implications for analysis of apoptotic pathways. Cell Death and Differentiation. 15 (2), 322-331 (2008).
- Thornberry, N. A., et al. A combinatorial approach defines specificities of members of the caspase family and granzyme B. Functional relationships established for key mediators of apoptosis. Journal of Biological Chemistry. 272 (29), 17907-17911 (1997).
- Vince, J. E., et al. IAP antagonists target cIAP1 to induce TNFalpha-dependent apoptosis. Cell. 131 (4), 682-693 (2007).
- McComb, S., et al. cIAP1 and cIAP2 limit macrophage necroptosis by inhibiting Rip1 and Rip3 activation. Cell Death and Differentiation. 19 (11), 1791-1801 (2012).
- Wong, W. W. -. L., et al. cIAPs and XIAP regulate myelopoiesis through cytokine production in an RIPK1- and RIPK3-dependent manner. Blood. 123 (16), 2562-2572 (2014).
- Liu, X., Quan, N. Immune cell isolation from mouse femur bone marrow. Bio-Protocol. 5 (20), e1631 (2015).
- Lin, H., Chen, C., Chen, B. D. Resistance of bone marrow-derived macrophages to apoptosis is associated with the expression of X-linked inhibitor of apoptosis protein in primary cultures of bone marrow cells. Biochemical Journal. 353 (Pt 2), 299-306 (2001).
- . Caspase activity assay buffer. Cold Spring Harbor Protocols. , (2015).
- Mackridge, A., Rowe, P. One-way analysis of variance (ANOVA) - Including Dunnett's and Tukey's follow up tests. Practical Approach to Using Statistics in Health Research: From Planning to Reporting. , 93-103 (2018).
- Chen, H., Ning, X., Jiang, Z. Caspases control antiviral innate immunity. Cellular and Molecular Immunology. 14 (9), 736-747 (2017).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеСмотреть дополнительные статьи
This article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены