Method Article
Mesure de l’activité des caspases à l’aide d’un dosage fluorométrique ou d’une cytométrie en flux
Dans cet article
Résumé
Le présent protocole décrit deux méthodes pour mesurer l’activité des caspases à travers un substrat fluorogénique à l’aide de la cytométrie en flux ou d’un spectrofluoromètre.
Résumé
L’activation des protéases de cystéine, connues sous le nom de caspases, reste un processus important dans de multiples formes de mort cellulaire. Les caspases sont des initiateurs et des bourreaux critiques de l’apoptose, la forme la plus étudiée de mort cellulaire programmée. L’apoptose survient au cours des processus de développement et est un événement nécessaire dans l’homéostasie tissulaire. La pyroptose est une autre forme de mort cellulaire qui utilise des caspases et est un processus essentiel dans l’activation du système immunitaire par l’activation de l’inflammasome, ce qui entraîne la libération de membres de la famille de l’interleukine-1 (IL-1). Pour évaluer l’activité des caspases, les substrats cibles peuvent être évalués. Cependant, la sensibilité peut être un problème lors de l’examen de cellules individuelles ou d’une activité de faible niveau. Nous démontrons comment un substrat fluorogénique peut être utilisé avec un test basé sur la population ou un test unicellulaire par cytométrie en flux. Avec des contrôles appropriés, différentes séquences d’acides aminés peuvent être utilisées pour identifier quelles caspases sont actives. En utilisant ces tests, la perte simultanée des inhibiteurs des protéines d’apoptose lors de la stimulation du facteur de nécrose tumorale (TNF) a été identifiée, ce qui induit principalement l’apoptose dans les macrophages plutôt que d’autres formes de mort cellulaire.
Introduction
Les caspases sont impliquées dans plusieurs formes de mort cellulaire programmée. L’apoptose est la forme la plus étudiée de mort cellulaire programmée et est associée à l’activité de la caspase1. Toutes les caspases possèdent une sous-unité catalytique grande et petite. La caspase-1, la caspase-4, la caspase-5, la caspase-9 et la caspase-11 possèdent un domaine d’activation et de recrutement des caspases (CARD), et les caspases-8 et les caspases-10 contiennent des domaines effecteurs de mort (DED)2,3,4,5 (tableau 1). L’apoptose peut être initiée par deux voies principales: la voie extrinsèque et la voie intrinsèque. La voie apoptotique extrinsèque est déclenchée par les récepteurs de mort, qui font partie de la superfamille des facteurs de nécrose tumorale (TNFSF). Les récepteurs de la mort possèdent des domaines DED, facilitant l’activité de la caspase-86. La voie apoptotique intrinsèque implique l’activation de la caspase-9 après la formation de l’apoptosome, nécessitant la libération du cytochrome c et de l’Apaf-17. L’activation de l’une ou l’autre caspase initiatrice, la caspase-8 ou la caspase-9, conduit au clivage et à l’activation ultérieure des caspases bourreaux, qui sont la caspase-3, la caspase-6 et la caspase-7. Identifier que les caspases bourreaux sont actives indique que les cellules subissent une apoptose, et cette activation est considérée comme un facteur important dans la définition du mode de mort cellulaire.
L’activation des caspases est également un moment critique pour la régulation de l’inflammation et l’induction de formes alternatives de mort cellulaire programmée. Par exemple, l’activation de la caspase-1 conduit à la maturation des cytokines pro-inflammatoires de la famille de l’interleukine-18. La libération et l’activation des cytokines de cette famille, en particulier l’IL-1β et l’IL-18, résultent du clivage de la gasdermine D et de la formation de pores au niveau de la membrane plasmique 9,10. Une réparation membranaire inadéquate des pores de la gasdermine D peut entraîner un type de mort cellulaire connu sous le nom de pyroptose11. De plus, l’activité de la caspase-8 entraîne l’inhibition d’une mort cellulaire indépendante de la caspase connue sous le nom de nécroptose12. La protéine kinase 1 sérine/thréonine interagissant avec les récepteurs (RIPK1) est l’un des facteurs critiques de la nécroptose et de l’inflammation régulée par NF-kB. Les modèles ont montré que RIPK1 est clivé par la caspase-8, ce qui limite la signalisation NF-kB, l’apoptose et la nécroptose13,14. Par conséquent, l’identification de l’activité des différentes caspases peut aider à comprendre l’inflammation résultante et la modalité de mort cellulaire.
Indépendamment de la fonction des caspases dans la régulation des modalités de mort cellulaire, l’activité des caspases peut également réguler d’autres familles de cytokines, telles que l’interféron (IFN), en réponse à une infection15,16. De plus, les caspases sont impliquées dans les fonctions de mort non cellulaire, y compris les décisions de devenir cellulaire, la réparation et la régénération des tissus, la tumorigenèse par la réparation de l’ADN et la fonction des synapses neuronales. On pense que l’activité des caspases dans ces rôles non létaux est limitée par la localisation cellulaire et la quantité de caspases. Par conséquent, la quantification du niveau d’activité des caspases pourrait bien définir si une cellule subit la mort cellulaire ou si la caspase joue un rôle dans une fonction de mort non cellulaire 4,17,18.
L’activité des caspases peut être évaluée par plusieurs méthodes. Le transfert Western pour les caspases clivées et leurs substrats a été utilisé comme indicateur d’activité, mais ces tests sont au mieux qualitatifs. Pour déterminer si l’activité des caspases est associée à la mort cellulaire, une mesure quantitative est idéale. Étant donné que les caspases clivent les substrats sur un site de reconnaissance composé de quatre acides aminés, des méthodes colorimétriques, luminescentes ou fluorométriques ont été développées. Cependant, les caspases semblent avoir une plasticité dans leur reconnaissance de substrat19,20. La séquence de reconnaissance n’est pas associée aux domaines protéiques (tableau 1). La séquence tétrapeptidique DEVD, cependant, peut être utilisée pour détecter l’activité de la caspase-3 et de la caspase-720,21.
Les mimétiques Smac sont des composés ciblant les inhibiteurs des protéines d’apoptose (IAP). L’utilisation de mimétiques Smac dans un sous-ensemble de cellules cancéreuses rend les cellules sensibles à la mort cellulaire induite par le TNF22. Dans les macrophages primaires, les mimétiques Smac provoquent la mort cellulaire sans l’ajout exogène de TNF23,24. La perte de cIAP1 par la dégradation induite par les mimétiques de Smac entraîne la production de TNF. Si l’activité de la caspase est détectée, cela signifie que les cellules ne sont pas mortes par nécroptose mais de manière apoptotique. Dans cette méthode, la détection du substrat DEVD clivé est utilisée pour identifier l’activité de la caspase-3/caspase-7. D’autres expériences pour confirmer la mort cellulaire apoptotique ont été publiées précédemment24.
Protocole
La présente étude a été réalisée avec l’approbation et conformément aux directives du comité d’éthique animale de l’Université de Zurich (#ZH149/19). Des souris C57Bl/6J mâles âgées de 8 à 16 semaines, élevées et hébergées dans des conditions spécifiques exemptes d’agents pathogènes (FPS), ont été utilisées pour la présente étude. Les os intacts peuvent être conservés sur de la glace dans la solution saline tamponnée stérile de Hank (HBSS) avec 2% de sérum fœtal bovin inactivé par la chaleur (FBS). La moelle osseuse a été prélevée sur le fémur et le tibia de la souris25 le jour de la différenciation. Les deux méthodes d’évaluation de l’activité des caspases peuvent être utilisées pour d’autres types de cellules, y compris primaires et transformées.
1. Différenciation des macrophages dérivés de la moelle osseuse (BMDM)
REMARQUE: Effectuez toutes les étapes dans une hotte à flux laminaire de culture tissulaire et utilisez des techniques aseptiques stériles.
- Préparez une seringue de 1 mL avec une aiguille de 21 G.
- Ajouter 5 mL de HBSS + 2% FBS dans un tube de 15 mL.
- À l’aide de pinces stériles, prenez un fémur excisé et insérez l’aiguille dans l’ouverture du fémur. En tenant le fémur dans le HBSS + 2% FBS, rincer la moelle osseuse jusqu’à ce que l’os soit blanc. Rincer le tibia de la même manière. Continuez à rincer la solution pour obtenir une suspension unicellulaire.
- Centrifuger la suspension unicellulaire à 200 x g pendant 4 min à température ambiante (RT).
- Retirez le surnageant à l’aide d’un aspirateur à vide. Tapotez le tube pour remettre doucement le granulé en suspension. Ajouter 1 mL de tampon de lyse érythrocytaire (voir le tableau des matières) et mélanger doucement avec une pipette P1,000. Incuber à TA pendant 1 min.
- Ajouter 10 mL de HBSS + 2% FBS, et centrifuger à 200 x g pendant 4 min à TA.
- Retirer le surnageant et remettre en suspension dans 10 mL de milieu de culture de macrophages dérivés de la moelle osseuse (BMDM).
REMARQUE : Le milieu de culture BMDM est constitué de DMEM à faible teneur en glucose additionné de 10 % de FBS, de 20 ng/ml de M-CSF, de pénicilline (50 U/mL) et de streptomycine (50 μg/mL) (voir le tableau des matériaux). Alternativement, le milieu conditionné à 20% L929 peut être substitué au M-CSF. - Ajouter 15 ml de milieu de culture BMDM dans deux boîtes de Petri de 15 cm. Ajouter 5 mL de la solution unicellulaire dans chaque plaque.
REMARQUE : N’utilisez pas de plaques traitées par culture tissulaire. Les plaques traitées par culture tissulaire limitent la différenciation. - Placer les plats à 37 °C, 5% CO2, pendant 6 jours.
REMARQUE: Les BMDM peuvent être récoltés après 5-7 jours. Des temps d’incubation plus longs pour la différenciation entraînent une augmentation de l’expression de la protéine anti-apoptotique26.
2. Récolte, ensemencement et traitement des cellules
REMARQUE: Effectuez toutes les étapes dans une hotte à flux laminaire de culture tissulaire et utilisez des techniques aseptiques stériles. Les macrophages entièrement différenciés adhèrent à la plaque, ce qui permet une séparation facile, tandis que les cellules flottantes peuvent être éliminées. La solution saline tamponnée au phosphate (PBS) peut être utilisée avec ou sans Ca 2+ et Mg2+.
- Après 6 jours d’incubation, retirez les cellules flottantes et le milieu de la plaque à l’aide d’un aspirateur.
- Ajouter 5 mL de PBS à chaque assiette de 15 cm. Retirez le PBS de la plaque à l’aide d’un aspirateur.
- Ajouter 2 mL de trypsine (voir le tableau des matières) dans chaque assiette. Incuber la plaque jusqu’à ce que le tapotement doux de la plaque déloge les cellules. Prélever 5 mL de milieu de culture BMDM et prélever les cellules de l’assiette.
- Transférer sur la deuxième plaque de 15 cm et récolter les cellules de la plaque. Retirez la suspension cellulaire de la plaque dans un tube de 50 mL. Prélever 5 mL supplémentaires de milieu de culture BMDM et laver les deux plaques pour vous assurer que toutes les cellules ont été recueillies. Placez la suspension cellulaire dans le même tube de 50 mL.
- Prélever 10 μL de la suspension cellulaire et compter à l’aide d’un hémocytomètre en utilisant une dilution 1:1 avec du bleu de trypan.
REMARQUE: Les compteurs de cellules automatiques peuvent également être utilisés lorsqu’ils sont étalonnés pour la taille des macrophages. - Ensemencer les macrophages à une densité de 1 x 106 cellules/mL. Les BMDM ensemencées à 2 x 10 6 cellules/puits dans une plaque à6 puits fournissent environ 2 mg/mL de protéines totales. Laisser les cellules adhérer à la plaque pendant au moins 6 h avant le traitement.
NOTE: Pour les autres types de cellules, la concentration optimale doit être déterminée. - Traiter les macrophages avec Smac mimétique (composé A, voir tableau des matériaux)22 à 250 nM et 500 nM pendant 16 h.
REMARQUE: Inclure un contrôle positif pour induire l’apoptose et le clivage de la caspase-3 pour s’assurer que le test fonctionne. Les inducteurs d’apoptose courants comprennent la staurosporine et l’étoposide. Pour que de nombreuses lignées cellulaires subissent l’apoptose, 0,1-10 μM pour 16 h de stimulation est suffisant.
3. Préparation de lysats cellulaires à partir de cellules traitées
NOTE: Cette étape doit être effectuée sur de la glace et les réactifs et les matériaux doivent être pré-refroidis.
- Transférer les plaques contenant les cellules traitées sur la glace. Recueillir le milieu de la culture cellulaire dans un tube de 1,5 mL, centrifuger à 300 x g pendant 5 min à 4 °C, aspirer le milieu et mettre le tube sur de la glace. Cela permet la collecte des cellules qui se sont détachées de la plaque.
- Ajouter 1 mL de PBS froid à la plaque de culture cellulaire pour laver les cellules, et aspirer tout le PBS. Ajouter 100 μL de trypsine aux cellules (si vous travaillez avec un plat à 6 puits). Laissez la trypsine soulever les cellules de la plaque et recueillez-les dans le tube de 1,5 mL. Utilisez 1 mL de PBS froid pour vous assurer que toutes les cellules ont été recueillies.
REMARQUE: Si vous travaillez avec des cellules en suspension, transférez doucement le milieu et les cellules dans un tube de 1,5 mL. - Centrifuger les cellules à 300 x g pendant 5 min à 4 °C. Retirer le surnageant et remettre en suspension dans un tampon de lyse DISC de 100 μL (chlorure de sodium 150 mM, 2 mM d’EDTA, 1 % de Triton X-100, 10 % de glycérol, 20 mM de Tris, pH de 7,5, voir le tableau des matériaux).
- Incuber les échantillons sur glace pendant 20 min.
- Centrifuger les lysats à ~12 000 x g pendant 10 min à 4 °C pour enrober la fraction insoluble.
- Transférer 25 μL du lysat dans une plaque blanche à fond plat de 96 puits pour l’essai d’activité caspase-3/caspase-7 (étape 5).
REMARQUE: Ne pas déranger la pastille. C’est la fraction insoluble du lysat cellulaire. - Transférer 10 μL du lysat restant dans une plaque transparente à fond plat de 96 puits pour le dosage de l’acide bicinchoninique (BCA) (étape 4). Cela sera utilisé pour la normalisation des échantillons.
- Gardez les deux plaques sur de la glace pour un traitement ultérieur.
REMARQUE: À ce stade, les plaques peuvent être scellées avec un couvercle adhésif et stockées à -20 ° C pendant environ 4 semaines.
4. Quantification des protéines à l’aide du test BCA
NOTE: D’autres réactifs ou dosages peuvent être utilisés pour quantifier la quantité de protéines dans chaque échantillon. Dans le test basé sur la population, les échantillons peuvent être comparés en normalisant la quantité de protéines utilisée dans l’essai.
- Préparer des concentrations étalons de protéines entre 0 μg/mL et 2 000 μg/mL (0 μg/mL, 25 μg/mL, 125 μg/mL, 250 μg/mL, 500 μg/mL, 750 μg/mL, 100 μg/mL, 1 500 μg/mL, 2 000 μg/mL) avec de l’albumine sérique bovine (BSA). Préparez les blancs avec un tampon de lyse uniquement.
- Ajouter 10 μL de chaque étalon dans la plaque à fond plat de 96 puits contenant les échantillons, mentionnée à l’étape 3.7.
- Mélanger le réactif BCA 1 avec le réactif BCA 2 dans un rapport de 50:1 (voir le tableau des matériaux). Ajouter 200 μL de réactif BCA mélangé à chaque échantillon et étalon.
- Incuber à 37 °C pendant 30 min.
- Mesurer l’absorbance à 562 nm sur un instrument fluorométrique et quantifier la concentration en protéines à l’aide de la courbe étalon.
5. Essai en population de l’activité de la caspase-3/caspase-7
REMARQUE: Ne laissez pas les lysats cellulaires dans la plaque reposer sur de la glace pendant plus de 3 heures. Si l’activité des caspases est présente, elle augmente avec le temps malgré la présence de l’échantillon sur la glace. Si les échantillons ont été congelés, décongelez-les sur de la glace et procédez immédiatement une fois que les lysats ont décongelé.
- Démarrez l’instrument fluorométrique (voir tableau des matériaux) et chauffez la machine à 37 °C. Préparez le script comme mentionné :
- Effectuer des lectures individuelles toutes les minutes pendant 40 minutes afin de déterminer la cinétique de la réaction.
- Réglez l’excitation à 360 nm et l’émission à 465 nm. Dix éclairs par puits suffisent.
- Préparer le contrôle positif de la caspase-3 recombinante (voir le tableau des matériaux). Mélanger 1 U de l’enzyme caspase-3 recombinante dans 50 μL de tampon de lyse (tube 1). Ajouter 25 μL de tampon de lyse à trois tubes supplémentaires. Transférer 25 μL du tube 1 au tube 2. Mélanger par pipetage.
- Répétez l’opération pour le tube 3 et le tube 4. Le tube 5 ne contiendra que 50 μL de tampon de lyse. Ajouter 25 μL de chaque étalon dans la plaque blanche à fond plat à 96 puits pour le test d’activité de la caspase-3, mentionné à l’étape 3.6.
- Préparer un mélange réactionnel principal pour l’essai d’activité des caspases sur glace. Pour une réaction, mélanger 50 μL de tampon de clivage de la caspase 2x (0,2M HEPES pH 7,5; 20% saccharose ou PEG; 0,2% CHAPS), 5 μL de 1 mM DEVD-AMC (substrat tétrapeptidique caspase-3), 2 μL de DTT 500 mM et 18 μL d’eau désionisée (voir le tableau des matériaux).
- Ajouter 75 μL du mélange réactionnel à chaque échantillon et étalon pour obtenir un volume de réaction total de 100 μL.
- Mesurer immédiatement la fluorescence à l’aide de l’instrument fluorométrique mis en place à l’étape 5.1.
- Pour chaque mesure fluorescente, soustrayez la lecture de fluorescence pour le blanc (tampon de lyse uniquement) de la fluorescence de l’échantillon. Normaliser la lecture en divisant par la concentration en protéines de l’échantillon (calculée à l’étape 4.5)27 :
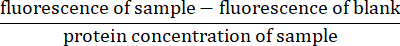
- Calculer le taux d’activité des caspases en déterminant la pente de la fluorescence normalisée sur l’axe des y et le temps sur l’axe des abscisses.
6. Essai unicellulaire (analyse par cytométrie en flux) pour l’activité de la caspase-3/caspase-7
- Ensemencer les cellules comme décrit à la rubrique 2.
- Récoltez les cellules dans un tube en polystyrène de 5 mL. Si vous travaillez avec des cellules adhérentes, collectez le milieu dans le tube de 5 mL. Ajouter 1 mL de PBS froid à la plaque de culture cellulaire et recueillir le PBS dans le tube de 5 mL. Ajouter de la trypsine aux cellules (100 μL si vous travaillez avec des plats à 6 puits). Laisser la trypsine soulever les cellules de la plaque et recueillir dans le tube de 5 mL. Utilisez 1 mL de PBS froid pour vous assurer que toutes les cellules ont été recueillies.
REMARQUE: Si vous travaillez avec des cellules de suspension, transférez doucement le milieu et les cellules dans un tube de 5 mL. - Centrifuger les échantillons à 300 x g pendant 5 min, 4 °C. Retirez le surnageant à l’aide d’un aspirateur à vide.
- Préparez le mélange de coloration. La concentration optimale de coloration est de 1 x 106-2 x 106 cellules dans 50 μL. Diluer le substrat fluorogénique conformément aux instructions du fabricant (voir le tableau des matières, cytométrie en flux). Prendre 1 μL du substrat mère et diluer dans 150 μL de PBS. Ajouter 50 uL par échantillon.
- Incuber les échantillons à 37 °C pendant 30 min à l’abri de la lumière, en mélangeant toutes les 15 min.
- Avec le cytomètre en flux utilisé dans cette étude, utilisez le laser rouge à 640 nm et détectez à l’aide de 675/25 nm. Exécutez d’abord l’échantillon témoin non coloré et obtenez un minimum de 10 000 événements de la population souhaitée. Exclure les débris à l’aide d’une porte (P1) sur un diagramme à points FSC-A et SSC-A.
- Utilisez un histogramme affichant les événements dans la porte P1 et la détection du substrat de caspase (axe y) pour déterminer l’intensité médiane de fluorescence (MFI).
NOTE: Le substrat de caspase décrit dans cette méthode nécessite une excitation à 590 nm et émet à 628 nm.
- Utilisez un histogramme affichant les événements dans la porte P1 et la détection du substrat de caspase (axe y) pour déterminer l’intensité médiane de fluorescence (MFI).
Résultats
Les macrophages primaires de la souris ont été différenciés pendant 6 jours. Après 6 jours, les cellules ont été récoltées, comptées et ensemencées. Les traitements suivants ont été utilisés : absence de traitement et mimétique Smac (composé A)22 à 250 nM et 500 nM pendant 16 h (Figure 1). L’expérience a été réalisée en double pour permettre l’évaluation de l’activation de la caspase-3/caspase-7 par un test basé sur la population ou une analyse unicellulaire utilisant la cytométrie en flux.
La concentration protéique des lysats cellulaires a été quantifiée à l’aide du test BCA (tableau supplémentaire 1). Cela est nécessaire pour s’assurer que la quantité de protéines utilisée dans le test d’activité caspase-3/caspase-7 est la même entre les échantillons. Dans ce test basé sur la population, les données peuvent être présentées de deux façons. La première consiste à montrer la cinétique en traçant la fluorescence ajustée (axe y) en fonction du temps (axe des abscisses) (Figure 2A). Alternativement, la pente peut être calculée pour comparer directement les échantillons (Figure 2B). L’augmentation de la pente sur un traitement mimétique Smac de 500 nM n’était pas significative sur la base d’une ANOVA unidirectionnelle ordinaire avec comparaisons multiples (test de comparaison multiple de Dunnett28).
Pour l’analyse de l’activité de la caspase-3/caspase-7 par cytométrie en flux, les cellules et le surnageant ont été récoltés. Les cellules non colorées ou la fluorescence moins un ont été utilisées comme témoin négatif, ainsi que les cellules non traitées. Un histogramme des cellules recueillies par cytométrie en flux a montré un décalage de fluorescence pour les cellules traitées avec des mimétiques Smac par rapport aux cellules non traitées (Figure 2C). Les données peuvent être présentées soit sous forme d’intensité médiane de fluorescence (Figure 2D), soit sous forme de changement de pli sur les cellules non traitées (Figure 2E).

Figure 1 : Organigramme de l’étude. (A) Les fémurs et les tibias ont été excisés des souris C57Bl/6. Les os ont été rincés et différenciés dans 20 ng/mL DE M-CSF pendant 6 jours. (B) Le jour 6, les macrophages ont été récoltés et réensemencés pour le traitement. Un ensemble de cellules a été récolté pour les lysats et évalué par activité fluorogénique, tandis que l’autre ensemble a été récolté, incubé avec le substrat fluorogénique et évalué par cytométrie en flux. Veuillez cliquer ici pour voir une version agrandie de cette figure.
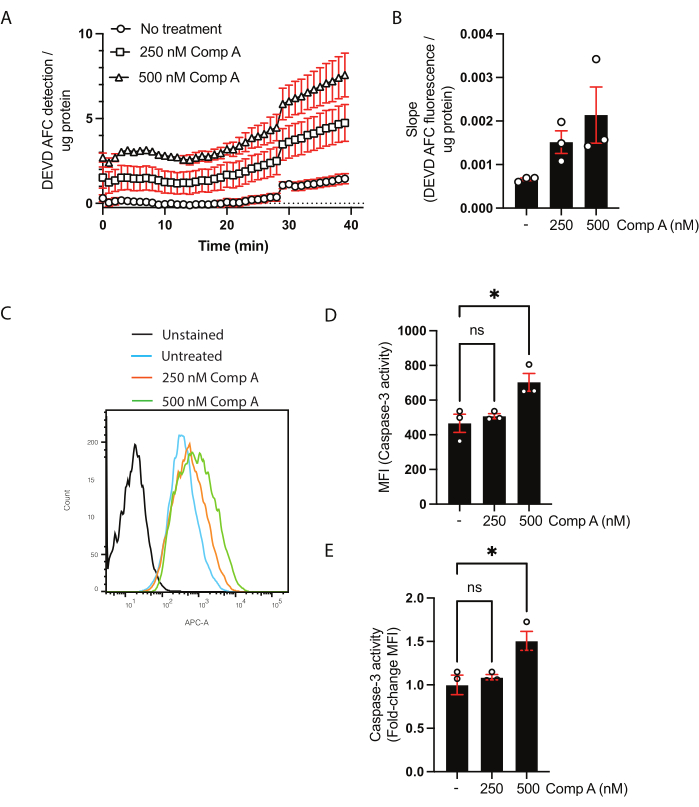
Figure 2 : Dosage cinétique de l’activité de la caspase-3/caspase-7 et du clivage du substrat par cytométrie en flux. (A,B) Données représentatives du dosage cinétique de l’activité de la caspase-3/caspase-7 (C-E) et du clivage du substrat par cytométrie en flux. Les macrophages ont été traités avec deux concentrations de Smac mimétique (composé A; 250 nM et 500 nM) pendant 16 h. (A) Détection du substrat DEVD AFC clivé au fil du temps. Les données ont été normalisées à la concentration de protéines dans l’échantillon. (B) Le taux de clivage (pente) de DEVD AFC pour chaque échantillon a été normalisé à la pente non traitée et présenté comme le changement de pli sur les cellules non traitées. (C) Histogrammes cytométriques en flux des cellules incubées avec le substrat de la caspase-3. (D, E) Comparaison des IFM et changement de pli de l’IMF par rapport à l’échantillon non traité. Chaque point de données représente un échantillon indépendant; la moyenne ± l’erreur-type de la moyenne sont indiquées; *p < 0,05 en utilisant une ANOVA unidirectionnelle et des tests de comparaison multiple (test de comparaison multiple de Dunnett). Veuillez cliquer ici pour voir une version agrandie de cette figure.
| Caspases | Espèce | Séquence de substrat | Domaines protéiques | ||
| Caspase-1 | Hs, Mm | (W/L) JEP | CARD, grand domaine, petit domaine catalytique | ||
| Caspase-2 | Hs, Mm | DEXD | CARD, grand domaine, petit domaine catalytique | ||
| Caspase-4 | Hs | (W/L) JEP | CARD, grand domaine, petit domaine catalytique | ||
| Caspase-5 | Hs | (W/L) JEP | CARD, grand domaine, petit domaine catalytique | ||
| Caspase-9 | Hs, Mm | (I/V/L) E(H/T)D | CARD, grand domaine, petit domaine catalytique | ||
| Caspase-11 | Mm | (W/L) JEP | CARD, grand domaine, petit domaine catalytique | ||
| Caspase-12 | Mm | ATAD | CARD, grand domaine, petit domaine catalytique | ||
| Caspase-8 | Hs, Mm | (I/V/L) E(H/T)D | DED, grand domaine, petit domaine catalytique | ||
| Caspase-10 | Hs | (I/V/L) E(H/T)D | DED, grand domaine, petit domaine catalytique | ||
| Caspase-3 | Hs, Mm | DEXD | Grand domaine, petit domaine catalytique | ||
| Caspase-6 | Hs, Mm | (I/V/L) E(H/T)D | Grand domaine, petit domaine catalytique | ||
| Caspase-7 | Hs, Mm | DEXD | Grand domaine, petit domaine catalytique | ||
| Caspase-14 | hs, mm | (W/L) JEP | Grand domaine, petit domaine catalytique | ||
| CARTE | Domaine d’activation et de recrutement des caspases | ||||
| DED | Domaine effecteur de mort | ||||
| Hs | Homo sapien | ||||
| Mm | Mus musculus | ||||
Tableau 1 : Spécificité du substrat et domaines protéiques des caspases. Le tableau est adapté de McStay et coll.20; Shalini et coll.3; et van Opdenbosch et Lamkanfi4.
Tableau supplémentaire 1 : Analyse cinétique DEVD. Veuillez cliquer ici pour télécharger ce tableau.
Discussion
Dans cette méthode, un substrat fluorogénique est utilisé dans un test basé sur la population ou une analyse unicellulaire pour mesurer l’activité de la caspase-3/caspase-7. Les deux méthodes mesurent l’activité de la caspase de manière quantitative en fonction du clivage d’un substrat. Un avantage est la possibilité d’utiliser ces méthodes pour de nombreux échantillons. Avec ces méthodes, l’activité de la caspase-3/caspase-7 est détectée dans les macrophages primaires traités avec des mimétiques Smac.
Un aspect essentiel du test fluorométrique basé sur la population est le temps écoulé entre la lyse et la lecture de la fluorescence. Les échantillons doivent être conservés sur la glace tout au long de la procédure, en particulier avant de « lire » l’essai. Cela empêche le clivage prématuré et la fluorescence du substrat. En utilisant le test basé sur la population, moins d’optimisation peut être nécessaire. La quantité de protéines utilisée dans le test est normalisée, ce qui permet de comparer directement les échantillons. Une mise en garde est qu’à un stade avancé de la mort cellulaire apoptotique, la quantité totale de protéines est réduite; Par conséquent, la détection de l’activité des caspases peut ne pas être possible. Différentes cinétiques ou différentes doses de traitement sont recommandées pour contourner ce problème. En outre, d’autres logiciels peuvent être utilisés pour évaluer avec précision le taux d’activité des caspases en plus du logiciel décrit dans cette méthode.
Pour le test cytométrique en flux, suffisamment d’événements ou de cellules sont nécessaires pour contrôler les populations en toute confiance. En outre, une optimisation plus poussée du test basé sur le flux peut être nécessaire pour obtenir le rapport optimal entre le substrat et le nombre de cellules. Cependant, avec la cytométrie en flux, cette méthode se prête à la mesure de paramètres supplémentaires, tels que les marqueurs de surface cellulaire pour l’identification du type cellulaire.
La méthode de population et la méthode unicellulaire pourraient être utilisées pour d’autres caspases. Cependant, il est important de se rappeler que la séquence de reconnaissance est moins discriminée pour les autres caspases. Par conséquent, d’autres méthodes d’activité des caspases doivent être utilisées. Cela inclut l’inhibition de l’activité des caspases, CRISPR ou knock-down de caspases spécifiques, et le Western blot pour détecter le clivage de substrats connus.
Une méthode alternative pour détecter l’activité des caspases est l’imagerie accélérée. Le même substrat de caspase perméable pourrait être utilisé avec d’autres marqueurs de viabilité, tels que l’annexine V, pour fournir des informations sur la cinétique de la mort cellulaire. L’imagerie séparerait également l’activité des caspases et la survie cellulaire, permettant la détection de quantités sublétales d’activité des caspases dans une population cellulaire. Les fonctions non létales de la caspase-3/caspase-7 sont liées à la régulation antivirale dans les cellules immunitaires innées29, en particulier l’activation de l’IFN de type I via la libération de l’ADN mitochondrial15,16. Ainsi, ces tests pour mesurer l’activité des caspases sont essentiels pour identifier différents modes de mort cellulaire et peuvent être utiles pour évaluer les fonctions de mort non cellulaire.
Déclarations de divulgation
Les auteurs n’ont aucun conflit d’intérêts à divulguer.
Remerciements
W.W.W. est soutenu par la subvention Clöetta Medical Research Fellow, S.R. est soutenu par le CanDoc UZH Forschungskredit, et J.T. est soutenu par le Chinese Scholarship Council.
matériels
| Name | Company | Catalog Number | Comments |
| 1.5 mL microfuge tubes | Sarstedt | 72.706.400 | |
| 15 cm Petri plates | Sarstedt | 82.1184.500 | |
| 37 degree incubator shaker | IKA shaker KS 4000i | 97014-816 | distributed by VWR |
| 6-well cell culture dish | Sarstedt | 83.392 | |
| 96 well flat bottom, white polystyrene, non-sterile | Sigma | CLS3600 | |
| 96 well flat plate | Sarstedt | 82.1581 | |
| Ac-DEVD-AFC | Enzo Life Sciences | ALX-260-032-M005 | Caspase-3 substrate |
| BD Fortessa | BD | any flow cytometer with the appropriate excitation and emission detector will work | |
| b-glycerolphosphate | Sigma | G9422-10G | |
| caspase-3 recombinant | Enzo Life Sciences | ALX-201-059-U025 | |
| CHAPS | Sigma | 1.11662 | |
| DMEM, low glucose, pyruvate | Thermoscientific | 31885023 | |
| DMSO | Sigma | D8418-250ML | |
| EDTA | Sigma | 03685-1KG | |
| EGTA | Sigma | 324626-25GM | |
| Etoposide | MedChem Express | HY-13629 | |
| FBS | Thermoscientific | 26140 | |
| Flow cytometry tubes | Falcon | 352008 | |
| Flowjo | Flowjo | A license in required but any program that can analyze .fcs files will suffice | |
| Glycerol | Sigma | G5516-500ML | |
| HEPES | Sigma | H4034 | |
| Magic Red caspase-3/7 assay kit; flow cytometry or imaging | Immunochemistry Technologies | 935 | |
| M-CSF | ebioscience | 14-8983-80 | now a subsidiary of Thermoscientific |
| M-Plex | Tecan | any fluorometric reader will work with the appropriate excitation and emission detectors | |
| NaCl | Roth | 3957.1 | |
| PBS pH 7.4 | Thermoscientific | 10010023 | |
| Penicillin-Streptomycin-Glutamine (100X) | Thermoscientific | 10378016 | |
| Pierce BCA Protein Assay Kit | ThermoFisher Scientific | 23225 | protein concentration assay |
| protease inhibitors | Biomol | P9070.100 | |
| Smac mimetic, Compound A | Tetralogics | also known as 12911; structure shown in supplementary figures of Vince et al., Cell 2007 | |
| Sodium Fluoride | Sigma | S7920-100G | |
| sodium orthovanadate | Sigma | S6508-10G | |
| sodium pyrophosphate | Sigma | P8010-500G | |
| Staurosporine | MedChem Express | HY-15141 | |
| sucrose | Sigma | 1.07687 | |
| Tris Base | Sigma | T1503-1KG | |
| Triton X100 | Sigma | T8787-50ML | |
| TrypLE | Thermoscientific | A1285901 | In the protocol, it is listed as Trypsin |
Références
- Ramirez, M. L. G., Salvesen, G. S. A primer on caspase mechanisms. Seminars in Cell and Developmental Biology. 82, 79-85 (2018).
- Nicholson, D. W., Thornberry, N. A. Caspases: Killer proteases. Trends in Biochemical Sciences. 22 (8), 299-306 (1997).
- Shalini, S., Dorstyn, L., Dawar, S., Kumar, S. Old, new and emerging functions of caspases. Cell Death and Differentiation. 22 (4), 526-539 (2014).
- Van Opdenbosch, N., Lamkanfi, M. Caspases in cell death, inflammation, and disease. Immunity. 50 (6), 1352-1364 (2019).
- Kesavardhana, S., Malireddi, R. K. S., Kanneganti, T. -. D. Caspases in cell death, inflammation, and pyroptosis. Annual Review of Immunology. 38, 567-595 (2020).
- Fu, T. -. M., et al. Cryo-EM structure of caspase-8 tandem DED filament reveals assembly and regulation mechanisms of the death-inducing signaling complex. Molecular Cell. 64 (2), 236-250 (2016).
- Jiang, X., Wang, X. Cytochrome c promotes caspase-9 activation by inducing nucleotide binding to Apaf-1. Journal of Biological Chemistry. 275 (40), 31199-31203 (2000).
- Christgen, S., Place, D. E., Kanneganti, T. -. D. Toward targeting inflammasomes: Insights into their regulation and activation. Cell Research. 30 (4), 315-327 (2020).
- Shi, J., et al. Cleavage of GSDMD by inflammatory caspases determines pyroptotic cell death. Nature. 526 (7575), 660-665 (2015).
- Sborgi, L., et al. GSDMD membrane pore formation constitutes the mechanism of pyroptotic cell death. EMBO Journal. 35 (16), 1766-1778 (2016).
- Rühl, S., et al. ESCRT-dependent membrane repair negatively regulates pyroptosis downstream of GSDMD activation. Science. 362 (6417), 956-960 (2018).
- Declercq, W., Takahashi, N., Vandenabeele, P. Dual face apoptotic machinery: From initiator of apoptosis to guardian of necroptosis. Immunity. 35 (4), 493-495 (2011).
- Newton, K., et al. Cleavage of RIPK1 by caspase-8 is crucial for limiting apoptosis and necroptosis. Nature. 574, 428-431 (2019).
- Fritsch, M., et al. Caspase-8 is the molecular switch for apoptosis, necroptosis and pyroptosis. Nature. 575, 683-687 (2019).
- White, M. J., et al. Apoptotic caspases suppress mtDNA-induced STING-mediated type I IFN production. Cell. 159 (7), 1549-1562 (2014).
- Rongvaux, A., et al. Apoptotic caspases prevent the induction of type I interferons by mitochondrial DNA. Cell. 159 (7), 1563-1577 (2014).
- Nakajima, Y. -. I., Kuranaga, E. Caspase-dependent non-apoptotic processes in development. Cell Death and Differentiation. 24, 1422-1430 (2017).
- Kumar, S., Dorstyn, L., Lim, Y. The role of caspases as executioners of apoptosis. Biochemical Society Transactions. 50 (1), 33-45 (2022).
- Agniswamy, J., Fang, B., Weber, I. T. Plasticity of S2-S4 specificity pockets of executioner caspase-7 revealed by structural and kinetic analysis. FEBS Journal. 274 (18), 4752-4765 (2007).
- McStay, G. P., Salvesen, G. S., Green, D. R. Overlapping cleavage motif selectivity of caspases: implications for analysis of apoptotic pathways. Cell Death and Differentiation. 15 (2), 322-331 (2008).
- Thornberry, N. A., et al. A combinatorial approach defines specificities of members of the caspase family and granzyme B. Functional relationships established for key mediators of apoptosis. Journal of Biological Chemistry. 272 (29), 17907-17911 (1997).
- Vince, J. E., et al. IAP antagonists target cIAP1 to induce TNFalpha-dependent apoptosis. Cell. 131 (4), 682-693 (2007).
- McComb, S., et al. cIAP1 and cIAP2 limit macrophage necroptosis by inhibiting Rip1 and Rip3 activation. Cell Death and Differentiation. 19 (11), 1791-1801 (2012).
- Wong, W. W. -. L., et al. cIAPs and XIAP regulate myelopoiesis through cytokine production in an RIPK1- and RIPK3-dependent manner. Blood. 123 (16), 2562-2572 (2014).
- Liu, X., Quan, N. Immune cell isolation from mouse femur bone marrow. Bio-Protocol. 5 (20), e1631 (2015).
- Lin, H., Chen, C., Chen, B. D. Resistance of bone marrow-derived macrophages to apoptosis is associated with the expression of X-linked inhibitor of apoptosis protein in primary cultures of bone marrow cells. Biochemical Journal. 353 (Pt 2), 299-306 (2001).
- . Caspase activity assay buffer. Cold Spring Harbor Protocols. , (2015).
- Mackridge, A., Rowe, P. One-way analysis of variance (ANOVA) - Including Dunnett's and Tukey's follow up tests. Practical Approach to Using Statistics in Health Research: From Planning to Reporting. , 93-103 (2018).
- Chen, H., Ning, X., Jiang, Z. Caspases control antiviral innate immunity. Cellular and Molecular Immunology. 14 (9), 736-747 (2017).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationExplorer plus d’articles
This article has been published
Video Coming Soon