Method Article
형광 분석 또는 유세포분석을 사용한 카스파제 활성 측정
요약
본 프로토콜은 유동 세포분석 또는 분광형광계를 사용하여 형광 기질을 통해 카스파아제 활성을 측정하는 두 가지 방법을 설명합니다.
초록
카스파아제로 알려진 시스테인 프로테아제의 활성화는 여러 형태의 세포 사멸에서 중요한 과정으로 남아 있습니다. Caspases는 프로그램 된 세포 사멸의 가장 많이 연구 된 형태 인 세포 사멸의 중요한 개시 자이자 집행 자입니다. 세포 사멸은 발달 과정에서 발생하며 조직 항상성에서 필요한 사건입니다. Pyroptosis는 카스파제를 이용하는 또 다른 형태의 세포 사멸이며 인플라마좀의 활성화를 통해 면역 체계를 활성화하는 중요한 과정으로, 인터루킨-1(IL-1) 계열의 구성원을 방출합니다. 카스파아제 활성을 평가하기 위해, 표적 기질을 평가할 수 있다. 그러나 민감도는 단일 세포 또는 낮은 수준의 활동을 검사할 때 문제가 될 수 있습니다. 우리는 형광 기질이 유세포 분석에 의한 인구 기반 분석 또는 단일 세포 분석과 함께 어떻게 사용될 수 있는지 보여줍니다. 적절한 대조군을 사용하면 다른 아미노산 서열을 사용하여 어떤 카스파제가 활성인지 확인할 수 있습니다. 이들 분석을 사용하여, 종양 괴사 인자 (TNF) 자극시 세포 사멸 단백질의 억제제의 동시 손실이 확인되었으며, 이는 주로 다른 형태의 세포 사멸보다는 대 식세포에서 세포 사멸을 유도한다.
서문
Caspases는 여러 형태의 프로그램 된 세포 사멸에 관여합니다. 세포 사멸은 프로그램 된 세포 사멸의 가장 많이 연구 된 형태이며 카스파 아제 활성1과 관련이 있습니다. 모든 카스파제는 크고 작은 촉매 서브 유닛을 가지고 있습니다. 카스파제-1, 카스파제-4, 카스파제-5, 카스파제-9 및 카스파제-11은 카스파아제 활성화 및 모집 도메인(CARD)을 보유하고, 카스파제-8 및 카스파제-10은 사멸 효과기 도메인(DED)2,3,4,5를 함유한다(표 1). 세포 사멸은 두 가지 주요 경로, 즉 외적 경로와 내인성 경로에 의해 시작될 수 있습니다. 외인성 세포 사멸 경로는 종양 괴사 인자 수퍼 패밀리 (TNFSF)의 일부인 사망 수용체에 의해 유발됩니다. 사멸 수용체는 DED 도메인을 보유하여 카스파제 -8 활성을 촉진합니다6. 내인성 세포 사멸 경로는 세포 사멸 형성 후 카스파 제 -9의 활성화를 포함하며, 시토크롬 c 및 Apaf-17의 방출을 필요로한다. 개시제 카스파제, 카스파제-8 또는 카스파제-9의 활성화는 카스파제-3, 카스파제-6 및 카스파제-7인 사형집행인 카스파제의 절단 및 후속 활성화를 유도한다. 사형 집행 인 카스파 아제가 활성화되어 있음을 확인하는 것은 세포가 세포 사멸을 겪고 있음을 나타내며,이 활성화는 세포 사멸 모드를 정의하는 중요한 요소로 간주됩니다.
카스파제 활성화는 또한 염증을 조절하고 대체 형태의 프로그램된 세포 사멸을 유도하는 중요한 분기점입니다. 예를 들어, 카스파제 -1 활성화는 인터루킨 -1 패밀리8의 전 염증성 사이토 카인의 성숙을 유도한다. 이 패밀리로부터의 사이토카인, 특히 IL-1β 및 IL-18의 방출 및 활성화는 원형질막 9,10에서의 가스더민 D 절단 및 기공 형성으로부터 발생한다. gasdermin D 기공의 부적절한 막 복구는 pyroptosis11로 알려진 일종의 세포 사멸을 초래할 수 있습니다. 더욱이, 카스파제-8 활성은 괴사(necroptosis)12로 알려진 카스파제-비의존적 세포 사멸의 억제를 초래한다. 수용체 상호작용 세린/트레오닌 단백질 키나아제 1(RIPK1)은 괴사증 및 NF-kB에 의해 조절되는 염증을 유발하는 데 중요한 요소 중 하나입니다. 모델은 RIPK1이 카스파제-8에 의해 절단되어 NF-kB 신호전달, 세포자멸사 및 괴사증13,14를 제한하는 것으로 나타났습니다. 따라서 다양한 카스파제의 활성을 확인하면 결과 염증 및 세포 사멸 양식을 이해하는 데 도움이 될 수 있습니다.
세포 사멸 양식을 조절하는 카스파제의 기능과는 별개로, 카스파아제 활성은 또한 감염15,16에 반응하여 인터페론 (IFN)과 같은 다른 사이토카인 패밀리를 조절할 수 있다. 또한 카스파제는 세포 운명 결정, 조직 복구 및 재생, DNA 복구를 통한 종양 발생 및 신경 시냅스 기능을 포함한 비 세포 사멸 기능에 관여합니다. 이러한 치명적이지 않은 역할에서 카스파제의 활성은 세포 국소화 및 카스파제의 양에 의해 제한되는 것으로 생각됩니다. 따라서, 카스파아제 활성의 수준을 정량화하는 것은 세포가 세포 사멸을 겪는지 또는 카스파아제가 비-세포 사멸 기능에서 역할을 하는지 여부를 잘 정의할 수 있다(4,17,18).
카스파제 활성은 여러 가지 방법으로 평가할 수 있습니다. 절단된 카스파제 및 그 기질에 대한 웨스턴 블로팅이 활성의 지표로 사용되었지만 이러한 분석은 기껏해야 정성적입니다. 카스파아제 활성이 세포 사멸과 관련이 있는지 여부를 결정하기 위해서는 정량적 측정이 이상적입니다. 카스파제는 4 개의 아미노산으로 구성된 인식 부위에서 기질을 절단하기 때문에 비색, 발광 또는 형광 측정 방법이 개발되었습니다. 그러나, 카스파제는 그들의 기질 인식(19,20)에서 가소성을 갖는 것으로 보인다. 인식 서열은 단백질 도메인과 연관되지 않는다(표 1). 그러나 테트라펩타이드 서열 DEVD는 카스파제-3 및 카스파제-7 활성20,21을 검출하는데 사용될 수 있다.
Smac 모방체는 아폽토시스 단백질 (IAP)의 억제제를 표적으로 하는 화합물이다. 암세포의 하위세트에서 Smac 모방체의 사용은 세포가 TNF-유도된 세포 사멸에 민감해지게 한다(22). 1차 대식세포에서, Smac 모방체는 TNF23,24의 외인성 첨가 없이 세포 사멸을 유발한다. Smac 모방체-유도된 분해에 의한 cIAP1의 손실은 TNF의 생산을 초래한다. 카스파아제 활성이 검출되면 세포가 괴사에 의해 죽지 않고 사멸 방식으로 죽었다는 것을 의미합니다. 이 방법에서, 절단된 DEVD 기질의 검출은 카스파제-3/카스파제-7 활성을 확인하는 데 사용된다. 세포 사멸을 확인하기 위한 추가 실험은이전에 24일에 발표되었습니다.
프로토콜
본 연구는 취리히 대학의 동물 윤리위원회의 승인과 지침에 따라 수행되었습니다 (#ZH149/19). 특정 병원체가 없는(SPF) 조건에서 사육되고 사육된 8-16주 된 수컷 C57Bl/6J 마우스를 본 연구에 사용했습니다. 온전한 뼈는 2% 열 불활성화 태아 소 혈청(FBS)과 함께 멸균 행크 완충 식염수(HBSS)의 얼음 위에 보관할 수 있습니다. 골수는 분화 당일에마우스 25 의 대퇴골과 경골로부터 수집하였다. 카스파제 활성을 평가하기 위한 두 가지 방법 모두 1차 및 형질전환 둘 다를 포함하는 다른 세포 유형에 사용될 수 있다.
1. 골수 유래 대식세포(BMDM) 분화
알림: 조직 배양 층류 후드의 모든 단계를 수행하고 멸균 무균 기술을 사용하십시오.
- 21G 바늘로 1mL 주사기를 준비하십시오.
- 5mL 튜브에 HBSS + 2% FBS 15mL를 추가합니다.
- 멸균 집게를 사용하여 대퇴골을 절제하고 바늘을 대퇴골 구멍에 삽입하십시오. 대퇴골을 HBSS + 2% FBS에 넣고 뼈가 하얗게 될 때까지 골수를 씻어냅니다. 같은 방법으로 경골을 플러시하십시오. 용액을 계속 세척하여 단세포 현탁액을 수득한다.
- 단일 셀 현탁액을 실온(RT)에서 4분 동안 200 x g 로 원심분리합니다.
- 진공 흡인기를 사용하여 상청액을 제거합니다. 튜브를 두드려 펠릿을 부드럽게 다시 매달아 놓습니다. 1mL의 적혈구 용해 완충액( 재료 표 참조)을 추가하고 P1,000 피펫으로 부드럽게 혼합합니다. RT에서 1 분 동안 배양하십시오.
- HBSS + 2% FBS 10mL를 추가하고 RT에서 4분 동안 200 x g 로 원심분리합니다.
- 상층액을 제거하고, 10 mL의 골수 유래 대식세포(BMDM) 배양액에 재현탁시킨다.
참고: BMDM 배양 배지는 10% FBS, 20ng/ml M-CSF, 페니실린(50U/mL) 및 스트렙토마이신(50μg/mL)이 첨가된 저포도당 DMEM으로 구성됩니다( 재료 표 참조). 대안적으로, 20% L929 조건화 배지가 M-CSF를 대체할 수 있다. - BMDM 배양 배지 15mL를 15cm 페트리 접시 2개에 추가합니다. 각 플레이트에 5mL의 단일 셀 용액을 추가합니다.
알림: 조직 배양 처리된 플레이트를 사용하지 마십시오. 조직 배양-처리된 플레이트는 분화를 제한한다. - 접시를 37 ° C, 5 % CO2에서 6 일 동안 두십시오.
알림: BMDM은 5-7 일 후에 수확 할 수 있습니다. 분화를 위한 더 긴 배양 시간은 증가된 항-아폽토시스 단백질 발현을 유도한다26.
2. 세포의 수확, 파종 및 처리
알림: 조직 배양 층류 후드의 모든 단계를 수행하고 멸균 무균 기술을 사용하십시오. 완전히 분화된 대식세포가 플레이트에 부착되어 쉽게 분리할 수 있으며 부유 세포는 버릴 수 있습니다. 인산염 완충 식염수 (PBS)는Ca2+ 및 Mg2+의 유무에 관계없이 사용할 수 있습니다.
- 6일 배양 후, 흡인기를 사용하여 플레이트로부터 부유 세포 및 배지를 제거한다.
- 각 15cm 플레이트에 5mL의 PBS를 추가합니다. 흡인기를 사용하여 플레이트에서 PBS를 제거합니다.
- 각 플레이트에 2mL의 트립신( 재료 표 참조)을 추가합니다. 플레이트를 부드럽게 두드려 세포가 제거 될 때까지 플레이트를 배양하십시오. BMDM 배양 배지 5mL를 취하여 플레이트에서 세포를 수확합니다.
- 두 번째 15 cm 플레이트로 옮기고, 플레이트로부터 세포를 수확한다. 플레이트에서 세포 현탁액을 50mL 튜브로 제거합니다. BMDM 배양 배지 5mL를 추가로 취하고 두 플레이트를 모두 세척하여 모든 세포가 수집되었는지 확인합니다. 세포 현탁액을 동일한 50mL 튜브에 넣습니다.
- 세포 현탁액 10μL를 취하고, 트리판 블루로 1:1 희석을 사용하여 혈구계를 사용하여 계수한다.
참고: 자동 세포 카운터는 대식세포의 크기에 맞게 보정할 때도 사용할 수 있습니다. - 1 x 106 cells/mL의 밀도로 대식세포를 시드합니다. 6웰 플레이트에서 2 x 106 세포/웰로 시딩된 BMDM은 약 2mg/mL의 총 단백질을 제공합니다. 치료 전에 세포가 최소 6시간 동안 플레이트에 부착되도록 합니다.
참고: 다른 세포 유형의 경우 최적 농도를 결정해야 합니다. - 대식세포를 Smac 모방체(화합물 A, 재료 표 참조)22 에서 250nM 및 500nM에서 16시간 동안 처리합니다.
참고: 분석이 작동하는지 확인하기 위해 세포자멸사 및 caspase-3 절단을 유도하는 양성 대조군을 포함합니다. 일반적인 아폽토시스 유도제는 스타우로스포린 및 에토포시드를 포함한다. 많은 세포주가 세포 사멸을 겪기 위해서는 16 시간의 자극 동안 0.1-10 μM이면 충분합니다.
3. 처리된 세포로부터 세포 용해물 준비
알림: 이 단계는 얼음에서 수행해야 하며 시약과 재료는 사전 냉각되어야 합니다.
- 처리 된 세포가 들어있는 플레이트를 얼음 위로 옮깁니다. 세포 배양물로부터 배지를 1.5mL 튜브로 수집하고, 4°C에서 5분 동안 300 x g 에서 원심분리하고, 배지를 흡인하고, 튜브를 얼음 위에 놓는다. 이렇게하면 플레이트에서 분리 된 세포를 수집 할 수 있습니다.
- 세포를 세척하기 위해 세포 배양 접시에 차가운 PBS 1mL를 첨가하고 모든 PBS를 흡인합니다. 100μL의 트립신을 세포에 추가합니다 (6 웰 접시로 작업하는 경우). 트립신이 플레이트에서 세포를 들어 올려 1.5mL 튜브에 모으도록합니다. 차가운 PBS 1mL를 사용하여 모든 세포가 수집되었는지 확인합니다.
참고: 현탁 세포로 작업하는 경우 배지와 세포를 1.5mL 튜브로 부드럽게 옮깁니다. - 세포를 300 x g 에서 4°C에서 5분 동안 원심분리합니다. 상청액을 제거하고, 100 μL DISC 용해 완충액 (150 mM 염화나트륨, 2 mM EDTA, 1% 트리톤 X-100, 10% 글리세롤, 20 mM 트리스, pH 7.5, 물질 표 참조)에 재현탁시킨다.
- 샘플을 얼음 위에서 20분 동안 배양합니다.
- 용해물을 ~12,000 x g 에서 4°C에서 10분 동안 원심분리하여 불용성 분획을 펠릿화합니다.
- 25μL의 용해물을 caspase-3/caspase-7 활성 분석을 위해 바닥이 평평한 흰색 96웰 플레이트로 옮깁니다(단계 5).
알림: 펠릿을 방해하지 마십시오. 이것은 세포 용해물의 불용성 분획입니다. - 남은 용해물 10μL를 비신코닌산(BCA) 분석을 위해 바닥이 평평한 투명한 96웰 플레이트로 옮깁니다(단계 4). 이것은 샘플의 정규화에 사용됩니다.
- 추가 처리를 위해 두 판을 얼음 위에 보관하십시오.
알림: 이 단계에서 플레이트는 접착 커버로 밀봉하고 -20°C에서 약 4주 동안 보관할 수 있습니다.
4. BCA 분석을 이용한 단백질 정량
참고: 다른 시약 또는 분석을 사용하여 각 샘플의 단백질 양을 정량화할 수 있습니다. 집단 기반 분석에서, 샘플은 분석에 사용된 단백질의 양을 정규화함으로써 비교될 수 있다.
- 소 혈청 알부민(BSA)을 사용하여 0 μg/mL에서 2,000 μg/mL(0 μg/mL, 25 μg/mL, 125 μg/mL, 250 μg/mL, 500 μg/mL, 750 μg/mL, 100 μg/mL, 1,500 μg/mL, 2,000 μg/mL) 사이의 표준 단백질 농도를 준비합니다. 용해 버퍼로만 블랭크를 준비하십시오.
- 10μL의 각 표준물질을 3.7단계에서 언급한 샘플이 들어 있는 평평한 바닥의 96웰 플레이트에 추가합니다.
- BCA 시약 1과 BCA 시약 2를 50:1 비율로 혼합합니다( 재료 표 참조). 200μL의 혼합 BCA 시약을 각 시료와 표준물질에 첨가합니다.
- 37°C에서 30분 동안 배양합니다.
- 형광 측정 기기에서 562nm에서 흡광도를 측정하고 표준 곡선으로 단백질 농도를 정량화합니다.
5. 카스파제-3/카스파제-7 활성에 대한 인구 기반 분석
알림: 플레이트의 세포 용해물이 3시간 이상 얼음 위에 놓이지 않도록 하십시오. 카스파아제 활성이 존재하면 샘플이 얼음 위에 있음에도 불구하고 시간이 지남에 따라 증가합니다. 샘플이 얼었다면 얼음에서 해동하고 용해물이 해동되면 즉시 진행하십시오.
- 형광 측정 기기( 재료 표 참조)를 시작하고 기계를 37°C로 가열합니다. 언급 된대로 스크립트를 준비하십시오.
- 반응의 역학을 결정하기 위해 40 분 동안 매분마다 개별 판독을 수행하십시오.
- 여기는 360nm로 설정하고 방출은 465nm로 설정합니다. 우물 당 10 번 깜박이면 충분합니다.
- 재조합 카스파제-3의 양성 대조군을 준비합니다( 재료 표 참조). 1 U의 재조합 카스파제-3 효소를 50 μL의 용해 완충액(튜브 1)에 혼합합니다. 25μL의 용해 완충액을 추가 3개의 튜브에 추가합니다. 튜브 1에서 튜브 2로 25 μL를 옮깁니다. 피펫팅으로 혼합합니다.
- 튜브 3과 튜브 4에 대해 반복합니다. 튜브 5에는 50μL의 용해 완충액만 포함됩니다. 3.6단계에서 언급한 caspase-3 활성 분석을 위해 바닥이 평평한 흰색 96웰 플레이트에 각 표준물질 25μL를 추가합니다.
- 얼음 위에서 카스파아제 활성 분석을 위한 마스터 반응 혼합물을 준비합니다. 한 가지 반응의 경우, 50 μL의 2x 카스파아제 절단 완충액(0.2M HEPES pH 7.5; 20% 수크로스 또는 PEG; 0.2% CHAPS), 5μL의 1mM DEVD-AMC(카스파제-3 테트라펩타이드 기질), 2μL의 500mM DTT, 및 18μL의 탈이온수를 혼합한다( 재료 표 참조).
- 각 시료와 표준물질에 75μL의 반응 혼합물을 첨가하여 100μL의 총 반응 부피를 얻습니다.
- 즉시 단계 5.1에서 설정한 형광 측정 기기를 사용하여 형광을 측정합니다.
- 각 형광 측정에 대해 샘플의 형광에서 블랭크(용해 버퍼만 해당)에 대한 형광 판독값을 뺍니다. 샘플의 단백질 농도로 나누어 판독값을 정규화합니다(4.5단계에서 계산)27:
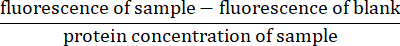
- y축에서 정규화된 형광의 기울기와 x축의 시간을 결정하여 카스파제 활성의 속도를 계산합니다.
6. 카스파제-3/카스파제-7 활성에 대한 단일 세포 분석(유세포 분석 분석)
- 섹션 2에 설명된 대로 셀을 시드합니다.
- 세포를 5mL 폴리스티렌 튜브에 수확합니다. 부착 세포로 작업하는 경우 배지를 5mL 튜브에 수집합니다. 세포 배양 플레이트에 차가운 PBS 1mL를 추가하고 PBS를 5mL 튜브에 수집합니다. 트립신을 세포에 첨가하십시오 (6 웰 접시로 작업하는 경우 100 μL). 트립신이 플레이트에서 세포를 들어 올리고 5mL 튜브에 모이도록 합니다. 차가운 PBS 1mL를 사용하여 모든 세포가 수집되었는지 확인합니다.
참고: 현탁 세포로 작업하는 경우 배지와 세포를 5mL 튜브로 부드럽게 옮깁니다. - 샘플을 300 x g 에서 5분, 4°C 동안 원심분리합니다. 진공 흡인기를 사용하여 상청액을 제거합니다.
- 염색 혼합물을 준비하십시오. 최적의 염색 농도는 50 μL에서 1 x 10 6-2 x 106 세포입니다. 제조업체의 지침에 따라 형광 생성 기질을 희석합니다(재료 표, 유세포 분석 참조). 1 μL의 스톡 기질을 취하고, 150 μL의 PBS로 희석한다. 샘플당 50uL를 추가합니다.
- 샘플을 37 ° C에서 30 분 동안 빛으로부터 보호하고 15 분마다 혼합합니다.
- 이 연구에 사용된 유세포분석기를 사용하여 640nm에서 적색 레이저를 사용하고 675/25nm를 사용하여 검출합니다. 염색되지 않은 대조군 샘플을 먼저 실행하고 원하는 모집단의 최소 10,000개의 이벤트를 획득합니다. FSC-A 및 SSC-A 점도표에서 게이트(P1)를 사용하여 파편을 제외합니다.
- P1 게이트의 이벤트를 표시하고 카스파제 기질(y축)에 대한 검출을 표시하는 히스토그램을 사용하여 중간 형광 강도(MFI)를 결정합니다.
참고: 이 방법에 설명된 카스파아제 기질은 590nm에서 여기가 필요하고 628nm에서 방출됩니다.
- P1 게이트의 이벤트를 표시하고 카스파제 기질(y축)에 대한 검출을 표시하는 히스토그램을 사용하여 중간 형광 강도(MFI)를 결정합니다.
결과
1차 마우스 대식세포는 6일 동안 분화되었다. 6일 후, 세포를 수확하고, 계수하고, 시딩하였다. 다음의 처리가 사용되었다: 무처리 및 Smac 모방체 (화합물 A)22를 250 nM 및 500 nM에서 16시간 동안 사용하였다(도 1). 실험은 caspase-3/caspase-7 활성화가 집단 기반 분석 또는 유세포분석을 사용한 단일 세포 분석에 의해 평가될 수 있도록 이중으로 수행되었습니다.
세포 용해물의 단백질 농도는 BCA 분석법을 이용하여 정량하였다(보충 표 1). 이는 caspase-3/caspase-7 활성 분석에 사용되는 단백질의 양이 샘플 간에 동일한지 확인하기 위해 필요합니다. 이 인구 기반 분석에서 데이터는 두 가지 방법으로 제시 될 수 있습니다. 첫 번째는 조정된 형광(y축) 대 시간(x축)을 플로팅하여 동역학을 보여주는 것입니다(그림 2A). 또는 기울기를 계산하여 샘플을 직접 비교할 수 있습니다(그림 2B). 500 nM Smac 모방 처리시 기울기의 증가는 다중 비교를 갖는 통상의 일원 분산 분석에 기초하여 유의하지 않았다 (Dunnett의 다중 비교 시험28).
유세포분석을 이용한 카스파제-3/카스파제-7 활성의 분석을 위해, 세포 및 상청액을 수확하였다. 염색되지 않은 세포 또는 형광을 뺀 세포는 처리되지 않은 세포뿐만 아니라 음성 대조군으로 사용되었다. 유동 세포측정에 의해 수집된 세포의 히스토그램은 처리되지 않은 세포와 비교하여 Smac 모방체로 처리된 세포에 대한 형광의 이동을 나타내었다 (도 2C). 데이터는 중앙값 형광 강도(그림 2D) 또는 처리되지 않은 세포에 대한 접힘 변화(그림 2E)로 표시될 수 있습니다.

그림 1: 연구의 순서도 . (A) 대퇴골과 경골은 C57Bl/6 마우스에서 절제하였다. 뼈를 6 일 동안 20 ng / mL M-CSF로 플러싱하고 분화시켰다. (b) 6일째에, 대식세포를 수확하고, 치료를 위해 재시딩하였다. 한 세트의 세포를 용해물에 대해 수확하고, 플루오로겐 활성에 의해 평가하고, 다른 세트를 수확하고, 플루오로겐 기질과 함께 인큐베이션하고, 유세포분석에 의해 평가하였다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
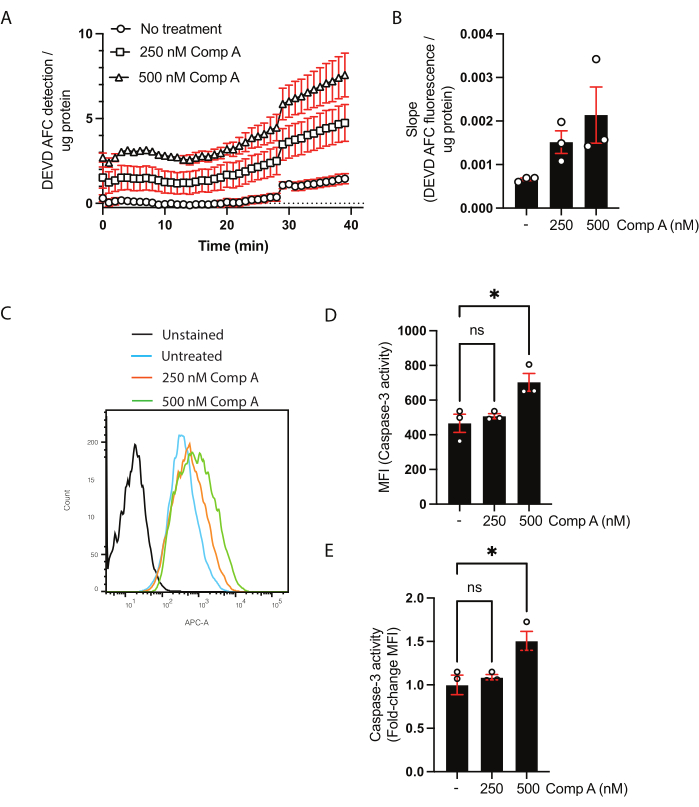
그림 2: 유세포분석에 의한 카스파제-3/카스파제-7 활성 및 기질 절단에 대한 역학 분석. (A,B) 유세포 분석에 의한 카스파제-3/카스파제-7 활성(C-E) 및 기질 절단에 대한 동역학 분석의 대표 데이터. 대식세포를 16시간 동안 2가지 농도의 Smac 모방체 (화합물 A; 250 nM 및 500 nM)로 처리하였다. (A) 시간 경과에 따른 절단된 DEVD AFC 기질의 검출. 데이터는 샘플 내의 단백질 농도로 정규화되었다. (b) 각 샘플에 대한 DEVD AFC의 절단 속도(slope)를 미처리 기울기로 정규화하고, 미처리 세포에 걸친 폴드 변화로서 제시하였다. (c) 카스파제-3 기질과 함께 배양된 세포의 유세포 히스토그램. (D,E) MFI 비교 및 처리되지 않은 샘플과 비교한 MFI에서의 폴드 변화. 각 데이터 포인트는 독립적인 샘플을 나타냅니다. 평균± 평균의 표준 오차가 표시됩니다. *p < 일원 분산 분석 및 다중 비교 검정(Dunnett의 다중 비교 검정)을 사용한 0.05입니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
| 카스파세 | 종 | 기판 서열 | 단백질 도메인 | ||
| 카스파제-1 | Hs, Mm | (승/패) 증권 시세 표시기 | CARD, 대형 도메인, 소형 촉매 도메인 | ||
| 카스파제-2 | Hs, Mm | 덱스드 | CARD, 대형 도메인, 소형 촉매 도메인 | ||
| 카스파제-4 | 증권 시세 표시기 | (승/패) 증권 시세 표시기 | CARD, 대형 도메인, 소형 촉매 도메인 | ||
| 카스파제-5 | 증권 시세 표시기 | (승/패) 증권 시세 표시기 | CARD, 대형 도메인, 소형 촉매 도메인 | ||
| 카스파제-9 | Hs, Mm | (I/V/L) E (H / T) D | CARD, 대형 도메인, 소형 촉매 도메인 | ||
| 카스파제-11 | 밀리미터 | (승/패) 증권 시세 표시기 | CARD, 대형 도메인, 소형 촉매 도메인 | ||
| 카스파제-12 | 밀리미터 | 아타드 | CARD, 대형 도메인, 소형 촉매 도메인 | ||
| 카스파제-8 | Hs, Mm | (I/V/L) E (H / T) D | DED, 대형 도메인, 소형 촉매 도메인 | ||
| 카스파제-10 | 증권 시세 표시기 | (I/V/L) E (H / T) D | DED, 대형 도메인, 소형 촉매 도메인 | ||
| 카스파제-3 | Hs, Mm | 덱스드 | 큰 도메인, 작은 촉매 도메인 | ||
| 카스파제-6 | Hs, Mm | (I/V/L) E (H / T) D | 큰 도메인, 작은 촉매 도메인 | ||
| 카스파제-7 | Hs, Mm | 덱스드 | 큰 도메인, 작은 촉매 도메인 | ||
| 카스파제 -14 | HS, 밀리미터 | (승/패) 증권 시세 표시기 | 큰 도메인, 작은 촉매 도메인 | ||
| 카드 | 카스파제 활성화 및 모집 도메인 | ||||
| 증권 시세 표시기 | 데스 이펙터 도메인 | ||||
| 증권 시세 표시기 | 호모 사피엔스 | ||||
| 밀리미터 | 무스 머슬러스 | ||||
표 1: 카스파제의 기질 특이성 및 단백질 도메인. 이 표는 McStay et al.20; 샬리니 외.3; 그리고 반 옵덴보쉬와 람칸피4.
보충 표 1: DEVD 동역학 분석. 이 표를 다운로드하려면 여기를 클릭하십시오.
토론
이 방법에서, 플루오로 생성 기질은 카스파제 -3 / 카스파 제 -7 활성을 측정하기 위해 집단 기반 분석 또는 단일 세포 분석에 사용됩니다. 두 방법 모두 기질의 절단에 기초한 정량적 방식으로 카스파제 활성을 측정한다. 한 가지 장점은 수많은 샘플에 이러한 방법을 활용할 수 있다는 것입니다. 이들 방법에 의해, 카스파제-3/카스파제-7 활성은 Smac 모방체로 처리된 1차 대식세포에서 검출된다.
인구 기반 형광 분석의 중요한 측면은 용해에서 형광 판독까지의 시간입니다. 샘플은 절차 내내, 특히 분석을 "판독"하기 전에 얼음 위에 보관해야 합니다. 이것은 기질의 조기 절단 및 형광을 방지합니다. 모집단 기반 분석을 사용하면 최적화가 덜 필요할 수 있습니다. 분석에 사용되는 단백질의 양이 정규화되어 샘플을 직접 비교할 수 있습니다. 한 가지주의 할 점은 세포 사멸의 후기 단계에서 총 단백질 양이 감소한다는 것입니다. 따라서, 카스파제 활성의 검출이 불가능할 수 있다. 이 문제를 피하기 위해 다른 동역학 또는 다른 치료 용량이 권장됩니다. 또한, 다른 소프트웨어를 사용하여 이 방법에 설명된 소프트웨어 외에 카스파제 활성의 속도를 정확하게 평가할 수 있습니다.
유세포 분석 분석의 경우, 집단을 자신있게 게이트하기에 충분한 이벤트 또는 세포가 필요합니다. 또한, 유동 기반 분석에서 더 많은 최적화가 세포 수에 대한 기질의 최적 비율을 달성하기 위해 요구될 수 있다. 그러나 유세포분석을 사용하면 이 방법은 세포 유형 식별을 위한 세포 표면 마커와 같은 추가 파라미터를 측정하는 데 적합합니다.
집단 및 단일 세포 방법 모두 다른 카스파제에 사용할 수 있습니다. 그러나 인식 시퀀스는 다른 카스파제에 대해 덜 차별된다는 점을 기억하는 것이 중요합니다. 따라서, 카스파제 활성을 위한 다른 방법들이 사용되어야 한다. 여기에는 카스파제 활성의 억제, 특정 카스파제의 CRISPR 또는 녹다운, 및 알려진 기질의 절단을 검출하기 위한 웨스턴 블로팅이 포함됩니다.
카스파제 활성을 검출하기 위한 하나의 대안적인 방법은 타임랩스 이미징이다. 동일한 투과성 카스파제 기질을 아넥신 V와 같은 다른 생존 마커와 함께 사용하여 세포 사멸의 동역학에 대한 정보를 제공할 수 있습니다. 이미징은 또한 카스파아제 활성과 세포 생존을 분리하여 세포 집단에서 치사량의 카스파아제 활성을 검출할 수 있습니다. 카스파제-3/카스파제-7의 비-살상 기능은 선천성 면역 세포(29)에서의 항바이러스 조절, 특히 미토콘드리아 DNA 방출(15,16)을 통한 I형 IFN의 활성화와 관련된다. 따라서, 카스파제 활성을 측정하기 위한 이들 분석은 세포 사멸의 상이한 모드를 확인하는데 중요하며, 비-세포 사멸 기능을 평가하는데 유용할 수 있다.
공개
저자는 공개 할 이해 상충이 없습니다.
감사의 말
WWW는 Clöetta Medical Research Fellow 보조금, S.R.은 CanDoc UZH Forschungskredit, J.T.는 중국 장학금 위원회의 지원을 받습니다.
자료
| Name | Company | Catalog Number | Comments |
| 1.5 mL microfuge tubes | Sarstedt | 72.706.400 | |
| 15 cm Petri plates | Sarstedt | 82.1184.500 | |
| 37 degree incubator shaker | IKA shaker KS 4000i | 97014-816 | distributed by VWR |
| 6-well cell culture dish | Sarstedt | 83.392 | |
| 96 well flat bottom, white polystyrene, non-sterile | Sigma | CLS3600 | |
| 96 well flat plate | Sarstedt | 82.1581 | |
| Ac-DEVD-AFC | Enzo Life Sciences | ALX-260-032-M005 | Caspase-3 substrate |
| BD Fortessa | BD | any flow cytometer with the appropriate excitation and emission detector will work | |
| b-glycerolphosphate | Sigma | G9422-10G | |
| caspase-3 recombinant | Enzo Life Sciences | ALX-201-059-U025 | |
| CHAPS | Sigma | 1.11662 | |
| DMEM, low glucose, pyruvate | Thermoscientific | 31885023 | |
| DMSO | Sigma | D8418-250ML | |
| EDTA | Sigma | 03685-1KG | |
| EGTA | Sigma | 324626-25GM | |
| Etoposide | MedChem Express | HY-13629 | |
| FBS | Thermoscientific | 26140 | |
| Flow cytometry tubes | Falcon | 352008 | |
| Flowjo | Flowjo | A license in required but any program that can analyze .fcs files will suffice | |
| Glycerol | Sigma | G5516-500ML | |
| HEPES | Sigma | H4034 | |
| Magic Red caspase-3/7 assay kit; flow cytometry or imaging | Immunochemistry Technologies | 935 | |
| M-CSF | ebioscience | 14-8983-80 | now a subsidiary of Thermoscientific |
| M-Plex | Tecan | any fluorometric reader will work with the appropriate excitation and emission detectors | |
| NaCl | Roth | 3957.1 | |
| PBS pH 7.4 | Thermoscientific | 10010023 | |
| Penicillin-Streptomycin-Glutamine (100X) | Thermoscientific | 10378016 | |
| Pierce BCA Protein Assay Kit | ThermoFisher Scientific | 23225 | protein concentration assay |
| protease inhibitors | Biomol | P9070.100 | |
| Smac mimetic, Compound A | Tetralogics | also known as 12911; structure shown in supplementary figures of Vince et al., Cell 2007 | |
| Sodium Fluoride | Sigma | S7920-100G | |
| sodium orthovanadate | Sigma | S6508-10G | |
| sodium pyrophosphate | Sigma | P8010-500G | |
| Staurosporine | MedChem Express | HY-15141 | |
| sucrose | Sigma | 1.07687 | |
| Tris Base | Sigma | T1503-1KG | |
| Triton X100 | Sigma | T8787-50ML | |
| TrypLE | Thermoscientific | A1285901 | In the protocol, it is listed as Trypsin |
참고문헌
- Ramirez, M. L. G., Salvesen, G. S. A primer on caspase mechanisms. Seminars in Cell and Developmental Biology. 82, 79-85 (2018).
- Nicholson, D. W., Thornberry, N. A. Caspases: Killer proteases. Trends in Biochemical Sciences. 22 (8), 299-306 (1997).
- Shalini, S., Dorstyn, L., Dawar, S., Kumar, S. Old, new and emerging functions of caspases. Cell Death and Differentiation. 22 (4), 526-539 (2014).
- Van Opdenbosch, N., Lamkanfi, M. Caspases in cell death, inflammation, and disease. Immunity. 50 (6), 1352-1364 (2019).
- Kesavardhana, S., Malireddi, R. K. S., Kanneganti, T. -. D. Caspases in cell death, inflammation, and pyroptosis. Annual Review of Immunology. 38, 567-595 (2020).
- Fu, T. -. M., et al. Cryo-EM structure of caspase-8 tandem DED filament reveals assembly and regulation mechanisms of the death-inducing signaling complex. Molecular Cell. 64 (2), 236-250 (2016).
- Jiang, X., Wang, X. Cytochrome c promotes caspase-9 activation by inducing nucleotide binding to Apaf-1. Journal of Biological Chemistry. 275 (40), 31199-31203 (2000).
- Christgen, S., Place, D. E., Kanneganti, T. -. D. Toward targeting inflammasomes: Insights into their regulation and activation. Cell Research. 30 (4), 315-327 (2020).
- Shi, J., et al. Cleavage of GSDMD by inflammatory caspases determines pyroptotic cell death. Nature. 526 (7575), 660-665 (2015).
- Sborgi, L., et al. GSDMD membrane pore formation constitutes the mechanism of pyroptotic cell death. EMBO Journal. 35 (16), 1766-1778 (2016).
- Rühl, S., et al. ESCRT-dependent membrane repair negatively regulates pyroptosis downstream of GSDMD activation. Science. 362 (6417), 956-960 (2018).
- Declercq, W., Takahashi, N., Vandenabeele, P. Dual face apoptotic machinery: From initiator of apoptosis to guardian of necroptosis. Immunity. 35 (4), 493-495 (2011).
- Newton, K., et al. Cleavage of RIPK1 by caspase-8 is crucial for limiting apoptosis and necroptosis. Nature. 574, 428-431 (2019).
- Fritsch, M., et al. Caspase-8 is the molecular switch for apoptosis, necroptosis and pyroptosis. Nature. 575, 683-687 (2019).
- White, M. J., et al. Apoptotic caspases suppress mtDNA-induced STING-mediated type I IFN production. Cell. 159 (7), 1549-1562 (2014).
- Rongvaux, A., et al. Apoptotic caspases prevent the induction of type I interferons by mitochondrial DNA. Cell. 159 (7), 1563-1577 (2014).
- Nakajima, Y. -. I., Kuranaga, E. Caspase-dependent non-apoptotic processes in development. Cell Death and Differentiation. 24, 1422-1430 (2017).
- Kumar, S., Dorstyn, L., Lim, Y. The role of caspases as executioners of apoptosis. Biochemical Society Transactions. 50 (1), 33-45 (2022).
- Agniswamy, J., Fang, B., Weber, I. T. Plasticity of S2-S4 specificity pockets of executioner caspase-7 revealed by structural and kinetic analysis. FEBS Journal. 274 (18), 4752-4765 (2007).
- McStay, G. P., Salvesen, G. S., Green, D. R. Overlapping cleavage motif selectivity of caspases: implications for analysis of apoptotic pathways. Cell Death and Differentiation. 15 (2), 322-331 (2008).
- Thornberry, N. A., et al. A combinatorial approach defines specificities of members of the caspase family and granzyme B. Functional relationships established for key mediators of apoptosis. Journal of Biological Chemistry. 272 (29), 17907-17911 (1997).
- Vince, J. E., et al. IAP antagonists target cIAP1 to induce TNFalpha-dependent apoptosis. Cell. 131 (4), 682-693 (2007).
- McComb, S., et al. cIAP1 and cIAP2 limit macrophage necroptosis by inhibiting Rip1 and Rip3 activation. Cell Death and Differentiation. 19 (11), 1791-1801 (2012).
- Wong, W. W. -. L., et al. cIAPs and XIAP regulate myelopoiesis through cytokine production in an RIPK1- and RIPK3-dependent manner. Blood. 123 (16), 2562-2572 (2014).
- Liu, X., Quan, N. Immune cell isolation from mouse femur bone marrow. Bio-Protocol. 5 (20), e1631 (2015).
- Lin, H., Chen, C., Chen, B. D. Resistance of bone marrow-derived macrophages to apoptosis is associated with the expression of X-linked inhibitor of apoptosis protein in primary cultures of bone marrow cells. Biochemical Journal. 353 (Pt 2), 299-306 (2001).
- . Caspase activity assay buffer. Cold Spring Harbor Protocols. , (2015).
- Mackridge, A., Rowe, P. One-way analysis of variance (ANOVA) - Including Dunnett's and Tukey's follow up tests. Practical Approach to Using Statistics in Health Research: From Planning to Reporting. , 93-103 (2018).
- Chen, H., Ning, X., Jiang, Z. Caspases control antiviral innate immunity. Cellular and Molecular Immunology. 14 (9), 736-747 (2017).
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기더 많은 기사 탐색
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유