Method Article
Medindo a atividade da caspase usando um ensaio fluorométrico ou citometria de fluxo
Neste Artigo
Resumo
O presente protocolo descreve dois métodos para medir a atividade da caspase através de um substrato fluorogênico usando citometria de fluxo ou um espectrofluorômetro.
Resumo
A ativação das cisteínas proteases, conhecidas como caspases, continua a ser um processo importante em múltiplas formas de morte celular. As caspases são iniciadores críticos e executores da apoptose, a forma mais estudada de morte celular programada. A apoptose ocorre durante os processos de desenvolvimento e é um evento necessário na homeostase tecidual. A piroptose é outra forma de morte celular que utiliza caspases e é um processo crítico na ativação do sistema imunológico através da ativação do inflamassoma, o que resulta na liberação de membros da família da interleucina-1 (IL-1). Para avaliar a atividade da caspase, os substratos-alvo podem ser avaliados. No entanto, a sensibilidade pode ser um problema ao examinar células individuais ou atividade de baixo nível. Demonstramos como um substrato fluorogênico pode ser usado com um ensaio de base populacional ou ensaio de célula única por citometria de fluxo. Com controles adequados, diferentes sequências de aminoácidos podem ser usadas para identificar quais caspases estão ativas. Usando esses ensaios, a perda simultânea dos inibidores das proteínas da apoptose após a estimulação do fator de necrose tumoral (TNF) foi identificada, o que induz principalmente a apoptose em macrófagos, em vez de outras formas de morte celular.
Introdução
As caspases estão envolvidas em várias formas de morte celular programada. A apoptose é a forma mais estudada de morte celular programada e está associada à atividade da caspase1. Todas as caspases possuem uma subunidade catalítica grande e pequena. A caspase-1, a caspase-4, a caspase-5, a caspase-9 e a caspase-11 possuem um domínio de ativação e recrutamento da caspase (CARD), e a caspase-8 e a caspase-10 contêm domínios efetores de morte (DED)2,3,4,5 (Tabela 1). A apoptose pode ser iniciada por duas vias principais: a via extrínseca e a via intrínseca. A via apoptótica extrínseca é desencadeada por receptores de morte, que fazem parte da superfamília do fator de necrose tumoral (TNFSF). Os receptores de óbito possuem domínios DED, facilitando a atividade da caspase-86. A via apoptótica intrínseca envolve a ativação da caspase-9 após a formação do apoptossomo, necessitando da liberação do citocromo c e Apaf-17. A ativação da caspase iniciadora, caspase-8 ou caspase-9, leva à clivagem e subsequente ativação das caspases executoras, que são caspase-3, caspase-6 e caspase-7. Identificar que as caspases do carrasco estão ativas indica que as células estão passando por apoptose, e essa ativação é considerada um fator importante na definição do modo de morte celular.
A ativação da caspase também é um momento crítico para regular a inflamação e a indução de formas alternativas de morte celular programada. Por exemplo, a ativação da caspase-1 leva à maturação de citocinas pró-inflamatórias da família da interleucina-18. A liberação e ativação de citocinas dessa família, particularmente IL-1β e IL-18, resultam da clivagem da gasdermina D e da formação de poros na membrana plasmática 9,10. O reparo inadequado da membrana dos poros da gasdermina D pode resultar em um tipo de morte celular conhecida como piroptose11. Além disso, a atividade da caspase-8 resulta na inibição de uma morte celular independente da caspase, conhecida como necroptose12. A serina/treonina proteína quinase 1 (RIPK1) que interage com o receptor é um dos fatores críticos na necroptose e na condução da inflamação regulada pela NF-kB. Modelos mostraram que a RIPK1 é clivada pela caspase-8, resultando na limitação da sinalização NF-kB, apoptose e necroptose13,14. Portanto, identificar a atividade de diferentes caspases pode ajudar na compreensão da inflamação resultante e da modalidade de morte celular.
Independentemente da função das caspases na regulação das modalidades de morte celular, a atividade da caspase também pode regular outras famílias de citocinas, como o interferon (IFN), em resposta à infecção15,16. Além disso, as caspases estão envolvidas em funções de morte não celular, incluindo decisões de destino celular, reparo e regeneração tecidual, tumorigênese através do reparo do DNA e função de sinapse neuronal. Acredita-se que a atividade das caspases nesses papéis não letais seja limitada pela localização celular e pela quantidade de caspases. Portanto, quantificar o nível de atividade da caspase pode muito bem definir se uma célula sofre morte celular ou se a caspase desempenha um papel em uma função de morte não celular 4,17,18.
A atividade da caspase pode ser avaliada por múltiplos métodos. Western blotting para caspases clivadas e seus substratos tem sido usado como um indicador de atividade, mas esses ensaios são qualitativos na melhor das hipóteses. Para determinar se a atividade da caspase está associada à morte celular, uma medida quantitativa é ideal. Uma vez que as caspases clivam substratos em um local de reconhecimento composto por quatro aminoácidos, métodos colorimétricos, de luminescência ou fluorométricos foram desenvolvidos. No entanto, as caspases parecem ter plasticidade no reconhecimento do substrato 19,20. A sequência de reconhecimento não está associada aos domínios proteicos (Tabela 1). A sequência tetrapeptídica DEVD, no entanto, pode ser utilizada para detectar a atividade da caspase-3 e da caspase-720,21.
Smac miméticos são compostos que visam os inibidores das proteínas da apoptose (IAPs). O uso de miméticos de Smac em um subconjunto de células cancerígenas faz com que as células se tornem sensíveis à morte celular induzida pelo TNF22. Em macrófagos primários, os miméticos de Smac causam morte celular sem a adição exógena de TNF23,24. A perda de cIAP1 pela degradação induzida por mimética do Smac resulta na produção de TNF. Se a atividade da caspase for detectada, isso significa que as células não morreram por necroptose, mas de maneira apoptótica. Neste método, a detecção do substrato DEVD clivado é usada para identificar a atividade da caspase-3/caspase-7. Outros experimentos para confirmar a morte celular apoptótica foram publicados anteriormente24.
Protocolo
O presente estudo foi realizado com a aprovação e seguindo as diretrizes do comitê de ética animal da Universidade de Zurique (#ZH149/19). Camundongos machos C57Bl/6J com idades entre 8-16 semanas, criados e alojados em condições específicas livres de patógenos (FPS), foram utilizados para o presente estudo. Os ossos intactos podem ser mantidos no gelo em solução salina tamponada de Hank estéril (HBSS) com soro fetal bovino inativado pelo calor (FBS) a 2%. A medula óssea foi coletada do fêmur e tíbia do camundongo25 no dia da diferenciação. Ambos os métodos para avaliar a atividade da caspase podem ser usados para outros tipos de células, incluindo primárias e transformadas.
1. Diferenciando macrófagos derivados da medula óssea (BMDMs)
NOTA: Execute todas as etapas em um exaustor de fluxo laminar de cultura de tecidos e use técnicas assépticas estéreis.
- Prepare uma seringa de 1 ml com uma agulha de 21 G.
- Adicione 5 mL de HBSS + FBS a 2% a um tubo de 15 mL.
- Usando pinça estéril, pegue um fêmur excisado e insira a agulha na abertura do fêmur. Segurando o fêmur no HBSS + 2% FBS, lave a medula óssea até que o osso esteja branco. Lave a tíbia da mesma maneira. Continue a lavar a solução para obter uma suspensão de célula única.
- Centrifugar a suspensão de célula única a 200 x g durante 4 min à temperatura ambiente (RT).
- Remova o sobrenadante usando um aspirador a vácuo. Toque no tubo para ressuspender suavemente o pellet. Adicione 1 mL de tampão de lise de glóbulos vermelhos (ver Tabela de Materiais) e misture suavemente com uma pipeta P1.000. Incubar no RT por 1 min.
- Adicione 10 mL de HBSS + FBS a 2% e centrifugar a 200 x g por 4 min no RT.
- Remova o sobrenadante e ressuscite em 10 mL de meio de cultura de macrófagos derivados da medula óssea (BMDM).
NOTA: O meio de cultura BMDM consiste em DMEM de baixa glicose com a adição de 10% de FBS, 20 ng/ml de M-CSF, penicilina (50 U/mL) e estreptomicina (50 μg/mL) (ver Tabela de Materiais). Alternativamente, 20% de L929 de meio condicionado pode ser substituído pelo M-CSF. - Adicionar 15 mL de meio de cultura BMDM em duas placas de Petri de 15 cm. Adicionar 5 ml da solução unicelular a cada placa.
NOTA: Não utilize placas tratadas com cultura de tecidos. As placas tratadas com cultura de tecidos limitam a diferenciação. - Coloque os pratos a 37 °C, 5% CO2, durante 6 dias.
NOTA: Os BMDMs podem ser colhidos após 5-7 dias. Tempos de incubação mais longos para diferenciação levam ao aumento da expressão de proteínas antiapoptóticas26.
2. Colheita, semeadura e tratamento de células
NOTA: Execute todas as etapas em um exaustor de fluxo laminar de cultura de tecidos e use técnicas assépticas estéreis. Macrófagos totalmente diferenciados aderem à placa, permitindo fácil separação, enquanto as células flutuantes podem ser descartadas. A solução salina tamponada com fosfato (PBS) pode ser usada com ou sem Ca 2+ e Mg2+.
- Após 6 dias de incubação, remova as células flutuantes e o meio da placa usando um aspirador.
- Adicione 5 mL de PBS a cada placa de 15 cm. Remova o PBS da placa usando um aspirador.
- Adicione 2 mL de tripsina (ver Tabela de Materiais) a cada placa. Incube a placa até que o toque suave da placa desaloje as células. Pegue 5 mL de meio de cultura BMDM e colha as células da placa.
- Transfira para a segunda placa de 15 cm e colha as células da placa. Remova a suspensão celular da placa para um tubo de 50 mL. Tome mais 5 mL de meio de cultura BMDM e lave ambas as placas para garantir que todas as células tenham sido coletadas. Coloque a suspensão celular no mesmo tubo de 50 mL.
- Tome 10 μL da suspensão celular e conte usando um hemacitômetro usando uma diluição de 1:1 com azul de tripano.
NOTA: Contadores automáticos de células também podem ser usados quando calibrados para o tamanho dos macrófagos. - Semeia os macrófagos a uma densidade de 1 x 106 células/mL. BMDMs semeadas a 2 x 10 6 células/poço em uma placa de6 poços fornecem aproximadamente 2 mg/mL de proteína total. Deixe as células aderirem à placa por um período mínimo de 6 h antes do tratamento.
NOTA: Para outros tipos de células, a concentração ideal deve ser determinada. - Trate os macrófagos com Smac mimético (Composto A, ver Tabela de Materiais)22 a 250 nM e 500 nM por 16 h.
NOTA: Inclua um controle positivo para induzir apoptose e clivagem da caspase-3 para garantir que o ensaio esteja funcionando. Os indutores comuns de apoptose incluem estaurosporina e etoposídeo. Para que muitas linhagens celulares sofram apoptose, 0,1-10 μM por 16 h de estimulação é suficiente.
3. Preparação de lisados celulares a partir de células tratadas
NOTA: Esta etapa deve ser feita em gelo, e os reagentes e materiais devem ser pré-resfriados.
- Transfira as placas que contêm as células tratadas para o gelo. Recolher o meio da cultura celular num tubo de 1,5 ml, centrifugar a 300 x g durante 5 min a 4 °C, aspirar o meio e colocar o tubo no gelo. Isso permite a coleta das células que se separaram da placa.
- Adicione 1 mL de PBS frio à placa de cultura celular para lavar as células e aspirar todo o PBS. Adicione 100 μL de tripsina às células (se trabalhar com um prato de 6 poços). Permita que a tripsina levante as células da placa e colete-as no tubo de 1,5 mL. Use 1 mL de PBS frio para garantir que todas as células tenham sido coletadas.
NOTA: Se trabalhar com células de suspensão, transfira suavemente o meio e as células para um tubo de 1,5 ml. - Centrifugar as células a 300 x g durante 5 min a 4 °C. Remova o sobrenadante e ressuscite em tampão de lise DISC de 100 μL (cloreto de sódio 150 mM, EDTA 2 mM, Triton X-100 a 1%, glicerol a 10%, Tris a 20 mM, pH 7,5, ver Tabela de Materiais).
- Incubar as amostras no gelo por 20 min.
- Centrifugar os lisados a ~12.000 x g durante 10 min a 4 °C para pellet a fracção insolúvel.
- Transfira 25 μL do lisado para uma placa branca de fundo plano de 96 poços para o ensaio de atividade de caspase-3/caspase-7 (etapa 5).
NOTA: Não perturbe o pellet. Esta é a fração insolúvel do lisado celular. - Transfira 10 μL do lisado restante para uma placa transparente de fundo plano de 96 poços para o ensaio de ácido bicinchonínico (BCA) (etapa 4). Isso será usado para a normalização das amostras.
- Mantenha ambas as placas no gelo para processamento posterior.
NOTA: Nesta fase, as placas podem ser seladas com uma tampa adesiva e armazenadas a -20 °C durante aproximadamente 4 semanas.
4. Quantificação de proteínas utilizando o ensaio de BCA
NOTA: Outros reagentes ou ensaios podem ser usados para quantificar a quantidade de proteína em cada amostra. No ensaio de base populacional, as amostras podem ser comparadas normalizando a quantidade de proteína utilizada no ensaio.
- Preparar concentrações proteicas padrão entre 0 μg/mL e 2.000 μg/mL (0 μg/mL, 25 μg/mL, 125 μg/mL, 250 μg/mL, 500 μg/mL, 750 μg/mL, 100 μg/mL, 1.500 μg/mL, 2.000 μg/mL) com albumina sérica bovina (BSA). Prepare espaços em branco apenas com buffer de lise.
- Adicionar 10 μL de cada norma à placa de fundo plano de 96 poços que contém as amostras, mencionadas na etapa 3.7.
- Misture o reagente BCA 1 com o reagente BCA 2 numa proporção de 50:1 (ver Tabela de Materiais). Adicionar 200 μL de reagente BCA misto a cada amostra e padrão.
- Incubar a 37 °C durante 30 min.
- Medir a absorbância a 562 nm em um instrumento fluorométrico e quantificar a concentração de proteína com a curva padrão.
5. Ensaio de base populacional para a atividade da caspase-3/caspase-7
NOTA: Não permita que os lisados celulares na placa fiquem sentados no gelo por mais de 3 h. Se a atividade da caspase estiver presente, isso aumenta com o tempo, apesar de a amostra estar no gelo. Se as amostras foram congeladas, descongele-as no gelo e prossiga imediatamente assim que os lisados tiverem descongelado.
- Ligue o instrumento fluorométrico (ver Tabela de Materiais) e aqueça a máquina a 37 °C. Prepare o script conforme mencionado:
- Realize leituras individuais a cada minuto durante 40 minutos, a fim de determinar a cinética da reação.
- Ajuste a excitação em 360 nm e a emissão em 465 nm. Dez flashes por poço são suficientes.
- Preparar o controle positivo da caspase-3 recombinante (ver Tabela de Materiais). Misture 1 U da enzima recombinante caspase-3 em 50 μL de tampão de lise (tubo 1). Adicionar 25 μL de tampão de lise a mais três tubos. Transfira 25 μL do tubo 1 para o tubo 2. Misture por pipetagem.
- Repita para o tubo 3 e o tubo 4. O tubo 5 conterá apenas 50 μL de tampão de lise. Adicionar 25 μL de cada padrão à placa de fundo plano branco de 96 poços para o ensaio de actividade da caspase-3, mencionado no passo 3.6.
- Prepare uma mistura de reação mestre para o ensaio de atividade de caspase no gelo. Para uma reação, misture 50 μL de 2x tampão de clivagem de caspase (0,2M HEPES pH 7,5; 20% de sacarose ou PEG; 0,2% CHAPS), 5 μL de 1 mM DEVD-AMC (substrato tetrapeptídico caspase-3), 2 μL de DTT de 500 mM e 18 μL de água deionizada (ver Tabela de Materiais).
- Adicionar 75 μL da mistura de reacção a cada amostra e padrão para obter um volume de reacção total de 100 μL.
- Medir imediatamente a fluorescência utilizando o instrumento fluorométrico configurado no passo 5.1.
- Para cada medição fluorescente, subtraia a leitura de fluorescência para o espaço em branco (somente tampão de lise) da fluorescência da amostra. Normalizar a leitura dividindo pela concentração proteica da amostra (calculada no passo 4.5)27:
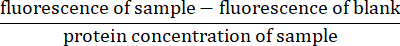
- Calcule a taxa de atividade da caspase determinando a inclinação da fluorescência normalizada no eixo y e o tempo no eixo x.
6. Ensaio unicelular (análise de citometria de fluxo) para atividade da caspase-3/caspase-7
- Semeia as células conforme descrito na secção 2.
- Colha as células em um tubo de poliestireno de 5 mL. Se estiver trabalhando com células aderentes, colete o meio no tubo de 5 mL. Adicione 1 mL de PBS frio à placa de cultura celular e colete o PBS no tubo de 5 mL. Adicione tripsina às células (100 μL se trabalhar com pratos de 6 poços). Permita que a tripsina levante as células da placa e colete para o tubo de 5 mL. Use 1 mL de PBS frio para garantir que todas as células tenham sido coletadas.
NOTA: Se trabalhar com células de suspensão, transfira suavemente o meio e as células para um tubo de 5 ml. - Centrifugar as amostras a 300 x g durante 5 min, 4 °C. Remova o sobrenadante usando um aspirador a vácuo.
- Prepare a mistura de coloração. A concentração ideal de coloração é de 1 x 10 6-2 x 106 células em 50 μL. Diluir o substrato fluorogénico de acordo com as instruções do fabricante (ver Tabela de Materiais, citometria de fluxo). Tomar 1 μL do substrato de reserva e diluir em 150 μL de PBS. Adicionar 50 uL por amostra.
- Incubar as amostras a 37 °C durante 30 min protegidas da luz, misturando a cada 15 min.
- Com o citômetro de fluxo utilizado neste estudo, utilizar o laser vermelho a 640 nm e detectar utilizando 675/25 nm. Execute a amostra de controle não corada primeiro e adquira um mínimo de 10.000 eventos da população desejada. Exclua os detritos usando uma porta (P1) em um gráfico de pontos FSC-A e SSC-A.
- Use um histograma exibindo os eventos na porta P1 e a detecção do substrato da caspase (eixo y) para determinar a intensidade mediana de fluorescência (MFI).
NOTA: O substrato de caspase descrito neste método requer uma excitação a 590 nm e emite a 628 nm.
- Use um histograma exibindo os eventos na porta P1 e a detecção do substrato da caspase (eixo y) para determinar a intensidade mediana de fluorescência (MFI).
Resultados
Macrófagos primários de camundongos foram diferenciados por 6 dias. Após 6 dias, as células foram colhidas, contadas e semeadas. Foram utilizados os seguintes tratamentos: sem tratamento e Smac mimético (Composto A)22 a 250 nM e 500 nM por 16 h (Figura 1). O experimento foi conduzido em duplicata para permitir que a ativação da caspase-3/caspase-7 fosse avaliada por um ensaio de base populacional ou análise de célula única usando citometria de fluxo.
A concentração proteica dos lisados celulares foi quantificada por meio do ensaio de BCA (Tabela Suplementar 1). Isso é necessário para garantir que a quantidade de proteína usada no ensaio de atividade de caspase-3/caspase-7 seja a mesma entre as amostras. Neste ensaio de base populacional, os dados podem ser apresentados de duas maneiras. A primeira é mostrar a cinética plotando a fluorescência ajustada (eixo y) versus o tempo (eixo x) (Figura 2A). Alternativamente, a inclinação pode ser calculada para comparar diretamente as amostras (Figura 2B). O aumento da inclinação após o tratamento mimético com Smac de 500 nM não foi significativo com base em uma ANOVA unidirecional comum com comparações múltiplas (teste de comparação múltipla de Dunnett28).
Para a análise da atividade da caspase-3/caspase-7 por citometria de fluxo, as células e o sobrenadante foram colhidos. Células não coradas ou fluorescência menos uma foram usadas como controle negativo, assim como as células não tratadas. Um histograma das células coletadas por citometria de fluxo mostrou um desvio na fluorescência para as células tratadas com miméticos de Smac em comparação com as células não tratadas (Figura 2C). Os dados podem ser mostrados como intensidade de fluorescência mediana (Figura 2D) ou como uma mudança de dobra sobre as células não tratadas (Figura 2E).

Figura 1: Fluxograma do estudo . (A) Fêmures e tíbias foram excisados de camundongos C57Bl/6. Os ossos foram lavados e diferenciados em 20 ng/mL M-CSF por 6 dias. (B) No 6º dia, os macrófagos foram colhidos e resemeados para tratamento. Um conjunto de células foi colhido para lisados e avaliado pela atividade fluorogênica, enquanto o outro conjunto foi colhido, incubado com o substrato fluorogênico e avaliado por citometria de fluxo. Por favor, clique aqui para ver uma versão maior desta figura.
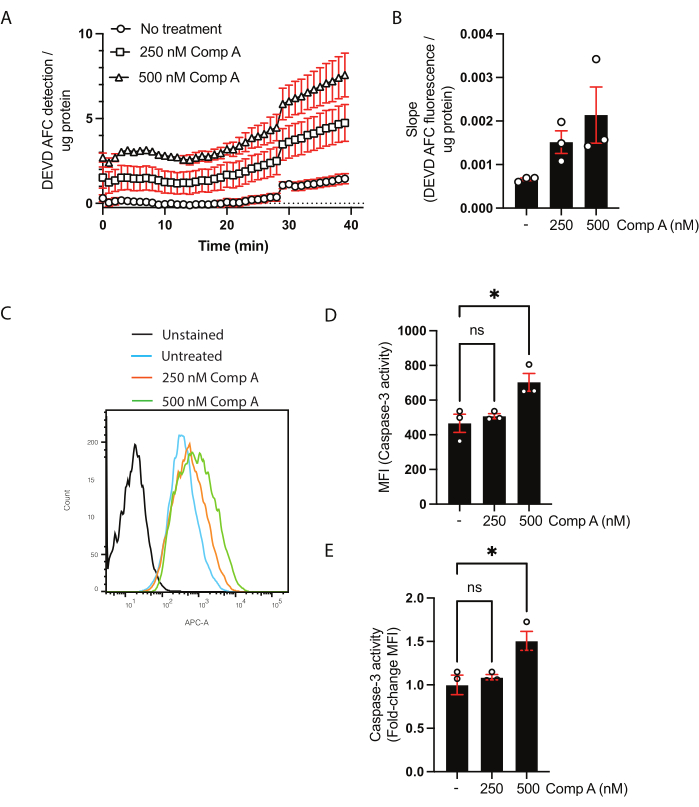
Figura 2: Ensaio cinético para atividade da caspase-3/caspase-7 e clivagem do substrato por citometria de fluxo. (A,B) Dados representativos do ensaio cinético para a atividade da caspase-3/caspase-7 (C-E) e clivagem do substrato por citometria de fluxo. Os macrófagos foram tratados com duas concentrações de Smac mimético (Composto A; 250 nM e 500 nM) por 16 h. (A) Detecção do substrato DEVD AFC clivado ao longo do tempo. Os dados foram normalizados para a concentração de proteína na amostra. (B) A taxa de clivagem (declive) de DEVD AFC para cada amostra foi normalizada para a inclinação não tratada e apresentada como a mudança de dobra sobre as células não tratadas. (C) Histogramas citométricos de fluxo das células incubadas com o substrato da caspase-3. (D,E) Comparação das IFM e alteração das dobras da IFM em comparação com a amostra não tratada. Cada ponto de dados representa uma amostra independente; média ± erro padrão da média são mostrados; *p < 0,05 usando uma ANOVA unidirecional e testes de comparação múltipla (teste de comparação múltipla de Dunnett). Por favor, clique aqui para ver uma versão maior desta figura.
| Caspase | Espécie | Sequência de substrato | Domínios proteicos | ||
| Espaça-1 | Hs, Milímetro | (P/L) EHD | CARD, domínio grande, domínio catalítico pequeno | ||
| Caspase-2 | Hs, Milímetro | DEXD | CARD, domínio grande, domínio catalítico pequeno | ||
| Caspase-4 | Hs | (P/L) EHD | CARD, domínio grande, domínio catalítico pequeno | ||
| Espaça-5 | Hs | (P/L) EHD | CARD, domínio grande, domínio catalítico pequeno | ||
| Caspase-9 | Hs, Milímetro | (I/V/L) E (H/T) D | CARD, domínio grande, domínio catalítico pequeno | ||
| Espaça-11 | Milímetro | (P/L) EHD | CARD, domínio grande, domínio catalítico pequeno | ||
| Espaça-12 | Milímetro | ATAD | CARD, domínio grande, domínio catalítico pequeno | ||
| Caspase-8 | Hs, Milímetro | (I/V/L) E (H/T) D | DED, domínio grande, domínio catalítico pequeno | ||
| Caspase-10 | Hs | (I/V/L) E (H/T) D | DED, domínio grande, domínio catalítico pequeno | ||
| Caspase-3 | Hs, Milímetro | DEXD | domínio grande, domínio catalítico pequeno | ||
| Caspase-6 | Hs, Milímetro | (I/V/L) E (H/T) D | domínio grande, domínio catalítico pequeno | ||
| Caspase-7 | Hs, Milímetro | DEXD | domínio grande, domínio catalítico pequeno | ||
| caspase-14 | hs, milímetro | (P/L) EHD | domínio grande, domínio catalítico pequeno | ||
| CARTÃO | domínio de ativação e recrutamento caspase | ||||
| DED | domínio efetor de morte | ||||
| Hs | homo sapien | ||||
| Milímetro | mus musculus | ||||
Tabela 1: Especificidade do substrato e os domínios proteicos das caspases. A tabela é adaptada de McStay et al.20; Shalini et al.3; e van Opdenbosch e Lamkanfi4.
Tabela Suplementar 1: Análise cinética do DEVD. Por favor, clique aqui para baixar esta Tabela.
Discussão
Neste método, um substrato fluorogênico é usado em um ensaio de base populacional ou análise de célula única para medir a atividade da caspase-3/caspase-7. Ambos os métodos medem a atividade da caspase de forma quantitativa com base na clivagem de um substrato. Uma vantagem é a capacidade de utilizar esses métodos para inúmeras amostras. Com esses métodos, a atividade da caspase-3/caspase-7 é detectada em macrófagos primários tratados com miméticos Smac.
Um aspecto crítico do ensaio fluorométrico de base populacional é o tempo desde a lise até a leitura da fluorescência. As amostras devem ser mantidas no gelo durante todo o procedimento, nomeadamente antes da "leitura" do ensaio. Isso evita a clivagem prematura e a fluorescência do substrato. Usando o ensaio de base populacional, menos otimização pode ser necessária. A quantidade de proteína utilizada no ensaio é normalizada, permitindo que as amostras sejam comparadas diretamente. Uma ressalva é que, em um estágio tardio da morte celular apoptótica, a quantidade total de proteína é reduzida; portanto, a detecção da atividade da caspase pode não ser possível. Recomenda-se diferentes cinéticas ou diferentes doses de tratamento para contornar este problema. Além disso, outros softwares podem ser usados para avaliar com precisão a taxa de atividade da caspase além do software descrito neste método.
Para o ensaio citométrico de fluxo, eventos ou células suficientes são necessários para atender as populações com confiança. Além disso, mais otimização no ensaio baseado em fluxo pode ser necessária para alcançar a proporção ideal de substrato para o número de células. No entanto, com a citometria de fluxo, esse método se presta a medir parâmetros adicionais, como marcadores de superfície celular para identificação do tipo celular.
Tanto a população quanto os métodos unicelulares poderiam ser usados para outras caspases. No entanto, é importante lembrar que a sequência de reconhecimento é menos discriminada para outras caspases. Como tal, devem ser utilizados outros métodos para a actividade da caspase. Isso inclui a inibição da atividade da caspase, CRISPR ou knock-down de caspases específicas e western blotting para detectar a clivagem de substratos conhecidos.
Um método alternativo para detectar a atividade da caspase é a imagem de lapso de tempo. O mesmo substrato de caspase permeável poderia ser usado juntamente com outros marcadores de viabilidade, como a anexina V, para fornecer informações sobre a cinética da morte celular. A imagem também separaria a atividade da caspase e a sobrevivência celular, permitindo a detecção de quantidades subletais de atividade da caspase em uma população celular. As funções não letais da caspase-3/caspase-7 estão ligadas à regulação antiviral em células imunes inatas29, particularmente a ativação do IFN tipo I via liberação de DNA mitocondrial15,16. Assim, esses ensaios para medir a atividade da caspase são críticos para identificar diferentes modos de morte celular e podem ser úteis na avaliação de funções de morte não celular.
Divulgações
Os autores não têm conflitos de interesse a divulgar.
Agradecimentos
A W.W.W. é apoiada pela bolsa Clöetta Medical Research Fellow, a S.R. é apoiada pelo CanDoc UZH Forschungskredit e a J.T. é apoiada pelo Conselho Chinês de Bolsas de Estudo.
Materiais
| Name | Company | Catalog Number | Comments |
| 1.5 mL microfuge tubes | Sarstedt | 72.706.400 | |
| 15 cm Petri plates | Sarstedt | 82.1184.500 | |
| 37 degree incubator shaker | IKA shaker KS 4000i | 97014-816 | distributed by VWR |
| 6-well cell culture dish | Sarstedt | 83.392 | |
| 96 well flat bottom, white polystyrene, non-sterile | Sigma | CLS3600 | |
| 96 well flat plate | Sarstedt | 82.1581 | |
| Ac-DEVD-AFC | Enzo Life Sciences | ALX-260-032-M005 | Caspase-3 substrate |
| BD Fortessa | BD | any flow cytometer with the appropriate excitation and emission detector will work | |
| b-glycerolphosphate | Sigma | G9422-10G | |
| caspase-3 recombinant | Enzo Life Sciences | ALX-201-059-U025 | |
| CHAPS | Sigma | 1.11662 | |
| DMEM, low glucose, pyruvate | Thermoscientific | 31885023 | |
| DMSO | Sigma | D8418-250ML | |
| EDTA | Sigma | 03685-1KG | |
| EGTA | Sigma | 324626-25GM | |
| Etoposide | MedChem Express | HY-13629 | |
| FBS | Thermoscientific | 26140 | |
| Flow cytometry tubes | Falcon | 352008 | |
| Flowjo | Flowjo | A license in required but any program that can analyze .fcs files will suffice | |
| Glycerol | Sigma | G5516-500ML | |
| HEPES | Sigma | H4034 | |
| Magic Red caspase-3/7 assay kit; flow cytometry or imaging | Immunochemistry Technologies | 935 | |
| M-CSF | ebioscience | 14-8983-80 | now a subsidiary of Thermoscientific |
| M-Plex | Tecan | any fluorometric reader will work with the appropriate excitation and emission detectors | |
| NaCl | Roth | 3957.1 | |
| PBS pH 7.4 | Thermoscientific | 10010023 | |
| Penicillin-Streptomycin-Glutamine (100X) | Thermoscientific | 10378016 | |
| Pierce BCA Protein Assay Kit | ThermoFisher Scientific | 23225 | protein concentration assay |
| protease inhibitors | Biomol | P9070.100 | |
| Smac mimetic, Compound A | Tetralogics | also known as 12911; structure shown in supplementary figures of Vince et al., Cell 2007 | |
| Sodium Fluoride | Sigma | S7920-100G | |
| sodium orthovanadate | Sigma | S6508-10G | |
| sodium pyrophosphate | Sigma | P8010-500G | |
| Staurosporine | MedChem Express | HY-15141 | |
| sucrose | Sigma | 1.07687 | |
| Tris Base | Sigma | T1503-1KG | |
| Triton X100 | Sigma | T8787-50ML | |
| TrypLE | Thermoscientific | A1285901 | In the protocol, it is listed as Trypsin |
Referências
- Ramirez, M. L. G., Salvesen, G. S. A primer on caspase mechanisms. Seminars in Cell and Developmental Biology. 82, 79-85 (2018).
- Nicholson, D. W., Thornberry, N. A. Caspases: Killer proteases. Trends in Biochemical Sciences. 22 (8), 299-306 (1997).
- Shalini, S., Dorstyn, L., Dawar, S., Kumar, S. Old, new and emerging functions of caspases. Cell Death and Differentiation. 22 (4), 526-539 (2014).
- Van Opdenbosch, N., Lamkanfi, M. Caspases in cell death, inflammation, and disease. Immunity. 50 (6), 1352-1364 (2019).
- Kesavardhana, S., Malireddi, R. K. S., Kanneganti, T. -. D. Caspases in cell death, inflammation, and pyroptosis. Annual Review of Immunology. 38, 567-595 (2020).
- Fu, T. -. M., et al. Cryo-EM structure of caspase-8 tandem DED filament reveals assembly and regulation mechanisms of the death-inducing signaling complex. Molecular Cell. 64 (2), 236-250 (2016).
- Jiang, X., Wang, X. Cytochrome c promotes caspase-9 activation by inducing nucleotide binding to Apaf-1. Journal of Biological Chemistry. 275 (40), 31199-31203 (2000).
- Christgen, S., Place, D. E., Kanneganti, T. -. D. Toward targeting inflammasomes: Insights into their regulation and activation. Cell Research. 30 (4), 315-327 (2020).
- Shi, J., et al. Cleavage of GSDMD by inflammatory caspases determines pyroptotic cell death. Nature. 526 (7575), 660-665 (2015).
- Sborgi, L., et al. GSDMD membrane pore formation constitutes the mechanism of pyroptotic cell death. EMBO Journal. 35 (16), 1766-1778 (2016).
- Rühl, S., et al. ESCRT-dependent membrane repair negatively regulates pyroptosis downstream of GSDMD activation. Science. 362 (6417), 956-960 (2018).
- Declercq, W., Takahashi, N., Vandenabeele, P. Dual face apoptotic machinery: From initiator of apoptosis to guardian of necroptosis. Immunity. 35 (4), 493-495 (2011).
- Newton, K., et al. Cleavage of RIPK1 by caspase-8 is crucial for limiting apoptosis and necroptosis. Nature. 574, 428-431 (2019).
- Fritsch, M., et al. Caspase-8 is the molecular switch for apoptosis, necroptosis and pyroptosis. Nature. 575, 683-687 (2019).
- White, M. J., et al. Apoptotic caspases suppress mtDNA-induced STING-mediated type I IFN production. Cell. 159 (7), 1549-1562 (2014).
- Rongvaux, A., et al. Apoptotic caspases prevent the induction of type I interferons by mitochondrial DNA. Cell. 159 (7), 1563-1577 (2014).
- Nakajima, Y. -. I., Kuranaga, E. Caspase-dependent non-apoptotic processes in development. Cell Death and Differentiation. 24, 1422-1430 (2017).
- Kumar, S., Dorstyn, L., Lim, Y. The role of caspases as executioners of apoptosis. Biochemical Society Transactions. 50 (1), 33-45 (2022).
- Agniswamy, J., Fang, B., Weber, I. T. Plasticity of S2-S4 specificity pockets of executioner caspase-7 revealed by structural and kinetic analysis. FEBS Journal. 274 (18), 4752-4765 (2007).
- McStay, G. P., Salvesen, G. S., Green, D. R. Overlapping cleavage motif selectivity of caspases: implications for analysis of apoptotic pathways. Cell Death and Differentiation. 15 (2), 322-331 (2008).
- Thornberry, N. A., et al. A combinatorial approach defines specificities of members of the caspase family and granzyme B. Functional relationships established for key mediators of apoptosis. Journal of Biological Chemistry. 272 (29), 17907-17911 (1997).
- Vince, J. E., et al. IAP antagonists target cIAP1 to induce TNFalpha-dependent apoptosis. Cell. 131 (4), 682-693 (2007).
- McComb, S., et al. cIAP1 and cIAP2 limit macrophage necroptosis by inhibiting Rip1 and Rip3 activation. Cell Death and Differentiation. 19 (11), 1791-1801 (2012).
- Wong, W. W. -. L., et al. cIAPs and XIAP regulate myelopoiesis through cytokine production in an RIPK1- and RIPK3-dependent manner. Blood. 123 (16), 2562-2572 (2014).
- Liu, X., Quan, N. Immune cell isolation from mouse femur bone marrow. Bio-Protocol. 5 (20), e1631 (2015).
- Lin, H., Chen, C., Chen, B. D. Resistance of bone marrow-derived macrophages to apoptosis is associated with the expression of X-linked inhibitor of apoptosis protein in primary cultures of bone marrow cells. Biochemical Journal. 353 (Pt 2), 299-306 (2001).
- . Caspase activity assay buffer. Cold Spring Harbor Protocols. , (2015).
- Mackridge, A., Rowe, P. One-way analysis of variance (ANOVA) - Including Dunnett's and Tukey's follow up tests. Practical Approach to Using Statistics in Health Research: From Planning to Reporting. , 93-103 (2018).
- Chen, H., Ning, X., Jiang, Z. Caspases control antiviral innate immunity. Cellular and Molecular Immunology. 14 (9), 736-747 (2017).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoExplore Mais Artigos
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados