需要订阅 JoVE 才能查看此. 登录或开始免费试用。
Method Article
体内 完整背根神经节中初级感觉神经元网络中神经元集合体的钙成像
摘要
该协议描述了背根神经节(DRG)的手术暴露,然后是GCaMP3(基因编码的Ca2+ 指示剂;绿色荧光蛋白-钙调蛋白-M13蛋白3)使用Pirt-GCaMP3小鼠对神经元集合进行Ca2+ 成像,同时对同侧后爪施加各种刺激。
摘要
Ca 2+成像可用作细胞活动的代理,包括动作电位和涉及Ca 2+进入细胞质或释放细胞内Ca2+储存的各种信号机制。基于Pirt-GCaMP3的小鼠背根神经节(DRG)初级感觉神经元的Ca2+成像提供了同时测量大量细胞的优势。可以监测多达 1,800 个神经元,允许在体内种群水平的正常生理环境中将神经网络和体感过程作为一个整体进行研究。监测的大量神经元允许检测使用其他方法难以检测的活动模式。刺激可以应用于小鼠后爪,从而可以研究刺激对DRG神经元系综的直接影响。产生 Ca 2+ 瞬变的神经元数量以及 Ca2+ 瞬变的振幅表明对特定感觉模式的敏感性。神经元的直径提供了活化纤维类型的证据(非有害机械纤维与有害疼痛纤维,Aβ,Aδ和C纤维)。表达特定受体的神经元可以用td-Tomato和特异性Cre重组酶以及Pirt-GCaMP进行遗传标记。因此,DRG的Pirt-GCaMP3 Ca2+成像为分析特定的感觉模式和神经元亚型提供了一个强大的工具和模型,在人群水平上作为一个集合来研究疼痛,瘙痒,触摸和其他躯体感觉信号。
引言
初级感觉神经元直接支配皮肤并将体感信息带回中枢神经系统1,2。背根神经节(DRGs)是由10,000-15,000个初级感觉神经元组成的细胞体簇3,4。DRG神经元表现出不同的大小、髓鞘形成水平以及基因和受体表达模式。较小直径的神经元包括疼痛感应神经元,较大直径的神经元通常对非疼痛的机械刺激做出反应5,6。初级感觉神经元的疾病,如损伤、慢性炎症和周围神经病,可以使这些神经元对各种刺激敏感,并导致慢性疼痛、异常性疼痛和疼痛超敏反应7,8。因此,DRG神经元的研究对于理解一般的躯体感觉和许多疼痛和瘙痒疾病都很重要。
体内放电的神经元对躯体感觉至关重要,但直到最近,研究体内完整神经节的工具仅限于相对较少的细胞数量9。在这里,我们描述了一种强大的方法,用于在体内集合中研究群体水平上神经元的动作电位或活动。该方法采用基于细胞质Ca2+动力学的成像。由于细胞质Ca 2+的浓度通常较低,Ca2+灵敏的荧光指示剂是测量细胞活性的良好代理。这些指标允许同时监测小鼠9,10,11,12,13,14,15,16和大鼠17中的数百至数千个初级感觉神经元。本研究中描述的体内Ca2+成像方法可用于直接观察群体对机械,冷,热和化学刺激的反应。
磷酸肌醇结合膜蛋白Pirt在几乎所有(>95%)原代感觉神经元18,19中均高水平表达,可用于驱动Ca2+传感器GCaMP3的表达,以监测体内神经元活性20。在该协议中,描述了使用共聚焦激光扫描显微镜(LSM)在Pirt-GCaMP3小鼠14的右侧腰椎5(L5)DRG中进行体内DRG手术,Ca2 +成像和分析的技术。
Access restricted. Please log in or start a trial to view this content.
研究方案
此处描述的所有程序均按照德克萨斯大学圣安东尼奥健康科学中心机构动物护理和使用委员会批准的协议进行。
注意:一旦开始,动物手术(步骤1)和成像(步骤2)必须以连续的方式完成。数据分析(步骤3)可以在以后进行。
1. 手术和固定动物进行右侧 L5 DRG 成像
注意:本研究使用了8周龄或以上的雄性和雌性Pirt-GCaMP3 C57BL / 6J小鼠。虽然任何一种性别都可以同样很好地成像,但由于年轻小鼠的Pirt表达较弱或间歇性,小鼠应至少8周大。Pirt-GCaMP3 C57BL / 6J小鼠在约翰霍普金斯大学14产生。可以对任何一侧 DRG 进行成像,而其他腰椎 DRG(例如腰椎 4)可以成像。给出的时间是经验丰富的外科医生的估计值。偶尔的技术问题(例如出血增加)可能会增加所需的时间。
- 制备含有40 mg/mL氯胺酮和6 mg/mL甲苯噻嗪的无菌盐水溶液。成像后,手术和安乐死的总体积应至少为 9 μL/g 体重。
注意:氯胺酮如果注射、吞咽或与眼睛接触时是有害的。小心处理。 - 确保所有手术工具均通过高压灭菌或其他NIH实验动物护理和使用指南批准的方法进行清洁和消毒。
- 在手术前15至25分钟之间,腹膜内(ip)注射Pirt-GCaMP3小鼠,每克体重(90mg / kg氯胺酮,13.5mg / kg甲苯噻嗪)含~2.25μL氯胺酮/甲苯噻嗪。不要超过120毫克/公斤氯胺酮。
- 在注射麻醉后15至25分钟内(步骤1.3),通过捏住对侧后爪(不是同侧/右后爪)来检查小鼠是否已到达麻醉的手术平面。无后肢退出反射可确保实现手术麻醉平面。
注意:在整个实验过程中使用后肢戒断反射来监测麻醉。始终使用对侧后爪。 - 将鼠标放在加热垫上以将体温保持在37°C。
注意:根据研究人员的喜好,用立体定位框架(参见 材料表)或其他框架将鼠标的头部固定到位可能会有所帮助。 - 通过感受小鼠的盆骨来定位腰椎增大。在腰椎增大区域上方刮掉鼠标背部。此步骤应需要 ~90 秒。
注意:可以将鼠标从加热垫上短暂取出以进行剃须。 - 用剪刀在腰椎增大上方做一个三面矩形切口(8 mm x 20 mm),并用镊子将皮肤折叠起来(图1A)。此步骤需要 ~2 分钟。
注意:研究人员也可以使用止血钳或牵开器来保持切口打开。这不是生存手术,因此不需要对手术区域进行额外清洁;然而,可以使用聚维酮碘来完成。这里给出了可接受的最大切口尺寸。较小的切口优于较大的切口。 - 使用13毫米弹簧解剖剪刀在脊柱右侧做3-4毫米的切口。用剪刀将皮肤和肌肉切回两侧,以露出脊柱(图1B)。此步骤需要 ~3 分钟。
- 使用8毫米剪刀清洁右侧L5 DRG的横向过程,切掉肌肉和结缔组织,同时尽量减少出血。使用棉花和/或凝胶泡沫吸收血液。L5椎骨是盆骨的第一椎骨。
注意:此步骤需要~3分钟,如果动物出血超过正常情况,则可能需要额外的时间。 - 使用弗里德曼-皮尔逊镊子或强力细钳切开右侧 L5 横向过程。小心不要触摸DRG(图1C)。
注意:此步骤需要~2分钟,但如果动物出血超过正常情况,则可能需要额外的时间。 - 在出血完全停止之前不要继续。使用凝胶泡沫或棉花防止渗到DRG表面。此步骤步骤需要 1-4 分钟。
- 将鼠标和加热垫移动到自定义载物台上(图2A,B)。使用载物台胶带将动物和加热垫固定到位。将动物的鼻子放在鼻锥中,以便动物可以接受连续的异氟醚麻醉。固定伸出舞台的右后爪,以便可以轻松地将刺激施加到爪子上。此步骤需要 3 分钟。
- 将脊柱固定到位,将载物台夹在椎骨和/或骨盆骨的皮肤上,刚好在L5 DRG的嘴部和尾部。调整夹具和载物台,使DRG的表面尽可能水平(图2B,C)。
注意:可能需要修剪位于DRG和物镜之间的组织。 - 将载物台放在显微镜下方,使物镜在降低时直接位于DRG上方8 mm(图3A,B)。插入直肠温度计。
注意:从DRG到物镜的距离可能因物镜、显微镜和动物而异。 - 将电源线连接到加热垫和直肠温度计。将鼻锥连接到异氟醚气体管路。
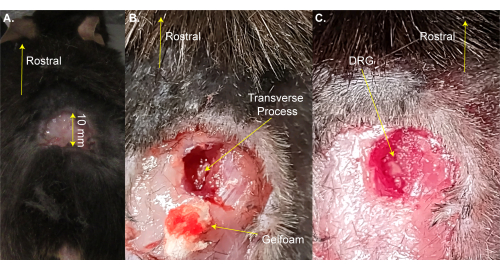
图1:DRG暴露手术示例 。 (A)剃光了一小块区域,将皮肤切开并折回。切口在喙尾轴上~10毫米。(B)在脊柱右侧切开一个切口,切掉肌肉和结缔组织,露出L5右侧横突。血液被凝胶泡沫吸收。(C)清洁横向过程并去除DRG上的骨头。 请点击此处查看此图的大图。
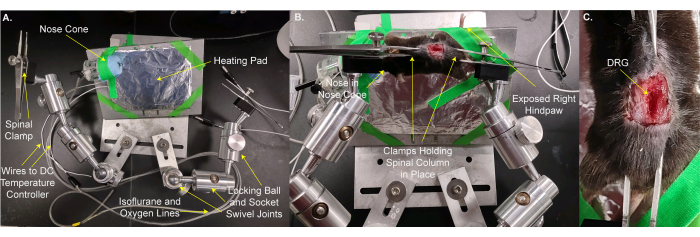
图 2:将鼠标安装在用于 DRG 成像的自定义载物台上 。 (A) 显示自定义阶段。它由底板和动物板组成。动物安装板位于锁定球和插座旋转接头上。带有用于输送氧气/异氟醚混合物的管线的鼻锥和废气管线以及铝箔包裹的加热垫被粘在动物安装板上。两个臂,每个臂由三个锁定球窝旋转接头制成,用螺栓固定在底板上。每个手臂都有一个由镊子制成的夹子,带有用于拧紧和松开的螺钉。(B)动物安装在动物安装板上。它的鼻子放在鼻锥中。夹子放在固定脊柱和盆骨的皮肤上。右(同侧)后爪被贴上胶带以突出,以便于施加刺激。(C)夹紧的脊柱和盆骨的特写图像。 请点击此处查看此图的大图。

图3:将定制载物台上的动物放置在显微镜物镜下方 。 (A)载物台、动物和显微镜的广角视图。左侧可以看到直流温度控制器的电线以及氧气/异氟醚进气和废气管道的线路。(B)显微镜物镜下方动物的特写视图。DRG 位于物镜下方 ~8 毫米。插入直肠温度计,鼻子在鼻锥内。 请点击此处查看此图的大图。
2. DRG 成像
- 使用正置共聚焦显微镜10x/0.4 DIC物镜和相关软件(见 材料表)进行成像。使用绿色滤光片 (FITC) 设置:激发 495 nm,发射 519 nm,检测波长 500-580 nm,GaAsP-Pmt1 成像器件,GaAsP-PMT 检测器。
注:对于其他显微镜,请使用制造商推荐的设置。 - 用显微镜找到DRG的表面。调整载物台上的夹具,使DRG表面尽可能水平,并在焦平面中显示最大表面积。
注意:物镜的选择可能因所使用的显微镜和用户偏好而异。软件的选择取决于显微镜。水平 DRG 产生更清晰的图像,允许软件构建更清晰的电影,允许对更多神经元进行成像,并使分析更容易、更准确。 - 向鼻锥提供1%-1.5%的异氟醚氧气流,以确保小鼠保持麻醉状态。在整个过程中仔细监测动物,以维持异氟醚麻醉而不会过量服用。
注意:维持麻醉所需的异氟醚量可能因个体动物和刺激而异。通常,1.5%就足够了。如果动物在刺激期间移动,应增加异氟醚。如果呼吸变浅,应减少异氟醚。在每次刺激之前,测试对侧后爪的后肢撤回反射。
注意:异氟醚如果吸入可能是有害的或引起头晕或嗜睡。避免吸入,仅在通风良好的地方使用。 - 加载显微镜快速扫描方案。
- 使用快速扫描的典型设置:体素大小 2.496 μm x 2.496 μm x 16 μm,512 x 512 像素,10 光学切片 Z 堆栈,1 个通风单位 (AU)/32 μm,1% 488 nm 激光功率 5 mW,像素时间 1.52 μs,行时 0.91 ms,帧时间 465 ms,LSM 扫描速度 8,双向扫描, 砷化镓P-PMT检测器增益650 V,数字增益1。最佳设置可能因显微镜和动物而异。
- 要设置快速扫描协议,请单击 "采集 "选项卡。在 "采集参数"下,单击 "帧 "选项卡。单击预设 > 512 x 512,将显微镜设置为记录512像素x 512像素的图像。这将反过来根据图像大小设置体素大小的 X 和 Y 值,该大小由显微镜软件确定。
- 在 "采集参数"下,单击 "通道 "选项卡。点击 轨道2 框。使用 Track2 框旁边的下拉菜单选择 绿色 (FITC)。将在 Track2 下方打开一个新选项卡。
- 在 激光旁边,单击 488 框。这将设置激发和发射波长。
- 在 488 nm 滑块旁边,将激光功率设置为 1%。单击 1 AU 按钮以设置 1 个通风单元的光圈。在FITC下,将主增益设置为650 V,将数字偏移设置为0,将数字增益设置为1。
- 在" 采集 "选项卡下,选中" Z 堆栈 "框。单击"实时"按钮以查看神经节的 实时 图像。向上转动焦平面旋钮,直到只看到一小段神经元弧。
- 在 "采集参数"下,单击" Z-Stack "选项卡>"设置 最后" 按钮。向下转动焦平面旋钮,直到只看到一小段神经元弧。在 "采集参数"下,单击" Z-Stack "选项卡>"设置 第一个 "按钮。单击"实时"按钮以关闭 实时 图像。
- 在 "采集参数"下,单击" Z-Stack "选项卡。在 切片 字段中填写 10。这将设置 10 个光学切片并自动确定体素深度。
- 在"采集"选项卡下,单击" 时间序列 "框。新的"时间序列"选项卡将显示在"采集参数"下。单击" 时间序列 "选项卡>" 周期 "字段,其中包含您希望接下来使用的周期数。在本例中,它是 8。
- 设置扫描速度和方向。在采集参数下,采集模式选项卡> >方向>双向箭头进行双向扫描。选择采集模式选项卡>帧>扫描速度滑块> 8。
注意:通常可以加载先前实验的设置,并且只需在图像太亮或太暗时才调整激光功率,并调整Z-Stack最后设置和首先设置。
- 通过单击"采集"选项卡下的"开始实验",对DRG进行简短的8个周期扫描。通过随时间推移进行扫描的正交投影(每帧一次扫描)来创建影片,并手动检查图像清晰度和成像伪影,例如穿过 DRG 的亮度"波"。调整夹紧位置和光学切片厚度并重复此步骤,直到获得清晰、高质量的电影。
注意:如果动物移动或被调查员移动,则应重复此步骤。要寻找的问题包括神经节区域(不仅仅是单个神经元)在实验过程中似乎变亮和变暗,从而产生波浪状外观或导致区域消失或变亮。运动大于小神经元直径(<20μm)的一半是另一个主要问题。波浪度通常可以通过将Z-Stack的第一个和最后一个位置靠得更近(参见上面的步骤2.4.4)并缩小光学切片厚度来固定。 视频 1 提供了调平和设置正确的光学切片厚度之前的波浪形神经节示例。 视频2 是在校正流平和光学切片厚度之后。差异是微妙的,但它对分析有巨大的影响。 - 加载显微镜高分辨率扫描协议。
- 使用高分辨率扫描的典型设置:体素大小 1.248 μm x 1.248 μm x 14 μm,1024 x 1024 像素,6 个光学切片 Z 堆栈,1.2 通风单位 (AU)/39 μm,5% 488 nm 激光功率/25 mW,像素时间 2.06 μs,行时间 4.95 ms,帧时间 5.06 s,LSM 扫描速度 6,双向扫描, 砷化镓P-PMT检测器增益650 V,数字增益1。最佳设置可能因显微镜和动物而异。
- 要设置高分辨率扫描协议,请单击 "采集 "选项卡。在 "采集参数"下,单击 "帧 "选项卡。单击预设 >1024 x 1024,将显微镜设置为记录1024像素x 1024像素的图像。这将反过来根据图像大小设置体素大小的 X 和 Y 值,该大小由显微镜软件确定。
- 在 "采集参数"下,单击 "通道 "选项卡。点击 轨道2 框。使用 Track2 框旁边的下拉菜单选择 绿色 (FITC)。将在 Track2 下方打开一个新选项卡。
- 在激光旁边,单击 488 框。这将设置激发和发射波长。单击 "高强度激光范围 "框。
- 在 488 nm 滑块旁边,将激光功率设置为 5%。单击 1 AU 按钮以设置 1 个通风单元的光圈。在FITC下,将主增益设置为650 V,将数字失调设置为0,将数字增益设置为1。
- 在" 采集 "选项卡下,选中" Z 堆栈 "框。单击"实时"按钮以查看神经节的 实时 图像。向上转动焦平面旋钮,直到只看到一小段神经元弧。
- 在" 采集参数"下,单击" Z-Stack "选项卡>"设置 最后" 按钮。向下转动焦平面旋钮,直到只看到一小段神经元弧。在 "采集参数"下,单击" Z-Stack "选项卡>"设置 第一个 "按钮。单击"实时"按钮以关闭 实时 图像。
- 在 "采集参数"下,单击" Z-Stack "选项卡。在 切片 字段中填写 6。这将设置 6 个光学切片并自动确定体素深度。
- 在 "获取 "选项卡下,确保未选中"时间序列"框(无 时间序列 )。
- 设置扫描速度和方向。在"采集参数"下,单击"采集模式"选项卡>"帧>预设"> 1024 x 1024。选择"采集模式"选项卡>"帧>方向">"双向箭头"进行双向扫描。选择采集模式选项卡>帧>扫描速度滑块> 6。
- 如果细胞用td-Tomato标记,则设置显微镜扫描红色通道592nm激发/ 614nm发射,检测波长600-700nm以及绿色通道。通过转到" 采集参数 "并单击" 通道 "选项卡>" Track1 "框来设置此设置。使用 Track1 框旁边的下拉菜单选择 红色 (德克萨斯红)。按照与步骤 2.6.3 中相同的过程进行操作,只是单击 561 框而不是 488 框。将 激光功率 设置为 1%。Td-Tomato比GCaMP3亮得多,并且需要更低的激光功率。
- 通过单击"采集"选项卡下的"开始实验"按钮,制作 DRG 的高分辨率图像。
- 加载显微镜快速扫描协议(参见步骤2.4)。记录DRG中的自发活动80个周期(约10分钟)。生成正交投影影片并验证图像是否具有足够的质量进行分析。
注意:质量注意事项与步骤 2.5 中的相同。 - 要施加刺激,请将显微镜设置为执行15-20次扫描。等待扫描 1-5 完成以生成基线。在扫描6-10期间应用刺激。每次刺激后至少等待 5 分钟,然后再应用下一次刺激以防止脱敏。
注意:应首先施加机械刺激,然后应用冷刺激、热刺激和化学刺激。较弱的刺激(例如,低机械力,接近室温的温度)应在较强的刺激(例如,较高的机械力,远离室温的温度)之前施加。施加刺激时,请确保不要引起DRG的任何移动。特别是对于强烈的热刺激,通常需要在开始刺激之前应用2%异氟醚1-2分钟。在本研究中使用的显微镜上,可以清楚地听到每次扫描,因此研究人员可以轻松识别扫描的结束,从而允许在扫描5后立即施加刺激。然而,任何有助于在一致的时间点应用刺激的方法都将起作用。 - 对于机械压力机,用爪子夹住测藻力计的夹子,不要接触爪子,并在扫描 5 结束后立即开始捏合,并在扫描 10 后立即停止。用测力计监测压力(见 材料表)。保持压力尽可能接近所需力(此处我们使用 100 g 压力刺激),并确保其不超过所需力的 10 g。
注意:人们可以用低至 0.07 g 的冯弗雷细丝和高达 600 g 的冲压力来检测刺激。 - 对于冷刺激和热刺激,将烧杯水冷却或加热至略低于(对于冷)或高于(对于热)所需温度并开始扫描。在这里,使用45°C刺激。当水的温度正确时,在扫描5后立即将爪子浸入水中来施加刺激。扫描 10 后立即拉开烧杯。
注意:扫描5时的温度应在所需温度的1°C以内。如果烧杯温度不正确,请不要施加刺激,因为这可能会使神经元脱敏。而是重新冷却或重新加热水,然后重试。我们测量的温度低至0°C(冰水)和高达95°C。 但是,请记住,高于50°C的温度可能会损坏组织并混淆以后的实验。同样,一些化学物质(例如河豚毒素,辣椒素)是不可逆的或不能被洗掉,可以阻止对动物的进一步实验。 - 在应用并记录所有刺激后,通过过量服用氯胺酮/甲苯噻嗪(200mg / kg氯胺酮,30mg / kg甲苯噻嗪或步骤1.1中制备的每克体重5μL溶液)对动物实施安乐死,然后斩首。
3. 数据分析
- 通过拖放到 ImageJ 中打开图像文件。打开文件后,在"图像 >类型"下选择图像类型>RGB颜色。
注意:StackReg 插件> StackReg 下的 StackReg 21 插件可用于校正和对齐运动伪影。ImageJ可以读取大多数显微镜软件文件格式。图像类型的选择取决于用户首选项。RGB 简化了用于发布的彩色图像的生成。显微镜制造商或 cytoNet22 提供的软件包也可能有助于分析。没有必要下载、安装和使用 StackReg,但建议这样做。 - 使用感兴趣区域 (ROI) 工具在 ROI 管理器>分析>工具下选择活动神经元。使用工具栏上的椭圆或矩形工具绘制 ROI,并通过按 ROI 管理器窗口上"添加"下的"添加"按钮或按"t"键将它们放置在 ROI 文件中。
注意:请务必经常保存 ROI 文件。用户始终可以通过将 ROI 文件拖放到 ImageJ 并单击 ROI 管理器窗口底部的" 全部显示 "框来恢复 ROI。不建议另存为叠加层。根据经验,另存为 ROI.zip 文件可简化分析。 - 在 分析>设置测量值下,确保选中 平均灰度值 选项;取消选中设置度量下的所有其他框。使用 ROI 管理器菜单上的多度量工具计算 ROI 内的强度。使用 更多>多重测量下的 ROI 窗口测量强度。
注意:有时相邻的神经元会靠得太近,无法绘制单独的ROI。这些神经元不能用于测量瞬态强度,但可以包含在激活神经元的计数中。 - 保存由Multimeasure生成的CSV文件,并使用任何电子表格软件打开CSV文件。
注意:有关有助于分析的示例电子表格模板,请参阅 补充文件 1 。 - 将 Ca 2+ 瞬态强度计算为 ΔF / F 0 = (F t- F 0) / F 0,其中 Ft 是感兴趣时间点 ROI 中的像素强度,F 0 是通过平均自发活动的 Ca 2+ 瞬态之前的 2-4 帧的强度或Ca 2+ 的 ROI 的前 1-5 帧的强度来确定的基线强度 刺激期间发生的瞬变。排除任何在刺激前产生Ca2+峰的神经元,并且在刺激结束后不要分析活动。
- 对于Ca2+ 瞬态强度分析,从每个神经节中随机采样大约相等数量的神经元,以避免将数据偏向产生最多响应神经元的神经节。排除ΔF / F 0<0.15 的峰。
注意:有其他已发表的分析和包含/排除神经元的方法11,12,23,24,25,26,27,28。 - 使用 ImageJ 中工具栏上的 线 工具测量神经元直径。根据沿最长和最短直径绘制的线计算平均直径。
Access restricted. Please log in or start a trial to view this content.
结果
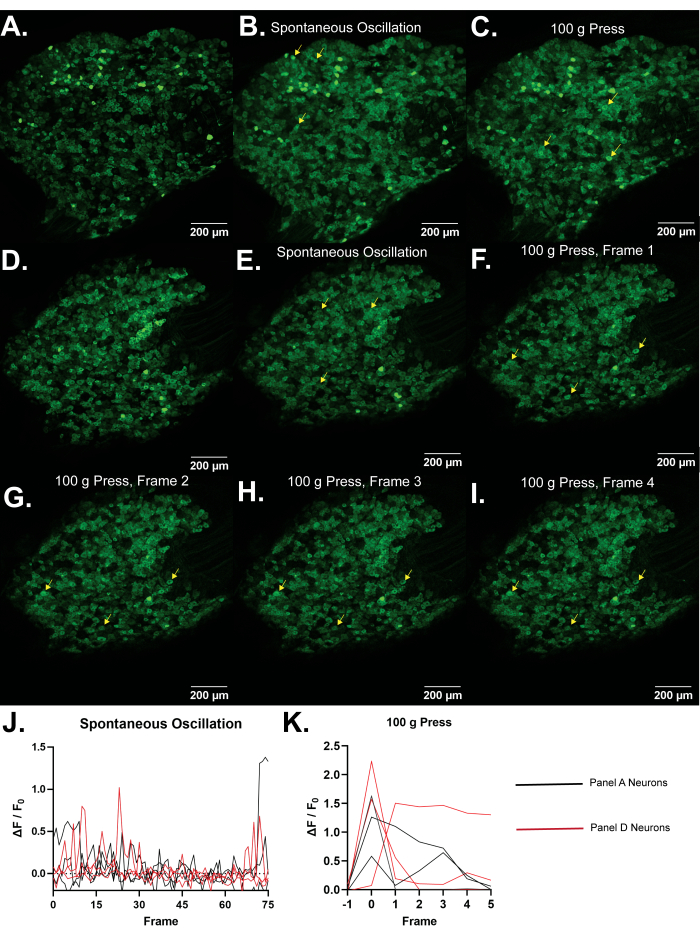
图4:Pirt-GCaMP3小鼠L5背根神经节的代表性图像。 (A,D)显示了Pirt-GCaMP3小鼠L5背根神经节的单帧高分辨率扫描。(乙,东).在没有刺激的情况下,分别来自图A和图D的15帧Pirt-GCaMP3 L5 DRG神经节的平均强度预测。一些产生自发Ca2+...
Access restricted. Please log in or start a trial to view this content.
讨论
持续性疼痛存在于多种疾病中,使约8%的人虚弱和/或降低生活质量29。初级感觉神经元检测皮肤上的有害刺激,它们的可塑性有助于持续疼痛8。虽然可以在细胞培养和外植体中研究神经元,但这样做会将它们从正常的生理环境中移除。DRG的手术暴露,然后进行Pirt-GCaMP3 Ca2+成像,允许使用施加在后爪的刺激在正常生理环境中研究初级感觉神经元。这种Ca
Access restricted. Please log in or start a trial to view this content.
披露声明
作者声明没有相互竞争的经济利益。
致谢
这项工作得到了美国国立卫生研究院拨款R01DE026677和R01DE031477(致YSK),UTHSCSA启动基金(YSK)和德克萨斯大学系统(YSK)的新星奖的支持。
Access restricted. Please log in or start a trial to view this content.
材料
| Name | Company | Catalog Number | Comments |
| Anased Injection (Xylazine) | Covetrus, Akorn | 33197 | |
| C Epiplan-Apochromat 10x/0.4 DIC | Cal Zeiss | 422642-9900-000 | |
| Cotton Tipped Applicators | McKesson | 24-106-1S | |
| Curved Hemostat | Fine Science Tools | 13007-12 | |
| DC Temperature Controller | FHC | 40-90-8D | |
| DC Temperature Controller Heating Pad | FHC | 40-90-2-05 | |
| Dumont Ceramic Coated Forceps | Fine Science Tools | 11252-50 | |
| FHC DC Temperature Controller | FHC | 40-90-8D | |
| Fluriso (Isoflurane) | MWI Animal Health, Piramal Group | 501017 | |
| Friedman-Pearson Rongeurs | Fine Science Tools | 16221-14 | |
| GelFoam | Pfizer | 09-0353-01 | |
| Ketaset (Ketamine) | Zoetis | KET-00002R2 | |
| Luminescent Green Stage Tape | JSITON/ Amazon | B803YW8ZWL | |
| Matrx VIP 3000 Isoflurane Vaporizer | Midmark | 91305430 | |
| Micro dissecting scissors | Roboz | RS-5882 | |
| Micro dissecting spring scissors | Fine Science Tools | 15023-10 | |
| Micro dissecting spring scissors | Roboz | RS-5677 | |
| Mini Rectal Thermistor Probe | FHC | 40-90-5D-02 | |
| Operating scissors | Roboz | RS-6812 | |
| Pirt-GCaMP3 C57BL/6J mice | Johns Hopkins University | N/A | Either sex can be imaged equally well. Mice should be at least 8 weeks old due to weak or intermittent Pirt promoter expression in younger mice. |
| SMALGO small animal algometer | Bioseb In vivo Research Instruments | BIO-SMALGO | |
| Stereotaxic frame | Kopf Model 923-B | 923-B | |
| td-Tomato C57BL/6J mice | Jackson Laboratory | 7909 | |
| Top Plate, 6 in x 10 in | Newport | 290-TP | |
| TrpV1-Cre C57BL/6J mice | Jackson Laboratory | 17769 | |
| Zeiss LSM 800 confocal microscope | Cal Zeiss | LSM800 | |
| Zeiss Zen 2.6 Blue Edition Software | Cal Zeiss | Zen (Blue Edition) 2.6 |
参考文献
- Rivero-Melián, C., Grant, G. Distribution of lumbar dorsal root fibers in the lower thoracic and lumbosacral spinal cord of the rat studied with choleragenoid horseradish peroxidase conjugate. The Journal of Comparative Neurology. 299 (4), 470-481 (1990).
- Wessels, W. J., Marani, E. A rostrocaudal somatotopic organization in the brachial dorsal root ganglia of neonatal rats. Clinical Neurology and Neurosurgery. 95, 3-11 (1993).
- Schmalbruch, H. The number of neurons in dorsal root ganglia L4-L6 of the rat. The Anatomical Record. 219 (3), 315-322 (1987).
- Sørensen, B., Tandrup, T., Koltzenburg, M., Jakobsen, J. No further loss of dorsal root ganglion cells after axotomy in p75 neurotrophin receptor knockout mice. The Journal of Comparative Neurology. 459 (3), 242-250 (2003).
- Basbaum, A. I., Woolf, C. J. Pain. Current Biology. 9 (12), 429-431 (1999).
- Liu, Y., Ma, Q. Generation of somatic sensory neuron diversity and implications on sensory coding. Current Opinion in Neurobiology. 21 (1), 52-60 (2011).
- Basbaum, A. I., Bautista, D. M., Scherrer, G., Julius, D. Cellular and molecular mechanisms of pain. Cell. 139 (2), 267-284 (2009).
- Stucky, C. L., Mikesell, A. R. Cutaneous pain in disorders affecting peripheral nerves. Neuroscience Letters. 765, 136233(2021).
- Iseppon, F., Linley, J. E., Wood, J. N. Calcium imaging for analgesic drug discovery. Neurobiology of Pain. 11, 100083(2022).
- Chen, Z., et al. Adjacent intact nociceptive neurons drive the acute outburst of pain following peripheral axotomy. Scientific Reports. 9 (1), 7651(2019).
- Chisholm, K. I., Khovanov, N., Lopes, D. M., La Russa, F., McMahon, S. B. Large scale in vivo recording of sensory neuron activity with GCaMP6. eNeuro. 5 (1), (2018).
- Emery, E. C., et al. In vivo characterization of distinct modality-specific subsets of somatosensory neurons using GCaMP. Science Advances. 2 (11), 1600990(2016).
- Ishida, H., et al. In vivo calcium imaging visualizes incision-induced primary afferent sensitization and its amelioration by capsaicin pretreatment. The Journal of Neuroscience. 41 (41), 8494-8507 (2021).
- Kim, Y. S., et al. Coupled activation of primary sensory neurons contributes to chronic pain. Neuron. 91 (5), 1085-1096 (2016).
- MacDonald, D. I., et al. Silent cold-sensing neurons contribute to cold allodynia in neuropathic pain. Brain. 144 (6), 1711-1726 (2021).
- Wang, F., et al. Sensory afferents use different coding strategies for heat and cold. Cell Reports. 23 (7), 2001-2013 (2018).
- Kucharczyk, M. W., et al. The impact of bone cancer on the peripheral encoding of mechanical pressure stimuli. Pain. 161 (8), 1894-1905 (2020).
- Kim, A. Y., et al. a phosphoinositide-binding protein, functions as a regulatory subunit of TRPV1. Cell. 133 (3), 475-485 (2008).
- Kim, Y. S., et al. Central terminal sensitization of TRPV1 by descending serotonergic facilitation modulates chronic pain. Neuron. 81 (4), 873-887 (2014).
- Tian, L., et al. Imaging neural activity in worms, flies and mice with improved GCaMP calcium indicators. Nature Methods. 6 (12), 875-881 (2009).
- Thévenaz, P., Ruttimann, U. E., Unser, M. A pyramid approach to subpixel registration based on intensity. IEEE Transactions on Image Processing. 7 (1), 27-41 (1998).
- Mahadevan, A. S., et al. cytoNet: Spatiotemporal network analysis of cell communities. PLoS Computational Biology. 18 (6), 1009846(2022).
- Barretto, R. P., et al. The neural representation of taste quality at the periphery. Nature. 517 (7534), 373-376 (2015).
- Leijon, S. C. M., et al. Oral thermosensing by murine trigeminal neurons: modulation by capsaicin, menthol and mustard oil. The Journal of Physiology. 597 (7), 2045-2061 (2019).
- Sekiguchi, K. J., et al. Imaging large-scale cellular activity in spinal cord of freely behaving mice. Nature Communications. 7, 11450(2016).
- Wu, A., Dvoryanchikov, G., Pereira, E., Chaudhari, N., Roper, S. D. Breadth of tuning in taste afferent neurons varies with stimulus strength. Nature Communications. 6, 8171(2015).
- Ran, C., Hoon, M. A., Chen, X. The coding of cutaneous temperature in the spinal cord. Nature Neuroscience. 19 (9), 1201-1209 (2016).
- Yarmolinsky, D. A., et al. Coding and plasticity in the mammalian thermosensory system. Neuron. 92 (5), 1079-1092 (2016).
- Torrance, N., Smith, B. H., Bennett, M. I., Lee, A. J. The epidemiology of chronic pain of predominantly neuropathic origin. Results from a general population survey. The Journal of Pain. 7 (4), 281-289 (2006).
- Shannonhouse, J., et al. Meclizine and metabotropic glutamate receptor agonists attenuate severe pain and Ca(2+) activity of primary sensory neurons in chemotherapy-induced peripheral neuropathy. The Journal of Neuroscience. 42 (31), 6020-6037 (2022).
- Luiz, A. P., et al. Cold sensing by Na(V)1.8-positive and Na(V)1.8-negative sensory neurons. Proceedings of the National Academy of Sciences of the United States of America. 116 (9), 3811-3816 (2019).
- Hartung, J. E., Gold, M. S. GCaMP as an indirect measure of electrical activity in rat trigeminal ganglion neurons. Cell Calcium. 89, 102225(2020).
- Chung, M. K., Wang, S., Oh, S. L., Kim, Y. S. Acute and chronic pain from facial skin and oral mucosa: Unique neurobiology and challenging treatment. International Journal of Molecular Sciences. 22 (11), 5810(2021).
- Chan, S. L., Mayne, M., Holden, C. P., Geiger, J. D., Mattson, M. P. Presenilin-1 mutations increase levels of ryanodine receptors and calcium release in PC12 cells and cortical neurons. The Journal of Biological Chemistry. 275 (24), 18195-18200 (2000).
- Sierra, D. A., Popov, S., Wilkie, T. M. Regulators of G-protein signaling in receptor complexes. Trends in Cardiovascular Medicine. 10 (6), 263-268 (2000).
- Yoshihara, K., et al. Astrocytic Ca(2+) responses in the spinal dorsal horn by noxious stimuli to the skin. Journal of Pharmacological Sciences. 137 (1), 101-104 (2018).
- Tan, C. H., McNaughton, P. A. The TRPM2 ion channel is required for sensitivity to warmth. Nature. 536 (7617), 460-463 (2016).
- Akemann, W., Mutoh, H., Perron, A., Rossier, J., Knöpfel, T. Imaging brain electric signals with genetically targeted voltage-sensitive fluorescent proteins. Nature Methods. 7 (8), 643-649 (2010).
- Gong, Y., et al. High-speed recording of neural spikes in awake mice and flies with a fluorescent voltage sensor. Science. 350 (6266), 1361-1366 (2015).
- Grewe, B. F., Langer, D., Kasper, H., Kampa, B. M., Helmchen, F. High-speed in vivo calcium imaging reveals neuronal network activity with near-millisecond precision. Nature Methods. 7 (5), 399-405 (2010).
- Harada, K., et al. Red fluorescent protein-based cAMP indicator applicable to optogenetics and in vivo imaging. Scientific Reports. 7 (1), 7351(2017).
Access restricted. Please log in or start a trial to view this content.
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。