Un abonnement à JoVE est nécessaire pour voir ce contenu. Connectez-vous ou commencez votre essai gratuit.
Method Article
In vivo Imagerie calcique d’ensembles neuronaux dans des réseaux de neurones sensoriels primaires dans des ganglions radiculaires dorsaux intacts
Dans cet article
Résumé
Ce protocole décrit l’exposition chirurgicale du ganglion radiculaire dorsal (DRG) suivi de GCaMP3 (indicateur Ca2+ codé génétiquement; Protéine fluorescente verte-calmoduline-protéine M13 3) Imagerie Ca2+ des ensembles neuronaux à l’aide de souris Pirt-GCaMP3 tout en appliquant une variété de stimuli à la patte postérieure ipsilatérale.
Résumé
L’imagerie Ca 2+ peut être utilisée comme proxy de l’activité cellulaire, y compris les potentiels d’action et divers mécanismes de signalisation impliquant l’entrée de Ca 2+ dans le cytoplasme ou la libération de réserves intracellulaires de Ca2+. L’imagerie Ca2+ basée sur Pirt-GCaMP3 des neurones sensoriels primaires du ganglion de la racine dorsale (DRG) chez la souris offre l’avantage de mesurer simultanément un grand nombre de cellules. Jusqu’à 1 800 neurones peuvent être surveillés, ce qui permet d’étudier les réseaux neuronaux et les processus somatosensoriels en tant qu’ensemble dans leur contexte physiologique normal au niveau de la population in vivo. Le grand nombre de neurones surveillés permet de détecter des schémas d’activité qui seraient difficiles à détecter en utilisant d’autres méthodes. Les stimuli peuvent être appliqués à la patte postérieure de la souris, ce qui permet d’étudier les effets directs des stimuli sur l’ensemble neuronal DRG. Le nombre de neurones produisant des transitoires Ca 2+ ainsi que l’amplitude des transitoires Ca2+ indiquent une sensibilité à des modalités sensorielles spécifiques. Le diamètre des neurones fournit des preuves de types de fibres activées (mécano non nocif vs fibres nocives de la douleur, fibres Aβ, Aδ et C). Les neurones exprimant des récepteurs spécifiques peuvent être marqués génétiquement avec la tomate td-tomate et des recombinases Cre spécifiques avec Pirt-GCaMP. Par conséquent, l’imagerie Pirt-GCaMP3 Ca2+ de DRG fournit un outil et un modèle puissants pour l’analyse de modalités sensorielles spécifiques et de sous-types de neurones agissant comme un ensemble au niveau de la population pour étudier la douleur, les démangeaisons, le toucher et d’autres signaux somatosensoriels.
Introduction
Les neurones sensoriels primaires innervent directement la peau et ramènent l’information somatosensorielle au système nerveux central 1,2. Les ganglions radiculaires dorsaux (DRG) sont des amas cellulaires de 10 000 à 15 000 neurones sensoriels primaires 3,4. Les neurones DRG présentent divers modèles d’expression de taille, de myélinisation et de gènes et de récepteurs. Les neurones de plus petit diamètre comprennent les neurones sensibles à la douleur et les neurones de plus grand diamètre répondent généralement à des stimuli mécaniques non douloureux 5,6. Les troubles des neurones sensoriels primaires tels que les blessures, l’inflammation chronique et les neuropathies périphériques peuvent sensibiliser ces neurones à divers stimuli et contribuer à la douleur chronique, à l’allodynie et à l’hypersensibilité à la douleur 7,8. Par conséquent, l’étude des neurones DRG est importante pour comprendre à la fois la somatosensation en général et de nombreux troubles de la douleur et des démangeaisons.
Les neurones qui tirent in vivo sont essentiels à la somatosensation, mais jusqu’à récemment, les outils permettant d’étudier in vivo les ganglions intacts étaient limités à un nombre relativement restreint de cellules9. Ici, nous décrivons une méthode puissante pour étudier les potentiels d’action ou les activités des neurones au niveau de la population in vivo en tant qu’ensemble. La méthode utilise l’imagerie basée sur la dynamique cytoplasmique Ca2+. Les indicateurs fluorescents sensibles au Ca 2+ sont de bons indicateurs pour mesurer l’activité cellulaire en raison de la concentration normalement faible de Ca2+ cytoplasmique. Ces indicateurs ont permis de surveiller simultanément des centaines à plusieurs milliers de neurones sensoriels primaires chez les souris 9,10,11,12,13,14,15,16 et les rats17. La méthode d’imagerie Ca2+ in vivo décrite dans cette étude peut être utilisée pour observer directement les réponses au niveau de la population aux stimuli mécaniques, froids, thermiques et chimiques.
La protéine membranaire liant le phosphoinositide, Pirt, est exprimée à des niveaux élevés dans presque tous les neurones sensoriels primaires (>95%)18,19 et peut être utilisée pour piloter l’expression du capteur Ca 2+, GCaMP3, pour surveiller l’activité des neurones in vivo20. Dans ce protocole, des techniques sont décrites pour effectuer une chirurgie DRG in vivo, une imagerie Ca2+ et une analyse dans le DRG lombaire 5 (L5) droit de souris Pirt-GCaMP314 à l’aide de la microscopie confocale à balayage laser (LSM).
Access restricted. Please log in or start a trial to view this content.
Protocole
Toutes les procédures décrites ici ont été effectuées conformément à un protocole approuvé par le Comité institutionnel de soin et d’utilisation des animaux du Centre des sciences de la santé de l’Université du Texas à San Antonio.
NOTE: Une fois commencé, la chirurgie animale (étape 1) et l’imagerie (étape 2) doivent être complétées de manière continue. L’analyse des données (étape 3) peut être effectuée ultérieurement.
1. Chirurgie et sécurisation de l’animal pour l’imagerie L5 DRG du côté droit
REMARQUE : Des souris mâles et femelles Pirt-GCaMP3 C57BL/6J âgées de 8 semaines ou plus ont été utilisées dans cette étude. Bien que l’un ou l’autre sexe puisse être bien illustré, les souris doivent être âgées d’au moins 8 semaines en raison d’une expression faible ou intermittente de Pirt chez les souris plus jeunes. Les souris Pirt-GCaMP3 C57BL/6J ont été générées à l’Université Johns Hopkins14. Les DRG de chaque côté peuvent être imagés, et d’autres DRG lombaires (par exemple, lombaire 4) peuvent être imagés. Les temps donnés sont des estimations pour un chirurgien expérimenté. Des problèmes techniques occasionnels tels qu’une augmentation des saignements peuvent augmenter le temps requis.
- Préparer une solution saline stérile contenant 40 mg/mL de kétamine et 6 mg/mL de xylazine. Le volume total devrait être d’au moins 9 μL/g de masse corporelle pour la chirurgie et l’euthanasie après imagerie.
ATTENTION : La kétamine est nocive si elle est injectée, avalée ou au contact de l’œil. Manipuler avec soin. - Assurez-vous que tous les outils chirurgicaux sont propres et stérilisés par autoclavage ou autre méthode approuvée par le Guide des NIH pour le soin et l’utilisation des animaux de laboratoire.
- Entre 15 et 25 minutes avant la chirurgie, injecter à une souris Pirt-GCaMP3 par voie intrapéritonéale (i.p.) ~2,25 μL de kétamine/xylazine pour chaque gramme de poids corporel (90 mg/kg de kétamine, 13,5 mg/kg de xylazine). Ne pas dépasser 120 mg/kg de kétamine.
- Dans les 15 à 25 minutes suivant l’injection de l’anesthésie (étape 1.3), vérifiez si la souris a atteint le plan chirurgical de l’anesthésie en pinçant la patte postérieure controlatérale (pas la patte postérieure ipsilatérale / droite). L’absence de réflexe de retrait des membres postérieurs assure l’atteinte d’un plan chirurgical de l’anesthésie.
REMARQUE: Le réflexe de retrait des membres postérieurs est utilisé tout au long de l’expérience pour surveiller l’anesthésie. Utilisez toujours la patte postérieure controlatérale. - Placez la souris sur un coussin chauffant pour maintenir la température corporelle à 37 °C.
REMARQUE : Il peut être utile de maintenir la tête de la souris en place à l’aide d’un cadre stéréotaxique (voir le tableau des matériaux) ou d’un autre cadre selon les préférences du chercheur. - Localisez l’élargissement lombaire en palpant l’os pelvien de la souris. Rasez le dos de la souris au-dessus de la zone d’élargissement lombaire. Cette étape devrait prendre ~90 s.
REMARQUE: La souris peut être brièvement retirée du coussin chauffant pour le rasage. - Faites une incision rectangulaire à trois côtés (8 mm x 20 mm) au-dessus de l’élargissement lombaire à l’aide de ciseaux et repliez la peau avec une pince (Figure 1A). Cette étape prend ~2 min.
REMARQUE : Les chercheurs peuvent aussi utiliser une pince hémostatique ou un rétracteur pour maintenir l’incision ouverte. Ce n’est pas une chirurgie de survie, donc un nettoyage supplémentaire de la zone chirurgicale n’est pas nécessaire; Cependant, il peut être fait en utilisant de la povidone-iode. La plus grande taille d’incision acceptable est donnée ici. Une incision plus petite est préférable à une incision plus grande. - Utilisez les ciseaux à dissection à ressort de 13 mm pour faire des incisions de 3 à 4 mm sur le côté droit de la colonne vertébrale. Utilisez des ciseaux pour couper la peau et les muscles sur les côtés afin d’exposer la colonne vertébrale (Figure 1B). Cette étape prend ~3 min.
- Utilisez des ciseaux de 8 mm pour nettoyer le processus transversal du DRG L5 droit en coupant le muscle et le tissu conjonctif tout en essayant de minimiser les saignements. Utilisez du coton et/ou de la gelfoam pour absorber le sang. La vertèbre L5 est la première vertèbre rostrale à l’os du bassin.
REMARQUE: Cette étape prend ~ 3 minutes et peut prendre plus de temps si l’animal saigne plus que la normale. - Coupez le processus transversal L5 du côté droit à l’aide de rongeurs Friedman-Pearson ou de pinces fines fortes. Veillez à ne pas toucher le DRG (Figure 1C).
REMARQUE: Cette étape prend ~ 2 minutes mais peut prendre plus de temps si l’animal saigne plus que la normale. - Ne continuez pas jusqu’à ce que le saignement cesse complètement. Prévenir les saignements sur la surface DRG à l’aide de mousse de gel ou de coton. Cette étape dure 1-4 min.
- Déplacez la souris et le coussin chauffant sur la scène personnalisée (Figure 2A,B). Utilisez du ruban de scène pour fixer l’animal et le coussin chauffant en place. Placez le nez de l’animal dans le cône nasal afin qu’il puisse recevoir une anesthésie continue à l’isoflurane. Fixez la patte arrière droite qui dépasse de la scène afin que les stimuli puissent être facilement appliqués à la patte. Cette étape prend 3 min.
- Fixez la colonne vertébrale en place avec les pinces de scène sur la peau sur les vertèbres et / ou l’os pelvien juste rostral et caudale au L5 DRG. Réglez les pinces et la platine pour que la surface du DRG soit aussi plane que possible (Figure 2B,C).
REMARQUE : Il peut être nécessaire de couper le tissu situé entre le DRG et l’objectif. - Placez la platine sous le microscope de manière à ce que l’objectif se trouve à 8 mm directement au-dessus du DRG lorsqu’il est abaissé (Figure 3A,B). Insérez le thermomètre rectal.
REMARQUE: La distance entre le DRG et l’objectif peut varier en fonction de l’objectif, du microscope et de l’animal. - Connectez les lignes électriques au coussin chauffant et au thermomètre rectal. Connectez le cône de nez aux conduites de gaz isoflurane.
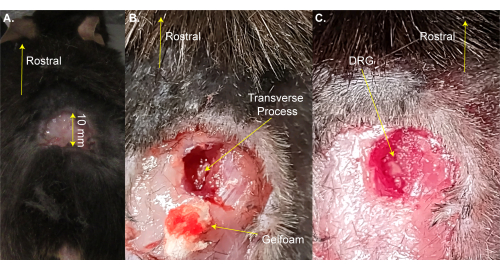
Figure 1 : Exemple de chirurgie d’exposition aux DRG. (A) Une petite zone a été rasée et la peau a été coupée et repliée. L’incision est de ~10 mm sur l’axe rostral-caudal. (B) Une incision a été pratiquée sur le côté droit de la colonne vertébrale et le muscle et le tissu conjonctif ont été coupés, exposant le processus transversal du côté droit L5. Le sang a été absorbé avec de la gelfoam. (C) Le processus transversal a été nettoyé et l’os au-dessus du DRG a été enlevé. Veuillez cliquer ici pour voir une version agrandie de cette figure.
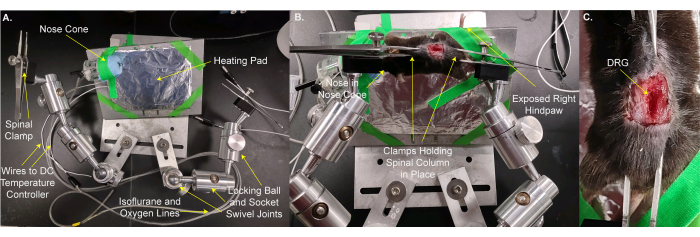
Figure 2 : montage de la souris sur une scène personnalisée pour l’imagerie DRG. (A) L’étape personnalisée est affichée. Il se compose d’une plaque de base et d’une plaque pour l’animal. La plaque de montage de l’animal repose sur une bille de verrouillage et un joint pivotant de douille. Un cône de nez avec des conduites pour fournir un mélange oxygène / isoflurane et une conduite de gaz résiduaires ainsi qu’un coussin chauffant enveloppé de papier d’aluminium sont collés à la plaque de montage de l’animal. Deux bras, chacun constitué de trois rotules de verrouillage et de joints pivotants à douille, sont boulonnés à la plaque de base. Chaque bras a une pince faite de pinces avec une vis pour le serrage et le desserrage. (B) L’animal est monté sur la plaque de montage de l’animal. Son nez est placé dans le cône de nez. Des pinces sont placées sur la peau qui maintient la colonne vertébrale et l’os pelvien. La patte postérieure droite (ipsilatérale) est collée pour sortir et faciliter l’accès à l’application de stimuli. (C) Image rapprochée de la colonne vertébrale serrée et de l’os pelvien. Veuillez cliquer ici pour voir une version agrandie de cette figure.

Figure 3 : L’animal sur le stade personnalisé est placé sous l’objectif du microscope. (A) Une vue grand angle de la scène, de l’animal et du microscope. Les fils vers le régulateur de température CC et les conduites vers l’admission d’oxygène / isoflurane et la conduite de gaz résiduaires sont visibles sur la gauche. (B) Vue rapprochée de l’animal sous l’objectif du microscope. Le DRG est ~8 mm en dessous de l’objectif. Le thermomètre rectal est inséré et le nez est à l’intérieur du cône nasal. Veuillez cliquer ici pour voir une version agrandie de cette figure.
2. Imagerie DRG
- Utilisez un microscope confocal vertical 10x/0,4 objectif DIC et le logiciel associé (voir le tableau des matériaux) pour l’imagerie. Utilisez les paramètres du filtre vert (FITC) : excitation 495 nm, émission 519 nm, longueur d’onde de détection 500-580 nm, appareil d’imagerie GaAsP-Pmt1, détecteur GaAsP-PMT.
REMARQUE: Pour les autres microscopes, utilisez les paramètres recommandés par le fabricant. - Trouvez la surface du DRG avec le microscope. Ajustez les pinces sur la scène de manière à ce que la surface DRG soit aussi plane que possible et que la surface maximale soit visualisée dans le plan focal.
REMARQUE: Le choix de l’objectif peut varier en fonction du microscope utilisé et des préférences de l’utilisateur. Le choix du logiciel dépend du microscope. Un DRG de niveau permet d’obtenir des images plus claires, permet au logiciel de construire des films plus clairs, permet l’imagerie de plus de neurones et rend l’analyse plus facile et plus précise. - Fournir 1 % à 1,5 % d’isoflurane dans le flux d’oxygène au cône nasal pour s’assurer que la souris reste anesthésiée. Surveillez attentivement l’animal tout au long de la procédure pour maintenir l’anesthésie à l’isoflurane sans surdosage.
REMARQUE: La quantité d’isoflurane nécessaire pour maintenir l’anesthésie peut varier selon l’animal et le stimulus. Habituellement, 1,5% est suffisant. Si l’animal se déplace pendant le stimulus, l’isoflurane doit être augmenté. Si la respiration devient superficielle, l’isoflurane doit être diminué. Avant chaque stimulus, testez le réflexe de retrait du membre postérieur sur la patte postérieure controlatérale.
ATTENTION : L’isoflurane peut être nocif ou causer des étourdissements ou de la somnolence en cas d’inhalation. Éviter l’inhalation et n’utiliser que dans un endroit bien ventilé. - Chargez le protocole de balayage rapide du microscope.
- Utilisez les paramètres typiques pour une numérisation rapide : taille du voxel 2,496 μm x 2,496 μm x 16 μm, 512 x 512 pixels, 10 tranches optiques Z-stack, 1 unité aérienne (AU)/32 μm, 1 % 488 nm de puissance laser 5 mW, temps de pixel 1,52 μs, temps de ligne 0,91 ms, temps d’image 465 ms, vitesse de balayage LSM 8, balayage bidirectionnel, Gain du détecteur GaAsP-PMT 650 V, gain numérique 1. Les réglages optimaux peuvent varier selon le microscope et l’animal.
- Pour configurer un protocole d’analyse rapide, cliquez sur l’onglet Acquisition . Sous Paramètres d’acquisition, cliquez sur l’onglet Cadres . Cliquez sur Préréglages > 512 x 512 pour régler le microscope afin d’enregistrer une image de 512 pixels x 512 pixels. Cela définira à son tour les valeurs X et Y de la taille du voxel en fonction de la taille de l’image, qui est déterminée par le logiciel de microscope.
- Sous Paramètres d’acquisition, cliquez sur l’onglet Canaux . Cliquez sur la case Track2 . Utilisez le menu déroulant à côté de la zone Track2 pour sélectionner Green (FITC). Un nouvel onglet s’ouvrira sous Track2.
- À côté de Lasers, cliquez sur la case 488 . Cela réglera les longueurs d’onde d’excitation et d’émission.
- À côté du curseur de 488 nm, réglez Puissance laser sur 1%. Cliquez sur le bouton 1 AU pour régler l’ouverture de 1 unité Airy. Sous FITC, définissez Master Gain sur 650 V, Digital Offset sur 0 et Digital Gain sur 1.
- Sous l’onglet Acquisition , cochez la case Z-Stack . Cliquez sur le bouton Live pour voir une image en direct du ganglion. Tournez le bouton du plan focal jusqu’à ce que seul un petit arc de neurones soit visible.
- Sous Paramètres d’acquisition, cliquez sur l’onglet Z-Stack > sur le bouton Définir en dernier . Tournez le bouton du plan focal vers le bas jusqu’à ce que seul un petit arc de neurones soit visible. Sous Paramètres d’acquisition, cliquez sur l’onglet Z-Stack > le bouton Définir en premier . Cliquez sur le bouton En direct pour désactiver l’image en direct .
- Sous Paramètres d’acquisition, cliquez sur l’onglet Z-Stack . Renseignez le champ Tranches avec 10. Cela définira 10 tranches optiques et déterminera automatiquement la profondeur du voxel.
- Sous l’onglet Acquisition, cliquez sur la case Séries chronologiques . Un nouvel onglet Séries chronologiques apparaîtra sous Paramètres d’acquisition. Cliquez sur l’onglet Séries chronologiques > le champ Cycles avec le nombre de cycles que vous souhaitez effectuer ensuite. Dans ce cas, c’est 8.
- Définissez la vitesse et la direction de l’analyse. Sous Paramètres d’acquisition , l’onglet Mode d’acquisition > > Direction > Flèche à double tête pour le balayage bidirectionnel. Sélectionnez l’onglet Mode d’acquisition > curseur Frame > Scan Speed > 8.
REMARQUE: Normalement, on peut charger les paramètres d’une expérience antérieure et n’avoir à ajuster la puissance laser que si l’image est trop lumineuse ou trop sombre et ajuster le Z-Stack Set Last et Set First.
- Faites un court scan de 8 cycles du DRG en cliquant sur Démarrer l’expérience sous l’onglet Acquisition . Créez un film en effectuant une projection orthogonale des numérisations (une numérisation par image) au fil du temps et vérifiez manuellement la clarté de l’image et les artefacts d’imagerie tels que les « ondes » de luminosité traversant le DRG. Ajustez la position de la pince et l’épaisseur de la section optique et répétez cette étape jusqu’à ce qu’un film clair et de haute qualité soit obtenu.
REMARQUE : Cette étape doit être répétée si l’animal bouge ou est déplacé par l’investigateur. Les problèmes à rechercher comprennent les zones du ganglion (pas seulement les neurones individuels) qui semblent devenir plus claires et plus sombres au cours de l’expérience, créant une apparence ondulée ou provoquant la disparition ou la luminosité de zones. Un mouvement supérieur à environ la moitié du diamètre d’un petit neurone (<20 μm) est un autre problème majeur. L’ondulation peut souvent être corrigée en rapprochant la première et la dernière position du Z-Stack (voir étape 2.4.4 ci-dessus) et en réduisant l’épaisseur de la tranche optique. Le film 1 fournit un exemple de ganglions ondulés avant de niveler et de régler l’épaisseur de tranche optique correcte. Le film 2 est après correction du nivellement et de l’épaisseur de la tranche optique. La différence est subtile, mais elle a un effet énorme sur l’analyse. - Chargez le protocole de balayage haute résolution du microscope.
- Utilisez les paramètres typiques pour la numérisation haute résolution : taille du voxel 1,248 μm x 1,248 μm x 14 μm, 1024 x 1024 pixels, 6 tranches optiques Z-stack, 1,2 unité aérienne (AU)/39 μm, 5 % 488 nm de puissance laser/25 mW, temps de pixel 2,06 μs, temps de ligne 4,95 ms, temps d’image 5,06 s, vitesse de numérisation LSM 6, balayage bidirectionnel, Gain du détecteur GaAsP-PMT 650 V, gain numérique 1. Les réglages optimaux peuvent varier selon le microscope et l’animal.
- Pour configurer un protocole d’analyse haute résolution, cliquez sur l’onglet Acquisition . Sous Paramètres d’acquisition, cliquez sur l’onglet Cadres . Cliquez sur Préréglages > 1024 x 1024 pour régler le microscope afin d’enregistrer une image de 1024 pixels x 1024 pixels. Cela définira à son tour les valeurs X et Y de la taille du voxel en fonction de la taille de l’image, qui est déterminée par le logiciel de microscope.
- Sous Paramètres d’acquisition, cliquez sur l’onglet Canaux . Cliquez sur la case Track2 . Utilisez le menu déroulant à côté de la zone Track2 pour sélectionner Green (FITC). Un nouvel onglet s’ouvrira sous Track2.
- À côté de Lasers, cliquez sur la case 488 . Cela réglera les longueurs d’onde d’excitation et d’émission. Cliquez sur la case High Intensity Laser Range (Portée laser haute intensité ).
- À côté du curseur de 488 nm, réglez Puissance laser sur 5%. Cliquez sur le bouton 1 AU pour régler l’ouverture de 1 unité Airy. Sous FITC, définissez le gain principal sur 650 V, le décalage numérique sur 0 et le gain numérique sur 1.
- Sous l’onglet Acquisition , cochez la case Z-Stack . Cliquez sur le bouton Live pour voir une image en direct du ganglion. Tournez le bouton du plan focal jusqu’à ce que seul un petit arc de neurones soit visible.
- Sous Paramètres d’acquisition, cliquez sur l’onglet Z-Stack > le bouton Définir en dernier . Tournez le bouton du plan focal vers le bas jusqu’à ce que seul un petit arc de neurones soit visible. Sous Paramètres d’acquisition, cliquez sur l’onglet Z-Stack > sur le bouton Définir en premier . Cliquez sur le bouton En direct pour désactiver l’image en direct .
- Sous Paramètres d’acquisition, cliquez sur l’onglet Z-Stack . Remplissez le champ Tranches avec 6. Cela définira 6 tranches optiques et déterminera automatiquement la profondeur du voxel.
- Sous l’onglet Acquisition , assurez-vous que la case Séries chronologiques n’est pas cochée (aucune série chronologique ).
- Définissez la vitesse et la direction de l’analyse. Sous Paramètres d’acquisition, cliquez sur l’onglet Mode d’acquisition > Préréglages de > d’images > 1024 x 1024. Sélectionnez l’onglet Mode d’acquisition > Frame > Direction > Flèche à double tête pour la numérisation bidirectionnelle. Sélectionnez l’onglet Mode d’acquisition > curseur Vitesse de balayage > image > 6.
- Si les cellules sont marquées avec une tomate td, réglez le microscope pour balayer le canal rouge 592 nm d’excitation/614 nm d’émission, la longueur d’onde de détection 600-700 nm en plus du canal vert. Définissez cela en allant dans Paramètres d’acquisition et cliquez sur l’onglet Canaux > la case Track1 . Utilisez le menu déroulant à côté de la zone Track1 pour sélectionner Rouge (Texas Red). Suivez le même processus qu’à l’étape 2.6.3, sauf que cliquez sur la case 561 au lieu de la case 488 . Réglez la puissance laser sur 1%. La tomate Td est beaucoup plus brillante que la GCaMP3 et nécessite une puissance laser plus faible.
- Créez une image haute résolution du DRG en cliquant sur le bouton Démarrer l’expérience sous l’onglet Acquisition .
- Chargez le protocole de balayage rapide du microscope (voir étape 2.4). Enregistrer l’activité spontanée dans le DRG pendant 80 cycles (environ 10 min). Générez un film de projection orthogonal et vérifiez que l’image est de qualité suffisante pour l’analyse.
REMARQUE : Les considérations relatives à la qualité sont les mêmes qu’à l’étape 2.5. - Pour appliquer des stimuli, réglez le microscope pour effectuer 15 à 20 scans. Attendez que les analyses 1 à 5 soient terminées pour produire la ligne de base. Appliquez le stimulus pendant les scans 6-10. Attendez au moins 5 minutes après chaque stimulus avant d’appliquer le stimulus suivant pour éviter la désensibilisation.
REMARQUE: Les stimuli mécaniques doivent être appliqués en premier, puis les stimuli froids, thermiques et chimiques. Des stimuli plus faibles (p. ex. faible force mécanique, températures plus proches de la température ambiante) devraient être appliqués avant des stimuli plus forts (p. ex. force mécanique plus élevée, températures plus éloignées de la température ambiante). Lorsque vous appliquez des stimuli, assurez-vous de ne provoquer aucun mouvement du DRG. Pour les stimuli thermiques forts en particulier, il est souvent nécessaire d’appliquer 2% d’isoflurane pendant 1-2 min avant de commencer le stimulus. Sur le microscope utilisé dans cette étude, chaque balayage peut être entendu clairement, de sorte que le chercheur peut facilement identifier la fin de l’analyse, permettant l’application du stimulus immédiatement après l’analyse 5. Cependant, toute méthode qui facilite l’application de stimuli à un moment cohérent fonctionnera. - Pour une pression mécanique, tenez la pince de l’algomètre avec la patte entre les palettes sans toucher la patte, et pincez en commençant immédiatement après la fin du scan 5 et en s’arrêtant immédiatement après le scan 10. Surveillez la force de la presse à l’aide d’un algomètre (voir le tableau des matériaux). Gardez la force de presse aussi proche que possible de la force souhaitée (nous utilisons ici un stimulus de pression de 100 g) et assurez-vous qu’elle ne dépasse pas 10 g sur la force souhaitée.
REMARQUE: On peut détecter des stimuli avec aussi peu que 0,07 g de filaments von Frey et jusqu’à 600 g de force de presse. - Pour les stimuli froids et thermiques, refroidissez ou chauffez un bécher d’eau juste en dessous (pour le froid) ou au-dessus (pour le thermique) de la température souhaitée et commencez à balayer. Ici, utilisez un stimulus à 45 °C. Lorsque l’eau est à la bonne température, appliquez le stimulus immédiatement après le balayage 5 en immergeant la patte dans l’eau. Retirez le bécher immédiatement après le balayage 10.
REMARQUE: La température doit être à moins de 1 ° C de la température souhaitée lors de l’analyse 5. Si la température du bécher est incorrecte, n’appliquez pas le stimulus car cela pourrait désensibiliser les neurones. Au lieu de cela, refroidissez ou réchauffez l’eau et réessayez. Nous avons mesuré des températures aussi basses que 0 ° C (eau glacée) et aussi élevées que 95 ° C. Cependant, rappelez-vous que des températures supérieures à 50 ° C peuvent endommager les tissus et perturber les expériences ultérieures. De même, certains produits chimiques (par exemple la tétrodotoxine, la capsaïcine) sont irréversibles ou ne peuvent pas être éliminés et peuvent empêcher d’autres expériences sur l’animal. - Une fois que tous les stimuli ont été appliqués et enregistrés, euthanasier l’animal par surdosage avec de la kétamine/xylazine (200 mg/kg de kétamine, 30 mg/kg de xylazine ou 5 μL par gramme de masse corporelle de solution préparée à l’étape 1.1) suivi d’une décapitation.
3. Analyse des données
- Ouvrez les fichiers image par glisser-déposer dans ImageJ. Après avoir ouvert le fichier, sélectionnez le type d’image sous Image > Type > couleur RVB.
REMARQUE: Le plug-in StackReg21 sous Plugins > StackReg est utile pour corriger et aligner les artefacts de mouvement. ImageJ peut lire la plupart des formats de fichiers de logiciels de microscope. Le choix du type d’image dépend des préférences de l’utilisateur. RVB simplifie la production d’images couleur pour la publication. Les progiciels du fabricant de microscope ou cytoNet22 peuvent également aider à l’analyse. Il n’est pas nécessaire de télécharger, d’installer et d’utiliser StackReg, mais c’est recommandé. - Utilisez l’outil de région d’intérêt (ROI) pour sélectionner des neurones actifs sous Analyser > outil > Gestionnaire de retour sur investissement. Dessinez des ROI à l’aide des outils ellipse ou rectangle de la barre d’outils et placez-les dans le fichier ROI en appuyant sur le bouton Ajouter sous Ajouter dans la fenêtre du gestionnaire de ROI, ou en appuyant sur la touche « t ».
REMARQUE: Assurez-vous d’enregistrer fréquemment le fichier ROI. Les utilisateurs peuvent toujours restaurer les ROI en faisant glisser et déposer un fichier ROI dans ImageJ et en cliquant sur la case Afficher tout en bas de la fenêtre ROI Manager. L’enregistrement en superposition n’est pas recommandé. D’expérience, l’enregistrement en tant que fichier ROI.zip simplifie l’analyse. - Sous Analyser > définir les mesures, assurez-vous que l’option de valeur de gris moyenne est cochée ; décochez toutes les autres cases sous Définir les mesures. Utilisez l’outil multi-mesures du menu du gestionnaire de retour sur investissement pour calculer l’intensité dans les ROI. Mesurez l’intensité à l’aide de la fenêtre ROI sous Plus > Multimesure.
REMARQUE: Parfois, les neurones adjacents seront trop proches les uns des autres pour tirer des ROI séparés. Ces neurones ne peuvent pas être utilisés pour mesurer l’intensité transitoire, mais peuvent être inclus dans le nombre de neurones activateurs. - Enregistrez le fichier CSV généré par Multimeasure et ouvrez le fichier CSV avec n’importe quel tableur.
REMARQUE : Voir Fichier supplémentaire 1 pour un exemple de modèle de feuille de calcul pour faciliter l’analyse. - Calculer l’intensité transitoire Ca 2+ comme ΔF / F 0 = (F t- F 0) / F 0, où Ft est l’intensité de pixel dans un ROI au point temporel d’intérêt, et F 0 est l’intensité de base déterminée en faisant la moyenne des intensités des 2-4 images avant le transitoire Ca 2+ pour l’activité spontanée ou les 1-5 premières images du ROI pour Ca 2+ transitoires survenant pendant la stimulation. Exclure tous les neurones produisant des pics de Ca2+ avant le stimulus et ne pas analyser l’activité après la fin du stimulus.
- Pour l’analyse de l’intensité transitoire Ca2+ , échantillonner au hasard un nombre approximativement égal de neurones de chaque ganglion pour éviter de fausser les données vers les ganglions qui ont produit le plus grand nombre de neurones répondants. Exclure les pics où ΔF / F 0 <0,15 .
NOTE: Il existe d’autres méthodes publiées d’analyse et d’inclusion/exclusion de neurones 11,12,23,24,25,26,27,28. - Mesurez les diamètres des neurones à l’aide de l’outil Ligne de la barre d’outils dans ImageJ. Calculez le diamètre moyen à partir des lignes tracées le long des diamètres les plus longs et les plus courts.
Access restricted. Please log in or start a trial to view this content.
Résultats
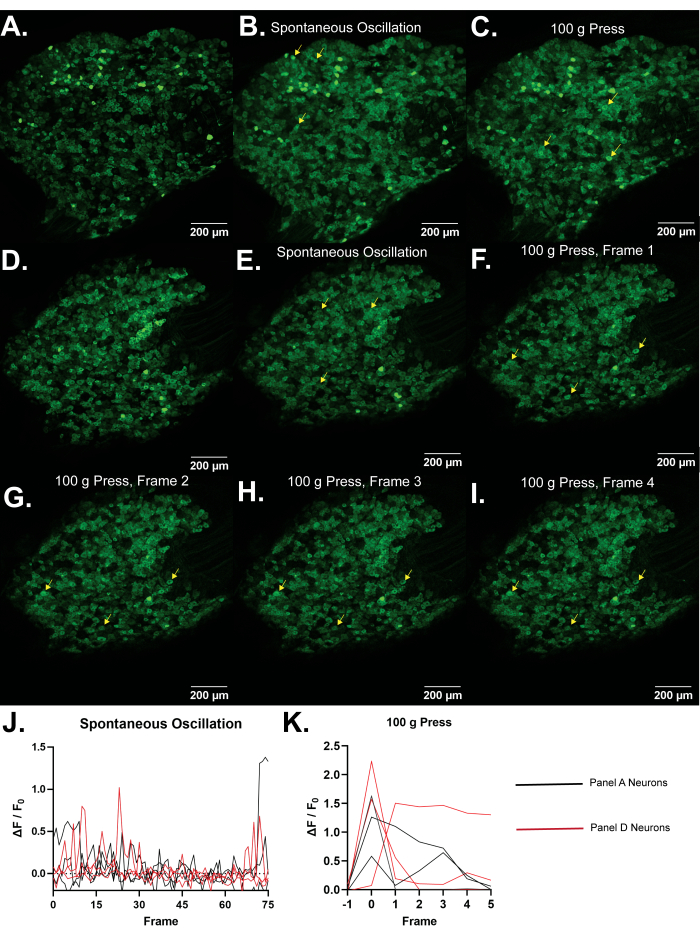
Figure 4 : Images représentatives des ganglions de la racine dorsale L5 de souris Pirt-GCaMP3. (A,D) Des scans haute résolution à image unique des ganglions de la racine dorsale L5 de souris Pirt-GCaMP3 sont montrés. (B, E) . Projections d’intensité moyenne de 15 images de ganglions DRG de Pi...
Access restricted. Please log in or start a trial to view this content.
Discussion
La douleur persistante est présente dans un large éventail de troubles, débilitante et/ou réduisant la qualité de vie d’environ 8% des personnes29. Les neurones sensoriels primaires détectent les stimuli nocifs sur la peau, et leur plasticité contribue à la persistance de la douleur8. Bien que les neurones puissent être étudiés en culture cellulaire et explants, cela les éloigne de leur contexte physiologique normal. L’exposition chirurgicale du DRG, suivie ...
Access restricted. Please log in or start a trial to view this content.
Déclarations de divulgation
Les auteurs ne déclarent aucun intérêt financier concurrent.
Remerciements
Ce travail a été soutenu par les subventions R01DE026677 et R01DE031477 des National Institutes of Health (à Y.S.K.), UTHSCSA startup fund (Y.S.K.) et un prix Rising STAR du système de l’Université du Texas (Y.S.K.).
Access restricted. Please log in or start a trial to view this content.
matériels
| Name | Company | Catalog Number | Comments |
| Anased Injection (Xylazine) | Covetrus, Akorn | 33197 | |
| C Epiplan-Apochromat 10x/0.4 DIC | Cal Zeiss | 422642-9900-000 | |
| Cotton Tipped Applicators | McKesson | 24-106-1S | |
| Curved Hemostat | Fine Science Tools | 13007-12 | |
| DC Temperature Controller | FHC | 40-90-8D | |
| DC Temperature Controller Heating Pad | FHC | 40-90-2-05 | |
| Dumont Ceramic Coated Forceps | Fine Science Tools | 11252-50 | |
| FHC DC Temperature Controller | FHC | 40-90-8D | |
| Fluriso (Isoflurane) | MWI Animal Health, Piramal Group | 501017 | |
| Friedman-Pearson Rongeurs | Fine Science Tools | 16221-14 | |
| GelFoam | Pfizer | 09-0353-01 | |
| Ketaset (Ketamine) | Zoetis | KET-00002R2 | |
| Luminescent Green Stage Tape | JSITON/ Amazon | B803YW8ZWL | |
| Matrx VIP 3000 Isoflurane Vaporizer | Midmark | 91305430 | |
| Micro dissecting scissors | Roboz | RS-5882 | |
| Micro dissecting spring scissors | Fine Science Tools | 15023-10 | |
| Micro dissecting spring scissors | Roboz | RS-5677 | |
| Mini Rectal Thermistor Probe | FHC | 40-90-5D-02 | |
| Operating scissors | Roboz | RS-6812 | |
| Pirt-GCaMP3 C57BL/6J mice | Johns Hopkins University | N/A | Either sex can be imaged equally well. Mice should be at least 8 weeks old due to weak or intermittent Pirt promoter expression in younger mice. |
| SMALGO small animal algometer | Bioseb In vivo Research Instruments | BIO-SMALGO | |
| Stereotaxic frame | Kopf Model 923-B | 923-B | |
| td-Tomato C57BL/6J mice | Jackson Laboratory | 7909 | |
| Top Plate, 6 in x 10 in | Newport | 290-TP | |
| TrpV1-Cre C57BL/6J mice | Jackson Laboratory | 17769 | |
| Zeiss LSM 800 confocal microscope | Cal Zeiss | LSM800 | |
| Zeiss Zen 2.6 Blue Edition Software | Cal Zeiss | Zen (Blue Edition) 2.6 |
Références
- Rivero-Melián, C., Grant, G. Distribution of lumbar dorsal root fibers in the lower thoracic and lumbosacral spinal cord of the rat studied with choleragenoid horseradish peroxidase conjugate. The Journal of Comparative Neurology. 299 (4), 470-481 (1990).
- Wessels, W. J., Marani, E. A rostrocaudal somatotopic organization in the brachial dorsal root ganglia of neonatal rats. Clinical Neurology and Neurosurgery. 95, 3-11 (1993).
- Schmalbruch, H. The number of neurons in dorsal root ganglia L4-L6 of the rat. The Anatomical Record. 219 (3), 315-322 (1987).
- Sørensen, B., Tandrup, T., Koltzenburg, M., Jakobsen, J. No further loss of dorsal root ganglion cells after axotomy in p75 neurotrophin receptor knockout mice. The Journal of Comparative Neurology. 459 (3), 242-250 (2003).
- Basbaum, A. I., Woolf, C. J. Pain. Current Biology. 9 (12), 429-431 (1999).
- Liu, Y., Ma, Q. Generation of somatic sensory neuron diversity and implications on sensory coding. Current Opinion in Neurobiology. 21 (1), 52-60 (2011).
- Basbaum, A. I., Bautista, D. M., Scherrer, G., Julius, D. Cellular and molecular mechanisms of pain. Cell. 139 (2), 267-284 (2009).
- Stucky, C. L., Mikesell, A. R. Cutaneous pain in disorders affecting peripheral nerves. Neuroscience Letters. 765, 136233(2021).
- Iseppon, F., Linley, J. E., Wood, J. N. Calcium imaging for analgesic drug discovery. Neurobiology of Pain. 11, 100083(2022).
- Chen, Z., et al. Adjacent intact nociceptive neurons drive the acute outburst of pain following peripheral axotomy. Scientific Reports. 9 (1), 7651(2019).
- Chisholm, K. I., Khovanov, N., Lopes, D. M., La Russa, F., McMahon, S. B. Large scale in vivo recording of sensory neuron activity with GCaMP6. eNeuro. 5 (1), (2018).
- Emery, E. C., et al. In vivo characterization of distinct modality-specific subsets of somatosensory neurons using GCaMP. Science Advances. 2 (11), 1600990(2016).
- Ishida, H., et al. In vivo calcium imaging visualizes incision-induced primary afferent sensitization and its amelioration by capsaicin pretreatment. The Journal of Neuroscience. 41 (41), 8494-8507 (2021).
- Kim, Y. S., et al. Coupled activation of primary sensory neurons contributes to chronic pain. Neuron. 91 (5), 1085-1096 (2016).
- MacDonald, D. I., et al. Silent cold-sensing neurons contribute to cold allodynia in neuropathic pain. Brain. 144 (6), 1711-1726 (2021).
- Wang, F., et al. Sensory afferents use different coding strategies for heat and cold. Cell Reports. 23 (7), 2001-2013 (2018).
- Kucharczyk, M. W., et al. The impact of bone cancer on the peripheral encoding of mechanical pressure stimuli. Pain. 161 (8), 1894-1905 (2020).
- Kim, A. Y., et al. a phosphoinositide-binding protein, functions as a regulatory subunit of TRPV1. Cell. 133 (3), 475-485 (2008).
- Kim, Y. S., et al. Central terminal sensitization of TRPV1 by descending serotonergic facilitation modulates chronic pain. Neuron. 81 (4), 873-887 (2014).
- Tian, L., et al. Imaging neural activity in worms, flies and mice with improved GCaMP calcium indicators. Nature Methods. 6 (12), 875-881 (2009).
- Thévenaz, P., Ruttimann, U. E., Unser, M. A pyramid approach to subpixel registration based on intensity. IEEE Transactions on Image Processing. 7 (1), 27-41 (1998).
- Mahadevan, A. S., et al. cytoNet: Spatiotemporal network analysis of cell communities. PLoS Computational Biology. 18 (6), 1009846(2022).
- Barretto, R. P., et al. The neural representation of taste quality at the periphery. Nature. 517 (7534), 373-376 (2015).
- Leijon, S. C. M., et al. Oral thermosensing by murine trigeminal neurons: modulation by capsaicin, menthol and mustard oil. The Journal of Physiology. 597 (7), 2045-2061 (2019).
- Sekiguchi, K. J., et al. Imaging large-scale cellular activity in spinal cord of freely behaving mice. Nature Communications. 7, 11450(2016).
- Wu, A., Dvoryanchikov, G., Pereira, E., Chaudhari, N., Roper, S. D. Breadth of tuning in taste afferent neurons varies with stimulus strength. Nature Communications. 6, 8171(2015).
- Ran, C., Hoon, M. A., Chen, X. The coding of cutaneous temperature in the spinal cord. Nature Neuroscience. 19 (9), 1201-1209 (2016).
- Yarmolinsky, D. A., et al. Coding and plasticity in the mammalian thermosensory system. Neuron. 92 (5), 1079-1092 (2016).
- Torrance, N., Smith, B. H., Bennett, M. I., Lee, A. J. The epidemiology of chronic pain of predominantly neuropathic origin. Results from a general population survey. The Journal of Pain. 7 (4), 281-289 (2006).
- Shannonhouse, J., et al. Meclizine and metabotropic glutamate receptor agonists attenuate severe pain and Ca(2+) activity of primary sensory neurons in chemotherapy-induced peripheral neuropathy. The Journal of Neuroscience. 42 (31), 6020-6037 (2022).
- Luiz, A. P., et al. Cold sensing by Na(V)1.8-positive and Na(V)1.8-negative sensory neurons. Proceedings of the National Academy of Sciences of the United States of America. 116 (9), 3811-3816 (2019).
- Hartung, J. E., Gold, M. S. GCaMP as an indirect measure of electrical activity in rat trigeminal ganglion neurons. Cell Calcium. 89, 102225(2020).
- Chung, M. K., Wang, S., Oh, S. L., Kim, Y. S. Acute and chronic pain from facial skin and oral mucosa: Unique neurobiology and challenging treatment. International Journal of Molecular Sciences. 22 (11), 5810(2021).
- Chan, S. L., Mayne, M., Holden, C. P., Geiger, J. D., Mattson, M. P. Presenilin-1 mutations increase levels of ryanodine receptors and calcium release in PC12 cells and cortical neurons. The Journal of Biological Chemistry. 275 (24), 18195-18200 (2000).
- Sierra, D. A., Popov, S., Wilkie, T. M. Regulators of G-protein signaling in receptor complexes. Trends in Cardiovascular Medicine. 10 (6), 263-268 (2000).
- Yoshihara, K., et al. Astrocytic Ca(2+) responses in the spinal dorsal horn by noxious stimuli to the skin. Journal of Pharmacological Sciences. 137 (1), 101-104 (2018).
- Tan, C. H., McNaughton, P. A. The TRPM2 ion channel is required for sensitivity to warmth. Nature. 536 (7617), 460-463 (2016).
- Akemann, W., Mutoh, H., Perron, A., Rossier, J., Knöpfel, T. Imaging brain electric signals with genetically targeted voltage-sensitive fluorescent proteins. Nature Methods. 7 (8), 643-649 (2010).
- Gong, Y., et al. High-speed recording of neural spikes in awake mice and flies with a fluorescent voltage sensor. Science. 350 (6266), 1361-1366 (2015).
- Grewe, B. F., Langer, D., Kasper, H., Kampa, B. M., Helmchen, F. High-speed in vivo calcium imaging reveals neuronal network activity with near-millisecond precision. Nature Methods. 7 (5), 399-405 (2010).
- Harada, K., et al. Red fluorescent protein-based cAMP indicator applicable to optogenetics and in vivo imaging. Scientific Reports. 7 (1), 7351(2017).
Access restricted. Please log in or start a trial to view this content.
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationExplorer plus d’articles
This article has been published
Video Coming Soon