A subscription to JoVE is required to view this content. Sign in or start your free trial.
Method Article
ב Vivo הדמיית סידן של הרכבים עצביים ברשתות של נוירונים חושיים ראשוניים בגרעיני שורש גבי שלמים
In This Article
Summary
פרוטוקול זה מתאר את החשיפה הכירורגית של גנגליון השורש הגבי (DRG) ואחריו GCaMP3 (אינדיקטור Ca2+ מקודד גנטית; חלבון פלואורסצנטי ירוק-קלמודולין-M13 חלבון 3) Ca2+ הדמיה של הרכבים עצביים באמצעות עכברי Pirt-GCaMP3 תוך הפעלת מגוון גירויים על הכף האחורית ipsilateral.
Abstract
הדמיית Ca 2+ יכולה לשמש כפרוקסי לפעילות תאית, כולל פוטנציאלי פעולה ומנגנוני איתות שונים הכוללים כניסה של Ca 2+ לציטופלסמה או שחרור מאגרי Ca 2+ תוך תאיים. הדמיית Ca2+ מבוססת Pirt-GCaMP3 של נוירונים חושיים ראשוניים של גנגליון השורש הגבי (DRG) בעכברים מציעה את היתרון של מדידה בו זמנית של מספר רב של תאים. ניתן לנטר עד 1,800 תאי עצב, מה שמאפשר לרשתות עצביות ולתהליכים סומטוסנסוריים להיחקר כמכלול בהקשר הפיזיולוגי הרגיל שלהם ברמת האוכלוסייה in vivo. המספר הגדול של תאי עצב המנוטרים מאפשר זיהוי של דפוסי פעילות שיהיה מאתגר לזהות באמצעות שיטות אחרות. גירויים יכולים להיות מיושמים על כף העכבר האחורית, המאפשר את ההשפעות הישירות של גירויים על הרכב נוירונים DRG להילמד. מספר תאי העצב המייצרים Ca 2+ transients כמו גם המשרעת של Ca2+ transients מצביע על רגישות לאופני חוש ספציפיים. קוטר תאי העצב מספק עדות לסוגי סיבים פעילים (מכנו לא מזיק לעומת סיבי כאב מזיקים, סיבי Aβ, Aδ ו-C). נוירונים המבטאים קולטנים ספציפיים יכולים להיות מסומנים גנטית עם td-Tomato ורקומבינזות Cre ספציפיות יחד עם Pirt-GCaMP. לכן, הדמיית Pirt-GCaMP3 Ca2+ של DRG מספקת כלי רב עוצמה ומודל לניתוח של אופני חישה ספציפיים ותת-סוגים של נוירונים הפועלים כאנסמבל ברמת האוכלוסייה לחקר כאב, גירוד, מגע ואותות סומטוסנסורים אחרים.
Introduction
נוירונים חושיים ראשוניים מעצבבים ישירות את העור ונושאים מידע סומטוסנסורי חזרה למערכת העצבים המרכזית 1,2. גרעיני שורש דורסלי (DRGs) הם צבירי גוף תאים של 10,000-15,000 נוירונים חושיים ראשוניים 3,4. נוירוני DRG מציגים גדלים שונים, רמות מיאלינציה ודפוסי ביטוי גנים וקולטנים. נוירונים בקוטר קטן יותר כוללים נוירונים קולטי כאב ותאי עצב בקוטר גדול יותר מגיבים בדרך כלל לגירויים מכניים לא כואבים 5,6. הפרעות בנוירונים החושיים הראשוניים כגון פציעה, דלקת כרונית ונוירופתיות היקפיות יכולות לגרום לרגישות נוירונים אלה לגירויים שונים ולתרום לכאב כרוני, אלודיניה ורגישות יתר לכאב 7,8. לכן, המחקר של נוירוני DRG חשוב להבנת הסומטוסנסציה באופן כללי והפרעות כאב וגירוד רבות.
תאי עצב היורים in vivo חיוניים לסומטוסנסציה, אך עד לאחרונה, כלים לחקר גרעינים שלמים in vivo היו מוגבלים למספר קטן יחסית של תאים9. במאמר זה אנו מתארים שיטה רבת עוצמה לחקר פוטנציאלי הפעולה או הפעילויות של תאי עצב ברמת האוכלוסייה in vivo כמכלול. השיטה משתמשת בדימות המבוסס על דינמיקה ציטופלזמית Ca2+. המדדים הפלואורסצנטיים הרגישים Ca 2+ הם פרוקסי טוב למדידת הפעילות התאית בשל הריכוז הנמוך בדרך כלל של Ca2+ ציטופלזמי. אינדיקטורים אלה אפשרו ניטור סימולטני של מאות עד כמה אלפי נוירונים חושיים ראשוניים בעכברים 9,10,11,12,13,14,15,16 ובחולדות 17. השיטה של הדמיה in vivo Ca2+ המתוארת במחקר זה יכולה לשמש לצפייה ישירה בתגובות ברמת האוכלוסייה לגירויים מכניים, קרים, תרמיים וכימיים.
חלבון הממברנה קושר הפוספואינוזיטיד Pirt מבוטא ברמות גבוהות כמעט בכל (>95%) נוירוני החישה הראשוניים18,19 וניתן להשתמש בו כדי להניע את הביטוי של חיישן Ca 2+, GCaMP3, כדי לנטר את פעילות הנוירונים in vivo20. בפרוטוקול זה, מתוארות טכניקות לביצוע ניתוח DRG in vivo, הדמיה Ca2+ וניתוח בצד ימין מותני 5 (L5) DRG של עכברי Pirt-GCaMP314 באמצעות מיקרוסקופ סריקת לייזר קונפוקלי (LSM).
Access restricted. Please log in or start a trial to view this content.
Protocol
כל ההליכים המתוארים כאן בוצעו בהתאם לפרוטוקול שאושר על ידי הוועדה המוסדית לטיפול ושימוש בבעלי חיים של המרכז למדעי הבריאות של אוניברסיטת טקסס בסן אנטוניו.
הערה: לאחר תחילת הניתוח, יש להשלים ניתוח בעלי חיים (שלב 1) והדמיה (שלב 2) באופן רציף. ניתוח נתונים (שלב 3) עשוי להתבצע מאוחר יותר.
1. ניתוח ואבטחת בעל החיים להדמיית L5 DRG בצד ימין
הערה: במחקר זה נעשה שימוש בעכברי Pirt-GCaMP3 C57BL/6J בני 8 שבועות ומעלה. בעוד שניתן לצלם את שני המינים באותה מידה, עכברים צריכים להיות בני 8 שבועות לפחות עקב ביטוי פירט חלש או לסירוגין בעכברים צעירים. עכברי Pirt-GCaMP3 C57BL/6J נוצרו באוניברסיטת ג'ונס הופקינס14. ניתן לצלם DRG משני הצדדים, וניתן לצלם DRG מותני אחר (למשל, מותני 4). הזמנים הניתנים הם הערכות עבור מנתח מנוסה. בעיות טכניות מזדמנות כגון דימום מוגבר עשויות להאריך את הזמן הנדרש.
- הכינו תמיסת מלח סטרילית המכילה 40 מ"ג/מ"ל קטמין ו-6 מ"ג/מ"ל קסילזין. הנפח הכולל צריך להיות לפחות 9 μL / g של מסת הגוף הן עבור ניתוח המתת חסד לאחר הדמיה.
אזהרה: קטמין מזיק אם הוא מוזרק, נבלע או בא במגע עם העין. טפל בזהירות. - ודא שכל כלי הניתוח נקיים ומעוקרים על ידי אוטוקלאבינג או מדריך אחר של NIH לטיפול ושימוש בשיטה שאושרה על ידי חיות מעבדה.
- בין 15 ל-25 דקות לפני הניתוח, יש להזריק לעכבר Pirt-GCaMP3 תוך צפקי (כלומר) ~2.25 מיקרוליטר קטמין/קסילזין לכל גרם של משקל גוף (90 מ"ג/ק"ג קטמין, 13.5 מ"ג/ק"ג קסילזין). אין לחרוג מ-120 מ"ג/ק"ג קטמין.
- תוך 15 עד 25 דקות לאחר הזרקת ההרדמה (שלב 1.3), בדוק אם העכבר הגיע למישור הכירורגי של ההרדמה על ידי צביטת הכף האחורית הנגדית (ולא הכף האחורית האיפסילטרלית/הימנית). היעדר רפלקס נסיגה בגפיים האחוריות מבטיח כי מטוס כירורגי של הרדמה מושגת.
הערה: רפלקס נסיגה של הגפיים האחוריות משמש לאורך כל הניסוי כדי לפקח על הרדמה. השתמש תמיד בכפה האחורית הנגדית. - הנח את העכבר על כרית מחוממת כדי לשמור על טמפרטורת הגוף ב 37 ° C.
הערה: ייתכן שיהיה מועיל להחזיק את ראש העכבר במקומו באמצעות מסגרת סטריאוטקסית (ראה טבלת חומרים), או מסגרת אחרת בהתאם להעדפת החוקר. - אתר את ההגדלה המותנית על ידי תחושה לעצם האגן של העכבר. יש לגלח את גב העכבר מעל אזור ההגדלה המותני. שלב זה צריך לקחת ~ 90 שניות.
הערה: ניתן להסיר את העכבר לזמן קצר מהפד המחומם לצורך גילוח. - בצעו חתך מלבני תלת-צדדי (8 מ"מ x 20 מ"מ) מעל ההגדלה המותנית באמצעות מספריים וקפלו את העור בעזרת מלקחיים (איור 1A). שלב זה לוקח ~ 2 דקות.
הערה: חוקרים עשויים גם להשתמש במלקחיים hemostat או retractor כדי להחזיק את החתך פתוח. זה לא ניתוח הישרדות, ולכן ניקוי נוסף של אזור הניתוח אינו הכרחי; עם זאת, זה יכול להיעשות באמצעות povidone-יוד. גודל החתך הגדול ביותר המקובל ניתן כאן. חתך קטן עדיף על חתך גדול יותר. - השתמש במספריים לדיסקציה קפיץ 13 מ"מ כדי לבצע חתכים 3-4 מ"מ בצד ימין של עמוד השדרה. השתמשו במספריים כדי לחתוך את העור והשרירים לצדדים כדי לחשוף את עמוד השדרה (איור 1B). שלב זה לוקח ~ 3 דקות.
- השתמש במספריים בקוטר 8 מ"מ כדי לנקות את התהליך הרוחבי של L5 DRG בצד ימין על ידי חיתוך השריר ורקמת החיבור תוך ניסיון למזער דימום. השתמש כותנה ו / או gelfoam כדי לספוג את הדם. חוליית L5 היא החוליה הראשונה לעצם האגן.
הערה: שלב זה אורך ~3 דקות ועשוי להימשך זמן נוסף אם בעל החיים מדמם יותר מהרגיל. - פתחו את התהליך הרוחבי L5 בצד ימין באמצעות רונגיורס פרידמן-פירסון או מלקחיים עדינים חזקים. היזהרו לא לגעת ב-DRG (איור 1C).
הערה: שלב זה אורך ~2 דקות, אך עשוי להימשך זמן נוסף אם בעל החיים מדמם יותר מהרגיל. - אין להמשיך עד שהדימום נפסק לחלוטין. יש למנוע דימום על משטח ה-DRG באמצעות קצף ג'ל או כותנה. שלב זה אורך 1-4 דקות.
- העבירו את העכבר ואת משטח החימום אל הבמה המותאמת אישית (איור 2A,B). השתמש בסרט הבמה כדי לאבטח את בעל החיים ואת כרית החימום במקומם. הניחו את אפו של בעל החיים בחרוט האף, כך שבעל החיים יוכל לקבל הרדמה איזופלורנית רציפה. אבטחו את כף הרגל האחורית הימנית הבולטת מהבמה, כך שניתן יהיה להחיל את הגירויים בקלות על הכפה. שלב זה אורך 3 דקות.
- הדקו את עמוד השדרה למקומו עם מהדקי הבמה על העור בחוליות ו/או עצם האגן רק רוסטרלית וקאודלית ל- L5 DRG. התאימו את המהדקים ואת הבמה כדי להפוך את פני השטח של DRG לרמה ככל האפשר (איור 2B,C).
הערה: ייתכן שיהיה צורך לחתוך את הרקמה המונחת בין DRG לבין המטרה. - מקמו את השלב מתחת למיקרוסקופ כך שהמטרה תהיה 8 מ"מ ישירות מעל DRG כאשר מורידים אותו (איור 3A,B). הכנס את המדחום הרקטלי.
הערה: המרחק בין DRG למטרה עשוי להשתנות בהתאם למטרה, למיקרוסקופ ולבעל החיים. - חברו את קווי החשמל לכרית החימום ולמדחום פי הטבעת. חבר את חרוט האף לקווי הגז איזופלורן.
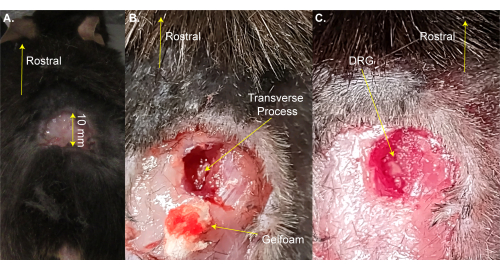
איור 1: דוגמה לניתוח חשיפה ל-DRG . (A) אזור קטן גולח והעור נחתך וקופל בחזרה. החתך הוא ~ 10 מ"מ על הציר הרוסטרלי-קאודלי. (B) בוצע חתך בצד ימין של עמוד השדרה ונחתכו שריר ורקמת חיבור, מה שחשף את התהליך הרוחבי L5 בצד ימין. הדם נספג בג'לקצף. (C) התהליך הרוחבי נוקה והעצם מעל DRG הוסרה. אנא לחץ כאן כדי להציג גרסה גדולה יותר של איור זה.
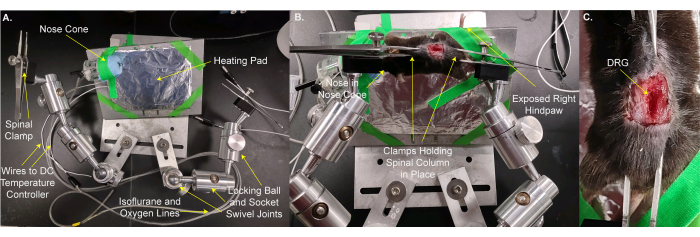
איור 2: הרכבת העכבר על במה מותאמת אישית להדמיית DRG . (A) השלב המותאם אישית מוצג. הוא מורכב צלחת בסיס צלחת עבור החיה. צלחת ההרכבה של בעלי החיים נמצאת על כדור נעילה ומפרק מסתובב שקע. חרוט אף עם קווים להעברת תערובת חמצן / איזופלורן וקו גז פסולת יחד עם כרית חימום עטופה ברדיד אלומיניום מודבקים לצלחת ההרכבה של בעלי החיים. שתי זרועות, שכל אחת מהן עשויה משלושה מפרקי כדור נעילה ושקע מסתובבים, מוברגות לצלחת הבסיס. לכל זרוע מהדק עשוי מלקחיים עם בורג להידוק והתרופפות. (B) בעל החיים מותקן על לוח ההרכבה של בעל החיים. אפו ממוקם בחרוט האף. מלחציים ממוקמים על העור מחזיק את עמוד השדרה ואת עצם האגן. הכף האחורית הימנית (ipsilateral) מודבקת כדי לבלוט החוצה לגישה נוחה להפעלת גירויים. (C) תמונת תקריב של עמוד השדרה המהודק ועצם האגן. אנא לחץ כאן כדי להציג גרסה גדולה יותר של איור זה.

איור 3: חיה על במה מותאמת אישית ממוקמת מתחת למטרת המיקרוסקופ . (A) זווית ראייה רחבה של הבמה, החיה והמיקרוסקופ. חוטים לבקר הטמפרטורה DC וקווים לצריכת חמצן / איזופלורן וקו גז פסולת נראים משמאל. (B) מבט מקרוב על בעל החיים מתחת למטרת המיקרוסקופ. DRG הוא ~ 8 מ"מ מתחת למטרה. מדחום פי הטבעת מוכנס והאף נמצא בתוך חרוט האף. אנא לחץ כאן כדי להציג גרסה גדולה יותר של איור זה.
2. הדמיית DRG
- השתמש במיקרוסקופ קונפוקלי זקוף 10x/0.4 DIC ובתוכנה המשויכת (ראה טבלת חומרים) להדמיה. השתמש בהגדרות המסנן הירוק (FITC): עירור 495 ננומטר, פליטה 519 ננומטר, אורך גל גילוי 500-580 ננומטר, מכשיר הדמיה GaAsP-Pmt1, גלאי GaAsP-PMT.
הערה: עבור מיקרוסקופים אחרים, השתמש בהגדרות המומלצות של היצרן. - מצא את פני השטח של DRG עם המיקרוסקופ. התאם את המלחציים על הבמה כך שמשטח DRG יהיה ישר ככל האפשר וששטח הפנים המרבי יודגם במישור המוקד.
הערה: בחירת המטרה עשויה להשתנות בהתאם למיקרוסקופ שבו נעשה שימוש ולהעדפת המשתמש. בחירת התוכנה תלויה במיקרוסקופ. רמת DRG מביאה לתמונות ברורות יותר, מאפשרת לתוכנה לבנות סרטים ברורים יותר, מאפשרת הדמיה של יותר נוירונים, והופכת את הניתוח לקל ומדויק יותר. - ספק איזופלורן 1%-1.5% בזרימת חמצן לקונוס האף כדי להבטיח שהעכבר יישאר מורדם. לפקח על החיה בזהירות לאורך כל ההליך כדי לשמור על הרדמה isoflurane ללא מנת יתר.
הערה: כמות האיזופלורן הדרושה לשמירה על הרדמה עשויה להשתנות בהתאם לבעל החיים ולגירוי. בדרך כלל, 1.5% מספיק. אם החיה נעה במהלך הגירוי, isoflurane צריך להיות מוגברת. אם הנשימה הופכת רדודה, isoflurane צריך להיות מופחת. לפני כל גירוי, בדוק את רפלקס הנסיגה של הגפה האחורית על הכף האחורית הנגדית.
אזהרה: איזופלורן עלול להזיק או לגרום לסחרחורת או נמנום בשאיפה. יש להימנע משאיפה ולהשתמש רק באזור מאוורר היטב. - טען את פרוטוקול הסריקה המהירה של המיקרוסקופ.
- השתמש בהגדרות האופייניות לסריקה מהירה: גודל ווקסל 2.496 מיקרומטר x 2.496 מיקרומטר x 16 מיקרומטר, 512 x 512 פיקסלים, 10 פרוסה אופטית ערימת Z, יחידה אוורירית אחת (AU)/32 מיקרומטר, עוצמת לייזר 1% 488 ננומטר 5 mW, זמן פיקסל 1.52 μs, זמן קו 0.91 מטר/שניה, זמן מסגרת 465 מטר/שניה, מהירות סריקת LSM 8, סריקה דו-כיוונית, GaAsP-PMT גלאי רווח 650 V, רווח דיגיטלי 1. ההגדרות האופטימליות עשויות להשתנות בהתאם למיקרוסקופ ולבעל החיים.
- כדי להגדיר פרוטוקול סריקה מהירה, לחץ על הכרטיסייה רכישה . תחת פרמטרים של רכישה, לחץ על הכרטיסייה מסגרות . לחץ על קביעות מוגדרות מראש > 512 x 512 כדי להגדיר את המיקרוסקופ להקליט תמונה של 512 פיקסלים x 512 פיקסלים. זה בתורו להגדיר את ערכי X ו- Y של גודל ווקסל בהתבסס על גודל התמונה, אשר נקבע על ידי תוכנת המיקרוסקופ.
- תחת פרמטרים של רכישה, לחץ על הכרטיסייה ערוצים . לחץ על התיבה Track2 . השתמש בתפריט הנפתח לצד התיבה Track2 כדי לבחור ירוק (FITC). כרטיסייה חדשה תיפתח מתחת לרצועה 2.
- לצד לייזרים, לחץ על התיבה 488 . זה יקבע את אורכי גל העירור והפליטה.
- לצד מחוון 488 ננומטר, הגדר את עוצמת הלייזר ל- 1%. לחץ על כפתור 1 AU כדי להגדיר את האפרטורה עבור יחידה אוורירית אחת. תחת FITC, הגדר את Master Gain ל- 650 V, את Digital Offset ל- 0 ואת Digital Gain ל- 1.
- תחת הכרטיסיה רכישה , סמן את התיבה Z-Stack . לחץ על כפתור Live כדי להציג תמונה חיה של הגנגליון. סובב את ידית מישור המוקד כלפי מעלה עד שרק קשת קטנה של נוירונים נראית לעין.
- תחת פרמטרים של רכישה, לחץ על הכרטיסייה Z-Stack > הגדר אחרון לחצן. סובב את ידית מישור המוקד כלפי מטה עד שרק קשת קטנה של נוירונים נראית לעין. תחת פרמטרים של רכישה, לחץ על הכרטיסייה Z-Stack > הגדר תחילה לחצן. לחץ על כפתור Live כדי לכבות את התמונה החיה.
- תחת פרמטרים של רכישה, לחץ על הכרטיסייה Z-Stack . מלא את השדה פרוסות ב- 10. פעולה זו תגדיר 10 פרוסות אופטיות ותקבע באופן אוטומטי את עומק הווקסל.
- תחת הכרטיסייה רכישה, לחץ על התיבה סדרת זמן . כרטיסייה חדשה של סדרות זמן תופיע תחת פרמטרים של רכישה. לחץ על הכרטיסייה סדרת זמן > שדה מחזורים עם מספר המחזורים הבא שברצונך לבצע. במקרה זה, זה 8.
- הגדר את מהירות הסריקה ואת כיוונה. תחת פרמטרים של רכישה, הכרטיסיה מצב רכישה > > כיוון > חץ דו-ראשי לסריקה דו-כיוונית . בחר בכרטיסיה מצב רכישה > Frame > Scan Speed Slider > 8.
הערה: בדרך כלל ניתן לטעון הגדרות של ניסוי קודם ויש לכוונן את עוצמת הלייזר רק אם התמונה בהירה או עמומה מדי ולהתאים את Z-Stack Set Last and Set First.
- בצע סריקה קצרה של 8 מחזורים של DRG על ידי לחיצה על התחל ניסוי תחת הכרטיסייה רכישה . צור סרט על-ידי ביצוע הקרנה אורתוגונלית של סריקות (סריקה אחת לכל מסגרת) לאורך זמן ובדוק ידנית את בהירות התמונה ואת תוצרי ההדמיה כגון "גלים" של בהירות החוצים את DRG. התאם את מיקום המהדק ואת עובי המקטע האופטי וחזור על שלב זה עד לקבלת סרט ברור ואיכותי.
הערה: יש לחזור על שלב זה אם בעל החיים זז או מועבר על ידי החוקר. בעיות שיש לחפש כוללות אזורים בגנגליון (לא רק נוירונים בודדים) שנראים בהירים וכהים יותר במהלך הניסוי, יוצרים מראה גלי או גורמים לאזורים להיעלם או להיות בהירים יותר. תנועה הגדולה ממחצית הקוטר של תא עצב קטן (<20 מיקרומטר) היא בעיה מרכזית נוספת. לעתים קרובות ניתן לתקן את הגליות על ידי קירוב המיקום הראשון והאחרון של Z-Stack זה לזה (ראה שלב 2.4.4 לעיל) וצמצום עובי הפרוסה האופטית. סרט 1 מספק דוגמה של גרעינים גליים לפני פילוס וקביעת עובי הפרוסה האופטית הנכונה. סרט 2 הוא לאחר תיקון פילוס ועובי פרוסה אופטית. ההבדל הוא עדין, אבל יש לו השפעה עצומה על הניתוח. - טען את פרוטוקול הסריקה ברזולוציה גבוהה במיקרוסקופ.
- השתמש בהגדרות האופייניות לסריקה ברזולוציה גבוהה: גודל ווקסל 1.248 מיקרומטר x 1.248 מיקרומטר x 14 מיקרומטר, 1024 x 1024 פיקסלים, 6 פרוסות אופטיות ערימת Z, 1.2 יחידה אוורירית (AU)/39 מיקרומטר, 5% עוצמת לייזר 488 ננומטר/25 mW, זמן פיקסל 2.06 μs, זמן קו 4.95 מטר/שניה, זמן מסגרת 5.06 שניות, מהירות סריקת LSM 6, סריקה דו-כיוונית, GaAsP-PMT גלאי רווח 650 V, רווח דיגיטלי 1. ההגדרות האופטימליות עשויות להשתנות בהתאם למיקרוסקופ ולבעל החיים.
- כדי להגדיר פרוטוקול סריקה ברזולוציה גבוהה, לחץ על הכרטיסייה רכישה . תחת פרמטרים של רכישה, לחץ על הכרטיסייה מסגרות . לחץ על קביעות מוגדרות מראש > 1024 x 1024 כדי להגדיר את המיקרוסקופ להקליט תמונה של 1024 פיקסלים x 1024 פיקסלים. זה בתורו להגדיר את ערכי X ו- Y של גודל ווקסל בהתבסס על גודל התמונה, אשר נקבע על ידי תוכנת המיקרוסקופ.
- תחת פרמטרים של רכישה, לחץ על הכרטיסייה ערוצים . לחץ על התיבה Track2 . השתמש בתפריט הנפתח לצד התיבה Track2 כדי לבחור ירוק (FITC). כרטיסייה חדשה תיפתח מתחת לרצועה 2.
- לצד לייזרים, לחץ על התיבה 488 . זה יקבע את אורכי גל העירור והפליטה. לחץ על התיבה טווח לייזר בעוצמה גבוהה .
- לצד מחוון 488 ננומטר, הגדר את עוצמת הלייזר ל- 5%. לחץ על כפתור 1 AU כדי להגדיר את האפרטורה עבור יחידה אוורירית אחת. תחת FITC הגדר את Master Gain ל- 650 V, את Digital Offset ל- 0 ואת Digital Gain ל- 1.
- תחת הכרטיסיה רכישה , סמן את התיבה Z-Stack . לחץ על כפתור Live כדי להציג תמונה חיה של הגנגליון. סובב את ידית מישור המוקד כלפי מעלה עד שרק קשת קטנה של נוירונים נראית לעין.
- תחת פרמטרים של רכישה, לחץ על הכרטיסייה Z-Stack > הגדר אחרון לחצן. סובב את ידית מישור המוקד כלפי מטה עד שרק קשת קטנה של נוירונים נראית לעין. תחת פרמטרים של רכישה, לחץ על הכרטיסייה Z-Stack > הגדר תחילה לחצן. לחץ על כפתור Live כדי לכבות את התמונה החיה.
- תחת פרמטרים של רכישה, לחץ על הכרטיסייה Z-Stack . מלא את השדה פרוסות ב- 6. פעולה זו תגדיר 6 פרוסות אופטיות ותקבע באופן אוטומטי את עומק הווקסל.
- תחת הכרטיסיה רכישה, ודא שהתיבה סידרת זמן אינה מסומנת (ללא סידרת זמן ).
- הגדר את מהירות הסריקה ואת כיוונה. תחת פרמטרים של רכישה, לחץ על הכרטיסייה מצב רכישה > הגדרות קבועות מראש > מסגרת > 1024 x 1024. בחר בכרטיסיה מצב רכישה > מסגרת > כיוון > חץ דו-ראשי לסריקה דו-כיוונית. בחר בכרטיסיה מצב רכישה > המחוון מהירות סריקה > מסגרת > 6.
- אם התאים מסומנים ב-td-Tomato, הגדר את המיקרוסקופ לסרוק את התעלה האדומה 592 ננומטר עירור / פליטת 614 ננומטר, גילוי אורך גל 600-700 ננומטר בנוסף לערוץ הירוק. הגדר זאת על ידי מעבר אל פרמטרים של רכישה ולחץ על הכרטיסייה ערוצים > Track1 תיבה. השתמש בתפריט הנפתח לצד התיבה Track1 כדי לבחור אדום (טקסס אדום ). בצע את אותו תהליך כמו בשלב 2.6.3, למעט לחץ על התיבה 561 במקום על התיבה 488 . הגדר את עוצמת הלייזר ל- 1%. Td-Tomato בהיר בהרבה מ- GCaMP3 ודורש עוצמת לייזר נמוכה יותר.
- צור תמונה ברזולוציה גבוהה של DRG על ידי לחיצה על התחל ניסוי כפתור תחת הכרטיסייה רכישה .
- טען את פרוטוקול הסריקה המהירה של המיקרוסקופ (ראה שלב 2.4). תיעוד פעילות ספונטנית ב-DRG במשך 80 מחזורים (כ-10 דקות). צור סרט הקרנה אורתוגונלי וודא שהתמונה באיכות מספקת לניתוח.
הערה: שיקולי האיכות זהים לשיקולי שלב 2.5. - להחלת גירויים, הגדר את המיקרוסקופ לביצוע 15-20 סריקות. המתן להשלמת סריקות 1-5 כדי להפיק את קו הבסיס. החל את הגירוי במהלך סריקות 6-10. המתן לפחות 5 דקות לאחר כל גירוי לפני הפעלת הגירוי הבא כדי למנוע דה-סנסיטיזציה.
הערה: יש ליישם תחילה גירויים מכניים, ולאחר מכן גירויים קרים, תרמיים וכימיים. גירויים חלשים יותר (למשל, כוח מכני נמוך, טמפרטורות קרובות יותר לטמפרטורת החדר) צריכים להיות מיושמים לפני גירויים חזקים יותר (למשל, כוח מכני גבוה יותר, טמפרטורות רחוקות יותר מטמפרטורת החדר). בעת החלת גירויים, הקפד לא לגרום לכל תנועה של DRG. עבור גירויים תרמיים חזקים בפרט, לעתים קרובות יש צורך ליישם 2% isoflurane במשך 1-2 דקות לפני תחילת הגירוי. במיקרוסקופ המשמש במחקר זה, ניתן לשמוע כל סריקה בבירור, כך שהחוקר יכול לזהות בקלות את סוף הסריקה, מה שמאפשר הפעלת גירוי מיד לאחר סריקה 5. עם זאת, כל שיטה המאפשרת יישום של גירויים בנקודת זמן עקבית תעבוד. - ללחיצה מכנית, החזיקו את הפינצ'ר של האלגומטר עם הכף בין המשוטים מבלי לגעת בכפה, וצבטו מיד לאחר סיום סריקה 5 ועצרו מיד לאחר סריקה 10. נטר את כוח העיתונות באמצעות אלגומטר (ראה טבלת חומרים). שמור על כוח הלחיצה קרוב ככל האפשר לכוח הרצוי (כאן אנו משתמשים בגירוי לחיצה של 100 גרם) וודא שהוא אינו עולה על 10 גרם מעל הכוח הרצוי.
הערה: ניתן לזהות גירויים עם מעט כמו 0.07 גרם חוטי פון פריי ועד 600 גרם כוח לחיצה. - לגירויים קרים ותרמיים, יש לקרר או לחמם מים מתחת לטמפרטורה הרצויה (לקור) או מעל (תרמית) ולהתחיל לסרוק. כאן, השתמש גירוי 45 מעלות צלזיוס. כאשר המים הם הטמפרטורה הנכונה, להחיל את הגירוי מיד לאחר סריקה 5 על ידי טבילת הכף במים. משכו את הכד מיד לאחר סריקה 10.
הערה: הטמפרטורה צריכה להיות בטווח של 1°C מהטמפרטורה הרצויה בסריקה 5. אם טמפרטורת הכד שגויה, אל תפעילו את הגירוי מכיוון שזה עלול להפחית את רגישות הנוירונים. במקום זאת, קררו מחדש או חממו מחדש את המים ונסו שוב. מדדנו טמפרטורות נמוכות כמו 0 °C (75 °F) (מי קרח) ו גבוה כמו 95 °C (75 °F). עם זאת, זכור כי טמפרטורות מעל 50 מעלות צלזיוס עלול לפגוע ברקמות ולבלבל ניסויים מאוחרים יותר. באופן דומה, כימיקלים מסוימים (למשל טטרודוטוקסין, קפסאיצין) הם בלתי הפיכים או שאינם ניתנים לשטיפה ויכולים למנוע ניסויים נוספים על החיה. - לאחר שכל הגירויים יושמו ותועדו, הרדימו את בעל החיים על ידי מנת יתר עם קטמין/קסילזין (200 מ"ג/ק"ג קטמין, 30 מ"ג/ק"ג קסילזין, או 5 מיקרוליטר לגרם מסת גוף של תמיסה שהוכנה בשלב 1.1) ולאחר מכן עריפת ראש.
3. ניתוח נתונים
- פתח את קובצי התמונה על-ידי גרירה ושחרור לתוך ImageJ. לאחר פתיחת הקובץ, בחר את סוג התמונה תחת Image > Type > RGB color.
הערה: תוסף StackReg21 תחת תוספים > StackReg שימושי לתיקון ויישור תוצרי תנועה. ImageJ יכול לקרוא את רוב הפורמטים של קבצי תוכנת המיקרוסקופ. בחירת סוג התמונה תלויה בהעדפת המשתמש. RGB מפשט את הפקת התמונות הצבעוניות לפרסום. חבילות תוכנה של יצרן המיקרוסקופ או cytoNet22 עשויות לסייע גם בניתוח. אין צורך להוריד, להתקין ולהשתמש ב- StackReg, אך מומלץ. - השתמש בכלי אזור עניין (ROI) כדי לבחור נוירונים פעילים תחת Analyze > Tool >- ROI Manager. צייר ROI באמצעות שלוש הנקודות או כלי המלבן בסרגל הכלים ומקם אותם בקובץ החזר ההשקעה על ידי לחיצה על לחצן הוסף תחת הוסף בחלון מנהל החזר ההשקעה, או על ידי לחיצה על מקש "t".
הערה: הקפד לשמור את קובץ החזר ההשקעה לעתים קרובות. משתמשים תמיד יכולים לשחזר ROI על ידי גרירה ושחרור של קובץ ROI לתוך ImageJ ולחיצה על התיבה הצג הכל בתחתית חלון מנהל החזר ההשקעה. שמירה כשכבת-על אינה מומלצת. מניסיון, שמירה כקובץ ROI .zip מפשטת את הניתוח. - תחת נתח > הגדר מדידות, ודא שהאפשרות ערך אפור ממוצע מסומנת; בטל את הסימון של כל התיבות האחרות תחת הגדר מדידות. השתמש בכלי הרב-מידות בתפריט מנהל החזר ההשקעה כדי לחשב את העוצמה בתוך החזר ההשקעה. מדוד עוצמה באמצעות חלון החזר ההשקעה תחת More > Multimeasure.
הערה: לפעמים תאי עצב סמוכים יהיו קרובים מדי זה לזה מכדי לצייר ROI נפרדים. לא ניתן להשתמש בתאי עצב אלה כדי למדוד עוצמה חולפת, אך ניתן לכלול אותם בספירות של הפעלת תאי עצב. - שמור את קובץ ה- CSV שנוצר על ידי Multimeasure ופתח את קובץ ה- CSV עם כל תוכנת גיליון אלקטרוני.
הערה: ראה קובץ משלים 1 לקבלת תבנית גיליון אלקטרוני לדוגמה כדי לסייע בניתוח. - חשב את העוצמה הארעית Ca 2+ כ- ΔF / F 0 = (F t- F 0) / F 0, כאשר Ft היא עוצמת הפיקסלים ב- ROI בנקודת הזמן המעניינת, ו- F 0 היא עוצמת קו הבסיס שנקבעת על ידי ממוצע העוצמות של 2-4 מסגרות לפני Ca 2+ ארעי לפעילות ספונטנית או 1-5 המסגרות הראשונות של החזר ההשקעה עבור Ca 2+ ארעיות המתרחשת במהלך הגירוי. לא לכלול נוירונים המייצרים פסגות Ca2+ לפני הגירוי ולא לנתח פעילות לאחר סיום הגירוי.
- עבור ניתוח עוצמה חולפתCa 2+ , דגמו באופן אקראי מספר שווה בקירוב של נוירונים מכל גנגליון כדי להימנע מהטיה של הנתונים לכיוון הגרעינים שיצרו את המספר הגדול ביותר של נוירונים מגיבים. לא לכלול פסגות שבהן ΔF / F 0 <0.15 .
הערה: ישנן שיטות חלופיות שפורסמו לניתוח והכללה/הדרה של נוירונים 11,12,23,24,25,26,27,28. - מדוד קוטרים של תאי עצב באמצעות הכלי קו בסרגל הכלים ב- ImageJ. חשב את הקוטר הממוצע מהקווים המשורטטים לאורך הקטרים הארוכים והקצרים ביותר.
Access restricted. Please log in or start a trial to view this content.
תוצאות
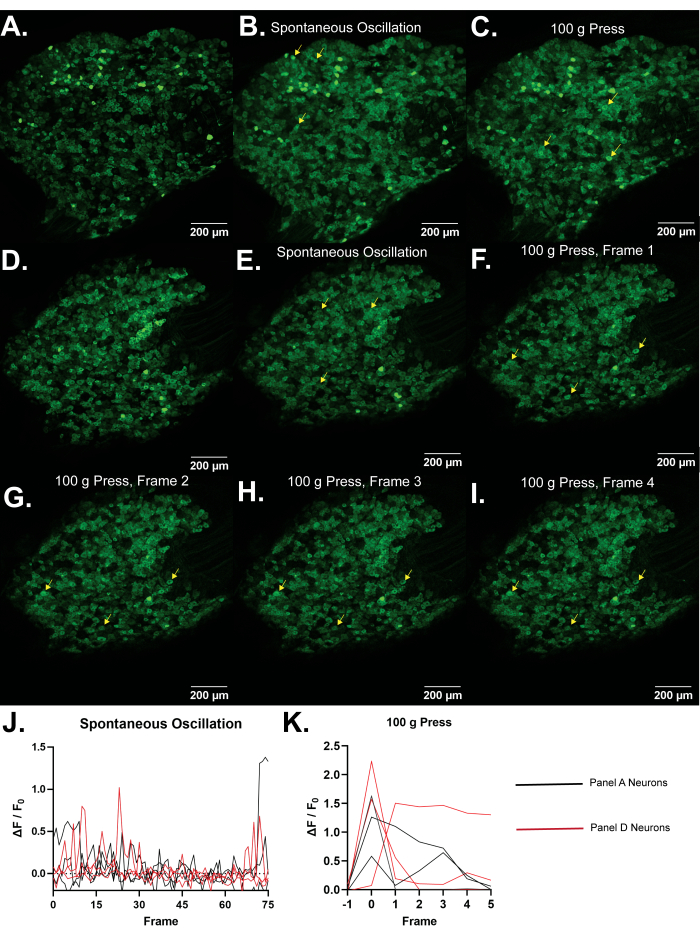
איור 4: תמונות מייצגות של גרעיני שורש גבי L5 של עכברי Pirt-GCaMP3. (A,D) מוצגות סריקות ברזולוציה גבוהה במסגרת אחת של גרעיני שורש גבי L5 של עכברי Pirt-GCaMP3. (ב,ה) . תחזיות עוצמה ממוצעת...
Access restricted. Please log in or start a trial to view this content.
Discussion
כאב מתמשך קיים במגוון רחב של הפרעות, מתיש ו / או מוריד את איכות החיים של כ -8% מהאנשים29. נוירונים חושיים ראשוניים מזהים גירויים מזיקים על העור, והפלסטיות שלהם תורמת לכאב מתמשך8. בעוד שניתן לחקור תאי עצב בתרביות תאים ובצמחים, פעולה זו מוציאה אותם מההקשר הפיזיולוגי הרג...
Access restricted. Please log in or start a trial to view this content.
Disclosures
המחברים מצהירים כי אין אינטרסים כלכליים מתחרים.
Acknowledgements
עבודה זו נתמכה על ידי מענקי המכונים הלאומיים לבריאות R01DE026677 ו- R01DE031477 (ל- Y.S.K.), קרן הסטארט-אפ UTHSCSA (Y.S.K.), ופרס כוכב עולה מאוניברסיטת טקסס (Y.S.K).
Access restricted. Please log in or start a trial to view this content.
Materials
| Name | Company | Catalog Number | Comments |
| Anased Injection (Xylazine) | Covetrus, Akorn | 33197 | |
| C Epiplan-Apochromat 10x/0.4 DIC | Cal Zeiss | 422642-9900-000 | |
| Cotton Tipped Applicators | McKesson | 24-106-1S | |
| Curved Hemostat | Fine Science Tools | 13007-12 | |
| DC Temperature Controller | FHC | 40-90-8D | |
| DC Temperature Controller Heating Pad | FHC | 40-90-2-05 | |
| Dumont Ceramic Coated Forceps | Fine Science Tools | 11252-50 | |
| FHC DC Temperature Controller | FHC | 40-90-8D | |
| Fluriso (Isoflurane) | MWI Animal Health, Piramal Group | 501017 | |
| Friedman-Pearson Rongeurs | Fine Science Tools | 16221-14 | |
| GelFoam | Pfizer | 09-0353-01 | |
| Ketaset (Ketamine) | Zoetis | KET-00002R2 | |
| Luminescent Green Stage Tape | JSITON/ Amazon | B803YW8ZWL | |
| Matrx VIP 3000 Isoflurane Vaporizer | Midmark | 91305430 | |
| Micro dissecting scissors | Roboz | RS-5882 | |
| Micro dissecting spring scissors | Fine Science Tools | 15023-10 | |
| Micro dissecting spring scissors | Roboz | RS-5677 | |
| Mini Rectal Thermistor Probe | FHC | 40-90-5D-02 | |
| Operating scissors | Roboz | RS-6812 | |
| Pirt-GCaMP3 C57BL/6J mice | Johns Hopkins University | N/A | Either sex can be imaged equally well. Mice should be at least 8 weeks old due to weak or intermittent Pirt promoter expression in younger mice. |
| SMALGO small animal algometer | Bioseb In vivo Research Instruments | BIO-SMALGO | |
| Stereotaxic frame | Kopf Model 923-B | 923-B | |
| td-Tomato C57BL/6J mice | Jackson Laboratory | 7909 | |
| Top Plate, 6 in x 10 in | Newport | 290-TP | |
| TrpV1-Cre C57BL/6J mice | Jackson Laboratory | 17769 | |
| Zeiss LSM 800 confocal microscope | Cal Zeiss | LSM800 | |
| Zeiss Zen 2.6 Blue Edition Software | Cal Zeiss | Zen (Blue Edition) 2.6 |
References
- Rivero-Melián, C., Grant, G. Distribution of lumbar dorsal root fibers in the lower thoracic and lumbosacral spinal cord of the rat studied with choleragenoid horseradish peroxidase conjugate. The Journal of Comparative Neurology. 299 (4), 470-481 (1990).
- Wessels, W. J., Marani, E. A rostrocaudal somatotopic organization in the brachial dorsal root ganglia of neonatal rats. Clinical Neurology and Neurosurgery. 95, 3-11 (1993).
- Schmalbruch, H. The number of neurons in dorsal root ganglia L4-L6 of the rat. The Anatomical Record. 219 (3), 315-322 (1987).
- Sørensen, B., Tandrup, T., Koltzenburg, M., Jakobsen, J. No further loss of dorsal root ganglion cells after axotomy in p75 neurotrophin receptor knockout mice. The Journal of Comparative Neurology. 459 (3), 242-250 (2003).
- Basbaum, A. I., Woolf, C. J. Pain. Current Biology. 9 (12), 429-431 (1999).
- Liu, Y., Ma, Q. Generation of somatic sensory neuron diversity and implications on sensory coding. Current Opinion in Neurobiology. 21 (1), 52-60 (2011).
- Basbaum, A. I., Bautista, D. M., Scherrer, G., Julius, D. Cellular and molecular mechanisms of pain. Cell. 139 (2), 267-284 (2009).
- Stucky, C. L., Mikesell, A. R. Cutaneous pain in disorders affecting peripheral nerves. Neuroscience Letters. 765, 136233(2021).
- Iseppon, F., Linley, J. E., Wood, J. N. Calcium imaging for analgesic drug discovery. Neurobiology of Pain. 11, 100083(2022).
- Chen, Z., et al. Adjacent intact nociceptive neurons drive the acute outburst of pain following peripheral axotomy. Scientific Reports. 9 (1), 7651(2019).
- Chisholm, K. I., Khovanov, N., Lopes, D. M., La Russa, F., McMahon, S. B. Large scale in vivo recording of sensory neuron activity with GCaMP6. eNeuro. 5 (1), (2018).
- Emery, E. C., et al. In vivo characterization of distinct modality-specific subsets of somatosensory neurons using GCaMP. Science Advances. 2 (11), 1600990(2016).
- Ishida, H., et al. In vivo calcium imaging visualizes incision-induced primary afferent sensitization and its amelioration by capsaicin pretreatment. The Journal of Neuroscience. 41 (41), 8494-8507 (2021).
- Kim, Y. S., et al. Coupled activation of primary sensory neurons contributes to chronic pain. Neuron. 91 (5), 1085-1096 (2016).
- MacDonald, D. I., et al. Silent cold-sensing neurons contribute to cold allodynia in neuropathic pain. Brain. 144 (6), 1711-1726 (2021).
- Wang, F., et al. Sensory afferents use different coding strategies for heat and cold. Cell Reports. 23 (7), 2001-2013 (2018).
- Kucharczyk, M. W., et al. The impact of bone cancer on the peripheral encoding of mechanical pressure stimuli. Pain. 161 (8), 1894-1905 (2020).
- Kim, A. Y., et al. a phosphoinositide-binding protein, functions as a regulatory subunit of TRPV1. Cell. 133 (3), 475-485 (2008).
- Kim, Y. S., et al. Central terminal sensitization of TRPV1 by descending serotonergic facilitation modulates chronic pain. Neuron. 81 (4), 873-887 (2014).
- Tian, L., et al. Imaging neural activity in worms, flies and mice with improved GCaMP calcium indicators. Nature Methods. 6 (12), 875-881 (2009).
- Thévenaz, P., Ruttimann, U. E., Unser, M. A pyramid approach to subpixel registration based on intensity. IEEE Transactions on Image Processing. 7 (1), 27-41 (1998).
- Mahadevan, A. S., et al. cytoNet: Spatiotemporal network analysis of cell communities. PLoS Computational Biology. 18 (6), 1009846(2022).
- Barretto, R. P., et al. The neural representation of taste quality at the periphery. Nature. 517 (7534), 373-376 (2015).
- Leijon, S. C. M., et al. Oral thermosensing by murine trigeminal neurons: modulation by capsaicin, menthol and mustard oil. The Journal of Physiology. 597 (7), 2045-2061 (2019).
- Sekiguchi, K. J., et al. Imaging large-scale cellular activity in spinal cord of freely behaving mice. Nature Communications. 7, 11450(2016).
- Wu, A., Dvoryanchikov, G., Pereira, E., Chaudhari, N., Roper, S. D. Breadth of tuning in taste afferent neurons varies with stimulus strength. Nature Communications. 6, 8171(2015).
- Ran, C., Hoon, M. A., Chen, X. The coding of cutaneous temperature in the spinal cord. Nature Neuroscience. 19 (9), 1201-1209 (2016).
- Yarmolinsky, D. A., et al. Coding and plasticity in the mammalian thermosensory system. Neuron. 92 (5), 1079-1092 (2016).
- Torrance, N., Smith, B. H., Bennett, M. I., Lee, A. J. The epidemiology of chronic pain of predominantly neuropathic origin. Results from a general population survey. The Journal of Pain. 7 (4), 281-289 (2006).
- Shannonhouse, J., et al. Meclizine and metabotropic glutamate receptor agonists attenuate severe pain and Ca(2+) activity of primary sensory neurons in chemotherapy-induced peripheral neuropathy. The Journal of Neuroscience. 42 (31), 6020-6037 (2022).
- Luiz, A. P., et al. Cold sensing by Na(V)1.8-positive and Na(V)1.8-negative sensory neurons. Proceedings of the National Academy of Sciences of the United States of America. 116 (9), 3811-3816 (2019).
- Hartung, J. E., Gold, M. S. GCaMP as an indirect measure of electrical activity in rat trigeminal ganglion neurons. Cell Calcium. 89, 102225(2020).
- Chung, M. K., Wang, S., Oh, S. L., Kim, Y. S. Acute and chronic pain from facial skin and oral mucosa: Unique neurobiology and challenging treatment. International Journal of Molecular Sciences. 22 (11), 5810(2021).
- Chan, S. L., Mayne, M., Holden, C. P., Geiger, J. D., Mattson, M. P. Presenilin-1 mutations increase levels of ryanodine receptors and calcium release in PC12 cells and cortical neurons. The Journal of Biological Chemistry. 275 (24), 18195-18200 (2000).
- Sierra, D. A., Popov, S., Wilkie, T. M. Regulators of G-protein signaling in receptor complexes. Trends in Cardiovascular Medicine. 10 (6), 263-268 (2000).
- Yoshihara, K., et al. Astrocytic Ca(2+) responses in the spinal dorsal horn by noxious stimuli to the skin. Journal of Pharmacological Sciences. 137 (1), 101-104 (2018).
- Tan, C. H., McNaughton, P. A. The TRPM2 ion channel is required for sensitivity to warmth. Nature. 536 (7617), 460-463 (2016).
- Akemann, W., Mutoh, H., Perron, A., Rossier, J., Knöpfel, T. Imaging brain electric signals with genetically targeted voltage-sensitive fluorescent proteins. Nature Methods. 7 (8), 643-649 (2010).
- Gong, Y., et al. High-speed recording of neural spikes in awake mice and flies with a fluorescent voltage sensor. Science. 350 (6266), 1361-1366 (2015).
- Grewe, B. F., Langer, D., Kasper, H., Kampa, B. M., Helmchen, F. High-speed in vivo calcium imaging reveals neuronal network activity with near-millisecond precision. Nature Methods. 7 (5), 399-405 (2010).
- Harada, K., et al. Red fluorescent protein-based cAMP indicator applicable to optogenetics and in vivo imaging. Scientific Reports. 7 (1), 7351(2017).
Access restricted. Please log in or start a trial to view this content.
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved