Zum Anzeigen dieser Inhalte ist ein JoVE-Abonnement erforderlich. Melden Sie sich an oder starten Sie Ihre kostenlose Testversion.
Method Article
Im lebenden Organismus Calcium-Bildgebung neuronaler Ensembles in Netzwerken primärer sensorischer Neurone in intakten dorsalen Wurzelganglien
In diesem Artikel
Zusammenfassung
Dieses Protokoll beschreibt die chirurgische Exposition des dorsalen Wurzelganglions (DRG) gefolgt von GCaMP3 (genetisch kodierter Ca2+ Indikator; Grün fluoreszierendes Protein-Calmodulin-M13 Protein 3) Ca2+ Bildgebung der neuronalen Ensembles mit Pirt-GCaMP3 Mäusen unter Anwendung einer Vielzahl von Stimuli auf die ipsilaterale Hinterpfote.
Zusammenfassung
Die Ca 2+-Bildgebung kann als Proxy für die zelluläre Aktivität verwendet werden, einschließlich Aktionspotentialen und verschiedener Signalmechanismen, die den Eintritt von Ca 2+ in das Zytoplasma oder die Freisetzung intrazellulärer Ca 2+-Speicher beinhalten. Die Pirt-GCaMP3-basierte Ca2+ Bildgebung von primären sensorischen Neuronen des dorsalen Wurzelganglions (DRG) in Mäusen bietet den Vorteil der gleichzeitigen Messung einer großen Anzahl von Zellen. Bis zu 1.800 Neuronen können überwacht werden, so dass neuronale Netzwerke und somatosensorische Prozesse als Ensemble in ihrem normalen physiologischen Kontext auf Populationsebene in vivo untersucht werden können. Die große Anzahl der überwachten Neuronen ermöglicht die Erkennung von Aktivitätsmustern, die mit anderen Methoden nur schwer zu erkennen wären. Stimuli können auf die Hinterpfote der Maus angewendet werden, so dass die direkten Auswirkungen von Stimuli auf das DRG-Neuronenensemble untersucht werden können. Die Anzahl der Neuronen, die Ca 2+-Transienten produzieren, sowie die Amplitude der Ca2+-Transienten weisen auf eine Sensitivität gegenüber bestimmten sensorischen Modalitäten hin. Der Durchmesser der Neuronen gibt Aufschluss über aktivierte Fasertypen (nicht-schädliche Mechano- vs. schädliche Schmerzfasern, Aβ-, Aδ- und C-Fasern). Neurone, die spezifische Rezeptoren exprimieren, können genetisch mit td-Tomato und spezifischen Cre-Rekombinasen zusammen mit Pirt-GCaMP markiert werden. Daher bietet die Pirt-GCaMP3 Ca2+ Bildgebung von DRG ein leistungsfähiges Werkzeug und Modell für die Analyse spezifischer sensorischer Modalitäten und Neuronensubtypen, die als Ensemble auf Populationsebene fungieren, um Schmerz, Juckreiz, Berührung und andere somatosensorische Signale zu untersuchen.
Einleitung
Primäre sensorische Neuronen innervieren direkt die Haut und leiten somatosensorische Informationen zurück an das zentrale Nervensystem 1,2. Dorsale Wurzelganglien (DRGs) sind Zellkörpercluster von 10.000-15.000 primären sensorischen Neuronen 3,4. DRG-Neuronen weisen unterschiedliche Größe, Myelinisierungsgrade sowie Gen- und Rezeptorexpressionsmuster auf. Neuronen mit kleinerem Durchmesser umfassen schmerzempfindliche Neuronen, und Neuronen mit größerem Durchmesser reagieren typischerweise auf nicht-schmerzhafte mechanische Reize 5,6. Störungen in den primären sensorischen Neuronen wie Verletzungen, chronische Entzündungen und periphere Neuropathien können diese Neuronen für verschiedene Reize sensibilisieren und zu chronischen Schmerzen, Allodynie und Schmerzüberempfindlichkeit beitragen 7,8. Daher ist die Untersuchung von DRG-Neuronen wichtig, um sowohl die Somatosensibilität im Allgemeinen als auch viele Schmerz- und Juckreizerkrankungen zu verstehen.
Neuronen, die in vivo feuern, sind für die Somatosensibilität unerlässlich, aber bis vor kurzem waren Werkzeuge zur Untersuchung intakter Ganglien in vivo auf eine relativ kleine Anzahl von Zellen beschränkt 9. Hier beschreiben wir eine leistungsfähige Methode, um die Aktionspotentiale oder Aktivitäten von Neuronen auf Populationsebene in vivo als Ensemble zu untersuchen. Die Methode verwendet Bildgebung, die auf der zytoplasmatischen Ca2+-Dynamik basiert. Die Ca 2+ empfindlichen Fluoreszenzindikatoren sind aufgrund der normalerweise niedrigen Konzentration von zytoplasmatischem Ca2+ gute Proxies für die Messung der zellulären Aktivität. Diese Indikatoren ermöglichten die gleichzeitige Überwachung von Hunderten bis mehreren Tausend primären sensorischen Neuronen bei Mäusen 9,10,11,12,13,14,15,16 und Ratten 17. Die in dieser Studie beschriebene Methode der In-vivo-Ca2+-Bildgebung kann verwendet werden, um Reaktionen auf Populationsebene auf mechanische, kalte, thermische und chemische Reize direkt zu beobachten.
Das Phosphoinositid-bindende Membranprotein Pirt wird in fast allen (>95%) primären sensorischen Neuronen in hohen Konzentrationen exprimiert18,19 und kann verwendet werden, um die Expression desCa2+-Sensors GCaMP3 zu steuern, um die Neuronenaktivität in vivozu überwachen 20. In diesem Protokoll werden Techniken zur Durchführung von In-vivo-DRG-Operationen, Ca2+-Bildgebung und Analyse im DRG der rechten Lendenwirbelsäule 5 (L5) von Pirt-GCaMP3-Mäusen14 unter Verwendung der konfokalen Laser-Scanning-Mikroskopie (LSM) beschrieben.
Access restricted. Please log in or start a trial to view this content.
Protokoll
Alle hier beschriebenen Verfahren wurden in Übereinstimmung mit einem Protokoll durchgeführt, das vom Institutional Animal Care and Use Committee des University of Texas Health Science Center in San Antonio genehmigt wurde.
HINWEIS: Einmal begonnen, müssen die Tierchirurgie (Schritt 1) und die Bildgebung (Schritt 2) kontinuierlich abgeschlossen werden. Die Datenanalyse (Schritt 3) kann zu einem späteren Zeitpunkt durchgeführt werden.
1. Operation und Sicherung des Tieres für die rechtsseitige L5-DRG-Bildgebung
HINWEIS: In dieser Studie wurden sowohl männliche als auch weibliche Pirt-GCaMP3 C57BL/6J-Mäuse im Alter von 8 Wochen oder älter verwendet. Während beide Geschlechter gleich gut abgebildet werden können, sollten Mäuse aufgrund der schwachen oder intermittierenden Pirt-Expression bei jüngeren Mäusen mindestens 8 Wochen alt sein. Die Pirt-GCaMP3 C57BL/6J Mäuse wurden an der Johns Hopkins University14 generiert. Es können beidseitige DRGs und andere lumbale DRGs (z. B. lumbale 4) abgebildet werden. Die angegebenen Zeiten sind Schätzungen für einen erfahrenen Chirurgen. Gelegentliche technische Probleme wie verstärkte Blutungen können den Zeitaufwand verlängern.
- Bereiten Sie eine sterile Kochsalzlösung vor, die 40 mg/ml Ketamin und 6 mg/ml Xylazin enthält. Das Gesamtvolumen sollte sowohl für die Operation als auch für die Euthanasie nach der Bildgebung mindestens 9 μl/g Körpermasse betragen.
VORSICHT: Ketamin ist schädlich, wenn es injiziert, verschluckt oder mit dem Auge in Berührung kommt. Mit Vorsicht behandeln. - Stellen Sie sicher, dass alle chirurgischen Instrumente sauber und sterilisiert sind, indem sie im Autoklavieren oder in einem anderen NIH-Leitfaden für die Pflege und Verwendung von Labortieren behandelt werden.
- Injizieren Sie einer Pirt-GCaMP3-Maus zwischen 15 und 25 Minuten vor der Operation intraperitoneal (i.p.) ~2,25 μl Ketamin/Xylazin pro Gramm Körpergewicht (90 mg/kg Ketamin, 13,5 mg/kg Xylazin). 120 mg/kg Ketamin dürfen nicht überschritten werden.
- Prüfen Sie innerhalb von 15 bis 25 Minuten nach der Injektion der Anästhesie (Schritt 1.3), ob die Maus die chirurgische Anästhesieebene erreicht hat, indem Sie die kontralaterale Hinterpfote (nicht die ipsilaterale/rechte Hinterpfote) einklemmen. Das Fehlen eines Rückzugsreflexes der Hintergliedmaßen sorgt dafür, dass eine chirurgische Anästhesieebene erreicht wird.
ANMERKUNG: Der Rückzugsreflex der Hintergliedmaßen wird während des gesamten Experiments verwendet, um die Anästhesie zu überwachen. Verwenden Sie immer die kontralaterale Hinterpfote. - Legen Sie die Maus auf ein beheiztes Pad, um die Körpertemperatur bei 37 °C zu halten.
HINWEIS: Es kann hilfreich sein, den Kopf der Maus mit einem stereotaktischen Rahmen (siehe Materialtabelle) oder einem anderen Rahmen, je nach Präferenz des Forschers, an Ort und Stelle zu halten. - Lokalisieren Sie die Vergrößerung der Lendenwirbelsäule, indem Sie nach dem Beckenknochen der Maus tasten. Rasieren Sie den Mausrücken über dem Bereich der Lendenwirbelsäule. Dieser Schritt sollte ~90 s dauern.
HINWEIS: Die Maus kann zum Rasieren kurz vom Heizkissen genommen werden. - Machen Sie mit einer Schere einen dreiseitigen rechteckigen Schnitt (8 mm x 20 mm) über der Lendenwirbelvergrößerung und falten Sie die Haut mit einer Pinzette weg (Abbildung 1A). Dieser Schritt dauert ~2 Minuten.
HINWEIS: Forscher können auch eine Hämostat-Pinzette oder einen Retraktor verwenden, um den Schnitt offen zu halten. Da es sich nicht um eine Überlebensoperation handelt, ist eine zusätzliche Reinigung des Operationsbereichs nicht erforderlich. Es kann jedoch mit Povidon-Jod erfolgen. Die größte akzeptable Schnittgröße ist hier angegeben. Ein kleinerer Schnitt ist einem größeren Schnitt vorzuziehen. - Verwenden Sie die 13 mm Federdissektionsschere, um 3-4 mm Schnitte auf der rechten Seite der Wirbelsäule zu machen. Verwenden Sie eine Schere, um die Haut und die Muskeln zu den Seiten zurückzuschneiden, um die Wirbelsäule freizulegen (Abbildung 1B). Dieser Schritt dauert ~3 Minuten.
- Verwenden Sie eine 8-mm-Schere, um den Querfortsatz des rechtsseitigen L5-DRG zu reinigen, indem Sie den Muskel und das Bindegewebe wegschneiden, während Sie versuchen, die Blutung zu minimieren. Verwenden Sie Baumwolle und/oder Gelschaum, um das Blut aufzunehmen. Der L5-Wirbel ist der erste rostrale Wirbel zum Beckenknochen.
Anmerkungen: Dieser Schritt dauert ~3 Minuten und kann zusätzliche Zeit in Anspruch nehmen, wenn das Tier mehr als normal blutet. - Schneiden Sie den rechten L5-Querfortsatz mit Friedman-Pearson-Rongeuren oder einer starken feinen Pinzette auf. Achten Sie darauf, das DRG nicht zu berühren (Abbildung 1C).
Anmerkungen: Dieser Schritt dauert ~2 Minuten, kann aber zusätzliche Zeit in Anspruch nehmen, wenn das Tier mehr als normal blutet. - Fahren Sie nicht fort, bis die Blutung vollständig aufgehört hat. Verhindern Sie ein Ausbluten auf der DRG-Oberfläche mit Gelschaum oder Watte. Dieser Schritt dauert 1-4 Minuten.
- Bewegen Sie die Maus und das Heizkissen auf den benutzerdefinierten Tisch (Abbildung 2A, B). Verwenden Sie Bühnenklebeband, um das Tier und das Heizkissen an Ort und Stelle zu befestigen. Legen Sie die Nase des Tieres in den Nasenkegel, damit das Tier eine kontinuierliche Isofluran-Anästhesie erhalten kann. Befestigen Sie die rechte Hinterpfote, die aus der Bühne herausragt, so dass die Reize leicht auf die Pfote angewendet werden können. Dieser Schritt dauert 3 Minuten.
- Fixieren Sie die Wirbelsäule mit den Tischklemmen über der Haut an den Wirbeln und/oder dem Beckenknochen direkt rostral und kaudal zum L5 DRG. Stellen Sie die Klemmen und den Tisch so ein, dass die Oberfläche des DRG so eben wie möglich ist (Abbildung 2B,C).
HINWEIS: Es kann notwendig sein, das Gewebe, das zwischen dem DRG und dem Objektiv liegt, zu kürzen. - Platzieren Sie den Tisch so unter dem Mikroskop, dass sich das Objektiv im abgesenkten Zustand 8 mm direkt über dem DRG befindet (Abbildung 3A,B). Setzen Sie das Rektalthermometer ein.
HINWEIS: Der Abstand zwischen dem DRG und dem Objektiv kann je nach Objektiv, Mikroskop und Tier variieren. - Schließen Sie die Stromleitungen an das Heizkissen und das Rektalthermometer an. Verbinden Sie den Nasenkonus mit den Isoflurangasleitungen.
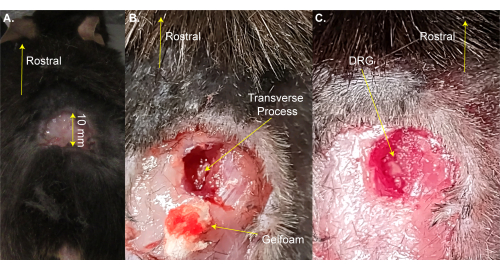
Abbildung 1: Beispiel für eine DRG-Expositionsoperation . (A) Eine kleine Stelle wurde rasiert und die Haut wurde geschnitten und zurückgefaltet. Der Schnitt beträgt ~10 mm auf der rostral-kaudalen Achse. (B) Es wurde ein Schnitt auf der rechten Seite der Wirbelsäule gemacht und Muskeln und Bindegewebe wurden weggeschnitten, wodurch der rechte Querfortsatz L5 freigelegt wurde. Das Blut wurde mit Gelschaum absorbiert. (C) Der Querfortsatz wurde gereinigt und der Knochen über dem DRG entfernt. Bitte klicken Sie hier, um eine größere Version dieser Abbildung zu sehen.
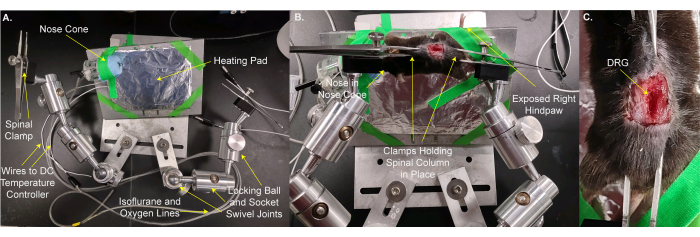
Abbildung 2: Montieren der Maus auf einem benutzerdefinierten Tisch für die DRG-Bildgebung. (A) Der benutzerdefinierte Tisch wird angezeigt. Es besteht aus einer Grundplatte und einer Platte für das Tier. Die Tiermontageplatte befindet sich auf einem Kugelgelenk mit Verriegelung. Ein Nasenkonus mit Leitungen zur Abgabe des Sauerstoff/Isofluran-Gemisches und eine Abgasleitung sowie ein mit Aluminiumfolie umwickeltes Heizkissen sind mit Klebeband auf die Tiermontageplatte geklebt. Zwei Arme, die jeweils aus drei Kugelgelenken bestehen, sind mit der Grundplatte verschraubt. Jeder Arm hat eine Klemme aus einer Pinzette mit einer Schraube zum Anziehen und Lösen. (B) Das Tier ist auf der Tiermontageplatte montiert. Seine Nase befindet sich im Nasenkegel. Die Klammern werden über die Haut gelegt und halten die Wirbelsäule und den Beckenknochen. Die rechte (ipsilaterale) Hinterpfote ist so verklebt, dass sie herausragt, um einen einfachen Zugang zum Anwenden von Reizen zu ermöglichen. (C) Eine Nahaufnahme der eingeklemmten Wirbelsäule und des Beckenknochens. Bitte klicken Sie hier, um eine größere Version dieser Abbildung zu sehen.

Abbildung 3: Das Tier auf dem kundenspezifischen Tisch wird unterhalb des Mikroskopobjektivs platziert . (A) Eine Weitwinkelansicht des Tisches, des Tieres und des Mikroskops. Links sind die Drähte zum DC-Temperaturregler und die Leitungen zum Sauerstoff-/Isofluran-Ansaug- und Abgasanschluss sichtbar. (B) Eine Nahaufnahme des Tieres unterhalb des Mikroskopobjektivs. Das DRG liegt ~8 mm unter dem Objektiv. Das Rektalthermometer wird eingeführt und die Nase befindet sich im Nasenkegel. Bitte klicken Sie hier, um eine größere Version dieser Abbildung zu sehen.
2. DRG-Bildgebung
- Verwenden Sie für die Bildgebung ein aufrechtes konfokales Mikroskop 10x/0,4 DIC-Objektiv und die zugehörige Software (siehe Materialtabelle). Verwenden Sie die Grünfiltereinstellungen (FITC): Anregung 495 nm, Emission 519 nm, Detektionswellenlänge 500-580 nm, GaAsP-Pmt1-Bildgebungsgerät, GaAsP-PMT-Detektor.
HINWEIS: Verwenden Sie für andere Mikroskope die vom Hersteller empfohlenen Einstellungen. - Ermitteln Sie die Oberfläche des DRG mit dem Mikroskop. Stellen Sie die Klemmen auf dem Tisch so ein, dass die DRG-Oberfläche so eben wie möglich ist und die maximale Oberfläche in der Fokusebene visualisiert wird.
HINWEIS: Die Wahl des Objektivs kann je nach verwendetem Mikroskop und Benutzerpräferenz variieren. Die Wahl der Software hängt vom Mikroskop ab. Ein Pegel-DRG führt zu klareren Bildern, ermöglicht es der Software, klarere Filme zu erstellen, ermöglicht die Abbildung von mehr Neuronen und macht die Analyse einfacher und genauer. - Versorgen Sie den Nasenkegel mit 1 % bis 1,5 % Isofluran im Sauerstofffluss, um sicherzustellen, dass die Maus betäubt bleibt. Überwachen Sie das Tier während des gesamten Eingriffs sorgfältig, um die Isofluran-Anästhesie ohne Überdosierung aufrechtzuerhalten.
HINWEIS: Die Menge an Isofluran, die zur Aufrechterhaltung der Anästhesie erforderlich ist, kann je nach Tier und Stimulus variieren. In der Regel sind 1,5 % ausreichend. Wenn sich das Tier während des Stimulus bewegt, sollte Isofluran erhöht werden. Wenn die Atmung flach wird, sollte Isofluran verringert werden. Testen Sie vor jedem Reiz den Rückzugsreflex der Hintergliedmaßen an der kontralateralen Hinterpfote.
VORSICHT: Isofluran kann beim Einatmen schädlich sein oder Schwindel oder Schläfrigkeit verursachen. Vermeiden Sie das Einatmen und verwenden Sie es nur in einem gut belüfteten Bereich. - Laden Sie das Schnellscanning-Protokoll des Mikroskops.
- Verwenden Sie die typischen Einstellungen für schnelles Scannen: Voxelgröße 2,496 μm x 2,496 μm x 16 μm, 512 x 512 Pixel, 10 optische Schichten Z-Stapel, 1 Lufteinheit (AU)/32 μm, 1% 488 nm Laserleistung 5 mW, Pixelzeit 1,52 μs, Zeilenzeit 0,91 ms, Bildzeit 465 ms, LSM-Scangeschwindigkeit 8, bidirektionales Scannen, GaAsP-PMT-Detektorverstärkung 650 V, digitale Verstärkung 1. Die optimalen Einstellungen können je nach Mikroskop und Tier variieren.
- Um ein schnelles Scanprotokoll einzurichten, klicken Sie auf die Registerkarte Erfassung . Klicken Sie unter Erfassungsparameter auf die Registerkarte Frames . Klicken Sie auf Voreinstellungen > 512 x 512, um das Mikroskop so einzustellen, dass es ein Bild mit 512 x 512 Pixel aufnimmt. Dadurch werden wiederum die X- und Y-Werte der Voxelgröße basierend auf der Bildgröße festgelegt, die von der Mikroskopsoftware bestimmt wird.
- Klicken Sie unter Erfassungsparameter auf die Registerkarte Kanäle . Klicken Sie auf das Feld Track2 . Verwenden Sie das Dropdown-Menü neben dem Feld Track2, um Grün (FITC) auszuwählen. Unter Track2 öffnet sich ein neuer Tab.
- Klicken Sie neben Laser auf das Kästchen 488 . Dadurch werden die Anregungs- und Emissionswellenlängen eingestellt.
- Stellen Sie neben dem 488-nm-Schieberegler die Laserleistung auf 1 % ein. Klicken Sie auf die Schaltfläche 1 AU, um die Blende für 1 Airy-Einheit einzustellen. Stellen Sie unter FITC Master Gain auf 650 V, Digital Offset auf 0 und Digital Gain auf 1 ein.
- Aktivieren Sie auf der Registerkarte " Erfassung" das Kontrollkästchen "Z-Stack ". Klicken Sie auf die Schaltfläche Live, um ein Live-Bild des Ganglions anzuzeigen. Drehen Sie den Knopf für die Fokusebene nach oben, bis nur noch ein kleiner Bogen von Neuronen sichtbar ist.
- Klicken Sie unter " Erfassungsparameter" auf die Registerkarte " Z-Stack " > die Schaltfläche "Letzte festlegen ". Drehen Sie den Knopf für die Fokusebene nach unten, bis nur noch ein kleiner Bogen von Neuronen sichtbar ist. Klicken Sie unter Erfassungsparameter auf die Registerkarte Z-Stack > die Schaltfläche Set First . Klicken Sie auf die Schaltfläche Live, um das Live-Bild auszuschalten.
- Klicken Sie unter Erfassungsparameter auf die Registerkarte Z-Stack . Füllen Sie das Feld Slices mit 10 aus. Dadurch werden 10 optische Schichten gesetzt und die Voxeltiefe automatisch bestimmt.
- Klicken Sie auf der Registerkarte "Erfassung" auf das Feld "Zeitreihe ". Eine neue Registerkarte "Zeitreihe" wird unter "Erfassungsparameter" angezeigt. Klicken Sie auf die Registerkarte Zeitreihe > Feld Zyklen mit der Anzahl der Zyklen, die Sie als nächstes ausführen möchten. In diesem Fall ist es 8.
- Stellen Sie die Scangeschwindigkeit und -richtung ein. Unter Erfassungsparameter > > Registerkarte Erfassungsmodus Richtung > Doppelpfeil für birdirektionales Scannen. Wählen Sie die Registerkarte Erfassungsmodus > Bild- > Schieberegler für die Scangeschwindigkeit > 8.
HINWEIS: Normalerweise kann man die Einstellungen eines früheren Experiments laden und muss die Laserleistung nur anpassen, wenn das Bild zu hell oder zu dunkel ist, und den Z-Stack Set Last und Set First einstellen.
- Führen Sie einen kurzen 8-Zyklus-Scan des DRG durch, indem Sie auf der Registerkarte "Erfassung" auf "Experiment starten" klicken. Erstellen Sie einen Film, indem Sie eine orthogonale Projektion der Scans (ein Scan pro Bild) im Zeitverlauf erstellen und manuell auf Bildschärfe und Bildartefakte wie Helligkeitswellen, die das DRG durchqueren, überprüfen. Passen Sie die Klemmposition und die Dicke des optischen Abschnitts an und wiederholen Sie diesen Schritt, bis ein klarer, qualitativ hochwertiger Film erreicht ist.
Anmerkungen: Dieser Schritt sollte wiederholt werden, wenn sich das Tier bewegt oder vom Ermittler bewegt wird. Zu den Problemen, auf die zu achten ist, gehören Bereiche des Ganglions (nicht nur einzelne Neuronen), die im Laufe des Experiments immer heller zu werden scheinen, ein welliges Erscheinungsbild erzeugen oder dazu führen, dass Bereiche verschwinden oder heller werden. Eine Bewegung, die größer als etwa die Hälfte des Durchmessers eines kleinen Neurons (<20 μm) ist, ist ein weiteres großes Problem. Die Welligkeit kann oft dadurch behoben werden, dass die erste und die letzte Position des Z-Stacks näher zusammengebracht werden (siehe Schritt 2.4.4 oben) und die Dicke der optischen Schichten verringert wird. Film 1 zeigt ein Beispiel für ein wellenförmiges Ganglien vor dem Nivellieren und Einstellen der richtigen optischen Schichtdicke. Film 2 ist nach der Korrektur der Nivellierung und der optischen Schichtdicke. Der Unterschied ist subtil, hat aber einen enormen Einfluss auf die Analyse. - Laden Sie das hochauflösende Scanprotokoll des Mikroskops.
- Verwenden Sie die typischen Einstellungen für hochauflösendes Scannen: Voxelgröße 1,248 μm x 1,248 μm x 14 μm, 1024 x 1024 Pixel, 6 optische Schichten Z-Stack, 1,2 Lufteinheit (AU)/39 μm, 5% 488 nm Laserleistung/25 mW, Pixelzeit 2,06 μs, Zeilenzeit 4,95 ms, Bildzeit 5,06 s, LSM-Scangeschwindigkeit 6, bidirektionales Scannen, GaAsP-PMT-Detektorverstärkung 650 V, digitale Verstärkung 1. Die optimalen Einstellungen können je nach Mikroskop und Tier variieren.
- Um ein hochauflösendes Scanprotokoll einzurichten, klicken Sie auf die Registerkarte Erfassung . Klicken Sie unter Erfassungsparameter auf die Registerkarte Frames . Klicken Sie auf Voreinstellungen > 1024 x 1024, um das Mikroskop so einzustellen, dass es ein Bild mit 1024 Pixel x 1024 Pixel aufnimmt. Dadurch werden wiederum die X- und Y-Werte der Voxelgröße basierend auf der Bildgröße festgelegt, die von der Mikroskopsoftware bestimmt wird.
- Klicken Sie unter Erfassungsparameter auf die Registerkarte Kanäle . Klicken Sie auf das Feld Track2 . Verwenden Sie das Dropdown-Menü neben dem Feld Track2, um Grün (FITC) auszuwählen. Unter Track2 öffnet sich ein neuer Tab.
- Klicken Sie neben Laser auf das Kästchen 488 . Dadurch werden die Anregungs- und Emissionswellenlängen eingestellt. Klicken Sie auf das Feld High Intensity Laser Range .
- Stellen Sie neben dem 488-nm-Schieberegler die Laserleistung auf 5 % ein. Klicken Sie auf die Schaltfläche 1 AU, um die Blende für 1 Airy-Einheit einzustellen. Stellen Sie unter FITC Master Gain auf 650 V, Digital Offset auf 0 und Digital Gain auf 1 ein.
- Aktivieren Sie auf der Registerkarte " Erfassung" das Kontrollkästchen "Z-Stack ". Klicken Sie auf die Schaltfläche Live, um ein Live-Bild des Ganglions anzuzeigen. Drehen Sie den Knopf für die Fokusebene nach oben, bis nur noch ein kleiner Bogen von Neuronen sichtbar ist.
- Klicken Sie unter " Erfassungsparameter" auf die Registerkarte " Z-Stack " > die Schaltfläche "Letzte festlegen ". Drehen Sie den Knopf für die Fokusebene nach unten, bis nur noch ein kleiner Bogen von Neuronen sichtbar ist. Klicken Sie unter " Erfassungsparameter" auf die Registerkarte " Z-Stack " > auf die Schaltfläche "Set First ". Klicken Sie auf die Schaltfläche Live, um das Live-Bild auszuschalten.
- Klicken Sie unter Erfassungsparameter auf die Registerkarte Z-Stack . Füllen Sie das Feld Slices mit 6 aus. Dadurch werden 6 optische Schichten festgelegt und die Voxeltiefe automatisch bestimmt.
- Vergewissern Sie sich, dass auf der Registerkarte "Erfassung" das Kontrollkästchen "Zeitreihe " deaktiviert ist (keine Zeitreihe ).
- Stellen Sie die Scangeschwindigkeit und -richtung ein. Klicken Sie unter Erfassungsparameter auf die Registerkarte Erfassungsmodus > Frame->-Presets > 1024 x 1024. Wählen Sie die Registerkarte Erfassungsmodus > Bild- > Richtungsrichtung > Doppelpfeil für bidirektionales Scannen. Wählen Sie die Registerkarte Erfassungsmodus > Schieberegler für Bild- > Scangeschwindigkeit > 6.
- Wenn Zellen mit td-Tomato markiert sind, stellen Sie das Mikroskop so ein, dass es zusätzlich zum grünen Kanal den roten Kanal 592 nm Anregung/614 nm Emission, Detektionswellenlänge 600-700 nm abtastet. Stellen Sie dies ein, indem Sie zu Akquisitionsparameter gehen und auf die Registerkarte Kanäle > Feld Track1 klicken. Verwenden Sie das Dropdown-Menü neben dem Feld Track1, um Rot (Texas Red) auszuwählen. Gehen Sie genauso vor wie in Schritt 2.6.3, außer dass Sie auf das Kästchen 561 statt auf das Kästchen 488 klicken. Stellen Sie die Laserleistung auf 1 % ein. Td-Tomato ist viel heller als GCaMP3 und benötigt eine geringere Laserleistung.
- Erstellen Sie ein hochauflösendes Bild des DRG, indem Sie auf der Registerkarte "Erfassung" auf die Schaltfläche "Experiment starten" klicken.
- Laden Sie das Mikroskop-Rapid-Scanning-Protokoll (siehe Schritt 2.4). Zeichnen Sie die Spontanaktivität im DRG für 80 Zyklen (ca. 10 min) auf. Generieren Sie einen orthogonalen Projektionsfilm, und überprüfen Sie, ob das Bild eine ausreichende Qualität für die Analyse aufweist.
HINWEIS: Die Qualitätsüberlegungen sind die gleichen wie in Schritt 2.5. - Stellen Sie das Mikroskop zum Auftragen von Reizen so ein, dass es 15-20 Scans durchführt. Warten Sie, bis die Scans 1 bis 5 abgeschlossen sind, um die Baseline zu erstellen. Wenden Sie den Stimulus während der Scans 6-10 an. Warten Sie nach jedem Stimulus mindestens 5 Minuten, bevor Sie den nächsten Stimulus anwenden, um eine Desensibilisierung zu verhindern.
Anmerkungen: Zuerst sollten mechanische Reize und dann kalte, thermische und chemische Reize angewendet werden. Schwächere Reize (z. B. geringe mechanische Kraft, Temperaturen näher an der Raumtemperatur) sollten vor stärkeren Reizen (z. B. höhere mechanische Kraft, Temperaturen, die weiter von der Raumtemperatur entfernt sind) angewendet werden. Achten Sie bei der Anwendung von Reizen darauf, dass sich das DRG nicht bewegt. Insbesondere bei starken thermischen Reizen ist es oft notwendig, 2% Isofluran für 1-2 min aufzutragen, bevor der Stimulus beginnt. Auf dem in dieser Studie verwendeten Mikroskop ist jeder Scan deutlich zu hören, so dass der Forscher das Ende des Scans leicht identifizieren kann, was eine Stimulusanwendung unmittelbar nach Scan 5 ermöglicht. Jede Methode, die die Anwendung von Reizen zu einem konsistenten Zeitpunkt erleichtert, funktioniert jedoch. - Halten Sie für einen mechanischen Druck die Zange des Algometers mit der Pfote zwischen den Paddeln, ohne die Pfote zu berühren, und kneifen Sie unmittelbar nach dem Ende von Scan 5 und stoppen Sie unmittelbar nach Scan 10. Überwachen Sie die Presskraft mit einem Algometer (siehe Materialtabelle). Halten Sie die Presskraft so nah wie möglich an der gewünschten Kraft (hier verwenden wir einen 100 g Pressreiz) und achten Sie darauf, dass sie 10 g über der gewünschten Kraft nicht überschreitet.
HINWEIS: Man kann Reize bereits mit 0,07 g von-Frey-Filamenten und bis zu 600 g Presskraft erkennen. - Kühlen oder erhitzen Sie für kalte und thermische Reize ein Becherglas Wasser auf knapp unter (für kalt) oder über (für thermisch) die gewünschte Temperatur und beginnen Sie mit dem Scannen. Verwenden Sie hier einen Reiz von 45 °C. Wenn das Wasser die richtige Temperatur hat, wenden Sie den Stimulus sofort nach Scan 5 an, indem Sie die Pfote in das Wasser tauchen. Ziehen Sie das Becherglas sofort nach Scan 10 ab.
Anmerkungen: Die Temperatur sollte bei Scan 5 innerhalb von 1 °C von der gewünschten Temperatur liegen. Wenn die Temperatur des Becherglases nicht korrekt ist, wenden Sie den Reiz nicht an, da dies die Neuronen desensibilisieren könnte. Kühlen oder erhitzen Sie stattdessen das Wasser und versuchen Sie es erneut. Wir haben Temperaturen von 0 °C (Eiswasser) bis zu 95 °C gemessen. Denken Sie jedoch daran, dass Temperaturen über 50 °C das Gewebe schädigen und spätere Experimente verfälschen können. Ebenso sind einige Chemikalien (z. B. Tetrodotoxin, Capsaicin) irreversibel oder können nicht ausgewaschen werden und können weitere Versuche am Tier verhindern. - Nachdem alle Reize angewendet und aufgezeichnet wurden, wird das Tier durch Überdosierung mit Ketamin/Xylazin (200 mg/kg Ketamin, 30 mg/kg Xylazin oder 5 μl pro Gramm Körpermasse der in Schritt 1.1 hergestellten Lösung) und anschließend durch Enthauptung eingeschläfert.
3. Datenanalyse
- Öffnen Sie die Bilddateien, indem Sie sie per Drag & Drop in ImageJ ziehen. Wählen Sie nach dem Öffnen der Datei den Bildtyp unter Bild > Geben Sie > RGB-Farbe ein.
HINWEIS: Das Plugin StackReg21 unter Plugins > StackReg ist nützlich zum Korrigieren und Ausrichten von Bewegungsartefakten. ImageJ kann die meisten Dateiformate von Mikroskop-Software lesen. Die Wahl des Bildtyps hängt von den Vorlieben des Benutzers ab. RGB vereinfacht die Erstellung von Farbbildern für die Veröffentlichung. Auch Softwarepakete des Mikroskopherstellers oder von cytoNet22 können bei der Analyse helfen. Es ist nicht erforderlich, StackReg herunterzuladen, zu installieren und zu verwenden, es wird jedoch empfohlen. - Verwenden Sie das ROI-Tool (Region of Interest), um aktive Neuronen unter Analyze > Tool > ROI-Manager auszuwählen. Zeichnen Sie ROIs mit den Ellipsen - oder Rechteckwerkzeugen in der Symbolleiste und platzieren Sie sie in der ROI-Datei, indem Sie im ROI-Manager-Fenster unter Hinzufügen auf die Schaltfläche Hinzufügen klicken oder die Taste "t" drücken.
HINWEIS: Achten Sie darauf, die ROI-Datei regelmäßig zu speichern. Benutzer können ROIs jederzeit wiederherstellen, indem sie eine ROI-Datei per Drag & Drop in ImageJ ziehen und auf das Feld "Alle anzeigen " am unteren Rand des ROI-Manager-Fensters klicken. Das Speichern als Overlay wird nicht empfohlen. Erfahrungsgemäß vereinfacht das Speichern als ROI.zip Datei die Analyse. - Vergewissern Sie sich, dass unter " Analysieren > Festlegen von Messungen" die Option " Mittlerer Grauwert" aktiviert ist. Deaktivieren Sie alle anderen Kontrollkästchen unter Maße festlegen. Verwenden Sie das Multi-Measure-Tool im Menü des ROI-Managers, um die Intensität innerhalb der ROIs zu berechnen. Messen Sie die Intensität mithilfe des ROI-Fensters unter Mehr > Multimeasure.
HINWEIS: Manchmal sind benachbarte Neuronen zu nahe beieinander, um separate ROIs zu erzielen. Diese Neuronen können nicht zur Messung der transienten Intensität verwendet werden, können aber in die Zählung der aktivierenden Neuronen einbezogen werden. - Speichern Sie die von Multimeasure generierte CSV-Datei und öffnen Sie die CSV-Datei mit einer beliebigen Tabellenkalkulationssoftware.
HINWEIS: Unter Ergänzende Datei 1 finden Sie ein Beispiel für eine Tabellenkalkulationsvorlage zur Unterstützung der Analyse. - Berechnen Sie die transiente Ca 2+-Intensität als ΔF / F 0 = (F t- F 0) / F 0, wobei Ft die Pixelintensität in einem ROI zum interessierenden Zeitpunkt ist und F 0 die Basislinienintensität ist, die durch Mittelung der Intensitäten entweder der 2-4 Frames vor dem Ca 2+-Transienten für spontane Aktivität oder der ersten 1-5 Frames des ROI für Ca 2+ bestimmt wird Transienten, die während der Stimulation auftreten. Schließen Sie alle Neuronen aus, die vor dem Stimulus Ca2+-Peaks produzieren, und analysieren Sie die Aktivität nach dem Ende des Stimulus nicht.
- Für die Analyse der transienten Intensität von Ca2+ werden nach dem Zufallsprinzip etwa gleich viele Neuronen aus jedem Ganglion entnommen, um zu vermeiden, dass die Daten in Richtung der Ganglien verzerrt werden, die die größte Anzahl antwortender Neuronen hervorgebracht haben. Schließen Sie Spitzen aus, bei denen ΔF / F 0 < 0,15 beträgt.
HINWEIS: Es gibt alternative veröffentlichte Methoden zur Analyse und zum Ein-/Ausschluss von Neuronen 11,12,23,24,25,26,27,28. - Messen Sie Neuronendurchmesser mit dem Linienwerkzeug in der Symbolleiste in ImageJ. Berechnen Sie den durchschnittlichen Durchmesser aus den Linien, die entlang des längsten und kürzesten Durchmessers gezeichnet werden.
Access restricted. Please log in or start a trial to view this content.
Ergebnisse
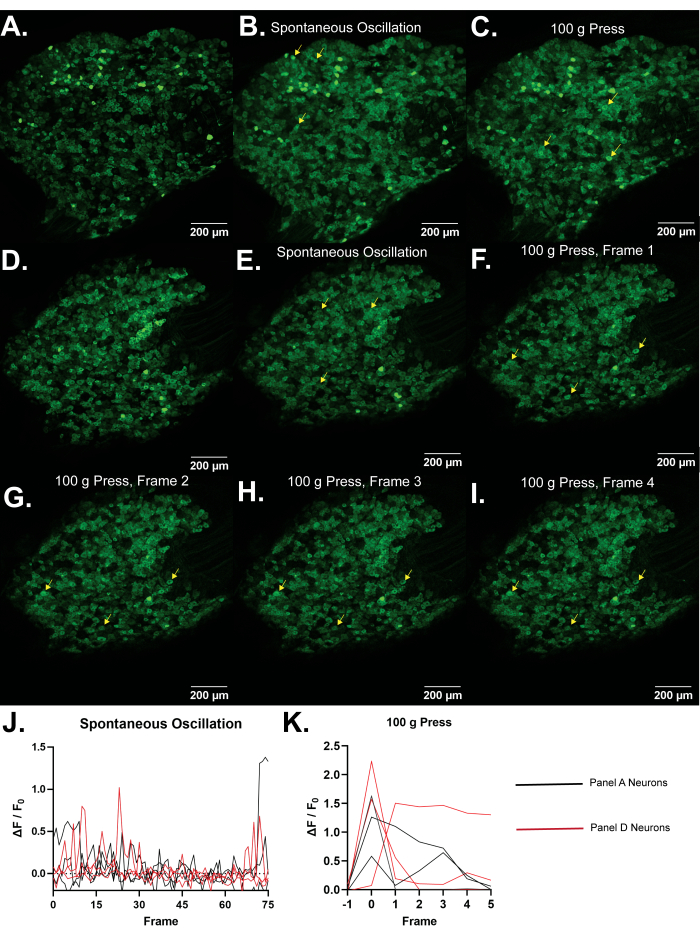
Abbildung 4: Repräsentative Bilder von L5 dorsalen Wurzelganglien von Pirt-GCaMP3 Mäusen. (A,D) Hochauflösende Einzelbildscans von L5 dorsalen Wurzelganglien von Pirt-GCaMP3 Mäusen werden gezeigt. (B,E) . Durchschnittliche Intensitätsprojektionen von 15 Bildern von Pirt-GCaMP3 L5 DRG-Ganglien a...
Access restricted. Please log in or start a trial to view this content.
Diskussion
Anhaltende Schmerzen treten bei einer Vielzahl von Erkrankungen auf und beeinträchtigen und/oder verringern die Lebensqualität von etwa 8 % der Menschen29. Primäre sensorische Neuronen erkennen schädliche Reize auf der Haut, und ihre Plastizität trägt zu anhaltenden Schmerzen bei8. Während Neuronen in Zellkulturen und Explantaten untersucht werden können, werden sie dadurch aus ihrem normalen physiologischen Kontext entfernt. Die chirurgische Exposition des DRG, gef...
Access restricted. Please log in or start a trial to view this content.
Offenlegungen
Die Autoren erklären, dass keine konkurrierenden finanziellen Interessen bestehen.
Danksagungen
Diese Arbeit wurde durch die National Institutes of Health Grants R01DE026677 und R01DE031477 (an Y.S.K.), UTHSCSA Startup Fund (Y.S.K.) und einen Rising STAR Award der University of Texas System (Y.S.K.) unterstützt.
Access restricted. Please log in or start a trial to view this content.
Materialien
| Name | Company | Catalog Number | Comments |
| Anased Injection (Xylazine) | Covetrus, Akorn | 33197 | |
| C Epiplan-Apochromat 10x/0.4 DIC | Cal Zeiss | 422642-9900-000 | |
| Cotton Tipped Applicators | McKesson | 24-106-1S | |
| Curved Hemostat | Fine Science Tools | 13007-12 | |
| DC Temperature Controller | FHC | 40-90-8D | |
| DC Temperature Controller Heating Pad | FHC | 40-90-2-05 | |
| Dumont Ceramic Coated Forceps | Fine Science Tools | 11252-50 | |
| FHC DC Temperature Controller | FHC | 40-90-8D | |
| Fluriso (Isoflurane) | MWI Animal Health, Piramal Group | 501017 | |
| Friedman-Pearson Rongeurs | Fine Science Tools | 16221-14 | |
| GelFoam | Pfizer | 09-0353-01 | |
| Ketaset (Ketamine) | Zoetis | KET-00002R2 | |
| Luminescent Green Stage Tape | JSITON/ Amazon | B803YW8ZWL | |
| Matrx VIP 3000 Isoflurane Vaporizer | Midmark | 91305430 | |
| Micro dissecting scissors | Roboz | RS-5882 | |
| Micro dissecting spring scissors | Fine Science Tools | 15023-10 | |
| Micro dissecting spring scissors | Roboz | RS-5677 | |
| Mini Rectal Thermistor Probe | FHC | 40-90-5D-02 | |
| Operating scissors | Roboz | RS-6812 | |
| Pirt-GCaMP3 C57BL/6J mice | Johns Hopkins University | N/A | Either sex can be imaged equally well. Mice should be at least 8 weeks old due to weak or intermittent Pirt promoter expression in younger mice. |
| SMALGO small animal algometer | Bioseb In vivo Research Instruments | BIO-SMALGO | |
| Stereotaxic frame | Kopf Model 923-B | 923-B | |
| td-Tomato C57BL/6J mice | Jackson Laboratory | 7909 | |
| Top Plate, 6 in x 10 in | Newport | 290-TP | |
| TrpV1-Cre C57BL/6J mice | Jackson Laboratory | 17769 | |
| Zeiss LSM 800 confocal microscope | Cal Zeiss | LSM800 | |
| Zeiss Zen 2.6 Blue Edition Software | Cal Zeiss | Zen (Blue Edition) 2.6 |
Referenzen
- Rivero-Melián, C., Grant, G. Distribution of lumbar dorsal root fibers in the lower thoracic and lumbosacral spinal cord of the rat studied with choleragenoid horseradish peroxidase conjugate. The Journal of Comparative Neurology. 299 (4), 470-481 (1990).
- Wessels, W. J., Marani, E. A rostrocaudal somatotopic organization in the brachial dorsal root ganglia of neonatal rats. Clinical Neurology and Neurosurgery. 95, 3-11 (1993).
- Schmalbruch, H. The number of neurons in dorsal root ganglia L4-L6 of the rat. The Anatomical Record. 219 (3), 315-322 (1987).
- Sørensen, B., Tandrup, T., Koltzenburg, M., Jakobsen, J. No further loss of dorsal root ganglion cells after axotomy in p75 neurotrophin receptor knockout mice. The Journal of Comparative Neurology. 459 (3), 242-250 (2003).
- Basbaum, A. I., Woolf, C. J. Pain. Current Biology. 9 (12), 429-431 (1999).
- Liu, Y., Ma, Q. Generation of somatic sensory neuron diversity and implications on sensory coding. Current Opinion in Neurobiology. 21 (1), 52-60 (2011).
- Basbaum, A. I., Bautista, D. M., Scherrer, G., Julius, D. Cellular and molecular mechanisms of pain. Cell. 139 (2), 267-284 (2009).
- Stucky, C. L., Mikesell, A. R. Cutaneous pain in disorders affecting peripheral nerves. Neuroscience Letters. 765, 136233(2021).
- Iseppon, F., Linley, J. E., Wood, J. N. Calcium imaging for analgesic drug discovery. Neurobiology of Pain. 11, 100083(2022).
- Chen, Z., et al. Adjacent intact nociceptive neurons drive the acute outburst of pain following peripheral axotomy. Scientific Reports. 9 (1), 7651(2019).
- Chisholm, K. I., Khovanov, N., Lopes, D. M., La Russa, F., McMahon, S. B. Large scale in vivo recording of sensory neuron activity with GCaMP6. eNeuro. 5 (1), (2018).
- Emery, E. C., et al. In vivo characterization of distinct modality-specific subsets of somatosensory neurons using GCaMP. Science Advances. 2 (11), 1600990(2016).
- Ishida, H., et al. In vivo calcium imaging visualizes incision-induced primary afferent sensitization and its amelioration by capsaicin pretreatment. The Journal of Neuroscience. 41 (41), 8494-8507 (2021).
- Kim, Y. S., et al. Coupled activation of primary sensory neurons contributes to chronic pain. Neuron. 91 (5), 1085-1096 (2016).
- MacDonald, D. I., et al. Silent cold-sensing neurons contribute to cold allodynia in neuropathic pain. Brain. 144 (6), 1711-1726 (2021).
- Wang, F., et al. Sensory afferents use different coding strategies for heat and cold. Cell Reports. 23 (7), 2001-2013 (2018).
- Kucharczyk, M. W., et al. The impact of bone cancer on the peripheral encoding of mechanical pressure stimuli. Pain. 161 (8), 1894-1905 (2020).
- Kim, A. Y., et al. a phosphoinositide-binding protein, functions as a regulatory subunit of TRPV1. Cell. 133 (3), 475-485 (2008).
- Kim, Y. S., et al. Central terminal sensitization of TRPV1 by descending serotonergic facilitation modulates chronic pain. Neuron. 81 (4), 873-887 (2014).
- Tian, L., et al. Imaging neural activity in worms, flies and mice with improved GCaMP calcium indicators. Nature Methods. 6 (12), 875-881 (2009).
- Thévenaz, P., Ruttimann, U. E., Unser, M. A pyramid approach to subpixel registration based on intensity. IEEE Transactions on Image Processing. 7 (1), 27-41 (1998).
- Mahadevan, A. S., et al. cytoNet: Spatiotemporal network analysis of cell communities. PLoS Computational Biology. 18 (6), 1009846(2022).
- Barretto, R. P., et al. The neural representation of taste quality at the periphery. Nature. 517 (7534), 373-376 (2015).
- Leijon, S. C. M., et al. Oral thermosensing by murine trigeminal neurons: modulation by capsaicin, menthol and mustard oil. The Journal of Physiology. 597 (7), 2045-2061 (2019).
- Sekiguchi, K. J., et al. Imaging large-scale cellular activity in spinal cord of freely behaving mice. Nature Communications. 7, 11450(2016).
- Wu, A., Dvoryanchikov, G., Pereira, E., Chaudhari, N., Roper, S. D. Breadth of tuning in taste afferent neurons varies with stimulus strength. Nature Communications. 6, 8171(2015).
- Ran, C., Hoon, M. A., Chen, X. The coding of cutaneous temperature in the spinal cord. Nature Neuroscience. 19 (9), 1201-1209 (2016).
- Yarmolinsky, D. A., et al. Coding and plasticity in the mammalian thermosensory system. Neuron. 92 (5), 1079-1092 (2016).
- Torrance, N., Smith, B. H., Bennett, M. I., Lee, A. J. The epidemiology of chronic pain of predominantly neuropathic origin. Results from a general population survey. The Journal of Pain. 7 (4), 281-289 (2006).
- Shannonhouse, J., et al. Meclizine and metabotropic glutamate receptor agonists attenuate severe pain and Ca(2+) activity of primary sensory neurons in chemotherapy-induced peripheral neuropathy. The Journal of Neuroscience. 42 (31), 6020-6037 (2022).
- Luiz, A. P., et al. Cold sensing by Na(V)1.8-positive and Na(V)1.8-negative sensory neurons. Proceedings of the National Academy of Sciences of the United States of America. 116 (9), 3811-3816 (2019).
- Hartung, J. E., Gold, M. S. GCaMP as an indirect measure of electrical activity in rat trigeminal ganglion neurons. Cell Calcium. 89, 102225(2020).
- Chung, M. K., Wang, S., Oh, S. L., Kim, Y. S. Acute and chronic pain from facial skin and oral mucosa: Unique neurobiology and challenging treatment. International Journal of Molecular Sciences. 22 (11), 5810(2021).
- Chan, S. L., Mayne, M., Holden, C. P., Geiger, J. D., Mattson, M. P. Presenilin-1 mutations increase levels of ryanodine receptors and calcium release in PC12 cells and cortical neurons. The Journal of Biological Chemistry. 275 (24), 18195-18200 (2000).
- Sierra, D. A., Popov, S., Wilkie, T. M. Regulators of G-protein signaling in receptor complexes. Trends in Cardiovascular Medicine. 10 (6), 263-268 (2000).
- Yoshihara, K., et al. Astrocytic Ca(2+) responses in the spinal dorsal horn by noxious stimuli to the skin. Journal of Pharmacological Sciences. 137 (1), 101-104 (2018).
- Tan, C. H., McNaughton, P. A. The TRPM2 ion channel is required for sensitivity to warmth. Nature. 536 (7617), 460-463 (2016).
- Akemann, W., Mutoh, H., Perron, A., Rossier, J., Knöpfel, T. Imaging brain electric signals with genetically targeted voltage-sensitive fluorescent proteins. Nature Methods. 7 (8), 643-649 (2010).
- Gong, Y., et al. High-speed recording of neural spikes in awake mice and flies with a fluorescent voltage sensor. Science. 350 (6266), 1361-1366 (2015).
- Grewe, B. F., Langer, D., Kasper, H., Kampa, B. M., Helmchen, F. High-speed in vivo calcium imaging reveals neuronal network activity with near-millisecond precision. Nature Methods. 7 (5), 399-405 (2010).
- Harada, K., et al. Red fluorescent protein-based cAMP indicator applicable to optogenetics and in vivo imaging. Scientific Reports. 7 (1), 7351(2017).
Access restricted. Please log in or start a trial to view this content.
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenWeitere Artikel entdecken
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten