È necessario avere un abbonamento a JoVE per visualizzare questo. Accedi o inizia la tua prova gratuita.
Method Article
In vivo Imaging del calcio di insiemi neuronali in reti di neuroni sensoriali primari nei gangli della radice dorsale intatti
In questo articolo
Riepilogo
Questo protocollo descrive l'esposizione chirurgica del ganglio della radice dorsale (DRG) seguito da GCaMP3 (indicatore Ca2+ codificato geneticamente; Green Fluorescent Protein-Calmodulin-M13 Protein 3) Ca2+ imaging degli insiemi neuronali utilizzando topi Pirt-GCaMP3 mentre si applica una varietà di stimoli alla zampa posteriore omolaterale.
Abstract
L'imaging di Ca 2+ può essere utilizzato come proxy per l'attività cellulare, compresi i potenziali d'azione e vari meccanismi di segnalazione che coinvolgono l'ingresso di Ca 2+ nel citoplasma o il rilascio di riserve intracellulari di Ca 2+. L'imaging Ca2+ basato su Pirt-GCaMP3 dei neuroni sensoriali primari del ganglio della radice dorsale (DRG) nei topi offre il vantaggio della misurazione simultanea di un gran numero di cellule. È possibile monitorare fino a 1.800 neuroni, consentendo di studiare le reti neuronali e i processi somatosensoriali come un insieme nel loro normale contesto fisiologico a livello di popolazione in vivo. Il gran numero di neuroni monitorati consente di rilevare modelli di attività che sarebbero difficili da rilevare utilizzando altri metodi. Gli stimoli possono essere applicati alla zampa posteriore del topo, consentendo di studiare gli effetti diretti degli stimoli sull'insieme dei neuroni DRG. Il numero di neuroni che producono transitori Ca 2+ e l'ampiezza dei transitori Ca2+ indicano sensibilità a specifiche modalità sensoriali. Il diametro dei neuroni fornisce prove di tipi di fibre attivate (meccano non nocivo vs fibre del dolore nocivo, fibre Aβ, Aδ e C). I neuroni che esprimono recettori specifici possono essere geneticamente marcati con td-Tomato e specifiche ricombinasi Cre insieme a Pirt-GCaMP. Pertanto, l'imaging Pirt-GCaMP3 Ca2+ di DRG fornisce un potente strumento e modello per l'analisi di specifiche modalità sensoriali e sottotipi di neuroni che agiscono come un insieme a livello di popolazione per studiare dolore, prurito, tatto e altri segnali somatosensoriali.
Introduzione
I neuroni sensoriali primari innervano direttamente la pelle e trasportano le informazioni somatosensoriali al sistema nervoso centrale 1,2. I gangli delle radici dorsali (DRG) sono gruppi di corpi cellulari di 10.000-15.000 neuroni sensoriali primari 3,4. I neuroni DRG presentano diverse dimensioni, livelli di mielinizzazione e modelli di espressione genica e recettoriale. I neuroni di diametro più piccolo includono neuroni sensibili al dolore e neuroni di diametro maggiore rispondono tipicamente a stimoli meccanici non dolorosi 5,6. Disturbi nei neuroni sensoriali primari come lesioni, infiammazione cronica e neuropatie periferiche possono sensibilizzare questi neuroni a vari stimoli e contribuire al dolore cronico, allodinia e ipersensibilità al dolore 7,8. Pertanto, lo studio dei neuroni DRG è importante per comprendere sia la somatosensazione in generale che molti disturbi del dolore e del prurito.
I neuroni che sparano in vivo sono essenziali per la somatosensazione, ma fino a poco tempo fa, gli strumenti per studiare i gangli intatti in vivo erano limitati a un numero relativamente piccolo di cellule 9. Qui, descriviamo un potente metodo per studiare i potenziali d'azione o le attività dei neuroni a livello di popolazione in vivo come insieme. Il metodo utilizza l'imaging basato sulla dinamica citoplasmatica di Ca2+. Gli indicatori fluorescenti sensibili al Ca 2+ sono buoni proxy per misurare l'attività cellulare a causa della concentrazione normalmente bassa di Ca2+ citoplasmatico. Questi indicatori hanno permesso il monitoraggio simultaneo di centinaia o diverse migliaia di neuroni sensoriali primari nei topi 9,10,11,12,13,14,15,16 e nei ratti 17. Il metodo di imaging in vivo Ca2+ descritto in questo studio può essere utilizzato per osservare direttamente le risposte a livello di popolazione a stimoli meccanici, freddi, termici e chimici.
La proteina di membrana legante i fosfoinositidi, Pirt è espressa ad alti livelli in quasi tutti i neuroni sensoriali primari (>95%)18,19 e può essere utilizzata per guidare l'espressione del sensore Ca 2+, GCaMP3, per monitorare l'attività neuronale in vivo20. In questo protocollo, vengono descritte le tecniche per eseguire interventi chirurgici DRG in vivo, imaging Ca2+ e analisi nel DRG lombare 5 (L5) destro di topi Pirt-GCaMP314 utilizzando la microscopia a scansione laser confocale (LSM).
Access restricted. Please log in or start a trial to view this content.
Protocollo
Tutte le procedure qui descritte sono state eseguite in conformità con un protocollo approvato dall'Institutional Animal Care and Use Committee dell'Università del Texas Health Science Center di San Antonio.
NOTA: Una volta iniziato, la chirurgia animale (fase 1) e l'imaging (fase 2) devono essere completati in modo continuo. L'analisi dei dati (fase 3) può essere eseguita successivamente.
1. Chirurgia e fissaggio dell'animale per l'imaging DRG L5 del lato destro
NOTA: In questo studio sono stati utilizzati topi Pirt-GCaMP3 C57BL/6J maschi e femmine di età pari o superiore a 8 settimane. Mentre entrambi i sessi possono essere visualizzati ugualmente bene, i topi dovrebbero avere almeno 8 settimane a causa dell'espressione di Pirt debole o intermittente nei topi più giovani. I topi Pirt-GCaMP3 C57BL/6J sono stati generati presso la Johns Hopkins University14. Entrambi i DRG laterali possono essere ripresi e altri DRG lombari (ad esempio, lombare 4) possono essere ripresi. I tempi indicati sono stime per un chirurgo esperto. Problemi tecnici occasionali come un aumento del sanguinamento possono aumentare il tempo richiesto.
- Preparare una soluzione salina sterile contenente 40 mg/ml di ketamina e 6 mg/ml di xilazina. Il volume totale deve essere di almeno 9 μL/g di massa corporea sia per la chirurgia che per l'eutanasia dopo l'imaging.
ATTENZIONE: La ketamina è dannosa se iniettata, ingerita o quando viene a contatto con l'occhio. Maneggiare con cura. - Assicurarsi che tutti gli strumenti chirurgici siano puliti e sterilizzati mediante autoclave o altra guida NIH per la cura e l'uso del metodo approvato dagli animali da laboratorio.
- Tra 15 e 25 minuti prima dell'intervento, iniettare un topo Pirt-GCaMP3 per via intraperitoneale (i.p.) con ~2,25 μL di ketamina/xilazina per ogni grammo di peso corporeo (90 mg/kg di ketamina, 13,5 mg/kg di xilazina). Non superare i 120 mg/kg di ketamina.
- Entro 15-25 minuti dopo l'iniezione di anestesia (fase 1.3), controllare se il topo ha raggiunto il piano chirurgico dell'anestesia pizzicando la zampa posteriore controlaterale (non la zampa posteriore omolaterale / destra). L'assenza del riflesso di ritiro degli arti posteriori assicura che si raggiunga un piano chirurgico di anestesia.
NOTA: Il riflesso di ritiro degli arti posteriori viene utilizzato durante l'esperimento per monitorare l'anestesia. Usa sempre la zampa posteriore controlaterale. - Posizionare il mouse su un pad riscaldato per mantenere la temperatura corporea a 37 °C.
NOTA: può essere utile tenere la testa del mouse in posizione con una cornice stereotassica (vedere Tabella dei materiali) o un'altra cornice in base alle preferenze del ricercatore. - Individua l'allargamento lombare sentendo l'osso pelvico del topo. Rasare il dorso del mouse sopra l'area di allargamento lombare. Questo passaggio dovrebbe richiedere ~ 90 s.
NOTA: il mouse può essere brevemente rimosso dal pad riscaldato per la rasatura. - Fare un'incisione rettangolare su tre lati (8 mm x 20 mm) sopra l'allargamento lombare usando le forbici e piegare la pelle con una pinza (Figura 1A). Questo passaggio richiede ~ 2 min.
NOTA: I ricercatori possono anche utilizzare una pinza emostatica o un divaricatore per tenere aperta l'incisione. Questo non è un intervento chirurgico di sopravvivenza, quindi non è necessaria un'ulteriore pulizia dell'area chirurgica; Tuttavia, può essere fatto usando povidone-iodio. Qui viene indicata la dimensione dell'incisione accettabile più grande. Un'incisione più piccola è preferibile a un'incisione più grande. - Utilizzare le forbici per dissezione a molla da 13 mm per praticare incisioni di 3-4 mm sul lato destro della colonna vertebrale. Utilizzare le forbici per tagliare la pelle e i muscoli ai lati per esporre la colonna vertebrale (Figura 1B). Questo passaggio richiede ~ 3 min.
- Utilizzare forbici da 8 mm per pulire il processo trasversale del lato destro L5 DRG tagliando via il muscolo e il tessuto connettivo mentre si cerca di ridurre al minimo il sanguinamento. Utilizzare cotone e / o gel foam per assorbire il sangue. La vertebra L5 è la prima vertebra rostrale all'osso pelvice.
NOTA: Questo passaggio richiede ~ 3 minuti e potrebbe richiedere più tempo se l'animale sanguina più del normale. - Tagliare il processo trasversale L5 sul lato destro usando rongeur Friedman-Pearson o forti pinze sottili. Fare attenzione a non toccare il DRG (Figura 1C).
NOTA: Questo passaggio richiede ~ 2 minuti, ma potrebbe richiedere più tempo se l'animale sanguina più del normale. - Non procedere fino a quando l'emorragia non si arresta completamente. Prevenire il sanguinamento sulla superficie DRG utilizzando schiuma di gel o cotone. Questo passaggio richiede 1-4 minuti.
- Spostare il mouse e il termoforo sullo stage personalizzato (Figura 2A,B). Utilizzare del nastro adesivo per fissare l'animale e la piastra elettrica in posizione. Posizionare il naso dell'animale nel cono del naso in modo che l'animale possa ricevere l'anestesia isoflurana continua. Fissare la zampa posteriore destra che sporge dal palco in modo che gli stimoli possano essere facilmente applicati alla zampa. Questo passaggio richiede 3 minuti.
- Fissare la colonna vertebrale in posizione con i morsetti dello stadio sulla pelle sulle vertebre e / o l'osso pelvico appena rostrale e caudale al DRG L5. Regolare i morsetti e il palco per rendere la superficie del DRG il più livellata possibile (Figura 2B,C).
NOTA: Potrebbe essere necessario tagliare il tessuto che si trova tra il DRG e l'obiettivo. - Posizionare lo stadio sotto il microscopio in modo che l'obiettivo sia 8 mm direttamente sopra il DRG quando viene abbassato (Figura 3A,B). Inserire il termometro rettale.
NOTA: La distanza tra il DRG e l'obiettivo può variare in base all'obiettivo, al microscopio e all'animale. - Collegare le linee elettriche alla piastra riscaldante e al termometro rettale. Collegare il cono del naso alle tubazioni del gas isoflurano.
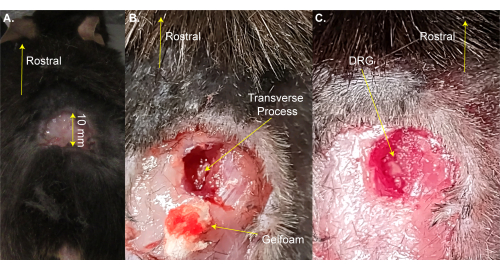
Figura 1: Esempio di chirurgia di esposizione al DRG . (A) Una piccola area è stata rasata e la pelle è stata tagliata e ripiegata. L'incisione è ~10 mm sull'asse rostrale-caudale. (B) È stata praticata un'incisione sul lato destro della colonna vertebrale e il muscolo e il tessuto connettivo sono stati tagliati, esponendo il processo trasversale del lato destro L5. Il sangue è stato assorbito con gelfoam. (C) Il processo trasversale è stato pulito e l'osso sopra il DRG è stato rimosso. Fare clic qui per visualizzare una versione ingrandita di questa figura.
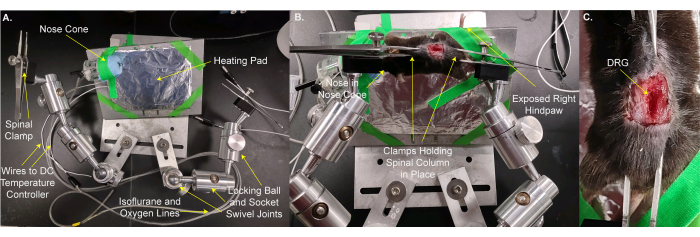
Figura 2: Montaggio del mouse su un palco personalizzato per l'imaging DRG . (A) Viene visualizzata la fase personalizzata. Consiste in una piastra di base e una piastra per l'animale. La piastra di montaggio dell'animale si trova su una sfera di bloccaggio e un giunto girevole a bussola. Un cono naso con linee per l'erogazione di miscela ossigeno / isoflurano e una linea di gas di scarico insieme a una piastra riscaldante avvolta in fogli di alluminio sono fissati alla piastra di montaggio dell'animale. Due bracci, ciascuno costituito da tre giunti girevoli a sfera di bloccaggio e presa, sono imbullonati alla piastra di base. Ogni braccio ha un morsetto fatto da una pinza con una vite per il serraggio e l'allentamento. (B) L'animale è montato sulla piastra di montaggio dell'animale. Il suo naso è posto nel cono del naso. I morsetti sono posizionati sulla pelle tenendo la colonna vertebrale e l'osso pelvico. La zampa posteriore destra (omolaterale) è nastrata per sporgere per un facile accesso per l'applicazione degli stimoli. (C) Un'immagine ravvicinata della colonna vertebrale bloccata e dell'osso pelvico. Fare clic qui per visualizzare una versione ingrandita di questa figura.

Figura 3: L'animale sul palco personalizzato è posizionato sotto l'obiettivo del microscopio. (A) Una vista grandangolare del palcoscenico, dell'animale e del microscopio. I fili al regolatore di temperatura CC e le linee per l'aspirazione ossigeno / isoflurano e la linea dei gas di scarico sono visibili sulla sinistra. (B) Una vista ravvicinata dell'animale al di sotto dell'obiettivo del microscopio. Il DRG è ~ 8 mm al di sotto dell'obiettivo. Il termometro rettale è inserito e il naso è all'interno del cono del naso. Fare clic qui per visualizzare una versione ingrandita di questa figura.
2. Imaging DRG
- Utilizzare un obiettivo 10x/0.4 DIC per microscopio confocale verticale e il software associato (vedere Tabella dei materiali) per l'imaging. Utilizzare le impostazioni del filtro verde (FITC): eccitazione 495 nm, emissione 519 nm, lunghezza d'onda di rilevamento 500-580 nm, dispositivo di imaging GaAsP-Pmt1, rilevatore GaAsP-PMT.
NOTA: per altri microscopi utilizzare le impostazioni consigliate dal produttore. - Trova la superficie del DRG con il microscopio. Regolate i morsetti sullo stage in modo che la superficie DRG sia il più livellata possibile e che la superficie massima venga visualizzata sul piano focale.
NOTA: La scelta dell'obiettivo può variare a seconda del microscopio utilizzato e delle preferenze dell'utente. La scelta del software dipende dal microscopio. Un DRG di livello si traduce in immagini più chiare, consente al software di costruire filmati più chiari, consente l'imaging di più neuroni e rende l'analisi più facile e accurata. - Fornire isoflurano all'1% -1,5% nel flusso di ossigeno al cono del naso per garantire che il topo rimanga anestetizzato. Monitorare attentamente l'animale durante tutta la procedura per mantenere l'anestesia con isoflurano senza sovradosaggio.
NOTA: La quantità di isoflurano necessaria per mantenere l'anestesia può variare in base al singolo animale e allo stimolo. Di solito, l'1,5% è sufficiente. Se l'animale si muove durante lo stimolo, l'isoflurano deve essere aumentato. Se la respirazione diventa superficiale, l'isoflurano deve essere ridotto. Prima di ogni stimolo, testare il riflesso di ritiro dell'arto posteriore sulla zampa posteriore controlaterale.
ATTENZIONE: L'isoflurano può essere dannoso o causare vertigini o sonnolenza se inalato. Evitare l'inalazione e l'uso solo in un'area ben ventilata. - Caricare il protocollo di scansione rapida del microscopio.
- Utilizzare le impostazioni tipiche per la scansione rapida: dimensioni voxel 2,496 μm x 2,496 μm x 16 μm, 512 x 512 pixel, 10 Z-stack a fetta ottica, 1 unità airy (AU)/32 μm, potenza laser 1% 488 nm 5 mW, tempo pixel 1,52 μs, tempo di linea 0,91 ms, tempo fotogramma 465 ms, velocità di scansione LSM 8, scansione bidirezionale, Guadagno rivelatore GaAsP-PMT 650 V, guadagno digitale 1. Le impostazioni ottimali possono variare in base al microscopio e all'animale.
- Per impostare un protocollo di scansione rapida, fare clic sulla scheda Acquisizione . In Parametri di acquisizione, fare clic sulla scheda Frame . Fare clic su Preset > 512 x 512 per impostare il microscopio per registrare un'immagine da 512 pixel x 512 pixel. Questo a sua volta imposterà i valori X e Y della dimensione del voxel in base alla dimensione dell'immagine, che è determinata dal software del microscopio.
- In Parametri di acquisizione, fare clic sulla scheda Canali . Fare clic sulla casella Traccia2 . Utilizzare il menu a discesa accanto alla casella Traccia2 per selezionare Verde (FITC). Una nuova scheda si aprirà sotto Track2.
- Accanto a Laser, fai clic sulla casella 488 . Questo imposterà le lunghezze d'onda di eccitazione ed emissione.
- Accanto al cursore da 488 nm, impostare Potenza laser su 1%. Fare clic sul pulsante 1 AU per impostare l'apertura per 1 unità Airy. In FITC, impostate Guadagno master su 650 V, Offset digitale su 0 e Guadagno digitale su 1.
- Nella scheda Acquisizione , seleziona la casella Z-Stack . Fare clic sul pulsante Live per visualizzare un'immagine live del ganglio di legno. Ruotare la manopola del piano focale verso l'alto fino a quando non è visibile solo un piccolo arco di neuroni.
- In Parametri di acquisizione, fare clic sulla scheda Z-Stack > sul pulsante Imposta ultimo . Ruotare la manopola del piano focale verso il basso fino a quando non è visibile solo un piccolo arco di neuroni. In Parametri di acquisizione, fare clic sulla scheda Z-Stack > sul pulsante Imposta primo . Fare clic sul pulsante Live per disattivare l'immagine live.
- In Parametri di acquisizione, fare clic sulla scheda Z-Stack . Compila il campo Sezioni con 10. Questo imposterà 10 fette ottiche e determinerà automaticamente la profondità del voxel.
- Nella scheda Acquisizione, fare clic sulla casella Serie temporali . Verrà visualizzata una nuova scheda Time Series in Parametri di acquisizione. Fare clic sulla scheda Serie temporali > campo Cicli con il numero di cicli che si desidera eseguire successivamente. In questo caso, è 8.
- Impostare la velocità e la direzione della scansione. In Parametri di acquisizione, scheda Modalità acquisizione > > Direzione > freccia a punta doppia per la scansione bidirezionale. Selezionare la scheda Modalità di acquisizione > Frame > Scan Speed Slider > 8.
NOTA: Normalmente è possibile caricare le impostazioni di un esperimento precedente e regolare la potenza del laser solo se l'immagine è troppo luminosa o fioca e regolare Z-Stack Set Last e Set First.
- Fai una breve scansione di 8 cicli del DRG facendo clic su Avvia esperimento nella scheda Acquisizione . Crea un filmato eseguendo una proiezione ortogonale delle scansioni (una scansione per fotogramma) nel tempo e controlla manualmente la chiarezza dell'immagine e gli artefatti di imaging come "onde" di luminosità che attraversano il DRG. Regolare la posizione del morsetto e lo spessore della sezione ottica e ripetere questo passaggio fino a ottenere un filmato chiaro e di alta qualità.
NOTA: Questo passaggio deve essere ripetuto se l'animale si muove o viene spostato dallo sperimentatore. I problemi da cercare includono aree del ganglio (non solo singoli neuroni) che sembrano diventare sempre più chiare nel corso dell'esperimento creando un aspetto ondulato o causando la scomparsa o la diventazione o più luminose delle aree. Il movimento superiore a circa la metà del diametro di un piccolo neurone (<20 μm) è un altro grosso problema. L'ondulazione può spesso essere risolta avvicinando la prima e l'ultima posizione dello Z-Stack (vedere il punto 2.4.4 sopra) e restringendo lo spessore della fetta ottica. Il filmato 1 fornisce un esempio di gangli ondulati prima di livellare e impostare lo spessore della fetta ottica corretto. Il filmato 2 è dopo aver corretto il livellamento e lo spessore della fetta ottica. La differenza è sottile, ma ha un enorme effetto sull'analisi. - Caricare il protocollo di scansione ad alta risoluzione del microscopio.
- Utilizzare le impostazioni tipiche per la scansione ad alta risoluzione: dimensioni voxel 1,248 μm x 1,248 μm x 14 μm, 1024 x 1024 pixel, 6 fette ottiche Z-stack, 1,2 unità airy (AU)/39 μm, 5% 488 nm potenza laser/25 mW, tempo pixel 2,06 μs, tempo di linea 4,95 ms, tempo fotogramma 5,06 s, velocità di scansione LSM 6, scansione bidirezionale, Guadagno rivelatore GaAsP-PMT 650 V, guadagno digitale 1. Le impostazioni ottimali possono variare in base al microscopio e all'animale.
- Per impostare un protocollo di scansione ad alta risoluzione, fare clic sulla scheda Acquisizione . In Parametri di acquisizione, fare clic sulla scheda Frame . Fare clic su Preset > 1024 x 1024 per impostare il microscopio per registrare un'immagine di 1024 pixel x 1024 pixel. Questo a sua volta imposterà i valori X e Y della dimensione del voxel in base alla dimensione dell'immagine, che è determinata dal software del microscopio.
- In Parametri di acquisizione, fare clic sulla scheda Canali . Fare clic sulla casella Traccia2 . Utilizzare il menu a discesa accanto alla casella Traccia2 per selezionare Verde (FITC). Una nuova scheda si aprirà sotto Track2.
- Accanto a Laser, fai clic sulla casella 488 . Questo imposterà le lunghezze d'onda di eccitazione ed emissione. Fare clic sulla casella Gamma laser ad alta intensità .
- Accanto al cursore a 488 nm, impostare Potenza laser su 5%. Fare clic sul pulsante 1 AU per impostare l'apertura per 1 unità Airy. In FITC impostare Master Gain a 650 V, Digital Offset a 0 e Digital Gain a 1.
- Nella scheda Acquisizione , seleziona la casella Z-Stack . Fare clic sul pulsante Live per visualizzare un'immagine live del ganglio di legno. Ruotare la manopola del piano focale verso l'alto fino a quando non è visibile solo un piccolo arco di neuroni.
- In Parametri di acquisizione, fare clic sulla scheda Z-Stack > sul pulsante Imposta ultimo . Ruotare la manopola del piano focale verso il basso fino a quando non è visibile solo un piccolo arco di neuroni. In Parametri di acquisizione, fare clic sulla scheda Z-Stack > sul pulsante Imposta primo . Fare clic sul pulsante Live per disattivare l'immagine live.
- In Parametri di acquisizione, fare clic sulla scheda Z-Stack . Compila il campo Sezioni con 6. Questo imposterà 6 fette ottiche e determinerà automaticamente la profondità del voxel.
- Nella scheda Acquisizione , verificare che la casella Serie temporali sia deselezionata (nessuna serie temporale).
- Impostare la velocità e la direzione della scansione. In Parametri di acquisizione, fare clic sulla scheda Modalità di acquisizione > Predefiniti di > fotogramma > 1024 x 1024. Selezionare la scheda Modalità acquisizione > Fotogramma > direzione > freccia a punta doppia per la scansione bidirezionale. Selezionare la scheda Modalità di acquisizione > Cursore Velocità di scansione > fotogrammi > 6.
- Se le cellule sono etichettate con td-Tomato, impostare il microscopio per scansionare il canale rosso 592 nm eccitazione / 614 nm emissione, lunghezza d'onda di rilevamento 600-700 nm oltre al canale verde. Impostalo andando su Parametri di acquisizione e fai clic sulla scheda Canali > casella Traccia1 . Utilizzare il menu a discesa accanto alla casella Traccia1 per selezionare Rosso (rosso Texas). Seguire la stessa procedura del passaggio 2.6.3, tranne fare clic sulla casella 561 anziché sulla casella 488 . Impostare la potenza laser all'1 %. Td-Tomato è molto più luminoso di GCaMP3 e richiede una potenza laser inferiore.
- Crea un'immagine ad alta risoluzione del DRG facendo clic sul pulsante Avvia esperimento nella scheda Acquisizione .
- Caricare il protocollo di scansione rapida del microscopio (vedere il passaggio 2.4). Registrare l'attività spontanea nel DRG per 80 cicli (circa 10 minuti). Generare un filmato di proiezione ortogonale e verificare che l'immagine sia di qualità sufficiente per l'analisi.
NOTA: le considerazioni sulla qualità sono le stesse del passaggio 2.5. - Per applicare stimoli, impostare il microscopio per eseguire 15-20 scansioni. Attendere il completamento delle scansioni da 1 a 5 per produrre la linea di base. Applicare lo stimolo durante le scansioni 6-10. Attendere almeno 5 minuti dopo ogni stimolo prima di applicare lo stimolo successivo per prevenire la desensibilizzazione.
NOTA: Gli stimoli meccanici devono essere applicati prima, e poi gli stimoli freddi, termici e chimici. Gli stimoli più deboli (ad esempio, bassa forza meccanica, temperature più vicine alla temperatura ambiente) dovrebbero essere applicati prima di stimoli più forti (ad esempio, forza meccanica più elevata, temperature più lontane dalla temperatura ambiente). Quando si applicano stimoli, assicurarsi di non causare alcun movimento del DRG. Per stimoli termici forti, in particolare, è spesso necessario applicare isoflurano al 2% per 1-2 minuti prima di iniziare lo stimolo. Sul microscopio utilizzato in questo studio, ogni scansione può essere ascoltata chiaramente, in modo tale che il ricercatore possa facilmente identificare la fine della scansione, consentendo l'applicazione dello stimolo immediatamente dopo la scansione 5. Tuttavia, qualsiasi metodo che faciliti l'applicazione di stimoli in un momento coerente funzionerà. - Per una pressa meccanica, tenere il pincher dell'algometro con la zampa tra le pale senza toccare la zampa e pizzicare iniziando immediatamente dopo la fine della scansione 5 e fermandosi immediatamente dopo la scansione 10. Monitorare la forza di pressatura con un algometro (vedere Tabella dei materiali). Mantenere la forza di pressione il più vicino possibile alla forza desiderata (qui usiamo uno stimolo di pressione di 100 g) e assicurarsi che non superi i 10 g oltre la forza desiderata.
NOTA: Si possono rilevare stimoli con un minimo di 0,07 g di filamenti di von Frey e fino a 600 g di forza di pressione. - Per gli stimoli freddi e termici, raffreddare o riscaldare un becher d'acqua appena al di sotto (per il freddo) o al di sopra (per il termico) della temperatura desiderata e iniziare la scansione. Qui, utilizzare uno stimolo a 45 °C. Quando l'acqua ha la temperatura corretta, applicare lo stimolo immediatamente dopo la scansione 5 immergendo la zampa nell'acqua. Tirare via il becher immediatamente dopo la scansione 10.
NOTA: la temperatura deve essere entro 1 °C della temperatura desiderata alla scansione 5. Se la temperatura del becher non è corretta, non applicare lo stimolo perché ciò potrebbe desensibilizzare i neuroni. Invece raffreddare o riscaldare nuovamente l'acqua e riprovare. Abbiamo misurato temperature fino a 0 °C (acqua ghiacciata) e fino a 95 °C. Tuttavia, ricorda che temperature superiori a 50 ° C possono danneggiare i tessuti e confondere gli esperimenti successivi. Allo stesso modo, alcune sostanze chimiche (ad esempio tetrodotossina, capsaicina) sono irreversibili o non possono essere lavate via e possono impedire ulteriori esperimenti sull'animale. - Dopo che tutti gli stimoli sono stati applicati e registrati, eutanasia l'animale per sovradosaggio con ketamina / xilazina (200 mg / kg di ketamina, 30 mg / kg di xilazina o 5 μL per grammo di massa corporea di soluzione preparata nella fase 1.1) seguita dalla decapitazione.
3. Analisi dei dati
- Aprire i file di immagine trascinandoli in ImageJ. Dopo aver aperto il file, selezionare il tipo di immagine in Immagine > Tipo > colore RGB.
NOTA: il plug-in StackReg21 in Plug-in > StackReg è utile per correggere e allineare gli artefatti di movimento. ImageJ è in grado di leggere la maggior parte dei formati di file software per microscopi. La scelta del tipo di immagine dipende dalle preferenze dell'utente. RGB semplifica la produzione di immagini a colori per la pubblicazione. Anche i pacchetti software del produttore del microscopio o di cytoNet22 possono aiutare nell'analisi. Non è necessario scaricare, installare e utilizzare StackReg, ma è consigliato. - Utilizzare lo strumento Regione di interesse (ROI) per selezionare i neuroni attivi in Analizza > Strumento > Gestione ROI. Disegna i ROI utilizzando gli strumenti ellisse o rettangolo sulla barra degli strumenti e inseriscili nel file ROI premendo il pulsante Aggiungi sotto Aggiungi nella finestra di gestione ROI o premendo il tasto "t".
NOTA: assicurarsi di salvare frequentemente il file ROI. Gli utenti possono sempre ripristinare i ROI trascinando e rilasciando un file ROI in ImageJ e facendo clic sulla casella Mostra tutto nella parte inferiore della finestra ROI Manager. Non è consigliabile salvare come overlay. Per esperienza, il salvataggio come file ROI.zip semplifica l'analisi. - In Analizza > imposta misurazioni verificare che l'opzione del valore di grigio medio sia selezionata; deseleziona tutte le altre caselle in Imposta misure. Utilizza lo strumento multi-misura nel menu ROI manager per calcolare l'intensità all'interno dei ROI. Misura l'intensità utilizzando la finestra ROI in Altro > Multimeasure.
NOTA: A volte i neuroni adiacenti saranno troppo vicini tra loro per disegnare ROI separati. Questi neuroni non possono essere utilizzati per misurare l'intensità transitoria, ma possono essere inclusi nei conteggi dei neuroni attivanti. - Salva il file CSV generato da Multimeasure e apri il file CSV con qualsiasi software per fogli di calcolo.
NOTA: vedere il file supplementare 1 per un modello di foglio di calcolo di esempio per facilitare l'analisi. - Calcola l'intensità transitoria Ca 2+ come ΔF / F 0 = (F t- F 0) / F 0, dove Ft è l'intensità dei pixel in un ROI nel punto di interesse temporale e F 0 è l'intensità di base determinata facendo la media delle intensità dei 2-4 fotogrammi prima del transitorio Ca 2+ per l'attività spontanea o dei primi 1-5 fotogrammi del ROI per Ca 2+ transitori che si verificano durante la stimolazione. Escludere eventuali neuroni che producono picchi di Ca2+ prima dello stimolo e non analizzare l'attività dopo la fine dello stimolo.
- Per l'analisi dell'intensità transitoria Ca2+, campionare casualmente un numero approssimativamente uguale di neuroni da ciascun ganglio per evitare di distorcere i dati verso i gangli che hanno prodotto il maggior numero di neuroni rispondenti. Escludere i picchi in cui ΔF / F 0 < 0,15.
NOTA: Esistono metodi alternativi pubblicati di analisi e inclusione/esclusione dei neuroni 11,12,23,24,25,26,27,28. - Misurare i diametri dei neuroni utilizzando lo strumento linea sulla barra degli strumenti in ImageJ. Calcola il diametro medio dalle linee tracciate lungo i diametri più lunghi e più corti.
Access restricted. Please log in or start a trial to view this content.
Risultati
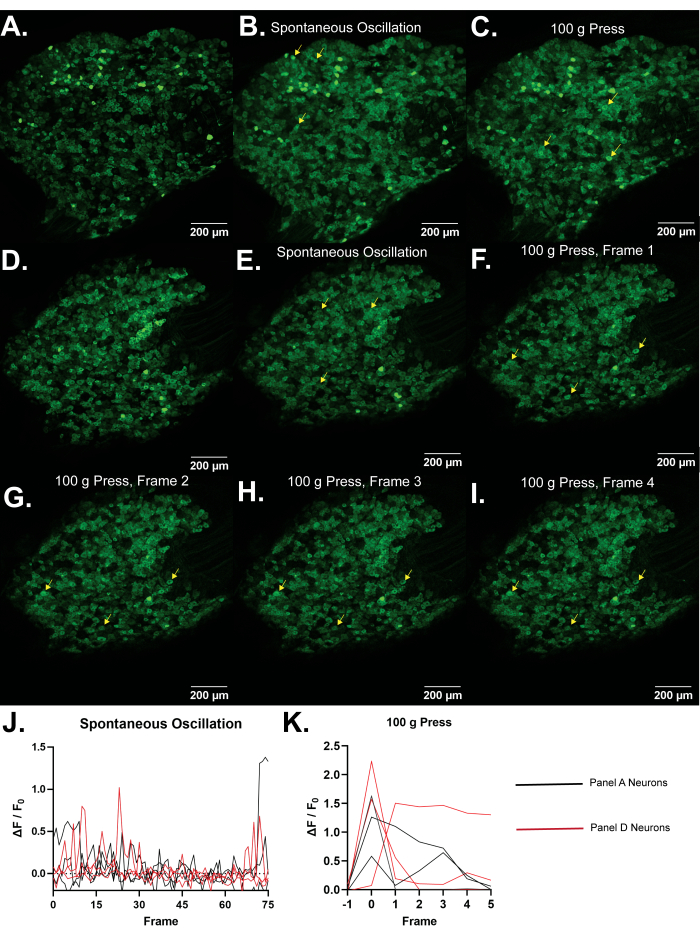
Figura 4: Immagini rappresentative dei gangli della radice dorsale L5 dei topi Pirt-GCaMP3. (A,D) Vengono mostrate scansioni ad alta risoluzione a fotogramma singolo dei gangli della radice dorsale L5 dei topi Pirt-GCaMP3. (B,E) . Proiezioni di intensità media di 15 fotogrammi di gangli Pirt-GCaMP3...
Access restricted. Please log in or start a trial to view this content.
Discussione
Il dolore persistente è presente in una vasta gamma di disturbi, debilitanti e / o riducendo la qualità della vita per circa l'8% delle persone29. I neuroni sensoriali primari rilevano stimoli nocivi sulla pelle e la loro plasticità contribuisce al dolore persistente8. Mentre i neuroni possono essere studiati in coltura cellulare ed espianti, così facendo li rimuove dal loro normale contesto fisiologico. L'esposizione chirurgica del DRG, seguita dall'imaging Pirt-GCaMP3...
Access restricted. Please log in or start a trial to view this content.
Divulgazioni
Gli autori non dichiarano interessi finanziari concorrenti.
Riconoscimenti
Questo lavoro è stato supportato dal National Institutes of Health Grants R01DE026677 e R01DE031477 (a Y.S.K.), dal fondo di avvio UTHSCSA (Y.S.K.) e da un Rising STAR Award del sistema dell'Università del Texas (Y.S.K.).
Access restricted. Please log in or start a trial to view this content.
Materiali
| Name | Company | Catalog Number | Comments |
| Anased Injection (Xylazine) | Covetrus, Akorn | 33197 | |
| C Epiplan-Apochromat 10x/0.4 DIC | Cal Zeiss | 422642-9900-000 | |
| Cotton Tipped Applicators | McKesson | 24-106-1S | |
| Curved Hemostat | Fine Science Tools | 13007-12 | |
| DC Temperature Controller | FHC | 40-90-8D | |
| DC Temperature Controller Heating Pad | FHC | 40-90-2-05 | |
| Dumont Ceramic Coated Forceps | Fine Science Tools | 11252-50 | |
| FHC DC Temperature Controller | FHC | 40-90-8D | |
| Fluriso (Isoflurane) | MWI Animal Health, Piramal Group | 501017 | |
| Friedman-Pearson Rongeurs | Fine Science Tools | 16221-14 | |
| GelFoam | Pfizer | 09-0353-01 | |
| Ketaset (Ketamine) | Zoetis | KET-00002R2 | |
| Luminescent Green Stage Tape | JSITON/ Amazon | B803YW8ZWL | |
| Matrx VIP 3000 Isoflurane Vaporizer | Midmark | 91305430 | |
| Micro dissecting scissors | Roboz | RS-5882 | |
| Micro dissecting spring scissors | Fine Science Tools | 15023-10 | |
| Micro dissecting spring scissors | Roboz | RS-5677 | |
| Mini Rectal Thermistor Probe | FHC | 40-90-5D-02 | |
| Operating scissors | Roboz | RS-6812 | |
| Pirt-GCaMP3 C57BL/6J mice | Johns Hopkins University | N/A | Either sex can be imaged equally well. Mice should be at least 8 weeks old due to weak or intermittent Pirt promoter expression in younger mice. |
| SMALGO small animal algometer | Bioseb In vivo Research Instruments | BIO-SMALGO | |
| Stereotaxic frame | Kopf Model 923-B | 923-B | |
| td-Tomato C57BL/6J mice | Jackson Laboratory | 7909 | |
| Top Plate, 6 in x 10 in | Newport | 290-TP | |
| TrpV1-Cre C57BL/6J mice | Jackson Laboratory | 17769 | |
| Zeiss LSM 800 confocal microscope | Cal Zeiss | LSM800 | |
| Zeiss Zen 2.6 Blue Edition Software | Cal Zeiss | Zen (Blue Edition) 2.6 |
Riferimenti
- Rivero-Melián, C., Grant, G. Distribution of lumbar dorsal root fibers in the lower thoracic and lumbosacral spinal cord of the rat studied with choleragenoid horseradish peroxidase conjugate. The Journal of Comparative Neurology. 299 (4), 470-481 (1990).
- Wessels, W. J., Marani, E. A rostrocaudal somatotopic organization in the brachial dorsal root ganglia of neonatal rats. Clinical Neurology and Neurosurgery. 95, 3-11 (1993).
- Schmalbruch, H. The number of neurons in dorsal root ganglia L4-L6 of the rat. The Anatomical Record. 219 (3), 315-322 (1987).
- Sørensen, B., Tandrup, T., Koltzenburg, M., Jakobsen, J. No further loss of dorsal root ganglion cells after axotomy in p75 neurotrophin receptor knockout mice. The Journal of Comparative Neurology. 459 (3), 242-250 (2003).
- Basbaum, A. I., Woolf, C. J. Pain. Current Biology. 9 (12), 429-431 (1999).
- Liu, Y., Ma, Q. Generation of somatic sensory neuron diversity and implications on sensory coding. Current Opinion in Neurobiology. 21 (1), 52-60 (2011).
- Basbaum, A. I., Bautista, D. M., Scherrer, G., Julius, D. Cellular and molecular mechanisms of pain. Cell. 139 (2), 267-284 (2009).
- Stucky, C. L., Mikesell, A. R. Cutaneous pain in disorders affecting peripheral nerves. Neuroscience Letters. 765, 136233(2021).
- Iseppon, F., Linley, J. E., Wood, J. N. Calcium imaging for analgesic drug discovery. Neurobiology of Pain. 11, 100083(2022).
- Chen, Z., et al. Adjacent intact nociceptive neurons drive the acute outburst of pain following peripheral axotomy. Scientific Reports. 9 (1), 7651(2019).
- Chisholm, K. I., Khovanov, N., Lopes, D. M., La Russa, F., McMahon, S. B. Large scale in vivo recording of sensory neuron activity with GCaMP6. eNeuro. 5 (1), (2018).
- Emery, E. C., et al. In vivo characterization of distinct modality-specific subsets of somatosensory neurons using GCaMP. Science Advances. 2 (11), 1600990(2016).
- Ishida, H., et al. In vivo calcium imaging visualizes incision-induced primary afferent sensitization and its amelioration by capsaicin pretreatment. The Journal of Neuroscience. 41 (41), 8494-8507 (2021).
- Kim, Y. S., et al. Coupled activation of primary sensory neurons contributes to chronic pain. Neuron. 91 (5), 1085-1096 (2016).
- MacDonald, D. I., et al. Silent cold-sensing neurons contribute to cold allodynia in neuropathic pain. Brain. 144 (6), 1711-1726 (2021).
- Wang, F., et al. Sensory afferents use different coding strategies for heat and cold. Cell Reports. 23 (7), 2001-2013 (2018).
- Kucharczyk, M. W., et al. The impact of bone cancer on the peripheral encoding of mechanical pressure stimuli. Pain. 161 (8), 1894-1905 (2020).
- Kim, A. Y., et al. a phosphoinositide-binding protein, functions as a regulatory subunit of TRPV1. Cell. 133 (3), 475-485 (2008).
- Kim, Y. S., et al. Central terminal sensitization of TRPV1 by descending serotonergic facilitation modulates chronic pain. Neuron. 81 (4), 873-887 (2014).
- Tian, L., et al. Imaging neural activity in worms, flies and mice with improved GCaMP calcium indicators. Nature Methods. 6 (12), 875-881 (2009).
- Thévenaz, P., Ruttimann, U. E., Unser, M. A pyramid approach to subpixel registration based on intensity. IEEE Transactions on Image Processing. 7 (1), 27-41 (1998).
- Mahadevan, A. S., et al. cytoNet: Spatiotemporal network analysis of cell communities. PLoS Computational Biology. 18 (6), 1009846(2022).
- Barretto, R. P., et al. The neural representation of taste quality at the periphery. Nature. 517 (7534), 373-376 (2015).
- Leijon, S. C. M., et al. Oral thermosensing by murine trigeminal neurons: modulation by capsaicin, menthol and mustard oil. The Journal of Physiology. 597 (7), 2045-2061 (2019).
- Sekiguchi, K. J., et al. Imaging large-scale cellular activity in spinal cord of freely behaving mice. Nature Communications. 7, 11450(2016).
- Wu, A., Dvoryanchikov, G., Pereira, E., Chaudhari, N., Roper, S. D. Breadth of tuning in taste afferent neurons varies with stimulus strength. Nature Communications. 6, 8171(2015).
- Ran, C., Hoon, M. A., Chen, X. The coding of cutaneous temperature in the spinal cord. Nature Neuroscience. 19 (9), 1201-1209 (2016).
- Yarmolinsky, D. A., et al. Coding and plasticity in the mammalian thermosensory system. Neuron. 92 (5), 1079-1092 (2016).
- Torrance, N., Smith, B. H., Bennett, M. I., Lee, A. J. The epidemiology of chronic pain of predominantly neuropathic origin. Results from a general population survey. The Journal of Pain. 7 (4), 281-289 (2006).
- Shannonhouse, J., et al. Meclizine and metabotropic glutamate receptor agonists attenuate severe pain and Ca(2+) activity of primary sensory neurons in chemotherapy-induced peripheral neuropathy. The Journal of Neuroscience. 42 (31), 6020-6037 (2022).
- Luiz, A. P., et al. Cold sensing by Na(V)1.8-positive and Na(V)1.8-negative sensory neurons. Proceedings of the National Academy of Sciences of the United States of America. 116 (9), 3811-3816 (2019).
- Hartung, J. E., Gold, M. S. GCaMP as an indirect measure of electrical activity in rat trigeminal ganglion neurons. Cell Calcium. 89, 102225(2020).
- Chung, M. K., Wang, S., Oh, S. L., Kim, Y. S. Acute and chronic pain from facial skin and oral mucosa: Unique neurobiology and challenging treatment. International Journal of Molecular Sciences. 22 (11), 5810(2021).
- Chan, S. L., Mayne, M., Holden, C. P., Geiger, J. D., Mattson, M. P. Presenilin-1 mutations increase levels of ryanodine receptors and calcium release in PC12 cells and cortical neurons. The Journal of Biological Chemistry. 275 (24), 18195-18200 (2000).
- Sierra, D. A., Popov, S., Wilkie, T. M. Regulators of G-protein signaling in receptor complexes. Trends in Cardiovascular Medicine. 10 (6), 263-268 (2000).
- Yoshihara, K., et al. Astrocytic Ca(2+) responses in the spinal dorsal horn by noxious stimuli to the skin. Journal of Pharmacological Sciences. 137 (1), 101-104 (2018).
- Tan, C. H., McNaughton, P. A. The TRPM2 ion channel is required for sensitivity to warmth. Nature. 536 (7617), 460-463 (2016).
- Akemann, W., Mutoh, H., Perron, A., Rossier, J., Knöpfel, T. Imaging brain electric signals with genetically targeted voltage-sensitive fluorescent proteins. Nature Methods. 7 (8), 643-649 (2010).
- Gong, Y., et al. High-speed recording of neural spikes in awake mice and flies with a fluorescent voltage sensor. Science. 350 (6266), 1361-1366 (2015).
- Grewe, B. F., Langer, D., Kasper, H., Kampa, B. M., Helmchen, F. High-speed in vivo calcium imaging reveals neuronal network activity with near-millisecond precision. Nature Methods. 7 (5), 399-405 (2010).
- Harada, K., et al. Red fluorescent protein-based cAMP indicator applicable to optogenetics and in vivo imaging. Scientific Reports. 7 (1), 7351(2017).
Access restricted. Please log in or start a trial to view this content.
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneEsplora altri articoli
This article has been published
Video Coming Soon