需要订阅 JoVE 才能查看此. 登录或开始免费试用。
Method Article
膜反应器中的氢气生产和利用
摘要
膜反应器可在室温条件下实现氢化,无需直接输入 H2 。我们可以使用大气质谱(atm-MS)和气相色谱质谱(GC-MS)跟踪这些系统中的氢气生产和利用。
摘要
工业加氢每年消耗~11 Mt化石衍生的H2 气体。我们小组发明了一种膜反应器,以绕过使用H2 气体进行加氢化学的需要。膜反应器从水中获取氢气,并使用可再生电力驱动反应。在该反应器中,一块薄薄的Pd将电化学制氢室与化学加氢室分开。膜反应器中的Pd充当(i)氢选择性膜,(ii)阴极和(iii)加氢催化剂。在本文中,我们报告了使用大气质谱(atm-MS)和气相色谱质谱(GC-MS)来证明在Pd膜上施加的电化学偏置可以在膜反应器中无需直接H2 输入的情况下实现高效氢化。使用atm-MS,我们测量了73%的氢渗透率,这使得苯丙酮以100%的选择性加氢为丙基苯,如GC-MS测量的那样。与传统的电化学加氢(仅限于溶解在质子电解质中的低浓度起始材料)相比,制氢与膜反应器中的利用的物理分离可以在任何溶剂或任何浓度下加氢。使用高浓度和多种溶剂对于反应器的可扩展性和未来的商业化尤为重要。
引言
热化学加氢反应用于~20%的所有化学合成1。这些反应需要大量的H2 气体,这些气体通常来自化石燃料,温度在150°C至600°C之间,压力高达200个大气压2。电化学加氢是绕过这些要求并使用水和可再生电力驱动氢化反应的一种有吸引力的方法3.对于常规电化学加氢,将不饱和原料溶解在电化学电池中的质子电解质中。当对电池施加电位时,阳极发生水氧化,而阴极发生氢化。在该反应装置中,电化学水氧化和化学氢化都发生在同一反应环境中。有机底物溶解在质子电解质中,以实现原料的电化学水分解和氢化。当反应物易受亲核攻击或反应物浓度过高(>0.25 M)4时,这些反应的接近会导致副产物形成和电极结垢。
这些挑战促使我们小组探索电化学驱动氢化反应的替代方法5,6,7。这种搜索导致使用了Pd膜,该膜通常用于氢气分离8。我们将其用作电化学反应器侧水电解的电极。钯膜的这种新应用能够将电化学水氧化位点与化学氢化位点物理分离。由此产生的反应器配置有两个隔间:1)用于制氢的电化学隔间;2)用于氢化的化学隔室(图1)。通过在Pt阳极和Pd膜(也用作阴极)上施加电势,在电化学室中产生质子。然后这些质子迁移到Pd膜,在那里它们被还原成表面吸附的氢原子。电化学室可以细分为包括可选的阳离子交换膜以促进这种质子迁移。表面吸附的氢原子通过Pd fcc晶格9的间隙八面体位点渗透,并在加氢室中膜的另一面出现,在那里它们与给定原料的不饱和键反应形成氢化产物7,10,11,12,13,14,15,16.因此,膜反应器中的Pd充当(i)氢选择性膜,(ii)阴极和(iii)加氢催化剂。
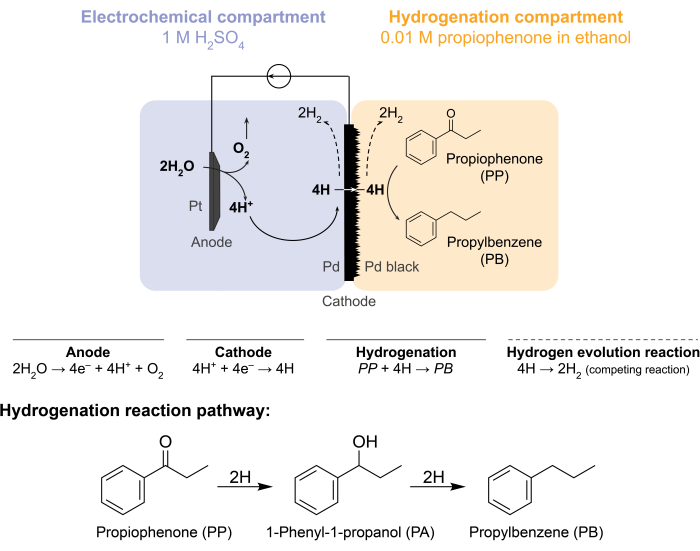
图1:膜反应器中的氢化。 阳极的水氧化产生质子,质子在钯阴极上被还原。H渗透通过Pd膜并与苯丙酮反应生成丙苯。析氢是一种竞争反应,可能发生在钯膜的两侧。对于大气质谱法,不使用化学原料,因此H需要以H2 气体的形式离开反应器,无论是在电化学室还是加氢室中。 请点击此处查看此图的大图。
膜反应器通过将Pd膜夹在电化学H-cell12的阳极和阴极室之间来组装。耐化学腐蚀的O形圈用于将膜固定到位并确保无泄漏密封。膜反应器的电化学室含有富氢水溶液。在这项研究中,我们使用 1 M H 2 SO4 和一个阳极,该阳极由包裹在 5 cm2铂网中的铂丝组成。阳极通过电化学室顶部的孔浸没在电解质溶液中。化学加氢室包含溶剂和加氢原料7,10,11,12,16,17。H细胞隔室顶部的孔用于采样。此处显示的实验使用0.01M苯丙酮乙醇溶液作为加氢进料。然而,起始材料(和浓度)可以改变以适应实验需求。例如,含有长烃链和炔基官能团的起始材料可以溶解在戊烷中以提高溶解度11。反应的施加电流可以在5 mA/cm 2和300 mA/cm2之间。所有反应均在环境温度和压力下进行。
大气质谱(atm-MS)用于测量渗透到加氢室11,12的电化学室中的氢百分比。这种测量对于了解膜反应器所需的能量输入非常重要,因为它揭示了最大可能的氢气利用率(即,产生的氢气中有多少实际上可用于氢化反应)。通过测量从电化学室和氢化室11,12逸出的H2的量来计算通过Pd膜的氢渗透。100%的渗透值意味着电化学室中产生的所有氢气通过Pd膜输送到加氢室,然后结合形成氢气。<100%的渗透值意味着在渗透通过膜之前,在电化学室中发生析氢。当H2从电化学室或氢化室产生时,它进入仪器并被电离为H2+。四极杆选择m / z = +2的碎片,并由探测器测量相应的电荷。通过该技术获得的图是离子电荷随时间的变化。首先测量加氢室的离子电荷,当信号稳定时,改变通道以测量电化学室。氢渗透的计算方法是将加氢室中的平均离子电荷除以反应器中测量的总离子电荷(公式1)11,12。为了计算氢气渗透,使用atm-MS分别测量来自氢化和电化学室的H2。
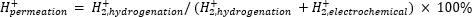 (公式1)
(公式1)
气相色谱质谱(GC-MS)用于监测加氢反应的进度12,14,15,16。为了收集示例的数据,反应器的加氢室充满0.01M苯丙酮的乙醇溶液。通过在铂阳极和钯阴极上施加电位,将活性氢供应到加氢室。然后,反应性氢原子将不饱和原料氢化,并使用GC-MS对产物进行定量,其中样品被碎片化和电离。通过分析这些片段的质量,可以确定加氢溶液的组成,并且可以计算反应速率12,14,15,16。
研究方案
1. 钯轧制
- 用棉布用己烷混合物清洁钯威化棒。
注意:己烷易燃,对健康有害,刺激物,对环境有害。在适当的通风下工作(即,呼吸管或通风橱)。 - 使用手动辊滚动Pd晶圆,直到达到≤150μm的厚度,由数字千分尺确定。
- 使用自动辊将 Pd 轧制成 25 μm 的厚度,由数字千分尺确定。然后,将所得的Pd切割成所需的尺寸(例如,3.5厘米x 3.5厘米)。
2. 钯退火
- 将轧制的Pd箔装入N2 气氛的马弗炉中。
- 从25°C开始加热Pd箔,并以60°C / h的速度将温度升至850°C。将温度保持在850°C1.5小时,然后以60°C / h的速度将烤箱冷却至室温。
3. 钯清洗
- 通过混合 10 mL 硝酸、20 mL 30% (v/v) 过氧化氢和 10 mL 去离子水制备清洁溶液。
注意:硝酸具有腐蚀性、氧化剂和毒性。过氧化氢具有腐蚀性、氧化剂和有害性。 - 将退火的Pd箔浸入清洁溶液中,直到剧烈冒泡消退或溶液变黄(20-30分钟)。
- 用去离子水冲洗两次,用异丙醇冲洗一次,然后用空气干燥。
4. 反应器组件(图2,从左到右)
- 通过将Pd膜夹在电化学H电池的两半之间来组装反应器。
- 在电池的左侧和Pd膜之间放置一个耐化学腐蚀的垫圈。
- 在Pd膜和电化学电池的右侧之间放置一个额外的耐化学腐蚀垫圈。
- 用夹子密封生成的单元配置。
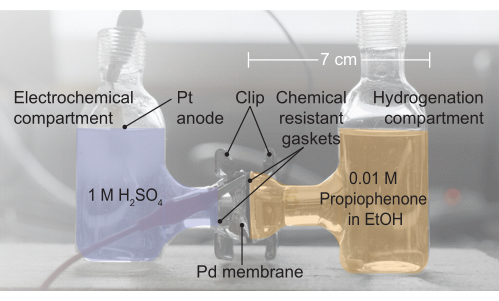
图 2:H 细胞组件的图像。电化学室包含 1 M H2SO4 电解质;这是水氧化发生的地方。钯膜将H电池的两半分开,垫圈提供无泄漏密封。氢化室含有0.01M苯丙酮乙醇(EtOH)。请点击此处查看此图的大图。
5. 钯电沉积
- 通过将PdCl2 溶解到1M HCl中以达到15.9mM的浓度来制备电镀溶液。
注意:氯化钯2有害且具有腐蚀性。盐酸具有腐蚀性和刺激性。 - 使用步骤3中的清洁Pd箔组装反应器。
- 用24mL制备的电镀溶液填充反应器的电化学室,并将加氢室留空。
- 将Pt网状阳极和Ag/AgCl参比电极放入电化学室的溶液中。
- 将电极连接到恒电位仪,并在Pd箔上施加-0.2 V相对于Ag/AgCl的电位,直到15 C的电荷通过。
- 拆卸反应器,用去离子水冲洗所得的Pd膜两次,用异丙醇冲洗一次,然后在气流或N2下干燥膜。Pd膜现在将在暴露于电镀溶液的表面上沉积出可见的Pd黑色。
6. ATM-MS反应器设置
- 按照步骤4中的指示组装反应器。用1M H2SO4填充电化学室,并用乙醇填充加氢室。不要添加加氢原料。
注意:H2SO4 是有害和腐蚀性的。乙醇易燃、有害且危害健康。 - 将铂对电极浸入电解质中。使用鳄鱼夹将铂对电极和钯膜连接到电源。连接Pt对电极作为正极,Pd膜作为负极。
- 施加 25 mA 的恒定电流。
7. 自动取款机-质谱仪器设置
- 打开 ATM-MS 装置背面电源线正下方的电源开关。
- 按下前面的泵按钮打开泵(打开时会亮起蓝色)。然后,打开烘烤夹克(绿色圆形开关,灯会亮起)。
- 打开要使用的毛细管通道(通道旁边的红色圆形开关,灯亮起)。通过感觉管子被加热来检查使用的通道是否已打开。
注意:"vac ok"旁边的绿色 LED 将在打开泵后的几分钟内亮起。要在完成实验后关闭系统,请关闭所有已打开的开关。 - 将氢化池出口连接到 atm-MS 毛细管。此连接必须是气密的。
8. 自动取款机软件设置
- 单击 服务 桌面快捷方式。转到 "设置"|"SEM/排放控制,并选中 SEM 和排放框。按"确定"。关闭服务窗口。
- 单击" 度量 "快捷方式,然后转到 "序列 |执行。
- 填写以下参数:测量值 = 30,清除时间 = 30 秒。按 文件管理器,然后创建一个文件夹以保存输出数据。这些设置将进行 30 次测量,每个测量集之间的清除时间为 30 秒;如果需要,可以更改此设置。
- 然后,MID 测量文件将打开。选择 "文件管理",然后打开一个程序以测量 m/z = 2 的质谱信号。该信号对应于来自H2+的离子电流,氢气的电离形式。
- 按 "确定" 启动程序。请勿关闭测量窗口,因为这会停止仪器运行。
- 信号稳定(1-3小时)后,断开atm-MS毛细管与加氢室的连接,并将其连接到电化学室。
- 保存数据,并在电化学室的信号稳定(约30分钟)时终止实验。
- 使用 公式1计算氢气通过Pd膜的百分比。
9. 电化学加氢
- 按照步骤4组装反应器。
- 用 24 mL 的 1 M H2SO4 填充电化学隔室。
- 通过对电极开口将Pt对电极插入电化学室。将铂对电极连接到电源的正极端子,并通过铜带 将 Pd膜连接到负极端子。
- 在电池上施加25mA(相当于40mA /cm 2)的恒电流15分钟。电压读数在 3 V 和 5 V 之间。
- 15分钟后,用24mL反应溶液(例如,0.01M苯丙酮乙醇溶液)填充化学隔室。在反应物添加过程中保持恒电流。
注意:在将初始反应溶液添加到反应器之前对其进行采样。请参阅步骤 9.6。
注意:苯丙酮是有害的。 - 使用微量移液管从化学室中取出 30 μL 反应溶液并将样品溶解在 1 mL 二氯甲烷中,定期(例如每 15 分钟)对化学室进行采样。将样品储存在GC-MS样品瓶中,直到反应完成。
注意:二氯甲烷有害且危害健康。
10. 气相色谱-质谱联用
- 将样品瓶装入自动取样托盘。
- 通过单击绿色的 Masshunter 图标启动GC-MS软件。
- 点击 序列 |编辑序列以打开序列 编辑窗口。在图表中填写所需的样品名称、样品瓶(在自动进样托盘中的位置)、方法路径、方法文件、数据路径和数据文件。将样品类型设置为"sample",将稀释度设置为1,并确保数据文件与样品名称匹配。
- 通过单击" 方法"|"编辑整个方法。
- 确保同时检查方法信息和仪器采集。单击确定。添加方法注释(如果需要)。
- 确保检查 数据采集 和 数据分析 。将其他所有字段留空。单击 确定。
- 确保样品入口设置为 GC,进样源设置为 GC ALS。选中使用 MS 框。确保入口位置设置为"前端",并且 MS 已连接到"前端"。单击确定。
- 在 入口 选项卡下,确保加热器温度设置为 250 °C。 将压力设置为 7.2 psi,将 He 流量设置为 23.1 mL/min。
- 在 烤箱 选项卡下,将初始温度设置为 50 °C,并保持 1 分钟。接下来,将升温速率设置为25°C / min,温度设置为200°C,并保持0分钟。单击 确定。
- 确保未检查任何显示信号。单击 确定。
- 将溶剂延迟设置为 2.50 分钟。单击 确定。
- 确保所选监视器包括以下内容:气相色谱炉温度、气相色谱入口 F 温度、气相色谱入口 F 压力、气相色谱柱 2 流量计算、MS EM 伏特、MS MS 源、MS MS 四边形。单击 确定。
- 将方法保存在所需的方法名称下。
- 通过单击序列 |开始顺序 |运行序列。
- 序列完成后,通过打开 Masshunter 软件并单击在步骤 10.3 中编程的文件名来查看数据。
- 通过单击 频谱 |将 采集的质谱图与NIST数据库进行比较的文库检索报告。
- 使用公式2计算起始材料和产物的相对组成。
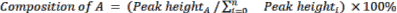 (公式2)
(公式2)
其中 A 是感兴趣的化学成分, n 是GC-MS测量的组分数。示例如下: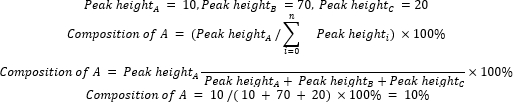
结果
ATM-MS用于测量膜反应器中产生的氢气的离子电流。我们可以使用这些测量来量化电解过程中有多少氢气渗透到Pd膜中。首先,测量从加氢室逸出的氢气(图3,虚线左侧)。当信号达到稳定状态时,通道切换到电化学室。然后测量从电化学室逸出的H2 气体,直到信号稳定(图3,虚线右侧)。总氢气渗透的计算方法是将加氢侧的平均电流除以总平?...
讨论
Pd膜可实现氢气渗透和化学氢化。因此,该膜的制备对膜反应器的功效非常重要。对Pd膜尺寸、晶体学和表面进行了调整,以改善实验结果。虽然Pd金属可以在任何厚度下释放氢,但Pd膜被轧制到25μm。膜厚度的这种标准化确保了氢气渗透到膜中所需的时间在所有实验中都是恒定的。此外,膜越薄,越容易形成针孔。钯膜被切割成比用于将其固定到位的垫圈尺寸大 30%-40%。在多次使用中,Pd膜通过针?...
披露声明
基于本作品中描述的技术的专利申请已经提交并公布:Berlinguette,C.P.;Sherbo,R.S."执行化学和电化学反应的方法和装置",美国专利申请第16964944号(PCT于2019年1月提交,2020年7月进入国家),公开号US20210040017A1(2021年2月公布)。加拿大专利申请号3089508(PCT于2019年1月提交,2020年7月进入国家),公开号CA3089508(2019年8月公布)。优先权数据:美国临时专利申请号62/622,305(2018年1月提交)。
致谢
我们感谢加拿大自然科学和工程研究理事会(RGPIN-2018-06748)、加拿大创新基金会(229288)、加拿大高级研究所(BSE-BERL-162173)和加拿大研究主席的财政支持。这项研究的部分原因是加拿大第一研究卓越基金,量子材料和未来技术计划的资助。我们感谢UBC共享仪器设施的Ben Herring在GC-MS仪器和方法开发方面的帮助。我们感谢Monika Stolar博士为本手稿的开发和编辑所做的贡献。最后,我们感谢不列颠哥伦比亚大学的整个Berlinguette小组在研究膜反应器方面的持续支持与合作。
材料
| Name | Company | Catalog Number | Comments |
| Ag/AgCl Reference Electrode | BASi research products | MW-2021 | Reference electrode |
| Analytical Balance | Cole-Parmer | RK-11219-03 | Instrument |
| Atmospheric Mass Spectrometer | ESS CatalySys | NA | Instrument |
| Bench Power Supply | Newark | 1550 | Instrument |
| Conductive Copper Foil Electrical Tape | McMaster Carr | 76555A711 | Electrochemical cell assembly |
| Dichloromethane | Sigma Aldrich | 270997 | Reagent |
| Electric Rolling Press with Dual Micrometer | MTI Corporation | MR100A | Equipment |
| Electrochemical glass H-cell | University of British Columbia glass blowing | NA | Electrochemical cell assembly |
| ESS catalysis QUADSTAR | ESS CatalySys | NA | Software |
| Ethanol | Sigma Aldrich | 493511 | Reagent |
| Flat Rolling Mill | Pepetolls | 18700A | Equipment |
| Gas Chromatography Mass Spectrometer | Agilent | NA | Instrument |
| GC-MS vial | Agilent | 5067-0205 | Vial for GC-MS |
| Hexanes | Sigma Aldrich | 1.0706 | Reagent |
| Hydrochloric Acid | Sigma Aldrich | 258148 | Reagent |
| Hydrogen peroxide solution (30% v/v) | Sigma Aldrich | H1009 | Reagent |
| Isopropyl Alcohol | Sigma Aldrich | W292907 | Reagent |
| Masshunter Aquisition Software | Agilent | G1617FA | Software |
| Micropipette (100 µL - 1000 µL) | Gilson | F123602 | instrument |
| Micropipette (20 µL - 200 µL) | Gilson | F123601 | Instrument |
| Mitutoyo Digital Micrometer | Uline | H-2780 | Instrument |
| Muffle Furnace | MTI Corporation | KSL-1100X | Equipment |
| Nitric acid | Sigma Aldrich | 438073 | Reagent |
| Nitrogen gas | Sigma Aldrich | 608661 | Reagent |
| Palladium (II) Chloride | Sigma Aldrich | 520659 | Reagent |
| Pd wafer bar, 1 oz, 99.95% | Silver Gold Bull. | NA | Reagent |
| Platinum Auxiliary Electrode | BASi research products | MW-1032 | Anode |
| Potentiostat | Metrohm | PGSTAT302N | Instrument |
| Propiophenone | Sigma Aldrich | P51605 | Reagent |
| Proton Exchange Membrane, Nafion 212 | Fuel cell store | NA | Electrochemical cell assembly |
| Sulfuric acid | Sigma Aldrich | 258105 | Reagent |
参考文献
- Rytter, E., Hillestad, M., Austbø, B., Lamb, J. J., Sarker, S., Lamb, J. J., Pollet, B. G. Chapter six - Thermochemical production of fuels. Hydrogen, Biomass and Bioenergy. , 89-117 (2020).
- Arpe, H. -. J. . Industrial Organic Chemistry. , (2017).
- Orella, M. J., Román-Leshkov, Y., Brushett, F. R. Emerging opportunities for electrochemical processing to enable sustainable chemical manufacturing. Current Opinion in Chemical Engineering. 20, 159-167 (2018).
- May, A. S., Biddinger, E. J. Strategies to control electrochemical hydrogenation and hydrogenolysis of furfural and minimize undesired side reactions. ACS Catalysis. 10 (5), 3212-3221 (2020).
- Tang, B. Y., Bisbey, R. P., Lodaya, K. M., Toh, W. L., Surendranath, Y. Reaction environment impacts charge transfer but not chemical reaction steps in hydrogen evolution catalysis. ChemRxiv. , (2022).
- Iwakura, C., Yoshida, Y., Inoue, H. A new hydrogenation system of 4-methylstyrene using a palladinized palladium sheet electrode. Journal of Electroanalytical Chemistry. 431 (1), 43-45 (1997).
- Inoue, H., Abe, T., Iwakura, C. Successive hydrogenation of styrene at a palladium sheet electrode combined with electrochemical supply of hydrogen. Chemical Communications. , 55-56 (1996).
- Conde, J. J., Maroño, M., Sánchez-Hervás, J. M. Pd-based membranes for hydrogen separation: Review of alloying elements and their influence on membrane properties. Separation and Purification Reviews. 46 (2), 152-177 (2017).
- Wicke, E., Brodowsky, H., Züchner, H., Alefeld, G., VÖlkl, J. Hydrogen in palladium and palladium alloys. Hydrogen in Metals II. Topics in Applied Physics., edited by Alefeld, G., Völkl, J. 29, (1978).
- Sato, T., Sato, S., Itoh, N. Using a hydrogen-permeable palladium membrane electrode to produce hydrogen from water and hydrogenate toluene. International Journal Hydrogen Energy. 41 (12), 5419-5427 (2016).
- Sherbo, R. S., Delima, R. S., Chiykowski, V. A., MacLeod, B. P., Berlinguette, C. P. Complete electron economy by pairing electrolysis with hydrogenation. Nature Catalysis. 1, 501-507 (2018).
- Sherbo, R. S., Kurimoto, A., Brown, C. M., Berlinguette, C. P. Efficient electrocatalytic hydrogenation with a palladium membrane reactor. Journal of American Chemical Society. 141 (19), 7815-7821 (2019).
- Kurimoto, A., Sherbo, R. S., Cao, Y., Loo, N. W. X., Berlinguette, C. P. Electrolytic deuteration of unsaturated bonds without using D2. Nature Catalysis. 3, 719-726 (2020).
- Jansonius, R. P., et al. Hydrogenation without H2 using a palladium membrane flow cell. Cell Reports Physical Science. 1 (7), 100105 (2020).
- Huang, A., et al. Electrolysis can be used to resolve hydrogenation pathways at palladium surfaces in a membrane reactor. Journal of American Chemical Society Au. 1 (3), 336-343 (2021).
- Delima, R. S., et al. Selective hydrogenation of furfural using a membrane reactor. Energy and Environmental Science. 15 (1), 215-224 (2021).
- Sato, T., Takada, A., Itoh, N. Low-temperature hydrogenation of toluene by electrolysis of water with hydrogen permeable palladium membrane electrode. Chemistry Letters. 46 (4), 477-480 (2017).
- Maoka, T., Enyo, M. Overpotential decay transients and the reaction mechanism on the Pd-H2 electrode. Surface Technology. 8 (5), 441-450 (1979).
- Kurimoto, A., et al. Physical separation of H2 activation from hydrogenation chemistry reveals the specific role of secondary metal catalysts. Angewandte Chemie International Edition. 60 (21), 11937-11942 (2021).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。