È necessario avere un abbonamento a JoVE per visualizzare questo. Accedi o inizia la tua prova gratuita.
Method Article
Produzione e utilizzo dell'idrogeno in un reattore a membrana
* Questi autori hanno contribuito in egual misura
In questo articolo
Riepilogo
I reattori a membrana consentono l'idrogenazione in condizioni ambientali senza ingresso diretto di H2 . Possiamo monitorare la produzione e l'utilizzo dell'idrogeno in questi sistemi utilizzando la spettrometria di massa atmosferica (atm-MS) e la spettrometria di massa gascromatografica (GC-MS).
Abstract
L'idrogenazione industriale consuma ~ 11 Mt di gas H2 di origine fossile all'anno. Il nostro gruppo ha inventato un reattore a membrana per aggirare la necessità di utilizzare il gas H2 per la chimica dell'idrogenazione. Il reattore a membrana fornisce idrogeno dall'acqua e guida le reazioni utilizzando elettricità rinnovabile. In questo reattore, un sottile pezzo di Pd separa un compartimento elettrochimico di produzione di idrogeno da un compartimento di idrogenazione chimica. Il Pd nel reattore a membrana agisce come (i) una membrana selettiva per l'idrogeno, (ii) un catodo e (iii) un catalizzatore per l'idrogenazione. Qui, riportiamo l'uso della spettrometria di massa atmosferica (atm-MS) e della spettrometria di massa gascromatografica (GC-MS) per dimostrare che una polarizzazione elettrochimica applicata attraverso una membrana Pd consente un'idrogenazione efficiente senza input diretto di H2 in un reattore a membrana. Con atm-MS, abbiamo misurato una permeazione dell'idrogeno del 73%, che ha permesso l'idrogenazione del propiofenone a propilbenzene con una selettività del 100%, misurata da GC-MS. A differenza dell'idrogenazione elettrochimica convenzionale, che è limitata a basse concentrazioni di materiale di partenza disciolto in un elettrolita protico, la separazione fisica della produzione di idrogeno dall'utilizzo nel reattore a membrana consente l'idrogenazione in qualsiasi solvente o a qualsiasi concentrazione. L'uso di alte concentrazioni e di un'ampia gamma di solventi è particolarmente importante per la scalabilità del reattore e la futura commercializzazione.
Introduzione
Le reazioni di idrogenazione termochimica sono utilizzate in ~ 20% di tutta la sintesi chimica1. Queste reazioni richiedono grandi quantità di gas H 2, che di solito derivano da combustibili fossili, temperature comprese tra 150 °C e 600 °C e pressioni fino a 200 atm2. L'idrogenazione elettrochimica è un modo interessante per aggirare questi requisiti e guidare le reazioni di idrogenazione utilizzando acqua ed elettricità rinnovabile3. Per l'idrogenazione elettrochimica convenzionale, una materia prima insatura viene disciolta in un elettrolita protico in una cella elettrochimica. Quando un potenziale viene applicato alla cella, l'ossidazione dell'acqua si verifica all'anodo, mentre l'idrogenazione avviene al catodo. In questa configurazione di reazione, sia l'ossidazione elettrochimica dell'acqua che l'idrogenazione chimica avvengono nello stesso ambiente di reazione. Il substrato organico viene sciolto in un elettrolita protico per consentire sia la scissione elettrochimica dell'acqua che l'idrogenazione della materia prima. La vicinanza di queste reazioni può portare alla formazione di sottoprodotti e all'incrostazione degli elettrodi quando il reagente è suscettibile all'attacco nucleofilo o se la concentrazione del reagente è troppo elevata (>0,25 M)4.
Queste sfide hanno spinto il nostro gruppo a esplorare modi alternativi per guidare elettrochimicamente le reazioni di idrogenazione 5,6,7. Questa ricerca ha portato all'uso di una membrana Pd, che è convenzionalmente utilizzata nella separazione dell'idrogeno gassoso8. Lo usiamo come elettrodo per l'elettrolisi dell'acqua sul lato del reattore elettrochimico. Questa nuova applicazione di una membrana di palladio consente la separazione fisica del sito di ossidazione elettrochimica dell'acqua dal sito di idrogenazione chimica. La configurazione del reattore risultante ha due compartimenti: 1) un compartimento elettrochimico per la produzione di idrogeno; e 2) un compartimento chimico per l'idrogenazione (Figura 1). I protoni vengono generati nel compartimento elettrochimico applicando un potenziale attraverso l'anodo Pt e la membrana Pd, che funge anche da catodo. Questi protoni migrano poi verso la membrana Pd, dove vengono ridotti ad atomi di idrogeno adsorbiti in superficie. Il compartimento elettrochimico può essere suddiviso per includere una membrana opzionale a scambio cationico per facilitare questa migrazione protonica. Gli atomi di idrogeno adsorbiti in superficie permeano attraverso i siti ottaedrici interstiziali del reticolo Pd fcc9 ed emergono sulla faccia opposta della membrana nel compartimento di idrogenazione, dove reagiscono con i legami insaturi di una data materia prima per formare prodotti idrogenati 7,10,11,12,13,14,15,16. Il Pd nel reattore a membrana, quindi, agisce come (i) una membrana selettiva per l'idrogeno, (ii) un catodo e (iii) un catalizzatore per l'idrogenazione.
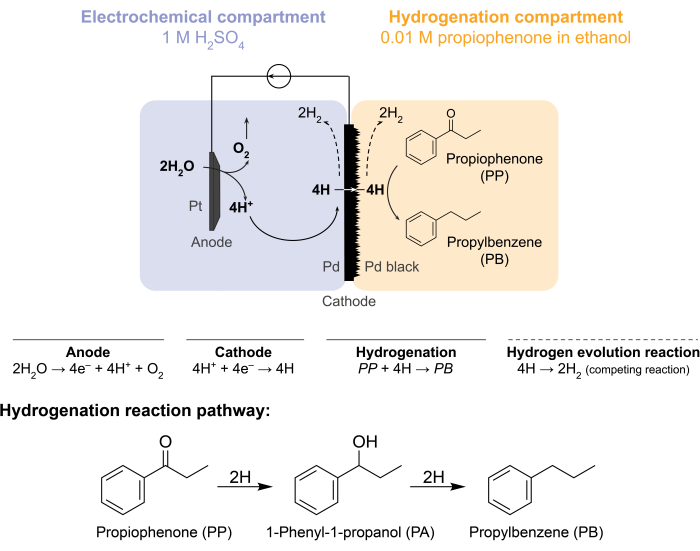
Figura 1: Idrogenazione in un reattore a membrana. L'ossidazione dell'acqua all'anodo produce protoni, che vengono ridotti sul catodo di palladio. H permea attraverso la membrana Pd e reagisce con propiofenone per formare propilbenzene. L'evoluzione dell'idrogeno è una reazione concorrente che può verificarsi su entrambi i lati della membrana del palladio. Per la spettrometria di massa atmosferica, non viene utilizzata alcuna materia prima chimica, rendendo necessario che H lasci il reattore sotto forma di gas H2 nei compartimenti elettrochimici o di idrogenazione. Fare clic qui per visualizzare una versione ingrandita di questa figura.
Il reattore a membrana viene assemblato inserendo una membrana Pd tra i compartimenti anodico e catodico di una cella H elettrochimica12. Gli O-ring resistenti agli agenti chimici vengono utilizzati per fissare la membrana in posizione e garantire una tenuta senza perdite. Il compartimento elettrochimico del reattore a membrana contiene una soluzione acquosa ricca di idrogeno. In questo studio, utilizziamo 1 M H 2 SO4 e un anodo costituito da un filo di Pt avvolto in un pezzo di rete di platino da 5 cm2. L'anodo è immerso nella soluzione elettrolitica attraverso un foro nella parte superiore del compartimento elettrochimico. Il compartimento di idrogenazione chimica contiene una materia prima solvente e idrogenazione 7,10,11,12,16,17. Il foro nella parte superiore del compartimento delle celle H viene utilizzato per il campionamento. Gli esperimenti mostrati qui utilizzano 0,01 M propiofenone in etanolo come mangime di idrogenazione. Tuttavia, il materiale di partenza (e la concentrazione) possono essere variati per soddisfare le esigenze sperimentali. Ad esempio, un materiale di partenza che contiene una lunga catena idrocarburica e un gruppo funzionale alchino può essere sciolto nel pentano per migliorare la solubilità11. La corrente applicata per la reazione può essere compresa tra 5 mA/cm 2 e 300 mA/cm2. Tutte le reazioni vengono eseguite a temperatura e pressione ambiente.
La spettrometria di massa atmosferica (atm-MS) viene utilizzata per misurare la percentuale di idrogeno nel compartimento elettrochimico che permea il compartimento di idrogenazione11,12. Questa misurazione è importante per comprendere gli input di energia richiesti per il reattore a membrana, perché rivela il massimo utilizzo possibile di idrogeno (cioè, quanto dell'idrogeno prodotto può essere effettivamente utilizzato per le reazioni di idrogenazione). La permeazione dell'idrogeno attraverso la membrana Pd viene calcolata misurando la quantità di H2 che evolve sia dal compartimento elettrochimico che da quello di idrogenazione11,12. Un valore di permeazione del 100% significa che tutto l'idrogeno prodotto nel compartimento elettrochimico viene trasportato attraverso la membrana Pd al compartimento di idrogenazione e successivamente si combina per formare idrogeno gassoso. Un valore di permeazione del <100% significa che l'evoluzione dell'idrogeno avviene nel compartimento elettrochimico prima di permeare attraverso la membrana. Poiché H2 viene prodotto dal compartimento elettrochimico o di idrogenazione, entra nello strumento e viene ionizzato in H2+. Il quadrupolo seleziona frammenti di m/z = +2 e la carica corrispondente viene misurata dal rivelatore. La trama ottenuta con questa tecnica è la carica ionica nel tempo. La carica ionica viene misurata prima per il compartimento di idrogenazione e, quando il segnale si stabilizza, i canali vengono modificati per misurare il compartimento elettrochimico. La permeazione dell'idrogeno è calcolata dividendo la carica ionica media nel compartimento di idrogenazione per la carica ionica totale misurata nel reattore (equazione 1)11,12. Per calcolare la permeazione dell'idrogeno, H2 dai compartimenti idrogenazione ed elettrochimici viene misurato separatamente utilizzando atm-MS.
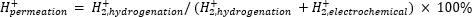 (Eq. 1)
(Eq. 1)
La spettrometria di massa gascromatografica (GC-MS) viene utilizzata per monitorare l'andamento della reazione di idrogenazione12,14,15,16. Per raccogliere dati per l'esempio, il compartimento di idrogenazione del reattore è riempito con 0,01 M propiofenone in etanolo. Applicando un potenziale attraverso l'anodo Pt e il catodo Pd, l'idrogeno reattivo viene fornito al compartimento di idrogenazione. Gli atomi di idrogeno reattivi idrogenano quindi la materia prima insatura e i prodotti vengono quantificati utilizzando GC-MS, dove il campione viene frammentato e ionizzato. Analizzando la massa di questi frammenti, è possibile determinare la composizione della soluzione di idrogenazione e calcolare le velocità di reazione 12,14,15,16.
Protocollo
1. Laminazione Pd
- Pulire la barra wafer Pd con una miscela di esani usando un panno di cotone.
ATTENZIONE: L'esano è infiammabile, pericoloso per la salute, irritante e dannoso per l'ambiente. Lavorare sotto un'adeguata ventilazione (ad esempio, un boccaglio o una cappa aspirante). - Arrotolare il wafer Pd utilizzando un rullo manuale fino a raggiungere uno spessore di ≤150 μm, come determinato da un micrometro digitale.
- Arrotolare il Pd utilizzando un rullo automatico ad uno spessore di 25 μm, come determinato da un micrometro digitale. Quindi, tagliare il Pd risultante nelle dimensioni desiderate (ad esempio, 3,5 cm x 3,5 cm).
2. Ricottura Pd
- Caricare le pellicole Pd laminate in un forno a muffola con atmosfera N2 .
- Riscaldare le pellicole Pd a partire da 25 °C e aumentare la temperatura a 850 °C ad una velocità di 60 °C/h. Mantenere la temperatura a 850 °C per 1,5 ore, quindi raffreddare il forno a temperatura ambiente ad una velocità di 60 °C/h.
3. Pulizia Pd
- Preparare una soluzione detergente combinando 10 ml di acido nitrico, 20 ml di perossido di idrogeno al 30% (v/v) e 10 ml di acqua deionizzata.
ATTENZIONE: L'acido nitrico è corrosivo, ossidante e tossico. Il perossido di idrogeno è corrosivo, ossidante e dannoso. - Immergere le pellicole di Pd ricotto nella soluzione detergente fino a quando il gorgogliante gorgogliante si attenua o la soluzione diventa gialla (20-30 min).
- Risciacquare i fogli Pd due volte con acqua DI e una volta con alcool isopropilico, quindi asciugare con aria.
4. Assemblaggio del reattore (figura 2, da sinistra a destra)
- Assemblare il reattore inserendo la membrana Pd tra due metà di una cella H elettrochimica.
- Posizionare una guarnizione resistente agli agenti chimici tra il lato sinistro della cella e la membrana Pd.
- Posizionare un'ulteriore guarnizione resistente alle sostanze chimiche tra la membrana Pd e il lato destro della cella elettrochimica.
- Sigillare la configurazione di cella risultante con una clip.
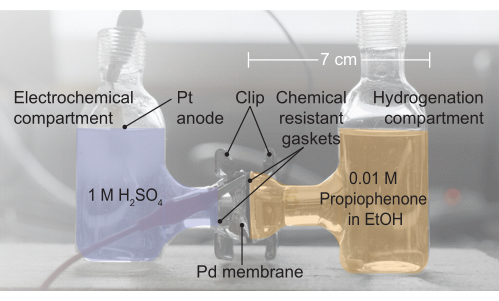
Figura 2: Un'immagine dell'assieme della cella H. Il compartimento elettrochimico contiene 1 elettrolita M H2SO4; È qui che si verifica l'ossidazione dell'acqua. La membrana di palladio separa le due metà della cella H e le guarnizioni forniscono una tenuta senza perdite. Il compartimento di idrogenazione contiene 0,01 M propiofenone in etanolo (EtOH). Fare clic qui per visualizzare una versione ingrandita di questa figura.
5. Elettrodeposizione Pd
- Preparare una soluzione galvanica sciogliendo PdCl2 in 1 M HCl per raggiungere una concentrazione di 15,9 mM.
ATTENZIONE: PdCl2 è dannoso e corrosivo. HCl è corrosivo e irritante. - Assemblare il reattore usando un foglio Pd pulito dal punto 3.
- Riempire il compartimento elettrochimico del reattore con 24 ml della soluzione galvanica preparata e lasciare vuoto il compartimento di idrogenazione.
- Posizionare un anodo a maglia Pt e un elettrodo di riferimento Ag/AgCl nella soluzione nel compartimento elettrochimico.
- Collegare gli elettrodi a un potenziostato e applicare un potenziale di -0,2 V rispetto ad Ag / AgCl alla lamina Pd fino a quando non è passata una carica di 15 C.
- Smontare il reattore, sciacquare la membrana Pd risultante due volte con acqua deionizzata e una volta con alcool isopropilico, quindi asciugare la membrana sotto un flusso d'aria o N2. La membrana Pd avrà ora una deposizione visibile di Pd nero sulla superficie che è stata esposta alla soluzione galvanica.
6. Configurazione del reattore Atm-MS
- Assemblare il reattore come indicato al punto 4. Riempire il compartimento elettrochimico con 1 M H2SO4 e riempire il compartimento di idrogenazione con etanolo. Non aggiungere materie prime di idrogenazione.
ATTENZIONE: H2SO4 è dannoso e corrosivo. L'etanolo è infiammabile, nocivo e pericoloso per la salute. - Immergere un elettrodo contatore Pt nell'elettrolita. Collegare il controelettrodo Pt e la membrana Pd a un alimentatore utilizzando clip a coccodrillo. Collegare il controelettrodo Pt come elettrodo positivo e la membrana Pd come elettrodo negativo.
- Applicare una corrente costante di 25 mA.
7. Configurazione dello strumento Atm-MS
- Accendere l'interruttore di alimentazione sul retro dell'unità atm-MS, appena sotto il cavo di alimentazione.
- Premere il pulsante della pompa sulla parte anteriore per accendere la pompa (si illuminerà di blu quando è accesa). Quindi, accendere la giacca da forno (interruttore rotondo verde, la luce si accenderà).
- Accendere il canale capillare da utilizzare (interruttori rotondi rossi accanto ai canali, la luce si accenderà). Verificare che il canale utilizzato sia acceso sentendo il tubo riscaldato.
NOTA: Il LED verde accanto a "vac ok" si accende entro pochi minuti dall'accensione della pompa. Per spegnere il sistema dopo aver terminato gli esperimenti, disattivare tutti gli interruttori che sono stati attivati. - Collegare l'uscita della cella di idrogenazione ai capillari atm-MS. Questa connessione deve essere ermetica.
8. Configurazione del software Atm-MS
- Fare clic sul collegamento sul desktop del servizio . Vai a Configurazione | SEM/Emission Control, e spuntare le caselle sia per SEM che per le emissioni. Premere OK. Chiudere la finestra di servizio.
- Fai clic sulla scorciatoia Misura e vai su Sequenza | Esegui.
- Compila i seguenti parametri: Misure = 30, Tempo di spurgo = 30 s. Premere File Manager e creare una cartella in cui salvare i dati di output. Queste impostazioni eseguiranno 30 misurazioni con un tempo di spurgo di 30 s tra ogni set di misurazioni; Questo può essere modificato se necessario.
- Il file di misurazione MID verrà quindi aperto. Selezionare Gestione file e aprire un programma per misurare il segnale di spettrometria di massa per m/z = 2. Questo segnale corrisponde alla corrente ionica di H2+, la forma ionizzata dell'idrogeno gassoso.
- Premere OK per avviare il programma. Non chiudere la finestra di misurazione in quanto ciò interromperebbe il funzionamento dello strumento.
- Dopo che il segnale si è stabilizzato (1-3 h), scollegare il capillare atm-MS dal compartimento di idrogenazione e collegarlo al compartimento elettrochimico.
- Salvare i dati e terminare l'esperimento quando il segnale per il compartimento elettrochimico si è stabilizzato (circa 30 minuti).
- Calcolare la percentuale di permeazione dell'idrogeno attraverso la membrana Pd utilizzando l'equazione 1.
9. Idrogenazione elettrochimica
- Assemblare il reattore secondo il punto 4.
- Riempire il compartimento elettrochimico con 24 ml di 1 M H2SO4.
- Inserire un elettrodo contatore Pt nel compartimento elettrochimico attraverso l'apertura del controelettrodo. Collegare l'elettrodo contatore Pt al terminale positivo di un alimentatore e collegare la membrana Pd al terminale negativo tramite nastro Cu.
- Applicare una corrente galvanostatica di 25 mA (corrispondente a 40 mA/cm2) attraverso la cella per 15 minuti. La tensione sarà compresa tra 3 V e 5 V.
- Dopo 15 minuti, riempire il compartimento chimico con 24 ml di soluzione di reazione (ad esempio, 0,01 M propiofenone in etanolo). Mantenere la corrente galvanostatica durante l'aggiunta del reagente.
NOTA: campionare la soluzione di reazione iniziale prima di aggiungerla al reattore. Vedere il punto 9.6.
ATTENZIONE: Propiofenone è dannoso. - Prelevare periodicamente il campione del compartimento chimico (ad esempio, ogni 15 minuti) prelevando 30 μL di soluzione di reazione dal compartimento chimico utilizzando una micropipetta e sciogliendo il campione in 1 mL di diclorometano. Conservare i campioni in flaconcini GC-MS fino al completamento della reazione.
ATTENZIONE: Il diclorometano è nocivo e pericoloso per la salute.
10. Gascromatografia-spettrometria di massa
- Caricare i flaconcini di campione nel vassoio di autocampionamento.
- Avviare il software GC-MS facendo clic sull'icona verde Masshunter .
- Clicca su Sequenza | Modifica sequenza per aprire la finestra di modifica della sequenza. Inserire i nomi dei campioni desiderati, il flaconcino (posizione nel vassoio di campionamento automatico), il percorso del metodo, il file del metodo, il percorso dei dati e il file di dati nel grafico. Impostare il tipo di campione su "sample" e la diluizione su 1 e assicurarsi che il file di dati corrisponda al nome del campione.
- Regola il metodo facendo clic su Metodo | Modifica l'intero metodo.
- Assicurarsi che siano controllate sia le informazioni sul metodo che l'acquisizione dello strumento . Fare clic su OK. Aggiungere commenti Metodo (se lo si desidera).
- Assicurarsi che l'acquisizione e l'analisi dei dati siano controllate. Lasciare vuoti tutti gli altri campi. Fare clic su OK.
- Assicurarsi che l'ingresso del campione sia impostato su GC e che la sorgente di iniezione sia impostata su GC ALS. Seleziona la casella Usa MS. Assicurarsi che la posizione di ingresso sia impostata su Front e che MS sia collegato a Front. Fare clic su OK.
- Nella scheda Ingresso , assicurarsi che la temperatura del riscaldatore sia impostata su 250 °C. Impostare la pressione su 7,2 psi e il flusso He su 23,1 ml/min.
- Nella scheda Forno, impostare la temperatura iniziale su 50 °C e tenere premuto per 1 minuto. Quindi, impostare la velocità di rampa su 25 °C/min e la temperatura su 200 °C e tenere premuto per 0 min. Fare clic su OK.
- Assicurarsi che nessuno dei segnali del display sia controllato. Fare clic su OK.
- Impostare il ritardo del solvente su 2,50 min. Fare clic su OK.
- Assicurarsi che i monitor selezionati includano quanto segue: temperatura del forno GC, temperatura dell'ingresso F GC, pressione F dell'ingresso GC, calc del flusso della colonna GC 2, volt SM EM, SORGENTE MS MS, QUAD MS MS. Fare clic su OK.
- Salvare il metodo con il nome del metodo desiderato.
- Avviare la sequenza facendo clic su Sequenza | Sequenza iniziale | Esegui sequenza.
- Al termine della sequenza, visualizzare i dati aprendo il software Masshunter e facendo clic sul nome del file programmato nel passaggio 10.3.
- Identifica i picchi di prodotto facendo clic su Spectrum | Rapporto di ricerca in biblioteca per confrontare gli spettri di massa acquisiti con il database NIST.
- Calcolare la composizione relativa delle materie prime e dei prodotti utilizzando l'equazione 2.
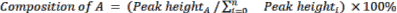 (Eq. 2)
(Eq. 2)
dove A è il componente chimico di interesse e n è il numero di componenti misurato da GC-MS. Un esempio è il seguente: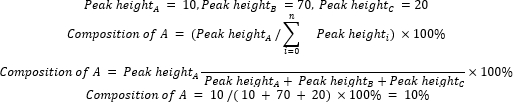
Risultati
Atm-MS viene utilizzato per misurare la corrente ionica dell'idrogeno prodotto nel reattore a membrana. Possiamo usare queste misurazioni per quantificare quanto idrogeno permea attraverso la membrana Pd durante l'elettrolisi. In primo luogo, viene misurato l'idrogeno che si evolve dal compartimento di idrogenazione (Figura 3, a sinistra delle linee tratteggiate). Quando il segnale raggiunge uno stato stazionario, il canale viene commutato nel compartimento elettrochimico. Il gas H2
Discussione
La membrana Pd consente la permeazione dell'idrogeno e l'idrogenazione chimica. La preparazione di questa membrana è, quindi, importante per l'efficacia del reattore a membrana. La dimensione della membrana Pd, la cristallografia e la superficie sono sintonizzate per migliorare i risultati sperimentali. Sebbene il metallo Pd possa evolvere idrogeno a qualsiasi spessore, le membrane Pd vengono arrotolate a 25 μm. Questa standardizzazione dello spessore della membrana assicura che il tempo necessario all'idrogeno per per...
Divulgazioni
Sono state depositate e pubblicate domande di brevetto basate sulla tecnologia descritta in questo lavoro: Berlinguette, C. P.; Sherbo, R. S. "Metodi e apparecchi per l'esecuzione di reazioni chimiche ed elettrochimiche" US Patent Application No. 16964944 (PCT depositato gennaio 2019, ingresso nazionale luglio 2020), pubblicazione n. US20210040017A1 (pubblicato a febbraio 2021). Canadian Patent Application No. 3089508 (PCT depositato gennaio 2019, ingresso nazionale luglio 2020), pubblicazione n. CA3089508 (pubblicata nell'agosto 2019). Dati prioritari: US Provisional Patent Application No. 62/622,305 (depositata a gennaio 2018).
Riconoscimenti
Siamo grati al Canadian Natural Sciences and Engineering Research Council (RGPIN-2018-06748), alla Canadian Foundation for Innovation (229288), al Canadian Institute for Advanced Research (BSE-BERL-162173) e alle cattedre di ricerca canadesi per il sostegno finanziario. Questa ricerca è stata intrapresa grazie in parte ai finanziamenti del Canada First Research Excellence Fund, Quantum Materials and Future Technologies Program. Ringraziamo Ben Herring dell'UBC Shared Instrument Facility per l'assistenza nello sviluppo dello strumento e del metodo GC-MS. Ringraziamo la dottoressa Monika Stolar per i contributi allo sviluppo e alla redazione di questo manoscritto. Infine, ringraziamo l'intero Gruppo Berlinguette dell'Università della British Columbia per il loro continuo supporto e collaborazione nello studio del reattore a membrana.
Materiali
| Name | Company | Catalog Number | Comments |
| Ag/AgCl Reference Electrode | BASi research products | MW-2021 | Reference electrode |
| Analytical Balance | Cole-Parmer | RK-11219-03 | Instrument |
| Atmospheric Mass Spectrometer | ESS CatalySys | NA | Instrument |
| Bench Power Supply | Newark | 1550 | Instrument |
| Conductive Copper Foil Electrical Tape | McMaster Carr | 76555A711 | Electrochemical cell assembly |
| Dichloromethane | Sigma Aldrich | 270997 | Reagent |
| Electric Rolling Press with Dual Micrometer | MTI Corporation | MR100A | Equipment |
| Electrochemical glass H-cell | University of British Columbia glass blowing | NA | Electrochemical cell assembly |
| ESS catalysis QUADSTAR | ESS CatalySys | NA | Software |
| Ethanol | Sigma Aldrich | 493511 | Reagent |
| Flat Rolling Mill | Pepetolls | 18700A | Equipment |
| Gas Chromatography Mass Spectrometer | Agilent | NA | Instrument |
| GC-MS vial | Agilent | 5067-0205 | Vial for GC-MS |
| Hexanes | Sigma Aldrich | 1.0706 | Reagent |
| Hydrochloric Acid | Sigma Aldrich | 258148 | Reagent |
| Hydrogen peroxide solution (30% v/v) | Sigma Aldrich | H1009 | Reagent |
| Isopropyl Alcohol | Sigma Aldrich | W292907 | Reagent |
| Masshunter Aquisition Software | Agilent | G1617FA | Software |
| Micropipette (100 µL - 1000 µL) | Gilson | F123602 | instrument |
| Micropipette (20 µL - 200 µL) | Gilson | F123601 | Instrument |
| Mitutoyo Digital Micrometer | Uline | H-2780 | Instrument |
| Muffle Furnace | MTI Corporation | KSL-1100X | Equipment |
| Nitric acid | Sigma Aldrich | 438073 | Reagent |
| Nitrogen gas | Sigma Aldrich | 608661 | Reagent |
| Palladium (II) Chloride | Sigma Aldrich | 520659 | Reagent |
| Pd wafer bar, 1 oz, 99.95% | Silver Gold Bull. | NA | Reagent |
| Platinum Auxiliary Electrode | BASi research products | MW-1032 | Anode |
| Potentiostat | Metrohm | PGSTAT302N | Instrument |
| Propiophenone | Sigma Aldrich | P51605 | Reagent |
| Proton Exchange Membrane, Nafion 212 | Fuel cell store | NA | Electrochemical cell assembly |
| Sulfuric acid | Sigma Aldrich | 258105 | Reagent |
Riferimenti
- Rytter, E., Hillestad, M., Austbø, B., Lamb, J. J., Sarker, S., Lamb, J. J., Pollet, B. G. Chapter six - Thermochemical production of fuels. Hydrogen, Biomass and Bioenergy. , 89-117 (2020).
- Arpe, H. -. J. . Industrial Organic Chemistry. , (2017).
- Orella, M. J., Román-Leshkov, Y., Brushett, F. R. Emerging opportunities for electrochemical processing to enable sustainable chemical manufacturing. Current Opinion in Chemical Engineering. 20, 159-167 (2018).
- May, A. S., Biddinger, E. J. Strategies to control electrochemical hydrogenation and hydrogenolysis of furfural and minimize undesired side reactions. ACS Catalysis. 10 (5), 3212-3221 (2020).
- Tang, B. Y., Bisbey, R. P., Lodaya, K. M., Toh, W. L., Surendranath, Y. Reaction environment impacts charge transfer but not chemical reaction steps in hydrogen evolution catalysis. ChemRxiv. , (2022).
- Iwakura, C., Yoshida, Y., Inoue, H. A new hydrogenation system of 4-methylstyrene using a palladinized palladium sheet electrode. Journal of Electroanalytical Chemistry. 431 (1), 43-45 (1997).
- Inoue, H., Abe, T., Iwakura, C. Successive hydrogenation of styrene at a palladium sheet electrode combined with electrochemical supply of hydrogen. Chemical Communications. , 55-56 (1996).
- Conde, J. J., Maroño, M., Sánchez-Hervás, J. M. Pd-based membranes for hydrogen separation: Review of alloying elements and their influence on membrane properties. Separation and Purification Reviews. 46 (2), 152-177 (2017).
- Wicke, E., Brodowsky, H., Züchner, H., Alefeld, G., VÖlkl, J. Hydrogen in palladium and palladium alloys. Hydrogen in Metals II. Topics in Applied Physics., edited by Alefeld, G., Völkl, J. 29, (1978).
- Sato, T., Sato, S., Itoh, N. Using a hydrogen-permeable palladium membrane electrode to produce hydrogen from water and hydrogenate toluene. International Journal Hydrogen Energy. 41 (12), 5419-5427 (2016).
- Sherbo, R. S., Delima, R. S., Chiykowski, V. A., MacLeod, B. P., Berlinguette, C. P. Complete electron economy by pairing electrolysis with hydrogenation. Nature Catalysis. 1, 501-507 (2018).
- Sherbo, R. S., Kurimoto, A., Brown, C. M., Berlinguette, C. P. Efficient electrocatalytic hydrogenation with a palladium membrane reactor. Journal of American Chemical Society. 141 (19), 7815-7821 (2019).
- Kurimoto, A., Sherbo, R. S., Cao, Y., Loo, N. W. X., Berlinguette, C. P. Electrolytic deuteration of unsaturated bonds without using D2. Nature Catalysis. 3, 719-726 (2020).
- Jansonius, R. P., et al. Hydrogenation without H2 using a palladium membrane flow cell. Cell Reports Physical Science. 1 (7), 100105 (2020).
- Huang, A., et al. Electrolysis can be used to resolve hydrogenation pathways at palladium surfaces in a membrane reactor. Journal of American Chemical Society Au. 1 (3), 336-343 (2021).
- Delima, R. S., et al. Selective hydrogenation of furfural using a membrane reactor. Energy and Environmental Science. 15 (1), 215-224 (2021).
- Sato, T., Takada, A., Itoh, N. Low-temperature hydrogenation of toluene by electrolysis of water with hydrogen permeable palladium membrane electrode. Chemistry Letters. 46 (4), 477-480 (2017).
- Maoka, T., Enyo, M. Overpotential decay transients and the reaction mechanism on the Pd-H2 electrode. Surface Technology. 8 (5), 441-450 (1979).
- Kurimoto, A., et al. Physical separation of H2 activation from hydrogenation chemistry reveals the specific role of secondary metal catalysts. Angewandte Chemie International Edition. 60 (21), 11937-11942 (2021).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneEsplora altri articoli
This article has been published
Video Coming Soon