É necessária uma assinatura da JoVE para visualizar este conteúdo. Faça login ou comece sua avaliação gratuita.
Method Article
Produção e Utilização de Hidrogênio em Reator de Membrana
* Estes autores contribuíram igualmente
Neste Artigo
Resumo
Os reatores de membrana permitem a hidrogenação em condições ambientais sem entrada direta de H2 . Podemos rastrear a produção e utilização de hidrogênio nesses sistemas usando espectrometria de massas atmosféricas (atm-MS) e cromatografia gasosa por espectrometria de massas (GC-MS).
Resumo
A hidrogenação industrial consome ~11 Mt de gás H2 derivado de fósseis anualmente. Nosso grupo inventou um reator de membrana para contornar a necessidade de usar gás H2 para a química de hidrogenação. O reator de membrana obtém hidrogênio da água e impulsiona reações usando eletricidade renovável. Neste reator, um pedaço fino de Pd separa um compartimento eletroquímico de produção de hidrogênio de um compartimento de hidrogenação química. O Pd no reator de membrana atua como (i) uma membrana seletiva de hidrogênio, (ii) um cátodo e (iii) um catalisador para hidrogenação. Neste artigo, relatamos o uso de espectrometria de massas atmosféricas (atm-MS) e cromatografia gasosa por espectrometria de massas (GC-MS) para demonstrar que um viés eletroquímico aplicado através de uma membrana de Pd permite hidrogenação eficiente sem entrada direta de H2 em um reator de membrana. Com atm-MS, medimos uma permeação de hidrogênio de 73%, o que permitiu a hidrogenação de propiofenona a propilbenzeno com 100% de seletividade, medida por GC-MS. Em contraste com a hidrogenação eletroquímica convencional, que é limitada a baixas concentrações de material de partida dissolvido em um eletrólito prótico, a separação física da produção de hidrogênio da utilização no reator de membrana permite a hidrogenação em qualquer solvente ou em qualquer concentração. O uso de altas concentrações e uma ampla gama de solventes é particularmente importante para a escalabilidade do reator e futura comercialização.
Introdução
Reações termoquímicas de hidrogenação são usadas em ~20% de toda a síntese química1. Essas reações requerem grandes quantidades de gás H 2, que geralmente são derivados de combustíveis fósseis, temperaturas entre 150 °C e 600 °C e pressões de até 200 atm2. A hidrogenação eletroquímica é uma maneira atraente de contornar esses requisitos e conduzir reações de hidrogenação usando água e eletricidade renovável3. Para hidrogenação eletroquímica convencional, uma matéria-prima insaturada é dissolvida em um eletrólito prótico em uma célula eletroquímica. Quando um potencial é aplicado à célula, a oxidação da água ocorre no ânodo, enquanto a hidrogenação ocorre no cátodo. Nesta configuração de reação, tanto a oxidação eletroquímica da água quanto a hidrogenação química ocorrem no mesmo ambiente reacional. O substrato orgânico é dissolvido em um eletrólito prótico para permitir a divisão eletroquímica da água e a hidrogenação da matéria-prima. A proximidade dessas reações pode levar à formação de subprodutos e incrustação de eletrodos quando o reagente é suscetível ao ataque nucleofílico ou se a concentração do reagente é muito alta (>0,25 M)4.
Esses desafios levaram nosso grupo a explorar maneiras alternativas de conduzir eletroquimicamente reações de hidrogenação 5,6,7. Essa busca resultou no uso de uma membrana de Pd, que é convencionalmente utilizada na separação de gáshidrogênio8. Nós o usamos como um eletrodo para eletrólise da água no lado do reator eletroquímico. Esta nova aplicação de uma membrana de paládio permite a separação física do local de oxidação eletroquímica da água do local de hidrogenação química. A configuração do reator resultante possui dois compartimentos: 1) um compartimento eletroquímico para produção de hidrogênio; e 2) um compartimento químico para hidrogenação (Figura 1). Os prótons são gerados no compartimento eletroquímico através da aplicação de um potencial através do ânodo de Pt e da membrana de Pd, que também serve como cátodo. Esses prótons então migram para a membrana Pd, onde são reduzidos a átomos de hidrogênio adsorvidos superficialmente. O compartimento eletroquímico pode ser subdividido para incluir uma membrana de troca catiônica opcional para facilitar essa migração de prótons. Os átomos de hidrogênio adsorvidos superficialmente permeiam através dos sítios octaédricos intersticiais da rede Pd fcc9 e emergem na face oposta da membrana no compartimento de hidrogenação, onde reagem com as ligações insaturadas de uma dada matéria-prima para formar produtos hidrogenados 7,10,11,12,13,14,15,16. O Pd no reator de membrana, portanto, atua como (i) uma membrana seletiva de hidrogênio, (ii) um cátodo e (iii) um catalisador para hidrogenação.
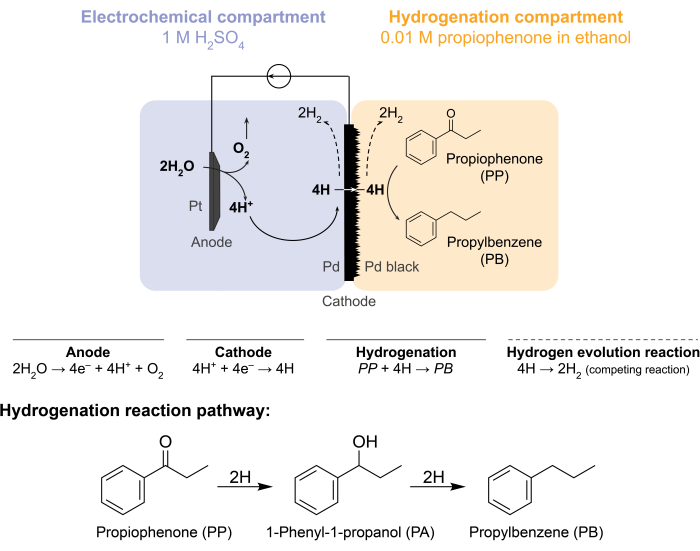
Figura 1: Hidrogenação em reator de membrana. A oxidação da água no ânodo produz prótons, que são reduzidos no cátodo de paládio. O H permeia através da membrana de Pd e reage com propiofenona para formar propilbenzeno. A evolução do hidrogênio é uma reação competitiva que pode ocorrer em ambos os lados da membrana do paládio. Para espectrometria de massa atmosférica, nenhuma matéria-prima química é usada, necessitando que H deixe o reator na forma de gás H2 nos compartimentos eletroquímico ou de hidrogenação. Clique aqui para ver uma versão maior desta figura.
O reator de membrana é montado por sanduíche de uma membrana de Pd entre os compartimentos do ânodo e do cátodo de uma célula H eletroquímica12. Anéis O-resistentes a produtos químicos são usados para fixar a membrana no lugar e garantir uma vedação livre de vazamentos. O compartimento eletroquímico do reator de membrana contém uma solução aquosa rica em hidrogênio. Neste estudo, utilizamos 1 M H 2 SO4 e um anodo que consiste em um fio Pt envolto em uma tela de platina de 5 cm2. O ânodo é submerso na solução eletrolítica através de um orifício no topo do compartimento eletroquímico. O compartimento de hidrogenação química contém um solvente e uma matéria-prima de hidrogenação 7,10,11,12,16,17. O orifício na parte superior do compartimento da célula H é usado para amostragem. Os experimentos aqui apresentados utilizam propiofenona 0,01 M em etanol como alimento para hidrogenação. No entanto, o material de partida (e a concentração) podem ser variados para atender às necessidades experimentais. Por exemplo, um material de partida que contém uma longa cadeia de hidrocarbonetos e um grupo funcional alquino pode ser dissolvido em pentano para melhorar a solubilidade11. A corrente aplicada para a reação pode estar entre 5 mA/cm 2 e 300 mA/cm2. Todas as reações são realizadas sob temperatura e pressão ambiente.
A espectrometria de massas atmosféricas (atm-MS) é utilizada para medir a porcentagem de hidrogênio no compartimento eletroquímico que permeia o compartimento de hidrogenação11,12. Essa medição é importante para entender as entradas de energia necessárias para o reator de membrana, pois revela a máxima utilização possível de hidrogênio (ou seja, quanto do hidrogênio que está sendo produzido pode realmente ser usado para reações de hidrogenação). A permeação de hidrogênio através da membrana Pd é calculada medindo-se a quantidade de H2 que evolui a partir dos compartimentos eletroquímico e de hidrogenação11,12. Um valor de permeação de 100% significa que todo o hidrogênio produzido no compartimento eletroquímico é transportado através da membrana Pd para o compartimento de hidrogenação e, posteriormente, se combina para formar gás hidrogênio. Um valor de permeação de <100% significa que a evolução do hidrogênio ocorre no compartimento eletroquímico antes de permear através da membrana. Como H2 é produzido a partir do compartimento eletroquímico ou de hidrogenação, ele entra no instrumento e é ionizado para H2+. O quadrupolo seleciona fragmentos de m/z = +2, e a carga correspondente é medida pelo detector. A parcela obtida por esta técnica é a carga iônica ao longo do tempo. A carga iônica é medida primeiro para o compartimento de hidrogenação e, quando o sinal se estabiliza, os canais são alterados para medir o compartimento eletroquímico. A permeação de hidrogênio é calculada dividindo-se a carga iônica média no compartimento de hidrogenação pela carga iônica total medida no reator (Equação 1)11,12. Para calcular a permeação de hidrogênio, H2 dos compartimentos de hidrogenação e eletroquímico são medidos separadamente usando atm-MS.
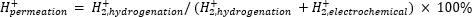 (Eq. 1)
(Eq. 1)
A cromatografia gasosa acoplada à espectrometria de massas (CG-EM) é utilizada para monitorar o progresso da reação de hidrogenação12,14,15,16. Para coletar dados para o exemplo, o compartimento de hidrogenação do reator é preenchido com propiofenona 0,01 M em etanol. Através da aplicação de um potencial através do ânodo de Pt e do cátodo de Pd, o hidrogênio reativo é fornecido ao compartimento de hidrogenação. Os átomos de hidrogênio reativos então hidrogenam a matéria-prima insaturada, e os produtos são quantificados usando GC-MS, onde a amostra é fragmentada e ionizada. Analisando a massa desses fragmentos, pode-se determinar a composição da solução de hidrogenação e calcular as taxas de reação12,14,15,16.
Protocolo
1. Rolagem de Pd
- Limpe a barra de wafer Pd com uma mistura de hexanos usando um pano de algodão.
CUIDADO: O hexano é inflamável, um perigo para a saúde, irritante e prejudicial ao meio ambiente. Trabalhe sob ventilação adequada (ou seja, um snorkel ou um exaustor). - Enrolar o wafer Pd usando um rolo manual até atingir uma espessura de ≤150 μm, determinada por um micrômetro digital.
- Enrolar o Pd usando um rolo automático até uma espessura de 25 μm, determinada por um micrômetro digital. Em seguida, corte o Pd resultante nas dimensões desejadas (por exemplo, 3,5 cm x 3,5 cm).
2. Recozimento de Pd
- Coloque as folhas de Pd laminadas em um forno mufla com uma atmosfera N2 .
- Aqueça as folhas de Pd a partir de 25 °C e aumente a temperatura para 850 °C a uma taxa de 60 °C/h. Mantenha a temperatura a 850 °C durante 1,5 h e, em seguida, arrefeça o forno até à temperatura ambiente a uma taxa de 60 °C/h.
3. Pd limpeza
- Preparar uma solução de limpeza combinando 10 mL de ácido nítrico, 20 mL de peróxido de hidrogênio a 30% (v/v) e 10 mL de água deionizada.
CUIDADO: O ácido nítrico é corrosivo, oxidante e tóxico. O peróxido de hidrogênio é corrosivo, oxidante e prejudicial. - Submergir as folhas de Pd recozido na solução de limpeza até que o borbulhamento vigoroso diminua ou a solução fique amarela (20-30 min).
- Enxágue as folhas de Pd duas vezes com água DI e uma vez com álcool isopropílico e, em seguida, seque com ar.
4. Montagem do reator (Figura 2, da esquerda para a direita)
- Montar o reator sanduíche a membrana de Pd entre duas metades de uma célula H eletroquímica.
- Coloque uma junta resistente a produtos químicos entre o lado esquerdo da célula e a membrana Pd.
- Coloque uma junta adicional resistente a produtos químicos entre a membrana de Pd e o lado direito da célula eletroquímica.
- Sele a configuração da célula resultante com um clipe.
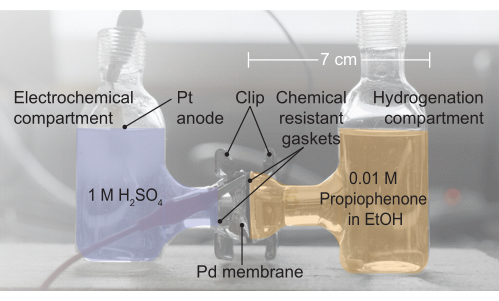
Figura 2: Uma imagem do conjunto da célula H. O compartimento eletroquímico contém 1 eletrólito MH 2SO4; É aqui que ocorre a oxidação da água. A membrana de paládio separa as duas metades da célula H, e as juntas fornecem uma vedação livre de vazamentos. O compartimento de hidrogenação contém propiofenona 0,01 M em etanol (EtOH). Clique aqui para ver uma versão maior desta figura.
5. Eletrodeposição de Pd
- Preparar uma solução de galvanoplastia dissolvendo PdCl2 em HCl 1 M para atingir uma concentração de 15,9 mM.
CUIDADO: PdCl2 é prejudicial e corrosivo. O HCl é corrosivo e irritante. - Monte o reator usando uma folha de Pd limpa da etapa 3.
- Preencher o compartimento eletroquímico do reator com 24 mL da solução de galvanoplastia preparada e deixar o compartimento de hidrogenação vazio.
- Coloque um ânodo de malha de Pt e um eletrodo de referência Ag/AgCl na solução no compartimento eletroquímico.
- Conecte os eletrodos a um potenciostático e aplique um potencial de -0,2 V versus Ag/AgCl na folha de Pd até que uma carga de 15 C tenha passado.
- Desmonte o reator, lave a membrana Pd resultante duas vezes com água deionizada e uma vez com álcool isopropílico e, em seguida, seque a membrana sob uma corrente de ar ou N2. A membrana de Pd agora terá uma deposição visível de Pd preto na superfície que foi exposta à solução de galvanoplastia.
6. Configuração do reator Atm-MS
- Monte o reator conforme indicado na etapa 4. Preencher o compartimento eletroquímico com 1 M H2SO4 e preencher o compartimento de hidrogenação com etanol. Não adicione matéria-prima de hidrogenação.
CUIDADO: H2SO4 é prejudicial e corrosivo. O etanol é inflamável, nocivo e um perigo para a saúde. - Submergir um contra-eletrodo de Pt no eletrólito. Conecte o contra-eletrodo Pt e a membrana Pd a uma fonte de alimentação usando clipes de jacaré. Conecte o contra-eletrodo Pt como eletrodo positivo e a membrana Pd como eletrodo negativo.
- Aplicar uma corrente constante de 25 mA.
7. Configuração do instrumento Atm-MS
- Ligue o interruptor de alimentação na parte traseira da unidade atm-MS, logo abaixo do cabo de alimentação.
- Pressione o botão da bomba na frente para ligar a bomba (ela acenderá azul quando ligada). Em seguida, ligue a jaqueta de assar (interruptor redondo verde, a luz se acenderá).
- Ligue o canal capilar a ser usado (interruptores redondos vermelhos ao lado dos canais, a luz se acenderá). Verifique se o canal utilizado está ligado sentindo o tubo sendo aquecido.
NOTA: O LED verde ao lado de "vac ok" acenderá dentro de alguns minutos após ligar a bomba. Para desligar o sistema depois de terminar os experimentos, desligue todos os interruptores que foram ligados. - Conectar a saída da célula de hidrogenação aos capilares atm-MS. Essa conexão deve ser hermética.
8. Configuração do software Atm-MS
- Clique no atalho da área de trabalho do serviço . Vá para Configuração | MEV/Controle de Emissões, e marque as caixas para MEV e emissões. Pressione OK. Feche a janela de serviço.
- Clique no atalho Medir e vá para Sequência | Executar.
- Preencha os seguintes parâmetros: Medidas = 30, Tempo de purga = 30 s. Pressione Gerenciador de arquivos e crie uma pasta para salvar os dados de saída. Essas configurações farão 30 medições com um tempo de purga de 30 s entre cada conjunto de medição; isso pode ser alterado, se necessário.
- O arquivo de medições MID será aberto. Selecione Gerenciamento de arquivos e abra um programa para medir o sinal de espectrometria de massa para m/z = 2. Este sinal corresponde à corrente iônica de H2+, a forma ionizada do gás hidrogênio.
- Pressione OK para iniciar o programa. Não feche a janela de medição, pois isso interromperá o funcionamento do instrumento.
- Após a estabilização do sinal (1-3 h), desconecte o capilar atm-MS do compartimento de hidrogenação e conecte-o ao compartimento eletroquímico.
- Salve os dados e encerre o experimento quando o sinal para o compartimento eletroquímico tiver se estabilizado (cerca de 30 min).
- Calcular a porcentagem de permeação de hidrogênio através da membrana Pd usando a Equação 1.
9. Hidrogenação eletroquímica
- Monte o reator de acordo com o passo 4.
- Preencher o compartimento eletroquímico com 24 mL de 1 M H2SO4.
- Insira um contra-eletrodo Pt no compartimento eletroquímico através da abertura do contra-eletrodo. Conecte o contra-eletrodo Pt ao terminal positivo de uma fonte de alimentação e conecte a membrana Pd ao terminal negativo através de fita de.
- Aplicar uma corrente galvanostática de 25 mA (corresponde a 40 mA/cm2) em toda a célula durante 15 minutos. A tensão será lida entre 3 V e 5 V.
- Após 15 min, preencha o compartimento químico com 24 mL de solução de reação (por exemplo, propiofenona 0,01 M em etanol). Manter a corrente galvanostática durante a adição do reagente.
NOTA: Recolha uma amostra da solução de reacção inicial antes de ser adicionada ao reactor. Consulte a etapa 9.6.
CUIDADO: A propiofenona é prejudicial. - Recolher amostras periódicas do compartimento químico (por exemplo, a cada 15 minutos) retirando 30 μL de solução de reacção do compartimento químico utilizando uma micropipeta e dissolvendo a amostra em 1 ml de diclorometano. Armazenar as amostras em frascos para injetáveis GC-MS até que a reação esteja completa.
CUIDADO: O diclorometano é prejudicial e um perigo para a saúde.
10. Cromatografia gasosa-espectrometria de massas
- Coloque os frascos para injetáveis de amostra na bandeja de recolha automática de amostras.
- Inicie o software GC-MS clicando no ícone verde do Masshunter .
- Clique em Sequência | Editar sequência para abrir a janela de edição de sequência. Preencha os nomes de amostra desejados, frasco (posição na bandeja de amostragem automática), caminho do método, arquivo de método, caminho de dados e arquivo de dados no gráfico. Defina o tipo de amostra como "amostra" e a diluição como 1 e verifique se o arquivo de dados corresponde ao nome da amostra.
- Ajuste o método clicando em Método | Edite o método inteiro.
- Certifique-se de que as informações do Método e a aquisição do Instrumento sejam verificadas. Clique em OK. Adicionar comentários de método (se desejado).
- Certifique-se de que a aquisição de dados e a análise de dados sejam verificadas. Deixe todos os outros campos em branco. Clique em OK.
- Certifique-se de que a entrada da amostra esteja definida como GC e a fonte de injeção esteja definida como GC ALS. Marque a caixa Usar MS. Verifique se o local de entrada está definido como Frontal e se o MS está conectado ao Front. Clique em OK.
- Na guia Entrada , verifique se a temperatura do aquecedor está ajustada para 250 °C. Ajuste a pressão para 7,2 psi e o fluxo de He para 23,1 mL/min.
- Na guia Forno, ajuste a temperatura inicial para 50 °C e segure por 1 min. Em seguida, defina a taxa de rampa para 25 °C/min e a temperatura para 200 °C, e segure por 0 min. Clique em OK.
- Certifique-se de que nenhum dos sinais de exibição esteja marcado. Clique em OK.
- Ajuste o atraso do solvente para 2,50 min. Clique em OK.
- Certifique-se de que os monitores selecionados incluam o seguinte: temperatura do forno GC, temperatura F da entrada GC, pressão F da entrada GC, calc de fluxo da coluna GC 2, volts MS EM, fonte MS MS, MS quad. Clique em OK.
- Salve o método sob o nome do método desejado.
- Inicie a sequência clicando em Sequência | Iniciar Sequência | Executar sequência.
- Quando a sequência estiver concluída, visualize os dados abrindo o software Masshunter e clicando no nome do arquivo que foi programado na etapa 10.3.
- Identifique os picos do produto clicando em Spectrum | Relatório de pesquisa da biblioteca para comparar os espectros de massa adquiridos com o banco de dados do NIST.
- Calcule a composição relativa das matérias-primas e produtos utilizando a Equação 2.
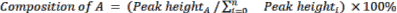 (Eq. 2)
(Eq. 2)
onde A é o componente químico de interesse e n é o número de componentes medidos por CG-EM. Um exemplo é o seguinte: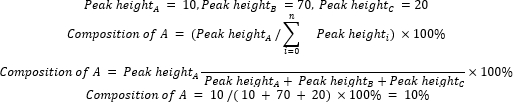
Resultados
Atm-MS é usado para medir a corrente iônica do hidrogênio que é produzido no reator de membrana. Podemos usar essas medidas para quantificar o quanto de hidrogênio permeia através da membrana de Pd durante a eletrólise. Primeiro, mede-se o hidrogênio que evolui a partir do compartimento de hidrogenação (Figura 3, à esquerda das linhas pontilhadas). Quando o sinal atinge um estado estacionário, o canal é comutado para o compartimento eletroquímico. O gás H2 que evolu...
Discussão
A membrana Pd permite a permeação de hidrogênio e hidrogenação química. A preparação desta membrana é, portanto, importante para a eficácia do reator de membrana. O tamanho da membrana de Pd, cristalografia e superfície são ajustados para melhorar os resultados experimentais. Embora o metal Pd possa evoluir hidrogênio em qualquer espessura, as membranas de Pd são laminadas a 25 μm. Essa padronização da espessura da membrana garante que o tempo necessário para o hidrogênio permear através da membrana s...
Divulgações
Pedidos de patente baseados na tecnologia descrita neste trabalho foram depositados e publicados: Berlinguette, C. P.; Sherbo, R. S. "Methods and Apparatus for Performing Chemical and Electrochemical Reactions" US Patent Application No. 16964944 (PCT depositado em janeiro de 2019, entrada nacional em julho de 2020), Publicação nº US20210040017A1 (publicado em fevereiro de 2021). Pedido de Patente Canadense Nº 3089508 (PCT depositado em janeiro de 2019, entrada nacional em julho de 2020), Publicação Nº CA3089508 (publicado em agosto de 2019). Dados prioritários: Pedido de Patente Provisório dos EUA nº 62/622.305 (depositado em janeiro de 2018).
Agradecimentos
Somos gratos ao Conselho Canadense de Pesquisa em Ciências Naturais e Engenharia (RGPIN-2018-06748), à Fundação Canadense para Inovação (229288), ao Instituto Canadense de Pesquisa Avançada (BSE-BERL-162173) e às Cátedras de Pesquisa do Canadá pelo apoio financeiro. Esta pesquisa foi realizada graças em parte ao financiamento do Canada First Research Excellence Fund, Quantum Materials and Future Technologies Program. Agradecemos a Ben Herring, do UBC Shared Instrument Facility, pela assistência com o desenvolvimento do instrumento e método GC-MS. Agradecemos à Dra. Monika Stolar pelas contribuições para o desenvolvimento e edição deste manuscrito. Finalmente, agradecemos a todo o Grupo Berlinguette da Universidade da Colúmbia Britânica por seu apoio contínuo e colaboração no estudo do reator de membrana.
Materiais
| Name | Company | Catalog Number | Comments |
| Ag/AgCl Reference Electrode | BASi research products | MW-2021 | Reference electrode |
| Analytical Balance | Cole-Parmer | RK-11219-03 | Instrument |
| Atmospheric Mass Spectrometer | ESS CatalySys | NA | Instrument |
| Bench Power Supply | Newark | 1550 | Instrument |
| Conductive Copper Foil Electrical Tape | McMaster Carr | 76555A711 | Electrochemical cell assembly |
| Dichloromethane | Sigma Aldrich | 270997 | Reagent |
| Electric Rolling Press with Dual Micrometer | MTI Corporation | MR100A | Equipment |
| Electrochemical glass H-cell | University of British Columbia glass blowing | NA | Electrochemical cell assembly |
| ESS catalysis QUADSTAR | ESS CatalySys | NA | Software |
| Ethanol | Sigma Aldrich | 493511 | Reagent |
| Flat Rolling Mill | Pepetolls | 18700A | Equipment |
| Gas Chromatography Mass Spectrometer | Agilent | NA | Instrument |
| GC-MS vial | Agilent | 5067-0205 | Vial for GC-MS |
| Hexanes | Sigma Aldrich | 1.0706 | Reagent |
| Hydrochloric Acid | Sigma Aldrich | 258148 | Reagent |
| Hydrogen peroxide solution (30% v/v) | Sigma Aldrich | H1009 | Reagent |
| Isopropyl Alcohol | Sigma Aldrich | W292907 | Reagent |
| Masshunter Aquisition Software | Agilent | G1617FA | Software |
| Micropipette (100 µL - 1000 µL) | Gilson | F123602 | instrument |
| Micropipette (20 µL - 200 µL) | Gilson | F123601 | Instrument |
| Mitutoyo Digital Micrometer | Uline | H-2780 | Instrument |
| Muffle Furnace | MTI Corporation | KSL-1100X | Equipment |
| Nitric acid | Sigma Aldrich | 438073 | Reagent |
| Nitrogen gas | Sigma Aldrich | 608661 | Reagent |
| Palladium (II) Chloride | Sigma Aldrich | 520659 | Reagent |
| Pd wafer bar, 1 oz, 99.95% | Silver Gold Bull. | NA | Reagent |
| Platinum Auxiliary Electrode | BASi research products | MW-1032 | Anode |
| Potentiostat | Metrohm | PGSTAT302N | Instrument |
| Propiophenone | Sigma Aldrich | P51605 | Reagent |
| Proton Exchange Membrane, Nafion 212 | Fuel cell store | NA | Electrochemical cell assembly |
| Sulfuric acid | Sigma Aldrich | 258105 | Reagent |
Referências
- Rytter, E., Hillestad, M., Austbø, B., Lamb, J. J., Sarker, S., Lamb, J. J., Pollet, B. G. Chapter six - Thermochemical production of fuels. Hydrogen, Biomass and Bioenergy. , 89-117 (2020).
- Arpe, H. -. J. . Industrial Organic Chemistry. , (2017).
- Orella, M. J., Román-Leshkov, Y., Brushett, F. R. Emerging opportunities for electrochemical processing to enable sustainable chemical manufacturing. Current Opinion in Chemical Engineering. 20, 159-167 (2018).
- May, A. S., Biddinger, E. J. Strategies to control electrochemical hydrogenation and hydrogenolysis of furfural and minimize undesired side reactions. ACS Catalysis. 10 (5), 3212-3221 (2020).
- Tang, B. Y., Bisbey, R. P., Lodaya, K. M., Toh, W. L., Surendranath, Y. Reaction environment impacts charge transfer but not chemical reaction steps in hydrogen evolution catalysis. ChemRxiv. , (2022).
- Iwakura, C., Yoshida, Y., Inoue, H. A new hydrogenation system of 4-methylstyrene using a palladinized palladium sheet electrode. Journal of Electroanalytical Chemistry. 431 (1), 43-45 (1997).
- Inoue, H., Abe, T., Iwakura, C. Successive hydrogenation of styrene at a palladium sheet electrode combined with electrochemical supply of hydrogen. Chemical Communications. , 55-56 (1996).
- Conde, J. J., Maroño, M., Sánchez-Hervás, J. M. Pd-based membranes for hydrogen separation: Review of alloying elements and their influence on membrane properties. Separation and Purification Reviews. 46 (2), 152-177 (2017).
- Wicke, E., Brodowsky, H., Züchner, H., Alefeld, G., VÖlkl, J. Hydrogen in palladium and palladium alloys. Hydrogen in Metals II. Topics in Applied Physics., edited by Alefeld, G., Völkl, J. 29, (1978).
- Sato, T., Sato, S., Itoh, N. Using a hydrogen-permeable palladium membrane electrode to produce hydrogen from water and hydrogenate toluene. International Journal Hydrogen Energy. 41 (12), 5419-5427 (2016).
- Sherbo, R. S., Delima, R. S., Chiykowski, V. A., MacLeod, B. P., Berlinguette, C. P. Complete electron economy by pairing electrolysis with hydrogenation. Nature Catalysis. 1, 501-507 (2018).
- Sherbo, R. S., Kurimoto, A., Brown, C. M., Berlinguette, C. P. Efficient electrocatalytic hydrogenation with a palladium membrane reactor. Journal of American Chemical Society. 141 (19), 7815-7821 (2019).
- Kurimoto, A., Sherbo, R. S., Cao, Y., Loo, N. W. X., Berlinguette, C. P. Electrolytic deuteration of unsaturated bonds without using D2. Nature Catalysis. 3, 719-726 (2020).
- Jansonius, R. P., et al. Hydrogenation without H2 using a palladium membrane flow cell. Cell Reports Physical Science. 1 (7), 100105 (2020).
- Huang, A., et al. Electrolysis can be used to resolve hydrogenation pathways at palladium surfaces in a membrane reactor. Journal of American Chemical Society Au. 1 (3), 336-343 (2021).
- Delima, R. S., et al. Selective hydrogenation of furfural using a membrane reactor. Energy and Environmental Science. 15 (1), 215-224 (2021).
- Sato, T., Takada, A., Itoh, N. Low-temperature hydrogenation of toluene by electrolysis of water with hydrogen permeable palladium membrane electrode. Chemistry Letters. 46 (4), 477-480 (2017).
- Maoka, T., Enyo, M. Overpotential decay transients and the reaction mechanism on the Pd-H2 electrode. Surface Technology. 8 (5), 441-450 (1979).
- Kurimoto, A., et al. Physical separation of H2 activation from hydrogenation chemistry reveals the specific role of secondary metal catalysts. Angewandte Chemie International Edition. 60 (21), 11937-11942 (2021).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados