Se requiere una suscripción a JoVE para ver este contenido. Inicie sesión o comience su prueba gratuita.
Method Article
Producción y utilización de hidrógeno en un reactor de membrana
* Estos autores han contribuido por igual
En este artículo
Resumen
Los reactores de membrana permiten la hidrogenación en condiciones ambientales sin entrada directa deH2 . Podemos rastrear la producción y utilización de hidrógeno en estos sistemas utilizando espectrometría de masas atmosférica (atm-MS) y espectrometría de masas por cromatografía de gases (GC-MS).
Resumen
La hidrogenación industrial consume ~ 11 Mt de gas H2 derivado de fósiles anualmente. Nuestro grupo inventó un reactor de membrana para evitar la necesidad de utilizar gasH2 para la química de hidrogenación. El reactor de membrana obtiene hidrógeno del agua e impulsa reacciones utilizando electricidad renovable. En este reactor, una pieza delgada de Pd separa un compartimiento de producción de hidrógeno electroquímico de un compartimiento de hidrogenación química. El Pd en el reactor de membrana actúa como (i) una membrana selectiva de hidrógeno, (ii) un cátodo y (iii) un catalizador para la hidrogenación. En este documento, informamos el uso de espectrometría de masas atmosférica (atm-MS) y espectrometría de masas por cromatografía de gases (GC-MS) para demostrar que un sesgo electroquímico aplicado a través de una membrana de Pd permite una hidrogenación eficiente sin entrada directa deH2 en un reactor de membrana. Con atm-MS, medimos una permeación de hidrógeno del 73%, lo que permitió la hidrogenación de propiofenona a propilbenceno con 100% de selectividad, según lo medido por GC-MS. A diferencia de la hidrogenación electroquímica convencional, que se limita a bajas concentraciones de material de partida disuelto en un electrolito prótico, la separación física de la producción de hidrógeno de la utilización en el reactor de membrana permite la hidrogenación en cualquier disolvente o en cualquier concentración. El uso de altas concentraciones y una amplia gama de disolventes es particularmente importante para la escalabilidad del reactor y la futura comercialización.
Introducción
Las reacciones termoquímicas de hidrogenación se utilizan en ~20% de toda la síntesis química1. Estas reacciones requieren grandes cantidades de gasH2 , que generalmente se derivan de combustibles fósiles, temperaturas entre 150 °C y 600 °C, y presiones de hasta 200 atm2. La hidrogenación electroquímica es una forma atractiva de eludir estos requisitos e impulsar reacciones de hidrogenación utilizando agua y electricidad renovable3. Para la hidrogenación electroquímica convencional, una materia prima insaturada se disuelve en un electrolito prótico en una celda electroquímica. Cuando se aplica un potencial a la célula, la oxidación del agua ocurre en el ánodo, mientras que la hidrogenación ocurre en el cátodo. En esta configuración de reacción, tanto la oxidación electroquímica del agua como la hidrogenación química ocurren en el mismo entorno de reacción. El sustrato orgánico se disuelve en un electrolito prótico para permitir tanto la división electroquímica del agua como la hidrogenación de la materia prima. La proximidad de estas reacciones puede conducir a la formación de subproductos y al ensuciamiento del electrodo cuando el reactivo es susceptible al ataque nucleofílico o si la concentración del reactivo es demasiado alta (>0,25 M)4.
Estos desafíos llevaron a nuestro grupo a explorar formas alternativas de conducir electroquímicamente las reacciones de hidrogenación 5,6,7. Esta búsqueda resultó en el uso de una membrana de Pd, que se utiliza convencionalmente en la separación de gas hidrógeno8. Lo usamos como electrodo para la electrólisis del agua en el lado del reactor electroquímico. Esta novedosa aplicación de una membrana de paladio permite la separación física del sitio de oxidación electroquímica del agua del sitio de hidrogenación química. La configuración del reactor resultante tiene dos compartimentos: 1) un compartimento electroquímico para la producción de hidrógeno; y 2) un compartimento químico para hidrogenación (Figura 1). Los protones se generan en el compartimiento electroquímico aplicando un potencial a través del ánodo de Pt y la membrana de Pd, que también sirve como cátodo. Estos protones luego migran a la membrana de Pd, donde se reducen a átomos de hidrógeno adsorbidos en la superficie. El compartimento electroquímico se puede subdividir para incluir una membrana de intercambio catiónico opcional para facilitar esta migración de protones. Los átomos de hidrógeno adsorbidos en superficie penetran a través de los sitios octaédricos intersticiales de la red 9 de Pdfcc y emergen en la cara opuesta de la membrana en el compartimiento de hidrogenación, donde reaccionan con los enlaces insaturados de una materia prima dada para formar productos hidrogenados 7,10,11,12,13,14,15,16. El Pd en el reactor de membrana, por lo tanto, actúa como (i) una membrana selectiva de hidrógeno, (ii) un cátodo y (iii) un catalizador para la hidrogenación.
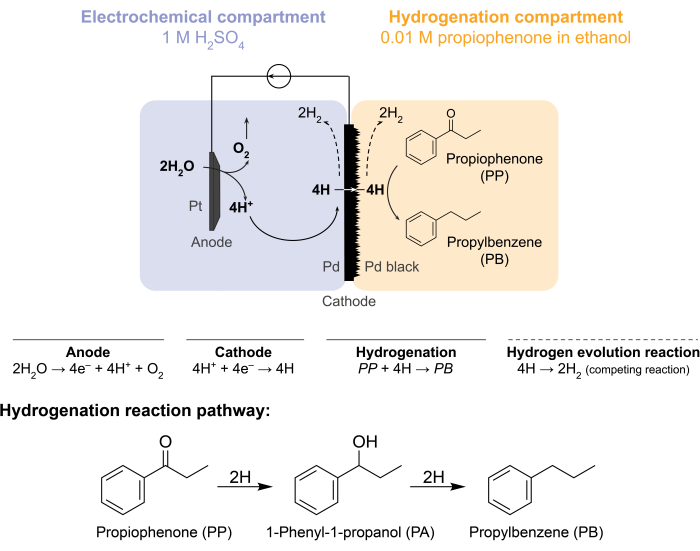
Figura 1: Hidrogenación en un reactor de membrana. La oxidación del agua en el ánodo produce protones, que se reducen en el cátodo de paladio. El H penetra a través de la membrana de Pd y reacciona con propiofenona para formar propilbenceno. La evolución del hidrógeno es una reacción competitiva que puede ocurrir a ambos lados de la membrana de paladio. Para la espectrometría de masas atmosférica, no se utiliza materia prima química, lo que requiere que H abandone el reactor en forma de gasH2 en los compartimentos electroquímicos o de hidrogenación. Haga clic aquí para ver una versión más grande de esta figura.
El reactor de membrana se ensambla intercalando una membrana de Pd entre los compartimentos de ánodo y cátodo de una celda H electroquímica12. Las juntas tóricas resistentes a los productos químicos se utilizan para asegurar la membrana en su lugar y garantizar un sello sin fugas. El compartimiento electroquímico del reactor de membrana contiene una solución acuosa rica en hidrógeno. En este estudio, utilizamos 1 M H 2SO4 y un ánodo que consiste en un alambre de Pt envuelto en una pieza de 5 cm2de malla de platino. El ánodo se sumerge en la solución electrolítica a través de un orificio en la parte superior del compartimiento electroquímico. El compartimento de hidrogenación química contiene un disolvente y una materia prima de hidrogenación 7,10,11,12,16,17. El orificio en la parte superior del compartimiento de células H se utiliza para el muestreo. Los experimentos que se muestran aquí utilizan 0,01 M propiofenona en etanol como alimento de hidrogenación. Sin embargo, el material de partida (y la concentración) se pueden variar para adaptarse a las necesidades experimentales. Por ejemplo, un material de partida que contiene una larga cadena de hidrocarburos y un grupo funcional alquino puede disolverse en pentano para mejorar la solubilidad11. La corriente aplicada para la reacción puede estar entre 5 mA/cm 2 y 300 mA/cm2. Todas las reacciones se llevan a cabo a temperatura y presión ambiente.
La espectrometría de masas atmosférica (ATM-MS) se utiliza para medir el porcentaje de hidrógeno en el compartimiento electroquímico que penetra en el compartimento de hidrogenación11,12. Esta medición es importante para comprender las entradas de energía requeridas para el reactor de membrana, ya que revela la máxima utilización posible de hidrógeno (es decir, cuánto del hidrógeno que se produce se puede usar realmente para reacciones de hidrogenación). La permeación de hidrógeno a través de la membrana de Pd se calcula midiendo la cantidad de H2 que evoluciona desde los compartimentos electroquímico e hidrogenado11,12. Un valor de permeación del 100% significa que todo el hidrógeno producido en el compartimiento electroquímico se transporta a través de la membrana de Pd al compartimiento de hidrogenación y luego se combina para formar gas hidrógeno. Un valor de permeación de <100% significa que la evolución del hidrógeno ocurre en el compartimiento electroquímico antes de penetrar a través de la membrana. Como elH2 se produce desde el compartimiento electroquímico o de hidrogenación, entra en el instrumento y se ioniza a H2+. El cuadrupolo selecciona fragmentos de m/z = +2, y la carga correspondiente es medida por el detector. La gráfica obtenida por esta técnica es la carga iónica a lo largo del tiempo. La carga iónica se mide primero para el compartimiento de hidrogenación, y cuando la señal se estabiliza, los canales se cambian para medir el compartimiento electroquímico. La permeación de hidrógeno se calcula dividiendo la carga iónica media en el compartimento de hidrogenación por la carga iónica total medida en el reactor (Ecuación 1)11,12. Para calcular la permeación de hidrógeno, elH2 de los compartimentos de hidrogenación y electroquímica se mide por separado utilizando atm-MS.
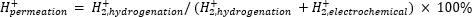 (Ec. 1)
(Ec. 1)
La espectrometría de masas por cromatografía de gases (GC-MS) se utiliza para monitorear el progreso de la reacción de hidrogenación12,14,15,16. Para recopilar datos para el ejemplo, el compartimiento de hidrogenación del reactor se llena con propiofenona 0.01 M en etanol. Al aplicar un potencial a través del ánodo de Pt y el cátodo de Pd, se suministra hidrógeno reactivo al compartimiento de hidrogenación. Los átomos de hidrógeno reactivos luego hidrogenan la materia prima insaturada, y los productos se cuantifican utilizando GC-MS, donde la muestra se fragmenta e ioniza. Al analizar la masa de estos fragmentos, se puede determinar la composición de la solución de hidrogenación y se pueden calcular las velocidades de reacción12,14,15,16.
Protocolo
1. Laminación de Pd
- Limpie la barra de obleas de Pd con una mezcla de hexanos usando un paño de algodón.
PRECAUCIÓN: El hexano es inflamable, un peligro para la salud, un irritante y perjudicial para el medio ambiente. Trabaje bajo ventilación adecuada (es decir, un snorkel o una campana extractora). - Enrollar la oblea de Pd con un rodillo manual hasta alcanzar un grosor de ≤150 μm, según lo determinado por un micrómetro digital.
- Enrollar el Pd con un rodillo automático hasta un espesor de 25 μm, según lo determinado por un micrómetro digital. Luego, corte el Pd resultante en las dimensiones deseadas (por ejemplo, 3.5 cm x 3.5 cm).
2. Recocido de Pd
- Cargue las láminas de Pd enrolladas en un horno de mufla con una atmósfera de N2 .
- Caliente las láminas de Pd a partir de 25 °C y aumente la temperatura a 850 °C a una velocidad de 60 °C/h. Mantener la temperatura a 850 °C durante 1,5 h, y luego enfriar el horno a temperatura ambiente a una velocidad de 60 °C/h.
3. Limpieza de Pd
- Prepare una solución de limpieza combinando 10 ml de ácido nítrico, 20 ml de peróxido de hidrógeno al 30% (v / v) y 10 ml de agua desionizada.
PRECAUCIÓN: El ácido nítrico es corrosivo, oxidante y tóxico. El peróxido de hidrógeno es corrosivo, oxidante y dañino. - Sumerja las láminas de Pd recocido en la solución de limpieza hasta que el burbujeo vigoroso disminuya o la solución se vuelva amarilla (20-30 min).
- Enjuague las láminas de Pd dos veces con agua DI y una vez con alcohol isopropílico, y luego séquelas con aire.
4. Conjunto del reactor (Figura 2, de izquierda a derecha)
- Ensamble el reactor intercalando la membrana de Pd entre dos mitades de una celda H electroquímica.
- Coloque una junta resistente a productos químicos entre el lado izquierdo de la célula y la membrana de Pd.
- Coloque una junta adicional resistente a productos químicos entre la membrana de Pd y el lado derecho de la celda electroquímica.
- Selle la configuración de celda resultante con un clip.
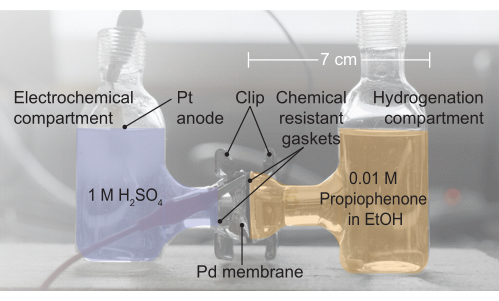
Figura 2: Una imagen del ensamblaje de células H. El compartimento electroquímico contiene 1 electrolito MH2SO4; Aquí es donde se produce la oxidación del agua. La membrana de paladio separa las dos mitades de la célula H, y las juntas proporcionan un sello sin fugas. El compartimento de hidrogenación contiene 0,01 M propiofenona en etanol (EtOH). Haga clic aquí para ver una versión más grande de esta figura.
5. Electrodeposición de Pd
- Preparar una solución de galvanoplastia disolviendo PdCl2 en HCl 1 M para alcanzar una concentración de 15,9 mM.
PRECAUCIÓN: PdCl2 es dañino y corrosivo. HCl es corrosivo y un irritante. - Ensamble el reactor usando una lámina de Pd limpia del paso 3.
- Llene el compartimento electroquímico del reactor con 24 ml de la solución galvanoplastia preparada y deje vacío el compartimiento de hidrogenación.
- Coloque un ánodo de malla Pt y un electrodo de referencia Ag/AgCl en la solución del compartimento electroquímico.
- Conecte los electrodos a un potenciostato, y aplique un potencial de -0,2 V frente a Ag/AgCl a la lámina de Pd hasta que haya pasado una carga de 15 C.
- Desmonte el reactor, enjuague la membrana de Pd resultante dos veces con agua desionizada y una vez con alcohol isopropílico, y luego seque la membrana bajo una corriente de aire oN2. La membrana de Pd ahora tendrá una deposición visible de negro de Pd en la superficie que fue expuesta a la solución de galvanoplastia.
6. Configuración del reactor Atm-MS
- Ensamble el reactor como se indica en el paso 4. Llene el compartimento electroquímico con 1 M H2SO4 y llene el compartimiento de hidrogenación con etanol. No agregue materia prima de hidrogenación.
PRECAUCIÓN: ElH2SO4 es dañino y corrosivo. El etanol es inflamable, dañino y un peligro para la salud. - Sumerja un contraelectrodo Pt en el electrolito. Conecte el electrodo contador de Pt y la membrana de Pd a una fuente de alimentación utilizando pinzas de cocodrilo. Conecte el contraelectrodo Pt como electrodo positivo y la membrana de Pd como electrodo negativo.
- Aplicar una corriente constante de 25 mA.
7. Configuración del instrumento Atm-MS
- Encienda el interruptor de encendido en la parte posterior de la unidad ATM-MS, justo debajo del cable de alimentación.
- Presione el botón de la bomba en la parte delantera para encender la bomba (se iluminará en azul cuando esté encendida). Luego, encienda la chaqueta para hornear (interruptor redondo verde, la luz se encenderá).
- Encienda el canal capilar que se utilizará (interruptores redondos rojos junto a los canales, la luz se encenderá). Compruebe que el canal utilizado esté encendido sintiendo que el tubo se está calentando.
NOTA: El LED verde junto a "vac ok" se encenderá a los pocos minutos de encender la bomba. Para apagar el sistema después de terminar los experimentos, apague todos los interruptores que se han encendido. - Conecte la salida de la célula de hidrogenación a los capilares atm-MS. Esta conexión debe ser hermética.
8. Configuración del software Atm-MS
- Haga clic en el acceso directo del escritorio del servicio . Ir a Configuración | SEM/Control de emisiones, y marque las casillas tanto para SEM como para emisiones. Pulse OK. Cierre la ventana de servicio.
- Haga clic en el acceso directo Medir y vaya a Secuencia | Ejecutar.
- Rellene los siguientes parámetros: Medidas = 30, Tiempo de purga = 30 s. Presione Administrador de archivos y cree una carpeta para guardar los datos de salida. Estos ajustes tomarán 30 mediciones con un tiempo de purga de 30 s entre cada conjunto de medición; Esto se puede cambiar si es necesario.
- A continuación, se abrirá el archivo de mediciones MID. Seleccione Administración de archivos y abra un programa para medir la señal de espectrometría de masas para m / z = 2. Esta señal corresponde a la corriente iónica deH2+, la forma ionizada del gas hidrógeno.
- Pulse OK para iniciar el programa. No cierre la ventana de medición, ya que esto detendrá el funcionamiento del instrumento.
- Después de que la señal se haya estabilizado (1-3 h), desconecte el capilar atm-MS del compartimiento de hidrogenación y conéctelo al compartimiento electroquímico.
- Guarde los datos y finalice el experimento cuando la señal del compartimiento electroquímico se haya estabilizado (unos 30 minutos).
- Calcule el porcentaje de permeación de hidrógeno a través de la membrana de Pd utilizando la Ecuación 1.
9. Hidrogenación electroquímica
- Ensamble el reactor de acuerdo con el paso 4.
- Llene el compartimento electroquímico con 24 ml de 1 M H2SO4.
- Inserte un contraelectrodo Pt en el compartimento electroquímico a través de la abertura del contraelectrodo. Conecte el electrodo contador de Pt al terminal positivo de una fuente de alimentación y conecte la membrana de Pd al terminal negativo a través de la cinta Cu.
- Aplicar una corriente galvanostática de 25 mA (corresponde a 40 mA/cm2) a través de la celda durante 15 min. El voltaje leerá entre 3 V y 5 V.
- Después de que hayan pasado 15 minutos, llene el compartimiento químico con 24 ml de solución de reacción (por ejemplo, 0,01 M de propiofenona en etanol). Mantener la corriente galvanostática durante la adición de reactivos.
NOTA: Muestree la solución de reacción inicial antes de añadirla al reactor. Consulte el paso 9.6.
PRECAUCIÓN: La propiofenona es perjudicial. - Muestrear el compartimento químico periódicamente (por ejemplo, cada 15 min) tomando 30 μL de solución de reacción del compartimento químico usando una micropipeta y disolviendo la muestra en 1 ml de diclorometano. Almacene las muestras en viales GC-MS hasta que se complete la reacción.
PRECAUCIÓN: El diclorometano es dañino y un peligro para la salud.
10. Cromatografía de gases-espectrometría de masas
- Cargue los viales de muestra en la bandeja de muestreo automático.
- Inicie el software GC-MS haciendo clic en el icono verde de Masshunter .
- Haga clic en Secuencia | Editar secuencia para abrir la ventana de edición de secuencias. Rellene en el gráfico los nombres de muestra deseados, el vial (posición en la bandeja de muestreo automático), la ruta del método, el archivo del método, la ruta de datos y el archivo de datos. Establezca el tipo de muestra en "muestra" y la dilución en 1, y asegúrese de que el archivo de datos coincida con el nombre de la muestra.
- Ajuste el método haciendo clic en Método | Edite todo el método.
- Asegúrese de que se comprueben tanto la información del método como la adquisición del instrumento . Haga clic en Aceptar. Agregue comentarios de método (si lo desea).
- Asegúrese de que se verifiquen la adquisición de datos y el análisis de datos. Deje todos los demás campos en blanco. Haga clic en Aceptar.
- Asegúrese de que la entrada de la muestra esté establecida en GC y la fuente de inyección esté establecida en GC ALS. Marque la casilla Usar MS. Asegúrese de que la ubicación de entrada esté establecida en Front y que MS esté conectado a Front. Haga clic en Aceptar.
- En la pestaña Entrada , asegúrese de que la temperatura del calentador esté a 250 °C. Ajuste la presión a 7.2 psi y el flujo He a 23.1 ml / min.
- En la pestaña Horno, ajuste la temperatura inicial a 50 °C y manténgala durante 1 min. A continuación, ajuste la velocidad de rampa a 25 °C/min y la temperatura a 200 °C, y manténgala durante 0 min. Haga clic en Aceptar.
- Asegúrese de que no se compruebe ninguna de las señales de visualización. Haga clic en Aceptar.
- Ajuste el retardo del disolvente a 2,50 min. Haga clic en Aceptar.
- Asegúrese de que los monitores seleccionados incluyan lo siguiente: temperatura del horno GC, temperatura F de entrada GC, presión F de entrada GC, cal de flujo GC columna 2, voltios MS EM, fuente MS MS, MS MS quad. Haga clic en Aceptar.
- Guarde el método con el nombre de método deseado.
- Inicie la secuencia haciendo clic en Secuencia | Secuencia de inicio | Secuencia de ejecución.
- Cuando se complete la secuencia, vea los datos abriendo el software Masshunter y haciendo clic en el nombre del archivo que se programó en el paso 10.3.
- Identifique los picos de productos haciendo clic en Spectrum | Informe de búsqueda en la biblioteca para comparar los espectros de masas adquiridos con la base de datos del NIST.
- Calcule la composición relativa de los materiales y productos de partida utilizando la Ecuación 2.
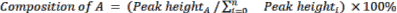 (Ec. 2)
(Ec. 2)
donde A es el componente químico de interés, y n es el número de componentes medido por GC-MS. Un ejemplo es el siguiente: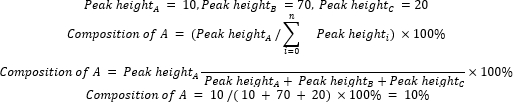
Resultados
Atm-MS se utiliza para medir la corriente iónica del hidrógeno que se produce en el reactor de membrana. Podemos usar estas mediciones para cuantificar cuánto hidrógeno penetra a través de la membrana de Pd durante la electrólisis. Primero, se mide el hidrógeno que evoluciona desde el compartimiento de hidrogenación (Figura 3, a la izquierda de las líneas punteadas). Cuando la señal alcanza un estado estacionario, el canal se cambia al compartimiento electroquímico. El gasH2<...
Discusión
La membrana de Pd permite la permeación de hidrógeno y la hidrogenación química. La preparación de esta membrana es, por lo tanto, importante para la eficacia del reactor de membrana. El tamaño de la membrana de Pd, la cristalografía y la superficie se ajustan para mejorar los resultados experimentales. Aunque el metal Pd puede desarrollar hidrógeno en cualquier espesor, las membranas de Pd se enrollan a 25 μm. Esta estandarización del espesor de la membrana asegura que el tiempo que tarda el hidrógeno en pene...
Divulgaciones
Se han presentado y publicado solicitudes de patente basadas en la tecnología descrita en este trabajo: Berlinguette, C. P.; Sherbo, R. S. "Métodos y aparatos para realizar reacciones químicas y electroquímicas" Solicitud de patente estadounidense N.º 16964944 (PCT presentada en enero de 2019, entrada nacional julio de 2020), publicación N.º US20210040017A1 (publicada en febrero de 2021). Solicitud de patente canadiense N.º 3089508 (PCT presentada en enero de 2019, entrada nacional en julio de 2020), Publicación N.º CA3089508 (publicada en agosto de 2019). Datos de prioridad: Solicitud de patente provisional de EE.UU. n.º 62/622.305 (presentada en enero de 2018).
Agradecimientos
Agradecemos al Consejo Canadiense de Investigación de Ciencias Naturales e Ingeniería (RGPIN-2018-06748), la Fundación Canadiense para la Innovación (229288), el Instituto Canadiense de Investigación Avanzada (BSE-BERL-162173) y las Cátedras de Investigación de Canadá por su apoyo financiero. Esta investigación se llevó a cabo gracias en parte a la financiación del Canada First Research Excellence Fund, Quantum Materials and Future Technologies Program. Agradecemos a Ben Herring en el UBC Shared Instrument Facility por su ayuda con el desarrollo del instrumento y el método GC-MS. Monika Stolar por sus contribuciones al desarrollo y edición de este manuscrito. Finalmente, agradecemos a todo el Grupo Berlinguette de la Universidad de Columbia Británica por su continuo apoyo y colaboración en el estudio del reactor de membrana.
Materiales
| Name | Company | Catalog Number | Comments |
| Ag/AgCl Reference Electrode | BASi research products | MW-2021 | Reference electrode |
| Analytical Balance | Cole-Parmer | RK-11219-03 | Instrument |
| Atmospheric Mass Spectrometer | ESS CatalySys | NA | Instrument |
| Bench Power Supply | Newark | 1550 | Instrument |
| Conductive Copper Foil Electrical Tape | McMaster Carr | 76555A711 | Electrochemical cell assembly |
| Dichloromethane | Sigma Aldrich | 270997 | Reagent |
| Electric Rolling Press with Dual Micrometer | MTI Corporation | MR100A | Equipment |
| Electrochemical glass H-cell | University of British Columbia glass blowing | NA | Electrochemical cell assembly |
| ESS catalysis QUADSTAR | ESS CatalySys | NA | Software |
| Ethanol | Sigma Aldrich | 493511 | Reagent |
| Flat Rolling Mill | Pepetolls | 18700A | Equipment |
| Gas Chromatography Mass Spectrometer | Agilent | NA | Instrument |
| GC-MS vial | Agilent | 5067-0205 | Vial for GC-MS |
| Hexanes | Sigma Aldrich | 1.0706 | Reagent |
| Hydrochloric Acid | Sigma Aldrich | 258148 | Reagent |
| Hydrogen peroxide solution (30% v/v) | Sigma Aldrich | H1009 | Reagent |
| Isopropyl Alcohol | Sigma Aldrich | W292907 | Reagent |
| Masshunter Aquisition Software | Agilent | G1617FA | Software |
| Micropipette (100 µL - 1000 µL) | Gilson | F123602 | instrument |
| Micropipette (20 µL - 200 µL) | Gilson | F123601 | Instrument |
| Mitutoyo Digital Micrometer | Uline | H-2780 | Instrument |
| Muffle Furnace | MTI Corporation | KSL-1100X | Equipment |
| Nitric acid | Sigma Aldrich | 438073 | Reagent |
| Nitrogen gas | Sigma Aldrich | 608661 | Reagent |
| Palladium (II) Chloride | Sigma Aldrich | 520659 | Reagent |
| Pd wafer bar, 1 oz, 99.95% | Silver Gold Bull. | NA | Reagent |
| Platinum Auxiliary Electrode | BASi research products | MW-1032 | Anode |
| Potentiostat | Metrohm | PGSTAT302N | Instrument |
| Propiophenone | Sigma Aldrich | P51605 | Reagent |
| Proton Exchange Membrane, Nafion 212 | Fuel cell store | NA | Electrochemical cell assembly |
| Sulfuric acid | Sigma Aldrich | 258105 | Reagent |
Referencias
- Rytter, E., Hillestad, M., Austbø, B., Lamb, J. J., Sarker, S., Lamb, J. J., Pollet, B. G. Chapter six - Thermochemical production of fuels. Hydrogen, Biomass and Bioenergy. , 89-117 (2020).
- Arpe, H. -. J. . Industrial Organic Chemistry. , (2017).
- Orella, M. J., Román-Leshkov, Y., Brushett, F. R. Emerging opportunities for electrochemical processing to enable sustainable chemical manufacturing. Current Opinion in Chemical Engineering. 20, 159-167 (2018).
- May, A. S., Biddinger, E. J. Strategies to control electrochemical hydrogenation and hydrogenolysis of furfural and minimize undesired side reactions. ACS Catalysis. 10 (5), 3212-3221 (2020).
- Tang, B. Y., Bisbey, R. P., Lodaya, K. M., Toh, W. L., Surendranath, Y. Reaction environment impacts charge transfer but not chemical reaction steps in hydrogen evolution catalysis. ChemRxiv. , (2022).
- Iwakura, C., Yoshida, Y., Inoue, H. A new hydrogenation system of 4-methylstyrene using a palladinized palladium sheet electrode. Journal of Electroanalytical Chemistry. 431 (1), 43-45 (1997).
- Inoue, H., Abe, T., Iwakura, C. Successive hydrogenation of styrene at a palladium sheet electrode combined with electrochemical supply of hydrogen. Chemical Communications. , 55-56 (1996).
- Conde, J. J., Maroño, M., Sánchez-Hervás, J. M. Pd-based membranes for hydrogen separation: Review of alloying elements and their influence on membrane properties. Separation and Purification Reviews. 46 (2), 152-177 (2017).
- Wicke, E., Brodowsky, H., Züchner, H., Alefeld, G., VÖlkl, J. Hydrogen in palladium and palladium alloys. Hydrogen in Metals II. Topics in Applied Physics., edited by Alefeld, G., Völkl, J. 29, (1978).
- Sato, T., Sato, S., Itoh, N. Using a hydrogen-permeable palladium membrane electrode to produce hydrogen from water and hydrogenate toluene. International Journal Hydrogen Energy. 41 (12), 5419-5427 (2016).
- Sherbo, R. S., Delima, R. S., Chiykowski, V. A., MacLeod, B. P., Berlinguette, C. P. Complete electron economy by pairing electrolysis with hydrogenation. Nature Catalysis. 1, 501-507 (2018).
- Sherbo, R. S., Kurimoto, A., Brown, C. M., Berlinguette, C. P. Efficient electrocatalytic hydrogenation with a palladium membrane reactor. Journal of American Chemical Society. 141 (19), 7815-7821 (2019).
- Kurimoto, A., Sherbo, R. S., Cao, Y., Loo, N. W. X., Berlinguette, C. P. Electrolytic deuteration of unsaturated bonds without using D2. Nature Catalysis. 3, 719-726 (2020).
- Jansonius, R. P., et al. Hydrogenation without H2 using a palladium membrane flow cell. Cell Reports Physical Science. 1 (7), 100105 (2020).
- Huang, A., et al. Electrolysis can be used to resolve hydrogenation pathways at palladium surfaces in a membrane reactor. Journal of American Chemical Society Au. 1 (3), 336-343 (2021).
- Delima, R. S., et al. Selective hydrogenation of furfural using a membrane reactor. Energy and Environmental Science. 15 (1), 215-224 (2021).
- Sato, T., Takada, A., Itoh, N. Low-temperature hydrogenation of toluene by electrolysis of water with hydrogen permeable palladium membrane electrode. Chemistry Letters. 46 (4), 477-480 (2017).
- Maoka, T., Enyo, M. Overpotential decay transients and the reaction mechanism on the Pd-H2 electrode. Surface Technology. 8 (5), 441-450 (1979).
- Kurimoto, A., et al. Physical separation of H2 activation from hydrogenation chemistry reveals the specific role of secondary metal catalysts. Angewandte Chemie International Edition. 60 (21), 11937-11942 (2021).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoExplorar más artículos
This article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados