Method Article
使用小鸡胚胎大脑作为人类胶质母细胞瘤细胞行为的 体内 和 离体 分析模型
摘要
鸡胚胎用于研究卵和离体脑切片共培养物中的人胶质母细胞瘤(GBM)脑肿瘤。GBM细胞行为可以通过离体共培养的延时显微镜记录,并且两种制剂都可以通过详细的3D共聚焦分析在实验终点进行分析。
摘要
雏鸡胚胎一直是研究脊椎动物发育的理想模型系统,特别是对于实验操作。雏鸡胚胎的使用已被扩展到研究 体内 人胶质母细胞瘤(GBM)脑肿瘤的形成以及肿瘤细胞对周围脑组织的侵袭性。GBM肿瘤可以通过将荧光标记的细胞悬浮液注射到 蛋中的E5中脑(视顶)脑室中来形成。
根据GBM细胞的不同,紧凑的肿瘤在脑室和脑壁内随机形成,细胞群侵入脑壁组织。可以对带有肿瘤的固定E15 tecta的厚组织切片(350μm)进行免疫染色,以揭示通过共聚焦z-stack图像的3D重建进行分析时,入侵细胞通常沿血管迁移。活E15中脑和前脑切片(250-350μm)可以在膜插入物上培养,其中荧光标记的GBM细胞可以引入非随机位置以提供 离体 共培养以分析细胞侵袭,这也可以沿着血管发生,在大约1周的时间内。这些 离体 共培养可以通过宽场或共聚焦荧光延时显微镜进行监测,以观察活细胞的行为。
然后,可以通过共聚焦显微镜固定,免疫染色和分析共培养的切片,以确定侵袭是否沿着血管或轴突发生。此外,共培养系统可用于研究潜在的细胞间相互作用,方法是将不同细胞类型和颜色的聚集体放置在不同的精确位置并观察细胞运动。药物治疗可以在 离体 培养物上进行,而这些治疗与 卵内 系统不兼容。这两种互补的方法允许在高度可操纵的脊椎动物大脑环境中对人类GBM细胞行为和肿瘤形成进行详细和精确的分析。
引言
癌细胞行为的体外研究通常用于剖析在体内异种移植模型中观察到的更复杂的行为期间操作的潜在机制。例如,对于胶质母细胞瘤(GBM),体外研究揭示了L1CAM在新型鸡胚胎异种移植脑肿瘤模型1,2,3,4,5中肿瘤形成和脑浸润期间潜在运作的机制。尽管体外和体内实验以有用的方式相互补充,但它们在结果如何关联方面留下了很大的差距。例如,培养皿上GBM细胞运动的机制分析是一种高度人工的情况,体内异种移植模型只能揭示肿瘤形成和细胞行为的静态时间点或终点分析。在这些异种移植模型中,使用啮齿动物或小鸡胚胎的体内研究不容易监测细胞行为,而细胞侵入脑组织。然而,雏鸡胚胎异种移植模型已经证明粘附蛋白L1CAM在人T98G GBM细胞的侵袭能力中起刺激作用2,5。
通过使用器官型脑切片培养模型(称为离体模型)桥接体内和体外方法,可以解决这个问题的合适解决方案。在这个离体模型中,活的脑组织可以保持在几百微米的厚度长达几周,从而可以植入癌细胞,随着时间的推移观察它们在实际组织中的行为,然后在实验终点进行更详细的标记分析。
一种流行的器官型切片培养方法是在半透明或透明的多孔膜上培养几百微米厚的脑切片,使组织暴露在空气中,但允许营养培养基从膜下方维持组织(参考Stoppini等人6)。该方法的不同变体已用于不同的研究,包括使用不同的培养基或不同的膜插入物。不同的膜插入物包括直径为30 mm的多孔(0.4 μm)膜插入物,装在35 mm培养皿6中,以及用于6孔板7的细胞培养插入物(0.4 μm)。不同的培养基包括 50% MEM/HEPES + 25% 热灭活马血清 + 25% 汉克斯平衡盐溶液 (HBSS)8、50% 还原血清培养基 + 25% 马血清 + 25% HBSS9 等。如果半透明或透明膜与荧光标记的GBM细胞一起使用,则可以使用倒置宽场或共聚焦荧光显微镜10,11,12,13,14,15从下方成像此类培养物。
虽然许多体内原位脑肿瘤异种移植和离体器官型脑切片培养模型已经使用啮齿动物建立,但如上所述,雏鸡胚胎(Gallus gallus)在这些目的上的利用不足。然而,雏鸡胚胎已被证明能够用作体内原位异种移植模型,用于研究人和大鼠胶质瘤侵袭1,2,5。异种移植细胞进入鸡胚胎大脑表现出与啮齿动物模型中观察到的相似的入侵模式,进一步支持使用鸡胚胎作为GBM肿瘤细胞分析的体内模型。雏鸡胚胎也便宜,比啮齿动物更容易维护(即,在实验室培养箱中的蛋壳中),并且更容易使用,使其成为短期体内GBM研究的有吸引力的选择。最近的一篇文章描述了在正常大脑发育过程中使用小鸡胚胎脑切片培养物形成和生长轴突,其中切片至少存活7天16。然而,缺乏使用这种鸡胚胎脑切片培养物在组织环境中对GBM细胞行为进行离体分析。本文描述了人GBM细胞和GBM干细胞(GSCs)在体内移植到早期鸡胚胎脑中,以及将GBM细胞引入活鸡胚胎脑切片培养物的离体。还提供了从这些制剂中获得的所得肿瘤和细胞侵袭模式的一些代表性实例。
研究方案
特拉华大学不需要许可或批准即可进行这项工作。
1.GBM细胞注射到雏鸡视顶
- 注射用GSC和GBM细胞的制备
- 在GSC培养基中培养GSC(表1)。培养物在GBM培养基中建立了GBM细胞系(表1)。
- 用无菌磷酸盐缓冲盐水(PBS)冲洗平板上的细胞,并将1mL胰蛋白酶溶液放入10厘米的培养皿中。在细胞培养箱中放置2-3分钟,直到细胞开始分离。
- 通过将 10 mL 适当的含血清培养基添加到 10 cm 培养皿中来灭活胰蛋白酶,并通过上下移液分离细胞。将细胞悬液放入 15 mL 锥形离心管中。
- 通过在4°C下以800× g 离心5分钟来沉淀细胞。
- 使用连接到侧臂烧瓶和真空泵的一次性精细玻璃移液管从细胞沉淀中吸出培养基。将细胞重悬于适当的生长培养基中至每微升10,000个细胞的浓度,并置于冰上的微量离心管或小螺旋盖管中。
- 将细胞与少量无菌 1% Fast Green FCF 染料混合(使用 5 μL 染料/100 μL 细胞悬液的比例)。
- 将GBM细胞注射到 蛋中的E5视顶。见 补充图1。
- 将受精鸡蛋在加湿的鸡蛋孵化器中孵育,尖头朝下,温度为37.5°C( 孵化的第1 天是胚胎第0天[E0])。在孵育的第6天(E5),喷洒70%乙醇对蛋壳进行消毒。
- 使用鸡蛋烛台,用铅笔沿着胚胎上方的空气空间的周边描摹,并用透明胶带覆盖轮廓区域。
- 使用弯曲的剪刀,在描边周围轻轻剪开,注意不要切入胚胎膜或血管,并丢弃蛋壳的顶部。
- 将几滴盐水或细胞培养基滴在气空间膜上以使其润湿,使其易于分离。使用细镊子,小心地刺穿胚胎顶部的气空间膜,将其取出,然后找到雏鸡胚胎的头部。
- 使用细镊子抓住紧邻胚胎的透明羊膜来定位头部,以便可以将细胞注射到视顶。用一只手握住羊膜,在注射过程中将头部保持在适当的位置。注意不要损坏蛋黄上绒毛膜尿囊膜中的胚胎外血管。
注意:上述程序需要一些练习才能有效地抓住紧密围绕胚胎的透明羊膜,因为在被抓住和拉动之前它是不可见的。练习使用细镊子抓住立即围绕胚胎的透明羊膜。 - 用细镊子夹住羊膜,使头部保持稳定。使用玻璃微量移液器和气动皮泵,将大约 50,000 个细胞在 5 μL 合适的细胞培养基中注入视顶(5 μL 约为填充微量移液器的 1/2)。
注意:参见Cretu等人1 ,以获取注射了与染料混合的GBM细胞的E5胚胎的图像。 - 将几滴50mg / mL氨苄青霉素放在胚胎顶部。
- 用透明胶带盖住鸡蛋顶部的孔,并留在加湿器中直到E15进行解剖。
2. 从 E15 胚胎中解剖大脑区域
注意:此处用于固定的E15大脑解剖类似于步骤8.2中描述的活脑切片,但此处的解剖不必在无菌条件下进行。
- 剪掉壳顶部周围的胶带,以便进入胚胎。
- 将胚胎在颈部斩首,然后将头部放入10厘米的培养皿中,并装有无菌无钙和无镁的Tyrodes(CMF Tyrode)溶液。见 补充图2。
- 使用细镊子,剥开覆盖大脑的皮肤,露出下面的硬脑膜。去除大脑左侧和右侧正在形成的颅骨。正在形成的颅骨尚未覆盖大部分大脑。
- 轻轻地用细尖的镊子撕开覆盖在大脑中心的脑膜,并将其剥离到两侧以露出大脑。
- 用弯曲的镊子从下面舀出大脑,然后轻轻地将其从腔中拉出。
- 将大脑解剖成部分:前脑,tecta,小脑。
- 使用细镊子从 tecta 中取出上覆的软脑膜。请注意,软脑膜很容易与 tecta 分离,但不能与前脑或小脑分离。通过触摸前脑或将其卷在一小张滤纸上来去除前脑的软脑膜。
- 将解剖的大脑区域放在一个小盘子里。
- 将用于固定的脑区域置于24孔板孔中,并在0.1M二甲胂酸钠缓冲液中固定在2%多聚甲醛(PFA)中。在4°C下放置至少24小时。
- 固定后,在嵌入琼脂之前,用 3x PBS 冲洗组织至少 1 小时。
3. 嵌入和切片收获的大脑区域
- 在PBS中预热3.5%琼脂和8%蔗糖的溶液直至熔化并保持在熔化温度。
- 使用弯曲的镊子作为勺子,轻轻地拿起雏鸡胚胎大脑的视顶或前脑区域,并在滤纸上轻轻吸干以去除多余的液体,以确保琼脂粘附在脑外表面。
- 使用无菌转移移液器,用琼脂溶液填充模具。
注意:可以通过在适当尺寸的物体周围形成铝箔来制作简单的模具,例如小矩形金属振动组织切片块。 - 将大脑区域放入琼脂中,让琼脂完全凝固。
- 从嵌入的大脑周围取下铝箔,并使用剃须刀片或手术刀修剪侧面多余的琼脂。
- 将一滴氰基丙烯酸酯胶水放在切片托盘的不锈钢方块上,将带有大脑的琼脂糖块放在胶水上,让胶水粘合1分钟。将托盘放入振动组织切片机卡盘中,拧紧并用足够的PBS填充托盘以覆盖琼脂块的顶部。
- 使用钢剃须刀片在350μm厚的振动组织切片机上切割脑切片。
- 当脑切片被切割并自由漂浮到切片托盘中时,使用刮刀从托盘中舀起并取出切片。轻轻地将切片从刮刀上滑落,并用PBS将其放入带有标签的10厘米培养皿中,使切片自由漂浮。
注意:如果大脑在嵌入前没有用滤纸充分吸干以去除多余的液体,则脑切片周围的琼脂可能会脱落。如果发生这种情况,可以从固化的琼脂中轻轻地去除脑组织,并在适当印迹多余的液体后重新包埋。
4. 用肿瘤细胞对脑切片进行免疫染色
- 使用配备落射荧光的体视显微镜,逐个筛选10cm培养皿中的单个切片是否存在肿瘤细胞。
- 用0.1%Triton X-100和5%正常山羊血清(PBSTG)(见 表1)制备足量的磷酸盐缓冲盐水进行免疫染色,并冲洗要免疫染色的切片。
- 在 24 孔板中半填充孔,该板将用于用 PBS 染色脑切片。
- 用刮刀或手术刀的边缘修剪掉脑切片周围的琼脂角,然后轻轻地将它们放入含有PBS的孔中。
- 吸出 PBS 并用 350 μL PBSTG 中的一抗染色溶液(例如,2 μg/mL UJ127 在 PBSTG 中)替换。
- 在冷室中轻轻搅拌孵育24小时,以便看到切片在孔内自由移动。
- 24小时后,除去一抗溶液,并在冷藏室中搅拌用PBSTG冲洗3 x 1小时。
- 冲洗完成后,在 PBSTG 中孵育 350 μL/孔的二抗染色溶液(例如,在 PBSTG 中生物素-GAM 的 1/200 稀释度)。在冷藏室中搅拌孵育20小时。
注意:如果放弃三级步骤并在此步骤中与含荧光染料的二抗一起孵育,请在孵育过程中盖上盖子避光,然后跳至步骤4.11。 - 取出二抗溶液,在冷藏室中搅拌在PBSTG中冲洗3 x 1小时。
- 取出 PBSTG 并在叔溶液中孵育(例如,Alexa Fluor 647 链霉亲和素在 PBSTG 中以 1:250 稀释度)。如果需要,通过在混合物中加入0.1μg/ mL双苯甲酰亚胺对细胞核进行染色。在冷藏室中搅拌孵育20小时。
- 除去叔溶液,在冷室中搅拌在PBSTG中冲洗3 x 1小时。
- 留在PBS中,直到准备好安装在显微镜载玻片上。
5. 在显微镜载玻片上安装切片
- 准备尽可能多的显微镜载玻片,因为要安装的部分。
- 对于每张载玻片,将一条 50 毫米长的 10 密耳(254 μm)厚的乙烯基电工胶带放在一块封口膜上。
- 使用 1 cm x 1 cm 方孔打孔器,在电工胶带和封口膜的中心打一个孔。
- 从封口膜上拉下胶带并将其放在显微镜载玻片的顶部,为载玻片上的标记胶带留出空间。
- 使用微量移液器,将一滴或两滴防褪色安装介质放入电工胶带中心的方孔中。
- 使用弯曲的刮刀从PBSTG中取出所需的振动组织切片机部分,并用干净的实验室湿巾或滤纸彻底吸走水分。
- 将切片的边缘触摸到封片剂滴,然后用另一把刮刀将切片轻轻滑入封片剂中。
- 再滴几滴封片剂覆盖该切片,并小心地将 24 mm x 30 mm(#1.5 厚)盖玻片放在切片和封片剂的顶部。
- 用指甲油密封盖玻片的边缘以将其固定到位。
6. 固定脑切片的共聚焦显微镜
- 使用宽场荧光,使用适当的物镜和滤光片组在安装的脑切片中查找荧光肿瘤。
注意:有些肿瘤可能非常大,使用4倍物镜很容易看到,而单细胞可能需要10倍物镜。 - 使用适当的物镜、激光器、针孔尺寸和检测器设置切换到共聚焦显微镜。要遵循此协议,请使用20倍物镜(数值孔径[N.A.] = 0.75)进行常规成像,使用60倍油物镜(N.A.= 1.40)进行高分辨率成像。
- 设置z轴的上限和下限以及步长(根据共聚焦显微镜制造商的说明针对具体情况)以获取光学切片。获取光学切片的 z 堆栈。
- 根据制造商的说明,使用共聚焦显微镜软件创建肿瘤的3D体积渲染。
7. 球体制备
- 创建聚(2-羟乙基甲基丙烯酸酯)(聚HEMA)板
- 在 95% 乙醇中制备 10 μg/mL 聚血红素的溶液,并用 1 mL 该溶液涂覆 35 mm 培养皿(或细胞培养皿)。
- 让盘子在室温下放在未覆盖的摇杆上过夜,以形成盘子表面的涂层。
注意:溶剂会蒸发并在培养皿上留下半透明的涂层,这可能看起来不均匀,但这不会影响制作细胞球状体的能力。 - 干燥后,在生物安全柜中的紫外线下对打开的培养皿进行消毒1小时。灭菌后盖上盖子。涂层培养皿现已准备就绪,可供使用。
- 用于延时显微镜的荧光 DiD 染色
注意:本节用于用DiD荧光染料对单个细胞进行染色,以用于制造球状体,从而优化实时延时成像的细胞运动可视化。- 将细胞悬浮在无血清培养基中。
- 加入 5 μL DiD 原液/mL 细胞悬液,并通过移液轻轻混合。在37°C孵育20分钟。
- 将标记的细胞悬液在5°C下以800× g 离心5分钟。
- 吸出上清液并将细胞重悬于温热培养基中冲洗。
- 重复此离心并再冲洗两次。
注意:如果需要,请跳到步骤 7.3.6,在此过程后立即制作椭球体。
- 制作细胞球体
- 将0.25%胰蛋白酶/乙二胺四乙酸(EDTA)溶液加热至37°C。
- 在GSC培养基17(表1)中培养GSC,在U-118培养基中培养U-118恶性肾小球(MG)细胞(见表1)。使用汇合的 10 cm 培养皿制备一块 35 mm 的球体板。最初向 GSC 中添加 bFGF(10 ng/mL 终浓度)和 TGF-α(20 ng/mL 最终浓度)生长因子,然后每 3 天加入一次。
注意:当前研究中使用的细胞是绿色GSC15-2 / K72,绿色GSC16-4 / K72,红色U-118 / L1LE / mCherry2x和红色U-118 / 1879 / mCherry2x。一块球状体板应该足以用于膜插入物上的两个 6 孔脑切片板。 - 用无菌PBS冲洗平板上的细胞,并将1mL胰蛋白酶溶液放入10厘米的培养皿上。放入细胞培养箱中2-3分钟,直到细胞开始分离。
- 通过将 10 mL 适当的含血清培养基添加到 10 cm 培养皿中来灭活胰蛋白酶,并通过上下移液分离细胞。将细胞悬液放入 15 mL 锥形离心管中。
- 通过在4°C下以800× g 离心5分钟来沉淀细胞。
- 从细胞沉淀中吸出培养基,并将细胞重悬于10 mL培养基中。
- 将 2 mL 细胞悬液放在每个 35 mm 聚乙烯 HEMA 包被的培养皿上,并再加入 2 mL 适当的培养基,以获得每培养皿 4 mL 的总培养基。如果使用GSC,请添加生长因子。
- 在细胞培养箱中孵育细胞,直到聚集体达到100-200μm的大小,这可能是1-2天,具体取决于所铺板细胞的密度。
8.活雏鸡胚胎脑解剖和 振动组织切片机
- 准备解剖
- 准备一个6孔聚酯膜插入板,在膜插入物下方装有1 mL脑切片培养基(见 表1)。
- 用70%乙醇对工作区域和工具进行消毒。
- 解剖时将6孔插入板放在冰上。
- 准备100 mL振动组织切片机切片介质(表1)并置于冰上。
- 将一瓶4%低熔点琼脂糖放入PBS中,置于水浴中,直到其融化成液体(约50°C)。
- 用冰块填充振动组织切片机桶。
- 无菌E14/15小鸡胚胎脑解剖术
- 使用鸡蛋烛台,用铅笔沿着 E14 或 E15 胚胎上方气穴的周边描摹,并用透明胶带覆盖轮廓区域。
- 使用弯曲或细剪刀,在描边区域周围轻轻剪开,注意不要切入胚胎膜或血管,并丢弃顶部的外壳。
- 使用弯曲的镊子,去除胚胎顶部的气隙膜并定位雏鸡胚胎的头部。
- 将胚胎斩首,并将头部放入装有冷无菌CMF溶液的10厘米培养皿中。见 补充图2。
- 使用无菌细钳,剥开覆盖大脑的皮肤,露出下面的硬脑膜。去除大脑左侧和右侧正在形成的颅骨。正在形成的颅骨尚未覆盖大部分大脑。
- 轻轻地使用细尖的镊子(#5或#55)撕开覆盖在大脑中心的脑膜,并将其剥离到两侧以露出大脑。
- 使用细弯曲的镊子,从底部前部舀起大脑,然后轻轻地将其从腔中拉出。
- 将大脑解剖成三个主要部分:前脑,中脑(视突),小脑。如果需要,请查阅雏鸡发育图谱。
- 使用细镊子从 tecta 中取出上覆的软脑膜。
注意:软脑膜很容易与前脑或小脑分离。软脑膜可以通过触摸或在无菌纱布上滚动来从前脑中取出。 - 将解剖的大脑区域放在冰上的小无菌盘中。
- 嵌入和切片大脑
- 使用弯曲的镊子作为勺子,轻轻拿起视顶或前脑区域,并在无菌纱布上轻轻吸干以去除多余的液体,以确保琼脂糖粘附在脑外表面。
- 使用无菌转移移液器,用低熔点琼脂糖填充模具。通过在适当大小的物体周围形成铝箔来准备一个简单的模具。通常使用小型矩形金属振动组织切片块作为对象。见 补充图3。
- 快速将大脑区域置于琼脂糖中,让它在冰上凝固(约4-5分钟)。
注意:在琼脂糖硬化之前,大脑可能会沉到模具底部。如果发生这种情况,等待1分钟让琼脂开始凝固,然后将大脑区域放入琼脂糖中。尝试将大脑区域直接悬浮在琼脂糖的中间。 - 从固化的琼脂糖中嵌入大脑周围取下铝箔,并使用无菌剃须刀片或手术刀修剪两侧多余的琼脂糖。
- 将一滴氰基丙烯酸酯胶水放在切片盘/托盘的不锈钢正方形上,将琼脂糖块与大脑一起放置,让胶水粘合 1 分钟。将培养皿/托盘放入振动组织切片机卡盘中,拧紧并用切片介质填充托盘以覆盖琼脂糖块的顶部。
- 使用蓝宝石刀在振动组织切片机上以 250-350 μm 切割切片,据报道,与钢剃须刀片相比,其活组织损伤更少。
- 当脑切片被切割并自由漂浮到切片托盘中时,使用无菌刮刀舀起切片并从托盘中取出。使用另一把无菌刮刀轻轻地将切片从刮刀上滑落到膜插入物上。
注意:通常,如果需要,可以将两个或三个脑切片放置在每个膜插入物上。如果大脑没有用无菌纱布充分吸干以去除多余的液体,脑切片周围的琼脂糖可能会脱落。如果在包埋前充分印迹后仍然发生这种情况,请轻轻拿起没有周围琼脂糖的切片并将其滑到膜插入物上。 - 将6孔脑切片板置于细胞培养箱中的膜插入物上,温度为37°C和5%CO2。
- 电镀后的第二天,使用无菌巴斯德移液器从插入物下方吸出培养基(插入物侧面有间隙,以便移液器能够接触到下面的培养基)。向膜插入物下方的每个孔中加入 1 mL 新鲜切片培养基。此后继续每隔一天更换一次媒体。
- 等待几天,让脑切片牢固地附着在膜插入物上,并似乎有些变平。这表明切片是可行的,并准备好引入GBM细胞。
9. GBM细胞引入脑切片
- 球体法
- 细胞球体尺寸达到 150-200 μm 后,使用设置为 5 μL 的 20 μL 微量移液器从培养皿中取出一到几个球体。见 补充图3。
- 轻轻地将带有球状体的培养基排出到所需的脑切片上。
注意:细胞球状体应在移液器吸头中可见。使用透明的移液器吸头将使它们更容易在吸头中看到。如果在释放液体时球体从脑切片上脱落,则应使用粘在薄木涂抹棒上的乙醇消毒睫毛轻轻地将球体推回脑切片上。 - 让球体在脑切片上培养2-5天。
注意:这里的限制似乎是切片中血管和脑细胞的最终降解。当对层粘连蛋白染色时,降解的血管将在切片中显示为不连续的球。
- 活检打孔法
- 通过在膜插入物上变平来允许脑切片附着(培养可能需要 2-5 天)。
- 在冰上解冻细胞基质。
- 在细胞培养生物安全柜中,将直径为1 mm的无菌活检打孔器连接到真空吸引器管。
- 用活检冲头轻轻触摸脑切片,在脑切片中心创建一个 1 毫米的孔。
注意:活检打孔器中的组织将通过真空吸入打孔器。 - 通过胰蛋白酶消化60%-70%汇合的10cm细胞培养皿并重悬于10mL培养基中来制备细胞基质悬浮液;然后,将该悬浮液的 1 mL 与 100 μL 的基质混合。
- 使用 20 μL 微量移液器,将 1 μL 细胞基质混合物放入脑切片的每个孔中。
- 细胞混合物放置完成后,将嵌入细胞的脑切片培养皿放回培养箱中,让基质凝固,细胞可能侵入周围的脑切片。
10. 宽场荧光延时显微镜
- 在 6 孔板的边缘周围放置可拆卸胶带以防止培养基蒸发,在一侧留出一个小间隙用于气体交换。
- 将板放置在倒置落射荧光显微镜上可调节自动载物台上的定制培养室中。
注意:使用气体注入控制器将腔室保持在5%CO2 和95%空气的大气条件下,并使用暖空气温度控制器和温控载物台插件将温度保持在37°C。参见Fotos等人18 ,了解此处使用的系统的详细信息。 - 使用合适的显微镜控制软件,创建一个延时采集计划,每10分钟收集一次感兴趣区域的荧光图像,持续20小时。
注意:如果在细胞中使用绿色荧光标记(例如,绿色荧光蛋白[GFP]),则使用可视化细胞所需的最小量的蓝色激发光以防止光毒性。由于波长较长,红色(例如,mCherry)和远红色(例如,DiD)标签似乎没有这种潜在问题。
11. 延时显微镜后脑切片的免疫染色
注意:该免疫染色方案针对用层粘连蛋白染色血管和用双苯甲酰亚胺染色细胞核进行了优化。对目标目标分子使用适当的抗体。
- 使用巴斯德移液管从膜插入物下方吸出培养基,并将 1 mL 的 2% PFA 置于插入物下方的 0.1 M 二甲胂酸钠缓冲液中,将 1 mL 置于插入物顶部以覆盖脑切片。让切片在4°C下固定过夜。
- 从膜插入物下方取出固定剂和脑切片上残留的任何固定剂(固定剂往往会通过膜插入物泄漏到下面的孔中)。
- 从 35 毫米孔中取出带有切片的插入物,并将它们放入更大的塑料培养皿中。
- 通过将 350 μL PBS 添加到与脑切片一样多的孔中来制备 24 孔板(免疫染色时为一个切片/孔)。
- 使用细刮刀,轻轻地从脑切片周围去除琼脂糖,不要将脑切片从膜插入物上分离。确保琼脂糖容易从脑切片的外边缘分离。如果没有,请将琼脂糖附着在脑切片上。
- 使用锋利的手术刀,切开脑切片周围的膜,直到带有下层膜的切片与插入物的其余部分脱落。用附着的脑切片捡起膜,用细镊子抓住膜,并将其放入PBS中24孔板的孔中。
- 在冷藏室中用PBS冲洗切片3倍超过1小时,不断轻轻搅拌或摇晃,使切片在孔内移动。
- 冲洗时,准备一抗溶液。
- 在PBSTG中将抗层粘连蛋白稀释至2μg/ mL(见 表1)。
- 从孔中取出PBS,并在冷藏室中轻轻搅拌的一抗溶液中孵育过夜。
- 孵育至少20小时后,吸出一抗溶液并在PBSTG中冲洗切片3x1小时。
- 冲洗时,制备二抗溶液。
- 用所需的特定荧光染料稀释荧光-GAM,在PBSTG中以1:200稀释,并加入0.1μg/mL浓度的双苯甲酰亚胺。
- 取出PBSTG并在冷藏室中孵育过夜,并在荧光二抗溶液中搅拌。
- 去除二抗并在PBSTG中冲洗1小时2次,在PBS中冲洗1小时冲洗1次。
- 留在PBS中,直到准备好安装在显微镜载玻片上(第5部分)并查看。
结果
这里展示的是多个图,显示了通过对视顶进行体内注射(图1和图2),培养活脑切片并评估其活力(图3),创建离体脑切片培养物和使用活检打孔方法植入荧光标记细胞(图4),通过在聚血红细胞中培养细胞来产生细胞球状体(图5)获得的一些代表性结果),创建与细胞球体的离体脑切片共培养,并使用4D共聚焦延时显微镜记录侵袭性细胞行为(图6),并分析球体相对于固定脑切片制剂中血管的侵袭性细胞行为(图7和图8)。这些结果绝不是详尽无遗的,而是提供了使用鸡胚胎大脑作为人类GBM研究的异种移植模型可以获得的很好的例子。
图1显示了注射表达GFP的GSC后在体内视盖形成的肿瘤的一些代表性结果。GSC附着在心室表面并在脑壁中形成浸润性肿瘤。GSC显然存在于血管附近,并且似乎正在沿着血管迁移。体内GSC肿瘤的固定和免疫染色切片的旋转3D体积渲染的电影在补充视频S1,补充视频S2,补充视频S3和补充视频S4中给出。 在该实验中,使用四种颜色来识别五个特征(绿色GSC,白色细胞核,白血管,蓝色整合素α-6和红色Sox2或红色巢蛋白)。
图2显示了注射表达GFP的GSCs与由于逆转录病毒载体转导而表达mCherry的U-118 / L1LE细胞2混合后在体内视顶形成的肿瘤的一些代表性结果。这些实验表明,当这些肿瘤由混合细胞悬浮液形成时,会发生分选,使得GSC位于外围或中心,而U-118细胞由内核心或外皮层组成,具体取决于特定的GSC系。
图3 显示了 离体 脑切片培养的活力结果。培养1周后,层粘连蛋白的固定和免疫染色显示许多完整的血管和Sox2的表达,这两者都用于证明脑切片的活力。这表明鸡胚胎脑切片可以在膜插入物上培养约2周,并且在正常外观的血管和转录因子表达下保持活力。
图4 显示了使用活检冲头法在切片中形成空腔后,将红色U-118 / L1LE / mCherry细胞(与基质混合)的"塞子"引入 离体 脑切片的结果。U-118细胞明显侵入脑组织,有时广泛侵入,通常沿着血管。然而,细胞侵袭在引入细胞的圆周周围并不均匀。血管有时在某些切片中也出现受损或缺失,可能是由于打孔方法或培养时间的延长增加了创伤。这表明活检打孔/细胞塞方法可用于将GBM细胞引入培养的 离体 脑切片中的特定位置,然后细胞侵入脑切片。
图5 显示了培养中的活球状体,以及将活GBM细胞微球引入离 体 脑切片以进行延时实验的几个宽场荧光示例。细胞从球体侵入脑切片的电影在补充视频 S5和补充视频S6 中给出。 这表明细胞球状体是将GBM细胞或GSC引入离 体 脑切片特定位置的另一种成功方法,并且可以通过宽场荧光显微镜监测侵袭性细胞行为,尽管单个细胞的分辨率可能很差。
图6显示了活GSC16-4 / GFP和U-118 / L1LE / mCherry细胞侵袭脑切片的共聚焦延时实验的静态图像。在多点延时实验中,在20小时内每10分钟采集一次共聚焦z-stack图像。随时间推移从球体侵入脑切片的电影作为共聚焦z堆栈呈现在补充视频S7,补充视频S8,补充视频S9,补充视频S10和补充 视频S11中。 该实验表明,共聚焦延时成像在跟踪单个细胞侵袭行为方面优于宽场荧光。在这些条件下,U-118 / L1LE细胞明显比GSC更具侵入性。这在静态图像中甚至很明显,GSC位于更中心的位置,而U-118细胞更分散。
图7 显示了 离体 脑切片/球状体制剂的几个示例,其中将两个不同的单独标记的微球(U-118 / L1LE / mCherry球体和GSC16-4 / GFP球体)放置在脑切片上,生长数天,随后固定,免疫染色层粘连蛋白,并通过共聚焦显微镜上的光学切片成像。这表明两种细胞类型都侵入了脑切片并沿着血管传播。当不同类型的微球足够接近以相互接触时,似乎很少(如果有的话)一种细胞类型侵入另一种细胞类型的球体,并且球体保持分离。
图8 显示了 离体 脑切片/球状体制剂的几个示例,其中使用两种不同标记的细胞类型(U-118 / L1LE / mCherry与GSC16-4 / GFP混合)培养产生的"混合细胞型"球状体放置在脑切片上,生长数天,随后固定,免疫染色层粘连蛋白,并通过共聚焦显微镜上的光学切片成像。这表明红色U-118 / L1LE / mCherry细胞从球体中迁移出来并且比绿色GSC16-4 / GFP细胞分散得更明显,绿色GSC16-4 / GFP细胞倾向于在球体中心附近保持团块。此外,U-118 / L1LE / mCherry细胞也用DiD染色,以便可以直接在固定的 离体 制备中比较两个单独的标记(mCherry和DiD)。即使在侵入脑切片的单个细胞中,仍然可以检测到DiD标签;然而,这是细胞内点。
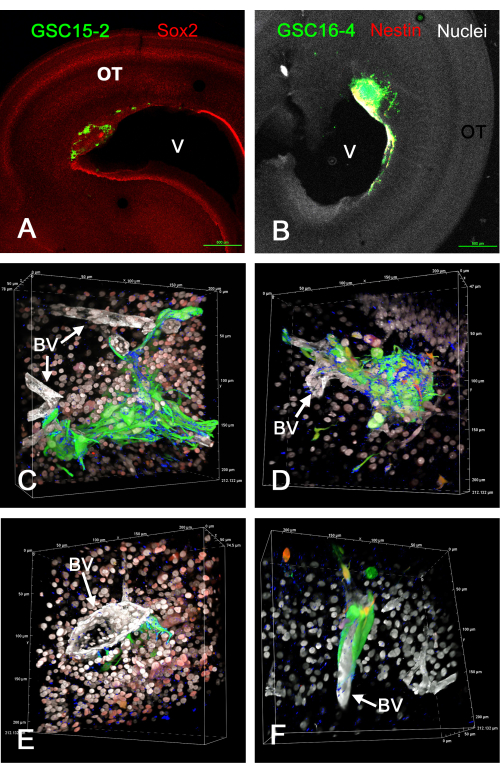
图 1:体内将 GSC 注射到 E5 视顶膜引起的 E15 处肿瘤。 由于GFP表达,GSC为绿色。GSC15-2 电池显示在图A、C 和 E 中,GSC16-4 电池显示在图示 B、D 和 F 中。(A)心室附近有肿瘤的视顶的低放大倍率视图(V)。Sox2染色以红色显示,可对OT细胞的大部分细胞核进行染色。(B)与A相似的图像,但GSC16-4细胞也被染成红色的巢蛋白,由于颜色混合和图像曝光,在图像中可能出现黄色或白色。由于用双苯甲酰亚胺复染,OT细胞核呈白色。(C-F)使用 60 倍油浸物镜从 z 堆栈生成的体积渲染的不同视角。由于双苯甲酰亚胺染色,细胞核呈白色,由于 Sox2 的免疫染色,在 C 和 E 图中显示的一些细胞核呈红色。图D和F中的红色染色来自巢蛋白染色。请注意,由于共聚焦显微镜软件中体积渲染的"Alpha 混合",颜色不会像使用最大强度投影那样混合,并且最流行的颜色占主导地位并掩盖了不太强烈的颜色。由于层粘连蛋白的免疫染色,血管被染成白色。GSC 标志物整合素 α-6 染色呈蓝色,在 GSC 表面上呈点状。微米比例沿体积渲染的边缘显示。面板 C-F 中体积渲染的旋转视频在补充视频 S1、补充视频 S2、补充视频 S3 和补充视频 S4 中呈现。 比例尺 = 500 μm (A,B)。缩写:GSC = 胶质母细胞瘤干细胞;OT = 视顶;GFP = 绿色荧光蛋白;BV = 血管。请点击此处查看此图的大图。
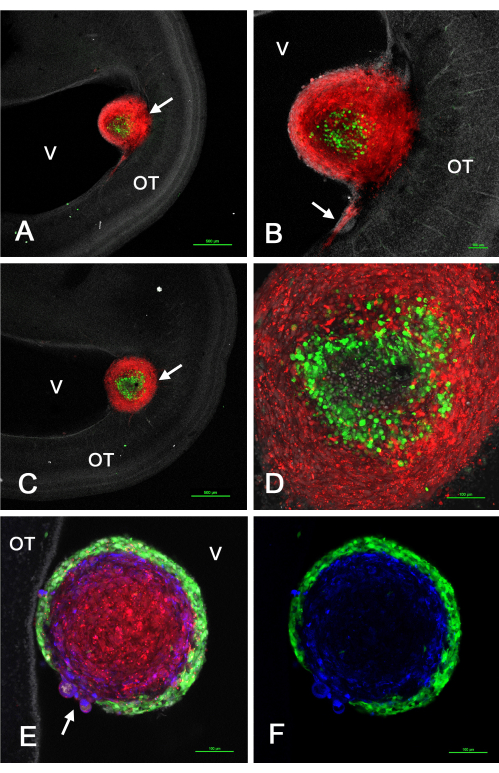
图 2:由 GSC 和 U-118 GBM 细胞混合物注射到 E5 视顶膜引起的 E15 处肿瘤。由于GFP表达,GSC为绿色,由于mCherry表达,U-118 / L1LE细胞为红色。GSC15-2 显示在面板 A-D 中,GSC16-4 显示在面板 E 和 F 中。(A)脑室附近混合细胞肿瘤(箭头)的低倍共聚焦单z平面。细胞核用双苯甲酰亚胺复染白色。(B)A中显示的肿瘤放大倍数更高(10倍物镜),红色U-118细胞侵入心室表面附近的OT。(C)与A中的光学切片略有不同的平面,显示嵌入OT壁深处的肿瘤(箭头)。(D)C中肿瘤的多个z平面的最大投影(20倍物镜),显示肿瘤内分选细胞的细节。(E)与GSC16-4细胞混合肿瘤的单z平面图像(20倍物镜),显示肿瘤内的分选以与GSC15-2细胞相反的模式发生,绿色GSC在红色U-118细胞周围形成薄而均匀的皮层。肿瘤与OT壁的附着区域未在此z平面中显示。注意肿瘤区域,其中GSC皮层不连续,U-118 / L1LE细胞凸出(箭头)。L1CAM 的免疫染色以蓝色显示。(F)与E中的图像相同,但仅显示绿色GSC和蓝色L1CAM染色。比例尺 = 500 μm (A,C), 100 μm (B,D,E,F)。缩写:GSC = 胶质母细胞瘤干细胞;OT = 视顶;GFP = 绿色荧光蛋白;V = 心室。请点击此处查看此图的大图。
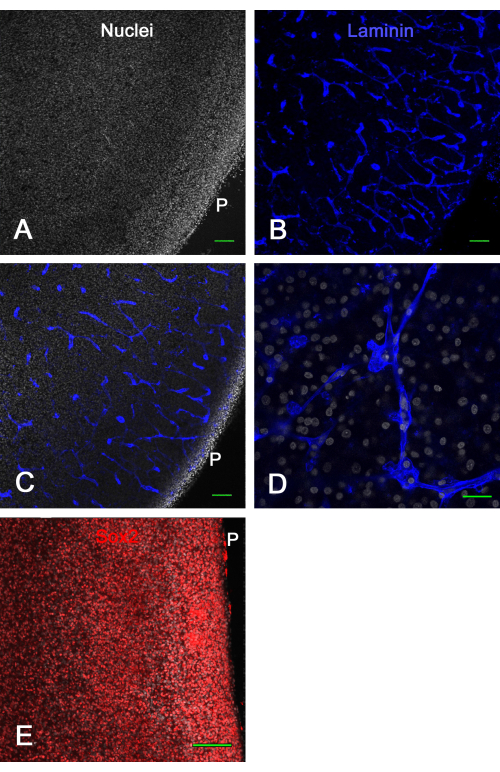
图 3:培养 1 周后离体视顶膜切片的活力。 将E14光学顶盖切片在膜插入物上培养1周,然后固定并免疫染色。A和B中显示的是用双苯甲酰亚胺(A)染色细胞核和免疫染色层粘连蛋白(B)的脑切片的共聚焦图像(10倍物镜),清楚地显示了通过层粘连蛋白染色以各种配置光学切片的正常,完整的血管。(C)类似于图A和B中显示的共聚焦图像,其中细胞核和层粘连蛋白染色都可见。(D)更高放大倍率(60倍油物镜)共聚焦图像,显示核和层粘连蛋白染色的细节。(E) 红色 Sox2 转录因子染色的脑切片共聚焦 z-stack(20 倍物镜)和白色双苯甲酰亚胺全核的最大投影图像。请注意,大多数细胞核表现出Sox2染色,如体内所示(见图1)。比例尺 = 100 μm (A, B, C, E), 25 μm (D)。缩写:P = 皮亚表面。请点击此处查看此图的大图。
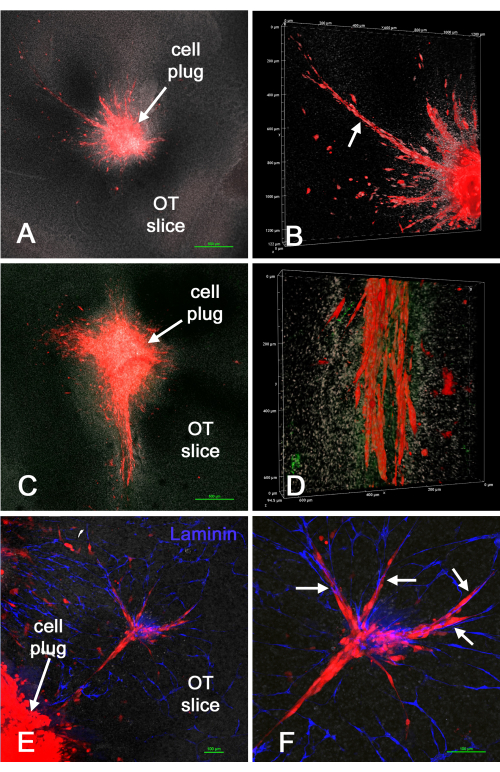
图 4:通过活检打孔法将 U-118/mCherry 细胞放入 离体 脑切片中。 使用1毫米活检冲头在脑切片中形成空腔,然后将与基质混合的红色U-118 / L1LE / mCherry细胞作为"塞子"植入。几天后,将脑切片固定,免疫染色层粘连蛋白,并安装在载玻片上进行共聚焦显微镜分析。图 A 和 C 显示了产生的"肿瘤"和侵入脑切片的周围细胞的低放大倍率,共聚焦,单个z平面图像(4倍物镜)。(B)图 A 中制备物在较高放大倍率(20倍物镜)下z-stack的体积渲染图,显示U-118细胞的广泛侵袭(箭头)。(D)图像显示了图 C所示的广泛入侵细胞下部的类似体积渲染。层粘连蛋白染色呈绿色,但血管不清晰。(E)图像显示了侵入脑切片的细胞塞和一组细胞的一部分,以及蓝色血管的层粘连蛋白染色。(F)图 E所示的入侵细胞的放大倍数更高,可以清楚地看到细胞沿着血管排列(箭头)。所有面板均显示用双苯甲酰亚胺进行白色核复染。比例尺 = 500 μm (A,C), 100 μm (E,F)。面板 B 和 D 的比例沿体积渲染轴。缩写:OT = 视顶。 请点击此处查看此图的大图。

图5:培养中的活细胞球体和离体脑切片中活GBM细胞的宽场荧光图像。图A和B中显示的是U-118 / L1LE GBM细胞(A)和GSC(B)作为球状体(箭头)生长的相衬图像(在倒置显微镜上使用10倍物镜)。图A的背景显示的是细胞培养皿上可能发生的聚HEMA涂层的失焦不均匀。图C-F中显示的是延时实验期间U-118 / L1LE细胞球状体和入侵细胞(箭头)的宽场荧光图像,以监测侵袭离体切片的活体行为(使用定制延时显微镜系统上的20倍物镜18)。在图C和E中,细胞用远红色荧光膜染料DiD染色,在图D和F中,细胞通过其红色mCherry表达成像。比例尺 = 100 μm。图C和D中显示的宽场荧光延时实验视频分别位于补充视频S5和补充视频S6中。缩写:GBM = 胶质母细胞瘤;GSC = GBM干细胞;S = 椭球体。请点击此处查看此图的大图。
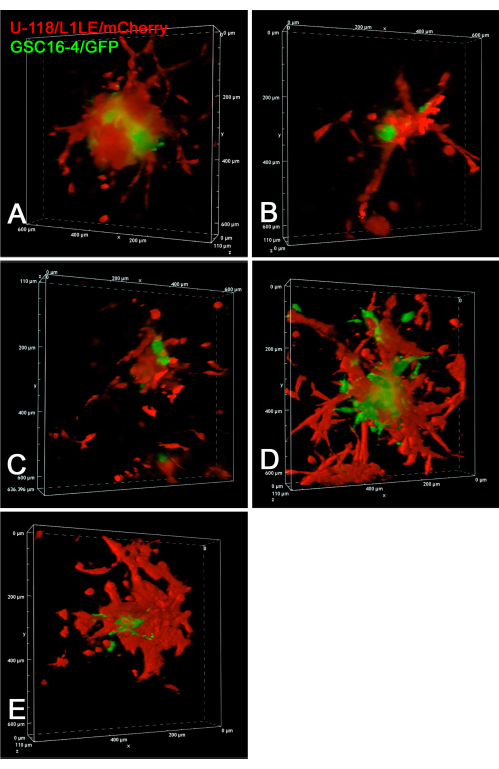
图 6:活 GSC 和 GBM 细胞的共聚焦 4D 延时体积渲染图像。所有面板中显示的是五个不同的混合细胞球状体植入不同脑切片的终点图像。对于面板A-E,在20小时内每10分钟以10μm步长采集共聚焦z-stack图像。制剂包括植入红色U-118 / L1LE / mCherry细胞和绿色GSC16-4 / GFP细胞的混合细胞球状体的脑切片。使用超长工作距离(ELWD)20倍物镜(0.45 NA)在6孔塑料细胞培养皿中的膜插入物上培养脑切片时拍摄共聚焦图像,这提供了所需的额外工作距离。体积渲染是使用共聚焦显微镜软件"Alpha Blending"生成的,该软件具有明显的3D效果。这些共聚焦体积随时间推移渲染的延时视频在补充视频 S7、补充视频 S8、补充视频 S9、补充视频 S10 和补充视频 S11 中呈现。 缩写:GBM = 胶质母细胞瘤;GSC = GBM干细胞;GFP = 绿色荧光蛋白;NA = 数值孔径。请点击此处查看此图的大图。
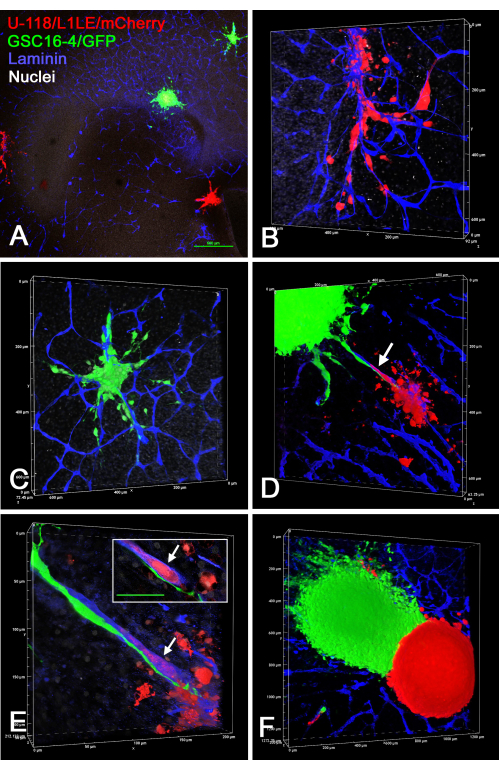
图 7:固定脑切片的共聚焦图像,具有来自不同细胞类型的球状体的侵袭性 GBM 细胞。绿色球体由GSC16-4/GFP细胞组成,红色球状体由U-118/L1LE/mCherry细胞组成。图A-F中显示的是脑切片的不同视图,在固定和免疫染色层粘连蛋白(蓝色)之前,在其上培养多个红色和绿色球体数天。图A-C是相同的OT切片,其中A是用4倍物镜拍摄的,图B和C是从图A中显示的两个球体侵入脑切片的细胞的更高放大倍率渲染(20倍物镜)。两种细胞类型都明显侵入血管组织。图D显示了不同脑切片的体积渲染(20倍物镜),其中两个不同的球体靠近在一起,并且可以看到来自两者的细胞沿着位于它们之间的同一血管迁移(箭头)。图E是高放大倍率(60倍油物镜)体积渲染,显示绿细胞沿血管外表面迁移,而红细胞在血管内迁移(箭头)。插图显示了单个 z 平面光学切片,其中红细胞被血管的蓝色染色(箭头)清楚地包围,绿色细胞显然在血管外。插图比例尺 = 50 μm。图F显示了前脑切片的体积渲染(10倍物镜),其中有两个紧密相连的不同颜色的球体。从一个球体到另一个球体发生的细胞侵袭很少(如果有的话),并且它们之间存在尖锐的边界。图A、B、C和E也显示用双苯甲酰亚胺进行白色核复染。比例尺 = 500 μm (A)。面板 B-F 的比例沿体积渲染轴。缩写:GBM = 胶质母细胞瘤;GSC = GBM干细胞;GFP = 绿色荧光蛋白;OT = 视顶。请点击此处查看此图的大图。
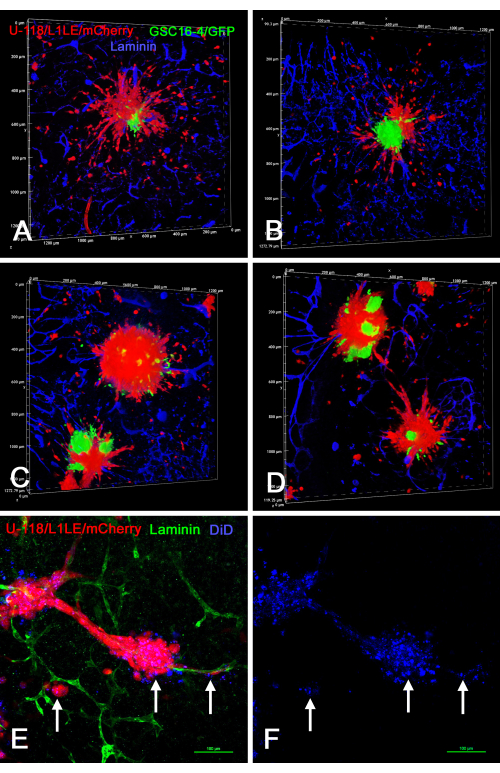
图 8:来自混合细胞球状体和用 DiD 标记的球状体的侵入性 GBM 细胞的固定脑切片的共聚焦图像。面板 A-D 显示了包含由绿色 GSC16-4/GFP 细胞和红色 U-118/L1LE/mCherry 细胞组成的混合细胞球体的脑切片的体积渲染。许多红色U-118细胞从球体中分散并向各个方向侵入脑切片,而绿色GSC没有分散并停留在球体的中心位置。图E和F显示了用红色U-118 / L1LE / mCherry球体进行离体切片制备,该球体也用远红膜染料DiD(显示为蓝色)标记。固定后,对切片进行绿色层粘连蛋白免疫染色。DiD标记在红细胞中可见,如点状染色(箭头),即使在从球状体沿血管分散的细胞中也可见。图中未显示双苯甲酰亚胺核复染,因此其他染色更清晰可见。比例尺 = 100 μm (E,F)。缩写:GBM = 胶质母细胞瘤;GSC = GBM干细胞;GFP = 绿色荧光蛋白。请点击此处查看此图的大图。
| 培养基/溶液 | 组成 | ||
| GSC媒体 | DMEM/F12、1% 胎牛血清 (FBS)、15 mM HEPES 缓冲液、2 mM L-谷氨酰胺、100 μg/mL 青霉素-链霉素(笔/链球菌)、不含维生素 A 的 2% B27 补充剂和 2.5 μg/mL 肝素的 1:1 混合物。 | ||
| GBM媒体 | DMEM(高葡萄糖)、10% FBS、笔/链球菌和 2 mM L-谷氨酰胺。 | ||
| 固定缓冲液 | 0.1 M 二甲胂酸钠缓冲液中的 2% PFA | ||
| 包埋介质 | PBS 中的 3.5% 琼脂和 8% 蔗糖 | ||
| 中国人民科学集团 | 0.1% Triton X-100 + 5% PBS 中的正常山羊血清 (NGS) | ||
| U-118 MG 细胞培养基 | DMEM + 10% FBS + 笔/链球菌 + L-谷氨酰胺 | ||
| 脑切片培养基 | 50% MEM + 25% HBSS + 25% 马血清 + B27 + 笔/链球菌 + L-过量 + 15 mM HEPES 缓冲液 | ||
| 振动组织切片机切片介质 | 培养基 199 + 笔/链球菌 + 15 mM HEPES 缓冲液 | ||
表1:本协议中使用的培养基和缓冲液的组成。
补充图1:注射到E5视顶。 (A) 在气空间上的蛋壳上切一个孔,并用盐水或介质润湿气空间膜后,用细镊子去除膜。(B) 为了将细胞注入视顶,将羊膜捏住并用细镊子固定以定位头部,以便可以进入视顶。 然后将微量移液器插入视顶,并将细胞加压注入其中。(C) 注射细胞后,使用注射器和细针在胚胎顶部加入几滴氨苄西林溶液。 请点击此处下载此文件。
补充图2:E15大脑区域的解剖。(A) 斩首后,将E15胚胎头放入装有无菌CMF溶液的培养皿中。(B) 然后使用细镊子去除覆盖在大脑上的皮肤。(C)然后将两块颅骨从覆盖的两个前脑(FB) 半球上移除。(D) 然后轻轻地从前脑(FB),视顶和小脑周围去除结缔组织硬脑。(E) 然后使用弯曲的镊子从脑腔下方轻轻地将其从脑腔中取出整个大脑。(F)显示的是整个切除的大脑的背视图,包括前脑(FB),视顶(OT)和小脑( CB)。(G)然后用细剪刀将分离的大脑解剖成前脑(FB),视顶(OT)半球和小脑( CB)。(H) 然后使用细镊子轻松地将脆弱的结缔组织软脑膜从视顶(OT)半球中取出。 请点击此处下载此文件。
补充图3:嵌入和切片E15光学顶盖以及细胞球状体的放置。(A) 使用弯曲的镊子将一个视顶半球浸没在低熔点琼脂糖中。(B) 琼脂糖在冰上硬化后,将包含光学顶盖的块修剪并粘在切片盘/托盘中的不锈钢基座上。(C) 胶水干燥后,将切片盘/托盘放入振动组织切片机的卡盘中,并填充冷切片介质。 然后用蓝宝石刀从浸没的组织块中切下切片。 切好的切片会漂浮到盘子/托盘中,可以用刮刀取出。 (D) 从培养皿/托盘中取出切好的切片,并直接放置在多孔板中带有底层切片培养基的膜插入物上。(E) 在聚 HEMA 包被培养皿上生长细胞球状体后,使用 20 μL 微量移液器在最少量的培养基中从培养皿中取出球状体。(F) 然后将分离的球体直接放置在最小介质中的脑切片上。(G) 如果球体由于介质流动而从脑切片上脱落,则可以使用粘在木制涂抹棒上的睫毛将其推回脑切片上。 请点击此处下载此文件。
补充视频S1:在E15处对小GSC15-2肿瘤进行高放大体积渲染的视频。 由于GFP表达,GSC为绿色。视频对应于 图1C ,显示了GSC15-2电池。该视频显示了使用 60 倍油浸物镜从 z 堆栈生成的体积渲染的旋转。由于双苯甲酰亚胺染色,细胞核呈白色,由于 Sox2 免疫染色,一些细胞核呈红色。请注意,由于共聚焦显微镜软件中体积渲染的"Alpha 混合",颜色不会像使用最大强度投影那样混合,并且最强烈的颜色占主导地位并遮挡了不太强烈的颜色。由于层粘连蛋白的免疫染色,血管被染成白色。GSC 标志物整合素 α-6 染色以蓝色显示,在绿色 GSC 表面上呈点状。微米尺度沿体积渲染的边缘显示。 请点击此处下载此视频。
补充视频S2:小GSC16-4肿瘤在E15处的高放大倍率体积渲染视频。 由于GFP表达,GSC为绿色。视频对应于 图1D ,显示了GSC16-4细胞。该视频显示了使用 60 倍油浸物镜从 z 堆栈生成的体积渲染的旋转。由于双苯甲酰亚胺染色,细胞核呈白色,一些GSC由于巢蛋白的免疫染色而呈现红色。请注意,由于共聚焦显微镜软件中体积渲染的"Alpha 混合",颜色不会像使用最大强度投影那样混合,并且最强烈的颜色占主导地位并遮挡了不太强烈的颜色。由于层粘连蛋白的免疫染色,血管被染成白色。GSC 标志物整合素 α-6 染色以蓝色显示,在绿色 GSC 表面上呈点状。微米尺度沿体积渲染的边缘显示。 请点击此处下载此视频。
补充视频S3:E15处小GSC15-2肿瘤的高放大倍率渲染视频。 由于GFP表达,GSC为绿色。视频对应于 图1E ,显示了GSC15-2电池。该视频显示了使用 60 倍油浸物镜从 z 堆栈生成的体积渲染的旋转。由于双苯甲酰亚胺染色,细胞核呈白色,由于 Sox2 免疫染色,一些细胞核呈红色。请注意,由于共聚焦显微镜软件中体积渲染的"Alpha 混合",颜色不会像使用最大强度投影那样混合,并且最强烈的颜色占主导地位并遮挡了不太强烈的颜色。由于层粘连蛋白的免疫染色,血管被染成白色。GSC 标志物整合素 α-6 染色以蓝色显示,在绿色 GSC 表面上呈点状。微米尺度沿体积渲染的边缘显示。 请点击此处下载此视频。
补充视频S4:E15处小GSC16-4肿瘤的高放大倍率渲染视频。 由于GFP表达,GSC为绿色。视频对应于 图1F ,显示了GSC16-4电池。该视频显示了使用 60 倍油浸物镜从 z 堆栈生成的体积渲染的旋转。由于双苯甲酰亚胺染色,细胞核呈白色,有些由于巢蛋白免疫染色而呈红色。请注意,由于共聚焦显微镜软件中体积渲染的"Alpha 混合",颜色不会像使用最大强度投影那样混合,并且最强烈的颜色占主导地位并遮挡了不太强烈的颜色。由于层粘连蛋白的免疫染色,血管被染成白色。GSC 标志物整合素 α-6 染色以蓝色显示,在绿色 GSC 表面上呈点状。微米尺度沿体积渲染的边缘显示。 请点击此处下载此视频。
补充视频S5: 离体 脑切片中活GBM细胞的视频。 视频对应于 图5C ,显示了延时实验期间U-118 / L1LE细胞球状体和入侵细胞的宽场荧光图像,以监测 侵袭离 体切片的活体行为(使用定制延时显微镜系统上的20倍物镜)。U-118 / L1LE细胞用远红色荧光膜染料DiD染色。图像是用单色相机采集的。 请点击此处下载此视频。
补充视频S6: 离体 脑切片中活GBM细胞的视频。 视频对应于 图5D ,显示了延时实验期间U-118 / L1LE细胞球状体和入侵细胞的宽场荧光图像,以监测 侵袭离体 切片的实时行为(在定制延时显微镜系统上使用20倍物镜)。细胞通过其红色mCherry表达 进行 成像。图像是用单色相机采集的。 请点击此处下载此视频。
补充视频S7:活GSC和GBM细胞共聚焦4D延时图像的体积渲染图像视频。 视频对应于 图6A。在20小时内每10分钟以10μm步长采集共聚焦z-stack图像。制备是脑切片,植入红色U-118 / L1LE / mCherry细胞和绿色GSC16-4 / GFP细胞的混合细胞球状体。当脑切片使用ELWD 20x物镜(0.45 NA)在6孔塑料细胞培养皿中的膜插入物上培养时拍摄共聚焦图像,这提供了所需的额外工作距离。体积渲染是使用共聚焦显微镜软件"Alpha Blending"生成的,该软件具有明显的3D效果。微米尺度沿体积渲染的边缘显示。最好通过手动来回拖动视频播放器中的视频进度滑块来观察单元格移动,而不是允许视频播放器以正常的慢速进行。 请点击此处下载此视频。
补充视频S8:活GSC和GBM细胞共聚焦4D延时图像的体积渲染图像视频。 视频对应于 图 6B。在20小时内每10分钟以10μm步长采集共聚焦z-stack图像。制备是脑切片,植入红色U-118 / L1LE / mCherry细胞和绿色GSC16-4 / GFP细胞的混合细胞球状体。当脑切片使用ELWD 20x物镜(0.45 NA)在6孔塑料细胞培养皿中的膜插入物上培养时拍摄共聚焦图像,这提供了所需的额外工作距离。体积渲染是使用共聚焦显微镜软件"Alpha Blending"生成的,该软件具有明显的3D效果。微米尺度沿体积渲染的边缘显示。最好通过手动来回拖动视频播放器中的视频进度滑块来观察单元格移动,而不是允许视频播放器以正常的慢速进行。 请点击此处下载此视频。
补充视频S9:活GSC和GBM细胞共聚焦4D延时图像的体积渲染图像视频。 视频对应于 图6C。在20小时内每10分钟以10μm步长采集共聚焦z-stack图像。制备是脑切片,植入红色U-118 / L1LE / mCherry细胞和绿色GSC16-4 / GFP细胞的混合细胞球状体。当脑切片使用ELWD 20x物镜(0.45 NA)在6孔塑料细胞培养皿中的膜插入物上培养时拍摄共聚焦图像,这提供了所需的额外工作距离。体积渲染是使用共聚焦显微镜软件"Alpha Blending"生成的,该软件具有明显的3D效果。微米尺度沿体积渲染的边缘显示。最好通过手动来回拖动视频播放器中的视频进度滑块来观察单元格移动,而不是允许视频播放器以正常的慢速进行。 请点击此处下载此视频。
补充视频S10:活GSC和GBM细胞共聚焦4D延时图像的体积渲染图像视频。 视频对应于 图 6D。在20小时内每10分钟以10μm步长采集共聚焦z-stack图像。制备是脑切片,植入红色U-118 / L1LE / mCherry细胞和绿色GSC16-4 / GFP细胞的混合细胞球状体。当脑切片使用ELWD 20x物镜(0.45 NA)在6孔塑料细胞培养皿中的膜插入物上培养时拍摄共聚焦图像,这提供了所需的额外工作距离。体积渲染是使用共聚焦显微镜软件"Alpha Blending"生成的,该软件具有明显的3D效果。微米尺度沿体积渲染的边缘显示。最好通过手动来回拖动视频播放器中的视频进度滑块来观察单元格移动,而不是允许视频播放器以正常的慢速进行。 请点击此处下载此视频。
补充视频S11:活GSC和GBM细胞共聚焦4D延时图像的体积渲染图像视频。 视频对应于 图 6E。在20小时内每10分钟以10μm步长采集共聚焦z-stack图像。该制剂包括植入红色U-118 / L1LE / mCherry细胞和绿色GSC16-4 / GFP细胞的混合细胞球状体的脑切片。当脑切片使用ELWD 20x物镜(0.45 NA)在6孔塑料细胞培养皿中的膜插入物上培养时拍摄共聚焦图像,这提供了所需的额外工作距离。体积渲染是使用共聚焦显微镜软件"Alpha Blending"生成的,该软件具有明显的3D效果。微米尺度沿体积渲染的边缘显示。最好通过手动来回拖动视频播放器中的视频进度滑块来观察单元格移动,而不是允许视频播放器以正常的慢速进行。 请点击此处下载此视频。
讨论
将细胞注射到中脑(视顶)心室方案中的关键步骤包括在注射前和注射期间不损伤卵子中脉络膜尿囊膜或胚胎周围的血管,尽管在将细胞注射到中脑时,可以轻轻拉动并按住胚胎周围的羊膜以定位头部。羊膜比较坚韧,可以用细镊子拉动头部,用一只手保持头部稳定,用另一只手将细胞注射到视顶,视顶是大脑中间的大圆形结构。一般来说,注射胚胎的活力范围从25%到75%,取决于未知因素,实际上每个存活的胚胎在视顶中至少包含一个小肿瘤。生成活脑切片的关键步骤包括吸干组织中多余的液体,以便琼脂糖在切片过程中粘附在大脑上,并保持组织和切片冷,直到放置在膜插入物上。由于不同的细胞类型形成球体的方式不同(速度和大小),因此应针对每种细胞类型优化聚HEMA平板上的接种细胞密度和收获微球之前的时间长度。
这里的工作尚未对脑切片的可行性进行正式的纵向研究。Yang等人使用与此处使用的类似的鸡胚胎脑切片培养物,并显示出切片的良好活力至少7天16。以前的研究表明,当OT组织保存在次优培养基中时,组织中会出现许多pyknotic nucle,而这在本文的工作中的切片中没有发生。此外,当切片在次优条件下退化时,血管碎裂并显示为一排排层粘连蛋白阳性球体(未显示)。因此,尽管尚未通过电生理学或活性半胱天冬酶-3表达等方法检查这里的活力,但在次优培养条件下观察到的细胞死亡指标均未出现。
OT一直专注于体内脑肿瘤实验,因为它是最容易注射的区域,具有最大的心室。在E5,这是胚胎足够小以保持在蛋黄顶部的最新一天,必须将注射注射到心室中,因为所有大脑区域只不过是一个薄的心室区域。然而,这些注射成功地导致嵌入肿瘤,细胞侵入脑实质。有时,在前脑或小脑中发现由此产生的肿瘤,但这并不常见。E15视顶的离体切片主要用于实验,因此离体共培养结果可以与体内注射实验相关联。然而,与视顶相比,前脑切片也适用,并且具有更大的表面积和非常薄的心室,这可能使前脑更适合与体内注射无关的离体共培养。
这里已经证明, 体内 注射,然后进行组织固定,振动组织切片机切片以及层粘连蛋白和其他标志物的免疫染色,从而在靠近血管的脑组织中获得了GBM细胞和GSC的高分辨率图像。通过使用共聚焦软件和制造商的说明从共聚焦光学切片的z堆栈创建3D体积渲染,极大地促进了确定肿瘤细胞和血管之间相互关系的能力。使用GFP,mCherry和DiD标记细胞的宽场荧光显微镜进行延时成像是可能的;然而,靠近高荧光球体的迁移细胞有时会被球体的"辉光"所掩盖。通过仔细调整收集宽场图像的曝光时间,可以在一定程度上将这种不良影响降至最低。使用共聚焦z堆栈随时间变化(4D)的延时成像消除了球体的失焦辉光,并导致具有深色背景的清晰迁移细胞。这在协议中没有描述,但与宽场延时成像类似,宽场延时成像是在6孔塑料板中的透明膜插入物上进行脑切片时进行的。尽管共聚焦延时成像可以明显更清晰地显示单个细胞及其行为的图像,但多点延时实验在20小时内以10分钟的间隔收集10个z平面/点的z堆栈是扫描头振镜的广泛使用。由于这可能会显著缩短电流计的使用寿命,因此应明智地使用此方法。
尽管雏鸡胚胎系统非常适合研究GBM细胞行为的 体内 注射和 离体 共培养实验,但该模型系统存在一些局限性。与任何异种移植系统一样,植入人类细胞的环境不是人脑,但GBM细胞的行为似乎模仿了啮齿动物模型和人类患者的行为。在E5上进行 体内 注射实验后,通常允许肿瘤形成10天,直到E15。这显然不足以研究肿瘤发生和细胞侵袭的各个方面。然而,这里已经证明,实体瘤在脑实质中形成,细胞在肿瘤内相互作用并重新排列,并且在相对较短的时间内沿着血管和弥漫性地发生显着的脑浸润。 体内 雏鸡胚胎系统的另一个限制是它不适合药物或其他治疗,因为在雏鸡胚胎发育过程中运行的大蛋黄和胚胎外循环系统。局部液体药物治疗会导致大脑中高度可变和未知的浓度,因为从胚胎扩散到更大的蛋黄块中。同样,将药物静脉注射到非常脆弱的胚胎外循环系统中会泄漏或扩散出血管,也会导致大脑中未知的浓度。这是采用 离体 切片培养方法的主要原因之一 - 这样不仅可以通过延时显微镜 观察 和跟踪细胞行为,而且可以在更相关的脑组织环境中测试成功改变培养皿4 中GBM细胞行为的治疗。
鸡胚胎原位脑肿瘤模型系统的开发被视为可用于研究GBM肿瘤形成和侵袭性细胞行为的系统和工具的重要补充。受精鸡蛋在大多数地区可能很容易获得,与啮齿动物相比,它们便宜,没有动物护理费用,胚胎非常有弹性和抗感染(即,大多数工作都是在台面上完成的),胚胎具有高度可操纵性,可以在无壳培养物中生长19,雏鸡胚胎不被视为脊椎动物,因此不需要NIH指南的IACUC批准(机构要求)可能会有所不同)。因此,这些多重优势使雏鸡胚胎系统非常有吸引力,如果人们将他们的问题和实验限制在其限制范围内。其他人使用雏鸡胚胎进行了多项GBM细胞研究,但这些研究几乎完全利用了胚胎的绒毛膜尿囊膜(CAM)20,21,22,23,24,25,26,27,28,29和肢芽30,而不是大脑。还有一份报告在E231上将髓母细胞瘤植入小鸡大脑。毫无疑问,使用鸡胚胎作为原位异种移植模型系统,如此处所述,应该产生比使用CAM的研究对人类GBM肿瘤生物学更有意义的结果。
虽然这些研究才刚刚开始充分利用鸡胚胎脑肿瘤模型系统来研究人类GBM细胞和GSC行为,但希望其他研究能够扩展用途并找到进一步的潜在应用。可以想象,该系统不仅会发现调节GBM肿瘤形成和细胞行为的机制,而且还将允许对特定患者细胞上的特定药物和物质进行临床前测试。例如,如果提前建立脑切片培养物,则可以将肿瘤细胞,手术肿瘤切除的碎片或患者来源的GBM类器官32 直接放置在 离体 共培养中,并且可以在几天内评估各种治疗方法。同样,解离的患者细胞可以直接注射到 卵中的 E5中脑中,以评估它们形成肿瘤和侵入脑实质的能力。因此,希望这里对方法和代表性结果的描述将促进和鼓励更多地使用这种高度未充分利用的系统进行脑癌研究。
披露声明
作者均无任何利益冲突。
致谢
这项工作的部分资金来自美国国家癌症研究所(R03CA227312)对DSG的赠款和Lisa Dean Moseley基金会的慷慨资助。活的GBM标本是在患者同意下通过Helen F. Graham癌症中心和研究所的组织采购中心获得的。A.R.的资金由美国国立卫生研究院国家研究资源中心和国家推进转化科学中心(UL1TR003107)提供。N.P.,A.L.,Z.W.和K.S.的暑期本科生研究奖学金由特拉华大学本科生研究计划提供。
材料
| Name | Company | Catalog Number | Comments |
| 1 cm x 1 cm square hole paper punch | Birabira | N/A | |
| 1 mm biopsy punch pen | Robbins Instruments | 20335 | |
| 6 well insert plate (Corning Transwell) | Millipore Sigma | CLS3450 | |
| 9" Disposable Pasteur Pipets | Fisher Scientific | 13-678-20C | |
| 15 mL centrifuge tubes | Fisher Scientific | 05-539-12 | |
| 24 well plate | Corning Costar | 3526 | |
| 50 mL centrifuge tubes | Fisher Scientific | 05-539-9 | |
| Agar | Fisher BioReagents | BP1423-500 | for embedding fixed brains |
| Alexafluor 488-conjugated GAM IgG | Jackson Immunoresearch | 115-605-146 | |
| Alexafluor 647-conjugated GAM IgG | Jackson Immunoresearch | 115-545-146 | |
| Aluminum foil | ReynoldsWrap | N/A | |
| Ampicillin | Sigma Aldrich | A-9518 | |
| anti-integrin alpha-6 monoclonal antibody GOH3 | Santa Cruz Biotechnology | sc-19622 | |
| anti-L1CAM monoclonal antibody UJ127 | Santa Cruz Biotechnology | sc-53386 | |
| anti-laminin monoclonal antibody | Developmental Studies Hybridoma Bank | 3H11 | |
| anti-nestin monoclonal antibody 10c2 | Santa Cruz Biotechnology | sc-23927 | |
| anti-Sox2 monoclonal antibody E-4 | Santa Cruz Biotechnology | sc-365823 | |
| B27 supplement without vitamin A | GIBCO | 17504-044 | |
| bisbenzimide (Hoechst 33258) | Sigma-Aldrich | B2883 | nuclear stain |
| Cell culture incubator | Forma | standard humidified CO2 incubator | |
| Centrifuge | Beckman Coulter | ||
| Confocal microscope | Nikon Instruments | C2si+ | With custom-made cell incubator chamber |
| Confocal microscope objective lenses | Nikon Instruments | Plan Apo lenses, except S Plan Fluor ELWD 20x 0.45 NA objective lens for confocal time-lapse imaging | |
| Confocal microscope software | Nikon Instruments | NIS Elements | Version 5.2 |
| Curved foreceps | World Precision Intruments | 504478 | |
| Curved scissors | Fine Science Tools | ||
| Curved spatula | Fisher Scientific | 14-375-20 | |
| Cyanoacrylate glue | Krazy Glue | KG-585 12R | |
| D-Glucose | Millipore Sigma | G8270 | |
| DiD far red fluorescent dye | Invitrogen | V22887 | Vybrant DiD |
| DMEM | Sigma Aldrich | D5671 | |
| DMEM/F12 | Sigma Aldrich | D8437 | |
| DMSO | Sigma Aldrich | D4540 | |
| Dulbecco's Phosphate buffered saline (PBS) | Sigma Aldrich | P5493-1L | |
| egg incubator | Humidaire | ||
| electrical tape (10 mil thick/254 µm) | Scotch | N/A | |
| Ethanol 200 proof | Decon Laboratories | 2701 | |
| Fast green FCF dye | Avocado Research Chemicals | 16520 | |
| FBS | Gemini Bio-products | 900-108 | |
| filter paper | Fisher Scientific | ||
| Gauze | Dynarex | 3353 | |
| Glass Capillaries for microinjection | World Precision Instruments | TW100-4 | |
| Glycerol | Fisher BioReagents | BP228-1 | for mounting media |
| GSCs (human glioblastoma stem cells) | Not applicable | Isolated from patient GBM specimens in Galileo laboratory in GSC media and then transduced with a GFP encoding lentiviral vector. Cells used were between passage 10 and 30. | |
| Hanks Balanced Salt Solution (HBSS) | Corning | 21-020-CV | |
| Hemacytometer | Hausser scientific | ||
| Heparin | Fisher Scientific | BP2524-100 | |
| HEPES buffer | Sigma Aldrich | H0887 | |
| Horse Serum (HI) | Gibco | 26050-088 | |
| Human FGF-2 | BioVision | 4037-1000 | |
| Human TGF-α | BioVision | 4339-1000 | |
| Inverted phase contrast microscope | Nikon Instruments | TMS | for routine viewing of cultured cells |
| KCl | Fisher Scientific | BP366 | |
| KH2PO4 | Fisher Scientific | P284 | |
| Laboratory film | Parafilm | ||
| Labquake Shaker | LabIndustries | T400-110 | |
| L-Glut:Pen:Strep | Gemini Bio-products | 400-110 | |
| Low-melt agarose | Fisher Scientific | BP1360 | for embedding live brains |
| Matrix | Corning Matrigel | 354234 | |
| Medium 199 | GIBCO | 11150-059 | |
| MEM | Corning | 10-010-CV | |
| Metal vibratome block | |||
| Micropipette tips (20, 200, 1,000 µL) | Fisherbrand | ||
| Micropipettors (20, 200, 1,000 µL) | Gilson | ||
| Microscope Coverglass (no. 1.5 thickness) | Fisherbrand | 12544A | |
| NaCl | Fisher Scientific | S271 | |
| NaH2PO4 + H2O | Fisher Scientific | S369 | |
| NaHCO3 | Fisher Scientific | BP328 | |
| Normal goat serum | Millipore Sigma | 526-M | |
| N-propyl gallate | Sigma Aldrich | P3130 | for mounting media |
| Parafilm | Parafilm | ||
| Paraformaldehyde | Electron Microscopy Sciences | 15710 | |
| PBS | Sigma Aldrich | P5493-1L | |
| Pencil | |||
| Plain Microscope slides | Fisherbrand | 12-550-A3 | |
| Plastic 35 mm Petri dish | Becton Dickinson | 351008 | |
| pneumatic picopump | World Precision Intruments | PV830 | |
| Poly(2-hydroxyethyl methacrylate) (poly-HEMA) | Sigma Aldrich | P-3932 | |
| razor blade- double edge | PACE | for cutting fixed brain slices | |
| sapphire knife | Delaware Diamond Knives | for cutting live brain slices | |
| Scalpel | TruMed | 1001 | |
| Sodium cacodylate buffer 0.2 M pH 7.4 | Electron Microscopy Sciences | 11652 | |
| Specimen chamber for vibratome | custom-made | ||
| Stereo Dissecting Microscope | Nikon Instruments | SMZ1500 | Equipped with epifluorescence |
| straight foreceps | World Precision Intruments | 500233 | |
| straight scissors | Fine Science Tools | ||
| Sucrose | Mallinckrodt | 7723 | |
| Time-lapse fluorescence microscope (widefield fluorescence) | Nikon Instruments | TE2000-E | With custom-made cell incubator chamber (see Fotos et al., 2006) |
| Tissue culture dish polystyrene 100 mm | Thermo Fisher Scientific | 130182 | for cell culturing |
| Tissue culture dish polystyrene 60 mm | Becton Dickinson | 353004 | for cell culturing |
| Transfer pipette | American Central Scientific Co. | FFP011 | |
| Transparent tape | Scotch | ||
| Triton X-100 | Sigma Aldrich | T-8787 | |
| Trypsin (0.25%) + 2.21 mM EDTA | Corning | 25-053-CI | |
| U-118 MG human GBM cell line | ATCC | HTB-15 | Cells were transduced with a lentiviral vector encoding the entire ectodomain sequence of the L1CAM adhesion protein and then with lentiviral vector pUltra-hot encoding mCherry. Passage numbers are unknown. |
| Vacuum pump | Cole-Parmer | EW-07532-40 | "Air Cadet" |
| Vibrating tissue slicer | Vibratome | 3000 | for cutting live and fixed brain slices |
参考文献
- Cretu, A., Fotos, J. S., Little, B. W., Galileo, D. S. Human and rat glioma growth, invasion, and vascularization in a novel chick embryo brain tumor model. Clinical & Experimental Metastasis. 22 (3), 225-236 (2005).
- Yang, M., et al. L1 stimulation of human glioma cell motility correlates with FAK activation. Journal of Neuro-Oncology. 105 (1), 27-44 (2011).
- Mohanan, V., Temburni, M. K., Kappes, J. C., Galileo, D. S. L1CAM stimulates glioma cell motility and proliferation through the fibroblast growth factor receptor. Clinical & Experimental Metastasis. 30 (4), 507-520 (2013).
- Anderson, H. J., Galileo, D. S. Small-molecule inhibitors of FGFR, integrins and FAK selectively decrease L1CAM-stimulated glioblastoma cell motility and proliferation. Cellular Oncology. 39 (3), 229-242 (2016).
- Pace, K. R., Dutt, R., Galileo, D. S. Exosomal L1CAM stimulates glioblastoma cell motility, proliferation, and invasiveness. International Journal of Molecular Sciences. 20 (16), 3982(2019).
- Stoppini, L., Buchs, P. A., Muller, D. A simple method for organotypic cultures of nervous tissue. Journal of Neuroscience Methods. 37 (2), 173-182 (1991).
- Ohnishi, T., Matsumura, H., Izumoto, S., Hiraga, S., Hayakawa, T. A novel model of glioma cell invasion using organotypic brain slice culture. Cancer Research. 58 (14), 2935-2940 (1998).
- Humpel, C. Organotypic brain slice cultures: A review. Neuroscience. 305, 86-98 (2015).
- Aaberg-Jessen, C., et al. Invasion of primary glioma- and cell line-derived spheroids implanted into corticostriatal slice cultures. International Journal of Clinical and Experimental Pathology. 6 (4), 546-560 (2013).
- Matsumura, H., Ohnishi, T., Kanemura, Y., Maruno, M., Yoshimine, T. Quantitative analysis of glioma cell invasion by confocal laser scanning microscopy in a novel brain slice model. Biochemical and Biophysical Research Communications. 269 (2), 513-520 (2000).
- Ren, B., et al. Invasion and anti-invasion research of glioma cells in an improved model of organotypic brain slice culture. Tumori. 101 (4), 390-397 (2015).
- Fayzullin, A., et al. Time-lapse phenotyping of invasive glioma cells ex vivo reveals subtype-specific movement patterns guided by tumor core signaling. Experimental Cell Research. 349 (2), 199-213 (2016).
- Jensen, S. S., et al. Establishment and characterization of a tumor stem cell-based glioblastoma invasion model. PloS One. 11 (7), e0158746(2016).
- Marques-Torrejon, M. A., Gangoso, E., Pollard, S. M. Modelling glioblastoma tumour-host cell interactions using adult brain organotypic slice co-culture. Disease Models & Mechanisms. 11 (2), 031435(2018).
- Tamura, R., et al. Visualization of spatiotemporal dynamics of human glioma stem cell invasion. Molecular Brain. 12 (1), 45(2019).
- Yang, C., et al. Organotypic slice culture based on in ovo electroporation for chicken embryonic central nervous system. Journal of Cellular and Molecular Medicine. 23 (3), 1813-1826 (2019).
- Murrell, W., et al. Expansion of multipotent stem cells from the adult human brain. PloS One. 8 (8), e71334(2013).
- Fotos, J. S., et al. Automated time-lapse microscopy and high-resolution tracking of cell migration. Cytotechnology. 51 (1), 7-19 (2006).
- Tufan, A. C., Akdogan, I., Adiguzel, E. Shell-less culture of the chick embryo as a model system in the study of developmental neurobiology. Neuroanatomy. 3 (1), 8-11 (2004).
- Shoin, K., et al. Chick embryo assay as chemosensitivity test for malignant glioma. Japanese Journal of Cancer Research. 82 (10), 1165-1170 (1991).
- Hagedorn, M., et al. Accessing key steps of human tumor progression in vivo by using an avian embryo model. Proceedings of the National Academy of Sciences. 102 (5), 1643-1648 (2005).
- Balciūniene, N., et al. Histology of human glioblastoma transplanted on chicken chorioallantoic membrane. Medicina. 45 (2), 123-131 (2009).
- De Magalhães, N., et al. Applications of a new In vivo tumor spheroid based shell-less chorioallantoic membrane 3-D model in bioengineering research. Journal of Biomedical Science and Engineering. 3 (1), 20-26 (2010).
- Szmidt, M., et al. Morphology of human glioblastoma model cultured in ovo. Journal of Veterinary Research. 56 (2), 261-266 (2012).
- Jaworski, S., et al. Comparison of tumor morphology and structure from U87 and U118 glioma cells cultured on chicken embryo chorioallantoic membrane. Journal of Veterinary Research. 57 (4), 593-598 (2013).
- Yuan, Y. J., Xu, K., Wu, W., Luo, Q., Yu, J. L. Application of the chick embryo chorioallantoic membrane in neurosurgery disease. International Journal of Medical Sciences. 11 (12), 1275-1281 (2014).
- Urbańska, K., et al. The effect of silver nanoparticles (AgNPs) on proliferation and apoptosis of in ovo cultured glioblastoma multiforme (GBM) cells. Nanoscale Research Letters. 10, 98(2015).
- DeBord, L. C., et al. The chick chorioallantoic membrane (CAM) as a versatile patient-derived xenograft (PDX) platform for precision medicine and preclinical research. American Journal of Cancer Research. 8 (8), 1642-1660 (2018).
- Han, J. M., Jung, H. J. Synergistic anticancer effect of a combination of berbamine and arcyriaflavin A against glioblastoma stem-like cells. Molecules. 27 (22), 7968(2022).
- Ruiz-Ontañon, P., et al. Cellular plasticity confers migratory and invasive advantages to a population of glioblastoma-initiating cells that infiltrate peritumoral tissue. Stem Cells. 31 (6), 1075-1085 (2013).
- Cage, T. A., et al. Distinct patterns of human medulloblastoma dissemination in the developing chick embryo nervous system. Clinical & Experimental Metastasis. 29 (4), 371-380 (2012).
- Darrigues, E., et al. Biobanked glioblastoma patient-derived organoids as a precision medicine model to study inhibition of invasion. International Journal of Molecular Sciences. 22 (19), 10720(2021).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。