Method Article
Использование мозга эмбриона цыпленка в качестве модели для анализа поведения клеток глиобластомы человека in vivo и ex vivo
В этой статье
Резюме
Куриные эмбрионы используются для изучения опухолей головного мозга глиобластомы человека (GBM) в ово и в совместных культурах среза мозга ex vivo . Поведение клеток GBM может быть зарегистрировано с помощью покадровой микроскопии в кокультурах ex vivo , и оба препарата могут быть проанализированы на экспериментальной конечной точке с помощью детального 3D-конфокального анализа.
Аннотация
Эмбрион цыпленка был идеальной модельной системой для изучения развития позвоночных, особенно для экспериментальных манипуляций. Использование куриного эмбриона было расширено для изучения образования опухолей головного мозга при глиобластоме человека (GBM) in vivo и инвазивности опухолевых клеток в окружающие ткани мозга. Опухоли GBM могут образовываться путем инъекции суспензии флуоресцентно меченных клеток в желудочек среднего мозга E5 (оптический тектум) в яйцеклетной оболочке.
В зависимости от клеток GBM компактные опухоли случайным образом образуются в желудочке и внутри стенки мозга, а группы клеток вторгаются в ткань стенки мозга. Толстые срезы ткани (350 мкм) фиксированной текты E15 с опухолями могут быть иммуноокрашены, чтобы выявить, что вторгшиеся клетки часто мигрируют по кровеносным сосудам при анализе с помощью 3D-реконструкции конфокальных изображений z-стека. Живые срезы среднего и переднего мозга E15 (250-350 мкм) могут культивироваться на мембранных вставках, где флуоресцентно меченные клетки GBM могут быть введены в неслучайные места, чтобы обеспечить совместные культуры ex vivo для анализа клеточной инвазии, которая также может происходить вдоль кровеносных сосудов, в течение периода около 1 недели. Эти кокультуры ex vivo можно контролировать с помощью широкопольной или конфокальной флуоресцентной покадровой микроскопии для наблюдения за поведением живых клеток.
Затем совместно культивируемые срезы могут быть зафиксированы, иммуноокрашены и проанализированы с помощью конфокальной микроскопии, чтобы определить, произошло ли вторжение вдоль кровеносных сосудов или аксонов. Кроме того, система совместного культивирования может быть использована для исследования потенциальных межклеточных взаимодействий путем размещения агрегатов различных типов клеток и цветов в разных точных местах и наблюдения за движениями клеток. Медикаментозное лечение может проводиться на культурах ex vivo , тогда как эти методы лечения несовместимы с системой in ovo . Эти два взаимодополняющих подхода позволяют проводить детальный и точный анализ поведения клеток GBM человека и образования опухолей в среде мозга позвоночных, которой можно манипулировать.
Введение
Исследования поведения раковых клеток in vitro часто используются для анализа потенциальных механизмов, которые действуют во время более сложного поведения, которое наблюдается во время образования опухоли и клеточной инвазии в моделях ксенотрансплантата in vivo. Например, с глиобластомой (GBM) исследования in vitro раскрыли механизмы того, как L1CAM потенциально действует во время образования опухоли и вторжения в мозг вновой модели опухоли головного мозга ксенотрансплантата эмбриона цыпленка 1,2,3,4,5. Хотя эксперименты in vitro и in vivo дополняют друг друга полезными способами, они оставляют существенный пробел в том, как результаты могут быть коррелированы. Например, механистический анализ подвижности клеток GBM на чашке является в высшей степени искусственной ситуацией, а модели ксенотрансплантата in vivo могут выявить только статический анализ времени или конечной точки образования опухоли и поведения клеток. Исследования in vivo с использованием грызунов или цыплят-эмбрионов нелегко поддаются мониторингу поведения клеток, в то время как клетки вторгаются в ткань мозга в этих моделях ксенотрансплантата. Тем не менее, модель ксенотрансплантата куриного эмбриона продемонстрировала, что адгезионный белок L1CAM играет стимулирующую роль в инвазивной способности клеток T98G GBMчеловека 2,5.
Подходящее решение этой проблемы может быть достигнуто путем объединения методов in vivo и in vitro с использованием органотипической модели культуры среза мозга, называемой моделью ex vivo . В этой модели ex vivo живая ткань мозга может поддерживаться при толщине в несколько сотен микрон в течение нескольких недель, что позволяет имплантировать раковые клетки, наблюдать за их поведением в реальной ткани с течением времени, а затем выполнять более подробный анализ маркеров в конечной точке эксперимента.
Популярным органотипическим методом культивирования срезов было культивирование среза мозга толщиной в несколько сотен микрон поверх полупрозрачной или прозрачной пористой мембраны, оставляя ткань открытой для воздуха, но позволяя питательным средам поддерживать ткань из-под мембраны (см. Стоппини и др.6). Различные варианты этого метода использовались для разных исследований, в том числе с использованием разных сред или разных мембранных вставок. Различные мембранные вставки включают пористую (0,4 мкм) мембранную вставку диаметром 30 мм в чашке для культивирования 6 диаметром 35 мм и вставки для клеточных культур (0,4 мкм)для 6-луночных планшетов7. Различные среды включают 50% MEM/HEPES + 25% инактивированную теплом конскую сыворотку + 25% сбалансированный солевой раствор Хэнкса (HBSS)8, 50% восстановленную сыворотку + 25% лошадиную сыворотку + 25% HBSS9, а также другие. Если полупрозрачная или прозрачная мембрана используется вместе с флуоресцентно меченными клетками GBM, то такие культуры можно визуализировать снизу с помощью инвертированного широкопольного или конфокального флуоресцентного микроскопа 10,11,12,13,14,15.
В то время как многие модели ксенотрансплантата ортотопической опухоли головного мозга in vivo и органотипической культуры среза мозга ex vivo были созданы с использованием грызунов, как упоминалось выше, эмбрион цыпленка (Gallus gallus) недостаточно использовался для этих целей. Тем не менее, было продемонстрировано, что эмбрион цыпленка может быть использован в качестве модели ортотопического ксенотрансплантата in vivo для изучения инвазии глиомы человека и крысы 1,2,5. Ксенотрансплантированные клетки в мозг эмбриона цыпленка продемонстрировали паттерны инвазии, аналогичные тем, которые наблюдались на моделях грызунов, что еще раз подтверждает использование эмбрионов цыплят в качестве модели in vivo для анализа опухолевых клеток GBM. Эмбрионы цыплят также недороги, их легче поддерживать, чем грызунов (например, в их яичной скорлупе в лабораторном инкубаторе), и с ними гораздо легче работать, что делает их привлекательным вариантом для краткосрочных исследований GBM in vivo. В недавней статье описано использование культур срезов мозга куриных эмбрионов для формирования и роста аксонов во время нормального развития мозга, когда срезы были жизнеспособными в течение не менее 7 дней16. Однако использование таких культур срезов мозга куриных эмбрионов для анализа поведения клеток GBM в тканевой среде ex vivo отсутствует. В данной статье описана как трансплантация клеток GBM человека и стволовых клеток GBM (GSC) в мозг раннего эмбриона цыпленка in vivo, так и введение клеток GBM в культуры срезов мозга живого эмбриона цыпленка ex vivo. Также приведены некоторые репрезентативные примеры результирующих опухолей и моделей клеточной инвазии, полученных из этих препаратов.
протокол
Для проведения этой работы в Университете штата Делавэр не требовалось никакого разрешения или одобрения.
1. Инъекция клеток GBM в оптический тектум цыплят
- Подготовка клеток GSC и GBM к инъекциям
- Культура GSC в средах GSC (табл. 1). Культивирование установило клеточные линии GBM в средах GBM (табл. 1).
- Промойте клетки на тарелках стерильным фосфатно-буферным физиологическим раствором (PBS) и поместите 1 мл раствора трипсина в 10-сантиметровую посуду. Оставьте в инкубаторе клеточных культур на 2-3 минуты, пока клетки не начнут отделяться.
- Инактивируйте трипсин, добавив 10 мл соответствующей питательной среды, содержащей сыворотку, в 10-сантиметровую чашку и отделите клетки пипеткой вверх и вниз. Поместите клеточную суспензию в коническую центрифужную пробирку объемом 15 мл.
- Гранулируют ячейки центрифугированием при 800 × г в течение 5 мин при 4 °C.
- Аспирируйте среду из гранул клетки с помощью одноразовой пипетки из тонкого стекла, прикрепленной к колбе с боковым рычагом и вакуумному насосу. Ресуспендируют клетки в соответствующей питательной среде до концентрации 10 000 клеток на микролитр и помещают в микрофугу или небольшую пробирку с завинчивающейся крышкой на льду.
- Смешайте клетки с небольшим количеством стерильного 1% красителя Fast Green FCF (используйте соотношение 5 мкл красителя / 100 мкл клеточной суспензии).
- Инъекция клеток GBM в тектум зрительного нерва E5 в яйцеклетке. Смотрите дополнительный рисунок 1.
- Инкубируют оплодотворенные куриные яйца в увлажненном инкубаторе для яиц заостренным концом вниз при температуре 37,5 °C ( 1-й день инкубации - эмбриональный день 0 [E0]). На 6-й день инкубации (Е5) стерилизуют яичную скорлупу, опрыскивая 70% этанолом.
- С помощью свечника для яиц обведите карандашом по периметру воздушное пространство над зародышем и заклейте очерченный участок прозрачным скотчем.
- Используя изогнутые ножницы, аккуратно обрежьте прорисованный участок, стараясь не врезаться в эмбриональные оболочки или кровеносные сосуды, и выбросьте верхнюю часть яичной скорлупы.
- Поместите несколько капель физиологического раствора или среды для культивирования клеток на мембрану воздушного пространства, чтобы смочить ее, чтобы она легко отделилась. С помощью тонких щипцов осторожно проткните мембрану воздушного пространства над верхней частью эмбриона, извлеките ее и найдите голову куриного эмбриона.
- Используйте тонкие щипцы, чтобы захватить прозрачную мембрану амниона, которая непосредственно окружает эмбрион, чтобы расположить голову так, чтобы в зрительный тектум можно было вводить клетки. Одной рукой используйте тонкие щипцы, чтобы удерживать амнион, чтобы удерживать головку на месте во время процесса инъекции. Будьте осторожны, чтобы не повредить внезародышевые кровеносные сосуды в хориоаллантоисной оболочке на желтке.
ПРИМЕЧАНИЕ: Описанная выше процедура требует некоторой практики, чтобы иметь возможность эффективно захватить прозрачную мембрану амниона, которая тесно окружает эмбрион, поскольку она невидима, пока ее не схватят и не вытащат. Потренируйтесь использовать тонкие щипцы, чтобы захватить прозрачный амнион, который непосредственно окружает эмбрион. - Держите голову неподвижно, захватывая мембрану амниона тонкими щипцами. Используя стеклянную микропипетку и пневматический пиконасос, введите около 50 000 клеток в 5 мкл подходящей среды для культивирования клеток в оптический тектум (5 мкл составляет примерно 1/2 заполненной микропипетки).
ПРИМЕЧАНИЕ: См. Cretu et al.1 для изображения эмбриона E5, которому были введены клетки GBM, смешанные с красителем. - Поместите несколько капель 50 мг / мл ампициллина поверх эмбриона.
- Закройте отверстие в верхней части яиц прозрачной лентой и оставьте в увлажнителе до E15 для вскрытия.
2. Рассечение участков мозга эмбрионов Е15
ПРИМЕЧАНИЕ: Вскрытие мозга Е15 здесь для фиксации аналогично тому, которое описано на шаге 8.2 для живых срезов мозга, но вскрытие здесь не обязательно проводить в асептических условиях.
- Отрежьте ленту вокруг верхней части скорлупы, обеспечив доступ к зародышу.
- Обезглавьте эмбрион на шее и поместите голову в 10-сантиметровую посуду со стерильным раствором Tyrodes, не содержащим кальция и магния (CMF Tyrode's). Смотрите дополнительный рисунок 2.
- Используя тонкие щипцы, снимите кожу, покрывающую мозг, чтобы обнажить лежащую под ней твердую мозговую оболочку. Удалите формирующиеся кости черепа на левой и правой сторонах мозга. Формирующиеся кости черепа еще не покрывают большую часть мозга.
- Аккуратно используйте тонкие заостренные щипцы, чтобы разорвать мозговые оболочки, лежащие над центром мозга, и очистить их с каждой стороны, чтобы открыть мозг.
- Используйте изогнутые щипцы, чтобы зачерпнуть мозг снизу и осторожно вытащить его из полости.
- Рассекают мозг на его части: передний мозг, текту, мозжечок.
- Удалите вышележащую мягкую мозговую оболочку из текты с помощью тонких щипцов. Обратите внимание, что пиа легко отделяется от текты, но не от переднего мозга или мозжечка. Удалите пиа из переднего мозга, прикоснувшись к нему или прокатав его по небольшому кусочку фильтровальной бумаги.
- Поместите рассеченные области мозга в небольшую посуду.
- Поместите области мозга для фиксации в 24-луночный планшетный колодец и зафиксируйте в 2% параформальдегиде (PFA) в 0,1 М буфере какодилата натрия. Оставьте не менее чем на 24 часа при температуре 4 °C.
- После фиксации промойте ткань в 3x PBS в течение не менее 1 часа перед встраиванием в агар.
3. Встраивание и нарезка собранных областей мозга
- Предварительно подогрейте раствор 3,5% агара и 8% сахарозы в PBS до расплавления и держите его при температуре плавления.
- Используя изогнутые щипцы в качестве совка, осторожно возьмите либо оптический тектум, либо переднюю область мозга мозга куриного эмбриона и слегка промокните на фильтровальной бумаге, чтобы удалить лишнюю жидкость и обеспечить адгезию агара к внешней поверхности мозга.
- С помощью стерильной пипетки для переноса заполните форму раствором агара.
ПРИМЕЧАНИЕ: Простая форма может быть изготовлена путем формирования алюминиевой фольги вокруг объекта соответствующего размера, такого как небольшие прямоугольные металлические вибрирующие блоки для резки ткани. - Поместите область мозга в агар и дайте агару полностью затвердеть.
- Снимите алюминиевую фольгу со встроенного мозга и обрежьте излишки агара по бокам с помощью бритвенного лезвия или скальпеля.
- Нанесите каплю цианоакрилатного клея на квадрат из нержавеющей стали лотка для нарезки, поместите агарозный блок с мозгом на клей и дайте клею склеиться в течение 1 минуты. Поместите лоток в патрон вибрирующего тканевого слайсера, затяните и заполните лоток достаточным количеством PBS, чтобы покрыть верхнюю часть агарового блока.
- Разрежьте срезы мозга на вибрационном слайсере для слайсеров с толщиной 350 мкм с помощью стального бритвенного лезвия.
- Когда ломтики мозга нарезаются и свободно плавают в лоток для нарезки, используйте лопатку, чтобы зачерпнуть и удалить ломтики из лотка. Аккуратно сдвиньте срез со шпателя в чашку Петри с маркировкой 10 см с PBS, чтобы секции свободно плавали.
ПРИМЕЧАНИЕ: Агар, окружающий срез мозга, может отслоиться, если мозг недостаточно промокнут фильтровальной бумагой для удаления лишней жидкости перед встраиванием. Если это происходит, мозговая ткань может быть аккуратно удалена из затвердевшего агара и повторно внедрена после надлежащего промокания лишней жидкости.
4. Иммуноокрашивание срезов мозга опухолевыми клетками
- Используя стереомикроскоп, оснащенный эпифлуоресценцией, просейте отдельные срезы в 10-сантиметровой чашке один за другим на наличие или отсутствие опухолевых клеток.
- Приготовьте достаточное количество фосфатно-буферного физиологического раствора с 0,1% Triton X-100 и 5% нормальной козьей сывороткой (PBSTG) (см. Таблицу 1) для иммуноокрашивания и промойте срезы для иммуноокрашивания.
- Наполовину заполните лунки в 24-луночной пластине, которая будет использоваться для окрашивания срезов мозга с помощью PBS.
- Обрежьте углы агара вокруг срезов мозга краем шпателя или скальпеля и аккуратно поместите их в лунки, содержащие PBS.
- Аспирируют PBS и заменяют 350 мкл раствора для окрашивания первичных антител в PBSTG (например, 2 мкг/мл UJ127 в PBSTG).
- Инкубируйте в течение 24 ч в холодном помещении с легким перемешиванием, чтобы было видно, что ломтик свободно перемещается в лунке.
- Через 24 ч удалить раствор первичных антител и промыть 3 х 1 ч ПБСТГ в холодном помещении с перемешиванием.
- После завершения полоскания инкубируйте в 350 мкл / лунку раствора для окрашивания вторичных антител в PBSTG (например, 1/200 разведения биотина-GAM в PBSTG). Выдерживают в течение 20 ч в холодном помещении при перемешивании.
ПРИМЕЧАНИЕ: Если вы отказались от третичной стадии и инкубировали с флуорохромсодержащим вторичным антителом на этом этапе, накройте крышку для защиты от света во время инкубации, а затем перейдите к шагу 4.11. - Удалить раствор вторичных антител и промыть 3 х 1 ч в PBSTG в холодном помещении с перемешиванием.
- Удалите PBSTG и инкубируйте в третичном растворе (например,.разведение 1:250 стрептавидина Alexa Fluor 647 в PBSTG). При желании окрашивают ядра на этом этапе, добавляя в смесь 0,1 мкг/мл бисбензимида. Выдерживают в течение 20 ч в холодном помещении при перемешивании.
- Удалить третичный раствор и промыть 3 х 1 ч в ПБСТГ в холодном помещении с перемешиванием.
- Оставьте в PBS до готовности к установке на предметные стекла микроскопа.
5. Монтаж срезов на предметных стеклах микроскопа
- Подготовьте столько предметных стекол микроскопа, сколько секций для монтажа.
- Для каждого предметного стекла поместите полоску виниловой изоленты толщиной 50 мм (254 мкм) на кусок парапленки.
- Используя квадратный дырокол размером 1 см х 1 см, проделайте отверстие в центре изоленты и парапленки.
- Снимите ленту с парапленки и поместите ее поверх предметного стекла микроскопа, оставив место для этикеточной ленты на предметном стекле.
- С помощью микропипетки поместите одну или две капли крепежного носителя против выцветания в квадратное отверстие в центре изоленты.
- С помощью изогнутого шпателя поднимите нужную секцию вибрирующего тканевого слайсера из PBSTG и тщательно удалите влагу чистой лабораторной салфеткой или куском фильтровальной бумаги.
- Прикоснитесь краем среза к капле крепления и с помощью другого шпателя аккуратно вставьте секцию в монтажный носитель.
- Накройте секцию еще несколькими каплями крепления и осторожно поместите покровное стекло размером 24 мм x 30 мм (толщина #1,5) поверх секции и крепления.
- Запечатайте края покровного стекла лаком для ногтей, чтобы оно оставалось на месте.
6. Конфокальная микроскопия фиксированных срезов мозга
- Используйте широкопольную флуоресценцию для поиска флуоресцентных опухолей в установленном срезе мозга с помощью соответствующих линз объектива и набора фильтров.
ПРИМЕЧАНИЕ: Некоторые опухоли могут быть довольно большими и легко видны с 4-кратным объективом, в то время как для отдельных клеток может потребоваться 10-кратный объектив. - Переключитесь на конфокальную микроскопию, используя соответствующую линзу объектива, лазер (лазеры), размер точечного отверстия и настройки детектора. Чтобы следовать этому протоколу, используйте 20-кратный объектив (числовая апертура [N.A.] = 0,75) для обычной визуализации и 60-кратный масляный объектив (N.A. = 1,40) для изображений с высоким разрешением.
- Установите верхнюю и нижнюю границы оси Z и размер шага (для конкретной ситуации в соответствии с инструкциями производителя конфокального микроскопа) для получения оптических срезов. Приобретите z-стек оптических секций.
- Используйте программное обеспечение конфокального микроскопа для создания объемного 3D-рендеринга опухоли в соответствии с инструкциями производителя.
7. Подготовка сфероида
- Создание поли (2-гидроксиэтилметакрилат) (поли-HEMA) пластин
- Создайте раствор 10 мкг/мл поли-HEMA в 95% этаноле и покройте 35-миллиметровые чашки Петри (или чашки для клеточных культур) 1 мл этого раствора.
- Дайте посуде постоять на коромысле без крышки на ночь при комнатной температуре, чтобы поверхность посуды покрылась покрытием.
ПРИМЕЧАНИЕ: Растворитель испарится и оставит на блюде полупрозрачное покрытие, которое может показаться неровным, но это не повлияет на способность образовывать сфероиды клеток. - После высыхания стерилизуйте открытую посуду под ультрафиолетовым светом в шкафу биобезопасности в течение 1 часа. Замените крышки после стерилизации. Теперь посуда с покрытием готова к использованию.
- Флуоресцентное окрашивание DiD для покадровой микроскопии
ПРИМЕЧАНИЕ: Этот раздел предназначен для окрашивания отдельных клеток флуоресцентным красителем DiD, который будет использоваться для изготовления сфероидов, что оптимизирует визуализацию подвижности клеток для покадровой визуализации в реальном времени.- Суспендировать клетки в питательной среде, не содержащей сыворотки.
- Добавьте 5 мкл запаса DiD / мл клеточной суспензии и аккуратно перемешайте пипеткой. Выдерживать 20 мин при 37 °C.
- Центрифугируют меченую клеточную суспензию при 800 × г при 5 °С в течение 5 мин.
- Аспирируйте надосадочную жидкость и ресуспендируйте клетки в теплой среде для промывки.
- Повторите это центрифугирование и промываем еще два раза.
ПРИМЕЧАНИЕ: При желании перейдите к шагу 7.3.6, чтобы сделать сфероиды сразу после этого процесса.
- Создание клеточных сфероидов
- Подогреть 0,25% раствор трипсина/этилендиаминтетрауксусной кислоты (ЭДТА) до 37 °C.
- Культивирование ГСК в средахГСК 17 (табл. 1) и клеток злокачественной глоимы (МГ) U-118 в питательной среде U-118 (см. табл. 1). Используйте сливающуюся 10-сантиметровую тарелку для приготовления одной 35-миллиметровой пластины сфероидов. Сначала добавляйте факторы роста bFGF (конечная концентрация 10 нг/мл) и TGF-α (конечная концентрация 20 нг/мл) к GSC, а затем каждые 3 дня.
ПРИМЕЧАНИЕ: Клетки, используемые в текущем исследовании, были зелеными GSC15-2 / K72, зелеными GSC16-4 / K72, красными U-118 / L1LE / mCherry2x и красными U-118 / 1879 / mCherry2x. Одной пластины сфероидов должно быть достаточно для двух 6-луночных пластин мозговых срезов на мембранных вставках. - Промойте клетки на пластинах стерильным PBS и поместите 1 мл раствора трипсина на 10-сантиметровую посуду. Поместите в инкубатор клеточных культур на 2-3 минуты, пока клетки не начнут отделяться.
- Инактивируйте трипсин, добавив 10 мл соответствующей питательной среды, содержащей сыворотку, в 10-сантиметровую чашку и отделите клетки пипеткой вверх и вниз. Поместите клеточную суспензию в коническую центрифужную пробирку объемом 15 мл.
- Гранулируют ячейки центрифугированием при 800 × г в течение 5 мин при 4 °C.
- Аспирируют среду из клеточной гранулы и ресуспендируют клетки в 10 мл среды.
- Поместите 2 мл клеточной суспензии на каждую 35-миллиметровую чашку, покрытую поли-ГЕМА, и добавьте еще 2 мл соответствующей среды, чтобы получить 4 мл общей среды на чашку. Если вы используете GSC, добавьте факторы роста.
- Инкубируют клетки в клеточном инкубаторе до тех пор, пока агрегаты не достигнут размера 100-200 мкм, что может занять 1-2 дня в зависимости от плотности клеток, которые были покрыты.
8. Вскрытие мозга живого куриного эмбриона и нарезка вибрирующей ткани слайсером
- Подготовка к вскрытию
- Подготовьте 6-луночную пластину для вставки из полиэфирной мембраны с 1 мл питательной среды для среза мозга (см. Таблицу 1) под мембранной вставкой.
- Стерилизуйте рабочую зону и инструменты 70% этанолом.
- Поместите 6-луночную вставную пластину на лед во время вскрытия.
- Подготовьте 100 мл вибрирующей среды для слайсера для слайсера (таблица 1) и поместите на лед.
- Поместите флакон с 4% низкоплавкой агарозой в PBS на водяную баню до тех пор, пока он не растает в жидкость (примерно 50 ° C).
- Наполните ванну для слайсера вибрирующей салфетки льдом.
- Асептическое вскрытие мозга эмбриона цыпленка E14/15
- С помощью свечи для яиц обведите карандашом по периметру воздушного кармана над эмбрионом Е14 или Е15 и заклейте очерченный участок прозрачным скотчем.
- Используя изогнутые или тонкие ножницы, аккуратно обрежьте прорисованную область, стараясь не разрезать оболочку эмбриона или кровеносные сосуды, и выбросьте верхний кусок скорлупы.
- С помощью изогнутых щипцов удалите мембрану воздушного пространства над верхней частью эмбриона и найдите голову куриного эмбриона.
- Обезглавьте эмбрион и поместите голову в 10-сантиметровую посуду с холодным стерильным раствором CMF. Смотрите дополнительный рисунок 2.
- Используя стерильные тонкие щипцы, снимите кожу, покрывающую мозг, чтобы обнажить лежащую в основе твердую мозговую оболочку. Удалите формирующиеся кости черепа на левой и правой сторонах мозга. Формирующиеся кости черепа еще не покрывают большую часть мозга.
- Аккуратно используйте тонкие заостренные щипцы (#5 или #55), чтобы разорвать мозговые оболочки, лежащие над центром мозга, и очистить их с каждой стороны, чтобы открыть мозг.
- Используя тонкие изогнутые щипцы, зачерпните мозг снизу вперед и осторожно вытащите его из полости.
- Рассекают мозг на три основные части: передний мозг, средний мозг (оптические текты), мозжечок. При необходимости обратитесь к атласу развития цыплят.
- Удалите вышележащую мягкую мозговую оболочку из текты с помощью тонких щипцов.
ПРИМЕЧАНИЕ: Пиа легко отделяется от текты, но не от переднего мозга или мозжечка. Пиа можно удалить из переднего мозга, прикоснувшись к нему или прокатав по стерильной марле. - Поместите рассеченные области мозга в небольшую стерильную посуду со льдом.
- Встраивание и нарезка мозга
- Используя изогнутые щипцы в качестве совка, осторожно возьмите либо тектум зрительного нерва, либо область переднего мозга и слегка промокните стерильную марлю, чтобы удалить лишнюю жидкость, чтобы обеспечить адгезию агарозы к внешней поверхности мозга.
- С помощью стерильной пипетки для переноса заполните форму неплавкой агарозой. Подготовьте простую форму, сформировав алюминиевую фольгу вокруг объекта соответствующего размера. В качестве объекта обычно используется небольшой прямоугольный металлический вибрирующий блок для резки ткани. Смотрите дополнительный рисунок 3.
- Быстро поместите область мозга в агарозу и дайте ей застыть (примерно 4-5 минут) на льду.
ПРИМЕЧАНИЕ: Мозг может опуститься на дно формы до того, как агароза затвердеет. Если это произойдет, подождите 1 минуту, чтобы агар начал застывать, а затем поместите область мозга в агарозу. Попробуйте подвешивать область мозга непосредственно в середине агарозы. - Удалите алюминиевую фольгу вокруг встроенного мозга в затвердевшую агарозу и обрежьте излишки агарозы по бокам с помощью стерильного бритвенного лезвия или скальпеля.
- Нанесите каплю цианоакрилатного клея на квадрат из нержавеющей стали на блюде/противне для нарезки, поместите агарозный блок с мозгом и дайте клею склеиться в течение 1 минуты. Поместите блюдо/противень в патрон вибрирующего тканевого слайсера, затяните и заполните противень нарезкой, чтобы покрыть верхнюю часть агарозного блока.
- Разрежьте срезы на вибрационном слайсере для слайсера с разрешением 250-350 мкм с помощью сапфирового ножа, который, как сообщается, приводит к меньшему повреждению живых тканей, чем стальное лезвие бритвы.
- Когда ломтики мозга нарезаются и свободно плавают в лоток для нарезки, используйте стерильный шпатель, чтобы зачерпнуть и вынуть ломтик из лотка. Аккуратно сдвиньте часть шпателя на мембранный вкладыш с помощью другого стерильного шпателя.
ПРИМЕЧАНИЕ: Обычно при желании на каждую мембранную вставку можно поместить два или три среза мозга. Агароза, окружающая срез мозга, может отслоиться, если мозг недостаточно промокнут стерильной марлей для удаления лишней жидкости. Если это все еще происходит после достаточного промокания перед встраиванием, аккуратно возьмите ломтик без окружающей агарозы и наденьте его на мембранную вставку. - Поместите 6-луночную пластину с срезами мозга на мембранные вставки в инкубатор клеточных культур при 37 ° C и 5% CO2.
- На следующий день после нанесения покрытия используйте стерильную пипетку Пастера, чтобы аспирировать носитель из-под вкладыша (по бокам вкладышей есть зазоры, позволяющие пипетке получить доступ к среде внизу). Добавьте по 1 мл свежего среза в каждую лунку под мембранной вставкой. После этого продолжайте менять носитель через день.
- Подождите несколько дней, пока срезы мозга прочно прикрепятся к мембранным вставкам и, по-видимому, несколько сплющиваются. Это признак того, что срезы жизнеспособны и готовы к введению клеток GBM.
9. Введение клеток GBM на срезы мозга
- Сфероидный метод
- После того, как сфероиды клеток достигнут размера 150-200 мкм, используйте микропипетку объемом 20 мкл, установленную на 5 мкл, чтобы удалить от одного до нескольких сфероидов из чашки для культивирования. Смотрите дополнительный рисунок 3.
- Аккуратно вытесните носитель со сфероидами на нужный срез мозга.
ПРИМЕЧАНИЕ: Сфероиды клеток должны быть видны на наконечнике пипетки. Использование прозрачного наконечника пипетки облегчит их разглядение в наконечнике. Если сфероид падает со среза мозга при высвобождении жидкости, следует использовать стерилизованную этанолом ресницу, приклеенную к тонкой деревянной палочке-аппликатору, чтобы аккуратно подтолкнуть сфероид обратно к срезу мозга. - Дайте сфероидам культивироваться на срезах мозга в течение 2-5 дней.
ПРИМЕЧАНИЕ: Ограничением здесь, по-видимому, является возможная деградация кровеносных сосудов и клеток мозга в срезе. Деградировавшие кровеносные сосуды будут выглядеть как прерывистые шарики в срезе при окрашивании на ламинин.
- Метод биопсии перфоратора
- Позвольте срезам мозга прикрепиться, показавшись, что они сплющиваются на мембранной вставке (может занять 2-5 дней в культуре).
- Разморозьте клеточную матрицу на льду.
- В шкафу биобезопасности клеточных культур подсоедините стерильный пуансон для биопсии диаметром 1 мм к вакуумной аспираторной трубке.
- Осторожно прикоснитесь к срезу мозга с помощью биопсийного перфоратора, чтобы создать отверстие диаметром 1 мм в центре среза мозга.
ПРИМЕЧАНИЕ: Ткань в пуансоне для биопсии будет аспирирована в пуансон вакуумом. - Приготовьте суспензию клеточного матрикса путем трипсинизации 60-70% сливающейся 10-сантиметровой чашки клеток и ресуспендирования в 10 мл среды; затем смешайте 1 мл этой суспензии со 100 мкл матрицы.
- Используя микропипетку объемом 20 мкл, поместите 1 мкл смеси клеточного матрикса в каждое отверстие в срезах мозга.
- После того, как размещение клеточной смеси будет завершено, поместите чашку с кусочками мозга со встроенными клетками обратно в инкубатор и дайте матрице затвердеть, а клеткам потенциально вторгнуться в окружающий срез мозга.
10. Широкопольная флуоресцентная покадровая микроскопия
- Поместите съемную ленту по краю 6-луночной пластины, чтобы предотвратить испарение среды, оставив с одной стороны небольшой зазор для газообмена.
- Поместите планшеты в индивидуальную культуральную камеру на регулируемом автоматизированном столике на инвертированном эпифлуоресцентном микроскопе.
ПРИМЕЧАНИЕ: Камера поддерживалась при атмосферных условиях 5% CO2 и 95% воздуха с помощью контроллера впрыска газа, а температура поддерживалась на уровне 37 ° C с помощью регулятора температуры теплого воздуха и вставки ступени с регулируемой температурой. Подробнее об используемой здесь системе см. Fotos et al.18 . - Используя подходящее программное обеспечение для управления микроскопом, создайте график покадровой съемки, который собирает флуоресцентные изображения интересующих областей каждые 10 минут в течение 20 часов.
ПРИМЕЧАНИЕ: Если в клетках используется зеленая флуоресцентная метка (например, зеленый флуоресцентный белок [GFP]), то используйте минимальное количество синего возбуждающего света, необходимое для визуализации клеток, чтобы предотвратить фототоксичность. Красные (например, mCherry) и дальние красные (например, DiD) метки, по-видимому, не имеют этой потенциальной проблемы из-за возбуждения с большей длиной волны.
11. Иммуноокрашивание срезов мозга после покадровой микроскопии
ПРИМЕЧАНИЕ: Этот протокол иммуноокрашивания оптимизирован для окрашивания кровеносных сосудов ламинином и ядер бисбензимидом. Используйте соответствующие антитела для желаемой молекулы (молекул), представляющей интерес.
- Аспирируйте среду из-под мембранного вкладыша с помощью пипетки Пастера и поместите 1 мл 2% PFA в 0,1 М буфер какодилата натрия под вставку и 1 мл поверх вкладыша, чтобы покрыть срез мозга. Дайте ломтикам закрепиться на ночь при температуре 4 °C.
- Удалите фиксатор из-под мембранной вставки и любой фиксатор, оставшийся на срезе мозга (фиксатор имеет тенденцию просачиваться через мембранную вставку в лунку ниже).
- Извлеките вставку с ломтиками из лунки 35 мм и поместите их в пластиковую посуду большего размера.
- Подготовьте 24-луночную пластину, добавив 350 мкл PBS в столько лунок, сколько есть срезов мозга (один кусочек / лунка при иммуноокрашивании).
- С помощью тонкого шпателя аккуратно удалите агарозу вокруг среза мозга, не отсоединяя срез мозга от мембранной вставки. Убедитесь, что агароза легко отделяется от внешнего края среза мозга. Если нет, оставьте агарозу прикрепленной к срезу мозга.
- Используя острый скальпель, разрежьте мембрану вокруг среза мозга до тех пор, пока срез с нижележащей мембраной не освободится от остальной части вставки. Возьмите мембрану с прикрепленным срезом мозга, используя тонкие щипцы, чтобы захватить мембрану, и поместите ее в лунку 24-луночной пластины в PBS.
- Промойте ломтики 3 раза с помощью PBS в течение 1 ч в холодном помещении при постоянном легком перемешивании или покачивании, чтобы ломтик перемещался внутри лунки.
- Во время полоскания приготовьте первичный раствор антител.
- Разбавьте антиламинин до 2 мкг/мл в PBSTG (см. Таблицу 1).
- Удалите PBS из лунок и инкубируйте в течение ночи в растворе первичных антител в холодном помещении с легким перемешиванием.
- По крайней мере, через 20 ч инкубации аспирируют раствор первичного антитела и промывают срезы 3 раза в течение 1 ч в PBSTG.
- Во время полоскания приготовьте раствор вторичных антител.
- Разбавьте флуоресцентный GAM специфическим флуорохромом, необходимым для разведения 1:200 в PBSTG вместе с концентрацией бисбензимида 0.1 мкг/мл.
- Удалить PBSTG и инкубировать в течение ночи в холодном помещении с перемешиванием в растворе флуоресцентного вторичного антитела.
- Удалите вторичное антитело и промывайте 2 раза в течение 1 ч в PBSTG и 1 раз в течение 1 ч в PBS.
- Оставьте в PBS до готовности к установке на предметные стекла микроскопа (раздел 5) и просмотру.
Результаты
Здесь представлены несколько рисунков, показывающих некоторые репрезентативные результаты, которые были получены при выполнении инъекций in vivo в тектум зрительного нерва (рис. 1 и рис. 2), культивировании живых срезов мозга и оценке их жизнеспособности (рис. 3), создании культур срезов мозга ex vivo и имплантации флуоресцентно меченных клеток с использованием метода биопсии (рис. 4), генерации клеточных сфероидов путем культивирования клеток на поли-HEMA (рис. 5), создавая совместные культуры среза мозга ex vivo с клеточными сфероидами и регистрируя инвазивное поведение клеток с помощью 4D-конфокальной покадровой микроскопии (рис. 6), а также анализируя инвазивное поведение клеток сфероидов относительно кровеносных сосудов в фиксированных препаратах среза мозга (рис. 7 и рис. 8). Эти результаты ни в коем случае не являются исчерпывающими, а скорее дают хорошие примеры того, что можно получить, используя мозг куриного эмбриона в качестве модели ксенотрансплантата для исследования GBM человека.
На рисунке 1 показаны некоторые репрезентативные результаты опухолей, которые образовались в тектуме зрительного нерва in vivo после инъекции ГСК, экспрессирующих GFP. ГСК прикрепляются к поверхности желудочков и образуют инвазивные опухоли в стенке головного мозга. GSC явно находятся рядом с кровеносными сосудами и, по-видимому, мигрируют вдоль них. Видеоролики вращающихся объемных 3D-рендеров фиксированных и иммуноокрашенных срезов опухолей GSC in vivo представлены в Дополнительном видео S1, Дополнительном видео S2, Дополнительном видео S3 и Дополнительном видео S4. В этом эксперименте четыре цвета были использованы для идентификации пяти признаков (зеленые GSC, белые ядра, белые кровеносные сосуды, синий интегрин альфа-6 и либо красный Sox2, либо красный нестин).
На рисунке 2 показаны некоторые репрезентативные результаты опухолей, которые образовались в тектуме зрительного нерва in vivo после инъекции GSC, экспрессирующих GFP, смешанных с клетками U-118 / L1LE2 , экспрессирующими mCherry из-за трансдукции ретровирусного вектора. Эти эксперименты показали, что, поскольку эти опухоли формировались из суспензии смешанных клеток, сортировка происходила таким образом, что GSC находились либо на периферии, либо в центре, в то время как клетки U-118 составляли либо внутреннее ядро, либо внешнюю кору, в зависимости от конкретной линии GSC.
На рисунке 3 показаны результаты жизнеспособности культур срезов мозга ex vivo . Через 1 неделю в культуре фиксация и иммуноокрашивание ламинина выявили множество неповрежденных кровеносных сосудов и экспрессию Sox2, которые были использованы здесь для демонстрации жизнеспособности среза мозга. Это показало, что срезы мозга куриного эмбриона могут культивироваться на мембранных вставках в течение примерно 2 недель и оставаться жизнеспособными с нормально выглядящими кровеносными сосудами и экспрессией транскрипционного фактора.
На рисунке 4 показаны результаты введения «пробок» красных клеток U-118/L1LE/mCherry (смешанных с матриксом) в срезы мозга ex vivo после создания полостей в срезах методом биопсии. Клетки U-118 явно вторгались в ткани мозга, иногда экстенсивно, а часто и вдоль кровеносных сосудов. Однако клеточная инвазия не была равномерной по окружности введенных клеток. Кровеносные сосуды иногда также казались поврежденными или отсутствовали в определенных срезах, по-видимому, из-за дополнительной травмы метода удара или продолжительности времени в культуре. Это показало, что метод биопсийного пуансона / клеточной пробки может быть использован для введения клеток GBM в определенные места в культивируемом срезе мозга ex vivo , после чего клетки вторгаются в срез мозга.
На рисунке 5 показаны живые сфероиды в культуре и несколько примеров широкопольной флуоресценции живых сфероидов клеток GBM, введенных в срезы мозга ex vivo для покадровых экспериментов. Видеоролики о клеточном вторжении из сфероидов в срез мозга приведены в Дополнительном видео S5 и Дополнительном видео S6 . Это показало, что клеточные сфероиды являются еще одним успешным методом введения клеток GBM или GSC в определенные места среза мозга ex vivo , а инвазивное поведение клеток можно контролировать с помощью широкопольной флуоресцентной микроскопии, хотя разрешение отдельных клеток может быть плохим.
На рисунке 6 показаны статические изображения конфокальных покадровых экспериментов по инвазии живых клеток GSC16-4/GFP и U-118/L1LE/mCherry в срезы мозга. Конфокальные z-stack изображения были получены каждые 10 минут в течение 20 часов в многоточечном эксперименте с интервальной съемкой. Видеоролики о клеточной инвазии из сфероидов в срезы мозга, взятые в виде конфокальных z-стеков с течением времени, представлены в Дополнительном видео S7, Дополнительном видео S8, Дополнительном видео S9, Дополнительном видео S10 и Дополнительном видео S11. Этот эксперимент показал, что конфокальная покадровая съемка превосходит широкопольную флуоресценцию для отслеживания индивидуального инвазивного поведения клеток. Клетки U-118 / L1LE были заметно более инвазивными, чем GSC в этих условиях. Это очевидно даже на статических изображениях, где GSC расположены более центрально, а ячейки U-118 более рассредоточены.
На рисунке 7 показано несколько примеров препаратов среза мозга/сфероидов ex vivo , где два разных отдельно меченных сфероида (сфероиды U-118/L1LE/mCherry и сфероиды GSC16-4/GFP) помещали на срезы мозга, выращивали в течение нескольких дней, а затем фиксировали, иммуноокрашивали ламинином и визуализировали с помощью оптического среза на конфокальном микроскопе. Это показало, что оба типа клеток вторглись в срез мозга и путешествовали по кровеносным сосудам. Когда различные типы сфероидов были достаточно близки, чтобы контактировать друг с другом, казалось, что вторжение одного типа клеток в сфероид другого типа клеток было незначительным, если вообще было, и сфероиды оставались сегрегированными.
На рисунке 8 показано несколько примеров препаратов среза мозга/сфероидов ex vivo , в которых сфероиды «смешанного клеточного типа», полученные в культуре с использованием двух по-разному меченных типов клеток (U-118 / L1LE / mCherry, смешанных с GSC16-4 / GFP), помещали на срезы мозга, выращивали в течение нескольких дней, а затем фиксировали, иммуноокрашивали для ламинина и визуализировали с помощью оптического среза на конфокальном микроскопе. Это показало, что красные клетки U-118 / L1LE / mCherry мигрировали из сфероидов и рассеивались гораздо более явно, чем зеленые клетки GSC16-4 / GFP, которые, как правило, оставались в скоплениях вблизи центра сфероидов. Кроме того, клетки U-118/L1LE/mCherry также окрашивали с помощью DiD, чтобы можно было сравнивать две отдельные метки (mCherry и DiD) непосредственно в фиксированных препаратах ex vivo . Метка DiD все еще может быть обнаружена даже в отдельных клетках, которые вторглись в срез мозга; Однако это было как внутриклеточная точка.
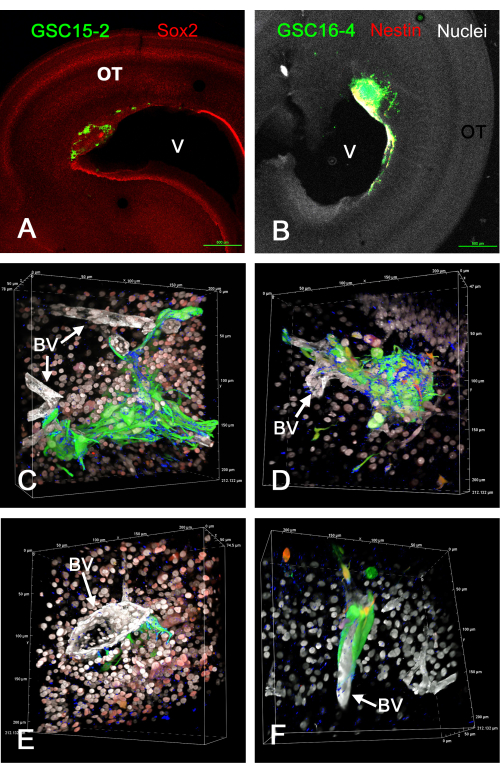
Рисунок 1: Опухоли при E15, возникающие в результате инъекции GSC в оптический тектум E5 in vivo. GSC имеют зеленый цвет из-за экспрессии GFP. Ячейки GSC15-2 показаны на панелях A, C и E, а ячейки GSC16-4 показаны на панелях B, D и F. (A) Вид тектума зрительного нерва с малым увеличением с опухолью вблизи желудочка (V). Красным цветом показано окрашивание Sox2, которое окрашивает большинство ядер клеток OT. (B) Изображение, аналогичное A, но с клетками GSC16-4, которые также окрашены на гнездо в красный цвет, который может казаться желтым или белым на изображении из-за смешивания цветов и экспозиции изображения. Ядра OT кажутся белыми из-за встречного окрашивания бисбензимидом. (С-Ж) Различные перспективы рендеринга объема, генерируемые из z-стеков с использованием 60-кратного иммерсионного объектива в масло. Ядра клеток кажутся белыми из-за окрашивания бисбензимидом, а некоторые из них кажутся красными на панелях C и E из-за иммуноокрашивания на Sox2. Красное окрашивание на панелях D и F происходит от окрашивания для гнезда. Обратите внимание, что из-за «альфа-смешивания» для объемного рендеринга в программном обеспечении конфокального микроскопа цвета не смешиваются, как при использовании проекции максимальной интенсивности, и наиболее распространенный цвет преобладает и затемняет менее интенсивный цвет. Кровеносные сосуды окрашиваются в белый цвет из-за иммуноокрашивания на ламинин. Окрашивание маркером GSC интегрин альфа-6 показано синим цветом и выглядит пунктированным на поверхностях GSC. Микронные масштабы показаны по краям объемных рендеров. Видео вращения объемных рендеров на панелях C-F представлены в Дополнительном видео S1, Дополнительном видео S2, Дополнительном видео S3 и Дополнительном видео S4. Масштабные линейки = 500 мкм (A, B). Сокращения: GSC = стволовые клетки глиобластомы; OT = тектум зрительного нерва; GFP = зеленый флуоресцентный белок; BV = кровеносный сосуд. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
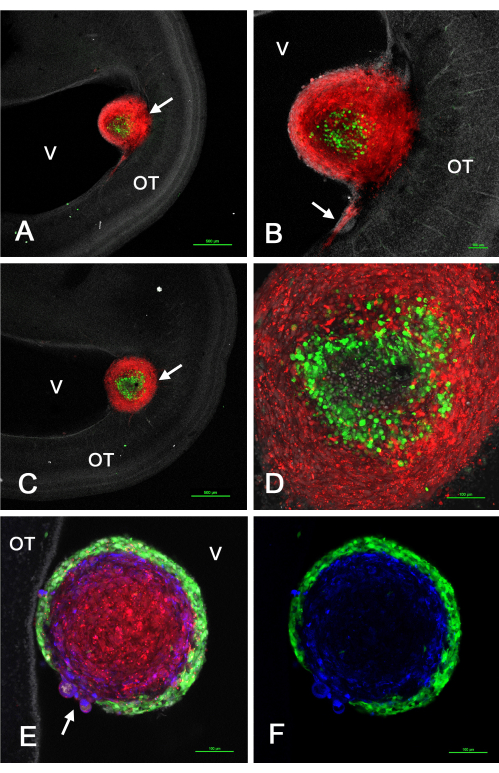
Рисунок 2: Опухоли при E15, возникающие в результате смеси GSC и клеток U-118 GBM, введенных в оптический тектум E5. GSC зеленые из-за экспрессии GFP, а клетки U-118 / L1LE - красные из-за экспрессии mCherry. GSC15-2 показаны на панелях A-D, а GSC16-4 показаны на панелях E и F. (A) Конфокальная одиночная z-плоскость смешанной клеточной опухоли (стрелка) вблизи желудочка с малым увеличением. Ядра окрашены бисбензимидом в белый цвет. (B) Более высокое увеличение (10-кратный объектив) опухоли, показанной в А, с вторжением красных клеток U-118 в OT вблизи поверхности желудочков. (C) Несколько иная плоскость оптического сечения, чем в А, показывающая опухоль (стрелка), встроенную глубже в стенку ОТ. (D) Максимальная проекция (20-кратная цель) нескольких z-плоскостей опухоли в C, показывающая детали отсортированных клеток в опухоли. (E) Одиночное изображение в z-плоскости (объектив 20x) смешанной опухоли с клетками GSC16-4, показывающее, что сортировка внутри опухоли происходила по схеме, противоположной клеткам GSC15-2, при этом зеленые GSC создавали тонкую и ровную кору, окружающую красные клетки U-118. Область прикрепления опухоли к стенке ОТ в этой z-плоскости не показана. Обратите внимание на область опухоли, где есть разрыв коры GSC с выпячивающимися клетками U-118 / L1LE (стрелка). Иммуноокрашивание на L1CAM показано синим цветом. (F) То же изображение, что и в E, но показывает только зеленые GSC и синее окрашивание L1CAM. Масштабные линейки = 500 мкм (A, C), 100 мкм (B, D, E, F). Сокращения: GSC = стволовые клетки глиобластомы; OT = тектум зрительного нерва; GFP = зеленый флуоресцентный белок; V = желудочек. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
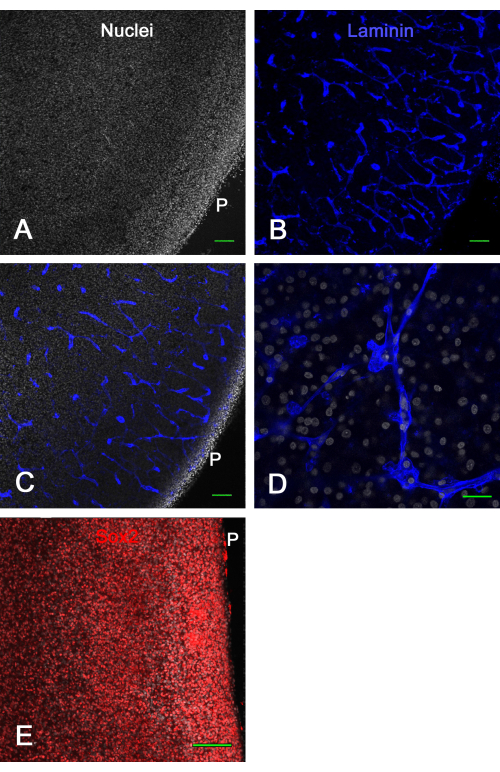
Рисунок 3: Жизнеспособность срезов тектума оптики ex vivo через 1 неделю в культуре. Срезы тектума зрительного нерва E14 культивировали на мембранных вставках в течение 1 недели, а затем фиксировали и иммуноокрашивали. В А и В показаны конфокальные изображения (объектив 10x) среза мозга, окрашенного на ядра бисбензимидом (А) и иммуноокрашенного на ламинин (В), на которых ясно видны нормальные, неповрежденные кровеносные сосуды, оптически срезанные в различных конфигурациях благодаря окрашиванию ламинином. (C) Конфокальное изображение, аналогичное тому, которое показано на панелях А и В , где видны ядра и окрашивание ламинина. (D) Конфокальное изображение с большим увеличением (60-кратный масляный объектив), показывающее детали ядерного окрашивания и окрашивания ламинина. (E) Максимальное проекционное изображение конфокального z-стека (20-кратный объектив) среза мозга, окрашенного на фактор транскрипции Sox2 красным цветом и полными ядрами бисбензимидом в белом цвете. Обратите внимание, что большинство ядер демонстрируют окрашивание Sox2, как показано in vivo (см. рис. 1). Масштабные линейки = 100 мкм (A, B, C, E), 25 мкм (D). Аббревиатура: P = пиальная поверхность. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
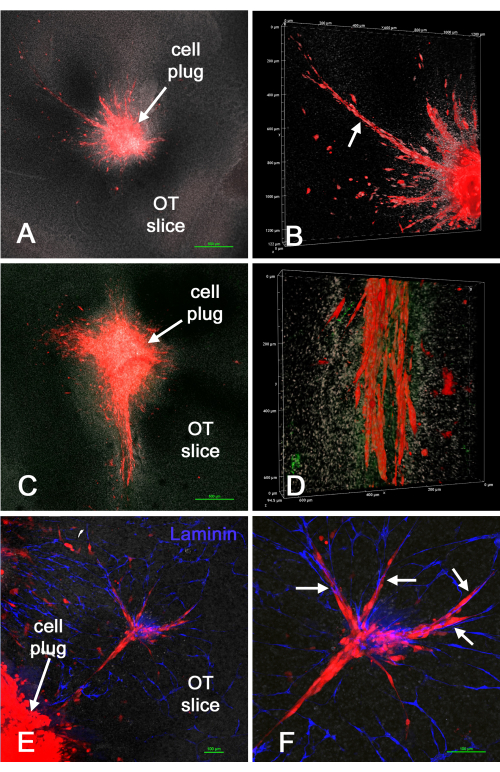
Рисунок 4: Клетки U-118 / mCherry, помещенные в срез мозга ex vivo с помощью метода биопсии. Полости были созданы в срезах мозга с использованием 1-миллиметрового биопсийного перфоратора, а затем красные клетки U-118 / L1LE / mCherry, смешанные с матрицей, были имплантированы в качестве «пробки». Через несколько дней срезы мозга были зафиксированы, иммуноокрашены для ламинина и установлены на предметных стеклах для анализа конфокальным микроскопом. На панелях A и C показаны конфокальные изображения в плоскости Z с малым увеличением (объектив 4x) полученной «опухоли» и окружающих клеток, которые вторглись в срез мозга. (B) Объемный рендеринг z-стека из препарата на панели A при большем увеличении (20-кратный объектив), показывающий обширное вторжение ячеек U-118 (стрелка). (D) На рисунке показана аналогичная объемная визуализация нижней части интенсивно вторгающихся ячеек, показанных на панели C. Окрашивание ламинина показано зеленым цветом, но прозрачных кровеносных сосудов не видно. (E) На изображении показана часть клеточной пробки и группа клеток, которые вторглись в срез мозга, а также окрашивание ламинина для кровеносных сосудов в синий цвет. (F) Более высокое увеличение вторгшихся клеток, показанных на панели E, и клетки четко видны вдоль кровеносных сосудов (стрелки). На всех панелях видно белое ядерное контрокрашивание бисбензимидом. Масштабные линейки = 500 мкм (A,C), 100 мкм (E,F). Масштаб для панелей B и D проходит по осям рендеринга объема. Аббревиатура: OT = оптический тектум. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.

Рисунок 5: Сфероиды живых клеток в культуре и широкопольные флуоресцентные изображения живых клеток GBM в срезах мозга ex vivo. На панелях A и B показаны фазово-контрастные изображения (с использованием 10-кратного объектива на инвертированном микроскопе) клеток U-118/L1LE GBM (A) и GSC (B), растущих в виде сфероидов (стрелки). На заднем плане панели А показана неравномерность расфокуса покрытия поли-HEMA, которая может возникнуть на чашке для культивирования клеток. На панелях C-F показаны широкопольные флуоресцентные изображения сфероидов клеток U-118 / L1LE и вторгающихся клеток (стрелки) во время покадрового эксперимента для мониторинга живого поведения вторжения в срезы ex vivo (с использованием 20-кратного объектива на специальной системе покадрового микроскопа18). В панелях C и E клетки окрашивают дальним красным флуоресцентным мембранным красителем DiD, а в панелях D и F клетки визуализируются через их экспрессию красной mCherry. Масштабные линейки = 100 мкм. Видеозаписи экспериментов с широкопольной флуоресцентной покадровой съемкой, показанные на панелях C и D, размещены в дополнительных видео S5 и дополнительных видео S6 соответственно. Сокращения: GBM = глиобластома; GSC = стволовые клетки GBM; S = сфероид. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
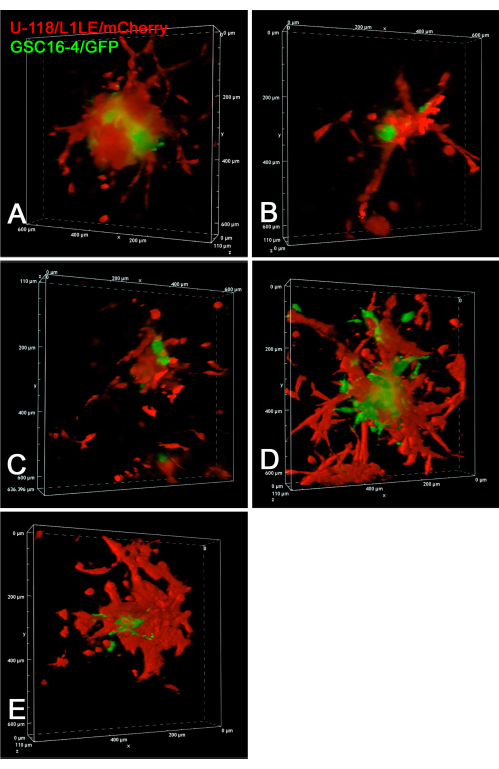
Рисунок 6: Объемный рендеринг изображений конфокального 4D-таймлапса живых клеток GSC и GBM. На всех панелях показаны конечные изображения пяти различных смешанных клеточных сфероидных трансплантатов на отдельных срезах мозга. Для панелей A-E конфокальные изображения z-стека были получены с шагом 10 мкм каждые 10 минут в течение 20-часового периода. Препараты включали срезы мозга с имплантированными смешанными клеточными сфероидами красных клеток U-118/L1LE/mCherry и зеленых клеток GSC16-4/GFP. Конфокальные изображения были сделаны, в то время как срезы мозга культивировались на мембранных вставках в 6-луночной пластиковой чашке для культивирования клеток с использованием 20-кратной линзы объектива со сверхдлинным рабочим расстоянием (ELWD) (0,45 NA), что обеспечивало необходимое дополнительное рабочее расстояние. Объемные рендеры были сгенерированы с помощью программного обеспечения конфокального микроскопа «Alpha Blending», которое дает очевидный 3D-эффект. Покадровые видеоролики этих конфокальных объемных рендеров с течением времени представлены в Дополнительном видео S7, Дополнительном видео S8, Дополнительном видео S9, Дополнительном видео S10 и Дополнительном видео S11. Сокращения: GBM = глиобластома; GSC = стволовые клетки GBM; GFP = зеленый флуоресцентный белок; NA = числовая апертура. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
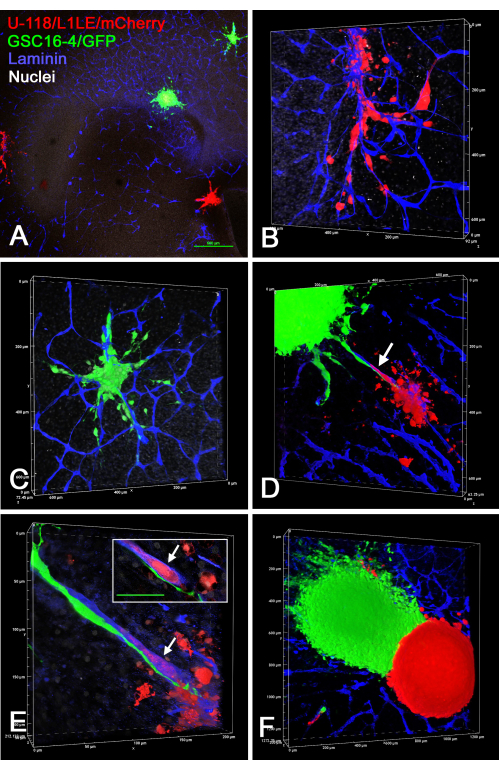
Рисунок 7: Конфокальные изображения фиксированных срезов мозга с инвазивными клетками GBM из сфероидов разных типов клеток. Зеленые сфероиды состояли из клеток GSC16-4/GFP, а красные сфероиды состояли из клеток U-118/L1LE/mCherry. На панелях A-F показаны различные виды срезов мозга, на которых несколько красных и зеленых сфероидов культивировались в течение нескольких дней перед фиксацией и иммуноокрашиванием на ламинин (синий). Панели A-C относятся к тому же срезу OT, где A был взят с 4-кратным объективом, а панели B и C представляют собой рендеры с более высоким объемом увеличения (20-кратный объектив) клеток, которые вторглись в срез мозга из двух сфероидов, показанных на панели A. Оба типа клеток явно вторгались в ткани вдоль кровеносных сосудов. На панели D показан объемный рендеринг (20-кратный объектив) другого среза мозга, где два разных сфероида были расположены близко друг к другу, и видно, как клетки обоих мигрируют по одному и тому же кровеносному сосуду, расположенному между ними (стрелка). Панель E представляет собой объемный рендеринг с большим увеличением (60-кратный масляный объектив), показывающий, что зеленые клетки мигрируют вдоль внешней поверхности кровеносного сосуда, в то время как эритроциты мигрируют внутри кровеносного сосуда (стрелка). На врезке показан один оптический срез z-плоскости, где эритроцит четко окружен синим окрашиванием кровеносного сосуда (стрелка), а зеленая клетка явно находится вне кровеносного сосуда. Масштабная линейка во вставке = 50 мкм. На панели F показан объемный рендеринг (10-кратный объектив) среза переднего мозга с двумя близко расположенными сфероидами разного цвета. Очень мало, если вообще было, инвазия клеток происходила из одного сфероида в другой, и между ними существовала резкая граница. На панелях A, B, C и E также показано белое ядерное контрокрашивание бисбензимидом. Масштабная линейка = 500 мкм (А). Шкалы для панелей B-F расположены вдоль осей объемного рендеринга. Сокращения: GBM = глиобластома; GSC = стволовые клетки GBM; GFP = зеленый флуоресцентный белок; OT = оптический тектум. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
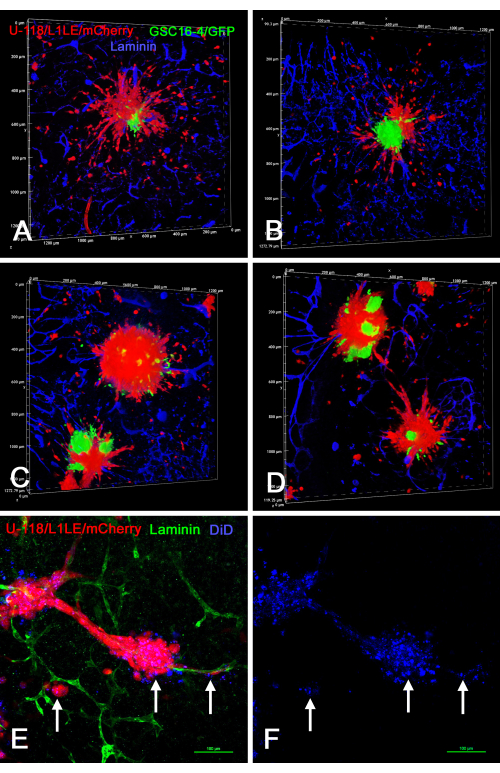
Рисунок 8: Конфокальные изображения фиксированных срезов мозга с инвазивными клетками GBM из смешанных клеточных сфероидов и сфероидов, меченных DiD. Панели A-D показывают объемные рендеры срезов мозга, которые содержали смешанные клеточные сфероиды, состоящие из зеленых клеток GSC16-4 / GFP и красных клеток U-118 / L1LE / mCherry. Многочисленные красные клетки U-118 рассеялись от сфероидов и вторглись в срез мозга во всех направлениях, тогда как зеленые GSC не рассеялись и остались в центральных местах сфероидов. На панелях E и F показано приготовление срезов ex vivo с красными сфероидами U-118 / L1LE / mCherry, также помеченными дальним красным мембранным красителем DiD (показан синим цветом). После фиксации срез был иммуноокрашен на ламинин зеленого цвета. Метка DiD была видна в эритроцитах в виде точечного окрашивания (стрелки) и была видна даже в клетках, которые рассеялись от сфероидов по кровеносным сосудам. Ядерное контрокрашивание бисбензимидом на этом рисунке не показано, так что другое окрашивание более четко видно. Масштабные линейки = 100 мкм (E, F). Сокращения: GBM = глиобластома; GSC = стволовые клетки GBM; GFP = зеленый флуоресцентный белок. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
| Среда/раствор | Состав | ||
| Медиа GSC | 1:1 смесь DMEM/F12, 1% фетальная бычья сыворотка (FBS), 15 мМ буфер HEPES, 2 мМ L-глутамин, 100 мкг/мл пенициллин-стрептомицин (ручка/стрептококк), 2% добавка B27 без витамина А и 2,5 мкг/мл гепарина. | ||
| Медиа GBM | DMEM (высокий уровень глюкозы), 10% FBS, шприц-ручка / стрептококк и 2 мМ L-глютамина. | ||
| Буфер фиксации | 2% PFA в 0,1 М буфере какодилата натрия | ||
| Носитель для встраивания | 3,5% агара и 8% сахарозы в PBS | ||
| ПБСТГ | 0,1% Triton X-100 + 5% нормальной козьей сыворотки (NGS) в PBS | ||
| U-118 MG среда для культивирования клеток | DMEM + 10% FBS + шприц-ручка / стрептококк + L-глютамин | ||
| Среда для культивирования среза мозга | 50% MEM + 25% HBSS + 25% сыворотка для лошадей + B27 + ручка/стрептококк + L-перенасыщение + 15 мМ буфер HEPES | ||
| Вибрирующий слайсер для нарезки тканей | Средний 199 + ручка/стрептококк + 15 мМ буфер HEPES | ||
Таблица 1: Состав носителей и буферов, используемых в этом протоколе.
Дополнительный рисунок 1: Инъекция в тектум зрительного нерва E5. (A) После того, как в яичной скорлупе прорезано отверстие над воздушным пространством и мембрана воздушного пространства смочена физиологическим раствором или средой, мембрана удаляется тонкими щипцами. (B) Чтобы ввести клетки в оптический тектум, амнион зажимают и удерживают тонкими щипцами, чтобы расположить голову так, чтобы зрительный тектум был доступен. Затем микропипетку вводят в тектум зрительного нерва и вводят в нее клетки под давлением. (C) После инъекции клеток несколько капель раствора ампициллина добавляют поверх эмбриона с помощью шприца и тонкой иглы. Пожалуйста, нажмите здесь, чтобы загрузить этот файл.
Дополнительный рисунок 2: Рассечение областей мозга E15. (А) После обезглавливания головку эмбриона Е15 помещают в чашку со стерильным раствором CMF. (B) Кожа, покрывающая мозг, затем удаляется с помощью тонких щипцов. (C) Затем две кости черепа удаляются из двух полушарий переднего мозга (FB). (D) Затем твердая мозговая оболочка соединительной ткани аккуратно удаляется из окружающего переднего мозга (FB), тектума зрительного нерва и мозжечка. (E) Затем весь мозг удаляется из головы путем осторожного вычерпывания его из полости мозга снизу с помощью изогнутых щипцов. (F ) Показан дорсальный вид всего удаленного мозга с передним мозгом (FB), тектумом зрительного нерва (OT) и мозжечком (CB). (G ) Изолированный мозг затем рассекается на полушария переднего мозга (FB), оптического тектума (OT) и мозжечок (CB) с помощью тонких ножниц. (H ) Тонкая соединительная ткань затем легко удаляется из полушарий тектума зрительного нерва (ОТ) с помощью тонких щипцов. Пожалуйста, нажмите здесь, чтобы загрузить этот файл.
Дополнительный рисунок 3: Встраивание и нарезка оптического тектума E15 и размещение клеточных сфероидов. (A) Одно полушарие оптического тектума погружается в агарозу с низким содержанием расплава с помощью изогнутых щипцов. (B) После того, как агароза затвердевает на льду, блок, содержащий оптический тектум, обрезается и приклеивается к пьедесталу из нержавеющей стали в чашке/подносе для нарезки. (C) После высыхания клея блюдо/противень для нарезки помещают в патрон вибрирующего тканевого слайсера и заполняют холодной нарезкой. Затем срезы вырезают сапфировым ножом из погруженного в воду тканевого блока. Нарезанные ломтики будут плавать в блюде/противне, и их можно будет удалить лопаткой. (D) Нарезанные ломтики удаляются из чашки/лотка и помещаются непосредственно на мембранные вставки с нижележащими средами для культивирования срезов в многолуночной пластине. (E) После того, как клеточные сфероиды выращивают на чашках, покрытых поли-HEMA, сфероид удаляют из чашки в минимальном количестве среды с помощью микропипеттора объемом 20 мкл. (F) Затем изолированный сфероид помещают непосредственно на срез мозга в минимальном количестве носителей. (G) Если сфероид выпадает из среза мозга из-за потока среды, то его можно подтолкнуть обратно к срезу мозга с помощью ресницы, приклеенной к деревянной палочке-аппликатору. Пожалуйста, нажмите здесь, чтобы загрузить этот файл.
Дополнительное видео S1: Видео объемного рендеринга большого увеличения небольшой опухоли GSC15-2 на E15. GSC имеют зеленый цвет из-за экспрессии GFP. Видео соответствует рисунку 1C и показывает ячейки GSC15-2. На видео показано вращение рендеринга объема, сгенерированного из z-стека с использованием 60-кратного иммерсионного объектива в масло. Ядра клеток кажутся белыми из-за окрашивания бисбензимидом, а некоторые кажутся красными из-за иммуноокрашивания на Sox2. Обратите внимание, что из-за «альфа-смешивания» для объемного рендеринга в программном обеспечении конфокального микроскопа цвета не смешиваются, как при использовании проекции максимальной интенсивности, и наиболее интенсивный цвет преобладает и затемняет менее интенсивный цвет. Кровеносные сосуды окрашиваются в белый цвет из-за иммуноокрашивания на ламинин. Окрашивание маркера GSC интегрин альфа-6 показано синим цветом и выглядит пунктированным на зеленых поверхностях GSC. Микронные масштабы показаны по краям объемного рендеринга. Пожалуйста, нажмите здесь, чтобы загрузить это видео.
Дополнительное видео S2: Видео рендеринга большого объема с большим увеличением небольшой опухоли GSC16-4 на E15. GSC имеют зеленый цвет из-за экспрессии GFP. Видео соответствует рисунку 1D и показывает ячейки GSC16-4. На видео показано вращение рендеринга объема, сгенерированного из z-стека с использованием 60-кратного иммерсионного объектива в масло. Ядра клеток кажутся белыми из-за окрашивания бисбензимидом, а некоторые GSC кажутся красными из-за иммуноокрашивания на нестин. Обратите внимание, что из-за «альфа-смешивания» для объемного рендеринга в программном обеспечении конфокального микроскопа цвета не смешиваются, как при использовании проекции максимальной интенсивности, и наиболее интенсивный цвет преобладает и затемняет менее интенсивный цвет. Кровеносные сосуды окрашиваются в белый цвет из-за иммуноокрашивания на ламинин. Окрашивание маркера GSC интегрин альфа-6 показано синим цветом и выглядит пунктированным на зеленых поверхностях GSC. Микронные масштабы показаны по краям объемного рендеринга. Пожалуйста, нажмите здесь, чтобы загрузить это видео.
Дополнительное видео S3: Видео рендеринга большого объема с большим увеличением небольшой опухоли GSC15-2 на E15. GSC имеют зеленый цвет из-за экспрессии GFP. Видео соответствует рисунку 1E и показывает ячейки GSC15-2. На видео показано вращение рендеринга объема, сгенерированного из z-стека с использованием 60-кратного иммерсионного объектива в масло. Ядра клеток кажутся белыми из-за окрашивания бисбензимидом, а некоторые кажутся красными из-за иммуноокрашивания на Sox2. Обратите внимание, что из-за «альфа-смешивания» для объемного рендеринга в программном обеспечении конфокального микроскопа цвета не смешиваются, как при использовании проекции максимальной интенсивности, и наиболее интенсивный цвет преобладает и затемняет менее интенсивный цвет. Кровеносные сосуды окрашиваются в белый цвет из-за иммуноокрашивания на ламинин. Окрашивание маркера GSC интегрин альфа-6 показано синим цветом и выглядит пунктированным на зеленых поверхностях GSC. Микронные масштабы показаны по краям объемного рендеринга. Пожалуйста, нажмите здесь, чтобы загрузить это видео.
Дополнительное видео S4: Видео рендеринга небольших опухолей GSC16-4 с большим увеличением на E15. GSC имеют зеленый цвет из-за экспрессии GFP. Видео соответствует рисунку 1F и показывает ячейки GSC16-4. На видео показано вращение рендеринга объема, сгенерированного из z-стека с использованием 60-кратного иммерсионного объектива в масло. Ядра клеток кажутся белыми из-за окрашивания бисбензимидом, а некоторые кажутся красными из-за иммуноокрашивания на нестин. Обратите внимание, что из-за «альфа-смешивания» для объемного рендеринга в программном обеспечении конфокального микроскопа цвета не смешиваются, как при использовании проекции максимальной интенсивности, и наиболее интенсивный цвет преобладает и затемняет менее интенсивный цвет. Кровеносные сосуды окрашиваются в белый цвет из-за иммуноокрашивания на ламинин. Окрашивание маркера GSC интегрин альфа-6 показано синим цветом и выглядит пунктированным на зеленых поверхностях GSC. Микронные масштабы показаны по краям объемного рендеринга. Пожалуйста, нажмите здесь, чтобы загрузить это видео.
Дополнительное видео S5: Видео живых клеток GBM в срезе мозга ex vivo. Видео соответствует рисунку 5C и показывает широкопольные флуоресцентные изображения сфероидов клеток U-118 / L1LE и вторгающихся клеток во время покадрового эксперимента для мониторинга живого поведения вторжения в срез ex vivo (с использованием 20-кратного объектива на специальной системе покадрового микроскопа). Клетки U-118 / L1LE окрашивали дальним красным флуоресцентным мембранным красителем DiD. Снимки были получены с помощью монохромной камеры. Пожалуйста, нажмите здесь, чтобы загрузить это видео.
Дополнительное видео S6: Видео живых клеток GBM в срезе мозга ex vivo. Видео соответствует рисунку 5D и показывает широкопольные флуоресцентные изображения сфероидов клеток U-118 / L1LE и вторгающихся клеток во время покадрового эксперимента для мониторинга живого поведения вторжения в срез ex vivo (с использованием 20-кратного объектива на специальной системе покадрового микроскопа). Клетки были изображены через их красную экспрессию mCherry. Снимки были получены с помощью монохромной камеры. Пожалуйста, нажмите здесь, чтобы загрузить это видео.
Дополнительное видео S7: Видео объемного рендеринга изображений конфокального 4D-таймлапса живых клеток GSC и GBM. Видео соответствует рисунку 6А. Конфокальные z-stack изображения получали с шагом 10 мкм каждые 10 мин в течение 20 часов. Препарат представлял собой срез мозга с имплантированными смешанными клеточными сфероидами красных клеток U-118 / L1LE / mCherry и зеленых клеток GSC16-4 / GFP. Конфокальные изображения были сделаны, когда срез мозга культивировался на мембранной вставке в 6-луночной пластиковой чашке для культивирования клеток с использованием объектива ELWD 20x (0,45 NA), что обеспечивало необходимое дополнительное рабочее расстояние. Объемный рендеринг был сгенерирован с помощью программного обеспечения конфокального микроскопа «Alpha Blending», которое дает очевидный 3D-эффект. Микронные масштабы показаны по краям объемного рендеринга. Видео лучше всего просматривать, вручную перетаскивая ползунок хода выполнения видео в видеопроигрывателе вперед и назад, чтобы наблюдать за движением ячейки, а не позволяя видеопроигрывателю двигаться с нормальной медленной скоростью. Пожалуйста, нажмите здесь, чтобы загрузить это видео.
Дополнительное видео S8: Видео объемного рендеринга изображений конфокального 4D-таймлапса живых клеток GSC и GBM. Видео соответствует рисунку 6B. Конфокальные z-stack изображения получали с шагом 10 мкм каждые 10 мин в течение 20 часов. Препарат представлял собой срез мозга с имплантированными смешанными клеточными сфероидами красных клеток U-118 / L1LE / mCherry и зеленых клеток GSC16-4 / GFP. Конфокальные изображения были сделаны, когда срез мозга культивировался на мембранной вставке в 6-луночной пластиковой чашке для культивирования клеток с использованием объектива ELWD 20x (0,45 NA), что обеспечивало необходимое дополнительное рабочее расстояние. Объемный рендеринг был сгенерирован с помощью программного обеспечения конфокального микроскопа «Alpha Blending», которое дает очевидный 3D-эффект. Микронные масштабы показаны по краям объемного рендеринга. Видео лучше всего просматривать, вручную перетаскивая ползунок хода выполнения видео в видеопроигрывателе вперед и назад, чтобы наблюдать за движением ячейки, а не позволяя видеопроигрывателю двигаться с нормальной медленной скоростью. Пожалуйста, нажмите здесь, чтобы загрузить это видео.
Дополнительное видео S9: Видео объемного рендеринга изображений конфокального 4D-таймлапса живых клеток GSC и GBM. Видео соответствует рисунку 6C. Конфокальные z-stack изображения получали с шагом 10 мкм каждые 10 мин в течение 20 часов. Препарат представлял собой срез мозга с имплантированными смешанными клеточными сфероидами красных клеток U-118 / L1LE / mCherry и зеленых клеток GSC16-4 / GFP. Конфокальные изображения были сделаны, когда срез мозга культивировался на мембранной вставке в 6-луночной пластиковой чашке для культивирования клеток с использованием объектива ELWD 20x (0,45 NA), что обеспечивало необходимое дополнительное рабочее расстояние. Объемный рендеринг был сгенерирован с помощью программного обеспечения конфокального микроскопа «Alpha Blending», которое дает очевидный 3D-эффект. Микронные масштабы показаны по краям объемного рендеринга. Видео лучше всего просматривать, вручную перетаскивая ползунок хода выполнения видео в видеопроигрывателе вперед и назад, чтобы наблюдать за движением ячейки, а не позволяя видеопроигрывателю двигаться с нормальной медленной скоростью. Пожалуйста, нажмите здесь, чтобы загрузить это видео.
Дополнительное видео S10: Видео объемного рендеринга изображений конфокальной 4D-покадровой съемки живых клеток GSC и GBM. Видео соответствует рисунку 6D. Конфокальные z-stack изображения получали с шагом 10 мкм каждые 10 мин в течение 20 часов. Препарат представлял собой срез мозга с имплантированными смешанными клеточными сфероидами красных клеток U-118 / L1LE / mCherry и зеленых клеток GSC16-4 / GFP. Конфокальные изображения были сделаны, когда срез мозга культивировался на мембранной вставке в 6-луночной пластиковой чашке для культивирования клеток с использованием объектива ELWD 20x (0,45 NA), что обеспечивало необходимое дополнительное рабочее расстояние. Объемный рендеринг был сгенерирован с помощью программного обеспечения конфокального микроскопа «Alpha Blending», которое дает очевидный 3D-эффект. Микронные масштабы показаны по краям объемного рендеринга. Видео лучше всего просматривать, вручную перетаскивая ползунок хода выполнения видео в видеопроигрывателе вперед и назад, чтобы наблюдать за движением ячейки, а не позволяя видеопроигрывателю двигаться с нормальной медленной скоростью. Пожалуйста, нажмите здесь, чтобы загрузить это видео.
Дополнительное видео S11: Видео объемного рендеринга изображений конфокальной 4D-покадровой съемки живых клеток GSC и GBM. Видео соответствует рисунку 6E. Конфокальные z-stack изображения получали с шагом 10 мкм каждые 10 мин в течение 20 часов. препарат включал срез мозга с имплантированными смешанными клеточными сфероидами красных клеток U-118/L1LE/mCherry и зеленых клеток GSC16-4/GFP. Конфокальные изображения были сделаны, когда срез мозга культивировался на мембранной вставке в 6-луночной пластиковой чашке для культивирования клеток с использованием объектива ELWD 20x (0,45 NA), что обеспечивало необходимое дополнительное рабочее расстояние. Объемный рендеринг был сгенерирован с помощью программного обеспечения конфокального микроскопа «Alpha Blending», которое дает очевидный 3D-эффект. Микронные масштабы показаны по краям объемного рендеринга. Видео лучше всего просматривать, вручную перетаскивая ползунок хода выполнения видео в видеопроигрывателе вперед и назад, чтобы наблюдать за движением ячейки, а не позволяя видеопроигрывателю двигаться с нормальной медленной скоростью. Пожалуйста, нажмите здесь, чтобы загрузить это видео.
Обсуждение
Критические шаги в протоколе инъекции клеток в желудочек среднего мозга (оптический тектум) включают не повреждение кровеносных сосудов в хориоаллантоисной мембране в яйцеклетке или вокруг эмбриона до и во время инъекции, хотя мембрану амниона, непосредственно окружающую эмбрион, можно осторожно потянуть и удерживать, чтобы расположить головку при инъекции клеток в средний мозг. Амнион относительно прочный и может быть вытянут тонкими щипцами, чтобы расположить голову и удерживать ее устойчиво одной рукой, для инъекции клеток другой рукой в оптический тектум, который представляет собой большую круглую структуру в середине мозга. Как правило, жизнеспособность инъецированных эмбрионов колеблется от 25% до 75%, в зависимости от неизвестных факторов, и практически каждый выживший эмбрион содержит, по крайней мере, небольшую опухоль в тектуме зрительного нерва. Критические шаги в создании жизнеспособных срезов мозга включают промокание ткани от лишней жидкости, чтобы агароза прилипала к мозгу во время нарезки, и чтобы ткань и срезы оставались холодными до тех пор, пока они не будут помещены на мембранную вставку. Поскольку разные типы клеток образуют сфероиды по-разному (по скорости и размеру), плотность покрытых клеток на пластинах поли-HEMA и продолжительность времени до сбора сфероидов должны быть оптимизированы для каждого типа клеток.
Работа здесь не была предметом формального лонгитюдного исследования жизнеспособности среза мозга. Yang et al. использовали культуры срезов мозга куриных эмбрионов, аналогичные тем, которые используются здесь, и показали хорошую жизнеспособность срезов в течение как минимум 7 дней16. Предыдущая работа показала, что, когда ткань OT хранилась в субоптимальной среде, в ткани появлялось много пикнотических ядер, чего не происходило в срезах в работе здесь. Кроме того, когда срезы дегенерируют в неоптимальных условиях, кровеносные сосуды фрагментируются и появляются в виде рядов ламининоположительных сфер (не показаны). Таким образом, хотя жизнеспособность здесь не была проверена такими методами, как электрофизиология или активная экспрессия каспазы-3, ни один из показателей гибели клеток, которые наблюдались при неоптимальных условиях культивирования, здесь не появился.
OT был сосредоточен на экспериментах с опухолями головного мозга in vivo, потому что это наиболее легко вводимая область с самым большим желудочком. На E5, который является последним днем, когда эмбрион достаточно мал, чтобы оставаться доступным поверх желтка, инъекции должны быть сделаны в желудочек, так как все области мозга представляют собой не что иное, как тонкую желудочковую зону. Тем не менее, эти инъекции успешно приводят к встроенным опухолям с клетками, которые вторгаются в паренхиму мозга. Иногда возникающие опухоли обнаруживаются в переднем мозге или мозжечке, но это не распространено. Срезы оптического тектума E15 ex vivo в основном использовались для экспериментов здесь, так что результаты совместной культуры ex vivo можно соотнести с экспериментами по инъекциям in vivo . Тем не менее, срезы переднего мозга также подходят и имеют большую площадь поверхности и очень тонкий желудочек по сравнению с тектумом зрительного нерва, что может сделать передний мозг более подходящим для кокультур ex vivo , которые не коррелируют с инъекциями in vivo .
Здесь было продемонстрировано, что инъекции in vivo с последующей фиксацией тканей, секционированием вибрирующей ткани слайсером и иммуноокрашиванием на ламинин и другие маркеры приводили к получению изображений с высоким разрешением клеток GBM и GSC в ткани головного мозга в непосредственной близости от кровеносных сосудов. Возможность определения взаимосвязей между опухолевыми клетками и кровеносными сосудами была значительно облегчена за счет создания объемных 3D-рендеров из z-стеков конфокальных оптических срезов с использованием конфокального программного обеспечения и инструкций производителя. Была возможна покадровая визуализация с использованием широкопольной флуоресцентной микроскопии клеток, меченных GFP, mCherry и DiD; Однако мигрирующие клетки, которые находились в непосредственной близости от сильно флуоресцентных сфероидов, иногда были скрыты «свечением» от сфероида. Этот нежелательный эффект можно несколько свести к минимуму, тщательно отрегулировав время экспозиции для получения широкоугольных изображений. Покадровая съемка с использованием конфокальных z-стеков с течением времени (4D) устранила расфокусированное свечение сфероидов и привела к появлению четко очерченных мигрирующих клеток с темным фоном. Это не было описано в протоколе, но проводилось аналогично широкопольной покадровой съемке, которая выполнялась, когда срезы мозга находились на прозрачных мембранных вставках в 6-луночной пластиковой пластине. Хотя конфокальная покадровая съемка приводит к заметно более четким изображениям отдельных клеток и их поведения, многоточечный покадровый эксперимент по сбору z-стеков из 10 z-плоскостей / точка с интервалом 10 минут в течение 20-часового периода представляет собой широкое использование гальванометров сканирующей головки. Поскольку это может значительно сократить срок службы гальванометров, этот метод используется разумно.
Хотя система куриных эмбрионов очень подходит как для инъекций in vivo, так и для экспериментов по совместному культивированию ex vivo , которые исследуют поведение клеток GBM, у этой модельной системы есть несколько ограничений. Как и в случае с любой системой ксенотрансплантатов, среда, в которую имплантируются человеческие клетки, не является человеческим мозгом, но поведение клеток GBM, по-видимому, имитирует поведение на моделях грызунов и у пациентов. После проведения экспериментов по инъекциям in vivo на E5 опухоли обычно формируются в течение 10 дней, до E15. Этого времени явно недостаточно для изучения всех аспектов онкогенеза и клеточной инвазии. Однако здесь было продемонстрировано, что солидные опухоли образуются в паренхиме головного мозга, клетки взаимодействуют и перестраиваются внутри опухоли, и значительная инвазия мозга происходит как вдоль кровеносных сосудов, так и диффузно в течение этого относительно короткого периода времени. Еще одним ограничением системы эмбрионов цыплят in vivo является то, что она не подходит для медикаментозного или другого лечения из-за большого желтка и внеэмбриональной системы кровообращения, которая работает во время развития эмбриона цыпленка. Местное лечение жидкими лекарственными препаратами приведет к очень изменчивой и неизвестной концентрации в мозге из-за диффузии от эмбриона в гораздо большую массу желтка. Точно так же внутривенная инъекция лекарств в очень тонкую внеэмбриональную систему кровообращения будет протекать или диффундировать из кровеносных сосудов, а также приводить к неизвестным концентрациям в мозге. Это одна из основных причин, по которой был принят метод культивирования срезов ex vivo - для того, чтобы можно было не только наблюдать и отслеживать поведение клеток с помощью покадровой микроскопии, но и для того, чтобы лечение, которое было успешным в изменении поведения клеток GBM в чашке4 , могло быть протестировано в более подходящей среде ткани мозга.
Разработка системы модели ортотопической опухоли головного мозга куриного эмбриона рассматривается как существенное дополнение к системам и инструментам, доступным для изучения образования опухолей GBM и поведения инвазивных клеток. Оплодотворенные куриные яйца, вероятно, будут легко доступны в большинстве районов, они недороги по сравнению с грызунами, нет затрат на уход за животными, эмбрионы очень устойчивы и устойчивы к инфекции (т. Е. Большая часть работы выполняется на столешнице), эмбрионы легко манипулируются и могут быть выращены в культуре без скорлупы19, а эмбрионы цыплят не считаются позвоночными животными и поэтому не требуют одобрения IACUC руководящими принципами NIH (институциональные требования может отличаться). Таким образом, эти многочисленные преимущества делают систему эмбрионов цыплят очень привлекательной, если ограничить свои вопросы и эксперименты теми, которые подпадают под ее ограничения. Несколько исследований клеток GBM были проведены другими с использованием эмбриона цыпленка, но в них почти исключительно использовалась хориоаллантоисная мембрана (CAM) эмбриона 20,21,22,23,24,25,26,27,28,29 и почки конечностей 30, а не мозг. Также сообщалось об имплантации медуллобластомы в мозг цыпленка на E231. Несомненно, использование куриного эмбриона в качестве ортотопической модельной системы ксенотрансплантата, как описано здесь, должно дать результаты, которые гораздо более значимы для биологии опухоли GBM человека, чем исследования с использованием CAM.
Хотя эти исследования только начали полностью использовать модельную систему опухоли головного мозга куриного эмбриона для изучения поведения клеток GBM человека и GSC, есть надежда, что другие расширят использование и найдут дальнейшие потенциальные применения. Можно предположить, что эта система не только раскроет механизмы, регулирующие образование опухолей GBM и поведение клеток, но также позволит проводить доклинические испытания конкретных лекарств и веществ на клетках конкретных пациентов. Например, если культуры срезов мозга были созданы заранее, то опухолевые клетки, кусочки хирургических резекций опухоли или полученные от пациента органоидыGBM 32 могут быть помещены непосредственно в совместную культуру ex vivo , и различные методы лечения могут быть оценены в течение нескольких дней. Точно так же диссоциированные клетки пациента могут быть введены непосредственно в средний мозг E5 в яйцеклетке, чтобы оценить их способность образовывать опухоли и вторгаться в паренхиму мозга. Таким образом, есть надежда, что описания методов и репрезентативные результаты будут способствовать и поощрять более широкое использование этой крайне недоиспользуемой системы для исследований рака мозга.
Раскрытие информации
Ни у кого из авторов нет конфликта интересов.
Благодарности
Эта работа частично финансировалась за счет гранта D.S.G. от Национального института рака (R03CA227312) и щедрого гранта от Фонда Лизы Дин Мозли. Живые образцы GBM были получены с согласия пациента через Центр закупок тканей Онкологического центра и научно-исследовательского института Хелен Ф. Грэм. Финансирование А.Р. было предоставлено Национальным центром исследовательских ресурсов и Национальным центром развития трансляционных наук Национальных институтов здравоохранения (UL1TR003107). Летние исследовательские стипендии для студентов N.P., A.L., Z.W. и K.S. были предоставлены Исследовательской программой бакалавриата Университета Делавэра.
Материалы
| Name | Company | Catalog Number | Comments |
| 1 cm x 1 cm square hole paper punch | Birabira | N/A | |
| 1 mm biopsy punch pen | Robbins Instruments | 20335 | |
| 6 well insert plate (Corning Transwell) | Millipore Sigma | CLS3450 | |
| 9" Disposable Pasteur Pipets | Fisher Scientific | 13-678-20C | |
| 15 mL centrifuge tubes | Fisher Scientific | 05-539-12 | |
| 24 well plate | Corning Costar | 3526 | |
| 50 mL centrifuge tubes | Fisher Scientific | 05-539-9 | |
| Agar | Fisher BioReagents | BP1423-500 | for embedding fixed brains |
| Alexafluor 488-conjugated GAM IgG | Jackson Immunoresearch | 115-605-146 | |
| Alexafluor 647-conjugated GAM IgG | Jackson Immunoresearch | 115-545-146 | |
| Aluminum foil | ReynoldsWrap | N/A | |
| Ampicillin | Sigma Aldrich | A-9518 | |
| anti-integrin alpha-6 monoclonal antibody GOH3 | Santa Cruz Biotechnology | sc-19622 | |
| anti-L1CAM monoclonal antibody UJ127 | Santa Cruz Biotechnology | sc-53386 | |
| anti-laminin monoclonal antibody | Developmental Studies Hybridoma Bank | 3H11 | |
| anti-nestin monoclonal antibody 10c2 | Santa Cruz Biotechnology | sc-23927 | |
| anti-Sox2 monoclonal antibody E-4 | Santa Cruz Biotechnology | sc-365823 | |
| B27 supplement without vitamin A | GIBCO | 17504-044 | |
| bisbenzimide (Hoechst 33258) | Sigma-Aldrich | B2883 | nuclear stain |
| Cell culture incubator | Forma | standard humidified CO2 incubator | |
| Centrifuge | Beckman Coulter | ||
| Confocal microscope | Nikon Instruments | C2si+ | With custom-made cell incubator chamber |
| Confocal microscope objective lenses | Nikon Instruments | Plan Apo lenses, except S Plan Fluor ELWD 20x 0.45 NA objective lens for confocal time-lapse imaging | |
| Confocal microscope software | Nikon Instruments | NIS Elements | Version 5.2 |
| Curved foreceps | World Precision Intruments | 504478 | |
| Curved scissors | Fine Science Tools | ||
| Curved spatula | Fisher Scientific | 14-375-20 | |
| Cyanoacrylate glue | Krazy Glue | KG-585 12R | |
| D-Glucose | Millipore Sigma | G8270 | |
| DiD far red fluorescent dye | Invitrogen | V22887 | Vybrant DiD |
| DMEM | Sigma Aldrich | D5671 | |
| DMEM/F12 | Sigma Aldrich | D8437 | |
| DMSO | Sigma Aldrich | D4540 | |
| Dulbecco's Phosphate buffered saline (PBS) | Sigma Aldrich | P5493-1L | |
| egg incubator | Humidaire | ||
| electrical tape (10 mil thick/254 µm) | Scotch | N/A | |
| Ethanol 200 proof | Decon Laboratories | 2701 | |
| Fast green FCF dye | Avocado Research Chemicals | 16520 | |
| FBS | Gemini Bio-products | 900-108 | |
| filter paper | Fisher Scientific | ||
| Gauze | Dynarex | 3353 | |
| Glass Capillaries for microinjection | World Precision Instruments | TW100-4 | |
| Glycerol | Fisher BioReagents | BP228-1 | for mounting media |
| GSCs (human glioblastoma stem cells) | Not applicable | Isolated from patient GBM specimens in Galileo laboratory in GSC media and then transduced with a GFP encoding lentiviral vector. Cells used were between passage 10 and 30. | |
| Hanks Balanced Salt Solution (HBSS) | Corning | 21-020-CV | |
| Hemacytometer | Hausser scientific | ||
| Heparin | Fisher Scientific | BP2524-100 | |
| HEPES buffer | Sigma Aldrich | H0887 | |
| Horse Serum (HI) | Gibco | 26050-088 | |
| Human FGF-2 | BioVision | 4037-1000 | |
| Human TGF-α | BioVision | 4339-1000 | |
| Inverted phase contrast microscope | Nikon Instruments | TMS | for routine viewing of cultured cells |
| KCl | Fisher Scientific | BP366 | |
| KH2PO4 | Fisher Scientific | P284 | |
| Laboratory film | Parafilm | ||
| Labquake Shaker | LabIndustries | T400-110 | |
| L-Glut:Pen:Strep | Gemini Bio-products | 400-110 | |
| Low-melt agarose | Fisher Scientific | BP1360 | for embedding live brains |
| Matrix | Corning Matrigel | 354234 | |
| Medium 199 | GIBCO | 11150-059 | |
| MEM | Corning | 10-010-CV | |
| Metal vibratome block | |||
| Micropipette tips (20, 200, 1,000 µL) | Fisherbrand | ||
| Micropipettors (20, 200, 1,000 µL) | Gilson | ||
| Microscope Coverglass (no. 1.5 thickness) | Fisherbrand | 12544A | |
| NaCl | Fisher Scientific | S271 | |
| NaH2PO4 + H2O | Fisher Scientific | S369 | |
| NaHCO3 | Fisher Scientific | BP328 | |
| Normal goat serum | Millipore Sigma | 526-M | |
| N-propyl gallate | Sigma Aldrich | P3130 | for mounting media |
| Parafilm | Parafilm | ||
| Paraformaldehyde | Electron Microscopy Sciences | 15710 | |
| PBS | Sigma Aldrich | P5493-1L | |
| Pencil | |||
| Plain Microscope slides | Fisherbrand | 12-550-A3 | |
| Plastic 35 mm Petri dish | Becton Dickinson | 351008 | |
| pneumatic picopump | World Precision Intruments | PV830 | |
| Poly(2-hydroxyethyl methacrylate) (poly-HEMA) | Sigma Aldrich | P-3932 | |
| razor blade- double edge | PACE | for cutting fixed brain slices | |
| sapphire knife | Delaware Diamond Knives | for cutting live brain slices | |
| Scalpel | TruMed | 1001 | |
| Sodium cacodylate buffer 0.2 M pH 7.4 | Electron Microscopy Sciences | 11652 | |
| Specimen chamber for vibratome | custom-made | ||
| Stereo Dissecting Microscope | Nikon Instruments | SMZ1500 | Equipped with epifluorescence |
| straight foreceps | World Precision Intruments | 500233 | |
| straight scissors | Fine Science Tools | ||
| Sucrose | Mallinckrodt | 7723 | |
| Time-lapse fluorescence microscope (widefield fluorescence) | Nikon Instruments | TE2000-E | With custom-made cell incubator chamber (see Fotos et al., 2006) |
| Tissue culture dish polystyrene 100 mm | Thermo Fisher Scientific | 130182 | for cell culturing |
| Tissue culture dish polystyrene 60 mm | Becton Dickinson | 353004 | for cell culturing |
| Transfer pipette | American Central Scientific Co. | FFP011 | |
| Transparent tape | Scotch | ||
| Triton X-100 | Sigma Aldrich | T-8787 | |
| Trypsin (0.25%) + 2.21 mM EDTA | Corning | 25-053-CI | |
| U-118 MG human GBM cell line | ATCC | HTB-15 | Cells were transduced with a lentiviral vector encoding the entire ectodomain sequence of the L1CAM adhesion protein and then with lentiviral vector pUltra-hot encoding mCherry. Passage numbers are unknown. |
| Vacuum pump | Cole-Parmer | EW-07532-40 | "Air Cadet" |
| Vibrating tissue slicer | Vibratome | 3000 | for cutting live and fixed brain slices |
Ссылки
- Cretu, A., Fotos, J. S., Little, B. W., Galileo, D. S. Human and rat glioma growth, invasion, and vascularization in a novel chick embryo brain tumor model. Clinical & Experimental Metastasis. 22 (3), 225-236 (2005).
- Yang, M., et al. L1 stimulation of human glioma cell motility correlates with FAK activation. Journal of Neuro-Oncology. 105 (1), 27-44 (2011).
- Mohanan, V., Temburni, M. K., Kappes, J. C., Galileo, D. S. L1CAM stimulates glioma cell motility and proliferation through the fibroblast growth factor receptor. Clinical & Experimental Metastasis. 30 (4), 507-520 (2013).
- Anderson, H. J., Galileo, D. S. Small-molecule inhibitors of FGFR, integrins and FAK selectively decrease L1CAM-stimulated glioblastoma cell motility and proliferation. Cellular Oncology. 39 (3), 229-242 (2016).
- Pace, K. R., Dutt, R., Galileo, D. S. Exosomal L1CAM stimulates glioblastoma cell motility, proliferation, and invasiveness. International Journal of Molecular Sciences. 20 (16), 3982(2019).
- Stoppini, L., Buchs, P. A., Muller, D. A simple method for organotypic cultures of nervous tissue. Journal of Neuroscience Methods. 37 (2), 173-182 (1991).
- Ohnishi, T., Matsumura, H., Izumoto, S., Hiraga, S., Hayakawa, T. A novel model of glioma cell invasion using organotypic brain slice culture. Cancer Research. 58 (14), 2935-2940 (1998).
- Humpel, C. Organotypic brain slice cultures: A review. Neuroscience. 305, 86-98 (2015).
- Aaberg-Jessen, C., et al. Invasion of primary glioma- and cell line-derived spheroids implanted into corticostriatal slice cultures. International Journal of Clinical and Experimental Pathology. 6 (4), 546-560 (2013).
- Matsumura, H., Ohnishi, T., Kanemura, Y., Maruno, M., Yoshimine, T. Quantitative analysis of glioma cell invasion by confocal laser scanning microscopy in a novel brain slice model. Biochemical and Biophysical Research Communications. 269 (2), 513-520 (2000).
- Ren, B., et al. Invasion and anti-invasion research of glioma cells in an improved model of organotypic brain slice culture. Tumori. 101 (4), 390-397 (2015).
- Fayzullin, A., et al. Time-lapse phenotyping of invasive glioma cells ex vivo reveals subtype-specific movement patterns guided by tumor core signaling. Experimental Cell Research. 349 (2), 199-213 (2016).
- Jensen, S. S., et al. Establishment and characterization of a tumor stem cell-based glioblastoma invasion model. PloS One. 11 (7), e0158746(2016).
- Marques-Torrejon, M. A., Gangoso, E., Pollard, S. M. Modelling glioblastoma tumour-host cell interactions using adult brain organotypic slice co-culture. Disease Models & Mechanisms. 11 (2), 031435(2018).
- Tamura, R., et al. Visualization of spatiotemporal dynamics of human glioma stem cell invasion. Molecular Brain. 12 (1), 45(2019).
- Yang, C., et al. Organotypic slice culture based on in ovo electroporation for chicken embryonic central nervous system. Journal of Cellular and Molecular Medicine. 23 (3), 1813-1826 (2019).
- Murrell, W., et al. Expansion of multipotent stem cells from the adult human brain. PloS One. 8 (8), e71334(2013).
- Fotos, J. S., et al. Automated time-lapse microscopy and high-resolution tracking of cell migration. Cytotechnology. 51 (1), 7-19 (2006).
- Tufan, A. C., Akdogan, I., Adiguzel, E. Shell-less culture of the chick embryo as a model system in the study of developmental neurobiology. Neuroanatomy. 3 (1), 8-11 (2004).
- Shoin, K., et al. Chick embryo assay as chemosensitivity test for malignant glioma. Japanese Journal of Cancer Research. 82 (10), 1165-1170 (1991).
- Hagedorn, M., et al. Accessing key steps of human tumor progression in vivo by using an avian embryo model. Proceedings of the National Academy of Sciences. 102 (5), 1643-1648 (2005).
- Balciūniene, N., et al. Histology of human glioblastoma transplanted on chicken chorioallantoic membrane. Medicina. 45 (2), 123-131 (2009).
- De Magalhães, N., et al. Applications of a new In vivo tumor spheroid based shell-less chorioallantoic membrane 3-D model in bioengineering research. Journal of Biomedical Science and Engineering. 3 (1), 20-26 (2010).
- Szmidt, M., et al. Morphology of human glioblastoma model cultured in ovo. Journal of Veterinary Research. 56 (2), 261-266 (2012).
- Jaworski, S., et al. Comparison of tumor morphology and structure from U87 and U118 glioma cells cultured on chicken embryo chorioallantoic membrane. Journal of Veterinary Research. 57 (4), 593-598 (2013).
- Yuan, Y. J., Xu, K., Wu, W., Luo, Q., Yu, J. L. Application of the chick embryo chorioallantoic membrane in neurosurgery disease. International Journal of Medical Sciences. 11 (12), 1275-1281 (2014).
- Urbańska, K., et al. The effect of silver nanoparticles (AgNPs) on proliferation and apoptosis of in ovo cultured glioblastoma multiforme (GBM) cells. Nanoscale Research Letters. 10, 98(2015).
- DeBord, L. C., et al. The chick chorioallantoic membrane (CAM) as a versatile patient-derived xenograft (PDX) platform for precision medicine and preclinical research. American Journal of Cancer Research. 8 (8), 1642-1660 (2018).
- Han, J. M., Jung, H. J. Synergistic anticancer effect of a combination of berbamine and arcyriaflavin A against glioblastoma stem-like cells. Molecules. 27 (22), 7968(2022).
- Ruiz-Ontañon, P., et al. Cellular plasticity confers migratory and invasive advantages to a population of glioblastoma-initiating cells that infiltrate peritumoral tissue. Stem Cells. 31 (6), 1075-1085 (2013).
- Cage, T. A., et al. Distinct patterns of human medulloblastoma dissemination in the developing chick embryo nervous system. Clinical & Experimental Metastasis. 29 (4), 371-380 (2012).
- Darrigues, E., et al. Biobanked glioblastoma patient-derived organoids as a precision medicine model to study inhibition of invasion. International Journal of Molecular Sciences. 22 (19), 10720(2021).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеСмотреть дополнительные статьи
This article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены