Method Article
ニワトリ胚脳をモデルとしてヒト膠芽腫細胞挙動の in vivoおよび ex vivo 解析(英語)
要約
ニワトリ胚は、 ovo および ex vivo 脳スライス共培養におけるヒト膠芽腫(GBM)脳腫瘍の研究に使用されます。GBM細胞の挙動は、 ex vivo 共培養におけるタイムラプス顕微鏡によって記録することができ、両方の調製物は、詳細な3D共焦点分析によって実験エンドポイントで分析することができる。
要約
ニワトリ胚は、脊椎動物の発生の研究、特に実験的操作のための理想的なモデルシステムです。ニワトリ胚の使用は、 in vivoでの ヒト膠芽腫(GBM)脳腫瘍の形成および周囲の脳組織への腫瘍細胞の浸潤性を研究するために拡張されています。GBM腫瘍は、蛍光標識細胞の懸濁液を ovoのE5中脳(視蓋)心室に注射することによって形成することができる。
GBM細胞によっては、脳室と脳壁内にコンパクトな腫瘍がランダムに形成され、細胞群が脳壁組織に浸潤します。腫瘍のある固定E15テクタの厚い組織切片(350 μm)を免疫染色して、共焦点zスタック画像の3D再構成によって分析すると、浸潤細胞が血管に沿って移動することが多いことを明らかにすることができます。生きたE15の中脳および前脳スライス(250-350 μm)をメンブレンインサート上で培養し、蛍光標識したGBM細胞を非ランダム位置に導入して、血管に沿って発生する可能性のある細胞浸潤を分析するための ex vivo 共培養を約1週間にわたって行うことができます。これらの ex vivo 共培養は、広視野または共焦点蛍光タイムラプス顕微鏡によってモニターして、生細胞の挙動を観察することができます。
次に、共培養スライスを固定し、免疫染色し、共焦点顕微鏡で分析して、浸潤が血管または軸索に沿って発生したかどうかを判断できます。さらに、共培養システムは、異なる細胞タイプおよび色の凝集体を異なる正確な位置に配置し、細胞の動きを観察することにより、潜在的な細胞間相互作用を調べるために使用することができる。薬物処理は ex vivo 培養で行うことができますが、これらの処理は in ovo システムと互換性がありません。これらの2つの相補的なアプローチにより、高度に操作可能な脊椎動物の脳環境におけるヒトGBM細胞の挙動と腫瘍形成の詳細かつ正確な分析が可能になります。
概要
癌細胞の挙動のin vitro研究は、in vivo異種移植片モデルにおける腫瘍形成および細胞浸潤中に観察されるより複雑な挙動の間に機能する潜在的なメカニズムを分析するためにしばしば使用されます。たとえば、膠芽腫(GBM)の場合、in vitro研究では、新しいニワトリ胚異種移植片脳腫瘍モデル1,2,3,4,5において、腫瘍形成および脳浸潤中にL1CAMがどのように機能する可能性があるかのメカニズムが明らかになりました。in vitro実験とin vivo実験は有用な方法で互いに補完し合っていますが、結果の相関方法には大きなギャップがあります。例えば、皿上のGBM細胞の運動性の機構解析は非常に人工的な状況であり、in vivo異種移植片モデルは、腫瘍形成と細胞挙動の静的な時点またはエンドポイント分析のみを明らかにすることができます。げっ歯類またはニワトリ胚のいずれかを使用したin vivo研究は、これらの異種移植片モデルで細胞が脳組織に侵入している間の細胞の挙動を監視するのに容易ではありません。それにもかかわらず、ニワトリ胚異種移植片モデルは、接着タンパク質L1CAMがヒトT98G GBM細胞の侵襲能力において刺激的役割を果たすことを実証した2,5。
この問題に対する適切な解決策は、ex vivoモデルと呼ばれる器官型脳スライス培養モデルを用いて、in vivoおよびin vitroの両方の方法を橋渡しすることによって達成することができる。このex vivoモデルでは、生きた脳組織を数百ミクロンの厚さで数週間まで維持できるため、がん細胞を移植し、実際の組織での挙動を経時的に観察し、実験のエンドポイントでより詳細なマーカー分析を行うことができます。
一般的な有機型スライス培養法は、半透明または透明な多孔質膜の上に数百ミクロンの厚さの脳スライスを培養し、組織を空気にさらしたままにし、栄養培地が膜の下から組織を維持することを可能にすることでした(Stoppini et al.6を参照)。この方法のさまざまなバリエーションが、異なる媒体または異なるメンブレンインサートの使用など、さまざまな研究に使用されてきました。さまざまなメンブレンインサートには、直径30 mm、35 mm培養皿6の多孔質(0.4 μm)メンブレンインサート、および6ウェルプレート7用の細胞培養インサート(0.4 μm)が含まれます。さまざまな培地には、50%MEM / HEPES + 25%熱不活性化馬血清+ 25%ハンクス平衡塩溶液(HBSS)8、50%還元血清培地+ 25%馬血清+ 25%HBSS9などがあります。半透明または透明なメンブレンが蛍光標識されたGBM細胞と共に使用される場合、そのような培養物は、倒立広視野または共焦点蛍光顕微鏡10、11、12、13、14、15を用いて下から画像化することができる。
げっ歯類を用いて多くのin vivo同所性脳腫瘍異種移植片およびex vivo有機型脳スライス培養モデルが確立されているが、上で引用したように、ニワトリ胚(Gallus gallus)はこれらの目的のために十分に活用されていない。しかしながら、ニワトリ胚は、ヒトおよびラットグリオーマ浸潤の両方の研究のためのin vivo同所性異種移植片モデルとして使用できることが実証されている1、2、5。ニワトリ胚脳への異種移植細胞は、げっ歯類モデルで観察されたものと同様の侵入パターンを示しており、GBM腫瘍細胞分析のためのin vivoモデルとしてのニワトリ胚の使用をさらに支持している。ひよこ胚はまた、安価であり、げっ歯類よりも簡単に維持でき(つまり、ラボインキュベーターの卵殻で)、取り扱いがはるかに簡単であるため、短期間のin vivoGBM研究にとって魅力的な選択肢となっています。最近の記事では、スライスが少なくとも7日間生存可能であった正常な脳発達中の軸索の形成および成長のためのニワトリ胚脳スライス培養の使用が記載されている16。しかしながら、組織環境におけるGBM細胞挙動のex vivo分析のためのそのようなニワトリ胚脳スライス培養の使用は不足している。この記事では、ヒトGBM細胞とGBM幹細胞(GSC)のin vivoの初期ニワトリ胚脳への移植、およびex vivoでの生きたニワトリ胚脳スライス培養へのGBM細胞の導入について説明します。これらの調製物から得られる結果として生じる腫瘍および細胞浸潤パターンのいくつかの代表例も提供される。
プロトコル
この作業を実行するために、デラウェア大学での許可や承認は必要ありませんでした。
1. ひよこ視蓋へのGBM細胞注入
- 注射用GSCおよびGBM細胞の調製
- GSC培地でGSCを培養する(表1)。GBM培地中でGBM細胞株を樹立した培養(表1)。
- プレート上の細胞を滅菌リン酸緩衝生理食塩水(PBS)ですすぎ、1 mLのトリプシン溶液を10 cmディッシュに入れます。細胞が剥離し始めるまで、細胞培養インキュベーターに2〜3分間放置します。
- 10 mLの適切な血清含有培養培地を10 cmディッシュに加えてトリプシンを不活性化し、上下にピペッティングして細胞を剥離します。細胞懸濁液を15 mLの円錐形遠沈管に入れます。
- 800 × g で4°Cで5分間遠心分離することにより細胞をペレット化します。
- サイドアームフラスコおよび真空ポンプに取り付けられた使い捨ての微細ガラスピペットを使用して細胞ペレットから培地を吸引する。細胞を適切な増殖培地にマイクロリットルあたり10,000細胞の濃度まで再懸濁し、氷上のマイクロフュージチューブまたは小さなスクリュートップチューブに入れます。
- 細胞を少量の滅菌1%ファストグリーンFCF色素と混合します(5 μLの色素/100 μLの細胞懸濁液の比率を使用)。
- OVOのE5視蓋へのGBM細胞の注入。補足図1を参照してください。
- 受精鶏卵を加湿卵インキュベーターで尖った端を下に向けて37.5°Cで孵化させます( 孵卵の1日目 は胚の0日目[E0]です)。インキュベーション(E5)の6日目に、70%エタノールをスプレーして卵殻を殺菌します。
- 卵キャンドラーを使用して、鉛筆で胚の上の空間の周囲に沿ってトレースし、輪郭を描かれた領域を透明なテープで覆います。
- 湾曲したハサミを使用して、胚膜や血管に切り込まないように注意しながら、トレース領域の周りをそっと切り、卵殻の上部を捨てます。
- 生理食塩水または細胞培養培地を数滴の空気空間膜に置き、容易に剥離するように濡らします。細かい鉗子を使用して、胚の上部に気空間膜を注意深く突き刺し、それを取り除き、ひよこ胚の頭を見つけます。
- 細かい鉗子を使用して、胚をすぐに囲む透明な羊膜をつかみ、視蓋に細胞を注入できるように頭を配置します。片手で細かい鉗子を使用して羊膜をつかみ、注射プロセス中に頭を所定の位置に保ちます。卵黄の絨毛尿膜の胚外血管を傷つけないように注意してください。
注:上記の手順は、胚を密接に取り囲む透明な羊膜を効率的につかむことができるようにするために、ある程度の練習が必要です。細かい鉗子を使って、胚をすぐに囲む透明な羊膜をつかむ練習をします。 - 羊膜を細かい鉗子でつかんで頭をしっかりと保持します。ガラスマイクロピペットと空気圧ピコポンプを使用して、5 μLの適切な細胞培養培地中の約50,000個の細胞を視蓋に注入します(5 μLは充填マイクロピペットの約1/2です)。
注:色素を混合したGBM細胞を注入したE5胚の画像については、Cretuら1 を参照してください。 - 胚の上に50 mg / mLのアンピシリンを数滴置きます。
- 卵の上の穴を透明なテープで覆い、解剖のためにE15まで加湿器に入れます。
2. E15胚からの脳領域の解剖
注:ここでの固定のためのE15脳の解剖は、生きた脳スライスのステップ8.2で説明されているものと似ていますが、ここでの解剖は無菌条件下で行う必要はありません。
- 殻の上部の周りのテープを切り取り、胚にアクセスできるようにします。
- 首の胚を断頭し、滅菌カルシウムとマグネシウムを含まないタイロード(CMF Tyrode)溶液を入れた10cmの皿に頭を置きます。 補足図2を参照してください。
- 細かい鉗子を使用して、脳を覆っている皮膚を剥がし、下にある硬膜を明らかにします。脳の左右にある形成中の頭蓋骨を取り除きます。形成する頭蓋骨はまだ脳の大部分を覆っていません。
- 細かい先のとがった鉗子をそっと使って、脳の中心にある髄膜を引き裂き、両側に剥がして脳を明らかにします。
- 湾曲した鉗子を使用して脳を下からすくい取り、そっと腔から引き出します。
- 脳をその部分に解剖します:前脳、テクタ、小脳。
- 細かい鉗子を使用して、上にある軟膜をテクタから取り除きます。軟膜はテクタから容易に分離するが、前脳や小脳からは分離しないことに注意してください。前脳に触れるか、ろ紙の上で転がして、前脳からピアを取り除きます。
- 解剖した脳領域を小さな皿に入れます。
- 固定する脳領域を24ウェルプレートウェルに入れ、0.1 Mカコジル酸ナトリウムバッファー中の2%パラホルムアルデヒド(PFA)で固定します。4°Cで少なくとも24時間放置します。
- 固定後、寒天に包埋する前に、少なくとも1時間にわたって3x PBSで組織をすすぎます。
3.収穫した脳領域の埋め込みとスライス
- PBS中の3.5%寒天と8%スクロースの溶液を溶融するまで予熱し、融解温度に保ちます。
- 湾曲した鉗子をスクープとして使用し、ニワトリ胚脳の視蓋または前脳領域のいずれかをそっと持ち上げ、ろ紙でわずかに吸い取って余分な液体を取り除き、寒天が外脳表面に付着するようにします。
- 滅菌トランスファーピペットを使用して、型に寒天溶液を充填します。
注意: 小さな長方形の金属振動組織スライサーブロックなど、適切なサイズのオブジェクトの周りにアルミホイルを形成することで、簡単な型を作成できます。 - 脳領域を寒天に入れ、寒天を完全に固化させます。
- 埋め込まれた脳の周りからアルミホイルを取り除き、かみそりの刃またはメスを使用して側面の周りの余分な寒天を切り取ります。
- スライストレイのステンレス鋼の正方形にシアノアクリレート接着剤を一滴置き、脳付きのアガロースブロックを接着剤の上に置き、接着剤を1分間接着させます。トレイを振動組織スライサーチャックに入れ、締めて、寒天ブロックの上部を覆うのに十分なPBSをトレイに充填します。
- スチール製のかみそりの刃を使用して、振動する組織スライサーで脳スライスを350μmの厚さで切断します。
- 脳のスライスがカットされてスライストレイに自由に浮かぶので、ヘラを使用してスライスをすくい上げ、トレイから取り出します。セクションをスパチュラからそっとスライドさせ、PBSでラベル付けされた10cmのペトリ皿に入れて、セクションが自由に浮くようにします。
注:脳スライスを囲む寒天は、埋め込む前に余分な液体を除去するために脳がろ紙で十分に吸い取られていない場合、剥離する可能性があります。これが発生した場合、脳組織は固化した寒天から穏やかに除去され、過剰な液体の適切な吸い取りの後に再埋め込まれます。
4.腫瘍細胞による脳スライスの免疫染色
- 落射蛍光を備えた実体顕微鏡を使用して、腫瘍細胞の有無について10cmディッシュ内の個々のスライスを1つずつスクリーニングします。
- 免疫染色のために0.1%Triton X-100および5%正常ヤギ血清(PBSTG)( 表1を参照)を含む十分な量のリン酸緩衝生理食塩水を調製し、免疫染色するスライスをすすぎます。
- PBSで脳切片を染色するために使用される24ウェルプレートのウェルをハーフフィルします。
- ヘラやメスの縁で脳スライスの周りの寒天の角を切り取り、PBSを含むウェルにそっと置きます。
- PBSを吸引し、PBSTG中の350 μLの一次抗体染色溶液(例えば、PBSTG中の2 μg/mL UJ127)と交換します。
- 穏やかな攪拌を伴う冷蔵室で24時間インキュベートし、スライスがウェル内で自由に動くのが見えるようにします。
- 24時間後、一次抗体溶液を取り出し、攪拌しながら冷蔵室でPBSTGで3 x 1時間すすぎます。
- すすぎが終了したら、PBSTG中の二次抗体染色溶液350 μL/ウェルでインキュベートします(例:PBSTG中のビオチンGAMの1/200希釈)。攪拌しながら冷蔵室で20時間インキュベートします。
注:三次ステップを先に進め、このステップで蛍光色素含有二次抗体とともにインキュベートする場合は、インキュベーション中に光から保護するためにカバーしてから、ステップ4.11にスキップしてください。 - 二次抗体溶液を取り出し、PBSTG中で撹拌しながら冷蔵室で3 x 1時間すすぎます。
- PBSTGを除去し、三次溶液中でインキュベートします(例:PBSTG中のAlexa Fluor 647ストレプトアビジンの1:250希釈)。必要に応じて、このステップで0.1 μg/mLのビスベンズイミドを混合物に加えて核を染色します。攪拌しながら冷蔵室で20時間インキュベートします。
- 三次溶液を取り出し、攪拌しながら冷蔵室でPBSTGで3 x 1時間すすぐ。
- 顕微鏡スライドに取り付ける準備ができるまでPBSに入れたままにします。
5. 顕微鏡スライドへのスライスの取り付け
- 取り付けるセクションと同じ数の顕微鏡スライドを準備します。
- スライドごとに、厚さ10ミル(254μm)のビニール電気テープの長さ50 mmのストリップをパラフィルムの上に置きます。
- 1 cm x 1 cmの正方形の穴あけパンチを使用して、電気テープとパラフィルムの中央に穴を開けます。
- パラフィルムからテープを引き抜き、顕微鏡スライドの上に置き、スライドにテープにラベルを付けるスペースを残します。
- マイクロピペットを使用して、電気テープの中央にある四角い穴に1〜2滴の退色防止封入剤を置きます。
- 湾曲したスパチュラを使用して、目的の振動組織スライサーセクションをPBSTGから持ち上げ、清潔な実験室用ワイプまたはろ紙で水分を完全に逃がします。
- スライスの端を封入剤の滴に触れ、別のヘラを使用してセクションを封入剤にそっとスライドさせます。
- さらに数滴のマウンタントでセクションを覆い、セクションとマウンタントの上に24 mm x 30 mm(#1.5の厚さ)のカバーガラスを慎重に置きます。
- カバーガラスの端をマニキュアでシールして、所定の位置に保ちます。
6. 固定脳スライスの共焦点顕微鏡
- 広視野蛍光を使用して、適切な対物レンズとフィルターセットを使用して、マウントされた脳スライス内の蛍光腫瘍を見つけます。
注:一部の腫瘍は非常に大きく、4倍の対物レンズで簡単に見ることができますが、単一細胞には10倍の対物レンズが必要になる場合があります。 - 適切な対物レンズ、レーザー、ピンホールサイズ、および検出器設定を使用して共焦点顕微鏡に切り替えます。このプロトコルに従うには、ルーチンイメージングには20倍の対物レンズ(開口数[N.A.] = 0.75)、高解像度のイメージングには60倍の対物レンズ(N.A.= 1.40)を使用します。
- 光学切片を取得するためのz軸とステップサイズの上限と下限を設定します(共焦点顕微鏡の製造元の指示に従って特定の状況に応じて)。光学セクションのZスタックを取得します。
- 共焦点顕微鏡ソフトウェアを使用して、製造元の指示に従って腫瘍の3Dボリュームレンダリングを作成します。
7.スフェロイドの準備
- ポリ(メタクリル酸2-ヒドロキシエチル)(ポリHEMA)プレートの作成
- 95%エタノール中の10 μg/mLポリHEMA溶液を作成し、35 mmペトリ皿(または細胞培養皿)を1 mLのこの溶液でコーティングします。
- 皿を室温で一晩カバーされていないロッカーに置いて、皿の表面のコーティングを開発します。
注意: 溶媒は蒸発し、皿に半透明のコーティングを残し、不均一に見える場合がありますが、これは細胞スフェロイドを作る能力には影響しません。 - 乾燥後、開いた皿をバイオセーフティキャビネット内のUV光の下で1時間滅菌します。滅菌後は蓋を元に戻してください。これで、コーティングされた皿を使用する準備が整いました。
- タイムラプス顕微鏡のための蛍光DiD染色
注:このセクションは、スフェロイドの作成に使用するDiD蛍光色素で単一細胞を染色するためのものであり、ライブタイムラプスイメージングのための細胞運動性の視覚化を最適化します。- 細胞を無血清培養培地に懸濁します。
- 5 μLのDiDストック/mLの細胞懸濁液を加え、ピペッティングで穏やかに混合します。37°Cで20分間インキュベートします。
- 標識細胞懸濁液を800 × g で5°Cで5分間遠心分離します。
- 上清を吸引し、細胞を温かい培地に再懸濁してすすぎます。
- この遠心分離とすすぎのステップをさらに2回繰り返します。
注意: 必要に応じて、手順7.3.6にスキップして、このプロセスの直後にスフェロイドを作成します。
- 細胞スフェロイドを作る
- 0.25%トリプシン/エチレンジアミン四酢酸(EDTA)溶液を37°Cに温めます。
- GSC培地17(表1)でGSCを培養し、U-118悪性グロイマ(MG)細胞をU-118培地(表1参照)で培養する。スフェロイドの35 mmプレート1枚を準備するために、コンフルエントな10 cmディッシュを使用します。bFGF(最終濃度10 ng/mL)およびTGF-α(最終濃度20 ng/mL)成長因子を最初にGSCに追加し、その後3日ごとに追加します。
注:現在の研究で使用された細胞は、緑色のGSC15-2 / K72、緑色のGSC16-4 / K72、赤色のU-118 / L1LE / mCherry2x、および赤色のU-118 / 1879 / mCherry2xでした。スフェロイドの1プレートは、メンブレンインサート上の脳スライスの2つの6ウェルプレートに十分なはずです。 - プレート上の細胞を滅菌PBSですすぎ、1 mLのトリプシン溶液を10 cmの皿に置きます。細胞が剥離し始めるまで2〜3分間細胞培養インキュベーターに入れます。
- 10 mLの適切な血清含有培養培地を10 cmディッシュに加えてトリプシンを不活性化し、上下にピペッティングして細胞を剥離します。細胞懸濁液を15 mLの円錐形遠沈管に入れます。
- 800 × g で4°Cで5分間遠心分離することにより細胞をペレット化します。
- 細胞ペレットから培地を吸引し、細胞を10 mLの培地に再懸濁します。
- 各35 mmポリHEMAコーティングディッシュに2 mLの細胞懸濁液を置き、さらに2 mLの適切な培地を加えて、ディッシュあたり4 mLの合計培地を取得します。GSCを使用する場合は、成長因子を追加します。
- 凝集体が100〜200μmのサイズに達するまで細胞をインキュベートし、これは播種された細胞の密度に応じて1〜2日であり得る。
8.生きたひよこ胚脳解剖と 振動組織スライサースライス
- 解剖の準備
- メンブレンインサートの下に1 mLの脳スライス培養培地( 表1を参照)を入れた6ウェルポリエステルメンブレンインサートプレートを準備します。
- 作業領域とツールを70%エタノールで滅菌します。
- 解剖中に6ウェルインサートプレートを氷上に置きます。
- 100 mLの振動組織スライサースライスメディア(表1)を準備し、氷上に置きます。
- PBS中の4%低メルトアガロースのバイアルを、液体(約50°C)に溶けるまで水浴に入れます。
- 振動するティッシュスライサータブを氷で満たします。
- 無菌E14/15ひよこ胚脳解剖
- 卵キャンドラーを使用して、E14またはE15胚の上のエアポケットの周囲に沿って鉛筆でトレースし、輪郭を描かれた領域を透明なテープで覆います。
- 湾曲したハサミや細かいハサミを使って、胚の膜や血管に切り込まないように注意しながら、トレースした部分の周りをそっと切り、一番上の殻を捨てます。
- 湾曲した鉗子を使用して、胚の上部にある空間膜を取り除き、ひよこ胚の頭を見つけます。
- 胚を断頭し、冷たい滅菌CMF溶液を入れた10 cmの皿に頭を置きます。 補足図2を参照してください。
- 滅菌済みの細かい鉗子を使用して、脳を覆っている皮膚を剥がして、下にある硬膜を明らかにします。脳の左右にある形成中の頭蓋骨を取り除きます。形成する頭蓋骨はまだ脳の大部分を覆っていません。
- 細かい先のとがった鉗子(#5または#55)をそっと使用して、脳の中心にある髄膜を引き裂き、両側に剥がして脳を明らかにします。
- 細かい湾曲した鉗子を使用して、脳を前面の下からすくい上げ、そっと空洞から引き出します。
- 脳を前脳、中脳(視神経蓋)、小脳の3つの主要部分に解剖します。必要に応じて、ひよこの発達のアトラスを参照してください。
- 細かい鉗子を使用して、上にある軟膜をテクタから取り除きます。
注:ピアはテクタから簡単に分離しますが、前脳や小脳からは分離しません。軟膜は、それに触れるか、滅菌ガーゼ上で転がすことによって前脳から取り除くことができる。 - 解剖した脳領域を氷の上の小さな滅菌皿に入れます。
- 脳の埋め込みとスライス
- 湾曲した鉗子をスクープとして使用し、視蓋または前脳領域のいずれかをそっと持ち上げ、滅菌ガーゼでわずかに吸い取って余分な液体を取り除き、アガロースが外脳表面に確実に付着するようにします。
- 滅菌トランスファーピペットを使用して、金型に低溶融アガロースを充填します。適切なサイズの物体の周りにアルミホイルを形成して、簡単な型を準備します。小さな長方形の金属振動組織スライサーブロックは、オブジェクトとして日常的に使用されます。 補足図3を参照してください。
- 脳領域をアガロースにすばやく置き、氷上で固化させます(約4〜5分)。
注:アガロースが硬化する前に、脳が型の底に沈むことがあります。これが発生した場合は、寒天が固まり始めるまで1分待ってから、脳領域をアガロースに配置します。アガロースの真ん中で脳領域を直接吊り下げてみてください。 - 固化したアガロースに埋め込まれた脳の周りからアルミホイルを取り除き、滅菌かみそりの刃またはメスを使用して側面の周りの余分なアガロースを切り取ります。
- スライス皿/トレイのステンレス鋼の正方形にシアノアクリレート接着剤を一滴置き、アガロースブロックを脳に置き、接着剤を1分間接着させます。皿/トレイを振動ティッシュスライサーチャックに入れ、締めて、トレイにスライスメディアを充填して、アガロースブロックの上部を覆います。
- サファイアナイフを使用して、振動組織スライサーの切片を250〜350μmで切断しますが、これは鋼製のかみそりの刃よりも生きた組織の損傷が少ないことが報告されています。
- 脳のスライスがカットされ、スライストレイに自由に浮かぶので、滅菌ヘラを使用してスライスをすくい上げ、トレイから取り出します。別の滅菌ヘラを使用して、セクションをスパチュラからメンブレンインサートにそっとスライドさせます。
注:通常、必要に応じて、2つまたは3つの脳スライスを各メンブレンインサートに配置できます。脳スライスを囲むアガロースは、脳が余分な液体を除去するために滅菌ガーゼで十分に吸い取られていない場合、剥離する可能性があります。包埋する前に十分なブロッティングを行ってもこれが発生する場合は、周囲のアガロースを含まないスライスをそっと持ち上げ、メンブレンインサートにスライドさせます。 - 脳スライスの6ウェルプレートを、37°Cおよび5%CO2の細胞培養インキュベーター内のメンブレンインサート上に置きます。
- めっきの翌日、滅菌パスツールピペットを使用して、インサートの下から培地を吸引します(ピペットが下の培地にアクセスできるように、インサートの側面に隙間があります)。メンブレンインサートの下の各ウェルに1 mLの新鮮なスライス培地を追加します。その後も1日おきにメディアを交換してください。
- 脳スライスがメンブレンインサートにしっかりと付着し、やや平らになっているように見えるまで数日待ちます。これは、スライスが実行可能であり、GBM細胞の導入の準備ができていることを示しています。
9.脳スライスへのGBM細胞の導入
- 回転楕円体法
- 細胞スフェロイドのサイズが150〜200 μmに達したら、5 μLに設定した20 μLマイクロピペットを使用して、培養皿から1〜数個のスフェロイドを除去します。 補足図3を参照してください。
- スフェロイドを含むメディアを目的の脳スライスに静かに排出します。
注意: 細胞スフェロイドはピペットチップに表示されているはずです。透明なピペットチップを使用すると、チップで見やすくなります。液体が放出されたときにスフェロイドが脳スライスから落ちる場合は、薄い木製のアプリケータースティックに接着されたエタノール滅菌まつげを使用して、スフェロイドを脳スライスにそっと押し戻す必要があります。 - スフェロイドを脳スライス上で2〜5日間培養します。
注:ここでの制限は、スライス内の血管と脳細胞の最終的な劣化であるように思われます。分解された血管は、ラミニンで染色されると、スライスに不連続なボールとして表示されます。
- 生検パンチ法
- メンブレンインサート上で平らに見えるようにして、脳スライスを付着させます(培養には2〜5日かかる場合があります)。
- 細胞マトリックスを氷上で解凍します。
- 細胞培養バイオセーフティキャビネットで、直径1mmの滅菌生検パンチを真空アスピレーターチューブに接続します。
- 生検パンチで脳スライスにそっと触れ、脳スライスの中央に1mmの穴を開けます。
注:生検パンチの組織は、真空によってパンチに吸引されます。 - 60%〜70%コンフルエントな10 cmディッシュの細胞をトリプシン処理し、10 mLの培地に再懸濁することにより、細胞マトリックス懸濁液を調製します。次に、その懸濁液1 mLを100 μLのマトリックスと混合します。
- 20 μLのマイクロピペットを使用して、1 μLの細胞マトリックス混合物を脳スライスの各穴に入れます。
- 細胞混合物の配置が終了したら、細胞が埋め込まれた脳スライスの皿をインキュベーターに戻し、マトリックスが固化し、細胞が周囲の脳スライスに侵入する可能性があります。
10. 広視野蛍光タイムラプス顕微鏡
- メディアの蒸発を防ぐために、6ウェルプレートの端の周りに取り外し可能なテープを置き、ガス交換のために片側に小さな隙間を残します。
- プレートを、倒立落射蛍光顕微鏡上の調整可能な自動ステージ上のカスタマイズされた培養チャンバーに置きます。
注:チャンバーは、ガスインジェクションコントローラーを使用して5%CO2 および95%空気の大気条件に保たれ、温度は温風温度コントローラーと温度制御されたステージインサートを使用して37°Cに維持されました。ここで使用されているシステムの詳細については、Fotos et al.18 を参照してください。 - 適切な顕微鏡制御ソフトウェアを使用して、10分ごとに20時間、関心のある領域の蛍光画像を収集するタイムラプス取得スケジュールを作成します。
注:緑色蛍光標識が細胞(緑色蛍光タンパク質[GFP]など)で使用されている場合は、光毒性を防ぐために、細胞を視覚化するために必要な最小限の青色励起光を使用してください。赤(mCherryなど)および遠赤(DiDなど)のラベルには、波長励起が長いため、この潜在的な問題はないようです。
11.タイムラプス顕微鏡後の脳スライスの免疫染色
注:この免疫染色プロトコルは、血管をラミニンで、核をビスベンズイミドで染色するために最適化されています。目的の分子に適した抗体を使用してください。
- パスツールピペットを使用してメンブレンインサートの下から培地を吸引し、インサートの下の0.1 Mカコジル酸ナトリウムバッファーに1 mLの2%PFAを置き、インサートの上部に1 mLを入れて脳スライスを覆います。スライスを4°Cで一晩固定します。
- メンブレンインサートの下から固定液を取り除き、脳スライスに残っている固定液を取り除きます(固定液はメンブレンインサートから下のウェルに漏れる傾向があります)。
- 35 mmウェルからスライスしたインサートを取り出し、より大きなプラスチック皿に入れます。
- 350 μLのPBSを脳スライスと同じ数のウェル(免疫染色時に1つのスライス/ウェル)に加えて、24ウェルプレートを調製します。
- 薄いヘラを使用して、脳スライスをメンブレンインサートから外さずに、脳スライスの周りからアガロースをそっと取り除きます。アガロースが脳スライスの外縁から簡単に外れることを確認してください。そうでない場合は、アガロースを脳スライスに付着したままにします。
- 鋭利なメスを使用して、下にある膜のあるスライスがインサートの残りの部分からなくなるまで、脳スライスの周りの膜を切り取ります。脳スライスが付着したメンブレンをピックアップし、細かい鉗子を使用してメンブレンをつかみ、PBSの24ウェルプレートのウェルに入れます。
- スライスがウェル内を移動するように、冷蔵室で1時間以上PBSでスライスを3回すすぎます。
- すすぎながら、一次抗体溶液を調製する。
- 抗ラミニンをPBSTGで2 μg / mLに希釈します( 表1を参照)。
- PBSをウェルから取り出し、低温室で一次抗体溶液中で穏やかに攪拌しながら一晩インキュベートします。
- 少なくとも20時間のインキュベーション後、一次抗体溶液を吸引し、切片をPBSTGで3倍に1時間すすぎます。
- すすぎながら、二次抗体溶液を調製する。
- 蛍光GAMをPBSTGで1:200に希釈するために必要な特定の蛍光色素で希釈し、0.1 μg/mL濃度のビスベンズイミドとともに希釈します。
- PBSTGを除去し、蛍光二次抗体溶液を撹拌しながら冷蔵室で一晩インキュベートします。
- 二次抗体を除去し、PBSTGで1時間かけて2回、PBSで1時間かけて1回すすぎます。
- 顕微鏡スライド(セクション5)とビューに取り付ける準備ができるまで、PBSに残しておきます。
結果
視蓋へのin vivo注射(図1および図2)、生きた脳スライスの培養とその生存率の評価(図3)、ex vivo脳スライス培養の作成、生検パンチ法による蛍光標識細胞の移植(図4)、ポリHEMA上で細胞を培養して細胞スフェロイドを生成する(図5)、細胞スフェロイドとのex vivo脳スライス共培養を作成し、4D共焦点タイムラプス顕微鏡を使用して侵襲的な細胞挙動を記録し(図6)、固定脳スライス調製物中の血管に対するスフェロイドからの侵襲的細胞挙動を分析します(図7および図8)。これらの結果は決して網羅的ではなく、ヒトGBM研究のための異種移植モデルとしてニワトリ胚脳を使用して得られるものの良い例を提供します。
図1は、GFPを発現するGSCの注射後にin vivoで視蓋に形成された腫瘍のいくつかの代表的な結果を示す。GSCは心室表面に付着し、脳壁に浸潤性腫瘍を形成します。GSCは明らかに血管の近くに存在し、血管に沿って移動しているように見えます。in vivo GSC腫瘍の固定および免疫染色されたスライスの回転3Dボリュームレンダリングの動画は、補足ビデオS1、補足ビデオS2、補足ビデオS3、および補足ビデオS4に記載されています。 この実験では、4色を使用して5つの特徴(緑色のGSC、白い核、白い血管、青いインテグリンα-6、および赤色のSox2または赤色ネスチン)を特定しました。
図2は、レトロウイルスベクター形質導入によりmCherryを発現するU-118/L1LE細胞2とGFPを発現するGSCを注射した後にin vivoで視蓋に形成された腫瘍の代表的な結果を示しています。これらの実験により、これらの腫瘍は混合細胞懸濁液から形成されるため、GSCは末梢または中央のいずれかに存在し、U-118細胞は特定のGSC系統に応じて内核または外皮質のいずれかで構成されるように選別が行われることが明らかになりました。
図3 は、 エキソビボ 脳スライス培養の生存率結果を示す。培養1週間後、ラミニンの固定と免疫染色により、多くの無傷の血管とSox2の発現が明らかになり、どちらも脳スライスの生存率を示すためにここで使用されました。これは、ニワトリ胚脳スライスを膜インサート上で約2週間培養し、正常に見える血管および転写因子発現で生存可能であることを示した。
図4 は、生検パンチ法を用いてスライスに空洞を作成した後、赤色U-118 / L1LE / mCherry細胞(マトリックスと混合)の「プラグ」を ex vivo 脳スライスに導入した結果を示しています。U-118細胞は明らかに脳組織に、時には広範囲に、そしてしばしば血管に沿って侵入した。しかし、細胞浸潤は、導入された細胞の周囲で均一ではなかった。血管は、おそらくパンチ法の外傷の追加または培養期間のために、特定のスライスで損傷または存在しないように見えることがありました。これは、生検パンチ/セルプラグ法を使用して、培養 されたex vivo 脳スライスの特定の場所にGBM細胞を導入し、その後細胞が脳スライスに侵入できることを示しました。
図5 は、培養中の生きたスフェロイドと、タイムラプス実験のために ex vivo 脳スライスに導入された生GBM細胞スフェロイドの広視野蛍光のいくつかの例を示しています。スフェロイドから脳スライスへの細胞浸潤の動画は、補足ビデオ S5および補足ビデオS6 に記載されています。 これは、細胞スフェロイドが ex vivo 脳スライスの特定の位置にGBM細胞またはGSCを導入する別の成功した方法であり、個々の細胞の解像度が悪い可能性があるものの、広視野蛍光顕微鏡によって侵襲的な細胞の挙動を監視できることを示しました。
図6は、生きたGSC16-4/GFPおよびU-118/L1LE/mCherry細胞の脳スライスへの浸潤の共焦点タイムラプス実験の静止画像を示しています。共焦点zスタック画像は、マルチポイントタイムラプス実験で20時間にわたって10分ごとに取得されました。スフェロイドから共焦点zスタックとして撮影された脳スライスへの細胞の浸潤の経時的な動画は、補足ビデオS7、補足ビデオS8、補足ビデオS9、補足ビデオS10、および補足ビデオS11で提示されます。 この実験により、共焦点タイムラプスイメージングは、個々の細胞の侵襲行動を追跡するために広視野蛍光よりも優れていることが明らかになりました。U-118/L1LE細胞は、これらの条件下でGSCよりも著しく侵襲性が高かった。これは静止画像でも明らかであり、GSCはより中央に配置され、U-118細胞はより分散しています。
図7 は、2つの異なる別々に標識されたスフェロイド(U-118 / L1LE / mCherryスフェロイドおよびGSC16-4 / GFPスフェロイド)を脳スライス上に置き、数日間成長させた後、固定し、ラミニンについて免疫染色し、共焦点顕微鏡での光学切片によって画像化した 、ex vivo 脳スライス/スフェロイド調製のいくつかの例を示しています。これにより、両方の細胞タイプが脳スライスに侵入し、血管に沿って移動することが明らかになりました。異なるタイプのスフェロイドが互いに接触するのに十分接近している場合、一方の細胞タイプの他方の細胞タイプのスフェロイドへの侵入は、あるとしてもほとんどないようであり、スフェロイドは分離されたままでした。
図8 は、2つの異なる標識細胞型(GSC16-4/GFPと混合したU-118/L1LE/mCherry)を用いた培養で生成された「混合細胞型」スフェロイドを脳スライス上に載せ、数日間増殖させた後、固定し、ラミニンについて免疫染色し、共焦点顕微鏡で光学切片によって画像化した ex vivo 脳スライス/スフェロイド調製物のいくつかの例を示しています。その結果、赤色のU-118/L1LE/mCherry細胞は、スフェロイドの中心付近に凝集塊として残る傾向にある緑色のGSC16-4/GFP細胞よりも、スフェロイドから移動し、はるかに明確に分散することが明らかになりました。さらに、U-118/L1LE/mCherry細胞もDiDで染色され、2つの別々の標識(mCherryおよびDiD)を固定された ex vivo 調製物で直接比較することができました。DiD標識は、脳スライスに侵入した単一細胞でも検出できました。しかし、これは細胞内プンクタのようでした。
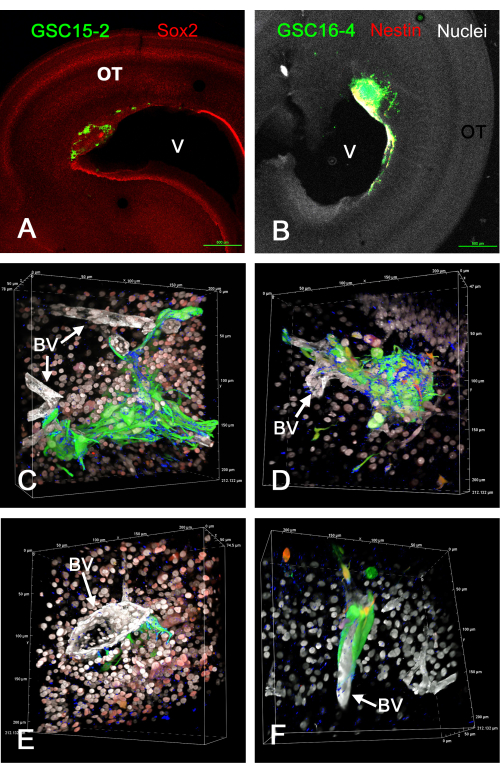
図1:in vivoでE5視蓋にGSCを注射した結果生じたE15の腫瘍。 GSCはGFP発現により緑色である。GSC15-2 セルはパネル A、C、および E に、GSC16-4 セルはパネル B、D、および F に示されています。(A)心室付近に腫瘍を有する視蓋の低倍率図(V)。Sox2染色は赤色で示され、OT細胞の核の大部分を染色します。(B)Aと同様の画像ですが、GSC16-4細胞もネスチンで赤く染色されており、混色や画像露出により画像に黄色または白に見えることがあります。OT核は、ビスベンズイミドによる対比染色により白色に見えます。(C-F)60倍の油浸対物レンズを使用してZスタックから生成されたボリュームレンダリングのさまざまな視点。細胞核はビスベンズイミド染色により白色に見え、Sox2の免疫染色によりパネルCおよびEでは赤く見えるものもあります。パネルD及びFにおける赤色染色は、ネスチンに対する染色によるものである。共焦点顕微鏡ソフトウェアのボリュームレンダリングの「アルファブレンディング」により、最大強度投影を使用する場合のように色がブレンドされず、最も一般的な色が優勢になり、強度の低い色が不明瞭になることに注意してください。血管はラミニンの免疫染色により白く染まります。GSCマーカーインテグリンα-6染色は青色で示され、GSC表面に点状に見えます。ミクロンスケールは、ボリュームレンダリングのエッジに沿って表示されます。パネル C-F のボリューム レンダリングの回転のビデオは、補足ビデオ S1、補足ビデオ S2、補足ビデオ S3、および補足ビデオ S4 に表示されます。 スケールバー= 500 μm(A、B)。略語:GSC =膠芽腫幹細胞;OT =視蓋;GFP = 緑色蛍光タンパク質;BV =血管。この図の拡大版を表示するには、ここをクリックしてください。
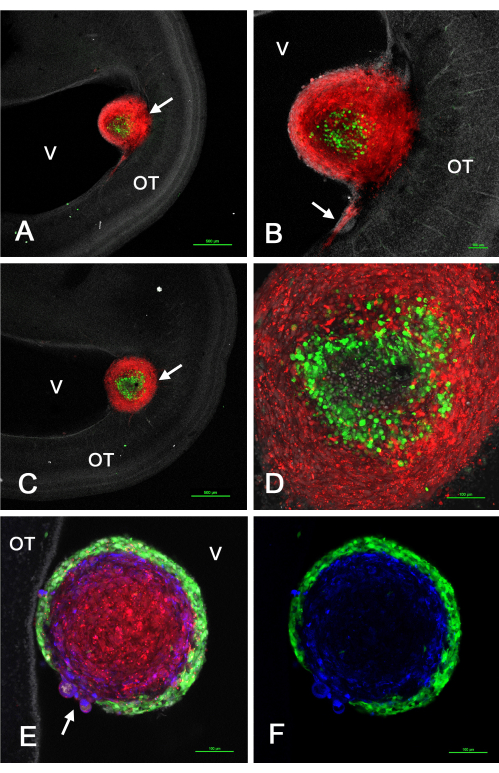
図2:E5視蓋に注入されたGSCとU-118 GBM細胞の混合物に起因するE15の腫瘍。GSCはGFP発現により緑色、U-118/L1LE細胞はmCherry発現により赤色です。GSC15-2はパネルA-Dに、GSC16-4はパネルEとFに示されています。(a)脳室付近の混合細胞腫瘍(矢印)の低倍率共焦点単体z面。核はビスベンズイミドで白く対比染色されています。(B)Aに示す腫瘍の高倍率(10倍対物レンズ)で、心室表面近くのOTに赤色U-118細胞が浸潤します。(C)OT壁の奥深くに埋め込まれた腫瘍(矢印)を示すAの光学面とはわずかに異なる光学面。(D)腫瘍内の選別された細胞の詳細を示すCにおける腫瘍の複数のz平面の最大投影(20倍対物レンズ)。(E)GSC16-4細胞との混合腫瘍の単一のz平面画像(20倍対物レンズ)は、腫瘍内での選別がGSC15-2細胞とは反対のパターンで発生し、緑色のGSCが赤色のU-118細胞を囲む薄く均一な皮質を作成することを示しています。OT壁への腫瘍の付着領域は、このz平面には示されていない。U-118 / L1LE細胞が膨らんでいるGSC皮質の不連続性がある腫瘍の領域に注意してください(矢印)。L1CAMの免疫染色は青色で示されています。(F)Eと同じ画像ですが、緑色のGSCと青色のL1CAM染色のみを示しています。スケールバー = 500 μm (A、C)、100 μm (B、D、E、F)。略語:GSC =膠芽腫幹細胞;OT =視蓋;GFP = 緑色蛍光タンパク質;V =心室。この図の拡大版を表示するには、ここをクリックしてください。
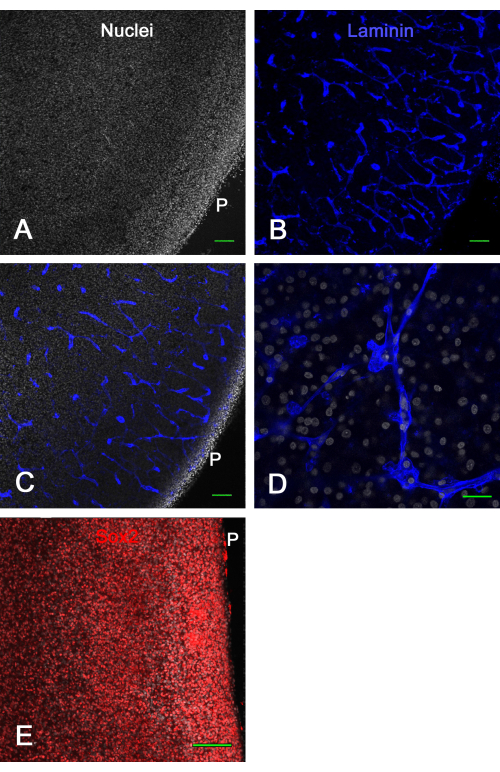
図3:培養1週間後のex vivo視蓋スライスの生存率。 E14視蓋スライスをメンブレンインサート上で1週間培養した後、固定して免疫染色しました。AとBは、ビスベンズイミド(A)で核を染色し、ラミニン(B)で免疫染色した脳スライスの共焦点画像(10倍対物レンズ)であり、ラミニン染色により、さまざまな構成で光学的に切片化された正常で無傷の血管を明確に示しています。(C)パネルAおよびBで示されているものと同様の共焦点画像で、核染色とラミニン染色の両方が見られます。(D)核およびラミニン染色の詳細を示す高倍率(60倍の油性対物レンズ)共焦点画像。(E)赤でSox2転写因子、白でビスベンズイミドで全核で染色された脳スライスの共焦点zスタック(20倍対物レンズ)の最大投影画像。なお、核の大部分は、in vivoで示されているようにSox2染色を示す(図1参照)。スケールバー = 100 μm (A、B、C、E)、25 μm (D)。略称: P = パイアルサーフェス。この図の拡大版を表示するには、ここをクリックしてください。
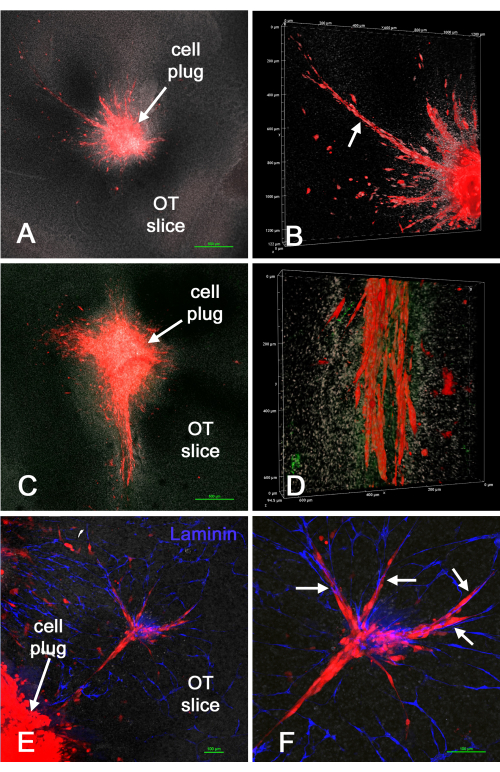
図4:生検パンチ法を介して ex vivo 脳スライスに配置されたU-118 / mCherry細胞。 1mm生検パンチを用いて脳スライスに空洞を作り、マトリックスと混合した赤色のU-118/L1LE/mCherry細胞を「プラグ」として移植した。数日後、脳スライスを固定し、ラミニンについて免疫染色し、共焦点顕微鏡分析のためにスライドに取り付けました。パネル A と C は、結果として生じる「腫瘍」と脳スライスに浸潤した周囲の細胞の低倍率、共焦点、単一のz平面画像(4倍対物レンズ)を示しています。(B)より高い倍率(20倍対物レンズ)でのパネル A の調製物からのzスタックの体積レンダリング、U-118細胞の広範な侵入を示す(矢印)。(D)画像は、パネル Cに示されている広範囲に侵入する細胞の下部の同様のボリュームレンダリングを示しています。ラミニン染色は緑色で示されていますが、明確な血管は明らかではありません。(E)画像は、細胞栓の一部と脳スライスに侵入した細胞群、および血管のラミニン染色を青色で示しています。(f)パネル Eに示す侵入細胞の倍率が高く、血管に沿って整列した細胞がはっきりと見える(矢印)。すべてのパネルは、ビスベンズイミドによる白色核対比染色を示しています。スケールバー = 500 μm (A、C)、100 μm (E、F)。パネル B と D の尺度は、ボリューム レンダリング軸に沿っています。略称:OT =視蓋。 この図の拡大版を表示するには、ここをクリックしてください。

図5:培養中の生細胞スフェロイドおよびex vivo脳スライス中の生GBM細胞の広視野蛍光画像。パネルAとBは、スフェロイド(矢印)として成長するU-118/L1LE GBM細胞(A)とGSC(B)の位相差画像(倒立顕微鏡で10倍の対物レンズを使用)を示しています。パネルAの背景に示されているのは、細胞培養皿に起こりうるポリHEMAコーティングの焦点ずれムラである。パネルC〜Fに示されているのは、エクスビボスライスへの侵入のライブ挙動を監視するためのタイムラプス実験中のU-118/L1LE細胞スフェロイドおよび侵入細胞(矢印)の広視野蛍光画像です(カスタムタイムラプス顕微鏡システムで20倍の対物レンズを使用18)。パネルCおよびEでは、細胞を遠赤色蛍光膜色素DiDで染色し、パネルDおよびFでは、細胞を赤色mCherry発現を介してイメージングします。スケールバー= 100μm。パネルCおよびDに示される広視野蛍光タイムラプス実験のビデオは、それぞれ補足ビデオS5および補足ビデオS6に位置する。略語:GBM =膠芽腫;GSC = GBM幹細胞;S =回転楕円体。この図の拡大版を表示するには、ここをクリックしてください。
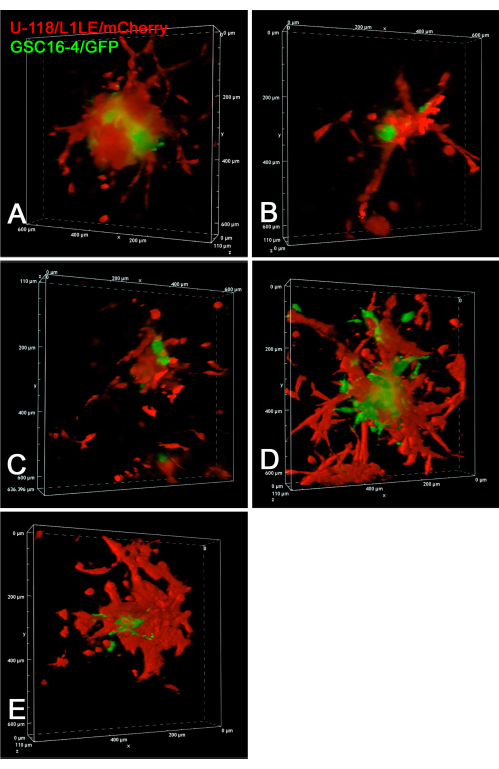
図6:生GSCおよびGBM細胞の共焦点4Dタイムラプスのボリュームレンダリング画像。すべてのパネルに示されているのは、別々の脳スライス上の5つの異なる混合細胞スフェロイド生着のエンドポイント画像です。パネルA〜Eの場合、共焦点zスタック画像は、20時間にわたって10分ごとに10μmステップで取得されました。調製物には、赤色のU-118/L1LE/mCherry細胞と緑色のGSC16-4/GFP細胞の混合細胞スフェロイドを移植した脳スライスが含まれていました。共焦点画像は、必要な余分な作動距離を提供する超長作動距離(ELWD)20倍対物レンズ(0.45 NA)を使用して、6ウェルプラスチック細胞培養皿の膜インサート上で脳スライスを培養しながら撮影されました。ボリュームレンダリングは、共焦点顕微鏡ソフトウェア「アルファブレンディング」を使用して生成され、明らかな3D効果が得られます。これらの共焦点ボリュームレンダリングの経時的なタイムラプスビデオは、補足ビデオS7、補足ビデオS8、補足ビデオS9、補足ビデオS10、および補足ビデオS11に提示されます。 略語:GBM =膠芽腫;GSC = GBM幹細胞;GFP = 緑色蛍光タンパク質;NA =開口数。この図の拡大版を表示するには、ここをクリックしてください。
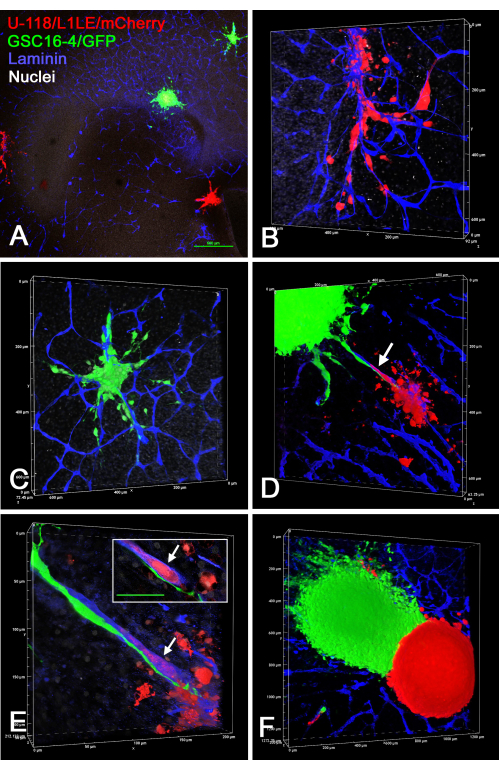
図7:異なる細胞タイプのスフェロイドからの侵襲性GBM細胞を用いた固定脳スライスの共焦点画像。緑色スフェロイドはGSC16-4/GFP細胞で構成され、赤色スフェロイドはU-118/L1LE/mCherry細胞で構成されていました。パネルA〜Fに示されているのは、ラミニン(青)の固定および免疫染色の前に、複数の赤および緑のスフェロイドを数日間培養した脳スライスの異なるビューです。パネルA〜Cは、Aが4倍の対物レンズで撮影されたのと同じOTスライスであり、パネルBとCは、パネルAに示す2つのスフェロイドから脳スライスに侵入した細胞の高倍率ボリュームレンダリング(20倍対物レンズ)です。どちらの細胞型も明らかに血管に沿った組織に侵入しました。パネルDは、2つの異なるスフェロイドが互いに近接して配置され、両方の細胞がそれらの間にある同じ血管に沿って移動するのが見られる、異なる脳スライスのボリュームレンダリング(20倍対物レンズ)を示しています(矢印)。パネルEは高倍率(60倍の油性対物レンズ)ボリュームレンダリングで、緑色の細胞が血管の外面に沿って移動し、赤血球が血管の内側を移動していることを示しています(矢印)。挿入図は単一のz平面光学切片を示しており、赤血球は血管の青い染色(矢印)ではっきりと囲まれており、緑色の細胞は明らかに血管の外側にあります。はめ込みのスケールバー= 50 μm。パネルFは、2つの密接に異なる色のスフェロイドを持つ前脳スライスのボリュームレンダリング(10倍対物レンズ)を示しています。一方の回転楕円体からもう一方の回転楕円体への細胞侵入は、あったとしてもほとんど起こらず、それらの間には鋭い境界が存在していました。パネルA、B、C、およびEも、ビスベンズイミドによる白色核対比染色を示しています。スケールバー= 500μm(A)。パネル B-F の尺度は、ボリューム レンダリング軸に沿っています。略語:GBM =膠芽腫;GSC = GBM幹細胞;GFP = 緑色蛍光タンパク質;OT =視蓋。この図の拡大版を表示するには、ここをクリックしてください。
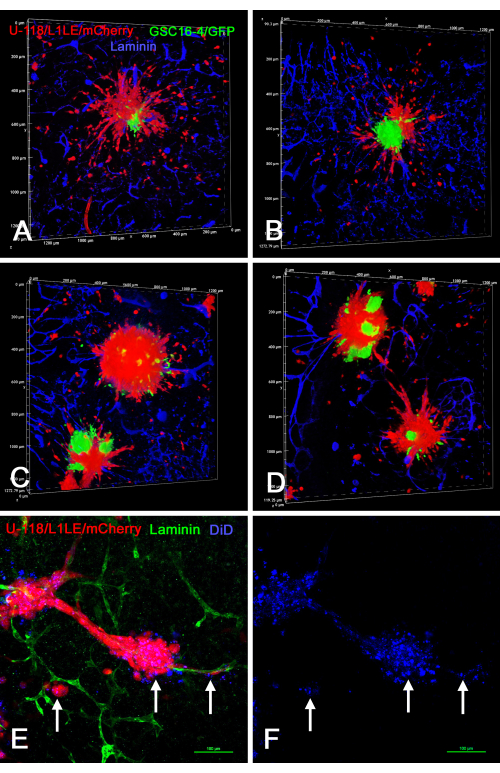
図8:混合細胞スフェロイドおよびDiDで標識されたスフェロイドからの侵襲性GBM細胞による固定脳スライスの共焦点画像。パネルA〜Dは、緑色のGSC16-4 / GFP細胞と赤色のU-118 / L1LE / mCherry細胞で構成される混合細胞スフェロイドを含む脳スライスのボリュームレンダリングを示しています。多数の赤色のU-118細胞がスフェロイドから分散し、脳スライスに四方八方に侵入したが、緑色のGSCは分散せず、スフェロイドの中央位置に留まった。パネルEおよびFは、遠赤色膜色素DiD(青色で表示)で標識された赤色のU-118 / L1LE / mCherryスフェロイドを用いたex vivoスライス調製物を示しています。固定後、スライスを緑色にしたラミニンについて免疫染色した。DiD標識は、赤血球では点状染色(矢印)として見え、スフェロイドから血管に沿って分散した細胞でも見えました。ビスベンズイミドによる核対比染色は、他の染色がよりはっきりと見えるように、この図には示されていません。スケールバー= 100μm(E、F)。略語:GBM =膠芽腫;GSC = GBM幹細胞;GFP = 緑色蛍光タンパク質。この図の拡大版を表示するには、ここをクリックしてください。
| 媒体/ソリューション | 組成 | ||
| GSCメディア | DMEM/F12、1%ウシ胎児血清(FBS)、15 mM HEPESバッファー、2 mM L-グルタミン、100 μg/mLペニシリン-ストレプトマイシン(ペン/連鎖球菌)、ビタミンAを含まない2%B27サプリメント、および2.5 μg/mLヘパリンの1:1混合物。 | ||
| GBM メディア | DMEM(高グルコース)、10%FBS、ペン/連鎖球菌、および2 mM L-グルタミン。 | ||
| 固定バッファー | 0.1 Mカコジル酸ナトリウム緩衝液中の2%PFA | ||
| 埋め込み媒体 | PBS中の3.5%寒天および8%スクロース | ||
| ティッカー | PBS中の0.1%トリトンX-100 + 5%正常ヤギ血清(NGS) | ||
| U-118 MG細胞培養液 | DMEM + 10% FBS + ペン/連鎖球菌 + L-グルタミン | ||
| 脳スライス培養培地 | 50% MEM + 25% HBSS + 25% ウマ血清 + B27 + ペン/連鎖球菌 + L-glut + 15 mM HEPES バッファー | ||
| 振動組織スライサースライスメディア | 培地 199 + ペン/連鎖球菌 + 15 mM HEPES バッファー | ||
表1:このプロトコルで使用されるメディアとバッファーの構成。
補足図1:E5視蓋への注射。 (A) 卵殻に空間上の穴を開け、空間膜を生理食塩水または培地で濡らした後、細かい鉗子で膜を取り除きます。(B) 視蓋に細胞を注入するには、羊膜をつまんで細かい鉗子で保持し、視蓋にアクセスできるように頭を配置します。 次に、マイクロピペットを視蓋に挿入し、細胞をそれに圧力注入します。(C) 細胞を注入した後、注射器と細い針を用いて数滴のアンピシリン溶液を胚の上に加える。 このファイルをダウンロードするには、ここをクリックしてください。
補足図2:E15脳領域の解剖。(A) 断頭後、E15胚頭部を滅菌CMF溶液と共に皿に入れる。(B) 次に、脳を覆う皮膚を細かい鉗子を使用して除去します。(C)次に、2つの頭蓋骨が2つの前脳(FB) 半球の上にあることから取り除かれます。(D) 次に、結合組織の硬膜を前脳(FB)、視蓋、小脳の周囲から穏やかに除去します。(E) 次に、湾曲した鉗子を使用して脳腔の下から脳腔からそっとすくい取ることにより、脳全体を頭から取り除きます。(F) は、前脳(FB)、視蓋(OT)、小脳(CB)を切除した脳全体の背側図である。(G)次に、孤立した脳を細かいハサミを使用して前脳(FB)、視蓋(OT)半球、および小脳(CB) に解剖します。(H) 繊細な結合組織軟膜は、細かい鉗子を使用して視蓋(OT)半球から簡単に除去されます。 このファイルをダウンロードするには、ここをクリックしてください。
補足図3:E15視蓋の埋め込みとスライス、および細胞スフェロイドの配置。(A) 1つの視蓋半球を湾曲した鉗子を使用して低溶融アガロースに沈めます。(B) アガロースが氷上で硬化した後、視蓋を含むブロックをトリミングし、スライス皿/トレイのステンレス鋼台座に接着します。(C) 接着剤が乾いた後、スライス皿/トレイを振動組織スライサーのチャックに入れ、冷たいスライス媒体で満たします。 次に、スライスを水中ティッシュブロックからサファイアナイフで切断します。 カットスライスは皿/トレイに浮かび、ヘラを使用して取り除くことができます。 (D) カットスライスをディッシュ/トレイから取り出し、マルチウェルプレートの下にあるスライス培養培地とともにメンブレンインサートに直接置きます。(E) ポリHEMAコーティングされたディッシュ上で細胞スフェロイドを増殖させた後、20μLのマイクロピペッターを使用して最小限の培地でスフェロイドをディッシュから除去します。(F) 次に、単離されたスフェロイドを最小媒体中の脳スライス上に直接配置する。(G) スフェロイドがメディアの流れによって脳スライスから落ちた場合は、木製のアプリケータースティックに接着されたまつげを使用して、スフェロイドを脳スライスに戻すことができます。 このファイルをダウンロードするには、ここをクリックしてください。
補足ビデオS1:E15での小さなGSC15-2腫瘍の高倍率ボリュームレンダリングのビデオ。 GSCはGFP発現により緑色である。ビデオは 図1C に対応し、GSC15-2細胞を示しています。このビデオは、60倍の油浸対物レンズを使用してzスタックから生成されたボリュームレンダリングの回転を示しています。細胞核はビスベンズイミド染色により白く見え、Sox2の免疫染色により赤く見えるものもあります。共焦点顕微鏡ソフトウェアのボリュームレンダリングの「アルファブレンディング」により、最大強度投影を使用する場合のように色がブレンドされず、最も強い色が優勢になり、強度の低い色が不明瞭になることに注意してください。血管はラミニンの免疫染色により白く染まります。GSCマーカーインテグリンα-6染色は青色で示され、緑色のGSC表面に点状に見えます。ミクロンスケールは、ボリュームレンダリングのエッジに沿って表示されます。 このビデオをダウンロードするには、ここをクリックしてください。
補足ビデオS2:E15での小さなGSC16-4腫瘍の高倍率ボリュームレンダリングのビデオ。 GSCはGFP発現により緑色である。ビデオは 図1D に対応し、GSC16-4細胞を示しています。このビデオは、60倍の油浸対物レンズを使用してzスタックから生成されたボリュームレンダリングの回転を示しています。細胞核はビスベンズイミド染色により白色に見え、一部のGSCはネスチンの免疫染色により赤色に見えます。共焦点顕微鏡ソフトウェアのボリュームレンダリングの「アルファブレンディング」により、最大強度投影を使用する場合のように色がブレンドされず、最も強い色が優勢になり、強度の低い色が不明瞭になることに注意してください。血管はラミニンの免疫染色により白く染まります。GSCマーカーインテグリンα-6染色は青色で示され、緑色のGSC表面に点状に見えます。ミクロンスケールは、ボリュームレンダリングのエッジに沿って表示されます。 このビデオをダウンロードするには、ここをクリックしてください。
補足ビデオS3:E15での小さなGSC15-2腫瘍の高倍率ボリュームレンダリングのビデオ。 GSCはGFP発現により緑色である。ビデオは 図1E に対応し、GSC15-2細胞を示しています。このビデオは、60倍の油浸対物レンズを使用してzスタックから生成されたボリュームレンダリングの回転を示しています。細胞核はビスベンズイミド染色により白く見え、Sox2の免疫染色により赤く見えるものもあります。共焦点顕微鏡ソフトウェアのボリュームレンダリングの「アルファブレンディング」により、最大強度投影を使用する場合のように色がブレンドされず、最も強い色が優勢になり、強度の低い色が不明瞭になることに注意してください。血管はラミニンの免疫染色により白く染まります。GSCマーカーインテグリンα-6染色は青色で示され、緑色のGSC表面に点状に見えます。ミクロンスケールは、ボリュームレンダリングのエッジに沿って表示されます。 このビデオをダウンロードするには、ここをクリックしてください。
補足ビデオS4:E15での小さなGSC16-4腫瘍の高倍率ボリュームレンダリングのビデオ。 GSCはGFP発現により緑色である。ビデオは 図1F に対応し、GSC16-4細胞を示しています。このビデオは、60倍の油浸対物レンズを使用してzスタックから生成されたボリュームレンダリングの回転を示しています。細胞核はビスベンズイミド染色により白く見え、ネスチンの免疫染色により赤く見えるものもあります。共焦点顕微鏡ソフトウェアのボリュームレンダリングの「アルファブレンディング」により、最大強度投影を使用する場合のように色がブレンドされず、最も強い色が優勢になり、強度の低い色が不明瞭になることに注意してください。血管はラミニンの免疫染色により白く染まります。GSCマーカーインテグリンα-6染色は青色で示され、緑色のGSC表面に点状に見えます。ミクロンスケールは、ボリュームレンダリングのエッジに沿って表示されます。 このビデオをダウンロードするには、ここをクリックしてください。
補足ビデオS5: ex vivo 脳スライス中の生きたGBM細胞のビデオ。 ビデオは 図5C に対応し、 ex vivo スライスへの浸潤のライブ挙動を監視するためのタイムラプス実験中のU-118/L1LE細胞のスフェロイドと侵入細胞の広視野蛍光画像を示しています(カスタムタイムラプス顕微鏡システムで20倍の対物レンズを使用)。U-118/L1LE細胞を遠赤色蛍光膜色素DiDで染色した。画像はモノクロカメラで取得しました。 このビデオをダウンロードするには、ここをクリックしてください。
補足ビデオS6: ex vivo 脳スライス中の生きたGBM細胞のビデオ。 ビデオは 図5D に対応し、 エクスビボ スライスへの浸潤のライブ挙動を監視するためのタイムラプス実験中のU-118/L1LE細胞のスフェロイドと侵入細胞の広視野蛍光画像を示しています(カスタムタイムラプス顕微鏡システムで20倍の対物レンズを使用)。細胞は、それらの赤いmCherry発現 を介して 画像化された。画像はモノクロカメラで取得しました。 このビデオをダウンロードするには、ここをクリックしてください。
補足ビデオS7:ライブGSCおよびGBMセルの共焦点4Dタイムラプスのボリュームレンダリング画像のビデオ。 ビデオは 図6Aに対応します。共焦点Zスタック画像は、20時間にわたって10分ごとに10μmステップで取得されました。調製物は、赤色のU-118/L1LE/mCherry細胞と緑色のGSC16-4/GFP細胞の混合細胞スフェロイドを移植した脳スライスであった。共焦点画像は、ELWD 20倍対物レンズ(0.45 NA)を使用して、6ウェルプラスチック細胞培養皿のメンブレンインサートで脳スライスを培養している間に撮影されました。ボリュームレンダリングは、共焦点顕微鏡ソフトウェア「アルファブレンディング」を使用して生成され、明らかな3D効果が得られます。ミクロンスケールは、ボリュームレンダリングのエッジに沿って表示されます。ビデオプレーヤーを通常の低速で進めるのではなく、ビデオプレーヤーのビデオ進行状況スライダーを手動で前後にドラッグしてセルの動きを観察すると、ビデオが最もよく観察されます。 このビデオをダウンロードするには、ここをクリックしてください。
補足ビデオS8:ライブGSCおよびGBMセルの共焦点4Dタイムラプスのボリュームレンダリング画像のビデオ。 ビデオは 図6Bに対応します。共焦点Zスタック画像は、20時間にわたって10分ごとに10μmステップで取得されました。調製物は、赤色のU-118/L1LE/mCherry細胞と緑色のGSC16-4/GFP細胞の混合細胞スフェロイドを移植した脳スライスであった。共焦点画像は、ELWD 20倍対物レンズ(0.45 NA)を使用して、6ウェルプラスチック細胞培養皿のメンブレンインサートで脳スライスを培養している間に撮影されました。ボリュームレンダリングは、共焦点顕微鏡ソフトウェア「アルファブレンディング」を使用して生成され、明らかな3D効果が得られます。ミクロンスケールは、ボリュームレンダリングのエッジに沿って表示されます。ビデオプレーヤーを通常の低速で進めるのではなく、ビデオプレーヤーのビデオ進行状況スライダーを手動で前後にドラッグしてセルの動きを観察すると、ビデオが最もよく観察されます。 このビデオをダウンロードするには、ここをクリックしてください。
補足ビデオS9:ライブGSCおよびGBMセルの共焦点4Dタイムラプスのボリュームレンダリング画像のビデオ。 ビデオは 図6Cに対応します。共焦点Zスタック画像は、20時間にわたって10分ごとに10μmステップで取得されました。調製物は、赤色のU-118/L1LE/mCherry細胞と緑色のGSC16-4/GFP細胞の混合細胞スフェロイドを移植した脳スライスであった。共焦点画像は、ELWD 20倍対物レンズ(0.45 NA)を使用して、6ウェルプラスチック細胞培養皿のメンブレンインサートで脳スライスを培養している間に撮影されました。ボリュームレンダリングは、共焦点顕微鏡ソフトウェア「アルファブレンディング」を使用して生成され、明らかな3D効果が得られます。ミクロンスケールは、ボリュームレンダリングのエッジに沿って表示されます。ビデオプレーヤーを通常の低速で進めるのではなく、ビデオプレーヤーのビデオ進行状況スライダーを手動で前後にドラッグしてセルの動きを観察すると、ビデオが最もよく観察されます。 このビデオをダウンロードするには、ここをクリックしてください。
補足ビデオS10:ライブGSCおよびGBMセルの共焦点4Dタイムラプスのボリュームレンダリング画像のビデオ。 ビデオは 図6Dに対応します。共焦点Zスタック画像は、20時間にわたって10分ごとに10μmステップで取得されました。調製物は、赤色のU-118/L1LE/mCherry細胞と緑色のGSC16-4/GFP細胞の混合細胞スフェロイドを移植した脳スライスであった。共焦点画像は、ELWD 20倍対物レンズ(0.45 NA)を使用して、6ウェルプラスチック細胞培養皿のメンブレンインサートで脳スライスを培養している間に撮影されました。ボリュームレンダリングは、共焦点顕微鏡ソフトウェア「アルファブレンディング」を使用して生成され、明らかな3D効果が得られます。ミクロンスケールは、ボリュームレンダリングのエッジに沿って表示されます。ビデオプレーヤーを通常の低速で進めるのではなく、ビデオプレーヤーのビデオ進行状況スライダーを手動で前後にドラッグしてセルの動きを観察すると、ビデオが最もよく観察されます。 このビデオをダウンロードするには、ここをクリックしてください。
補足ビデオS11:ライブGSCおよびGBM細胞の共焦点4Dタイムラプスのボリュームレンダリング画像のビデオ。 ビデオは 図6Eに対応します。共焦点Zスタック画像は、20時間にわたって10分ごとに10μmステップで取得されました。調製物には、赤色のU-118 / L1LE / mCherry細胞と緑色のGSC16-4 / GFP細胞の混合細胞スフェロイドを移植した脳スライスが含まれていました。共焦点画像は、ELWD 20倍対物レンズ(0.45 NA)を使用して、6ウェルプラスチック細胞培養皿のメンブレンインサートで脳スライスを培養している間に撮影されました。ボリュームレンダリングは、共焦点顕微鏡ソフトウェア「アルファブレンディング」を使用して生成され、明らかな3D効果が得られます。ミクロンスケールは、ボリュームレンダリングのエッジに沿って表示されます。ビデオプレーヤーを通常の低速で進めるのではなく、ビデオプレーヤーのビデオ進行状況スライダーを手動で前後にドラッグしてセルの動きを観察すると、ビデオが最もよく観察されます。 このビデオをダウンロードするには、ここをクリックしてください。
ディスカッション
中脳(視蓋)脳室に細胞を注入するためのプロトコルの重要なステップには、卵子の脈絡膜の血管を損傷しないこと、または注射前および注射中に胚を囲むことが含まれますが、胚のすぐ周囲の羊膜は穏やかに引っ張って保持することができます細胞を中脳に注入するときに頭を配置します。羊膜は比較的丈夫で、細かい鉗子で引っ張って頭を配置し、片手でしっかりと保持し、もう一方の手で脳の中央にある大きくて丸い構造である視蓋に細胞を注入することができます。一般に、注入された胚の生存率は、未知の要因に応じて25%から75%の範囲であり、生存する事実上すべての胚は、視蓋に少なくとも小さな腫瘍を含んでいます。生存可能な脳スライスを生成するための重要なステップには、スライス中にアガロースが脳に付着し、メンブレンインサートに配置されるまで組織とスライスを冷たく保つために、過剰な液体の組織を吸い取ることが含まれます。細胞タイプが異なればスフェロイドの形成速度とサイズも異なるため、poly-HEMAプレート上のメッキ細胞密度とスフェロイドを採取するまでの時間は、細胞タイプごとに最適化する必要があります。
ここでの研究は、脳スライスの生存率に関する正式な縦断的研究の対象となっていません。Yangらは、ここで用いたものと同様のニワトリ胚脳スライス培養物を使用し、少なくとも7日間、スライスの良好な生存率を示した16。以前の研究では、OT組織を最適ではない培地に保持すると、多くのピノティック核が組織に出現したことが示されましたが、これはここでの研究のスライスでは発生しませんでした。さらに、スライスが最適でない条件で変性すると、血管が断片化し、ラミニン陽性球の列として現れる(図示せず)。したがって、ここでの生存率は電気生理学や活性カスパーゼ-3発現などの方法では確認されていませんが、最適ではない培養条件下で見られた細胞死の指標はここには現れませんでした。
OTは、最大の心室を備えた最も注入しやすい領域であるため、in vivo脳腫瘍実験に焦点を当ててきました。胚が卵黄の上にアクセスできるほど小さい最新の日であるE5では、すべての脳領域が薄い心室ゾーンにすぎないため、脳室に注射を行う必要があります。それにもかかわらず、これらの注射は、脳実質に浸潤する細胞を有する埋め込み腫瘍を首尾よくもたらす。時々、結果として生じる腫瘍は前脳または小脳に見られますが、これは一般的ではありません。E15視蓋のエクスビボスライスは、主にここでの実験に使用されてきたため、エクスビボ共培養の結果はインビボ注射実験と相関させることができます。ただし、前脳スライスも適しており、視蓋と比較して表面積が大きく、心室が非常に薄いため、前脳はin vivo注射と相関していないex vivo共培養により適している可能性があります。
ここでは、 in vivo 注射、組織固定、振動組織スライサー切片、ラミニンやその他のマーカーの免疫染色を行うと、血管に近接した脳組織中のGBM細胞とGSCの高解像度画像が得られることが実証されています。腫瘍細胞と血管の相互関係を決定する機能は、共焦点ソフトウェアと製造元の指示を使用して共焦点光学切片のzスタックから3Dボリュームレンダリングを作成することによって大幅に促進されました。GFP、mCherry、およびDiD標識細胞の広視野蛍光顕微鏡を使用したタイムラプスイメージングが可能でした。しかし、高蛍光スフェロイドに近接していた遊走細胞は、スフェロイドからの「輝き」によって不明瞭になることがありました。この望ましくない影響は、広視野画像を収集するための露光時間を慎重に調整することで、いくらか最小限に抑えることができます。共焦点Zスタックを用いた経時的なタイムラプスイメージング(4D)により、スフェロイドから焦点が合っていない輝きがなくなり、暗い背景で移動する細胞が鮮明に定義されました。これはプロトコルには記載されていませんでしたが、脳スライスが6ウェルプラスチックプレートの透明なメンブレンインサート上にある間に実行された広視野タイムラプスイメージングと同様に実行されました。共焦点タイムラプスイメージングは、個々の細胞とその挙動の著しく鮮明な画像をもたらしますが、10 z平面/点のzスタックを20時間にわたって10分間隔で収集するマルチポイントタイムラプス実験は、スキャンヘッド検流計の広範な使用です。これにより検流計の寿命が大幅に短くなる可能性があるため、この方法は慎重に使用されます。
ニワトリ胚系は、GBM細胞の挙動を調べるin vivo注射およびex vivo共培養実験の両方に非常に適していますが、このモデル系にはいくつかの制限があります。他の異種移植システムと同様に、ヒト細胞が移植される環境はヒトの脳ではありませんが、GBM細胞の挙動はげっ歯類モデルおよびヒト患者の挙動を模倣しているように見えます。E5でin vivo注射実験を行った後、腫瘍は通常、E15まで10日間形成されます。これは明らかに、腫瘍形成と細胞浸潤のすべての側面を研究するのに十分な時間ではありません。しかし、ここでは、固形腫瘍が脳実質に形成され、細胞が腫瘍内で相互作用して再編成され、この比較的短い期間内に血管に沿ってびまん性に重大な脳浸潤が発生することが実証されています。in vivoニワトリ胚系に対する別の制限は、ニワトリ胚発生中に作動する大きな卵黄および胚外循環系のために、薬物または他の治療に適さないことである。局所液体薬物治療は、胚からはるかに大きな卵黄塊への拡散のために、脳内の非常に変動した未知の濃度をもたらすであろう。同様に、非常に繊細な胚外循環系への薬物の静脈内注射は、血管から漏れたり拡散したりし、脳内の濃度が不明になります。これがex vivoスライス培養法が採用された主な理由の1つであり、タイムラプス顕微鏡で細胞の挙動を観察および追跡できるだけでなく、ディッシュ4でGBM細胞の挙動を変えることに成功した治療をより適切な脳組織環境でテストできるようにしました。
ニワトリ胚同所性脳腫瘍モデルシステムの開発は、GBM腫瘍形成および浸潤性細胞挙動の研究に利用可能なシステムおよびツールへの重要な追加と見なされている。受精鶏卵はほとんどの地域で容易に入手できる可能性が高く、げっ歯類に比べて安価であり、動物の世話費用がなく、胚は非常に弾力性があり、感染に耐性があり(つまり、ほとんどの作業はベンチトップで行われます)、胚は非常に操作可能であり、殻のない培養で成長することができます19、およびニワトリの胚は脊椎動物とは見なされないため、NIHガイドラインによるIACUCの承認を必要としません(制度上の要件異なる場合があります)。したがって、これらの複数の利点は、質問や実験をその制限内にあるものに限定する場合、ニワトリ胚システムを非常に魅力的にします。複数のGBM細胞研究がニワトリ胚を用いて他の人によって行われているが、これらはほぼ独占的に胚20、21、22、23、24、25、26、27、28、29および四肢芽30の絨毛尿膜(CAM)を利用している。、そして脳ではありません。E231に髄芽腫をニワトリの脳に移植した報告もあります。間違いなく、ここで説明したように、同所性異種移植片モデルシステムとしてのニワトリ胚の使用は、CAMを使用した研究よりもヒトGBM腫瘍生物学にとってはるかに意味のある結果をもたらすはずです。
これらの研究は、ヒトGBM細胞とGSCの挙動の研究にニワトリ胚脳腫瘍モデルシステムを十分に活用し始めたばかりですが、他の研究が用途を拡大し、さらなる潜在的なアプリケーションを見つけることが期待されています。このシステムは、GBM腫瘍の形成と細胞の挙動を制御するメカニズムを明らかにするだけでなく、特定の患者の細胞に対する特定の薬物や物質の前臨床試験を可能にすることが想像できます。例えば、脳スライス培養が事前に設定されていれば、腫瘍細胞、外科的腫瘍切除からの断片、または患者由来のGBMオルガノイド32 を ex vivo 共培養に直接配置することができ、さまざまな治療法を数日で評価することができます。同様に、解離した患者細胞を ovoの E5中脳に直接注入して、腫瘍を形成して脳実質に浸潤する能力を評価することができます。したがって、ここでの方法と代表的な結果の説明が、脳腫瘍研究のためのこの非常に十分に活用されていないシステムの使用の増加を促進し、奨励することが期待されています。
開示事項
どの著者も利益相反を持っていません。
謝辞
この研究の一部は、国立がん研究所からのD.S.G.への助成金(R03CA227312)と、リサディーンモーズリー財団からの寛大な助成金によって資金提供されました。生きたGBM検体は、ヘレンF.グラハムがんセンターおよび研究所の組織調達センターを通じて患者の同意を得て入手しました。A.R.への資金提供は、国立研究資源センターと国立衛生研究所のトランスレーショナルサイエンス推進センター(UL1TR003107)から提供されました。N.P.、A.L.、Z.W.、およびKSへの夏の学部研究フェローシップは、デラウェア大学の学部研究プログラムによって提供されました。
資料
| Name | Company | Catalog Number | Comments |
| 1 cm x 1 cm square hole paper punch | Birabira | N/A | |
| 1 mm biopsy punch pen | Robbins Instruments | 20335 | |
| 6 well insert plate (Corning Transwell) | Millipore Sigma | CLS3450 | |
| 9" Disposable Pasteur Pipets | Fisher Scientific | 13-678-20C | |
| 15 mL centrifuge tubes | Fisher Scientific | 05-539-12 | |
| 24 well plate | Corning Costar | 3526 | |
| 50 mL centrifuge tubes | Fisher Scientific | 05-539-9 | |
| Agar | Fisher BioReagents | BP1423-500 | for embedding fixed brains |
| Alexafluor 488-conjugated GAM IgG | Jackson Immunoresearch | 115-605-146 | |
| Alexafluor 647-conjugated GAM IgG | Jackson Immunoresearch | 115-545-146 | |
| Aluminum foil | ReynoldsWrap | N/A | |
| Ampicillin | Sigma Aldrich | A-9518 | |
| anti-integrin alpha-6 monoclonal antibody GOH3 | Santa Cruz Biotechnology | sc-19622 | |
| anti-L1CAM monoclonal antibody UJ127 | Santa Cruz Biotechnology | sc-53386 | |
| anti-laminin monoclonal antibody | Developmental Studies Hybridoma Bank | 3H11 | |
| anti-nestin monoclonal antibody 10c2 | Santa Cruz Biotechnology | sc-23927 | |
| anti-Sox2 monoclonal antibody E-4 | Santa Cruz Biotechnology | sc-365823 | |
| B27 supplement without vitamin A | GIBCO | 17504-044 | |
| bisbenzimide (Hoechst 33258) | Sigma-Aldrich | B2883 | nuclear stain |
| Cell culture incubator | Forma | standard humidified CO2 incubator | |
| Centrifuge | Beckman Coulter | ||
| Confocal microscope | Nikon Instruments | C2si+ | With custom-made cell incubator chamber |
| Confocal microscope objective lenses | Nikon Instruments | Plan Apo lenses, except S Plan Fluor ELWD 20x 0.45 NA objective lens for confocal time-lapse imaging | |
| Confocal microscope software | Nikon Instruments | NIS Elements | Version 5.2 |
| Curved foreceps | World Precision Intruments | 504478 | |
| Curved scissors | Fine Science Tools | ||
| Curved spatula | Fisher Scientific | 14-375-20 | |
| Cyanoacrylate glue | Krazy Glue | KG-585 12R | |
| D-Glucose | Millipore Sigma | G8270 | |
| DiD far red fluorescent dye | Invitrogen | V22887 | Vybrant DiD |
| DMEM | Sigma Aldrich | D5671 | |
| DMEM/F12 | Sigma Aldrich | D8437 | |
| DMSO | Sigma Aldrich | D4540 | |
| Dulbecco's Phosphate buffered saline (PBS) | Sigma Aldrich | P5493-1L | |
| egg incubator | Humidaire | ||
| electrical tape (10 mil thick/254 µm) | Scotch | N/A | |
| Ethanol 200 proof | Decon Laboratories | 2701 | |
| Fast green FCF dye | Avocado Research Chemicals | 16520 | |
| FBS | Gemini Bio-products | 900-108 | |
| filter paper | Fisher Scientific | ||
| Gauze | Dynarex | 3353 | |
| Glass Capillaries for microinjection | World Precision Instruments | TW100-4 | |
| Glycerol | Fisher BioReagents | BP228-1 | for mounting media |
| GSCs (human glioblastoma stem cells) | Not applicable | Isolated from patient GBM specimens in Galileo laboratory in GSC media and then transduced with a GFP encoding lentiviral vector. Cells used were between passage 10 and 30. | |
| Hanks Balanced Salt Solution (HBSS) | Corning | 21-020-CV | |
| Hemacytometer | Hausser scientific | ||
| Heparin | Fisher Scientific | BP2524-100 | |
| HEPES buffer | Sigma Aldrich | H0887 | |
| Horse Serum (HI) | Gibco | 26050-088 | |
| Human FGF-2 | BioVision | 4037-1000 | |
| Human TGF-α | BioVision | 4339-1000 | |
| Inverted phase contrast microscope | Nikon Instruments | TMS | for routine viewing of cultured cells |
| KCl | Fisher Scientific | BP366 | |
| KH2PO4 | Fisher Scientific | P284 | |
| Laboratory film | Parafilm | ||
| Labquake Shaker | LabIndustries | T400-110 | |
| L-Glut:Pen:Strep | Gemini Bio-products | 400-110 | |
| Low-melt agarose | Fisher Scientific | BP1360 | for embedding live brains |
| Matrix | Corning Matrigel | 354234 | |
| Medium 199 | GIBCO | 11150-059 | |
| MEM | Corning | 10-010-CV | |
| Metal vibratome block | |||
| Micropipette tips (20, 200, 1,000 µL) | Fisherbrand | ||
| Micropipettors (20, 200, 1,000 µL) | Gilson | ||
| Microscope Coverglass (no. 1.5 thickness) | Fisherbrand | 12544A | |
| NaCl | Fisher Scientific | S271 | |
| NaH2PO4 + H2O | Fisher Scientific | S369 | |
| NaHCO3 | Fisher Scientific | BP328 | |
| Normal goat serum | Millipore Sigma | 526-M | |
| N-propyl gallate | Sigma Aldrich | P3130 | for mounting media |
| Parafilm | Parafilm | ||
| Paraformaldehyde | Electron Microscopy Sciences | 15710 | |
| PBS | Sigma Aldrich | P5493-1L | |
| Pencil | |||
| Plain Microscope slides | Fisherbrand | 12-550-A3 | |
| Plastic 35 mm Petri dish | Becton Dickinson | 351008 | |
| pneumatic picopump | World Precision Intruments | PV830 | |
| Poly(2-hydroxyethyl methacrylate) (poly-HEMA) | Sigma Aldrich | P-3932 | |
| razor blade- double edge | PACE | for cutting fixed brain slices | |
| sapphire knife | Delaware Diamond Knives | for cutting live brain slices | |
| Scalpel | TruMed | 1001 | |
| Sodium cacodylate buffer 0.2 M pH 7.4 | Electron Microscopy Sciences | 11652 | |
| Specimen chamber for vibratome | custom-made | ||
| Stereo Dissecting Microscope | Nikon Instruments | SMZ1500 | Equipped with epifluorescence |
| straight foreceps | World Precision Intruments | 500233 | |
| straight scissors | Fine Science Tools | ||
| Sucrose | Mallinckrodt | 7723 | |
| Time-lapse fluorescence microscope (widefield fluorescence) | Nikon Instruments | TE2000-E | With custom-made cell incubator chamber (see Fotos et al., 2006) |
| Tissue culture dish polystyrene 100 mm | Thermo Fisher Scientific | 130182 | for cell culturing |
| Tissue culture dish polystyrene 60 mm | Becton Dickinson | 353004 | for cell culturing |
| Transfer pipette | American Central Scientific Co. | FFP011 | |
| Transparent tape | Scotch | ||
| Triton X-100 | Sigma Aldrich | T-8787 | |
| Trypsin (0.25%) + 2.21 mM EDTA | Corning | 25-053-CI | |
| U-118 MG human GBM cell line | ATCC | HTB-15 | Cells were transduced with a lentiviral vector encoding the entire ectodomain sequence of the L1CAM adhesion protein and then with lentiviral vector pUltra-hot encoding mCherry. Passage numbers are unknown. |
| Vacuum pump | Cole-Parmer | EW-07532-40 | "Air Cadet" |
| Vibrating tissue slicer | Vibratome | 3000 | for cutting live and fixed brain slices |
参考文献
- Cretu, A., Fotos, J. S., Little, B. W., Galileo, D. S. Human and rat glioma growth, invasion, and vascularization in a novel chick embryo brain tumor model. Clinical & Experimental Metastasis. 22 (3), 225-236 (2005).
- Yang, M., et al. L1 stimulation of human glioma cell motility correlates with FAK activation. Journal of Neuro-Oncology. 105 (1), 27-44 (2011).
- Mohanan, V., Temburni, M. K., Kappes, J. C., Galileo, D. S. L1CAM stimulates glioma cell motility and proliferation through the fibroblast growth factor receptor. Clinical & Experimental Metastasis. 30 (4), 507-520 (2013).
- Anderson, H. J., Galileo, D. S. Small-molecule inhibitors of FGFR, integrins and FAK selectively decrease L1CAM-stimulated glioblastoma cell motility and proliferation. Cellular Oncology. 39 (3), 229-242 (2016).
- Pace, K. R., Dutt, R., Galileo, D. S. Exosomal L1CAM stimulates glioblastoma cell motility, proliferation, and invasiveness. International Journal of Molecular Sciences. 20 (16), 3982(2019).
- Stoppini, L., Buchs, P. A., Muller, D. A simple method for organotypic cultures of nervous tissue. Journal of Neuroscience Methods. 37 (2), 173-182 (1991).
- Ohnishi, T., Matsumura, H., Izumoto, S., Hiraga, S., Hayakawa, T. A novel model of glioma cell invasion using organotypic brain slice culture. Cancer Research. 58 (14), 2935-2940 (1998).
- Humpel, C. Organotypic brain slice cultures: A review. Neuroscience. 305, 86-98 (2015).
- Aaberg-Jessen, C., et al. Invasion of primary glioma- and cell line-derived spheroids implanted into corticostriatal slice cultures. International Journal of Clinical and Experimental Pathology. 6 (4), 546-560 (2013).
- Matsumura, H., Ohnishi, T., Kanemura, Y., Maruno, M., Yoshimine, T. Quantitative analysis of glioma cell invasion by confocal laser scanning microscopy in a novel brain slice model. Biochemical and Biophysical Research Communications. 269 (2), 513-520 (2000).
- Ren, B., et al. Invasion and anti-invasion research of glioma cells in an improved model of organotypic brain slice culture. Tumori. 101 (4), 390-397 (2015).
- Fayzullin, A., et al. Time-lapse phenotyping of invasive glioma cells ex vivo reveals subtype-specific movement patterns guided by tumor core signaling. Experimental Cell Research. 349 (2), 199-213 (2016).
- Jensen, S. S., et al. Establishment and characterization of a tumor stem cell-based glioblastoma invasion model. PloS One. 11 (7), e0158746(2016).
- Marques-Torrejon, M. A., Gangoso, E., Pollard, S. M. Modelling glioblastoma tumour-host cell interactions using adult brain organotypic slice co-culture. Disease Models & Mechanisms. 11 (2), 031435(2018).
- Tamura, R., et al. Visualization of spatiotemporal dynamics of human glioma stem cell invasion. Molecular Brain. 12 (1), 45(2019).
- Yang, C., et al. Organotypic slice culture based on in ovo electroporation for chicken embryonic central nervous system. Journal of Cellular and Molecular Medicine. 23 (3), 1813-1826 (2019).
- Murrell, W., et al. Expansion of multipotent stem cells from the adult human brain. PloS One. 8 (8), e71334(2013).
- Fotos, J. S., et al. Automated time-lapse microscopy and high-resolution tracking of cell migration. Cytotechnology. 51 (1), 7-19 (2006).
- Tufan, A. C., Akdogan, I., Adiguzel, E. Shell-less culture of the chick embryo as a model system in the study of developmental neurobiology. Neuroanatomy. 3 (1), 8-11 (2004).
- Shoin, K., et al. Chick embryo assay as chemosensitivity test for malignant glioma. Japanese Journal of Cancer Research. 82 (10), 1165-1170 (1991).
- Hagedorn, M., et al. Accessing key steps of human tumor progression in vivo by using an avian embryo model. Proceedings of the National Academy of Sciences. 102 (5), 1643-1648 (2005).
- Balciūniene, N., et al. Histology of human glioblastoma transplanted on chicken chorioallantoic membrane. Medicina. 45 (2), 123-131 (2009).
- De Magalhães, N., et al. Applications of a new In vivo tumor spheroid based shell-less chorioallantoic membrane 3-D model in bioengineering research. Journal of Biomedical Science and Engineering. 3 (1), 20-26 (2010).
- Szmidt, M., et al. Morphology of human glioblastoma model cultured in ovo. Journal of Veterinary Research. 56 (2), 261-266 (2012).
- Jaworski, S., et al. Comparison of tumor morphology and structure from U87 and U118 glioma cells cultured on chicken embryo chorioallantoic membrane. Journal of Veterinary Research. 57 (4), 593-598 (2013).
- Yuan, Y. J., Xu, K., Wu, W., Luo, Q., Yu, J. L. Application of the chick embryo chorioallantoic membrane in neurosurgery disease. International Journal of Medical Sciences. 11 (12), 1275-1281 (2014).
- Urbańska, K., et al. The effect of silver nanoparticles (AgNPs) on proliferation and apoptosis of in ovo cultured glioblastoma multiforme (GBM) cells. Nanoscale Research Letters. 10, 98(2015).
- DeBord, L. C., et al. The chick chorioallantoic membrane (CAM) as a versatile patient-derived xenograft (PDX) platform for precision medicine and preclinical research. American Journal of Cancer Research. 8 (8), 1642-1660 (2018).
- Han, J. M., Jung, H. J. Synergistic anticancer effect of a combination of berbamine and arcyriaflavin A against glioblastoma stem-like cells. Molecules. 27 (22), 7968(2022).
- Ruiz-Ontañon, P., et al. Cellular plasticity confers migratory and invasive advantages to a population of glioblastoma-initiating cells that infiltrate peritumoral tissue. Stem Cells. 31 (6), 1075-1085 (2013).
- Cage, T. A., et al. Distinct patterns of human medulloblastoma dissemination in the developing chick embryo nervous system. Clinical & Experimental Metastasis. 29 (4), 371-380 (2012).
- Darrigues, E., et al. Biobanked glioblastoma patient-derived organoids as a precision medicine model to study inhibition of invasion. International Journal of Molecular Sciences. 22 (19), 10720(2021).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved