Method Article
Utilisation du cerveau de l’embryon de poussin comme modèle pour les analyses in vivo et ex vivo du comportement des cellules de glioblastome humain
Dans cet article
Résumé
Les embryons de poussins sont utilisés pour étudier les tumeurs cérébrales du glioblastome humain (GBM) en co-cultures ovo et ex vivo de tranches cérébrales. Le comportement des cellules GBM peut être enregistré par microscopie time-lapse dans des co-cultures ex vivo , et les deux préparations peuvent être analysées au point final expérimental par une analyse confocale 3D détaillée.
Résumé
L’embryon de poussin a été un système modèle idéal pour l’étude du développement des vertébrés, en particulier pour les manipulations expérimentales. L’utilisation de l’embryon de poussin a été étendue pour étudier la formation de tumeurs cérébrales du glioblastome humain (GBM) in vivo et le caractère invasif des cellules tumorales dans les tissus cérébraux environnants. Les tumeurs GBM peuvent être formées par injection d’une suspension de cellules marquées par fluorescence dans le ventricule du mésencéphale E5 (tectum optique) in ovo.
Selon les cellules GBM, des tumeurs compactes se forment au hasard dans le ventricule et dans la paroi cérébrale, et des groupes de cellules envahissent le tissu de la paroi cérébrale. Des coupes de tissus épais (350 μm) de tecta E15 fixe avec des tumeurs peuvent être immunocolorées pour révéler que les cellules envahissantes migrent souvent le long des vaisseaux sanguins lorsqu’elles sont analysées par reconstruction 3D d’images confocales z-stack. Des tranches vivantes de cerveau moyen et antérieur E15 (250-350 μm) peuvent être cultivées sur des inserts membranaires, où des cellules GBM marquées par fluorescence peuvent être introduites dans des endroits non aléatoires pour fournir des co-cultures ex vivo pour analyser l’invasion cellulaire, qui peut également se produire le long des vaisseaux sanguins, sur une période d’environ 1 semaine. Ces co-cultures ex vivo peuvent être surveillées par microscopie à fluorescence large ou confocale pour observer le comportement des cellules vivantes.
Les tranches co-cultivées peuvent ensuite être fixées, immunocolorées et analysées par microscopie confocale pour déterminer si l’invasion s’est produite le long des vaisseaux sanguins ou des axones. De plus, le système de co-culture peut être utilisé pour étudier les interactions cellule-cellule potentielles en plaçant des agrégats de différents types et couleurs cellulaires à différents endroits précis et en observant les mouvements cellulaires. Les traitements médicamenteux peuvent être effectués sur des cultures ex vivo , alors que ces traitements ne sont pas compatibles avec le système in ovo . Ces deux approches complémentaires permettent des analyses détaillées et précises du comportement des cellules GBM humaines et de la formation de tumeurs dans un environnement cérébral de vertébrés hautement manipulable.
Introduction
Les études in vitro des comportements des cellules cancéreuses sont souvent utilisées pour disséquer les mécanismes potentiels qui opèrent pendant le comportement plus complexe observé lors de la formation de tumeurs et de l’invasion cellulaire dans des modèles de xénogreffes in vivo. Par exemple, avec le glioblastome (GBM), des études in vitro ont révélé des mécanismes de la façon dont L1CAM fonctionne potentiellement pendant la formation de tumeurs et l’invasion cérébrale dans un nouveau modèle de tumeur cérébrale de xénogreffe d’embryon de poussin 1,2,3,4,5. Bien que les expériences in vitro et in vivo se complètent de manière utile, elles laissent un vide substantiel dans la façon dont les résultats peuvent être corrélés. Par exemple, les analyses mécanistes de la motilité des cellules GBM sur une boîte sont une situation hautement artificielle, et les modèles de xénogreffes in vivo ne peuvent révéler que des analyses statiques ponctuelles ou finales de la formation tumorale et du comportement cellulaire. Les études in vivo utilisant des rongeurs ou des embryons de poussins ne se prêtent pas facilement à la surveillance du comportement cellulaire alors que les cellules envahissent le tissu cérébral dans ces modèles de xénogreffes. Néanmoins, le modèle de xénogreffe d’embryon de poussin a démontré que la protéine d’adhésion L1CAM joue un rôle stimulant dans la capacité invasive des cellules GBM T98G humaines 2,5.
Une solution appropriée à ce problème peut être trouvée en faisant le pont entre les méthodes in vivo et in vitro à l’aide d’un modèle organotypique de culture de tranches de cerveau, appelé modèle ex vivo . Dans ce modèle ex vivo , le tissu cérébral vivant peut être maintenu à une épaisseur de plusieurs centaines de microns pendant quelques semaines, ce qui permet d’implanter des cellules cancéreuses, d’observer leur comportement dans les tissus réels au fil du temps, puis d’effectuer une analyse plus détaillée des marqueurs à la fin de l’expérience.
Une méthode de culture de tranches organotypiques populaire a consisté à cultiver une tranche de cerveau de plusieurs centaines de microns d’épaisseur sur une membrane poreuse translucide ou transparente, laissant le tissu exposé à l’air, tout en permettant aux milieux nutritifs de soutenir le tissu sous la membrane (voir Stoppini et coll.6). Différentes variantes de cette méthode ont été utilisées pour différentes études, y compris l’utilisation de différents milieux ou de différents inserts membranaires. Les différents inserts membranaires comprennent un insert membranaire poreux (0,4 μm) de diamètre dans une boîte de culture6 de 35 mm et des inserts de culture cellulaire (0,4 μm) pour les plaques6 puits 7. Les différents milieux comprennent 50% MEM/HEPES + 25% de sérum de cheval inactivé par la chaleur + 25% de solution saline équilibrée Hanks (HBSS)8, 50% de milieu sérique réduit + 25% de sérum de cheval + 25% HBSS9, ainsi que d’autres. Si une membrane translucide ou transparente est utilisée avec des cellules GBM marquées par fluorescence, ces cultures peuvent être imagées par le bas à l’aide d’un microscope à fluorescence à grand champ inversé ou confocale 10,11,12,13,14,15.
Alors que de nombreux modèles in vivo de xénogreffe de tumeurs cérébrales orthotopiques et de cultures de tranches cérébrales organotypiques ex vivo ont été établis à l’aide de rongeurs, comme indiqué ci-dessus, l’embryon de poussin (Gallus gallus) a été sous-utilisé à ces fins. Cependant, il a été démontré que l’embryon de poussin peut être utilisé comme modèle de xénogreffe orthotopique in vivo pour l’étude de l’invasion du gliome humain et du rat 1,2,5. Les cellules xénogreffées dans le cerveau d’embryons de poussins ont présenté des schémas d’invasion similaires à ceux observés dans les modèles de rongeurs, ce qui renforce l’utilisation d’embryons de poussins comme modèle in vivo pour l’analyse des cellules tumorales GBM. Les embryons de poussins sont également peu coûteux, peuvent être plus facilement entretenus que les rongeurs (c.-à-d. dans leurs coquilles d’œufs dans un incubateur de laboratoire) et sont beaucoup plus faciles à travailler, ce qui en fait une option attrayante pour les études in vivo à court terme sur le GBM. Un article récent a décrit l’utilisation de cultures de tranches de cerveau d’embryons de poussins pour la formation et la croissance d’axones au cours du développement normal du cerveau où les tranches étaient viables pendant au moins 7 jours16. Cependant, l’utilisation de telles cultures de tranches de cerveau d’embryons de poussins pour l’analyse ex vivo du comportement des cellules GBM dans un environnement tissulaire fait défaut. Dans cet article, la transplantation de cellules GBM humaines et de cellules souches GBM (GSC) dans le cerveau embryonnaire précoce de poussin in vivo, ainsi que l’introduction de cellules GBM sur des cultures de tranches de cerveau d’embryons de poussins vivants ex vivo, sont décrites. Quelques exemples représentatifs des tumeurs résultantes et des modèles d’invasion cellulaire obtenus à partir de ces préparations sont également fournis.
Protocole
Aucune autorisation ou approbation n’était nécessaire à l’Université du Delaware pour effectuer ce travail.
1. Injection de cellules GBM dans le tectum optique des poussins
- Préparation des CGG et des cellules GBM pour injection
- Culture CGC dans les milieux de la CGC (tableau 1). La culture a établi des lignées cellulaires GBM dans des milieux GBM (tableau 1).
- Rincer les cellules sur des plaques avec une solution saline tamponnée au phosphate (PBS) stérile et placer 1 mL de solution de trypsine dans un plat de 10 cm. Laisser dans un incubateur de culture cellulaire pendant 2-3 minutes jusqu’à ce que les cellules commencent à se détacher.
- Inactiver la trypsine en ajoutant 10 mL de milieux de culture appropriés contenant du sérum dans la capsule de 10 cm et détacher les cellules en les pipetant de haut en bas. Placer la suspension cellulaire dans un tube à centrifuger conique de 15 mL.
- Enduire les cellules par centrifugation à 800 × g pendant 5 min à 4 °C.
- Aspirer le fluide de la pastille de cellule à l’aide d’une pipette en verre fin jetable fixée à un ballon à bras latéral et à une pompe à vide. Remettez les cellules en suspension dans un milieu de croissance approprié à une concentration de 10 000 cellules par microlitre et placez-les dans un tube à microfuge ou un petit tube à vis sur de la glace.
- Mélanger les cellules avec une petite quantité de colorant FCF vert rapide stérile à 1 % (utiliser un rapport de 5 μL de colorant/100 μL de suspension cellulaire).
- Injection de cellules GBM dans le tectum optique E5 in ovo. Voir la figure supplémentaire 1.
- Incuber les œufs de poule fécondés dans un incubateur à œufs humidifié, l’extrémité pointue tournée vers le bas, à 37,5 °C (le 1er jour d’incubation est le jour embryonnaire 0 [E0]). Le 6ème jour d’incubation (E5), stérilisez la coquille d’œuf en pulvérisant avec de l’éthanol à 70%.
- À l’aide d’un chandelier à œufs, tracez le long du périmètre de l’espace d’air au-dessus de l’embryon avec un crayon et couvrez la zone délimitée avec du ruban adhésif transparent.
- À l’aide de ciseaux incurvés, coupez doucement autour de la zone tracée, en prenant soin de ne pas couper dans les membranes embryonnaires ou les vaisseaux sanguins, et jetez le haut de la coquille d’œuf.
- Placez quelques gouttes de milieu de culture saline ou cellulaire sur la membrane de l’espace aérien pour la mouiller afin qu’elle se détache facilement. À l’aide de pinces fines, percez soigneusement la membrane de l’espace aérien sur le dessus de l’embryon, retirez-la et localisez la tête de l’embryon de poussin.
- Utilisez une pince fine pour saisir la membrane amnion transparente qui entoure immédiatement l’embryon pour positionner la tête afin que le tectum optique puisse être injecté avec des cellules. D’une main, utilisez la pince fine pour tenir l’amnion afin de maintenir la tête en place pendant le processus d’injection. Veillez à ne pas endommager les vaisseaux sanguins extraembryonnaires de la membrane chorio-allantoïdienne du jaune.
REMARQUE: La procédure ci-dessus nécessite un peu de pratique pour pouvoir saisir efficacement la membrane amnion transparente qui entoure intimement l’embryon, car elle est invisible jusqu’à ce qu’elle soit saisie et tirée. Entraînez-vous à utiliser des pinces fines pour saisir l’amnion clair qui entoure immédiatement l’embryon. - Maintenez la tête stable en saisissant la membrane amnion avec une pince fine. À l’aide d’une micropipette en verre et d’une picopompe pneumatique, injecter environ 50 000 cellules dans 5 μL de milieu de culture cellulaire approprié dans le tectum optique (5 μL représentent environ la moitié d’une micropipette remplie).
REMARQUE : Voir Cretu et coll.1 pour une image d’un embryon E5 qui a été injecté avec des cellules GBM mélangées à un colorant. - Placez quelques gouttes d’ampicilline à 50 mg/mL sur l’embryon.
- Couvrir le trou dans le haut des œufs avec du ruban adhésif transparent et laisser dans l’humidificateur jusqu’à E15 pour la dissection.
2. Dissection de régions cérébrales à partir d’embryons E15
REMARQUE: La dissection des cerveaux E15 ici pour la fixation est similaire à celle décrite à l’étape 8.2 pour les tranches de cerveau vivant, mais la dissection ici ne doit pas être faite dans des conditions aseptiques.
- Coupez le ruban autour du dessus de la coquille, permettant l’accès à l’embryon.
- Décapitater l’embryon au niveau du cou et placer la tête dans une boîte de 10 cm avec une solution stérile de Tyrodes sans calcium et magnésium (CMF Tyrode). Voir la figure supplémentaire 2.
- À l’aide de pinces fines, retirez la peau qui recouvre le cerveau pour révéler la dure-mère sous-jacente. Enlevez les os du crâne en formation sur les côtés gauche et droit du cerveau. Les os du crâne en formation ne couvrent pas encore la majorité du cerveau.
- Utilisez doucement des pinces fines et pointues pour déchirer les méninges recouvrant le centre du cerveau et pelez-les de chaque côté pour découvrir le cerveau.
- Utilisez des pinces incurvées pour prélever le cerveau par le bas et le sortir doucement de sa cavité.
- Disséquer le cerveau en ses parties: cerveau antérieur, tecta, cervelet.
- Retirez la pie-mère sus-jacente du tecta à l’aide de pinces fines. Notez que le pia se sépare facilement du tecta, mais pas du cerveau antérieur ou du cervelet. Retirez le pia du cerveau antérieur en le touchant ou en le roulant sur un petit morceau de papier filtre.
- Placez les régions cérébrales disséquées dans un petit plat.
- Placer les régions du cerveau pour la fixation dans une plaque de 24 puits et fixer dans du paraformaldéhyde (PFA) à 2% dans un tampon de cacodylate de sodium 0,1 M. Laisser agir pendant au moins 24 h à 4 °C.
- Après la fixation, rincer le tissu dans 3x PBS pendant au moins 1 heure avant de l’incorporer dans l’agar-agar.
3. Intégrer et trancher les régions du cerveau récoltées
- Préchauffer une solution de gélose à 3,5 % et de saccharose à 8 % dans du PBS jusqu’à ce qu’elle soit fondue et la maintenir à la température de fusion.
- À l’aide d’une pince incurvée comme cuillère, ramasser doucement le tectum optique ou la région du cerveau antérieur du cerveau de l’embryon de poussin et éponger légèrement sur du papier filtre pour éliminer le liquide supplémentaire afin d’assurer l’adhérence de la gélose à la surface externe du cerveau.
- À l’aide d’une pipette de transfert stérile, remplir le moule avec une solution d’agar.
REMARQUE: Un moule simple peut être fabriqué en formant une feuille d’aluminium autour d’un objet de taille appropriée, tel que de petits blocs de trancheurs de tissu vibrants en métal rectangulaires. - Placez la région du cerveau dans l’agar et laissez la gélose se solidifier complètement.
- Retirez la feuille d’aluminium autour du cerveau incrusté et coupez l’excès de gélose sur les côtés à l’aide d’une lame de rasoir ou d’un scalpel.
- Placez une goutte de colle cyanoacrylate sur le carré en acier inoxydable du plateau de tranchage, placez le bloc d’agarose avec la cervelle sur la colle et laissez la colle se lier pendant 1 min. Placez le plateau dans le mandrin vibrant de la trancheuse à tissus, serrez et remplissez le plateau avec suffisamment de PBS pour couvrir le dessus du bloc de gélose.
- Coupez les tranches de cerveau sur une trancheuse de tissu vibrant à une épaisseur de 350 μm à l’aide d’une lame de rasoir en acier.
- Lorsque les tranches de cerveau sont coupées et flottent librement dans le plateau de tranchage, utilisez une spatule pour ramasser et retirer les tranches du plateau. Faites glisser doucement la section de la spatule et dans une boîte de Petri étiquetée de 10 cm avec du PBS pour que les sections flottent librement.
REMARQUE: La gélose entourant la tranche de cerveau peut se détacher si le cerveau n’est pas suffisamment épongé avec du papier filtre pour éliminer l’excès de liquide avant l’incorporation. Si cela se produit, le tissu cérébral peut être retiré doucement de la gélose solidifiée et réintégré après un bon buvardage de l’excès de liquide.
4. Immunomarquage des tranches de cerveau avec des cellules tumorales
- À l’aide d’un stéréomicroscope équipé d’épifluorescence, cribler les tranches individuelles dans la boîte de 10 cm une par une pour détecter la présence ou l’absence de cellules tumorales.
- Préparer une quantité suffisante de solution saline tamponnée au phosphate avec 0,1 % de Triton X-100 et 5 % de sérum de chèvre normal (PBSTG) (voir le tableau 1) pour l’immunocoloration et rincer les tranches à immunocolorer.
- Puits de demi-remplissage dans une plaque de 24 puits qui sera utilisée pour colorer les sections de cerveau avec du PBS.
- Coupez les coins de gélose autour des tranches de cerveau avec le bord d’une spatule ou d’un scalpel, et placez-les doucement dans les puits contenant du PBS.
- Aspirer le PBS et le remplacer par 350 μL de solution de coloration d’anticorps primaires dans PBSTG (p. ex. 2 μg/mL UJ127 dans PBSTG).
- Incuber pendant 24 h dans une chambre froide en agitant doucement afin que la tranche se déplace librement dans le puits.
- Après 24 h, retirer la solution d’anticorps primaires et rincer 3 x 1 h avec PBSTG dans une chambre froide avec agitation.
- Une fois le rinçage terminé, incuber dans 350 μL/puits de solution de coloration d’anticorps secondaires dans PBSTG (p. ex., dilution de 1/200 de biotine-GAM dans PBSTG). Incuber pendant 20 h dans une chambre froide avec agitation.
REMARQUE : Si vous renoncez à l’étape tertiaire et que vous incubez avec l’anticorps secondaire contenant du fluorochrome à cette étape, couvrez pour protéger de la lumière pendant l’incubation maintenant, puis passez à l’étape 4.11. - Retirer la solution d’anticorps secondaires et rincer 3 x 1 h dans PBSTG en chambre froide avec agitation.
- Retirer le PBSTG et incuber dans la solution tertiaire (par exemple, dilution 1:250 de la streptavidine Alexa Fluor 647 dans PBSTG). Si désiré, colorer les noyaux à cette étape en ajoutant 0,1 μg/mL de bisbenzimide au mélange. Incuber pendant 20 h dans une chambre froide avec agitation.
- Retirer la solution tertiaire et rincer 3 x 1 h dans PBSTG en chambre froide avec agitation.
- Laisser dans PBS jusqu’à ce que vous soyez prêt à monter sur des lames de microscope.
5. Montage de tranches sur des lames de microscope
- Préparez autant de lames de microscope qu’il y a de sections à monter.
- Pour chaque diapositive, placez une bande de vinyle électrique de 50 mm de longueur de 10 mil (254 μm) d’épaisseur sur un morceau de parafilm.
- À l’aide d’un perforateur carré de 1 cm x 1 cm, percez un trou au centre de la bande électrique et du parafilm.
- Retirez le ruban du parafilm et placez-le sur la lame du microscope, en laissant de la place pour l’étiquetage du ruban adhésif sur la lame.
- À l’aide d’une micropipette, placez une ou deux gouttes de support de montage anti-décoloration dans le trou carré au centre de la bande électrique.
- Utilisez une spatule incurvée pour soulever la section de trancheuse de tissu vibrant souhaitée du PBSTG et évacuez soigneusement l’humidité avec une lingette de laboratoire propre ou un morceau de papier filtre.
- Touchez le bord de la tranche à la goutte de support et utilisez une autre spatule pour faire glisser doucement la section dans le support de montage.
- Couvrez la section avec quelques gouttes supplémentaires de support et placez soigneusement une glissière de couverture de 24 mm x 30 mm (#1,5 d’épaisseur) sur le dessus de la section et du support.
- Scellez les bords de la lamelle de couverture avec du vernis à ongles pour le maintenir en place.
6. Microscopie confocale de tranches de cerveau fixes
- Utilisez la fluorescence à grand champ pour trouver des tumeurs fluorescentes dans la tranche de cerveau montée à l’aide de la lentille d’objectif et du ou des ensembles de filtres appropriés.
REMARQUE: Certaines tumeurs peuvent être assez grandes et sont facilement visibles avec l’objectif 4x, tandis que les cellules individuelles peuvent nécessiter l’objectif 10x. - Passez à la microscopie confocale à l’aide d’une lentille d’objectif, d’un ou de plusieurs lasers, d’une taille de sténopé et de paramètres de détecteur appropriés. Pour suivre ce protocole, utilisez un objectif 20x (ouverture numérique [N.A.] = 0,75) pour l’imagerie de routine et un objectif d’huile 60x (N.A. = 1,40) pour l’imagerie haute résolution.
- Définissez les limites supérieure et inférieure de l’axe z et de la taille du pas (pour la situation spécifique selon les instructions du fabricant du microscope confocal) pour l’acquisition de sections optiques. Acquérir une pile z de sections optiques.
- Utilisez le logiciel de microscope confocal pour créer un rendu de volume 3D de la tumeur, selon les instructions du fabricant.
7. Préparation sphéroïde
- Création de plaques de poly(méthacrylate de 2-hydroxyéthyle) (poly-HEMA)
- Créer une solution de poly-HEMA à 10 μg/mL dans de l’éthanol à 95 % et enrober des boîtes de Petri de 35 mm (ou boîtes de culture cellulaire) avec 1 mL de cette solution.
- Laissez les plats reposer sur une bascule découverte pendant la nuit à température ambiante pour développer un revêtement de la surface du plat.
REMARQUE: Le solvant s’évaporera et laissera un revêtement translucide sur la capsule, ce qui peut sembler inégal, mais cela n’affectera pas la capacité de fabriquer des sphéroïdes cellulaires. - Après séchage, stériliser les plats ouverts sous lumière UV dans une enceinte de biosécurité pendant 1 h. Replacez les couvercles après la stérilisation. Les plats enrobés sont maintenant prêts à l’emploi.
- Coloration fluorescente DiD pour microscopie time-lapse
REMARQUE: Cette section concerne la coloration de cellules individuelles avec un colorant fluorescent DiD à utiliser pour fabriquer des sphéroïdes, ce qui optimise la visualisation de la motilité cellulaire pour l’imagerie en accéléré en direct.- Suspendre les cellules dans un milieu de culture sans sérum.
- Ajouter 5 μL de DiD stock/mL de suspension cellulaire et mélanger doucement par pipetage. Incuber 20 min à 37 °C.
- Centrifuger la suspension cellulaire marquée à 800 × g à 5 °C pendant 5 min.
- Aspirer le surnageant et remettre les cellules en suspension dans un milieu chaud pour les rincer.
- Répétez cette centrifugation et rincez l’étape deux fois de plus.
REMARQUE: Si vous le souhaitez, passez à l’étape 7.3.6 pour créer des sphéroïdes immédiatement après ce processus.
- Fabrication de sphéroïdes cellulaires
- Réchauffer la solution de trypsine/acide éthylènediaminetétraacétique (EDTA) à 0,25 % à 37 °C.
- CGV de culture dans les milieux17 de la CGC (tableau 1) et les cellules de gloima maligne (MG) U-118 dans le milieu de culture U-118 (voir tableau 1). Utilisez une capsule confluente de 10 cm pour la préparation d’une assiette de sphéroïdes de 35 mm. Ajouter les facteurs de croissance du FGFb (concentration finale de 10 ng/mL) et du TGF-α (concentration finale de 20 ng/mL) aux CGS dans un premier temps, puis tous les 3 jours.
REMARQUE : Les cellules utilisées dans la présente étude étaient le vert GSC15-2/K72, le vert GSC16-4/K72, le rouge U-118/L1LE/mCherry2x et le rouge U-118/1879/mCherry2x. Une plaque de sphéroïdes devrait suffire pour deux plaques de 6 puits de tranches de cerveau sur des inserts membranaires. - Rincer les cellules sur les plaques avec du PBS stérile et placer 1 ml de solution de trypsine sur une boîte de 10 cm. Placer dans l’incubateur de culture cellulaire pendant 2-3 minutes jusqu’à ce que les cellules commencent à se détacher.
- Inactiver la trypsine en ajoutant 10 mL de milieux de culture appropriés contenant du sérum dans la capsule de 10 cm et détacher les cellules en les pipetant de haut en bas. Placer la suspension cellulaire dans un tube à centrifuger conique de 15 mL.
- Enduire les cellules par centrifugation à 800 × g pendant 5 min à 4 °C.
- Aspirer le média de la pastille cellulaire et remettre les cellules en suspension dans 10 ml de média.
- Placer 2 mL de suspension cellulaire sur chaque boîte de 35 mm revêtue de poly-HEMA et ajouter 2 mL supplémentaires de milieu approprié pour obtenir 4 mL de média total par boîte. Si vous utilisez des CGV, ajoutez des facteurs de croissance.
- Incuber les cellules dans un incubateur cellulaire jusqu’à ce que les agrégats atteignent une taille de 100-200 μm, ce qui pourrait être 1-2 jours selon la densité des cellules qui ont été plaquées.
8. Dissection cérébrale d’embryons de poussins vivants et tranches de tissus vibrants
- Préparation à la dissection
- Préparez une plaque d’insertion à membrane en polyester à 6 puits avec 1 mL de milieu de culture de tranches de cerveau (voir le tableau 1) sous l’insert à membrane.
- Stérilisez la zone de travail et les outils avec de l’éthanol à 70 %.
- Placez la plaque d’insertion à 6 puits sur de la glace pendant la dissection.
- Préparer 100 mL de trancheuse à tissulaire vibrant (tableau 1) et déposer sur de la glace.
- Placer un flacon d’agarose à bas point de fusion à 4 % dans du PBS au bain-marie jusqu’à ce qu’il fonde en liquide (environ 50 °C).
- Remplissez la cuve vibrante de la trancheuse à mouchoirs avec de la glace.
- Dissection cérébrale d’embryon de poussin E14/15 aseptique
- À l’aide d’un chandelier à œufs, tracez le long du périmètre de la poche d’air au-dessus de l’embryon E14 ou E15 avec un crayon et couvrez la zone délimitée avec du ruban adhésif transparent.
- À l’aide de ciseaux incurvés ou fins, coupez doucement autour de la zone tracée, en veillant à ne pas couper dans la membrane embryonnaire ou les vaisseaux sanguins, et jetez le morceau supérieur de la coquille.
- À l’aide d’une pince incurvée, retirez la membrane de l’espace aérien sur le dessus de l’embryon et localisez la tête de l’embryon de poussin.
- Décapitater l’embryon et placer la tête dans une boîte de 10 cm avec une solution froide stérile de FMC. Voir la figure supplémentaire 2.
- À l’aide de pinces fines stériles, retirez la peau qui recouvre le cerveau pour révéler la dure-mère sous-jacente. Enlevez les os du crâne en formation sur les côtés gauche et droit du cerveau. Les os du crâne en formation ne couvrent pas encore la majorité du cerveau.
- Utilisez doucement des pinces fines pointues (#5 ou #55) pour déchirer les méninges recouvrant le centre du cerveau et pelez-les de chaque côté pour découvrir le cerveau.
- À l’aide de fines pinces incurvées, ramassez le cerveau par le bas vers le haut et retirez-le doucement de sa cavité.
- Disséquer le cerveau en ses trois parties principales: cerveau antérieur, mésencéphale (tecta optique), cervelet. Consultez un atlas du développement des poussins, au besoin.
- Retirez la pie-mère sus-jacente du tecta à l’aide de pinces fines.
REMARQUE: Le pia se sépare facilement du tecta, mais pas du cerveau antérieur ou du cervelet. Le pia peut être retiré du cerveau antérieur en le touchant ou en le roulant sur de la gaze stérile. - Placez les régions cérébrales disséquées dans une petite boîte stérile sur de la glace.
- Intégrer et trancher le cerveau
- À l’aide d’une pince incurvée comme cuillère, prenez doucement le tectum optique ou la région du cerveau antérieur et épongez légèrement sur de la gaze stérile pour éliminer le liquide supplémentaire afin d’assurer l’adhérence de l’agarose à la surface externe du cerveau.
- À l’aide d’une pipette de transfert stérile, remplir le moule d’agarose à bas point de fusion. Préparez un moule simple en formant une feuille d’aluminium autour d’un objet de taille appropriée. Le petit bloc de trancheur de tissu vibrant métallique rectangulaire est couramment utilisé comme objet. Voir la figure supplémentaire 3.
- Placez rapidement la région du cerveau dans l’agarose et laissez-la se solidifier (environ 4-5 minutes) sur la glace.
REMARQUE: Le cerveau peut couler au fond du moule avant que l’agarose ne durcisse. Si cela se produit, attendez 1 minute pour laisser la gélose commencer à prendre, puis placez la région du cerveau dans l’agarose. Essayez de suspendre la région du cerveau directement au milieu de l’agarose. - Retirez la feuille d’aluminium autour du cerveau incrusté dans l’agarose solidifiée et coupez l’excès d’agarose sur les côtés à l’aide d’une lame de rasoir ou d’un scalpel stérile.
- Placez une goutte de colle cyanoacrylate sur le carré en acier inoxydable du plat/plateau à trancher, placez le bloc d’agarose avec le cerveau et laissez la colle se lier pendant 1 min. Placez le plat ou le plateau dans le mandrin vibrant de la trancheuse à mouchoirs, serrez et remplissez le plateau avec un fluide de tranchage pour couvrir le dessus du bloc d’agarose.
- Coupez les sections d’une trancheuse à papier vibrant à 250-350 μm à l’aide d’un couteau en saphir, ce qui entraînerait moins de dommages aux tissus vivants qu’une lame de rasoir en acier.
- Lorsque les tranches de cerveau sont coupées et flottent librement dans le plateau de tranchage, utilisez une spatule stérile pour ramasser et retirer la tranche du plateau. Faites glisser doucement la section hors de la spatule et sur un insert à membrane à l’aide d’une autre spatule stérile.
REMARQUE: Normalement, deux ou trois tranches de cerveau peuvent être placées sur chaque insert de membrane, si désiré. L’agarose entourant la tranche de cerveau peut se détacher si le cerveau n’est pas suffisamment épongé avec de la gaze stérile pour éliminer l’excès de liquide. Si cela se produit encore après un buvard suffisant avant l’encastrement, ramassez doucement la tranche sans l’agarose environnante et faites-la glisser sur l’insert à membrane. - Placer la plaque à 6 puits de tranches de cerveau sur des inserts membranaires dans l’incubateur de culture cellulaire à 37 °C et 5% de CO2.
- Le lendemain du placage, utilisez une pipette Pasteur stérile pour aspirer le média sous l’insert (il y a des espaces sur les côtés des inserts pour permettre à une pipette d’accéder au média en dessous). Ajouter 1 mL de fluide en tranches fraîches à chaque puits sous l’insert à membrane. Continuez à changer de média tous les deux jours par la suite.
- Attendez quelques jours que les tranches de cerveau se fixent fermement aux inserts membranaires et semblent s’aplatir quelque peu. C’est un signe que les tranches sont viables et prêtes pour l’introduction des cellules GBM.
9. Introduction de cellules GBM sur des tranches de cerveau
- Méthode sphéroïde
- Une fois que les sphéroïdes cellulaires ont atteint une taille de 150 à 200 μm, utilisez une micropipette de 20 μL réglée à 5 μL pour retirer un à plusieurs sphéroïdes de leur boîte de culture. Voir la figure supplémentaire 3.
- Expulser doucement le média avec des sphéroïdes sur la tranche de cerveau désirée.
REMARQUE: Les sphéroïdes cellulaires doivent être visibles dans l’embout de la pipette. L’utilisation d’une pointe de pipette transparente les rendra plus faciles à voir dans la pointe. Si le sphéroïde tombe de la tranche de cerveau lorsque le liquide est libéré, un cil stérilisé à l’éthanol collé à un mince bâtonnet d’applicateur en bois doit être utilisé pour pousser doucement le sphéroïde sur la tranche de cerveau. - Laissez les sphéroïdes se cultiver sur les tranches de cerveau pendant 2 à 5 jours.
REMARQUE: La limitation ici semble être la dégradation éventuelle des vaisseaux sanguins et des cellules cérébrales dans la tranche. Les vaisseaux sanguins dégradés apparaîtront sous forme de boules discontinues dans la tranche lorsqu’ils seront colorés pour la laminine.
- Méthode de biopsie
- Laissez les tranches de cerveau se fixer en semblant s’aplatir sur l’insert membranaire (peut prendre de 2 à 5 jours en culture).
- Décongeler la matrice cellulaire sur la glace.
- Dans l’enceinte de biosécurité de culture cellulaire, connectez un poinçon de biopsie stérile de 1 mm de diamètre à un tube d’aspiration sous vide.
- Touchez doucement la tranche de cerveau avec le poinçon de biopsie pour créer un trou de 1 mm au centre de la tranche de cerveau.
REMARQUE: Le tissu dans le poinçon de biopsie sera aspiré dans le poinçon par le vide. - Préparer une suspension de matrice cellulaire en trypsinisant une boîte confluente de cellules de 10 cm à 60 % à 70 % et en la remettant en suspension dans 10 ml de milieu; Ensuite, mélangez 1 mL de cette suspension avec 100 μL de matrice.
- À l’aide d’une micropipette de 20 μL, placer 1 μL du mélange de matrice cellulaire dans chaque trou des tranches de cerveau.
- Une fois le placement du mélange cellulaire terminé, replacez le plat de tranches de cerveau avec des cellules intégrées dans l’incubateur et permettez à la matrice de se solidifier et aux cellules d’envahir potentiellement la tranche de cerveau environnante.
10. Microscopie accélérée à fluorescence à grand champ
- Placez du ruban amovible autour du bord de la plaque à 6 puits pour empêcher l’évaporation du média, en laissant un petit espace d’un côté pour l’échange gazeux.
- Placez les plaques dans une chambre de culture personnalisée sur une platine automatisée réglable sur un microscope à épifluorescence inversée.
NOTE: La chambre a été maintenue à des conditions atmosphériques de 5% de CO2 et 95% d’air à l’aide d’un contrôleur d’injection de gaz, et la température a été maintenue à 37 ° C avec un régulateur de température de l’air chaud et un insert de platine à température contrôlée. Voir Fotos et coll.18 pour plus de détails sur le système utilisé ici. - À l’aide d’un logiciel de contrôle de microscope approprié, créez un programme d’acquisition en accéléré qui recueille des images fluorescentes des zones d’intérêt une fois toutes les 10 minutes pendant 20 h.
REMARQUE : Si une étiquette fluorescente verte est utilisée dans les cellules (p. ex., protéine fluorescente verte [GFP]), utilisez la quantité minimale de lumière d’excitation bleue requise pour visualiser les cellules afin de prévenir la phototoxicité. Les étiquettes rouges (par exemple, mCherry) et rouges lointaines (par exemple, DiD) ne semblent pas avoir ce problème potentiel en raison de l’excitation de longueur d’onde plus longue.
11. Immunomarquage des tranches de cerveau après microscopie accélérée
REMARQUE: Ce protocole d’immunomarquage est optimisé pour colorer les vaisseaux sanguins avec de la laminine et les noyaux avec du bisbenzimide. Utilisez des anticorps appropriés pour la ou les molécules d’intérêt souhaitées.
- Aspirer le média sous l’insert membranaire à l’aide d’une pipette Pasteur et placer 1 mL de PFA à 2 % dans un tampon de cacodylate de sodium 0,1 M sous l’insert et 1 mL sur le dessus de l’insert pour couvrir la tranche de cerveau. Laisser les tranches fixer pendant la nuit à 4 °C.
- Retirez le fixateur sous l’insert membranaire et tout fixateur restant sur la tranche de cerveau (le fixateur a tendance à fuir à travers l’insert membranaire dans le puits inférieur).
- Retirez l’insert avec les tranches du puits de 35 mm et placez-les dans un plat en plastique plus grand.
- Préparez une assiette de 24 puits en ajoutant 350 μL de PBS dans autant de puits qu’il y a de tranches de cerveau (une tranche / puits lors de l’immunomarquage).
- À l’aide d’une fine spatule, retirez doucement l’agarose autour de la tranche de cerveau sans détacher la tranche de cerveau de l’insert membranaire. Assurez-vous que l’agarose se détache facilement du bord extérieur de la tranche de cerveau. Sinon, laissez l’agarose attachée à la tranche de cerveau.
- À l’aide d’un scalpel tranchant, couper à travers la membrane autour de la tranche de cerveau jusqu’à ce que la tranche avec la membrane sous-jacente soit libre du reste de l’insert. Ramassez la membrane avec la tranche de cerveau attachée, en utilisant une pince fine pour saisir la membrane, et placez-la dans un puits de la plaque de 24 puits dans PBS.
- Rincer les tranches 3x avec du PBS pendant 1 h dans la chambre froide avec une agitation douce constante ou un balancement, de sorte que la tranche se déplace dans le puits.
- Pendant le rinçage, préparez la solution d’anticorps primaire.
- Diluer l’antilaminine à 2 μg/mL dans PBSTG (voir tableau 1).
- Retirer le PBS des puits et incuber pendant la nuit dans une solution d’anticorps primaires dans une chambre froide avec une agitation douce.
- Après au moins 20 h d’incubation, aspirer la solution d’anticorps primaires et rincer les sections 3x pendant 1 h dans PBSTG.
- Pendant le rinçage, préparer la solution d’anticorps secondaire.
- Diluer le fluorescent-GAM avec le fluorochrome spécifique nécessaire à une dilution de 1:200 dans PBSTG avec une concentration de bisbenzimide de 0,1 μg/mL.
- Retirer le PBSTG et incuber pendant une nuit dans une chambre froide en agitant dans la solution d’anticorps secondaires fluorescents.
- Retirer l’anticorps secondaire et rincer 2x sur 1 h dans PBSTG et 1x sur 1 h dans PBS.
- Laisser dans PBS jusqu’à ce que vous soyez prêt à monter sur des lames de microscope (section 5) et visualiser.
Résultats
Les figures présentées ici montrent certains résultats représentatifs obtenus en effectuant des injections in vivo dans le tectum optique (Figure 1 et Figure 2), en cultivant des tranches de cerveau vivantes et en évaluant leur viabilité (Figure 3), en créant des cultures ex vivo de tranches cérébrales et en implantant des cellules marquées par fluorescence à l’aide de la méthode du poinçon de biopsie (Figure 4), en générant des sphéroïdes cellulaires en cultivant des cellules sur poly-HEMA (Figure 5 ), créant des co-cultures ex vivo de tranches cérébrales avec des sphéroïdes cellulaires et enregistrant le comportement cellulaire invasif à l’aide de la microscopie confocale time-lapse 4D (Figure 6), et analysant le comportement cellulaire invasif des sphéroïdes par rapport aux vaisseaux sanguins dans des préparations de tranches cérébrales fixes (Figure 7 et Figure 8). Ces résultats ne sont en aucun cas exhaustifs, mais fournissent plutôt de bons exemples de ce qui peut être obtenu en utilisant le cerveau d’embryon de poussin comme modèle de xénogreffe pour la recherche sur le GBM humain.
La figure 1 montre quelques résultats représentatifs des tumeurs qui se sont formées dans le tectum optique in vivo après l’injection de GSC exprimant la GFP. Les GSC se fixent à la surface ventriculaire et forment des tumeurs invasives dans la paroi cérébrale. Les CGC résident clairement près des vaisseaux sanguins et semblent migrer le long de ceux-ci. Des films de rendus de volume 3D rotatifs de tranches fixes et immunocolorées de tumeurs GSC in vivo sont donnés dans la vidéo supplémentaire S1, la vidéo supplémentaire S2, la vidéo supplémentaire S3 et la vidéo supplémentaire S4. Dans cette expérience, quatre couleurs ont été utilisées pour identifier cinq caractéristiques (GSC verts, noyaux blancs, vaisseaux sanguins blancs, intégrine alpha-6 bleue et Sox2 rouge ou nestine rouge).
La figure 2 montre quelques résultats représentatifs de tumeurs qui se sont formées dans le tectum optique in vivo après l’injection de GSC exprimant la GFP mélangée à des cellules U-118/L1LE2 exprimant mCherry en raison de la transduction vectorielle rétrovirale. Ces expériences ont révélé que lorsque ces tumeurs se formaient à partir d’une suspension de cellules mixtes, le tri se produisait de telle sorte que les GSC résidaient soit à la périphérie, soit au centre, tandis que les cellules U-118 comprenaient soit un noyau interne, soit un cortex externe, selon la lignée spécifique de GSC.
La figure 3 montre les résultats de viabilité des cultures ex vivo de tranches de cerveau. Après 1 semaine en culture, la fixation et l’immunocoloration de la laminine ont révélé de nombreux vaisseaux sanguins intacts et l’expression de Sox2, qui ont tous deux été utilisés ici pour démontrer la viabilité de la tranche de cerveau. Cela a montré que les tranches de cerveau d’embryon de poussin pouvaient être cultivées sur des inserts membranaires pendant environ 2 semaines et rester viables avec des vaisseaux sanguins d’apparence normale et l’expression du facteur de transcription.
La figure 4 montre les résultats de l’introduction de « bouchons » de cellules rouges U-118/L1LE/mCherry (mélangées à la matrice) dans des tranches de cerveau ex vivo après avoir créé des cavités dans les tranches à l’aide de la méthode du poinçon de biopsie. Les cellules U-118 ont clairement envahi le tissu cérébral, parfois en grande échelle et souvent le long des vaisseaux sanguins. Cependant, l’invasion cellulaire n’était pas uniforme autour de la circonférence des cellules introduites. Les vaisseaux sanguins semblaient parfois endommagés ou absents dans certaines tranches, probablement en raison du traumatisme supplémentaire de la méthode de poinçonnage ou de la durée de la culture. Cela a montré que la méthode du poinçon de biopsie / bouchon cellulaire pouvait être utilisée pour introduire des cellules GBM dans des endroits spécifiques dans une tranche de cerveau ex vivo en culture, après quoi les cellules envahissent la tranche de cerveau.
La figure 5 montre des sphéroïdes vivants en culture et plusieurs exemples de fluorescence à grand champ de sphéroïdes de cellules GBM vivantes introduits sur des tranches de cerveau ex vivo pour des expériences accélérées . Des films d’invasion cellulaire des sphéroïdes dans la tranche de cerveau sont donnés dans la vidéo supplémentaire S5 et la vidéo supplémentaire S6. Cela a montré que les sphéroïdes cellulaires sont une autre méthode efficace d’introduction de cellules GBM ou GSC sur des emplacements spécifiques d’une tranche de cerveau ex vivo , et le comportement des cellules invasives peut être surveillé par microscopie à fluorescence à grand champ, bien que la résolution des cellules individuelles puisse être médiocre.
La figure 6 montre des images statiques d’expériences confocales en accéléré d’invasion de cellules de GSC16-4/GFP et U-118/L1LE/mCherry vivantes dans des tranches de cerveau. Des images confocales z-stack ont été acquises toutes les 10 minutes sur une période de 20 heures dans une expérience time-lapse en plusieurs points. Des films d’invasion cellulaire des sphéroïdes en tranches de cerveau prises comme piles z confocales au fil du temps sont présentés dans la vidéo supplémentaire S7, la vidéo supplémentaire S8, la vidéo supplémentaire S9, la vidéo supplémentaire S10 et la vidéo supplémentaire S11. Cette expérience a révélé que l’imagerie confocale time-lapse était supérieure à la fluorescence à grand champ pour suivre le comportement invasif des cellules individuelles. Les cellules U-118/L1LE étaient sensiblement plus invasives que les CGG dans ces conditions. Cela est même évident dans les images statiques, les CGC étant situées plus au centre et les cellules U-118 étant plus dispersées.
La figure 7 montre plusieurs exemples de préparations ex vivo de tranches cérébrales/sphéroïdes, où deux sphéroïdes différents marqués séparément (sphéroïdes U-118/L1LE/mCherry et sphéroïdes GSC16-4/GFP) ont été placés sur des tranches de cerveau, cultivées pendant plusieurs jours, puis fixées, immunocolorées pour la laminine et imagées par coupe optique au microscope confocal. Cela a révélé que les deux types de cellules ont envahi la tranche de cerveau et ont voyagé le long des vaisseaux sanguins. Lorsque les différents types de sphéroïdes étaient suffisamment proches pour entrer en contact les uns avec les autres, il semblait y avoir peu, voire aucune, invasion d’un type de cellule dans le sphéroïde de l’autre type de cellule, et les sphéroïdes restaient séparés.
La figure 8 montre plusieurs exemples de préparations ex vivo de tranches de cerveau/sphéroïdes où des sphéroïdes de « type à cellules mixtes » générés en culture à l’aide de deux types de cellules marquées différemment (U-118/L1LE/mCherry mélangé avec GSC16-4/GFP) ont été placés sur des tranches de cerveau, cultivées pendant plusieurs jours, puis fixées, immunocolorées pour la laminine et imagées par coupe optique au microscope confocal. Cela a révélé que les cellules rouges U-118 / L1LE / mCherry ont migré hors des sphéroïdes et se sont dispersées beaucoup plus clairement que les cellules vertes GSC16-4 / GFP, qui avaient tendance à rester en touffes près du centre des sphéroïdes. De plus, les cellules U-118/L1LE/mCherry ont également été colorées avec du DiD afin que les deux étiquettes distinctes (mCherry et DiD) puissent être comparées directement dans les préparations ex vivo fixes. L’étiquette DiD pouvait toujours être détectée, même dans des cellules individuelles qui avaient envahi la tranche de cerveau; Cependant, c’était comme puncta intracellulaire.
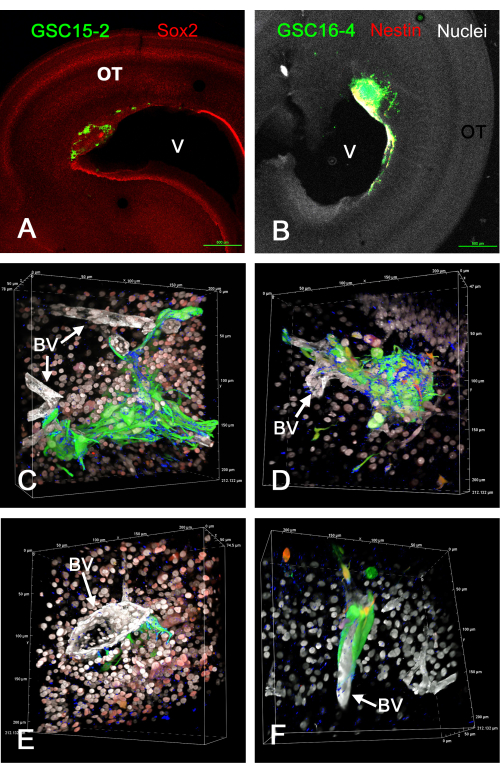
Figure 1 : Tumeurs à E15 résultant de l’injection de CGS dans le tectum optique E5 in vivo. Les CGC sont vertes en raison de l’expression de GFP. Les cellules GSC15-2 sont présentées dans les panneaux A, C et E, et les cellules GSC16-4 sont présentées dans les panneaux B, D et F. (A) Vue à faible grossissement du tectum optique avec une tumeur près du ventricule (V). La coloration Sox2 est représentée en rouge, ce qui colore la plupart des noyaux des cellules OT. (B) Image similaire à A mais avec des cellules GSC16-4 qui sont également colorées pour la nestine en rouge, qui peut apparaître jaune ou blanc dans l’image en raison du mélange des couleurs et de l’exposition de l’image. Les noyaux OT apparaissent blancs en raison de la contre-coloration avec le bisbenzimide. (C-F) Différentes perspectives de rendus de volume générés à partir de z-stacks à l’aide d’un objectif d’immersion dans l’huile 60x. Les noyaux cellulaires apparaissent blancs en raison de la coloration au bisbenzimide, et certains apparaissent en rouge dans les panneaux C et E en raison de l’immunomarquage pour Sox2. La coloration rouge dans les panneaux D et F provient de la coloration pour la nidine. Notez qu’en raison du « mélange alpha » pour les rendus de volume dans le logiciel de microscope confocal, les couleurs ne se mélangent pas comme elles le feraient avec une projection d’intensité maximale, et la couleur la plus répandue prédomine et obscurcit la couleur moins intense. Les vaisseaux sanguins sont colorés en blanc en raison de l’immunocoloration de la laminine. La coloration de l’intégrine alpha-6 du marqueur GSC est représentée en bleu et apparaît ponctuée sur les surfaces GSC. Les échelles de microns sont affichées le long des bords des rendus de volume. Les vidéos des rotations des rendus de volume dans les panneaux C à F sont présentées dans la vidéo supplémentaire S1, la vidéo supplémentaire S2, la vidéo supplémentaire S3 et la vidéo supplémentaire S4. Barres d’échelle = 500 μm (A,B). Abréviations : CGS = cellules souches de glioblastome; OT = tectum optique; GFP = protéine fluorescente verte; BV = vaisseau sanguin. Veuillez cliquer ici pour voir une version agrandie de cette figure.
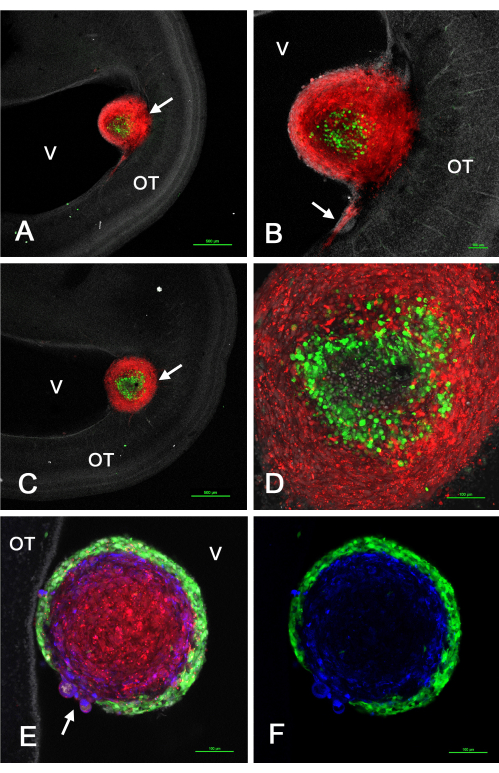
Figure 2 : Tumeurs à E15 résultant d’un mélange de cellules CGC et de cellules GBM U-118 injectées dans le tectum optique E5. Les GSC sont vertes en raison de l’expression de GFP et les cellules U-118/L1LE sont rouges en raison de l’expression de mCherry. GSC15-2 sont présentés dans les panneaux A à D, et GSC16-4 sont présentés dans les panneaux E et F. (A) Plan z confocale unique à faible grossissement d’une tumeur à cellules mixtes (flèche) près du ventricule. Les noyaux sont contre-colorés en blanc avec du bisbenzimide. (B) Grossissement plus élevé (objectif 10x) de la tumeur montrée dans A avec invasion de cellules U-118 rouges dans l’OT près de la surface ventriculaire. (C) Un plan de coupe optique légèrement différent de celui de A montrant la tumeur (flèche) enfoncée plus profondément dans la paroi de l’OT. (D) Projection maximale (objectif 20x) de plusieurs plans z de la tumeur en C montrant les détails des cellules triées dans la tumeur. (E) Image unique du plan z (objectif 20x) d’une tumeur mixte avec des cellules GSC16-4, montrant que le tri dans la tumeur s’est produit selon un schéma opposé à celui des cellules GSC15-2, les GSC verts créant un cortex mince et uniforme entourant les cellules U-118 rouges. La zone de fixation de la tumeur à la paroi de l’OT n’est pas représentée dans ce plan z. Notez la zone de la tumeur où il y a une discontinuité du cortex GSC avec des cellules U-118 / L1LE bombées à travers (flèche). L’immunomarquage pour L1CAM est représenté en bleu. (F) Même image que dans E, mais montrant uniquement les CGV vertes et la coloration bleue L1CAM. Barres d’échelle = 500 μm (A,C), 100 μm (B,D,E,F). Abréviations : CGS = cellules souches de glioblastome; OT = tectum optique; GFP = protéine fluorescente verte; V = ventricule. Veuillez cliquer ici pour voir une version agrandie de cette figure.
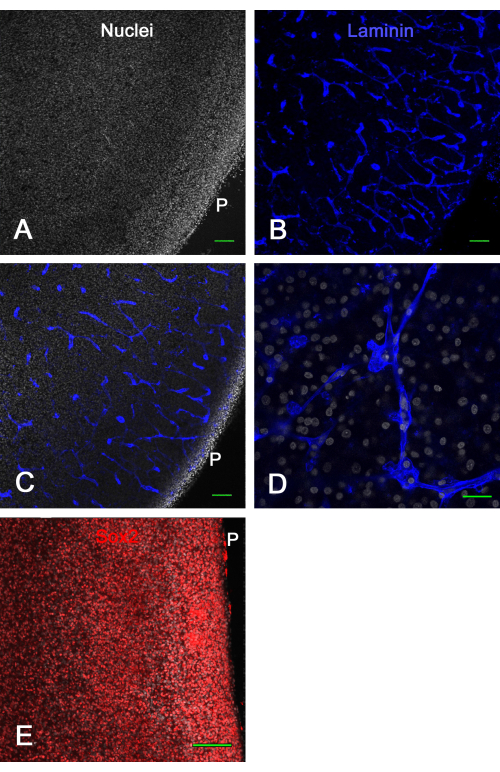
Figure 3 : Viabilité des tranches de tectum optique ex vivo après 1 semaine en culture. Les tranches de tectum optique E14 ont été cultivées sur des inserts membranaires pendant 1 semaine, puis fixées et immunocolorées. Les images confocales (objectif 10x) d’une tranche de cerveau colorée pour les noyaux avec du bisbenzimide (A) et immunocolorée pour la laminine (B) montrent clairement des vaisseaux sanguins normaux et intacts optiquement sectionnés dans diverses configurations en vertu de la coloration à la laminine. (C) Une image confocale similaire à celle montrée dans les panneaux A et B où les noyaux et la coloration à la laminine sont tous deux visibles. (D) Une image confocale à grossissement plus élevé (objectif de pétrole 60x) montrant les détails de la coloration nucléaire et de la laminine. (E) Image de projection maximale de la pile z confocale (objectif 20x) de la tranche de cerveau colorée pour le facteur de transcription Sox2 en rouge et les noyaux totaux avec bisbenzimide en blanc. Notez que la majorité des noyaux présentent une coloration Sox2, comme le montre in vivo (voir Figure 1). Barres d’échelle = 100 μm (A,B,C,E), 25 μm (D). Abréviation : P = surface piale. Veuillez cliquer ici pour voir une version agrandie de cette figure.
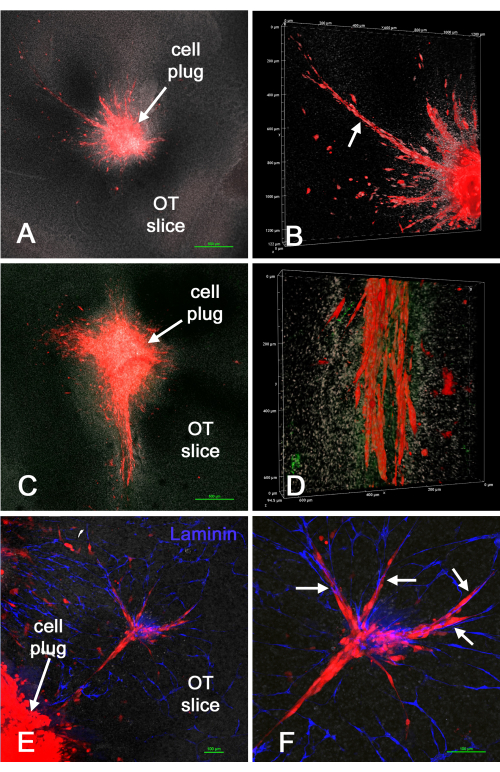
Figure 4 : Cellules U-118/mCherry placées dans une tranche de cerveau ex vivo par la méthode du poinçon de biopsie. Des cavités ont été créées dans des tranches de cerveau à l’aide d’un coup de biopsie de 1 mm, puis des cellules rouges U-118 / L1LE / mCherry mélangées à une matrice ont été implantées comme un « bouchon ». Après plusieurs jours, les tranches de cerveau ont été fixées, immunocolorées pour la laminine et montées sur des lames pour l’analyse au microscope confocal. Les panneaux A et C montrent des images à faible grossissement, confocales, d’un seul plan z (objectif 4x) de la « tumeur » résultante et des cellules environnantes qui ont envahi la tranche de cerveau. (B) Un rendu volumique d’une pile z de la préparation du panneau A à un grossissement plus élevé (objectif 20x), montrant une invasion étendue de cellules U-118 (flèche). (D) L’image montre un rendu volumique similaire de la partie inférieure des cellules largement envahissantes montrées dans le panneau C. La coloration à la laminine est indiquée en vert, mais aucun vaisseau sanguin clair n’est apparent. (E) L’image montre une partie d’un bouchon cellulaire et un groupe de cellules qui ont envahi la tranche de cerveau, ainsi que la coloration de laminine pour les vaisseaux sanguins en bleu. (F) Un grossissement plus élevé des cellules envahissantes montrées dans le panneau E, et les cellules peuvent clairement être vues alignées le long des vaisseaux sanguins (flèches). Tous les panneaux montrent une contre-coloration nucléaire blanche avec du bisbenzimide. Barres d’échelle = 500 μm (A,C), 100 μm (E,F). L’échelle des panneaux B et D se situe le long des axes de rendu du volume. Abréviation : OT = tectum optique. Veuillez cliquer ici pour voir une version agrandie de cette figure.

Figure 5 : Sphéroïdes de cellules vivantes en culture et images de fluorescence à grand champ de cellules GBM vivantes dans des tranches de cerveau ex vivo. Les panneaux A et B montrent des images à contraste de phase (utilisant un objectif 10x sur un microscope inversé) de cellules GBM U-118/L1LE (A) et de GSC (B) se développant sous forme de sphéroïdes (flèches). L’arrière-plan du panneau A montre l’inégalité floue du revêtement poly-HEMA qui peut se produire sur la boîte de culture cellulaire. Les panneaux C à F montrent des images de fluorescence à grand champ de sphéroïdes de cellules U-118/L1LE et de cellules envahissantes (flèches) au cours d’une expérience accélérée pour surveiller le comportement en direct de l’invasion dans les tranches ex vivo (en utilisant un objectif 20x sur un système de microscope time-lapsepersonnalisé 18). Dans les panneaux C et E, les cellules sont colorées avec le colorant à membrane fluorescente rouge lointain DiD, et dans les panneaux D et F, les cellules sont imagées via leur expression rouge mCherry. Barres d’échelle = 100 μm. Les vidéos d’expériences accélérées de fluorescence à grand champ montrées dans les panneaux C et D se trouvent respectivement dans la vidéo supplémentaire S5 et la vidéo supplémentaire S6. Abréviations : GBM = glioblastome; CGC = cellules souches GBM; S = sphéroïde. Veuillez cliquer ici pour voir une version agrandie de cette figure.
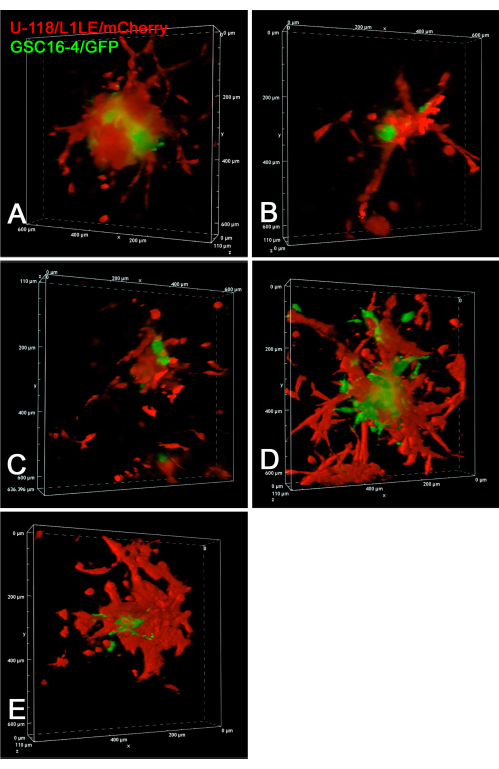
Figure 6 : Rendu de volume d’images de time-lapse confocale 4D de cellules GSC et GBM vivantes. Tous les panneaux montrent les images finales de cinq greffes de sphéroïdes à cellules mixtes différentes sur des tranches de cerveau distinctes. Pour les panneaux A à E, des images confocales z-stack ont été acquises par pas de 10 μm toutes les 10 minutes sur une période de 20 heures. Les préparations comprenaient des tranches de cerveau avec des sphéroïdes à cellules mixtes implantées de cellules rouges U-118 / L1LE / mCherry et de cellules vertes GSC16-4 / GFP. Des images confocales ont été prises tandis que des tranches de cerveau ont été cultivées sur des inserts membranaires dans une boîte de culture cellulaire en plastique à 6 puits à l’aide d’une lentille d’objectif 20x à distance de travail extra-longue (ELWD) (0,45 NA), qui a fourni la distance de travail supplémentaire nécessaire. Les rendus de volume ont été générés à l’aide du logiciel de microscope confocal « Alpha Blending », qui donne un effet 3D apparent. Les vidéos accélérées de ces rendus de volume confocaux au fil du temps sont présentées dans la vidéo supplémentaire S7, la vidéo supplémentaire S8, la vidéo supplémentaire S9, la vidéo supplémentaire S10 et la vidéo supplémentaire S11. Abréviations : GBM = glioblastome; CGC = cellules souches GBM; GFP = protéine fluorescente verte; NA = ouverture numérique. Veuillez cliquer ici pour voir une version agrandie de cette figure.
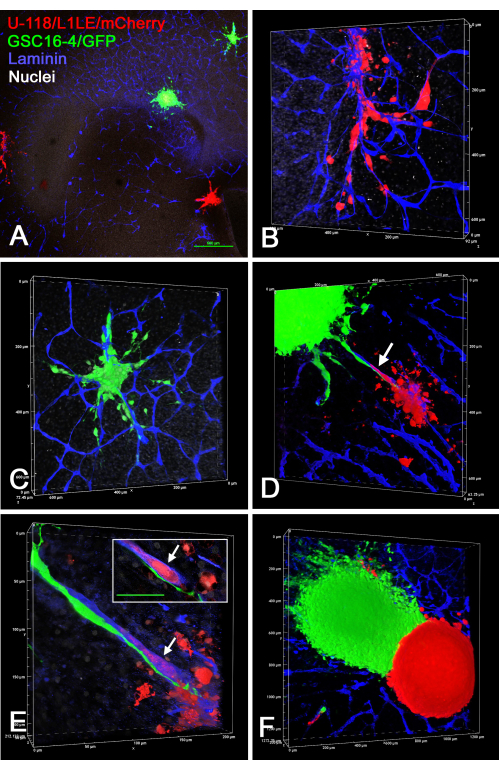
Figure 7 : Images confocales de tranches de cerveau fixes avec des cellules GBM invasives provenant de sphéroïdes de différents types de cellules. Les sphéroïdes verts étaient composés de cellules GSC16-4/GFP et les sphéroïdes rouges étaient composés de cellules U-118/L1LE/mCherry. Les panneaux A à F montrent différentes vues de tranches de cerveau, sur lesquelles plusieurs sphéroïdes rouges et verts ont été cultivés pendant plusieurs jours avant la fixation et l’immunocoloration pour la laminine (bleu). Les panneaux A-C sont de la même tranche OT où A a été pris avec un objectif 4x, et les panneaux B et C sont des rendus de volume de grossissement plus élevés (objectif 20x) des cellules qui ont envahi la tranche cérébrale de deux des sphéroïdes montrés dans le panneau A. Les deux types de cellules ont clairement envahi les tissus le long des vaisseaux sanguins. Le panneau D montre un rendu de volume (objectif 20x) d’une tranche de cerveau différente où deux sphéroïdes différents étaient situés à proximité l’un de l’autre, et les cellules des deux sont vues migrant le long du même vaisseau sanguin qui est situé entre eux (flèche). Le panneau E est un volume à fort grossissement (objectif d’huile 60x) révélant que les cellules vertes migrent le long de la surface extérieure du vaisseau sanguin, tandis que les globules rouges migrent à l’intérieur du vaisseau sanguin (flèche). L’encart montre une seule section optique z-plane, où le globule rouge est clairement entouré d’une coloration bleue du vaisseau sanguin (flèche), et le globule vert est clairement à l’extérieur du vaisseau sanguin. Barre d’échelle en encart = 50 μm. Le panneau F montre un rendu de volume (objectif 10x) d’une tranche du cerveau antérieur avec deux sphéroïdes étroitement apposés de couleurs différentes. Très peu, voire aucune, invasion cellulaire s’est produite d’un sphéroïde à l’autre, et une frontière nette existait entre eux. Les panneaux A, B, C et E montrent également une contre-coloration nucléaire blanche avec du bisbenzimide. Barre d’échelle = 500 μm (A). Les échelles des panneaux B-F se trouvent le long des axes de rendu du volume. Abréviations : GBM = glioblastome; CGC = cellules souches GBM; GFP = protéine fluorescente verte; OT = tectum optique. Veuillez cliquer ici pour voir une version agrandie de cette figure.
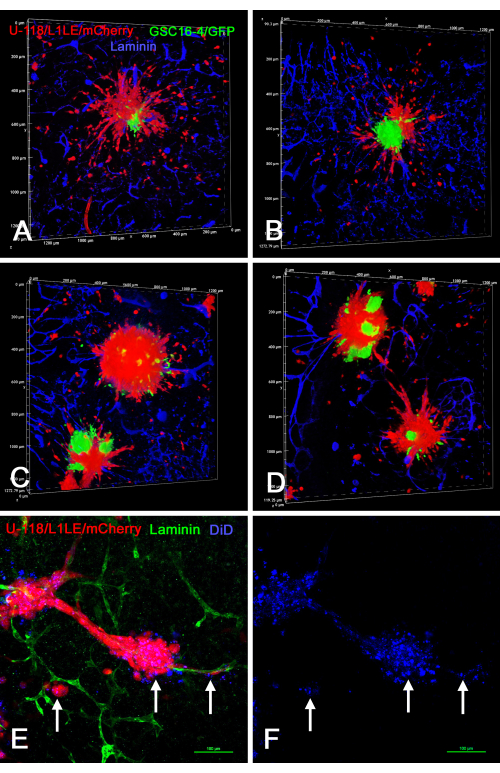
Figure 8 : Images confocales de tranches de cerveau fixes avec des cellules GBM invasives provenant de sphéroïdes à cellules mixtes et de sphéroïdes marqués avec DiD. Les panneaux A à D montrent les rendus voluminiques de tranches de cerveau contenant des sphéroïdes à cellules mixtes composés de cellules vertes GSC16-4 / GFP et de cellules rouges U-118 / L1LE / mCherry. De nombreuses cellules rouges U-118 se sont dispersées à partir des sphéroïdes et ont envahi la tranche de cerveau dans toutes les directions, tandis que les CGC vertes ne se sont pas dispersées et sont restées aux emplacements centraux des sphéroïdes. Les panneaux E et F montrent une préparation ex vivo de tranches avec des sphéroïdes rouges U-118 / L1LE / mCherry également marqués avec un colorant membranaire rouge lointain DiD (en bleu). Après fixation, la tranche a été immunocolorée pour la laminine en vert. L’étiquette DiD était visible dans les globules rouges sous forme de coloration ponctuée (flèches) et était visible même dans les cellules qui s’étaient dispersées à partir des sphéroïdes le long des vaisseaux sanguins. La contre-coloration nucléaire au bisbenzimide n’est pas représentée dans cette figure, de sorte que l’autre coloration est plus clairement visible. Barres d’échelle = 100 μm (E,F). Abréviations : GBM = glioblastome; CGC = cellules souches GBM; GFP = protéine fluorescente verte. Veuillez cliquer ici pour voir une version agrandie de cette figure.
| Milieu/solution | Composition | ||
| Médias de la CGC | Mélange 1:1 de DMEM/F12, sérum bovin fœtal à 1 % (FBS), tampon HEPES 15 mM, 2 mM de L-glutamine, 100 μg/mL de pénicilline-streptomycine (stylo/streptocoque), supplément de B27 à 2 % sans vitamine A et 2,5 μg/mL d’héparine. | ||
| Médias GBM | DMEM (glucose élevé), FBS à 10%, stylo / streptocoque et 2 mM de L-glutamine. | ||
| Tampon de fixation | PFA à 2 % dans un tampon cacodylate de sodium 0,1 M | ||
| Support d’intégration | 3,5 % de gélose et 8 % de saccharose dans le PBS | ||
| Le | 0,1% Triton X-100 + 5% de sérum de chèvre normal (NGS) dans PBS | ||
| U-118 MG milieu de culture cellulaire | DMEM + 10% FBS + stylo/streptocoque + L-glutamine | ||
| Milieux de culture de tranches de cerveau | 50% MEM + 25% HBSS + 25% Sérum Cheval + B27 + stylo/streptocoque + L-glut + 15 mM Tampon HEPES | ||
| Trancheuse de tissu vibrant Média de tranchage | Moyen 199 + stylo/streptocoque + tampon HEPES 15 mM | ||
Tableau 1 : Composition des milieux et des tampons utilisés dans le présent protocole.
Figure supplémentaire 1 : Injection dans le tectum optique E5. (A) Une fois qu’un trou est percé dans la coquille d’œuf au-dessus de la lame d’air et que la membrane de l’espace aérien est mouillée avec une solution saline ou un média, la membrane est enlevée à l’aide d’une pince fine. (B) Pour injecter des cellules dans le tectum optique, l’amnion est pincé et maintenu avec une pince fine pour positionner la tête de manière à ce que le tectum optique soit accessible. Ensuite, la micropipette est insérée dans le tectum optique et des cellules y sont injectées sous pression. (C) Après injection de cellules, quelques gouttes de solution d’ampicilline sont ajoutées sur l’embryon à l’aide d’une seringue et d’une aiguille fine. Veuillez cliquer ici pour télécharger ce fichier.
Figure supplémentaire 2 : Dissection des régions cérébrales E15. (A) Après décapitation, la tête de l’embryon E15 est placée dans une boîte avec une solution stérile de CMF. (B) La peau recouvrant le cerveau est ensuite enlevée à l’aide d’une pince fine. (C) Les deux os du crâne sont ensuite retirés des deux hémisphères du cerveau antérieur (FB). (D) La dure-mère du tissu conjonctif est ensuite délicatement retirée de l’entourage du cerveau antérieur (FB), du tectum optique et du cervelet. (E) Le cerveau entier est ensuite retiré de la tête en le sortant doucement de la cavité cérébrale par le dessous à l’aide de pinces incurvées. (F ) La vue dorsale de l’ensemble du cerveau enlevé avec le cerveau antérieur (FB), le tectum optique (OT) et le cervelet (CB) est montrée. (G ) Le cerveau isolé est ensuite disséqué dans les hémisphères du cerveau antérieur (FB), du tectum optique (OT) et du cervelet (CB) à l’aide de fins ciseaux. (H ) La délicate pie du tissu conjonctif est ensuite facilement retirée des hémisphères du tectum optique (OT) à l’aide de pinces fines. Veuillez cliquer ici pour télécharger ce fichier.
Figure supplémentaire 3 : Encastrement et découpage du tectum optique E15 et placement des sphéroïdes cellulaires. (A) Un hémisphère tectum optique est immergé dans de l’agarose à bas point de fusion à l’aide de pinces incurvées. (B) Une fois que l’agarose durcit sur la glace, le bloc contenant le tectum optique est coupé et collé au piédestal en acier inoxydable dans le plat/plateau à trancher. (C) Une fois la colle sèche, le plat/plateau de tranchage est placé dans le mandrin de la trancheuse à papier vibrant et rempli de milieu de tranchage froid. Les tranches sont ensuite coupées avec le couteau saphir du bloc de tissu immergé. Les tranches coupées flottent dans le plat / plateau et peuvent être retirées à l’aide d’une spatule. (D) Les tranches coupées sont retirées de la capsule ou du plateau et placées directement sur les inserts de membrane avec le milieu de culture en tranches sous-jacent dans une plaque multipuits. (E) Une fois que les sphéroïdes cellulaires sont cultivés sur des boîtes enduites de poly-AMHE, un sphéroïde est retiré de la capsule dans une quantité minimale de milieu à l’aide d’un micropipeteur de 20 μL. (F) Le sphéroïde isolé est ensuite placé directement sur la tranche de cerveau dans le milieu minimal. (G) Si le sphéroïde tombe de la tranche de cerveau en raison de l’écoulement du média, il peut être repoussé sur la tranche de cerveau à l’aide d’un cil collé à un bâton applicateur en bois. Veuillez cliquer ici pour télécharger ce fichier.
Vidéo supplémentaire S1: Vidéo du rendu à fort volume de grossissement d’une petite tumeur GSC15-2 à E15. Les CGC sont vertes en raison de l’expression de GFP. La vidéo correspond à la figure 1C et montre les cellules GSC15-2. La vidéo montre la rotation d’un rendu de volume généré à partir d’une pile z à l’aide d’un objectif d’immersion dans l’huile 60x. Les noyaux cellulaires apparaissent blancs en raison de la coloration au bisbenzimide, et certains apparaissent rouges en raison de l’immunomarquage de Sox2. Notez qu’en raison du « mélange alpha » pour les rendus de volume dans le logiciel de microscope confocal, les couleurs ne se mélangent pas comme elles le feraient avec une projection d’intensité maximale, et la couleur la plus intense prédomine et obscurcit la couleur moins intense. Les vaisseaux sanguins sont colorés en blanc en raison de l’immunocoloration de la laminine. La coloration de l’intégrine alpha-6 du marqueur GSC est représentée en bleu et apparaît ponctuée sur les surfaces vertes de la GSC. Les échelles de microns sont affichées le long des bords du rendu du volume. Veuillez cliquer ici pour télécharger cette vidéo.
Vidéo supplémentaire S2: Vidéo du rendu à fort grossissement de la petite tumeur GSC16-4 à E15. Les CGC sont vertes en raison de l’expression de GFP. La vidéo correspond à la figure 1D et montre les cellules GSC16-4. La vidéo montre la rotation d’un rendu de volume généré à partir d’une pile z à l’aide d’un objectif d’immersion dans l’huile 60x. Les noyaux cellulaires apparaissent blancs en raison de la coloration au bisbenzimide, et certains CGG apparaissent rouges en raison de l’immunomarquage de la nestine. Notez qu’en raison du « mélange alpha » pour les rendus de volume dans le logiciel de microscope confocal, les couleurs ne se mélangent pas comme elles le feraient avec une projection d’intensité maximale, et la couleur la plus intense prédomine et obscurcit la couleur moins intense. Les vaisseaux sanguins sont colorés en blanc en raison de l’immunocoloration de la laminine. La coloration de l’intégrine alpha-6 du marqueur GSC est représentée en bleu et apparaît ponctuée sur les surfaces vertes de la GSC. Les échelles de microns sont affichées le long des bords du rendu du volume. Veuillez cliquer ici pour télécharger cette vidéo.
Vidéo supplémentaire S3: Vidéo de rendus à fort volume de grossissement de petite tumeur GSC15-2 à E15. Les CGC sont vertes en raison de l’expression de GFP. La vidéo correspond à la figure 1E et montre les cellules GSC15-2. La vidéo montre la rotation d’un rendu de volume généré à partir d’une pile z à l’aide d’un objectif d’immersion dans l’huile 60x. Les noyaux cellulaires apparaissent blancs en raison de la coloration au bisbenzimide, et certains apparaissent rouges en raison de l’immunomarquage de Sox2. Notez qu’en raison du « mélange alpha » pour les rendus de volume dans le logiciel de microscope confocal, les couleurs ne se mélangent pas comme elles le feraient avec une projection d’intensité maximale, et la couleur la plus intense prédomine et obscurcit la couleur moins intense. Les vaisseaux sanguins sont colorés en blanc en raison de l’immunocoloration de la laminine. La coloration de l’intégrine alpha-6 du marqueur GSC est représentée en bleu et apparaît ponctuée sur les surfaces vertes de la GSC. Les échelles de microns sont affichées le long des bords du rendu du volume. Veuillez cliquer ici pour télécharger cette vidéo.
Vidéo supplémentaire S4: Vidéo des rendus à fort grossissement de petites tumeurs GSC16-4 à E15. Les CGC sont vertes en raison de l’expression de GFP. La vidéo correspond à la figure 1F et montre les cellules GSC16-4. La vidéo montre la rotation d’un rendu de volume généré à partir d’une pile z à l’aide d’un objectif d’immersion dans l’huile 60x. Les noyaux cellulaires apparaissent blancs en raison de la coloration au bisbenzimide, et certains apparaissent rouges en raison de l’immunomarquage de la nestine. Notez qu’en raison du « mélange alpha » pour les rendus de volume dans le logiciel de microscope confocal, les couleurs ne se mélangent pas comme elles le feraient avec une projection d’intensité maximale, et la couleur la plus intense prédomine et obscurcit la couleur moins intense. Les vaisseaux sanguins sont colorés en blanc en raison de l’immunocoloration de la laminine. La coloration de l’intégrine alpha-6 du marqueur GSC est représentée en bleu et apparaît ponctuée sur les surfaces vertes de la GSC. Les échelles de microns sont affichées le long des bords du rendu du volume. Veuillez cliquer ici pour télécharger cette vidéo.
Vidéo supplémentaire S5 : Vidéo de cellules GBM vivantes dans une tranche de cerveau ex vivo . La vidéo correspond à la figure 5C et montre des images de fluorescence à grand champ de sphéroïdes de cellules U-118/L1LE et de cellules envahissantes au cours d’une expérience en accéléré pour surveiller le comportement en direct de l’invasion dans la tranche ex vivo (en utilisant un objectif 20x sur un système de microscope time-lapse personnalisé). Les cellules U-118/L1LE ont été colorées avec le colorant à membrane fluorescente rouge lointain DiD. Les images ont été acquises avec un appareil photo monochrome. Veuillez cliquer ici pour télécharger cette vidéo.
Vidéo supplémentaire S6: Vidéo de cellules GBM vivantes dans une tranche de cerveau ex vivo . La vidéo correspond à la figure 5D et montre des images de fluorescence à grand champ de sphéroïdes de cellules U-118/L1LE et de cellules envahissantes au cours d’une expérience en accéléré pour surveiller le comportement d’invasion en direct dans la tranche ex vivo (en utilisant un objectif 20x sur un système de microscope time-lapse personnalisé). Les cellules ont été imagées via leur expression mCherry rouge. Les images ont été acquises avec un appareil photo monochrome. Veuillez cliquer ici pour télécharger cette vidéo.
Vidéo supplémentaire S7: Vidéo de rendu de volume d’images de time-lapse confocale 4D de GSC et de cellules GBM en direct. La vidéo correspond à la figure 6A. Des images confocales z-stack ont été acquises par pas de 10 μm toutes les 10 minutes sur une période de 20 heures. La préparation consistait en une tranche de cerveau avec des sphéroïdes à cellules mixtes implantées de cellules rouges U-118 / L1LE / mCherry et de cellules vertes GSC16-4 / GFP. Des images confocales ont été prises pendant que la tranche cérébrale était cultivée sur un insert membranaire dans une boîte de culture cellulaire en plastique à 6 puits à l’aide d’une lentille d’objectif ELWD 20x (0,45 NA), qui fournissait la distance de travail supplémentaire nécessaire. Le rendu du volume a été généré à l’aide du logiciel de microscope confocal « Alpha Blending », qui donne un effet 3D apparent. Les échelles de microns sont affichées le long des bords du rendu du volume. La vidéo est mieux observée en faisant glisser manuellement le curseur de progression vidéo dans le lecteur vidéo d’avant en arrière pour observer le mouvement de la cellule plutôt que de permettre au lecteur vidéo de continuer à sa vitesse lente normale. Veuillez cliquer ici pour télécharger cette vidéo.
Vidéo supplémentaire S8 : Vidéo de rendu de volume d’images de time-lapse confocale 4D de GSC et de cellules GBM en direct. La vidéo correspond à la figure 6B. Des images confocales z-stack ont été acquises par pas de 10 μm toutes les 10 minutes sur une période de 20 heures. La préparation consistait en une tranche de cerveau avec des sphéroïdes à cellules mixtes implantées de cellules rouges U-118 / L1LE / mCherry et de cellules vertes GSC16-4 / GFP. Des images confocales ont été prises pendant que la tranche cérébrale était cultivée sur un insert membranaire dans une boîte de culture cellulaire en plastique à 6 puits à l’aide d’une lentille d’objectif ELWD 20x (0,45 NA), qui fournissait la distance de travail supplémentaire nécessaire. Le rendu du volume a été généré à l’aide du logiciel de microscope confocal « Alpha Blending », qui donne un effet 3D apparent. Les échelles de microns sont affichées le long des bords du rendu du volume. La vidéo est mieux observée en faisant glisser manuellement le curseur de progression vidéo dans le lecteur vidéo d’avant en arrière pour observer le mouvement de la cellule plutôt que de permettre au lecteur vidéo de continuer à sa vitesse lente normale. Veuillez cliquer ici pour télécharger cette vidéo.
Vidéo supplémentaire S9 : Vidéo de rendu de volume d’images de time-lapse confocale 4D de GSC et de cellules GBM en direct. La vidéo correspond à la figure 6C. Des images confocales z-stack ont été acquises par pas de 10 μm toutes les 10 minutes sur une période de 20 heures. La préparation consistait en une tranche de cerveau avec des sphéroïdes à cellules mixtes implantées de cellules rouges U-118 / L1LE / mCherry et de cellules vertes GSC16-4 / GFP. Des images confocales ont été prises pendant que la tranche cérébrale était cultivée sur un insert membranaire dans une boîte de culture cellulaire en plastique à 6 puits à l’aide d’une lentille d’objectif ELWD 20x (0,45 NA), qui fournissait la distance de travail supplémentaire nécessaire. Le rendu du volume a été généré à l’aide du logiciel de microscope confocal « Alpha Blending », qui donne un effet 3D apparent. Les échelles de microns sont affichées le long des bords du rendu du volume. La vidéo est mieux observée en faisant glisser manuellement le curseur de progression vidéo dans le lecteur vidéo d’avant en arrière pour observer le mouvement de la cellule plutôt que de permettre au lecteur vidéo de continuer à sa vitesse lente normale. Veuillez cliquer ici pour télécharger cette vidéo.
Vidéo supplémentaire S10: Vidéo de rendu de volume d’images de time-lapse confocale 4D de GSC et de cellules GBM en direct. La vidéo correspond à la figure 6D. Des images confocales z-stack ont été acquises par pas de 10 μm toutes les 10 minutes sur une période de 20 heures. La préparation consistait en une tranche de cerveau avec des sphéroïdes à cellules mixtes implantées de cellules rouges U-118 / L1LE / mCherry et de cellules vertes GSC16-4 / GFP. Des images confocales ont été prises pendant que la tranche cérébrale était cultivée sur un insert membranaire dans une boîte de culture cellulaire en plastique à 6 puits à l’aide d’une lentille d’objectif ELWD 20x (0,45 NA), qui fournissait la distance de travail supplémentaire nécessaire. Le rendu du volume a été généré à l’aide du logiciel de microscope confocal « Alpha Blending », qui donne un effet 3D apparent. Les échelles de microns sont affichées le long des bords du rendu du volume. La vidéo est mieux observée en faisant glisser manuellement le curseur de progression vidéo dans le lecteur vidéo d’avant en arrière pour observer le mouvement de la cellule plutôt que de permettre au lecteur vidéo de continuer à sa vitesse lente normale. Veuillez cliquer ici pour télécharger cette vidéo.
Vidéo supplémentaire S11: Vidéo de rendu de volume d’images de time-lapse confocale 4D de GSC et de cellules GBM en direct. La vidéo correspond à la figure 6E. Des images confocales z-stack ont été acquises par pas de 10 μm toutes les 10 minutes sur une période de 20 heures. la préparation comprenait une tranche de cerveau avec des sphéroïdes à cellules mixtes implantées de cellules rouges U-118 / L1LE / mCherry et de cellules vertes GSC16-4 / GFP. Des images confocales ont été prises pendant que la tranche cérébrale était cultivée sur un insert membranaire dans une boîte de culture cellulaire en plastique à 6 puits à l’aide d’une lentille d’objectif ELWD 20x (0,45 NA), qui fournissait la distance de travail supplémentaire nécessaire. Le rendu du volume a été généré à l’aide du logiciel de microscope confocal « Alpha Blending », qui donne un effet 3D apparent. Les échelles de microns sont affichées le long des bords du rendu du volume. La vidéo est mieux observée en faisant glisser manuellement le curseur de progression vidéo dans le lecteur vidéo d’avant en arrière pour observer le mouvement de la cellule plutôt que de permettre au lecteur vidéo de continuer à sa vitesse lente normale. Veuillez cliquer ici pour télécharger cette vidéo.
Discussion
Les étapes critiques du protocole pour l’injection de cellules dans le ventricule du mésencéphale (tectum optique) comprennent le fait de ne pas endommager les vaisseaux sanguins de la membrane chorio-allantoïdienne de l’œuf ou entourant l’embryon avant et pendant l’injection, bien que la membrane amnionique entourant immédiatement l’embryon puisse être doucement tirée et maintenue pour positionner la tête lors de l’injection des cellules dans le mésencéphale. L’amnion est relativement dur et peut être tiré avec une pince fine pour positionner la tête et la maintenir stable d’une main, pour l’injection de cellules de l’autre main dans le tectum optique, qui est la grande structure ronde au milieu du cerveau. Généralement, la viabilité des embryons injectés varie de 25% à 75%, en fonction de facteurs inconnus, et pratiquement chaque embryon qui survit contient au moins une petite tumeur dans le tectum optique. Les étapes critiques dans la génération de tranches de cerveau viables comprennent le buvard du tissu de l’excès de liquide afin que l’agarose adhère au cerveau pendant le découpage et pour garder les tissus et les tranches froids jusqu’à ce qu’ils soient placés sur l’insert membranaire. Comme différents types de cellules forment les sphéroïdes différemment (en vitesse et en taille), la densité cellulaire plaquée sur les plaques poly-HEMA et le temps avant la récolte des sphéroïdes doivent être optimisés pour chaque type de cellule.
Le travail ici n’a pas fait l’objet d’une étude longitudinale formelle de la viabilité des tranches de cerveau. Yang et al. ont utilisé des cultures de tranches de cerveau d’embryons de poussins similaires à celles utilisées ici et ont montré une bonne viabilité des tranches pendant au moins 7 jours16. Des travaux antérieurs ont montré que lorsque le tissu OT était conservé dans des milieux sous-optimaux, de nombreux noyaux pyknotiques apparaissaient dans le tissu, ce qui ne se produisait pas dans les tranches du travail ici. De plus, lorsque les tranches dégénèrent dans des conditions sous-optimales, les vaisseaux sanguins se fragmentent et apparaissent sous forme de rangées de sphères positives à la laminine (non représentées). Ainsi, bien que la viabilité ici n’ait pas été vérifiée par des méthodes telles que l’électrophysiologie ou l’expression active de la caspase-3, aucun des indicateurs de mort cellulaire observés dans des conditions de culture sous-optimales n’est apparu ici.
L’ergothérapie a été concentrée pour des expériences in vivo sur les tumeurs cérébrales parce que c’est la région la plus facilement injectable avec le plus gros ventricule. À E5, qui est le dernier jour où l’embryon est assez petit pour rester accessible au-dessus du jaune, les injections doivent être faites dans un ventricule, car toutes les régions du cerveau ne sont rien de plus qu’une mince zone ventriculaire. Néanmoins, ces injections aboutissent avec succès à des tumeurs intégrées avec des cellules qui envahissent le parenchyme cérébral. Parfois, les tumeurs résultantes se trouvent dans le cerveau antérieur ou le cervelet, mais ce n’est pas commun. Les tranches ex vivo de tectum optique E15 ont été principalement utilisées pour des expériences ici, de sorte que les résultats de co-culture ex vivo peuvent être corrélés avec les expériences d’injection in vivo . Cependant, les tranches du cerveau antérieur conviennent également et ont une plus grande surface et un ventricule très mince par rapport au tectum optique, ce qui pourrait rendre le cerveau antérieur plus approprié pour les co-cultures ex vivo qui ne sont pas corrélées avec des injections in vivo .
Il a été démontré ici que les injections in vivo , suivies d’une fixation tissulaire, d’une section vibrante de trancheuses de tissus et d’une immunocoloration de la laminine et d’autres marqueurs, ont abouti à des images à haute résolution de cellules GBM et de GSC dans les tissus cérébraux à proximité immédiate des vaisseaux sanguins. La capacité de déterminer les interrelations entre les cellules tumorales et les vaisseaux sanguins a été grandement facilitée par la création de rendus de volume 3D à partir de piles z de sections optiques confocales à l’aide du logiciel confocal et des instructions du fabricant. L’imagerie accélérée utilisant la microscopie à fluorescence à grand champ de cellules marquées GFP, mCherry et DiD était possible; Cependant, les cellules migrantes qui se trouvaient à proximité des sphéroïdes hautement fluorescents étaient parfois obscurcies par la « lueur » du sphéroïde. Cet effet indésirable peut être quelque peu minimisé en ajustant soigneusement les temps d’exposition pour la collecte d’images à grand champ. L’imagerie accélérée utilisant des piles z confocales au fil du temps (4D) a éliminé la lueur floue des sphéroïdes et a abouti à des cellules migratrices nettement définies avec un arrière-plan sombre. Cela n’a pas été décrit dans le protocole, mais a été réalisé de la même manière que l’imagerie accélérée à grand champ, qui a été réalisée alors que des tranches de cerveau étaient sur les inserts de membrane transparente dans une plaque en plastique à 6 puits. Bien que l’imagerie confocale en accéléré donne des images nettement plus claires des cellules individuelles et de leur comportement, une expérience en accéléré multipoint collectant des piles z de 10 plans z / point, à des intervalles de 10 minutes sur une période de 20 heures, est une utilisation intensive des galvanomètres à tête de balayage. Comme cela pourrait réduire considérablement la durée de vie des galvanomètres, cette méthode est utilisée judicieusement.
Bien que le système embryonnaire de poussin soit très approprié pour les expériences d’injection in vivo et de co-culture ex vivo qui étudient le comportement des cellules GBM, ce système modèle présente plusieurs limites. Comme pour tout système de xénogreffe, l’environnement dans lequel les cellules humaines sont implantées n’est pas le cerveau humain, mais le comportement des cellules GBM semble imiter celui des modèles de rongeurs et des patients humains. Après avoir effectué des expériences d’injection in vivo sur E5, les tumeurs sont normalement autorisées à se former pendant 10 jours, jusqu’à E15. Ce n’est clairement pas assez de temps pour étudier tous les aspects de la tumorigenèse et de l’invasion cellulaire. Cependant, il a été démontré ici que des tumeurs solides se forment dans le parenchyme cérébral, que les cellules interagissent et se réorganisent au sein de la tumeur, et qu’une invasion cérébrale significative se produit à la fois le long des vaisseaux sanguins et de manière diffuse dans ce laps de temps relativement court. Une autre limite du système embryonnaire in vivo de poussin est qu’il ne convient pas aux traitements médicamenteux ou autres en raison du grand jaune et du système circulatoire extraembryonnaire qui fonctionne pendant le développement de l’embryon de poussin. Les traitements médicamenteux liquides topiques entraîneraient une concentration très variable et inconnue dans le cerveau en raison de la diffusion loin de l’embryon dans la masse vitelline beaucoup plus grande. De même, l’injection intraveineuse de médicaments dans le système circulatoire extraembryonnaire très délicat fuirait ou diffuserait hors des vaisseaux sanguins et entraînerait également des concentrations inconnues dans le cerveau. C’est l’une des principales raisons pour lesquelles la méthode de culture ex vivo en tranches a été adoptée, afin que non seulement le comportement cellulaire puisse être observé et suivi par microscopie accélérée, mais aussi pour que les traitements qui ont réussi à modifier le comportement des cellules GBM dans une boîte4 puissent être testés dans un environnement de tissu cérébral plus pertinent.
Le développement du système modèle de tumeur cérébrale orthotopique de l’embryon de poussin est considéré comme un ajout important aux systèmes et outils disponibles pour l’étude de la formation de tumeurs GBM et du comportement cellulaire invasif. Les œufs de poule fécondés sont susceptibles d’être facilement disponibles dans la plupart des régions, ils sont peu coûteux par rapport aux rongeurs, il n’y a pas de coûts de soins aux animaux, les embryons sont très résistants et résistants aux infections (c.-à-d. que la plupart du travail est effectué sur une paillasse), les embryons sont hautement manipulables et peuvent être cultivés en culture sans coquille19, et les embryons de poussins ne sont pas considérés comme des animaux vertébrés et ne nécessitent donc pas l’approbation de l’IACUC par les directives des NIH (exigences institutionnelles peut varier). Ainsi, ces multiples avantages rendent le système embryonnaire de poussin très attractif si l’on limite leurs questions et expériences à celles qui en rentrent dans ses limites. Plusieurs études sur les cellules GBM ont été réalisées par d’autres en utilisant l’embryon de poussin, mais celles-ci ont presque exclusivement utilisé la membrane chorio-allantoïdienne (CAM) de l’embryon 20,21,22,23,24,25,26,27,28,29 et le bourgeon du membre 30, et non le cerveau. Il y a également eu un rapport implantant un médulloblastome dans le cerveau du poussin sur E231. Sans aucun doute, l’utilisation de l’embryon de poussin comme système modèle de xénogreffe orthotopique, comme décrit ici, devrait donner des résultats beaucoup plus significatifs pour la biologie tumorale du GBM humain que les études utilisant le CAM.
Bien que ces études aient seulement commencé à utiliser pleinement le système de modèle de tumeur cérébrale embryonnaire de poussin pour des études sur les cellules GBM humaines et le comportement de GSC, on espère que d’autres étendront les utilisations et trouveront d’autres applications potentielles. On pourrait imaginer que non seulement ce système découvrira des mécanismes qui régulent la formation de tumeurs GBM et le comportement cellulaire, mais permettra également des tests précliniques de médicaments et de substances spécifiques sur des cellules de patients spécifiques. Par exemple, si des cultures de tranches cérébrales étaient mises en place à l’avance, des cellules tumorales, des morceaux de résections tumorales chirurgicales ou des organoïdes GBM dérivés de patients32 pourraient être placés directement en co-culture ex vivo , et divers traitements pourraient être évalués en quelques jours. De même, des cellules de patients dissociées pourraient être injectées directement dans le mésencéphale E5 in ovo pour évaluer leur capacité à former des tumeurs et à envahir le parenchyme cérébral. Ainsi, on espère que les descriptions des méthodes et les résultats représentatifs ici faciliteront et encourageront une utilisation accrue de ce système hautement sous-utilisé pour la recherche sur le cancer du cerveau.
Déclarations de divulgation
Aucun des auteurs n’a de conflit d’intérêts.
Remerciements
Ce travail a été financé en partie par une subvention au D.S.G. du National Cancer Institute (R03CA227312) et par une généreuse subvention de la Fondation Lisa Dean Moseley. Des échantillons de GBM vivants ont été obtenus avec le consentement du patient par l’intermédiaire du Tissue Procurement Center du Helen F. Graham Cancer Center and Research Institute. Le financement de A.R. a été fourni par le National Center for Research Resources et le National Center for Advancing Translational Sciences, National Institutes of Health (UL1TR003107). Des bourses de recherche d’été de premier cycle à N.P., A.L., Z.W. et K.S. ont été fournies par le programme de recherche de premier cycle de l’Université du Delaware.
matériels
| Name | Company | Catalog Number | Comments |
| 1 cm x 1 cm square hole paper punch | Birabira | N/A | |
| 1 mm biopsy punch pen | Robbins Instruments | 20335 | |
| 6 well insert plate (Corning Transwell) | Millipore Sigma | CLS3450 | |
| 9" Disposable Pasteur Pipets | Fisher Scientific | 13-678-20C | |
| 15 mL centrifuge tubes | Fisher Scientific | 05-539-12 | |
| 24 well plate | Corning Costar | 3526 | |
| 50 mL centrifuge tubes | Fisher Scientific | 05-539-9 | |
| Agar | Fisher BioReagents | BP1423-500 | for embedding fixed brains |
| Alexafluor 488-conjugated GAM IgG | Jackson Immunoresearch | 115-605-146 | |
| Alexafluor 647-conjugated GAM IgG | Jackson Immunoresearch | 115-545-146 | |
| Aluminum foil | ReynoldsWrap | N/A | |
| Ampicillin | Sigma Aldrich | A-9518 | |
| anti-integrin alpha-6 monoclonal antibody GOH3 | Santa Cruz Biotechnology | sc-19622 | |
| anti-L1CAM monoclonal antibody UJ127 | Santa Cruz Biotechnology | sc-53386 | |
| anti-laminin monoclonal antibody | Developmental Studies Hybridoma Bank | 3H11 | |
| anti-nestin monoclonal antibody 10c2 | Santa Cruz Biotechnology | sc-23927 | |
| anti-Sox2 monoclonal antibody E-4 | Santa Cruz Biotechnology | sc-365823 | |
| B27 supplement without vitamin A | GIBCO | 17504-044 | |
| bisbenzimide (Hoechst 33258) | Sigma-Aldrich | B2883 | nuclear stain |
| Cell culture incubator | Forma | standard humidified CO2 incubator | |
| Centrifuge | Beckman Coulter | ||
| Confocal microscope | Nikon Instruments | C2si+ | With custom-made cell incubator chamber |
| Confocal microscope objective lenses | Nikon Instruments | Plan Apo lenses, except S Plan Fluor ELWD 20x 0.45 NA objective lens for confocal time-lapse imaging | |
| Confocal microscope software | Nikon Instruments | NIS Elements | Version 5.2 |
| Curved foreceps | World Precision Intruments | 504478 | |
| Curved scissors | Fine Science Tools | ||
| Curved spatula | Fisher Scientific | 14-375-20 | |
| Cyanoacrylate glue | Krazy Glue | KG-585 12R | |
| D-Glucose | Millipore Sigma | G8270 | |
| DiD far red fluorescent dye | Invitrogen | V22887 | Vybrant DiD |
| DMEM | Sigma Aldrich | D5671 | |
| DMEM/F12 | Sigma Aldrich | D8437 | |
| DMSO | Sigma Aldrich | D4540 | |
| Dulbecco's Phosphate buffered saline (PBS) | Sigma Aldrich | P5493-1L | |
| egg incubator | Humidaire | ||
| electrical tape (10 mil thick/254 µm) | Scotch | N/A | |
| Ethanol 200 proof | Decon Laboratories | 2701 | |
| Fast green FCF dye | Avocado Research Chemicals | 16520 | |
| FBS | Gemini Bio-products | 900-108 | |
| filter paper | Fisher Scientific | ||
| Gauze | Dynarex | 3353 | |
| Glass Capillaries for microinjection | World Precision Instruments | TW100-4 | |
| Glycerol | Fisher BioReagents | BP228-1 | for mounting media |
| GSCs (human glioblastoma stem cells) | Not applicable | Isolated from patient GBM specimens in Galileo laboratory in GSC media and then transduced with a GFP encoding lentiviral vector. Cells used were between passage 10 and 30. | |
| Hanks Balanced Salt Solution (HBSS) | Corning | 21-020-CV | |
| Hemacytometer | Hausser scientific | ||
| Heparin | Fisher Scientific | BP2524-100 | |
| HEPES buffer | Sigma Aldrich | H0887 | |
| Horse Serum (HI) | Gibco | 26050-088 | |
| Human FGF-2 | BioVision | 4037-1000 | |
| Human TGF-α | BioVision | 4339-1000 | |
| Inverted phase contrast microscope | Nikon Instruments | TMS | for routine viewing of cultured cells |
| KCl | Fisher Scientific | BP366 | |
| KH2PO4 | Fisher Scientific | P284 | |
| Laboratory film | Parafilm | ||
| Labquake Shaker | LabIndustries | T400-110 | |
| L-Glut:Pen:Strep | Gemini Bio-products | 400-110 | |
| Low-melt agarose | Fisher Scientific | BP1360 | for embedding live brains |
| Matrix | Corning Matrigel | 354234 | |
| Medium 199 | GIBCO | 11150-059 | |
| MEM | Corning | 10-010-CV | |
| Metal vibratome block | |||
| Micropipette tips (20, 200, 1,000 µL) | Fisherbrand | ||
| Micropipettors (20, 200, 1,000 µL) | Gilson | ||
| Microscope Coverglass (no. 1.5 thickness) | Fisherbrand | 12544A | |
| NaCl | Fisher Scientific | S271 | |
| NaH2PO4 + H2O | Fisher Scientific | S369 | |
| NaHCO3 | Fisher Scientific | BP328 | |
| Normal goat serum | Millipore Sigma | 526-M | |
| N-propyl gallate | Sigma Aldrich | P3130 | for mounting media |
| Parafilm | Parafilm | ||
| Paraformaldehyde | Electron Microscopy Sciences | 15710 | |
| PBS | Sigma Aldrich | P5493-1L | |
| Pencil | |||
| Plain Microscope slides | Fisherbrand | 12-550-A3 | |
| Plastic 35 mm Petri dish | Becton Dickinson | 351008 | |
| pneumatic picopump | World Precision Intruments | PV830 | |
| Poly(2-hydroxyethyl methacrylate) (poly-HEMA) | Sigma Aldrich | P-3932 | |
| razor blade- double edge | PACE | for cutting fixed brain slices | |
| sapphire knife | Delaware Diamond Knives | for cutting live brain slices | |
| Scalpel | TruMed | 1001 | |
| Sodium cacodylate buffer 0.2 M pH 7.4 | Electron Microscopy Sciences | 11652 | |
| Specimen chamber for vibratome | custom-made | ||
| Stereo Dissecting Microscope | Nikon Instruments | SMZ1500 | Equipped with epifluorescence |
| straight foreceps | World Precision Intruments | 500233 | |
| straight scissors | Fine Science Tools | ||
| Sucrose | Mallinckrodt | 7723 | |
| Time-lapse fluorescence microscope (widefield fluorescence) | Nikon Instruments | TE2000-E | With custom-made cell incubator chamber (see Fotos et al., 2006) |
| Tissue culture dish polystyrene 100 mm | Thermo Fisher Scientific | 130182 | for cell culturing |
| Tissue culture dish polystyrene 60 mm | Becton Dickinson | 353004 | for cell culturing |
| Transfer pipette | American Central Scientific Co. | FFP011 | |
| Transparent tape | Scotch | ||
| Triton X-100 | Sigma Aldrich | T-8787 | |
| Trypsin (0.25%) + 2.21 mM EDTA | Corning | 25-053-CI | |
| U-118 MG human GBM cell line | ATCC | HTB-15 | Cells were transduced with a lentiviral vector encoding the entire ectodomain sequence of the L1CAM adhesion protein and then with lentiviral vector pUltra-hot encoding mCherry. Passage numbers are unknown. |
| Vacuum pump | Cole-Parmer | EW-07532-40 | "Air Cadet" |
| Vibrating tissue slicer | Vibratome | 3000 | for cutting live and fixed brain slices |
Références
- Cretu, A., Fotos, J. S., Little, B. W., Galileo, D. S. Human and rat glioma growth, invasion, and vascularization in a novel chick embryo brain tumor model. Clinical & Experimental Metastasis. 22 (3), 225-236 (2005).
- Yang, M., et al. L1 stimulation of human glioma cell motility correlates with FAK activation. Journal of Neuro-Oncology. 105 (1), 27-44 (2011).
- Mohanan, V., Temburni, M. K., Kappes, J. C., Galileo, D. S. L1CAM stimulates glioma cell motility and proliferation through the fibroblast growth factor receptor. Clinical & Experimental Metastasis. 30 (4), 507-520 (2013).
- Anderson, H. J., Galileo, D. S. Small-molecule inhibitors of FGFR, integrins and FAK selectively decrease L1CAM-stimulated glioblastoma cell motility and proliferation. Cellular Oncology. 39 (3), 229-242 (2016).
- Pace, K. R., Dutt, R., Galileo, D. S. Exosomal L1CAM stimulates glioblastoma cell motility, proliferation, and invasiveness. International Journal of Molecular Sciences. 20 (16), 3982(2019).
- Stoppini, L., Buchs, P. A., Muller, D. A simple method for organotypic cultures of nervous tissue. Journal of Neuroscience Methods. 37 (2), 173-182 (1991).
- Ohnishi, T., Matsumura, H., Izumoto, S., Hiraga, S., Hayakawa, T. A novel model of glioma cell invasion using organotypic brain slice culture. Cancer Research. 58 (14), 2935-2940 (1998).
- Humpel, C. Organotypic brain slice cultures: A review. Neuroscience. 305, 86-98 (2015).
- Aaberg-Jessen, C., et al. Invasion of primary glioma- and cell line-derived spheroids implanted into corticostriatal slice cultures. International Journal of Clinical and Experimental Pathology. 6 (4), 546-560 (2013).
- Matsumura, H., Ohnishi, T., Kanemura, Y., Maruno, M., Yoshimine, T. Quantitative analysis of glioma cell invasion by confocal laser scanning microscopy in a novel brain slice model. Biochemical and Biophysical Research Communications. 269 (2), 513-520 (2000).
- Ren, B., et al. Invasion and anti-invasion research of glioma cells in an improved model of organotypic brain slice culture. Tumori. 101 (4), 390-397 (2015).
- Fayzullin, A., et al. Time-lapse phenotyping of invasive glioma cells ex vivo reveals subtype-specific movement patterns guided by tumor core signaling. Experimental Cell Research. 349 (2), 199-213 (2016).
- Jensen, S. S., et al. Establishment and characterization of a tumor stem cell-based glioblastoma invasion model. PloS One. 11 (7), e0158746(2016).
- Marques-Torrejon, M. A., Gangoso, E., Pollard, S. M. Modelling glioblastoma tumour-host cell interactions using adult brain organotypic slice co-culture. Disease Models & Mechanisms. 11 (2), 031435(2018).
- Tamura, R., et al. Visualization of spatiotemporal dynamics of human glioma stem cell invasion. Molecular Brain. 12 (1), 45(2019).
- Yang, C., et al. Organotypic slice culture based on in ovo electroporation for chicken embryonic central nervous system. Journal of Cellular and Molecular Medicine. 23 (3), 1813-1826 (2019).
- Murrell, W., et al. Expansion of multipotent stem cells from the adult human brain. PloS One. 8 (8), e71334(2013).
- Fotos, J. S., et al. Automated time-lapse microscopy and high-resolution tracking of cell migration. Cytotechnology. 51 (1), 7-19 (2006).
- Tufan, A. C., Akdogan, I., Adiguzel, E. Shell-less culture of the chick embryo as a model system in the study of developmental neurobiology. Neuroanatomy. 3 (1), 8-11 (2004).
- Shoin, K., et al. Chick embryo assay as chemosensitivity test for malignant glioma. Japanese Journal of Cancer Research. 82 (10), 1165-1170 (1991).
- Hagedorn, M., et al. Accessing key steps of human tumor progression in vivo by using an avian embryo model. Proceedings of the National Academy of Sciences. 102 (5), 1643-1648 (2005).
- Balciūniene, N., et al. Histology of human glioblastoma transplanted on chicken chorioallantoic membrane. Medicina. 45 (2), 123-131 (2009).
- De Magalhães, N., et al. Applications of a new In vivo tumor spheroid based shell-less chorioallantoic membrane 3-D model in bioengineering research. Journal of Biomedical Science and Engineering. 3 (1), 20-26 (2010).
- Szmidt, M., et al. Morphology of human glioblastoma model cultured in ovo. Journal of Veterinary Research. 56 (2), 261-266 (2012).
- Jaworski, S., et al. Comparison of tumor morphology and structure from U87 and U118 glioma cells cultured on chicken embryo chorioallantoic membrane. Journal of Veterinary Research. 57 (4), 593-598 (2013).
- Yuan, Y. J., Xu, K., Wu, W., Luo, Q., Yu, J. L. Application of the chick embryo chorioallantoic membrane in neurosurgery disease. International Journal of Medical Sciences. 11 (12), 1275-1281 (2014).
- Urbańska, K., et al. The effect of silver nanoparticles (AgNPs) on proliferation and apoptosis of in ovo cultured glioblastoma multiforme (GBM) cells. Nanoscale Research Letters. 10, 98(2015).
- DeBord, L. C., et al. The chick chorioallantoic membrane (CAM) as a versatile patient-derived xenograft (PDX) platform for precision medicine and preclinical research. American Journal of Cancer Research. 8 (8), 1642-1660 (2018).
- Han, J. M., Jung, H. J. Synergistic anticancer effect of a combination of berbamine and arcyriaflavin A against glioblastoma stem-like cells. Molecules. 27 (22), 7968(2022).
- Ruiz-Ontañon, P., et al. Cellular plasticity confers migratory and invasive advantages to a population of glioblastoma-initiating cells that infiltrate peritumoral tissue. Stem Cells. 31 (6), 1075-1085 (2013).
- Cage, T. A., et al. Distinct patterns of human medulloblastoma dissemination in the developing chick embryo nervous system. Clinical & Experimental Metastasis. 29 (4), 371-380 (2012).
- Darrigues, E., et al. Biobanked glioblastoma patient-derived organoids as a precision medicine model to study inhibition of invasion. International Journal of Molecular Sciences. 22 (19), 10720(2021).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationExplorer plus d’articles
This article has been published
Video Coming Soon