Method Article
שימוש במוח עובר אפרוח כמודל לניתוחי In Vivo ו - Ex Vivo של התנהגות תאי גליובלסטומה אנושיים
In This Article
Summary
עוברי אפרוחים משמשים לחקר גידולי מוח מסוג גליובלסטומה אנושית (GBM) בתרביות משותפות של פרוסות מוח ב-ovo וב-ex vivo. ניתן לתעד התנהגות תאי GBM במיקרוסקופ בהילוך מהיר בתרביות משותפות ex vivo, וניתן לנתח את שני התכשירים בנקודת הקצה של הניסוי על ידי ניתוח קונפוקלי תלת-ממדי מפורט.
Abstract
עובר האפרוחים היה מערכת מודל אידיאלית לחקר התפתחות בעלי חוליות, במיוחד למניפולציות ניסיוניות. השימוש בעובר האפרוח הורחב לחקר היווצרותם של גידולי מוח מסוג גליובלסטומה אנושית (GBM) in vivo ופולשניות תאי הגידול לרקמת המוח הסובבת אותו. גידולי GBM יכולים להיווצר על ידי הזרקה של תרחיף של תאים המסומנים באופן פלואורסצנטי לחדר E5 של המוח התיכון (טקטום אופטי) באובו.
בהתאם לתאי GBM, גידולים קומפקטיים נוצרים באופן אקראי בחדר ובתוך דופן המוח, וקבוצות תאים פולשות לרקמת דופן המוח. קטעי רקמה עבים (350 מיקרומטר) של טקטה E15 קבועה עם גידולים יכולים להיות מוכתמים חיסונית כדי לגלות כי תאים פולשים לעתים קרובות נודדים לאורך כלי הדם כאשר מנותחים על ידי שחזור תלת ממדי של תמונות z-stack קונפוקליות. ניתן לתרבית פרוסות חיות של E15 במוח התיכון ובמוח הקדמי (250-350 מיקרומטר) על תוספות ממברנה, שם ניתן להחדיר תאי GBM המסומנים באופן פלואורסצנטי למיקומים לא אקראיים כדי לספק תרביות משותפות ex vivo לניתוח פלישת תאים, שיכולה להתרחש גם לאורך כלי הדם, במשך תקופה של כשבוע. ניתן לנטר תרביות משותפות ex-vivo אלה באמצעות מיקרוסקופ פלואורסצנטי רחב או קונפוקלי בהילוך מהיר כדי לצפות בהתנהגות תאים חיים.
לאחר מכן ניתן לתקן, לצבוע את מערכת החיסון ולנתח אותן באמצעות מיקרוסקופ קונפוקלי כדי לקבוע אם הפלישה התרחשה לאורך כלי דם או אקסונים. בנוסף, מערכת התרבית המשותפת יכולה לשמש לחקר אינטראקציות אפשריות בין תאים על ידי הצבת אגרגטים של סוגי תאים וצבעים שונים במקומות מדויקים שונים והתבוננות בתנועות התא. טיפולים תרופתיים יכולים להתבצע בתרביות ex vivo , בעוד שטיפולים אלה אינם תואמים את מערכת in ovo . שתי גישות משלימות אלה מאפשרות ניתוח מפורט ומדויק של התנהגות תאי GBM אנושיים והיווצרות גידולים בסביבת מוח של בעלי חוליות הניתנת למניפולציה רבה.
Introduction
מחקרי מבחנה של התנהגויות תאים סרטניים משמשים לעתים קרובות לניתוח מנגנונים פוטנציאליים הפועלים במהלך ההתנהגות המורכבת יותר שנצפתה במהלך היווצרות הגידול ופלישת תאים במודלים in vivo xenograft. לדוגמה, עם גליובלסטומה (GBM), מחקרי מבחנה חשפו מנגנונים של האופן שבו L1CAM פועל באופן פוטנציאלי במהלך היווצרות הגידול והפלישה למוח בעובר אפרוח חדש xenograft מודלגידול מוח 1,2,3,4,5. למרות שניסויי in vitro ו- in vivo משלימים זה את זה בדרכים שימושיות, הם משאירים פער משמעותי באופן שבו התוצאות יכולות להיות מתואמות. לדוגמה, ניתוחים מכניסטיים של תנועתיות תאי GBM על צלחת הם מצב מלאכותי ביותר, ומודלים של xenograft in vivo יכולים לחשוף רק נקודות זמן סטטיות או ניתוחי נקודות קצה של היווצרות גידולים והתנהגות תאים. מחקרי In vivo המשתמשים במכרסמים או בעוברי אפרוחים אינם מתאימים בקלות לניטור התנהגות התא בזמן שהתאים פולשים לרקמת המוח במודלים אלה של xenograft. עם זאת, מודל xenograft עובר אפרוח הוכיח כי חלבון ההידבקות L1CAM ממלא תפקיד מגרה ביכולת הפולשנות של תאי T98G GBM אנושיים 2,5.
פתרון מתאים לבעיה זו ניתן להגיע על ידי גישור הן בשיטות in vivo והן בשיטות in vitro באמצעות מודל תרבית פרוסת מוח אורגנוטיפית, המכונה מודל ex vivo. במודל ex vivo זה, רקמת מוח חיה יכולה להישמר בעובי של כמה מאות מיקרונים למשך עד מספר שבועות, מה שמאפשר להשתיל תאים סרטניים, לצפות בהתנהגותם ברקמה בפועל לאורך זמן, ולאחר מכן לבצע ניתוח סמן מפורט יותר בנקודת הסיום של הניסוי.
שיטה פופולרית לתרבית פרוסות אורגנוטיפיות הייתה תרבית פרוסת מוח בעובי של כמה מאות מיקרונים על גבי קרום נקבובי שקוף או שקוף, מה שמשאיר את הרקמה חשופה לאוויר, אך מאפשר למדיה התזונתית לקיים את הרקמה מתחת לקרום (עיין Stoppini et al.6). וריאציות שונות של שיטה זו שימשו למחקרים שונים, כולל שימוש במדיה שונה או בתוספות ממברנה שונות. תוספות קרום שונות כוללות תוספת קרום בקוטר 30 מ"מ, תוספת קרום נקבובית (0.4 מיקרומטר) בצלחת תרבית 35 מ"מ 6, ותוספות תרבית תאים (0.4 מיקרומטר) עבור לוחות6 בארות7. מדיות שונות כוללות 50% MEM/HEPES + 25% סרום סוס מומת בחום + 25% תמיסת מלח מאוזנת Hanks (HBSS)8, 50% מדיה מופחתת בסרום + 25% סרום סוס + 25% HBSS9, כמו גם אחרים. אם משתמשים בקרום שקוף או שקוף יחד עם תאי GBM המסומנים באופן פלואורסצנטי, ניתן לצלם תרביות כאלה מלמטה באמצעות שדה רחב הפוך או מיקרוסקופ פלואורסצנטי קונפוקלי 10,11,12,13,14,15.
בעוד שמודלים רבים של גידול מוח אורתוטופי in vivo xenograft ו- ex vivo organotypic brain slice model הוקמו באמצעות מכרסמים, כפי שצוטט לעיל, עובר האפרוח (Gallus gallus) לא נוצל למטרות אלה. עם זאת, עובר הגוזל הוכח כמסוגל לשמש כמודל invivo אורתוטופי xenograft לחקר פלישת גליומה אנושית וחולדה 1,2,5. תאים שהושתלו במוחות של עוברי אפרוחים הציגו דפוסי פלישה דומים לאלה שנצפו במודלים של מכרסמים, מה שתומך עוד יותר בשימוש בעוברי אפרוחים כמודל in vivo לניתוח תאי גידול מסוג GBM. עוברי אפרוחים הם גם זולים, ניתנים לתחזוקה בקלות רבה יותר מאשר מכרסמים (כלומר, בקליפות הביצים שלהם באינקובטור מעבדה), והרבה יותר קל לעבוד איתם, מה שהופך אותם לאופציה אטרקטיבית למחקרי GBM קצרי טווח in vivo. מאמר שפורסם לאחרונה תיאר את השימוש בתרביות פרוסות מוח של עוברי אפרוח להיווצרות וצמיחה של אקסונים במהלך התפתחות מוחית תקינה, כאשר הפרוסות היו בנות קיימא לפחות 7 ימים16. עם זאת, השימוש בתרביות פרוסות מוח עוברי אפרוח כאלה לניתוח ex vivo של התנהגות תאי GBM בסביבת רקמה לוקה בחסר. במאמר זה מתוארת השתלה של תאי GBM אנושיים ותאי גזע מסוג GBM (GSCs) במוח העובר המוקדם של אפרוח in vivo, כמו גם החדרת תאי GBM לתרביות פרוסות מוח של עוברי אפרוח חיים ex vivo. כמה דוגמאות מייצגות של גידולים כתוצאה מכך דפוסי פלישה תאים המתקבלים תכשירים אלה מסופקים גם.
Protocol
לא היה צורך באישור או אישור באוניברסיטת דלאוור כדי לבצע עבודה זו.
1. הזרקת תאי GBM לתוך טקטום אופטי אפרוח
- הכנת תאי GSC ו-GBM להזרקה
- תרבות GSCs בתקשורת GSC (טבלה 1). תרבית קבעה קווי תאי GBM במדיית GBM (טבלה 1).
- שטפו את התאים בצלחות במי מלח סטריליים חוצצי פוספט (PBS) והכניסו 1 מ"ל של תמיסת טריפסין לצלחת בקוטר 10 ס"מ. השאירו באינקובטור תרבית תאים למשך 2-3 דקות עד שהתאים יתחילו להתנתק.
- נטרלו את הטריפסין על ידי הוספת 10 מ"ל של תרבית מתאימה המכילה סרום לצלחת בקוטר 10 ס"מ ונתקו את התאים על ידי פיפטינג למעלה ולמטה. הכניסו את מתלה התא לצינור צנטריפוגה חרוטי בנפח 15 מ"ל.
- גלולה את התאים על ידי צנטריפוגה ב 800 × גרם במשך 5 דקות ב 4 ° C.
- שאפו את המדיה מכדורית התא באמצעות פיפטה חד פעמית מזכוכית עדינה המחוברת לבקבוק זרוע צדדי ולמשאבת ואקום. מרחפים מחדש את התאים במצע גדילה מתאים לריכוז של 10,000 תאים למיקרוליטר ומניחים בצינור מיקרופוגה או צינור בורג קטן על קרח.
- ערבבו את התאים עם כמות קטנה של צבע FCF סטרילי 1% ירוק מהיר (השתמשו ביחס של 5 מיקרוליטר צבע/100 מיקרוליטר של תרחיף תאים).
- הזרקת תאי GBM לתוך טקטום אופטי E5 באובו. ראו תרשים משלים 1.
- דוגרים על ביצי התרנגולות המופרות באינקובטור ביצים לחות, כאשר הקצה המחודד פונה כלפי מטה, בטמפרטורה של 37.5 מעלות צלזיוס (היום הראשון של הדגירה הוא היום העוברי 0 [E0]). ביום השישי של הדגירה (E5), לעקר את קליפת הביצה על ידי ריסוס עם אתנול 70%.
- בעזרת נר ביצית, עקבו בעיפרון לאורך היקף חלל האוויר שמעל העובר וכסו את האזור המתואר בסרט שקוף.
- בעזרת מספריים מעוקלים, לחתוך בעדינות סביב האזור traced, נזהר לא לחתוך לתוך קרום העובר או כלי הדם, ולהשליך את החלק העליון של קליפת הביצה.
- הניחו כמה טיפות של מדיית מלח או תרבית תאים על קרום חלל האוויר כדי להרטיב אותו כך שהוא יתנתק בקלות. בעזרת מלקחיים עדינים, חוררים בזהירות את קרום חלל האוויר מעל חלקו העליון של העובר, מוציאים אותו ומאתרים את ראשו של עובר האפרוח.
- השתמש במלקחיים עדינים כדי לתפוס את קרום מי השפיר השקוף המקיף מיד את העובר כדי למקם את הראש כך שניתן יהיה להזריק לטקטום האופטי תאים. ביד אחת, השתמש במלקחיים עדינים כדי להחזיק את מי השפיר כדי לשמור על הראש במקום במהלך תהליך ההזרקה. היזהר לא לפגוע בכלי הדם החוץ עובריים בקרום chorioallantoic על החלמון.
הערה: ההליך הנ"ל דורש תרגול מסוים כדי להיות מסוגל לתפוס ביעילות את קרום מי השפיר השקוף המקיף את העובר, שכן הוא בלתי נראה עד שהוא נתפס ומושך. תרגלו שימוש במלקחיים עדינים כדי לתפוס את מי השפיר השקופים שמקיפים מיד את העובר. - החזיקו את הראש יציב על ידי אחיזת קרום מי השפיר במלקחיים עדינים. באמצעות מיקרופיפטה מזכוכית ומשאבת פיקו-משאבה פנאומטית, מזריקים כ-50,000 תאים ב-5 מיקרוליטר של מדיה מתאימה לתרבית תאים לתוך הטקטום האופטי (5 μL הוא בערך 1/2 מיקרופיפטה מלאה).
הערה: ראו Cretu et al.1 לתמונה של עובר E5 שהוחדר לו תאי GBM מעורבבים עם צבע. - יש לטפטף כמה טיפות של אמפיצילין במינון 50 מ"ג/מ"ל על גבי העובר.
- מכסים את החור בחלק העליון של הביצים בנייר דבק שקוף ומשאירים במכשיר אדים עד E15 לנתיחה.
2. דיסקציה של אזורי מוח מעוברי E15
הערה: הדיסקציה של מוחות E15 כאן לצורך קיבוע דומה לזו המתוארת בשלב 8.2 עבור פרוסות מוח חיות, אך הדיסקציה כאן אינה חייבת להיעשות בתנאים אספטיים.
- חותכים את הסרט סביב החלק העליון של הקליפה, המאפשר גישה לעובר.
- ערפו את ראשו של העובר בצוואר והניחו את הראש בכלי בקוטר 10 ס"מ עם תמיסת טירודים סטרילית נטולת סידן ומגנזיום (CMF Tyrode). ראו איור משלים 2.
- בעזרת מלקחיים עדינים, קלפו את העור המכסה את המוח כדי לחשוף את הדורה מאטר הבסיסית. הסר את עצמות הגולגולת היוצרות בצד שמאל וימין של המוח. עצמות הגולגולת היוצרות עדיין אינן מכסות את רוב המוח.
- השתמשו בעדינות במלקחיים דקיקות ומחודדות כדי לקרוע את קרומי המוח שמעל מרכז המוח ולקלף אותם לכל צד כדי לחשוף את המוח.
- השתמשו במלקחיים מעוקלים כדי לגרוף את המוח מלמטה ולשלוף אותו בעדינות מהחלל שלו.
- לנתח את המוח לחלקיו: המוח הקדמי, tecta, המוח הקטן.
- הסר את הפיה מאטר שמעל הטקטה באמצעות מלקחיים עדינים. שימו לב שהפיה נפרדת בקלות מהטקטה, אך לא מהמוח הקדמי או מהמוח הקטן. הסר את הפייה מהמוח הקדמי על ידי נגיעה בה או גלגול שלה על פיסת נייר סינון קטנה.
- הניחו את אזורי המוח המנותחים בכלי קטן.
- מקמו את אזורי המוח לקיבוע בבאר צלחת של 24 בארות וקיבעו ב-2% פרפורמלדהיד (PFA) במאגר נתרן קקודילט של 0.1 מ'. להשאיר לפחות 24 שעות ב 4 °C (75 °F).
- לאחר הקיבוע, שטפו את הרקמה ב-3x PBS במשך שעה לפחות לפני ההטבעה באגר.
3. הטבעה וחיתוך של אזורי מוח שנקטפו
- מחממים מראש תמיסה של 3.5% אגר ו-8% סוכרוז ב-PBS עד להתכה ושומרים אותה בטמפרטורת התכה.
- בעזרת מלקחיים מעוקלים ככף מדידה, הרימו בעדינות את הטקטום האופטי או את אזור המוח הקדמי של מוח עובר האפרוחים, וטפחו מעט על נייר פילטר כדי להסיר נוזלים מיותרים כדי להבטיח הידבקות של האגר לפני השטח החיצוניים של המוח.
- בעזרת פיפטת העברה סטרילית, ממלאים את התבנית בתמיסת אגר.
הערה: ניתן ליצור תבנית פשוטה על ידי יצירת רדיד אלומיניום סביב אובייקט בגודל מתאים, כגון בלוקים קטנים של חיתוך רקמות רוטטות ממתכת. - הניחו את אזור המוח באגר, ותנו לאגר להתמצק לחלוטין.
- הסר את רדיד האלומיניום מסביב למוח המשובץ וחתוך את עודפי האגר סביב הצדדים באמצעות סכין גילוח או אזמל.
- מניחים טיפה של דבק ציאנואקרילט על ריבוע הנירוסטה של מגש החיתוך, מניחים את גוש האגרוז עם המוח על הדבק, ונותנים לדבק להיקשר למשך דקה. הכניסו את המגש לצ'אק פרוסת הרקמה הרוטט, הדקו ומלאו את המגש בכמות מספקת של PBS כדי לכסות את החלק העליון של גוש האגר.
- חתכו את פרוסות המוח על פרוסת רקמות רוטטת בעובי של 350 מיקרומטר באמצעות סכין גילוח מפלדה.
- כאשר פרוסות המוח נחתכות וצפות בחופשיות לתוך מגש הפריסה, השתמשו במרית כדי לגרוף ולהוציא את הפרוסות מהמגש. החליקו בעדינות את החלק מהמרית לתוך צלחת פטרי מסומנת בקוטר 10 ס"מ עם PBS כך שהחלקים יצופו בחופשיות.
הערה: האגר המקיף את פרוסת המוח עלול להתנתק אם המוח אינו מכוסה מספיק בנייר סינון כדי להסיר נוזלים עודפים לפני ההטבעה. אם זה קורה, ניתן להסיר בעדינות את רקמת המוח מהאגר המוצק ולהטמיע אותה מחדש לאחר ניקוי נכון של עודפי נוזלים.
4. immunostaining פרוסות המוח עם תאים סרטניים
- באמצעות מיקרוסקופ סטריאו מצויד epifluorescence, מסך פרוסות בודדות בצלחת 10 ס"מ אחד אחד עבור נוכחות או היעדר של תאים סרטניים.
- הכינו כמות מספקת של מלח חוצץ פוספט עם 0.1% Triton X-100 ו-5% סרום עיזים רגיל (PBSTG) (ראו טבלה 1) לצביעת מערכת החיסון ושטפו את הפרוסות כדי לעבור חיסון.
- חצי מילוי בארות בצלחת של 24 בארות שתשמש להכתמת חלקי מוח עם PBS.
- חותכים את פינות האגר סביב פרוסות המוח עם קצה של מרית או אזמל, ומניחים אותם בעדינות לתוך הבארות המכילות PBS.
- יש לשאוף את ה-PBS ולהחליף ב-350 מיקרוליטר של תמיסת צביעת נוגדנים ראשונית ב-PBSTG (למשל, 2 מיקרוגרם/מ"ל UJ127 ב-PBSTG).
- דוגרים במשך 24 שעות בחדר קר עם תסיסה עדינה, כך שהפרוסה נראית נעה בחופשיות בתוך הבאר.
- לאחר 24 שעות, הסר את תמיסת הנוגדנים העיקרית ושטוף 3 x 1 שעות עם PBSTG בחדר קר עם תסיסה.
- בסיום השטיפה, יש לדגור ב-350 מיקרוליטר/באר של תמיסת צביעת נוגדנים משנית ב-PBSTG (למשל, דילול של 1/200 ביוטין-GAM ב-PBSTG). לדגור במשך 20 שעות בחדר קר עם סערה.
הערה: אם מוותרים על השלב השלישוני ודוגרים עם נוגדן משני המכיל פלואורוכרום בשלב זה, יש לכסות כדי להגן מפני אור במהלך הדגירה מדי פעם ואז לדלג לשלב 4.11. - הסר את תמיסת הנוגדנים המשנית ושטוף 3 x 1 שעות ב- PBSTG בחדר קר עם תסיסה.
- הסר את PBSTG ודגר בתמיסה שלישוני (למשל, דילול 1:250 של אלקסה פלואור 647 סטרפטאווידין ב- PBSTG). אם תרצה, הכתימו את הגרעינים בשלב זה על ידי הוספת 0.1 מיקרוגרם / מ"ל ביסבנזימיד לתערובת. לדגור במשך 20 שעות בחדר קר עם סערה.
- הסר את התמיסה השלישוני ושטוף 3 x 1 שעות PBSTG בחדר קר עם תסיסה.
- השאר ב- PBS עד מוכן להרכבה על שקופיות מיקרוסקופ.
5. הרכבת פרוסות על שקופיות מיקרוסקופ
- הכינו שקופיות מיקרוסקופ רבות ככל שיהיו קטעים להרכבה.
- עבור כל שקופית, הניחו רצועה באורך 50 מ"מ של סרט ויניל חשמלי בעובי 10 מיל (254 מיקרומטר) על פיסת פרפילם.
- בעזרת ניקוב חורים בגודל 1 ס"מ על 1 ס"מ מרובע, ניקבו חור דרך מרכז הסרט החשמלי והפרפילם.
- משוך את הסרט מהסרט והנח אותו על גבי שקופית המיקרוסקופ, תוך השארת מקום לסרט תיוג על השקופית.
- בעזרת מיקרופיפטה, מניחים טיפה אחת או שתיים של אמצעי הרכבה נגד דהייה בחור המרובע במרכז הסרט החשמלי.
- השתמשו במרית מעוקלת כדי להרים את החלק הרצוי של כלי החיתוך הרוטט של הרקמה מה-PBSTG ולנדף היטב את הלחות בעזרת מגבון מעבדה נקי או פיסת נייר פילטר.
- געו בשולי הפרוסה עד לטיפת ההרכבה והשתמשו במרית אחרת כדי להחליק בעדינות את המקטע לתוך אמצעי ההרכבה.
- כסו את הקטע עם עוד כמה טיפות של mountant ובזהירות מניחים כיסוי 24 מ"מ x 30 מ"מ (#1.5 עובי) על גבי החלק ואת mountant.
- אטמו את שולי הכיסוי בלק כדי לשמור אותו במקומו.
6. מיקרוסקופ קונפוקלי של פרוסות מוח קבועות
- השתמש בפלואורסצנטיות בשדה רחב כדי למצוא גידולים פלואורסצנטיים בפרוסת המוח המותקנת באמצעות עדשת המטרה המתאימה וערכות המסנן.
הערה: גידולים מסוימים יכולים להיות גדולים למדי וניתן לראות אותם בקלות עם המטרה 4x, בעוד תאים בודדים עשויים לדרוש את המטרה 10x. - עבור למיקרוסקופ קונפוקלי באמצעות עדשה אובייקטיבית מתאימה, לייזר(ים), גודל חור סיכה והגדרות גלאי. כדי לעקוב אחר פרוטוקול זה, השתמש במטרה של 20x (צמצם מספרי [N.A.] = 0.75) עבור הדמיה שגרתית ומטרת שמן של 60x (N.A. = 1.40) עבור הדמיה ברזולוציה גבוהה.
- הגדר גבולות עליונים ותחתונים של ציר z וגודל צעד (למצב הספציפי על פי הוראות יצרן המיקרוסקופ הקונפוקלי) לרכישת מקטעים אופטיים. רכוש ערימת z של חלקים אופטיים.
- השתמש בתוכנת המיקרוסקופ הקונפוקלי כדי ליצור עיבוד נפח תלת ממדי של הגידול, בהתאם להוראות היצרן.
7. הכנת כדוריד
- יצירת לוחות פולי(2-הידרוקסיאתיל מתקרילט) (poly-HEMA)
- צור תמיסה של 10 מיקרוגרם/מ"ל פולי-HEMA באתנול 95%, וציפה צלחות פטרי 35 מ"מ (או צלחות תרבית תאים) ב-1 מ"ל של תמיסה זו.
- הניחו לכלים לשבת על נדנדה חשופה למשך הלילה בטמפרטורת החדר כדי לפתח ציפוי של משטח המנה.
הערה: הממס יתאדה וישאיר ציפוי שקוף על המנה, שעשוי להיראות לא אחיד, אך הדבר לא ישפיע על היכולת לייצר ספרואידים של תאים. - לאחר הייבוש, יש לעקר את הכלים הפתוחים תחת אור UV בארון בטיחות ביולוגית למשך שעה אחת. יש להחליף את העפעפיים לאחר העיקור. הכלים המצופים מוכנים כעת לשימוש.
- צביעת DiD פלואורסצנטית למיקרוסקופ בהילוך מהיר
הערה: סעיף זה מיועד לצביעת תאים בודדים בצבע פלואורסצנטי DiD לשימוש לייצור ספרואידים, אשר ממטב את ההדמיה של תנועתיות התא עבור הדמיה חיה בהילוך מהיר.- השהה את התאים במדיום תרבית ללא סרום.
- הוסף 5 μL של ציר DiD / מ"ל של תרחיף התא וערבב בעדינות על ידי pipetting. יש לדגור במשך 20 דקות בטמפרטורה של 37°C.
- צנטריפוגה את תרחיף התא המסומן ב 800 × גרם ב 5 ° C במשך 5 דקות.
- שאפו את הסופרנאטנט והשהו מחדש את התאים במדיה חמה כדי לשטוף.
- חזור על שלב זה של הצנטריפוגה ושטוף פעמיים נוספות.
הערה: אם תרצה, דלג לשלב 7.3.6 כדי ליצור ספרואידים מיד לאחר תהליך זה.
- ביצוע ספרואידים של תאים
- יש לחמם 0.25% תמיסת טריפסין/אתילאנדיאמין טטראצטי (EDTA) ל-37°C.
- תרבית GSCs במדיהGSC 17 (טבלה 1) ותאי גלוימה ממאירים U-118 (MG) בתווך תרבית U-118 (ראה טבלה 1). השתמש צלחת 10 ס"מ להכנת צלחת אחת 35 מ"מ של ספרואידים. הוסף גורמי גדילה bFGF (ריכוז סופי של 10 ננוגרם/מ"ל) ו-TGF-α (ריכוז סופי של 20 ננוגרם/מ"ל) ל-GSCs תחילה ולאחר מכן כל 3 ימים.
הערה: התאים ששימשו במחקר הנוכחי היו GSC15-2/K72 ירוק, GSC16-4/K72 ירוק, אדום U-118/L1LE/mCherry2x ואדום U-118/1879/mCherry2x. צלחת אחת של ספרואידים אמורה להספיק לשתי צלחות של 6 בארות של פרוסות מוח על תוספות ממברנה. - שטפו את התאים שעל הצלחות עם PBS סטרילי והניחו 1 מ"ל של תמיסת טריפסין על צלחת בקוטר 10 ס"מ. מניחים באינקובטור תרבית התאים למשך 2-3 דקות עד שהתאים מתחילים להתנתק.
- נטרלו את הטריפסין על ידי הוספת 10 מ"ל של תרבית מתאימה המכילה סרום לצלחת בקוטר 10 ס"מ ונתקו את התאים על ידי פיפטינג למעלה ולמטה. הכניסו את מתלה התא לצינור צנטריפוגה חרוטי בנפח 15 מ"ל.
- גלולה את התאים על ידי צנטריפוגה ב 800 × גרם במשך 5 דקות ב 4 ° C.
- שאפו את המדיה מכדורית התא והשעו מחדש את התאים ב -10 מ"ל של מדיה.
- הניחו 2 מ"ל של תרחיף תאים על כל צלחת מצופה פולי-HEMA בקוטר 35 מ"מ והוסיפו עוד 2 מ"ל של מדיה מתאימה כדי לקבל 4 מ"ל של מדיה כוללת לכל מנה. אם אתה משתמש ב- GSCs, הוסף גורמי גדילה.
- לדגור על התאים באינקובטור תאים עד שהאגרגטים מגיעים לגודל של 100-200 מיקרומטר, שיכול להיות 1-2 ימים בהתאם לצפיפות התאים שהיו מצופים.
8. דיסקציה מוחית של עובר אפרוח חי וחיתוך רקמות רוטט
- הכנה לדיסקציה
- הכינו פלטת הוספת קרום פוליאסטר 6 בארות עם 1 מ"ל של תרבית פרוסת מוח (ראה טבלה 1) מתחת לתוספת הממברנה.
- לעקר את אזור העבודה ואת הכלים עם 70% אתנול.
- הניחו את צלחת 6 הבארות על קרח בזמן שהדיסקציה מתרחשת.
- מכינים 100 מ"ל של חומר חיתוך רקמה רוטט (טבלה 1) ומניחים על קרח.
- הניחו בקבוקון של אגרוז נמס נמוך 4% ב-PBS באמבט מים עד שהוא נמס לנוזל (כ-50°C).
- מלאו את גיגית פרוסת הרקמה הרוטטת בקרח.
- דיסקציה מוחית של עובר אפרוח E14/15 אספטי
- בעזרת נר ביצה, עקבו בעיפרון אחר היקף כיס האוויר שמעל לעובר E14 או E15 וכסו את האזור המתואר בסרט שקוף.
- בעזרת מספריים מעוקלים או עדינים, חותכים בעדינות סביב האזור העוקב, נזהרים לא לחתוך לתוך קרום העובר או כלי הדם, ולהשליך את פיסת הקליפה העליונה.
- בעזרת מלקחיים מעוקלים, הסירו את קרום חלל האוויר מעל חלקו העליון של העובר ואתרו את ראשו של עובר האפרוח.
- ערפו את ראשו של העובר והניחו את הראש בכלי בקוטר 10 ס"מ עם תמיסת CMF סטרילית קרה. ראו איור משלים 2.
- באמצעות מלקחיים עדינים סטריליים, לקלף את העור המכסה את המוח כדי לחשוף את dura mater הבסיסי. הסר את עצמות הגולגולת היוצרות בצד שמאל וימין של המוח. עצמות הגולגולת היוצרות עדיין אינן מכסות את רוב המוח.
- השתמש בעדינות במלקחיים מחודדים עדינים (#5 או #55) כדי לקרוע את קרומי המוח שמעל מרכז המוח ולקלף אותו לכל צד כדי לחשוף את המוח.
- בעזרת מלקחיים מעוקלים עדינים, גרפו את המוח למעלה מהחזית התחתונה ומשכו אותו בעדינות מתוך החלל שלו.
- נתחו את המוח לשלושת חלקיו העיקריים: המוח הקדמי, המוח התיכון (אופטי טקטה), המוח הקטן. התייעצו עם אטלס של התפתחות אפרוחים, במידת הצורך.
- הסר את הפיה מאטר שמעל הטקטה באמצעות מלקחיים עדינים.
הערה: ה-pia נפרד בקלות מהטקטה, אך לא מהמוח הקדמי או מהמוח הקטן. ניתן להסיר את הפיאה מהמוח הקדמי על ידי נגיעה בה או גלגול על גזה סטרילית. - הניחו את אזורי המוח המנותחים בכלי סטרילי קטן על קרח.
- הטבעה וחיתוך של המוח
- בעזרת מלקחיים מעוקלים ככף מדידה, הרימו בעדינות את הטקטום האופטי או את אזור המוח הקדמי וכתם מעט על גזה סטרילית כדי להסיר נוזל נוסף כדי להבטיח הידבקות של האגרוז לפני השטח החיצוניים של המוח.
- באמצעות פיפטה העברה סטרילית, למלא את התבנית עם agarose נמס נמוך. הכינו תבנית פשוטה על ידי יצירת רדיד אלומיניום סביב חפץ בגודל מתאים. גוש חיתוך הרקמה הרוטטת הקטן מלבני מתכת משמש באופן שגרתי כאובייקט. ראו תרשים משלים 3.
- מקם במהירות את אזור המוח באגרוז ותן לו להתמצק (בערך 4-5 דקות) על קרח.
הערה: המוח עלול לשקוע לתחתית התבנית לפני שהאגרוז מתקשה. אם זה קורה, המתן דקה אחת כדי לתת לאגר להתחיל לשקוע, ולאחר מכן הכנס את אזור המוח לתוך האגרוז. נסו להשעות את אזור המוח ישירות באמצע האגרוז. - הסר את רדיד האלומיניום מסביב למוח המוטבע באגרוז המוצק וחתוך את עודפי האגרוז סביב הצדדים באמצעות סכין גילוח סטרילי או אזמל.
- מניחים טיפה של דבק ציאנואקרילט על ריבוע הנירוסטה של הצלחת/מגש הפריסה, מניחים את גוש האגרוז עם המוח ונותנים לדבק להיקשר למשך דקה. מניחים את המנה/מגש בצ'אק פרוסת הרקמה הרוטט, מהדקים וממלאים את המגש במדיה חותכת כדי לכסות את החלק העליון של גוש האגרוז.
- חתכו את המקטעים על חותך רקמות רוטט ב 250-350 מיקרומטר באמצעות סכין ספיר, אשר דווח כי לגרום פחות נזק לרקמות חיות מאשר סכין גילוח פלדה.
- כאשר פרוסות המוח נחתכות וצפות בחופשיות לתוך מגש הפריסה, השתמשו במרית סטרילית כדי לגרוף ולהסיר את הפרוסה מהמגש. החליקו בעדינות את החלק מהמרית אל תוך ממברנה בעזרת מרית סטרילית נוספת.
הערה: בדרך כלל, ניתן להניח שתיים או שלוש פרוסות מוח על כל ממברנה, אם רוצים. האגרוז המקיף את פרוסת המוח עלול להתנתק אם המוח אינו מכוסה מספיק בגזה סטרילית כדי להסיר נוזלים עודפים. אם זה עדיין קורה לאחר הדבקה מספקת לפני ההטבעה, הרימו בעדינות את הפרוסה ללא האגרוז שמסביב והחליקו אותה על תוספת הממברנה. - הניחו את צלחת 6 הבארות של פרוסות המוח על תוספות ממברנה באינקובטור תרבית התא בטמפרטורה של 37°C ו-5% CO2.
- יום לאחר הציפוי, השתמשו בפיפטת פסטר סטרילית כדי לשאוף את המדיה מתחת לאינסרט (יש רווחים בצידי התוספות כדי לאפשר לפיפטה לקבל גישה למדיה שמתחת). הוסף 1 מ"ל של מדיה פרוסה טרייה לכל באר מתחת לתוספת הממברנה. המשיכו להחליף מדיה כל יומיים לאחר מכן.
- המתינו מספר ימים עד שפרוסות המוח יתחברו היטב לתוספות הממברנה וייראו כאילו הן משתטחות מעט. זהו סימן לכך שהפרוסות בנות קיימא ומוכנות להכנסת תאי GBM.
9. החדרת תאי GBM לפרוסות מוח
- שיטת הספרואיד
- לאחר שספרואידים התא הגיעו לגודל של 150-200 מיקרומטר, השתמש במיקרופיפטה של 20 μL המוגדרת ל -5 μL כדי להסיר אחד עד כמה ספרואידים מצלחת התרבית שלהם. ראו תרשים משלים 3.
- מוציאים בעדינות את המדיה עם ספרואידים אל פרוסת המוח הרצויה.
הערה: כדורי התא צריכים להיות גלויים בקצה פיפטה. שימוש בקצה פיפטה שקוף יקל על ראייתם בקצה. אם הספרואיד נופל מפרוסת המוח כאשר הנוזל משתחרר, יש להשתמש בריסים מעוקרים באתנול המודבקים למקל אפליקטור עץ דק כדי לדחוף בעדינות את הספרואיד בחזרה אל פרוסת המוח. - אפשר את הספרואידים לתרבית על פרוסות המוח במשך 2-5 ימים.
הערה: נראה שהמגבלה כאן היא בסופו של דבר השפלה של כלי הדם ותאי המוח בפרוסה. כלי דם מפורקים יופיעו ככדורים לא רציפים בפרוסה כאשר הם מוכתמים בלמינין.
- שיטת ניקוב ביופסיה
- תנו לפרוסות המוח להתחבר על ידי כך שנראה שהן משתטחות על תוספת הממברנה (עשוי לקחת 2-5 ימים בתרבית).
- הפשירו את מטריצת התא על קרח.
- בארון הבטיחות הביולוגית של תרבית התא, חברו ניקוב ביופסיה סטרילי בקוטר 1 מ"מ לצינור שואב ואקום.
- געו בעדינות בפרוסת המוח עם ניקוב הביופסיה כדי ליצור חור של 1 מ"מ במרכז פרוסת המוח.
הערה: הרקמה בניקוב הביופסיה תישאף לתוך האגרוף על ידי הוואקום. - להכין השעיה מטריצת התא על ידי טריפסינזציה של צלחת 60%-70% 10 ס"מ של תאים והשעיה מחדש ב 10 מ"ל של מדיה; לאחר מכן, מערבבים 1 מ"ל של המתלה הזה עם 100 μL של מטריצה.
- באמצעות מיקרופיפטה של 20 μL, מניחים 1 μL של תערובת מטריצת התא בכל חור בפרוסות המוח.
- לאחר סיום מיקום תערובת התאים, הניחו את צלחת פרוסות המוח עם התאים המשובצים בחזרה לאינקובטור, ואפשרו למטריצה להתמצק ולתאים לפלוש פוטנציאלית לפרוסת המוח שמסביב.
10. מיקרוסקופ פלואורסצנטי רחב טווח
- מניחים סרט נשלף סביב קצה צלחת 6 בארות כדי למנוע אידוי של התקשורת, משאיר רווח קטן בצד אחד להחלפת גז.
- הניחו את הצלחות בתא תרבית מותאם אישית על במה אוטומטית מתכווננת במיקרוסקופ אפיפלואורסצנטי הפוך.
הערה: התא נשמר בתנאים אטמוספריים של 5% CO2 ו 95% אוויר באמצעות בקר הזרקת גז, והטמפרטורה נשמרה על 37 ° C עם בקר טמפרטורת אוויר חם ותוספת שלב מבוקרת טמפרטורה. ראה Fotos et al.18 לפרטים על המערכת המשמשת כאן. - באמצעות תוכנת בקרת מיקרוסקופ מתאימה, צור לוח זמנים לרכישה בהילוך מהיר שאוסף תמונות פלורסנט של תחומי העניין אחת ל-10 דקות למשך 20 שעות.
הערה: אם משתמשים בתווית פלואורסצנטית ירוקה בתאים (למשל, חלבון פלואורסצנטי ירוק [GFP]), השתמש בכמות המינימלית של אור עירור כחול הדרושה כדי לדמיין את התאים כדי למנוע רעילות לאור. נראה כי תוויות אדומות (למשל, mCherry) ואדומות רחוקות (למשל, DiD) אינן מכילות בעיה פוטנציאלית זו עקב עירור אורכי גל ארוכים יותר.
11. צביעת חיסון, פרוסות מוח לאחר מיקרוסקופ בהילוך מהיר
הערה: פרוטוקול חיסוני זה ממוטב להכתמת כלי דם עם למינין וגרעינים עם ביסבנזימיד. השתמש נוגדנים מתאימים עבור המולקולות הרצויות של עניין.
- שאפו את המדיה מתחת לתוספת הממברנה באמצעות פיפטה של פסטר, והניחו 1 מ"ל של 2% PFA במאגר נתרן קקודיל 0.1 M מתחת לאינסרט ו-1 מ"ל מעל האינסרט כדי לכסות את פרוסת המוח. תן את פרוסות לתקן לילה ב 4 °C (75 °F).
- הסר את הקיבוע מתחת לממברנה וכל קיבוע שנותר על פרוסת המוח (קיבוע נוטה לדלוף דרך ממברנה מוכנס לתוך הבאר שמתחת).
- מוציאים את הפרוסות מהבאר בקוטר 35 מ"מ ומניחים אותן בכלי פלסטיק גדול יותר.
- הכינו צלחת של 24 בארות על ידי הוספת 350 μL של PBS לתוך בארות רבות ככל שיש פרוסות מוח (פרוסה אחת / באר בעת immunostaining).
- בעזרת מרית דקה, מוציאים בעדינות את האגרוז מסביב לפרוסת המוח מבלי לנתק את פרוסת המוח מהחדרת הממברנה. ודאו שהאגרוז מתנתק מהקצה החיצוני של פרוסת המוח בקלות. אם לא, השאירו את האגרוז מחובר לפרוסת המוח.
- בעזרת אזמל חד, חותכים דרך הקרום סביב פרוסת המוח עד שהפרוסה עם הקרום שמתחתיה פנויה משאר האינווסט. הרימו את הממברנה עם פרוסת המוח המצורפת, השתמשו במלקחיים עדינים כדי לתפוס את הממברנה, והניחו אותה בבאר של צלחת 24 בארות ב- PBS.
- שטפו את הפרוסות 3 פעמים עם PBS במשך שעה בחדר הקר עם תסיסה עדינה מתמדת או נדנוד, כך שהפרוסה תנוע בתוך הבאר.
- בזמן השטיפה, הכינו את תמיסת הנוגדנים העיקרית.
- לדלל אנטי-למינין ל-2 מיקרוגרם/מ"ל ב-PBSTG (ראה טבלה 1).
- הוציאו את PBS מהבארות ודגרו לילה בתמיסת נוגדנים ראשונית בחדר קר עם תסיסה עדינה.
- לאחר לפחות 20 שעות של דגירה, יש לשאוף את תמיסת הנוגדנים הראשונית ולשטוף את המקטעים 3x במשך שעה אחת ב-PBSTG.
- בזמן השטיפה, להכין את פתרון נוגדנים משני.
- לדלל פלואורסצנטי-GAM עם פלואורוכרום ספציפי הדרוש לדילול 1:200 ב- PBSTG יחד עם ריכוז של 0.1 מיקרוגרם / מ"ל של ביסבנזימיד.
- הסר PBSTG ודגור לילה בחדר קר עם תסיסה בתמיסת נוגדנים משניים פלואורסצנטיים.
- יש להסיר את הנוגדן המשני ולשטוף 2x במשך שעה ב-PBSTG ו-1x מעל שעה ב-PBS.
- השאר ב- PBS עד מוכן להרכבה על שקופיות מיקרוסקופ (סעיף 5) והצג.
תוצאות
מוצגים כאן נתונים רבים שמראים כמה תוצאות מייצגות שהתקבלו מביצוע זריקות in vivo לתוך הטקטום האופטי (איור 1 ואיור 2), גידול פרוסות מוח חיות והערכת הכדאיות שלהן (איור 3), יצירת תרביות פרוסות מוח ex vivo והשתלת תאים המסומנים באופן פלואורסצנטי באמצעות שיטת ניקוב הביופסיה (איור 4), יצירת ספרואידים של תאים על-ידי תרבית תאים על פולי-HEMA (איור 5), יצירת תרביות משותפות של פרוסות מוח Ex vivo עם ספרואידים של תאים ורישום התנהגות התא הפולשנית באמצעות מיקרוסקופ קונפוקלי 4D בהילוך מהיר (איור 6), וניתוח התנהגות תאים פולשנית מספרואידים ביחס לכלי דם בתכשירים קבועים של פרוסות מוח (איור 7 ואיור 8). תוצאות אלה אינן ממצות, אלא מספקות דוגמאות טובות למה שניתן להשיג באמצעות מוח עובר אפרוח כמודל xenograft לחקר GBM בבני אדם.
איור 1 מראה כמה תוצאות מייצגות של גידולים שנוצרו בטקטום האופטי in vivo לאחר הזרקת GSCs המבטאים GFP. GSCs נצמדים לפני השטח של החדר ויוצרים גידולים פולשניים בדופן המוח. GSCs שוכנים בבירור ליד כלי דם ונראה שהם נודדים לאורכם. סרטים של עיבודי נפח תלת-ממדיים מסתובבים של פרוסות קבועות ומוכתמות חיסון של גידולי GSC in vivo ניתנים ב- Supplementary Video S1, Supplementary Video S2, Supplementary Video S3 ו- Supplementary Video S4. בניסוי זה נעשה שימוש בארבעה צבעים כדי לזהות חמש תכונות (GSCs ירוקים, גרעינים לבנים, כלי דם לבנים, אינטגרין אלפא-6 כחול, ו-Sox2 אדום או נסטין אדום).
איור 2 מראה כמה תוצאות מייצגות של גידולים שנוצרו בטקטום האופטי in vivo לאחר הזרקת GSCs המבטאים GFP מעורבב עם תאי U-118/L1LE2 המבטאים mCherry עקב התמרה וקטורית רטרו-ויראלית. ניסויים אלה גילו כי כאשר גידולים אלה נוצרו מתרחיף של תאים מעורבים, המיון התרחש כך שתאי GSC שכנו בפריפריה או במרכז, בעוד שתאי U-118 כללו ליבה פנימית או קליפת מוח חיצונית, בהתאם לקו GSC הספציפי.
איור 3 מראה תוצאות כדאיות של תרביות פרוסות מוח ex vivo . לאחר שבוע בתרבית, קיבוע וצביעת מערכת החיסון ללמינין חשפו כלי דם שלמים רבים ואת הביטוי של Sox2, שניהם שימשו כאן כדי להדגים את הכדאיות של פרוסת המוח. זה הראה כי פרוסות מוח של עוברי אפרוח יכולות להיות בתרבית על תוספות קרום במשך כשבועיים ולהישאר בנות קיימא עם כלי דם המופיעים באופן תקין וביטוי גורמי שעתוק.
איור 4 מראה את התוצאות של החדרת "תקעים" של תאי U-118/L1LE/mCherry אדומים (מעורבבים עם מטריצה) לתוך פרוסות מוח ex vivo לאחר יצירת חללים בפרוסות בשיטת ניקוב הביופסיה. תאי U-118 פלשו בבירור לרקמת המוח, לעתים באופן נרחב, ולעתים קרובות לאורך כלי הדם. עם זאת, פלישת התאים לא הייתה אחידה סביב היקף התאים שהוכנסו. לעיתים גם כלי דם הופיעו פגומים או נעדרים בפרוסות מסוימות, ככל הנראה בשל הטראומה הנוספת של שיטת הניקוב או משך הזמן בתרבית. זה הראה כי ניתן להשתמש בשיטת ניקוב הביופסיה / תקע תאים כדי להחדיר תאי GBM למקומות ספציפיים בפרוסת מוח אקס ויוו בתרבית, שם התאים פולשים לפרוסת המוח.
איור 5 מראה ספרואידים חיים בתרבית וכמה דוגמאות של פלואורסצנטיות שדה רחב של ספרואידים חיים של תאי GBM שהוכנסו לפרוסות מוח ex vivo לצורך ניסויים בהילוך מהיר. סרטים של פלישת תאים מהספרואידים לתוך פרוסת המוח ניתנים בסרטון משלים S5 ובסרטון משלים S6 . זה הראה כי ספרואידים של תאים הם שיטה מוצלחת נוספת של החדרת תאי GBM או GSCs למיקומים ספציפיים של פרוסת מוח ex vivo , והתנהגות תאים פולשנית יכולה להיות מנוטרת על ידי מיקרוסקופ פלואורסצנטי שדה רחב, אם כי הרזולוציה של תאים בודדים יכולה להיות גרועה.
איור 6 מראה תמונות סטטיות של ניסויים בהילוך מהיר קונפוקלי של פלישה חיה של תאי GSC16-4/GFP ו-U-118/L1LE/mCherry לתוך פרוסות מוח. תמונות קונפוקליות מסוג z-stack נרכשו כל 10 דקות במשך 20 שעות בניסוי רב-נקודתי בהילוך מהיר. סרטים של פלישת תאים מהספרואידים לפרוסות מוח שצולמו כערימות z קונפוקליות לאורך זמן מוצגים בסרטון משלים S7, וידאו משלים S8, וידאו משלים S9, וידאו משלים S10 ווידאו משלים S11. ניסוי זה גילה כי הדמיה קונפוקלית בהילוך מהיר עדיפה על פלואורסצנטיות שדה רחב למעקב אחר התנהגות פולשנית של תאים בודדים. תאי U-118/L1LE היו פולשניים יותר באופן ניכר מאשר תאי GSC בתנאים אלה. הדבר ניכר אפילו בתמונות הסטטיות, כאשר תאי ה-GSC ממוקמים באופן מרכזי יותר ותאי ה-U-118 מפוזרים יותר.
איור 7 מראה כמה דוגמאות של תכשירי פרוסת מוח/ספרואידים אקס-ויווו , שבהם שני ספרואידים שונים המסומנים בנפרד (U-118/L1LE/mCherry spheroids ו-GSC16-4/GFP spheroids) הונחו על פרוסות מוח, גודלו במשך מספר ימים, ולאחר מכן תוקנו, הוכתמו כמוכתם ללמינין וצולמו על-ידי חתך אופטי במיקרוסקופ קונפוקלי. זה גילה ששני סוגי התאים פלשו לפרוסת המוח ונעו לאורך כלי הדם. כאשר הסוגים השונים של הספרואידים היו קרובים מספיק כדי ליצור קשר זה עם זה, נראה הייתה פלישה מועטה, אם בכלל, של סוג תא אחד לתוך הספרואיד של סוג התא השני, והספרואידים נותרו מופרדים.
איור 8 מראה כמה דוגמאות של תכשירי פרוסת מוח/ספרואידים אקס-ויוו שבהם ספרואידים מסוג "תא מעורב" שנוצרו בתרבית באמצעות שני סוגי תאים בעלי תווית שונה (U-118/L1LE/mCherry מעורבבים עם GSC16-4/GFP) הונחו על פרוסות מוח, גודלו במשך מספר ימים, ולאחר מכן תוקנו, הוכתמו כמוכתם ללמינין וצולמו באמצעות חתך אופטי במיקרוסקופ קונפוקלי. זה גילה כי תאי U-118/L1LE/mCherry האדומים נדדו החוצה מהספרואידים והתפזרו בצורה הרבה יותר ברורה מאשר תאי GSC16-4/GFP הירוקים, שנטו להישאר בגושים ליד מרכז הספרואידים. בנוסף, תאי U-118/L1LE/mCherry הוכתמו גם הם ב-DiD כך שניתן היה להשוות ישירות בין שתי התוויות הנפרדות (mCherry ו-DiD) בתכשירים הקבועים ex vivo . תווית DiD עדיין יכולה להיות מזוהה, אפילו בתאים בודדים שפלשו לפרוסת המוח; עם זאת, זה היה כמו puncta תאי.
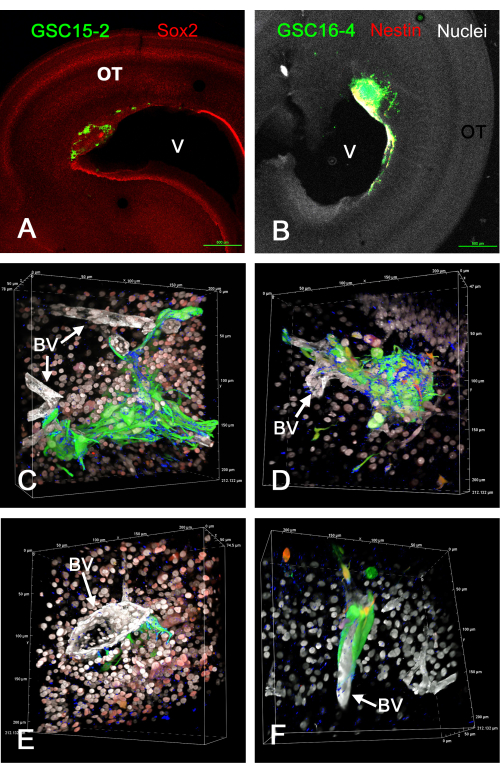
איור 1: גידולים ב-E15 כתוצאה מהזרקת GSCs לתוך E5 אופטי טקטום in vivo. GSCs הם ירוקים עקב ביטוי GFP. תאי GSC15-2 מוצגים בלוחות A, C ו- E, ותאי GSC16-4 מוצגים בלוחות B, D ו- F. (A) מבט בהגדלה נמוכה של טקטום אופטי עם גידול ליד החדר (V). צביעת Sox2 מוצגת באדום, אשר מכתים את רוב גרעיני תאי OT. (B) תמונה דומה ל-A אך עם תאי GSC16-4 שגם הם מוכתמים עבור נסטין באדום, שיכולים להופיע צהובים או לבנים בתמונה עקב ערבוב צבעים וחשיפת תמונה. גרעיני OT נראים לבנים עקב צביעה נגדית עם ביסבנזימיד. (ג-ו) פרספקטיבות שונות של עיבודי נפח המופקים מערימות z באמצעות מטרה של טבילת שמן 60x. גרעיני התא נראים לבנים עקב צביעת ביסבנזימיד, וחלקם מופיעים באדום בלוחות C ו-E עקב צביעה חיסונית עבור Sox2. צביעה אדומה בלוחות D ו-F היא מצביעה לקנין. שימו לב שבגלל "מיזוג אלפא" לעיבודי נפח בתוכנת המיקרוסקופ הקונפוקלי, הצבעים אינם מתמזגים כפי שהיו מתמזגים באמצעות הקרנה בעוצמה מרבית, והצבע הנפוץ ביותר שולט ומטשטש את הצבע הפחות עז. כלי הדם מוכתמים בלבן עקב אימונוסטיין למינין. צביעת סמן GSC integrin alpha-6 מוצגת בכחול, ונראית מנוקבת על משטחי GSC. קשקשי מיקרון מוצגים לאורך הקצוות של עיבודי אמצעי האחסון. סרטונים של סיבובים של עיבודי נפח בלוחות C-F מוצגים ב- Supplementary Video S1, Supplementary Video S2, Supplementary Video S3 ו - Supplementary Video S4. פסי קנה מידה = 500 מיקרומטר (A,B). קיצורים: GSCs = תאי גזע גליובלסטומה; OT = טקטום אופטי; GFP = חלבון פלואורסצנטי ירוק; BV = כלי דם. אנא לחץ כאן כדי להציג גרסה גדולה יותר של איור זה.
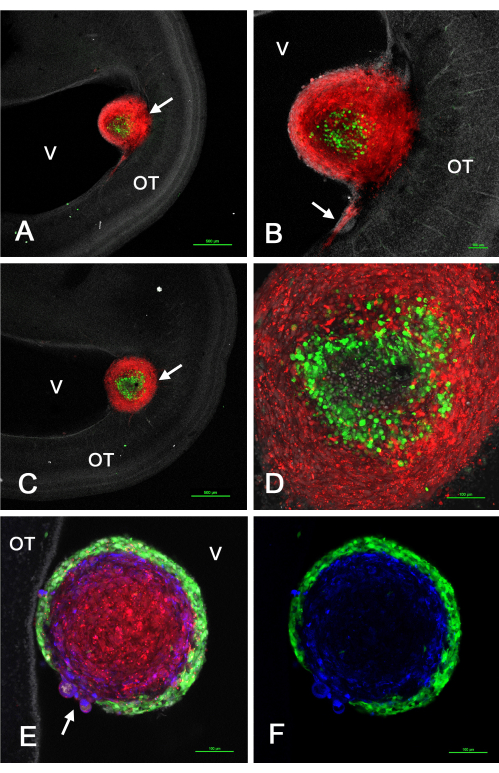
איור 2: גידולים ב-E15 כתוצאה מתערובת של GSCs ותאי U-118GBM שהוזרקו לטקטום אופטי E5. תאי GSC ירוקים עקב ביטוי GFP ותאי U-118/L1LE אדומים עקב ביטוי mCherry. GSC15-2 מוצגים בלוחות A-D, ו-GSC16-4 מוצגים בלוחות E ו-F. (A) מישור z יחיד קונפוקלי בהגדלה נמוכה של גידול תאי מעורב (חץ) ליד החדר. גרעינים מוכתמים בלבן עם ביסבנזימיד. (B) הגדלה גבוהה יותר (פי 10 אובייקטיבית) של הגידול המוצגת ב-A עם פלישה של תאי U-118 אדומים לתוך ה-OT ליד פני החדר. (C) מישור שונה במקצת של חתך אופטי מזה שב-A המראה את הגידול (החץ) המשובץ עמוק יותר בדופן ה-OT. (D) הקרנה מקסימלית (20x אובייקטיבית) של מישורי z מרובים של הגידול ב-C המראים פרטים של התאים הממוינים בתוך הגידול. (E) תמונה בודדת של מישור z (20x אובייקטיבי) של גידול מעורב עם תאי GSC16-4, המראה כי המיון בתוך הגידול התרחש בתבנית הפוכה מתאי GSC15-2, כאשר ה-GSCs הירוקים יוצרים קליפת מוח דקה ואחידה המקיפה את תאי U-118 האדומים. אזור החיבור של הגידול לדופן OT אינו מוצג במישור z זה. שימו לב לאזור הגידול שבו יש חוסר רציפות של קליפת המוח GSC עם תאי U-118/L1LE בולטים דרכו (חץ). Immunostaining עבור L1CAM מוצג בכחול. (F) אותה תמונה כמו ב-E, אך מציגה רק את ה-GSCs הירוקים ואת צביעת L1CAM הכחולה. פסי קנה מידה = 500 מיקרומטר (A,C), 100 מיקרומטר (B,D,E,F). קיצורים: GSCs = תאי גזע גליובלסטומה; OT = טקטום אופטי; GFP = חלבון פלואורסצנטי ירוק; V = חדר. אנא לחץ כאן כדי להציג גרסה גדולה יותר של איור זה.
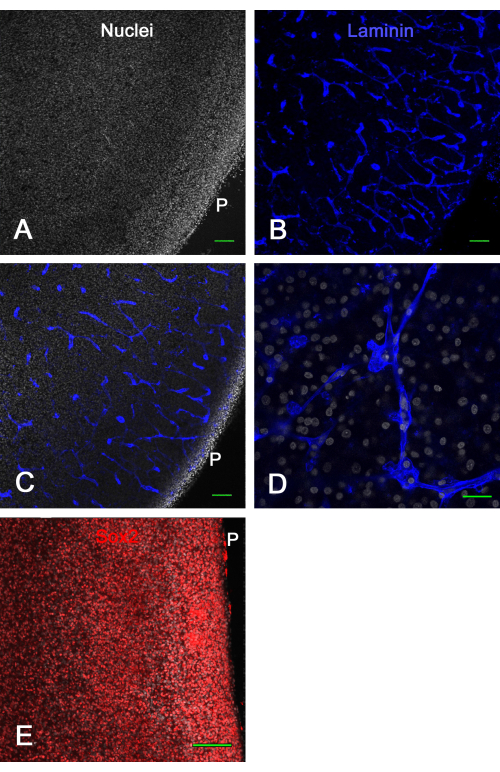
איור 3: הכדאיות של פרוסות טקטום אופטיות ex vivo לאחר שבוע אחד בתרבית. פרוסות טקטום אופטיות E14 גודלו בתרבית על תוספות ממברנה במשך שבוע ולאחר מכן תוקנו והוכתמו כמוכתם חיסון. בתמונות A ו-B מוצגות תמונות קונפוקליות (אובייקטיביות פי 10) של פרוסת מוח מוכתמת עבור גרעינים עם ביסבנזימיד (A) ומוכתמת חיסון עבור למינין (B), אשר מראה בבירור כלי דם תקינים ושלמים חתוכים אופטית בתצורות שונות בזכות צביעת הלמינין. (C) תמונה קונפוקלית דומה לזו המוצגת בלוחות A ו-B, שבהם נראים גרעינים וצביעת למינין. (D) תמונה קונפוקלית בהגדלה גבוהה יותר (פי 60 מטרת שמן) המציגה פרטים של צביעה גרעינית ולמינין. (E) תמונת הקרנה מקסימלית של מחסנית z קונפוקלית (20x אובייקטיבית) של פרוסת מוח מוכתמת עבור גורם שעתוק Sox2 בגרעינים אדומים וסך הכל גרעינים עם ביסבנזימיד בלבן. שימו לב שרוב הגרעינים מציגים צביעת Sox2, כפי שמוצג in vivo (ראו איור 1). פסי קנה מידה = 100 מיקרומטר (A,B,C,E), 25 מיקרומטר (D). קיצור: P = משטח pial. אנא לחץ כאן כדי להציג גרסה גדולה יותר של איור זה.
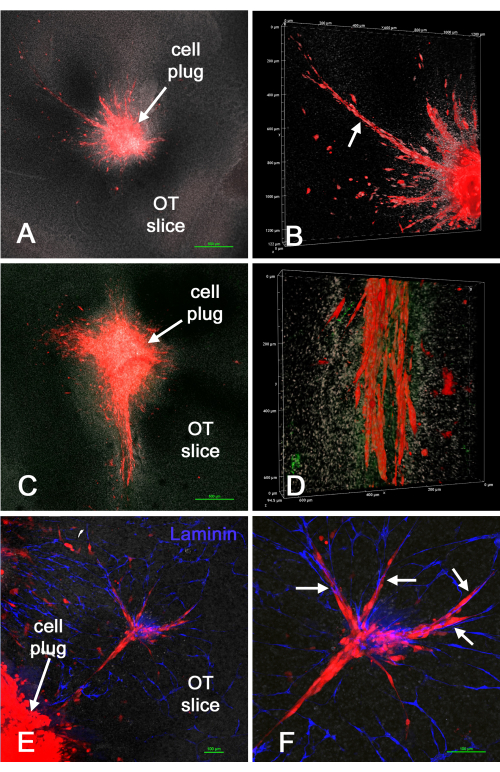
איור 4: תאי U-118/mCherry שהוכנסו לפרוסת מוח ex vivo באמצעות שיטת ניקוב הביופסיה. חללים נוצרו בפרוסות מוח באמצעות ניקוב ביופסיה של 1 מ"מ, ולאחר מכן תאי U-118/L1LE/mCherry אדומים מעורבבים עם מטריצה הושתלו כ"תקע". לאחר מספר ימים, פרוסות המוח תוקנו, הוכתמו ללמינין, והורכבו על שקופיות לניתוח מיקרוסקופ קונפוקלי. לוחות A ו-C מציגים תמונות במישור Z יחיד בהגדלה נמוכה, קונפוקליות (4x אובייקטיביות) של ה"גידול" שנוצר והתאים הסובבים אותו שפלשו לפרוסת המוח. (B) עיבוד נפח של ערימת z מההכנה בלוח A בהגדלה גבוהה יותר (יעד של פי 20), המראה פלישה נרחבת לתאי U-118 (חץ). (D) התמונה מציגה עיבוד נפח דומה של החלק התחתון של התאים הפולשים באופן נרחב המוצג בלוח C. כתמי למינין מוצגים בירוק, אך לא נראים כלי דם ברורים. (E) התמונה מראה חלק מתקע התא וקבוצת תאים שפלשו לפרוסת המוח, יחד עם צביעת למינין של כלי דם בכחול. (F) הגדלה גבוהה יותר של התאים הפולשים המוצגת בלוח E, וניתן לראות בבירור תאים מיושרים לאורך כלי הדם (חיצים). כל הלוחות מראים צביעת נגד גרעינית לבנה עם ביסבנזימיד. פסי קנה מידה = 500 מיקרומטר (A,C), 100 מיקרומטר (E,F). קנה המידה לחלוניות B ו- D הוא לאורך צירי עיבוד אמצעי האחסון. קיצור: OT = טקטום אופטי. אנא לחץ כאן כדי להציג גרסה גדולה יותר של איור זה.

איור 5: ספרואידים של תאים חיים בתרבית ותמונות פלואורסצנטיות רחבות שדה של תאי GBM חיים בפרוסות מוח ex vivo. בלוחות A ו-B מוצגות תמונות ניגודיות פאזה (באמצעות מטרה של 10x במיקרוסקופ הפוך) של תאי GBM U-118/L1LE (A) ו-GSCs (B) הגדלים כספרואידים (חצים). ברקע של לוח A מוצג חוסר אחידות מחוץ למיקוד של ציפוי poly-HEMA שיכול להתרחש על צלחת תרבית התא. בפאנלים C-F מוצגות תמונות פלואורסצנטיות רחבות שדה של ספרואידים של תאי U-118/L1LE ותאים פולשים (חצים) במהלך ניסוי בהילוך מהיר כדי לנטר את ההתנהגות החיה של פלישה לתוך פרוסות ex vivo (באמצעות מטרה של פי 20 במערכת מיקרוסקופ מותאמת אישית בהילוך מהיר18). בלוחות C ו-E התאים מוכתמים בצבע קרום פלואורסצנטי אדום רחוק DiD, ובלוחות D ו-F התאים מצולמים באמצעות ביטוי הדובדבן האדום שלהם. פסי קנה מידה = 100 מיקרומטר. סרטונים של ניסויי קיטועי זמן פלואורסצנטיים בשדה רחב המוצגים בלוחות C ו-D ממוקמים ב-Supplementary Video S5 וב-Supplementary Video S6, בהתאמה. קיצורים: GBM = גליובלסטומה; GSCs = תאי גזע GBM; S = ספרואיד. אנא לחץ כאן כדי להציג גרסה גדולה יותר של איור זה.
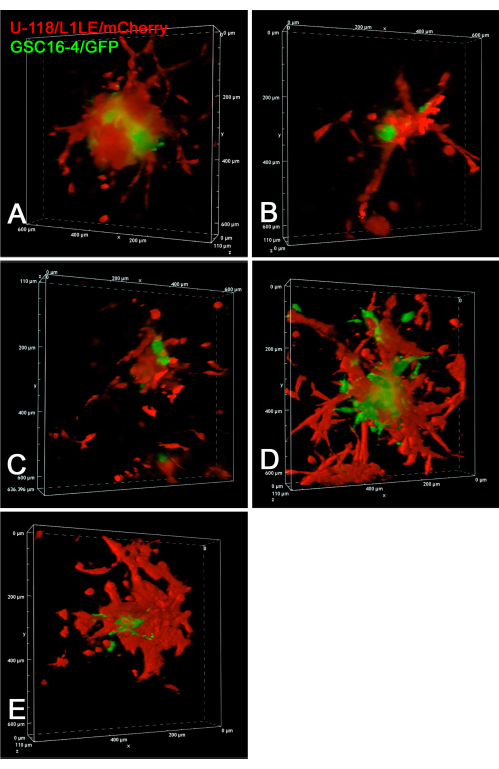
איור 6: נפח עיבוד תמונות של קיטועי זמן קונפוקליים 4D של GSCs חיים ותאי GBM. בכל החלוניות מוצגות תמונות נקודת הקצה של חמש חריטות ספרואידים שונות של תאים מעורבים על פרוסות מוח נפרדות. עבור לוחות A-E, תמונות מחסנית z קונפוקלית נרכשו בצעדים של 10 מיקרומטר כל 10 דקות במשך תקופה של 20 שעות. ההכנות כללו פרוסות מוח עם תאים מעורבים מושתלים של תאי U-118/L1LE/mCherry אדומים ותאי GSC16-4/GFP ירוקים. תמונות קונפוקליות צולמו בזמן שפרוסות מוח תורבתו על תוספות קרום בצלחת תרבית תאי פלסטיק בת 6 בארות באמצעות עדשה אובייקטיבית 20x (מרחק עבודה ארוך במיוחד (ELWD) (0.45 NA), שסיפקה את מרחק העבודה הנוסף הדרוש. עיבודי נפח נוצרו באמצעות תוכנת מיקרוסקופ קונפוקלי "אלפא מיזוג", אשר נותן אפקט 3D לכאורה. סרטוני קיטועי זמן של עיבודי נפח קונפוקליים אלה לאורך זמן מוצגים ב- Supplementary Video S7, Supplementary Video S8, Supplementary Video S9, Supplementary Video S10 ו- Supplementary Video S11. קיצורים: GBM = גליובלסטומה; GSCs = תאי גזע GBM; GFP = חלבון פלואורסצנטי ירוק; NA = צמצם מספרי. אנא לחץ כאן כדי להציג גרסה גדולה יותר של איור זה.
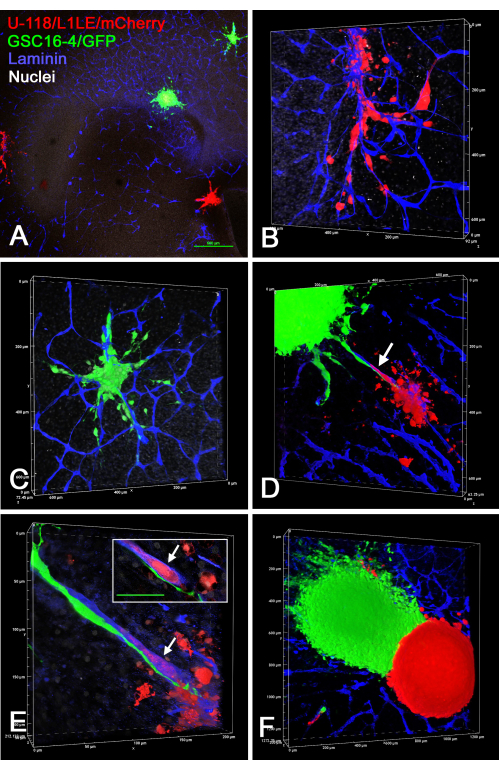
איור 7: תמונות קונפוקליות של פרוסות מוח קבועות עם תאי GBM פולשניים מספרואידים מסוגי תאים שונים. ספרואידים ירוקים הורכבו מתאי GSC16-4/GFP וספרואידים אדומים הורכבו מתאי U-118/L1LE/mCherry. בפאנלים A-F מוצגות תצוגות שונות של פרוסות מוח, שעליהן תורבתו מספר ספרואידים אדומים וירוקים במשך מספר ימים לפני קיבוע וצביעת מערכת החיסון עבור למינין (כחול). לוחות A-C הם מאותה פרוסת OT שבה A נלקח עם מטרה 4x, ולוחות B ו-C הם עיבודי נפח הגדלה גבוהים יותר (20x אובייקטיביים) של תאים שפלשו לפרוסת המוח משני הספרואידים המוצגים בלוח A. שני סוגי התאים פלשו בבירור לרקמות לאורך כלי הדם. לוח D מראה עיבוד נפח (20x אובייקטיבי) של פרוסת מוח אחרת שבה שני ספרואידים שונים היו ממוקמים קרוב זה לזה, ותאים משניהם נראים נודדים לאורך אותו כלי דם הממוקם ביניהם (חץ). לוח E הוא נפח הגדלה גבוהה (פי 60 מטרת שמן) החושף כי התאים הירוקים נודדים לאורך פני השטח החיצוניים של כלי הדם, בעוד שהתא האדום נודד בתוך כלי הדם (חץ). הכניסה מראה חתך אופטי יחיד במישור z, שבו התא האדום מוקף בבירור בכתמים כחולים של כלי הדם (חץ), והתא הירוק נמצא בבירור מחוץ לכלי הדם. סרגל קנה מידה בכניסה = 50 מיקרומטר. לוח F מציג עיבוד נפח (10x אובייקטיבי) של פרוסת מוח קדמי עם שני ספרואידים צמודים זה לזה בצבעים שונים. מעט מאוד, אם בכלל, התרחשה פלישת תאים מספרואיד אחד למשנהו, וגבול חד היה קיים ביניהם. לוחות A, B, C ו-E מראים גם צביעת נגד גרעינית לבנה עם ביסבנזימיד. סרגל קנה מידה = 500 מיקרומטר (A). קנה מידה ללוחות B-F נמצא לאורך צירי עיבוד אמצעי האחסון. קיצורים: GBM = גליובלסטומה; GSCs = תאי גזע GBM; GFP = חלבון פלואורסצנטי ירוק; OT = טקטום אופטי. אנא לחץ כאן כדי להציג גרסה גדולה יותר של איור זה.
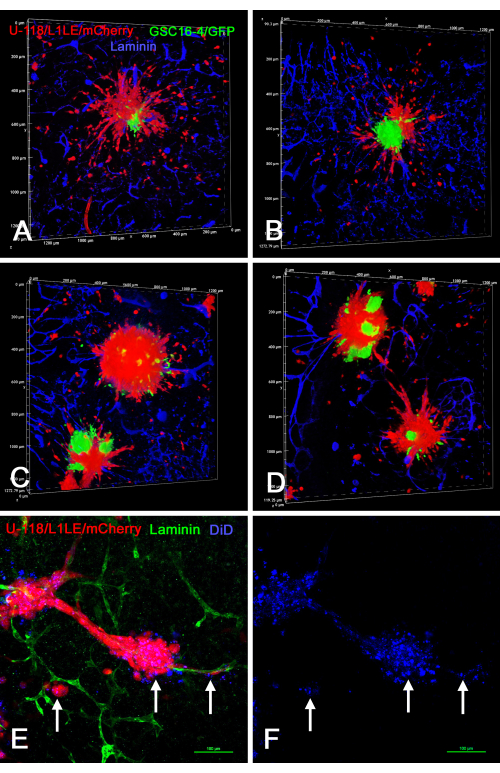
איור 8: תמונות קונפוקליות של פרוסות מוח קבועות עם תאי GBM פולשניים מספרואידים מעורבים של תאים וספרואידים המסומנים ב-DiD. לוחות A-D מראים עיבודי נפח של פרוסות מוח שהכילו ספרואידים מעורבים של תאים המורכבים מתאי GSC16-4/GFP ירוקים ותאי U-118/L1LE/mCherry אדומים. תאי U-118 אדומים רבים התפזרו מהספרואידים ופלשו לפרוסת המוח לכל הכיוונים, בעוד שה-GSCs הירוקים לא התפזרו ונשארו במקומות המרכזיים של הספרואידים. לוחות E ו-F מראים הכנת פרוסת ex vivo עם כדורי U-118/L1LE/mCherry אדומים המסומנים גם בצבע קרום אדום רחוק DiD (מוצג ככחול). לאחר הקיבוע, הפרוסה היתה immunostained עבור למינין בירוק. תווית DiD נראתה בתאים אדומים כצביעת ניקוב (חצים) ונראתה אפילו בתאים שהתפזרו מהספרואידים לאורך כלי הדם. מכתים נגדיים גרעיניים עם ביסבנזימיד אינם מוצגים באיור זה, כך שהכתמים האחרים נראים בצורה ברורה יותר. פסי קנה מידה = 100 מיקרומטר (E,F). קיצורים: GBM = גליובלסטומה; GSCs = תאי גזע GBM; GFP = חלבון פלואורסצנטי ירוק. אנא לחץ כאן כדי להציג גרסה גדולה יותר של איור זה.
| בינוני/פתרון | הרכב | ||
| מדיה GSC | תערובת 1:1 של DMEM/F12, סרום בקר עוברי 1% (FBS), חיץ HEPES 15 mM, 2 mM L-גלוטמין, 100 מיקרוגרם/מ"ל פניצילין-סטרפטומיצין (עט/סטרפטוקו), תוסף B27 2% ללא ויטמין A ו-2.5 מיקרוגרם/מ"ל הפרין. | ||
| מדיית GBM | DMEM (גלוקוז גבוה), 10% FBS, עט/סטרפטוקוקוס ו-2 מילימ"ר L-גלוטמין. | ||
| מאגר קיבוע | 2% PFA במאגר נתרן קקודילט באורך 0.1 מטר | ||
| הטבעה בינונית | 3.5% אגר ו-8% סוכרוז ב-PBS | ||
| PBSTG | 0.1% Triton X-100 + 5% סרום עיזים רגיל (NGS) ב-PBS | ||
| U-118 MG תרבית תאים בינונית | DMEM + 10% FBS + עט / סטרפטוקוקוס + L-גלוטמין | ||
| פרוסת מוח מדיה תרבות | 50% MEM + 25% HBSS + 25% סרום סוסים + B27 + עט / סטרפטוקוקוס + L-glut + 15 mM חיץ HEPES | ||
| כלי פריסה רוטט של רקמות חותך מדיה | בינוני 199 + עט / סטרפ + 15 mM חיץ HEPES | ||
טבלה 1: הרכב המדיה והמאגרים המשמשים בפרוטוקול זה.
איור משלים 1: הזרקה לטקטום אופטי E5. (A) לאחר שחותכים חור בקליפת הביצה מעל חלל האוויר, ומרטיבים את קרום חלל האוויר במי מלח או מדיה, מסירים את הקרום במלקחיים עדינים. (B) כדי להזריק תאים לתוך הטקטום האופטי, צובטים את מי השפיר ומוחזקים במלקחיים עדינים כדי למקם את הראש כך שהטקטום האופטי יהיה נגיש. לאחר מכן המיקרופיפטה מוחדרת לטקטום האופטי ותאים מוזרקים לתוכו בלחץ. (C) לאחר הזרקת תאים, מוסיפים כמה טיפות של תמיסת אמפיצילין על גבי העובר באמצעות מזרק ומחט עדינה. אנא לחץ כאן כדי להוריד קובץ זה.
איור משלים 2: דיסקציה של אזורי מוח E15. (A) לאחר עריפת ראשו, ראש העובר E15 מונח בצלחת עם תמיסת CMF סטרילית. (B) העור שמעל המוח מוסר לאחר מכן באמצעות מלקחיים עדינים. (C) שתי עצמות הגולגולת מוסרות לאחר מכן משתי ההמיספרות של המוח הקדמי (FB). (D) הדורה של רקמת החיבור מוסרת בעדינות מהסביבות של המוח הקדמי (FB), טקטום אופטי והמוח הקטן. (E) המוח כולו מוסר מהראש על-ידי גריפה עדינה שלו מחלל המוח שמתחתיו באמצעות מלקחיים מעוקלים. (F ) מוצגת התצוגה הגבית של כל המוח שהוסר באמצעות המוח הקדמי (FB), טקטום אופטי (OT) והמוח הקטן (CB). (G ) המוח המבודד מנותח לאחר מכן למוח הקדמי (FB), להמיספרות טקטום אופטי (OT) ולמוח הקטן (CB) באמצעות מספריים עדינים. (H ) רקמת החיבור העדינה pia מוסרת בקלות מחצי הכדור של הטקטום האופטי (OT) באמצעות מלקחיים עדינים. אנא לחץ כאן כדי להוריד קובץ זה.
איור משלים 3: הטבעה וחיתוך של טקטום אופטי E15 ומיקום ספרואידים של תאים. (A) חצי כדור טקטום אופטי אחד שקוע באגרוז נמס נמוך באמצעות מלקחיים מעוקלים. (B) לאחר שהאגרוז מתקשה על קרח, הבלוק המכיל את הטקטום האופטי נחתך ומודבק על כן הנירוסטה בצלוח/מגש החיתוך. (C) לאחר שהדבק מתייבש, מניחים את הצלחת/מגש החיתוך לתוך הצ'אק של כלי החיתוך הרוטט וממלאים אותו במצע חיתוך קר. לאחר מכן חותכים את הפרוסות עם סכין הספיר מגוש הרקמה השקועה. פרוסות חתוכות יצופו לתוך המנה/מגש וניתן להסיר אותן בעזרת מרית. (D) פרוסות חתוכות מוסרות מהצלחת/המגש ומונחות ישירות על תוספות קרום עם תרבית פרוסה תחתונה בצלחת מרובת בארות. (E) לאחר גידול ספרואידים של תאים על כלים מצופים פולי-HEMA, מוציאים ספרואיד מהצלחת בכמות מינימלית של מדיה באמצעות מיקרופיפטור של 20 μL. (F) הספרואיד המבודד מונח ישירות על פרוסת המוח במדיה המינימלית. (G) אם הספרואיד נופל מפרוסת המוח עקב זרימת המדיה, ניתן לדחוף אותו בחזרה אל פרוסת המוח באמצעות ריס המודבק למקל אפליקטור מעץ. אנא לחץ כאן כדי להוריד קובץ זה.
וידאו משלים S1: וידאו של עיבוד נפח הגדלה גבוהה של גידול GSC15-2 קטן ב- E15. GSCs הם ירוקים עקב ביטוי GFP. וידאו מתאים לאיור 1C ומראה תאי GSC15-2. הסרטון מציג סיבוב של עיבוד נפח שנוצר מערימת z באמצעות מטרת טבילת שמן של 60x. גרעיני התא נראים לבנים עקב צביעת ביסבנזימיד, וחלקם נראים אדומים עקב צביעה חיסונית עבור Sox2. שימו לב שבשל "מיזוג אלפא" עבור עיבודי נפח בתוכנת המיקרוסקופ הקונפוקלי, הצבעים אינם מתמזגים כפי שהיו מתמזגים באמצעות הקרנה בעוצמה מרבית, והצבע העז ביותר שולט ומטשטש את הצבע הפחות עז. כלי הדם מוכתמים בלבן עקב אימונוסטיין למינין. צביעת סמן GSC integrin alpha-6 מוצגת בכחול ונראית מנוקבת על משטחי GSC ירוקים. קשקשים של מיקרון מוצגים לאורך הקצוות של עיבוד אמצעי האחסון. אנא לחץ כאן כדי להוריד סרטון זה.
וידאו משלים S2: וידאו של עיבוד נפח הגדלה גבוהה של גידול GSC16-4 קטן ב- E15. GSCs הם ירוקים עקב ביטוי GFP. וידאו מתאים לאיור 1D ומראה תאי GSC16-4. הסרטון מציג סיבוב של עיבוד נפח שנוצר מערימת z באמצעות מטרת טבילת שמן של 60x. גרעיני התא נראים לבנים עקב צביעת ביסבנזימיד, וחלק מה-GSCs נראים אדומים עקב צביעה חיסונית של נסטין. שימו לב שבשל "מיזוג אלפא" עבור עיבודי נפח בתוכנת המיקרוסקופ הקונפוקלי, הצבעים אינם מתמזגים כפי שהיו מתמזגים באמצעות הקרנה בעוצמה מרבית, והצבע העז ביותר שולט ומטשטש את הצבע הפחות עז. כלי הדם מוכתמים בלבן עקב אימונוסטיין למינין. צביעת סמן GSC integrin alpha-6 מוצגת בכחול ונראית מנוקבת על משטחי GSC ירוקים. קשקשים של מיקרון מוצגים לאורך הקצוות של עיבוד אמצעי האחסון. אנא לחץ כאן כדי להוריד סרטון זה.
וידאו משלים S3: וידאו של עיבודי נפח הגדלה גבוהה של גידול GSC15-2 קטן ב- E15. GSCs הם ירוקים עקב ביטוי GFP. וידאו מתאים לאיור 1E ומראה תאי GSC15-2. הסרטון מציג סיבוב של עיבוד נפח שנוצר מערימת z באמצעות מטרת טבילת שמן של 60x. גרעיני התא נראים לבנים עקב צביעת ביסבנזימיד, וחלקם נראים אדומים עקב צביעה חיסונית עבור Sox2. שימו לב שבשל "מיזוג אלפא" עבור עיבודי נפח בתוכנת המיקרוסקופ הקונפוקלי, הצבעים אינם מתמזגים כפי שהיו מתמזגים באמצעות הקרנה בעוצמה מרבית, והצבע העז ביותר שולט ומטשטש את הצבע הפחות עז. כלי הדם מוכתמים בלבן עקב אימונוסטיין למינין. צביעת סמן GSC integrin alpha-6 מוצגת בכחול ונראית מנוקבת על משטחי GSC ירוקים. קשקשים של מיקרון מוצגים לאורך הקצוות של עיבוד אמצעי האחסון. אנא לחץ כאן כדי להוריד סרטון זה.
וידאו משלים S4: וידאו של עיבודי נפח בהגדלה גבוהה של גידולים קטנים GSC16-4 ב- E15. GSCs הם ירוקים עקב ביטוי GFP. וידאו מתאים לאיור 1F ומראה תאי GSC16-4. הסרטון מציג סיבוב של עיבוד נפח שנוצר מערימת z באמצעות מטרת טבילת שמן של 60x. גרעיני התא נראים לבנים עקב צביעת ביסבנזימיד, וחלקם נראים אדומים עקב צביעה חיסונית של נסטין. שימו לב שבשל "מיזוג אלפא" עבור עיבודי נפח בתוכנת המיקרוסקופ הקונפוקלי, הצבעים אינם מתמזגים כפי שהיו מתמזגים באמצעות הקרנה בעוצמה מרבית, והצבע העז ביותר שולט ומטשטש את הצבע הפחות עז. כלי הדם מוכתמים בלבן עקב אימונוסטיין למינין. צביעת סמן GSC integrin alpha-6 מוצגת בכחול ונראית מנוקבת על משטחי GSC ירוקים. קשקשים של מיקרון מוצגים לאורך הקצוות של עיבוד אמצעי האחסון. אנא לחץ כאן כדי להוריד סרטון זה.
וידאו משלים S5: וידאו של תאי GBM חיים בפרוסת מוח ex vivo . הווידיאו מתאים לאיור 5C ומראה תמונות פלואורסצנטיות רחבות שדה של ספרואידים של תאי U-118/L1LE ותאים פולשים במהלך ניסוי בהילוך מהיר כדי לנטר את ההתנהגות החיה של פלישה לתוך פרוסת ex vivo (באמצעות מטרה של פי 20 במערכת מיקרוסקופ מותאמת אישית בהילוך מהיר). תאי U-118/L1LE היו מוכתמים בצבע קרום פלואורסצנטי אדום רחוק DiD. התמונות נרכשו באמצעות מצלמה מונוכרומטית. אנא לחץ כאן כדי להוריד סרטון זה.
וידאו משלים S6: וידאו של תאי GBM חיים בפרוסת מוח ex vivo . הווידיאו מתאים לאיור 5D ומראה תמונות פלואורסצנטיות בשדה רחב של ספרואידים של תאי U-118/L1LE ותאים פולשים במהלך ניסוי בהילוך מהיר כדי לנטר את ההתנהגות החיה של פלישה לתוך פרוסת ex vivo (באמצעות מטרה של פי 20 במערכת מיקרוסקופ מותאמת אישית בהילוך מהיר). התאים צולמו באמצעות ביטוי הדובדבן האדום שלהם. התמונות נרכשו באמצעות מצלמה מונוכרומטית. אנא לחץ כאן כדי להוריד סרטון זה.
וידאו משלים S7: וידאו של תמונות עיבוד נפח של קיטועי זמן 4D קונפוקליים של GSCs חיים ותאי GBM. הווידיאו מתאים לאיור 6A. תמונות קונפוקליות מסוג z-stack נרכשו בצעדים של 10 מיקרומטר כל 10 דקות במשך 20 שעות. ההכנה הייתה של פרוסת מוח עם תאים מעורבים מושתלים של תאי U-118/L1LE/mCherry אדומים ותאי GSC16-4/GFP ירוקים. תמונות קונפוקליות צולמו בזמן שפרוסת המוח תורבתה על ממברנה בצלחת תרבית תאי פלסטיק בת 6 בארות באמצעות עדשת ELWD 20x אובייקטיבית (0.45 NA), שסיפקה את מרחק העבודה הנוסף הדרוש. עיבוד הנפח נוצר באמצעות תוכנת המיקרוסקופ הקונפוקלי "Alpha Blending", המעניקה אפקט תלת ממדי לכאורה. קשקשים של מיקרון מוצגים לאורך הקצוות של עיבוד אמצעי האחסון. הסרטון נצפה בצורה הטובה ביותר על ידי גרירה ידנית של מחוון התקדמות הווידאו בנגן הווידאו קדימה ואחורה כדי לצפות בתנועת התא במקום לאפשר לנגן הווידאו להמשיך במהירות האיטית הרגילה שלו. אנא לחץ כאן כדי להוריד סרטון זה.
וידאו משלים S8: וידאו של תמונות עיבוד נפח של קיטועי זמן 4D קונפוקליים של GSCs חיים ותאי GBM. הווידיאו מתאים לאיור 6B. תמונות קונפוקליות מסוג z-stack נרכשו בצעדים של 10 מיקרומטר כל 10 דקות במשך 20 שעות. ההכנה הייתה של פרוסת מוח עם תאים מעורבים מושתלים של תאי U-118/L1LE/mCherry אדומים ותאי GSC16-4/GFP ירוקים. תמונות קונפוקליות צולמו בזמן שפרוסת המוח תורבתה על ממברנה בצלחת תרבית תאי פלסטיק בת 6 בארות באמצעות עדשת ELWD 20x אובייקטיבית (0.45 NA), שסיפקה את מרחק העבודה הנוסף הדרוש. עיבוד הנפח נוצר באמצעות תוכנת המיקרוסקופ הקונפוקלי "Alpha Blending", המעניקה אפקט תלת ממדי לכאורה. קשקשים של מיקרון מוצגים לאורך הקצוות של עיבוד אמצעי האחסון. הסרטון נצפה בצורה הטובה ביותר על ידי גרירה ידנית של מחוון התקדמות הווידאו בנגן הווידאו קדימה ואחורה כדי לצפות בתנועת התא במקום לאפשר לנגן הווידאו להמשיך במהירות האיטית הרגילה שלו. אנא לחץ כאן כדי להוריד סרטון זה.
וידאו משלים S9: וידאו של תמונות עיבוד נפח של קיטועי זמן 4D קונפוקליים של GSCs חיים ותאי GBM. הווידיאו מתאים לאיור 6C. תמונות קונפוקליות מסוג z-stack נרכשו בצעדים של 10 מיקרומטר כל 10 דקות במשך 20 שעות. ההכנה הייתה של פרוסת מוח עם תאים מעורבים מושתלים של תאי U-118/L1LE/mCherry אדומים ותאי GSC16-4/GFP ירוקים. תמונות קונפוקליות צולמו בזמן שפרוסת המוח תורבתה על ממברנה בצלחת תרבית תאי פלסטיק בת 6 בארות באמצעות עדשת ELWD 20x אובייקטיבית (0.45 NA), שסיפקה את מרחק העבודה הנוסף הדרוש. עיבוד הנפח נוצר באמצעות תוכנת המיקרוסקופ הקונפוקלי "Alpha Blending", המעניקה אפקט תלת ממדי לכאורה. קשקשים של מיקרון מוצגים לאורך הקצוות של עיבוד אמצעי האחסון. הסרטון נצפה בצורה הטובה ביותר על ידי גרירה ידנית של מחוון התקדמות הווידאו בנגן הווידאו קדימה ואחורה כדי לצפות בתנועת התא במקום לאפשר לנגן הווידאו להמשיך במהירות האיטית הרגילה שלו. אנא לחץ כאן כדי להוריד סרטון זה.
וידאו משלים S10: וידאו של תמונות עיבוד נפח של קיטועי זמן 4D קונפוקליים של GSCs חיים ותאי GBM. הווידיאו מתאים לאיור 6D. תמונות קונפוקליות מסוג z-stack נרכשו בצעדים של 10 מיקרומטר כל 10 דקות במשך 20 שעות. ההכנה הייתה של פרוסת מוח עם תאים מעורבים מושתלים של תאי U-118/L1LE/mCherry אדומים ותאי GSC16-4/GFP ירוקים. תמונות קונפוקליות צולמו בזמן שפרוסת המוח תורבתה על ממברנה בצלחת תרבית תאי פלסטיק בת 6 בארות באמצעות עדשת ELWD 20x אובייקטיבית (0.45 NA), שסיפקה את מרחק העבודה הנוסף הדרוש. עיבוד הנפח נוצר באמצעות תוכנת המיקרוסקופ הקונפוקלי "Alpha Blending", המעניקה אפקט תלת ממדי לכאורה. קשקשים של מיקרון מוצגים לאורך הקצוות של עיבוד אמצעי האחסון. הסרטון נצפה בצורה הטובה ביותר על ידי גרירה ידנית של מחוון התקדמות הווידאו בנגן הווידאו קדימה ואחורה כדי לצפות בתנועת התא במקום לאפשר לנגן הווידאו להמשיך במהירות האיטית הרגילה שלו. אנא לחץ כאן כדי להוריד סרטון זה.
וידאו משלים S11: וידאו של תמונות עיבוד נפח של קיטועי זמן 4D קונפוקליים של GSCs חיים ותאי GBM. הווידיאו מתאים לאיור 6E. תמונות קונפוקליות מסוג z-stack נרכשו בצעדים של 10 מיקרומטר כל 10 דקות במשך 20 שעות. ההכנה כללה פרוסת מוח עם תאים מעורבים מושתלים של תאי U-118/L1LE/mCherry אדומים ותאי GSC16-4/GFP ירוקים. תמונות קונפוקליות צולמו בזמן שפרוסת המוח תורבתה על ממברנה בצלחת תרבית תאי פלסטיק בת 6 בארות באמצעות עדשת ELWD 20x אובייקטיבית (0.45 NA), שסיפקה את מרחק העבודה הנוסף הדרוש. עיבוד הנפח נוצר באמצעות תוכנת המיקרוסקופ הקונפוקלי "Alpha Blending", המעניקה אפקט תלת ממדי לכאורה. קשקשים של מיקרון מוצגים לאורך הקצוות של עיבוד אמצעי האחסון. הסרטון נצפה בצורה הטובה ביותר על ידי גרירה ידנית של מחוון התקדמות הווידאו בנגן הווידאו קדימה ואחורה כדי לצפות בתנועת התא במקום לאפשר לנגן הווידאו להמשיך במהירות האיטית הרגילה שלו. אנא לחץ כאן כדי להוריד סרטון זה.
Discussion
שלבים קריטיים בפרוטוקול הזרקת התאים לחדר המוח התיכון (טקטום אופטי) כוללים הימנעות מפגיעה בכלי הדם בקרום הכוריאואלנטואי בביצית או סביב העובר לפני ההזרקה ובמהלכה, אם כי ניתן למשוך בעדינות את קרום מי השפיר המקיף את העובר ולהחזיקו כדי למקם את הראש בעת הזרקת התאים למוח האמצעי. מי השפיר קשיחים יחסית וניתן למשוך אותם בעזרת מלקחיים עדינים כדי למקם את הראש ולהחזיק אותו יציב ביד אחת, לצורך הזרקת תאים ביד השנייה לטקטום האופטי, שהוא המבנה הגדול והעגול במרכז המוח. בדרך כלל, הכדאיות של עוברים מוזרקים נעה בין 25% ל -75%, תלוי בגורמים לא ידועים, וכמעט כל עובר ששורד מכיל לפחות גידול קטן בטקטום האופטי. שלבים קריטיים ביצירת פרוסות מוח בנות קיימא כוללים ניקוי הרקמה של נוזלים עודפים כך שהאגרוז נצמד למוח במהלך החיתוך ולשמור על רקמות ופרוסות קרות עד שהונחו על החדרת הממברנה. מכיוון שסוגי תאים שונים יוצרים ספרואידים באופן שונה (במהירות ובגודל), צפיפות התאים המצופים על לוחות poly-HEMA ומשך הזמן לפני קצירת ספרואידים צריכים להיות אופטימליים עבור כל סוג תא.
העבודה כאן לא הייתה כפופה למחקר אורך רשמי של כדאיות פרוסת המוח. יאנג ועמיתיו השתמשו בתרביות פרוסות מוח עוברי אפרוח דומות לאלה המשמשות כאן והראו כדאיות טובה של הפרוסות לפחות 7 ימים16. עבודות קודמות הראו שכאשר רקמת OT נשמרה במדיה תת-אופטימלית, הופיעו גרעינים פיקנוטיים רבים ברקמה, מה שלא התרחש בפרוסות בעבודה כאן. בנוסף, כאשר פרוסות מתנוונות בתנאים תת-אופטימליים, כלי הדם מתפצלים ומופיעים כשורות של כדורים חיוביים למינין (לא מוצגים). לכן, למרות שהכדאיות כאן לא נבדקה בשיטות כגון אלקטרופיזיולוגיה או ביטוי קספאז-3 פעיל, אף אחד מהאינדיקטורים למוות תאי שנצפו בתנאי תרבית תת-אופטימליים לא הופיע כאן.
ה- OT התמקד בניסויים בגידולי מוח in vivo מכיוון שהוא האזור המוזרק ביותר בקלות עם החדר הגדול ביותר. ב- E5, שהוא היום האחרון שבו העובר קטן מספיק כדי להישאר נגיש על גבי החלמון, יש לבצע זריקות לחדר, שכן כל אזורי המוח אינם אלא אזור חדר דק. עם זאת, זריקות אלה גורמות בהצלחה לגידולים משובצים עם תאים הפולשים לפרנכימה במוח. לפעמים, גידולים כתוצאה מכך נמצאים במוח הקדמי או במוח הקטן, אבל זה לא נפוץ. פרוסות Ex vivo של טקטום אופטי E15 שימשו בעיקר לניסויים כאן, כך שתוצאות התרבית המשותפת ex vivo יכולות להיות מתואמות עם ניסויי הזרקת in vivo. עם זאת, פרוסות המוח הקדמי מתאימות גם הן ויש להן שטח פנים גדול יותר וחדר דק מאוד בהשוואה לטקטום האופטי, מה שעשוי להפוך את המוח הקדמי למתאים יותר לתרביות משותפות ex vivo שאינן מתואמות עם זריקות in vivo.
הוכח כאן כי זריקות in vivo , ובעקבותיהן קיבוע רקמות, חתך רקמה רוטט וצביעה חיסונית עבור למינין וסמנים אחרים, הביאו לתמונות ברזולוציה גבוהה של תאי GBM ו- GSCs ברקמת המוח בקרבת כלי דם. היכולת לקבוע את יחסי הגומלין בין תאי הגידול וכלי הדם הקלה מאוד על ידי יצירת עיבודי נפח תלת-ממדיים מערימות z של מקטעים אופטיים קונפוקליים באמצעות תוכנת קונפוקל והוראות היצרן. הדמיה בהילוך מהיר באמצעות מיקרוסקופ פלואורסצנטי רחב שדה של GFP, mCherry ותאים המסומנים ב- DiD הייתה אפשרית; עם זאת, תאים נודדים שהיו קרובים לספרואידים הפלואורסצנטיים מאוד הוסתרו לעיתים על ידי ה"זוהר" מהספרואידים. ניתן למזער במידת מה את האפקט הבלתי רצוי הזה על ידי התאמה קפדנית של זמני החשיפה לאיסוף תמונות בשדה רחב. הדמיה בהילוך מהיר באמצעות ערימות z קונפוקליות לאורך זמן (4D) ביטלה את הזוהר הלא ממוקד מהספרואידים והביאה לתאים נודדים מוגדרים בחדות עם רקע כהה. זה לא תואר בפרוטוקול, אך בוצע בדומה להדמיית קיטועי זמן בשדה רחב, שבוצעה בזמן שפרוסות המוח היו על תוספות הממברנה השקופות בלוח פלסטיק בן 6 בארות. אף על פי שהדמיית קיטועי זמן קונפוקלית מביאה לתמונות ברורות יותר באופן ניכר של תאים בודדים והתנהגותם, ניסוי רב-נקודתי בהילוך מהיר האוסף ערימות z של 10 מישורי z לנקודה, במרווחים של 10 דקות על פני תקופה של 20 שעות, הוא שימוש נרחב בגלוונומטרים של ראש הסריקה. מכיוון שזה יכול להפחית באופן משמעותי את תוחלת החיים של גלוונומטרים, שיטה זו משמשת בתבונה.
למרות שמערכת עוברי האפרוחים מתאימה מאוד הן להזרקת in vivo והן לניסויי תרבית משותפת ex vivo החוקרים התנהגות תאי GBM, ישנן מספר מגבלות למערכת מודל זו. כמו בכל מערכת קסנוגרפט, הסביבה שבה מושתלים תאים אנושיים אינה המוח האנושי, אך נראה כי התנהגות תאי GBM מחקה זאת במודלים של מכרסמים ובחולים אנושיים. לאחר ביצוע ניסויים בהזרקת in vivo על E5, גידולים מורשים בדרך כלל להיווצר במשך 10 ימים, עד E15. ברור שזה לא מספיק זמן כדי לחקור את כל ההיבטים של גידולים ופלישה לתאים. עם זאת, הוכח כאן כי גידולים מוצקים נוצרים בפרנכימה של המוח, תאים מתקשרים ומסדרים את עצמם מחדש בתוך הגידול, ופלישה מוחית משמעותית מתרחשת הן לאורך כלי הדם והן באופן מפוזר בפרק זמן קצר יחסית זה. מגבלה נוספת למערכת עוברי האפרוחים in vivo היא שהיא אינה מתאימה לטיפולים תרופתיים או אחרים בגלל החלמון הגדול ומערכת הדם החוץ-עוברית הפועלת במהלך התפתחות עובר האפרוחים. טיפול תרופתי מקומי בנוזל יגרום לריכוז משתנה מאוד ולא ידוע במוח עקב דיפוזיה הרחק מהעובר לתוך מסת החלמון הגדולה בהרבה. באופן דומה, הזרקה תוך ורידית של תרופות למערכת הדם החוץ-עוברית העדינה מאוד תדלוף או תתפזר החוצה מכלי הדם וגם תגרום לריכוזים לא ידועים במוח. זוהי אחת הסיבות העיקריות לכך שאומצה שיטת תרבית פרוסות ex vivo - כך שלא רק שניתן היה לצפות בהתנהגות התא ולעקוב אחריה באמצעות מיקרוסקופ בהילוך מהיר, אלא גם כדי שניתן יהיה לבחון טיפולים שהצליחו לשנות את התנהגות תאי GBM בצלחת4 בסביבת רקמת מוח רלוונטית יותר.
פיתוח מערכת מודל גידולי מוח אורתוטופיים לעובר אפרוח נתפס כתוספת משמעותית למערכות ולכלים הזמינים לחקר היווצרות גידולי GBM והתנהגות תאים פולשניים. ביצי תרנגולת מופרות צפויות להיות זמינות ברוב האזורים, הן זולות בהשוואה למכרסמים, אין עלויות טיפול בבעלי חיים, העוברים עמידים מאוד ועמידים בפני זיהומים (כלומר, רוב העבודה נעשית על ראש ספסל), העוברים ניתנים למניפולציה גבוהה וניתן לגדל אותם בתרבית ללא קונכייה19, ועוברי אפרוחים אינם נחשבים לבעלי חוליות ולכן אינם דורשים אישור IACUC על פי הנחיות NIH (דרישות מוסדיות עשוי להשתנות). לפיכך, יתרונות מרובים אלה הופכים את מערכת עוברי האפרוחים לאטרקטיבית מאוד אם מגבילים את שאלותיהם וניסוייהם לאלה הנופלים במגבלותיה. מחקרים מרובים של תאי GBM בוצעו על ידי אחרים באמצעות עובר אפרוח, אך אלה השתמשו כמעט אך ורק בקרום הכוריאואלנטואי (CAM) של העובר 20,21,22,23,24,25,26,27,28,29 וניצן הגפיים 30ולא המוח., דווח גם על השתלת מדולובלסטומה במוח הגוזל ב-E231. אין ספק, השימוש בעובר אפרוח כמערכת מודל קסנוגרפט אורתוטופית, כפי שמתואר כאן, אמור להניב תוצאות שהן הרבה יותר משמעותיות לביולוגיה של גידולי GBM אנושיים מאשר מחקרים המשתמשים ב- CAM.
למרות שמחקרים אלה רק החלו לנצל באופן מלא את מערכת מודל הגידול במוח של עוברי אפרוח למחקרים על התנהגות תאי GBM אנושיים ו- GSC, יש לקוות שאחרים ירחיבו את השימושים וימצאו יישומים פוטנציאליים נוספים. ניתן היה לדמיין כי לא רק שמערכת זו תחשוף מנגנונים המווסתים את היווצרות הגידול בגליובלסטומה ואת התנהגות התא, אלא גם תאפשר בדיקות פרה-קליניות של תרופות וחומרים ספציפיים על תאים ספציפיים של חולים. לדוגמה, אם תרביות פרוסות מוח נקבעו מראש, אז תאים סרטניים, חתיכות מכריתות גידולים כירורגיות, או אורגנואידים GBM32 שמקורם במטופל יכולים להיות ממוקמים ישירות בתרבית משותפת ex vivo , וטיפולים שונים יכולים להיות מוערכים בתוך ימים ספורים. באופן דומה, תאי חולים מנותקים יכולים להיות מוזרקים ישירות לתוך המוח התיכון E5 ב ovo כדי להעריך את יכולתם ליצור גידולים ולפלוש parenchyma המוח. לפיכך, יש לקוות כי תיאורי השיטות והתוצאות המייצגות כאן יקלו ויעודדו שימוש מוגבר במערכת בלתי מנוצלת זו לחקר סרטן המוח.
Disclosures
לאף אחד מהכותבים אין ניגודי עניינים.
Acknowledgements
עבודה זו מומנה בחלקה על ידי מענק ל- D.S.G. מהמכון הלאומי לסרטן (R03CA227312) ועל ידי מענק נדיב מקרן ליסה דין מוסלי. דגימות חיות של GBM הושגו בהסכמת המטופל באמצעות המרכז לרכישת רקמות במרכז הסרטן ומכון המחקר ע"ש הלן פ. גרהם. המימון לא.ר. ניתן על ידי המרכז הלאומי למשאבי מחקר והמרכז הלאומי לקידום מדעי התרגום, המכונים הלאומיים לבריאות (UL1TR003107). מלגות מחקר קיץ לתואר ראשון ל- N.P., A.L., Z.W. ו- K.S. ניתנו על ידי תוכנית המחקר לתואר ראשון באוניברסיטת דלאוור.
Materials
| Name | Company | Catalog Number | Comments |
| 1 cm x 1 cm square hole paper punch | Birabira | N/A | |
| 1 mm biopsy punch pen | Robbins Instruments | 20335 | |
| 6 well insert plate (Corning Transwell) | Millipore Sigma | CLS3450 | |
| 9" Disposable Pasteur Pipets | Fisher Scientific | 13-678-20C | |
| 15 mL centrifuge tubes | Fisher Scientific | 05-539-12 | |
| 24 well plate | Corning Costar | 3526 | |
| 50 mL centrifuge tubes | Fisher Scientific | 05-539-9 | |
| Agar | Fisher BioReagents | BP1423-500 | for embedding fixed brains |
| Alexafluor 488-conjugated GAM IgG | Jackson Immunoresearch | 115-605-146 | |
| Alexafluor 647-conjugated GAM IgG | Jackson Immunoresearch | 115-545-146 | |
| Aluminum foil | ReynoldsWrap | N/A | |
| Ampicillin | Sigma Aldrich | A-9518 | |
| anti-integrin alpha-6 monoclonal antibody GOH3 | Santa Cruz Biotechnology | sc-19622 | |
| anti-L1CAM monoclonal antibody UJ127 | Santa Cruz Biotechnology | sc-53386 | |
| anti-laminin monoclonal antibody | Developmental Studies Hybridoma Bank | 3H11 | |
| anti-nestin monoclonal antibody 10c2 | Santa Cruz Biotechnology | sc-23927 | |
| anti-Sox2 monoclonal antibody E-4 | Santa Cruz Biotechnology | sc-365823 | |
| B27 supplement without vitamin A | GIBCO | 17504-044 | |
| bisbenzimide (Hoechst 33258) | Sigma-Aldrich | B2883 | nuclear stain |
| Cell culture incubator | Forma | standard humidified CO2 incubator | |
| Centrifuge | Beckman Coulter | ||
| Confocal microscope | Nikon Instruments | C2si+ | With custom-made cell incubator chamber |
| Confocal microscope objective lenses | Nikon Instruments | Plan Apo lenses, except S Plan Fluor ELWD 20x 0.45 NA objective lens for confocal time-lapse imaging | |
| Confocal microscope software | Nikon Instruments | NIS Elements | Version 5.2 |
| Curved foreceps | World Precision Intruments | 504478 | |
| Curved scissors | Fine Science Tools | ||
| Curved spatula | Fisher Scientific | 14-375-20 | |
| Cyanoacrylate glue | Krazy Glue | KG-585 12R | |
| D-Glucose | Millipore Sigma | G8270 | |
| DiD far red fluorescent dye | Invitrogen | V22887 | Vybrant DiD |
| DMEM | Sigma Aldrich | D5671 | |
| DMEM/F12 | Sigma Aldrich | D8437 | |
| DMSO | Sigma Aldrich | D4540 | |
| Dulbecco's Phosphate buffered saline (PBS) | Sigma Aldrich | P5493-1L | |
| egg incubator | Humidaire | ||
| electrical tape (10 mil thick/254 µm) | Scotch | N/A | |
| Ethanol 200 proof | Decon Laboratories | 2701 | |
| Fast green FCF dye | Avocado Research Chemicals | 16520 | |
| FBS | Gemini Bio-products | 900-108 | |
| filter paper | Fisher Scientific | ||
| Gauze | Dynarex | 3353 | |
| Glass Capillaries for microinjection | World Precision Instruments | TW100-4 | |
| Glycerol | Fisher BioReagents | BP228-1 | for mounting media |
| GSCs (human glioblastoma stem cells) | Not applicable | Isolated from patient GBM specimens in Galileo laboratory in GSC media and then transduced with a GFP encoding lentiviral vector. Cells used were between passage 10 and 30. | |
| Hanks Balanced Salt Solution (HBSS) | Corning | 21-020-CV | |
| Hemacytometer | Hausser scientific | ||
| Heparin | Fisher Scientific | BP2524-100 | |
| HEPES buffer | Sigma Aldrich | H0887 | |
| Horse Serum (HI) | Gibco | 26050-088 | |
| Human FGF-2 | BioVision | 4037-1000 | |
| Human TGF-α | BioVision | 4339-1000 | |
| Inverted phase contrast microscope | Nikon Instruments | TMS | for routine viewing of cultured cells |
| KCl | Fisher Scientific | BP366 | |
| KH2PO4 | Fisher Scientific | P284 | |
| Laboratory film | Parafilm | ||
| Labquake Shaker | LabIndustries | T400-110 | |
| L-Glut:Pen:Strep | Gemini Bio-products | 400-110 | |
| Low-melt agarose | Fisher Scientific | BP1360 | for embedding live brains |
| Matrix | Corning Matrigel | 354234 | |
| Medium 199 | GIBCO | 11150-059 | |
| MEM | Corning | 10-010-CV | |
| Metal vibratome block | |||
| Micropipette tips (20, 200, 1,000 µL) | Fisherbrand | ||
| Micropipettors (20, 200, 1,000 µL) | Gilson | ||
| Microscope Coverglass (no. 1.5 thickness) | Fisherbrand | 12544A | |
| NaCl | Fisher Scientific | S271 | |
| NaH2PO4 + H2O | Fisher Scientific | S369 | |
| NaHCO3 | Fisher Scientific | BP328 | |
| Normal goat serum | Millipore Sigma | 526-M | |
| N-propyl gallate | Sigma Aldrich | P3130 | for mounting media |
| Parafilm | Parafilm | ||
| Paraformaldehyde | Electron Microscopy Sciences | 15710 | |
| PBS | Sigma Aldrich | P5493-1L | |
| Pencil | |||
| Plain Microscope slides | Fisherbrand | 12-550-A3 | |
| Plastic 35 mm Petri dish | Becton Dickinson | 351008 | |
| pneumatic picopump | World Precision Intruments | PV830 | |
| Poly(2-hydroxyethyl methacrylate) (poly-HEMA) | Sigma Aldrich | P-3932 | |
| razor blade- double edge | PACE | for cutting fixed brain slices | |
| sapphire knife | Delaware Diamond Knives | for cutting live brain slices | |
| Scalpel | TruMed | 1001 | |
| Sodium cacodylate buffer 0.2 M pH 7.4 | Electron Microscopy Sciences | 11652 | |
| Specimen chamber for vibratome | custom-made | ||
| Stereo Dissecting Microscope | Nikon Instruments | SMZ1500 | Equipped with epifluorescence |
| straight foreceps | World Precision Intruments | 500233 | |
| straight scissors | Fine Science Tools | ||
| Sucrose | Mallinckrodt | 7723 | |
| Time-lapse fluorescence microscope (widefield fluorescence) | Nikon Instruments | TE2000-E | With custom-made cell incubator chamber (see Fotos et al., 2006) |
| Tissue culture dish polystyrene 100 mm | Thermo Fisher Scientific | 130182 | for cell culturing |
| Tissue culture dish polystyrene 60 mm | Becton Dickinson | 353004 | for cell culturing |
| Transfer pipette | American Central Scientific Co. | FFP011 | |
| Transparent tape | Scotch | ||
| Triton X-100 | Sigma Aldrich | T-8787 | |
| Trypsin (0.25%) + 2.21 mM EDTA | Corning | 25-053-CI | |
| U-118 MG human GBM cell line | ATCC | HTB-15 | Cells were transduced with a lentiviral vector encoding the entire ectodomain sequence of the L1CAM adhesion protein and then with lentiviral vector pUltra-hot encoding mCherry. Passage numbers are unknown. |
| Vacuum pump | Cole-Parmer | EW-07532-40 | "Air Cadet" |
| Vibrating tissue slicer | Vibratome | 3000 | for cutting live and fixed brain slices |
References
- Cretu, A., Fotos, J. S., Little, B. W., Galileo, D. S. Human and rat glioma growth, invasion, and vascularization in a novel chick embryo brain tumor model. Clinical & Experimental Metastasis. 22 (3), 225-236 (2005).
- Yang, M., et al. L1 stimulation of human glioma cell motility correlates with FAK activation. Journal of Neuro-Oncology. 105 (1), 27-44 (2011).
- Mohanan, V., Temburni, M. K., Kappes, J. C., Galileo, D. S. L1CAM stimulates glioma cell motility and proliferation through the fibroblast growth factor receptor. Clinical & Experimental Metastasis. 30 (4), 507-520 (2013).
- Anderson, H. J., Galileo, D. S. Small-molecule inhibitors of FGFR, integrins and FAK selectively decrease L1CAM-stimulated glioblastoma cell motility and proliferation. Cellular Oncology. 39 (3), 229-242 (2016).
- Pace, K. R., Dutt, R., Galileo, D. S. Exosomal L1CAM stimulates glioblastoma cell motility, proliferation, and invasiveness. International Journal of Molecular Sciences. 20 (16), 3982(2019).
- Stoppini, L., Buchs, P. A., Muller, D. A simple method for organotypic cultures of nervous tissue. Journal of Neuroscience Methods. 37 (2), 173-182 (1991).
- Ohnishi, T., Matsumura, H., Izumoto, S., Hiraga, S., Hayakawa, T. A novel model of glioma cell invasion using organotypic brain slice culture. Cancer Research. 58 (14), 2935-2940 (1998).
- Humpel, C. Organotypic brain slice cultures: A review. Neuroscience. 305, 86-98 (2015).
- Aaberg-Jessen, C., et al. Invasion of primary glioma- and cell line-derived spheroids implanted into corticostriatal slice cultures. International Journal of Clinical and Experimental Pathology. 6 (4), 546-560 (2013).
- Matsumura, H., Ohnishi, T., Kanemura, Y., Maruno, M., Yoshimine, T. Quantitative analysis of glioma cell invasion by confocal laser scanning microscopy in a novel brain slice model. Biochemical and Biophysical Research Communications. 269 (2), 513-520 (2000).
- Ren, B., et al. Invasion and anti-invasion research of glioma cells in an improved model of organotypic brain slice culture. Tumori. 101 (4), 390-397 (2015).
- Fayzullin, A., et al. Time-lapse phenotyping of invasive glioma cells ex vivo reveals subtype-specific movement patterns guided by tumor core signaling. Experimental Cell Research. 349 (2), 199-213 (2016).
- Jensen, S. S., et al. Establishment and characterization of a tumor stem cell-based glioblastoma invasion model. PloS One. 11 (7), e0158746(2016).
- Marques-Torrejon, M. A., Gangoso, E., Pollard, S. M. Modelling glioblastoma tumour-host cell interactions using adult brain organotypic slice co-culture. Disease Models & Mechanisms. 11 (2), 031435(2018).
- Tamura, R., et al. Visualization of spatiotemporal dynamics of human glioma stem cell invasion. Molecular Brain. 12 (1), 45(2019).
- Yang, C., et al. Organotypic slice culture based on in ovo electroporation for chicken embryonic central nervous system. Journal of Cellular and Molecular Medicine. 23 (3), 1813-1826 (2019).
- Murrell, W., et al. Expansion of multipotent stem cells from the adult human brain. PloS One. 8 (8), e71334(2013).
- Fotos, J. S., et al. Automated time-lapse microscopy and high-resolution tracking of cell migration. Cytotechnology. 51 (1), 7-19 (2006).
- Tufan, A. C., Akdogan, I., Adiguzel, E. Shell-less culture of the chick embryo as a model system in the study of developmental neurobiology. Neuroanatomy. 3 (1), 8-11 (2004).
- Shoin, K., et al. Chick embryo assay as chemosensitivity test for malignant glioma. Japanese Journal of Cancer Research. 82 (10), 1165-1170 (1991).
- Hagedorn, M., et al. Accessing key steps of human tumor progression in vivo by using an avian embryo model. Proceedings of the National Academy of Sciences. 102 (5), 1643-1648 (2005).
- Balciūniene, N., et al. Histology of human glioblastoma transplanted on chicken chorioallantoic membrane. Medicina. 45 (2), 123-131 (2009).
- De Magalhães, N., et al. Applications of a new In vivo tumor spheroid based shell-less chorioallantoic membrane 3-D model in bioengineering research. Journal of Biomedical Science and Engineering. 3 (1), 20-26 (2010).
- Szmidt, M., et al. Morphology of human glioblastoma model cultured in ovo. Journal of Veterinary Research. 56 (2), 261-266 (2012).
- Jaworski, S., et al. Comparison of tumor morphology and structure from U87 and U118 glioma cells cultured on chicken embryo chorioallantoic membrane. Journal of Veterinary Research. 57 (4), 593-598 (2013).
- Yuan, Y. J., Xu, K., Wu, W., Luo, Q., Yu, J. L. Application of the chick embryo chorioallantoic membrane in neurosurgery disease. International Journal of Medical Sciences. 11 (12), 1275-1281 (2014).
- Urbańska, K., et al. The effect of silver nanoparticles (AgNPs) on proliferation and apoptosis of in ovo cultured glioblastoma multiforme (GBM) cells. Nanoscale Research Letters. 10, 98(2015).
- DeBord, L. C., et al. The chick chorioallantoic membrane (CAM) as a versatile patient-derived xenograft (PDX) platform for precision medicine and preclinical research. American Journal of Cancer Research. 8 (8), 1642-1660 (2018).
- Han, J. M., Jung, H. J. Synergistic anticancer effect of a combination of berbamine and arcyriaflavin A against glioblastoma stem-like cells. Molecules. 27 (22), 7968(2022).
- Ruiz-Ontañon, P., et al. Cellular plasticity confers migratory and invasive advantages to a population of glioblastoma-initiating cells that infiltrate peritumoral tissue. Stem Cells. 31 (6), 1075-1085 (2013).
- Cage, T. A., et al. Distinct patterns of human medulloblastoma dissemination in the developing chick embryo nervous system. Clinical & Experimental Metastasis. 29 (4), 371-380 (2012).
- Darrigues, E., et al. Biobanked glioblastoma patient-derived organoids as a precision medicine model to study inhibition of invasion. International Journal of Molecular Sciences. 22 (19), 10720(2021).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved