需要订阅 JoVE 才能查看此. 登录或开始免费试用。
Method Article
低成本脑电图记录系统结合毫米级线圈,在体内经颅刺激小鼠大脑
摘要
提出了一种低成本的脑电图记录系统,结合毫米尺寸的线圈来驱动体内 小鼠大脑的经颅磁刺激。使用具有定制、柔性、多电极阵列基板的传统螺旋电极,可以从小鼠大脑响应经颅磁刺激进行多位点记录。
摘要
这里提出了一种低成本的脑电图(EEG)记录系统,利用毫米大小的线圈 驱动 体内小鼠大脑的经颅磁刺激(TMS)。使用传统的螺旋电极与定制的、灵活的多电极阵列基板相结合,可以从小鼠大脑进行多位点记录。此外,我们还解释了如何使用实验室中常见的低成本设备生产毫米尺寸的线圈。还介绍了制造柔性多电极阵列基板的实用程序和螺杆电极的手术植入技术,这是产生低噪声脑电信号所必需的。尽管该方法对于从任何小动物的大脑中记录是有用的,但本报告侧重于麻醉小鼠头骨中的电极实施。此外,这种方法可以很容易地扩展到清醒的小动物,它通过公共适配器 与 系留电缆连接,并在录制过程中用TMS设备固定在头部。描述了当前版本的EEG-TMS系统,其最多可以包括32个EEG通道(具有16个通道的设备作为具有较少通道的示例)和一个TMS通道设备。此外,简要报告了通过将EEG-TMS系统应用于麻醉小鼠获得的典型结果。
引言
经颅磁刺激(TMS)因其非/低侵入性而成为人脑科学,临床应用和动物模型研究的有前途的工具。在TMS应用的早期阶段,人类和动物对单脉冲和配对脉冲TMS的皮质效应的测量仅限于运动皮层;易于测量的输出仅限于涉及运动皮层的运动诱发电位和感应肌电位1,2。为了扩展可以通过TMS调制测量的大脑区域,将脑电图(EEG)记录与单脉冲和配对脉冲TMS集成在一起,作为直接检查整个大脑区域的兴奋性,连通性和时空动力学的有用方法3,4,5。因此,同时将TMS和脑电图记录(TMS-EEG)应用于大脑已被用于探测人类和动物的各种浅表皮质大脑区域,以研究皮层内神经回路(见Tremblay等人6)。此外,TMS-EEG系统可用于检查其他皮质时空特征,包括信号传播到其他皮质区域和振荡活动的产生7,8。
然而,由于TMS的非侵入性,TMS在大脑中的作用机制仍然是推测性的,这限制了我们对TMS应用期间大脑功能的知识。因此,从啮齿动物到人类的动物的侵入性转化研究对于了解TMS对神经回路及其活性的影响机制至关重要。特别是,对于动物的TMS-EEG组合实验,尚未为小动物密集开发同步刺激和测量系统。因此,实验者需要根据其特定的实验要求,通过试错来构建这样的系统。此外,小鼠模型在其他 体内 动物物种模型中是有用的,因为许多转基因和品系分离的小鼠品系可作为生物资源使用。因此,对于许多神经科学研究人员来说,为小鼠构建TMS-EEG组合测量系统的便捷方法是可取的。
本研究提出了一种TMS-EEG组合方法,可用于同时刺激和记录小鼠大脑,小鼠大脑是研究中使用的主要转基因动物类型,可以在典型的神经科学实验室中轻松构建。首先,描述了使用常规螺旋电极和柔性基板的低成本脑电图记录系统,以在每个实验中可重复地分配电极阵列位置。其次,磁刺激系统是使用毫米尺寸的线圈构建的,可以在典型的实验室中轻松定制。第三,TMS-EEG组合系统记录对声音和磁刺激的神经活动。本研究中提出的方法可以揭示在小动物中产生特定疾病的机制,并且可以翻译在动物模型中获得的结果以了解相应的人类疾病。
研究方案
在本研究中,所有动物实验均按照美国国立卫生研究院实验动物护理和使用指南进行,并得到北海道大学机构动物护理和使用委员会的批准。C57BL / 6J小鼠,两只雄性和三只雌性,8至10周龄,用于本研究。这是一个终端过程。这些动物是从商业来源获得的(见 材料表)。
1. 灵活的二维阵列设计和构造
- 准备所需数量的微型螺旋电极(不锈钢,SUS XM7;见 材料表),具有以下结构特性,用作脑电图记录和参比电极:公称直径,颈部长度和头部直径分别为0.6 mm,1.5 mm和1.1 mm(图1A)。
注意:在本研究中,使用了16个微型螺旋电极。 - 按照以下步骤在柔性基板上准备印刷电路图的蓝图。
- 在柔性基板上创建二维(2D)电极垫图案(整个尺寸,41.2 mm×19.9 mm;参见 材料表),以便读取螺杆电极。设计 2D 电极排列。 图1B 显示了本研究中使用的特定排列和基线点的相对坐标(在原点[0,0]处标记了十字)。
注意:在本研究中,为了记录颞叶内听觉皮层的神经活动,侧向至内侧(水平)方向的电极放置时间长于喙部至尾部(垂直)方向的电极放置时间长(图1B)。 - 确保对于EEG记录电极,柔性基板上的每个铜垫(见 材料表)具有外径为1.3 mm,内径为0.8 mm的环形(图1C,左)。在每个螺旋电极的中心开一个小孔(直径0.8毫米),以穿过基板。对于参比电极,每个铜焊盘应具有边长为1.4 mm的方形;同样,在每个螺钉的中心开一个小孔(直径 0.8 毫米),以穿过基板上的方形垫(图 1C,右)。
- 接下来,要焊接表面贴装连接器(图 1D,左),请设计通向连接器的读出焊盘(2D 阵列)(图 1D 右)。例如,使用具有 2 × 10 个引脚且相邻引脚间距为 1.27 mm 的连接器(图 1D,右)。
- 使用表面和背面层对螺旋电极焊盘和连接器焊盘进行接线,线宽为 0.03 mm,线间隔为 0.03 mm( 图 1E 中的细线)。
- 此外,要将基准和接地通道连接到放大器,请将参考电极和接地电极的电极焊盘连接到柔性2D阵列外部的隔离部分( 图1E底部的两个垂直矩形由"G"和"HR"表示)。确定基准和接地通道后,请记住将电极焊盘焊接到相应的连接器上(参见步骤2.1)。
- 正确设计未被保护层(聚酰亚胺层)覆盖的暴露区域。暴露表面层中的连接器焊盘,同时露出表面和背面的螺旋电极焊盘。整个电极设计、尺寸和制造的柔性2D阵列如图 1E所示,制造基板的图像如图 1F所示。
- 在柔性2D阵列的顶部电极部分(头部)中,确保从上到下的三层结构由以下部分组成(总厚度为49.0μm):顶部铜层(12.0μm厚度),中间层核心聚酰亚胺(25.0μm)和底部铜层(12.0μm)(图1G,顶部)。
- 在基板的顶部和底部表面上蚀刻铜层,例如,使用湿法蚀刻和标准制造技术9。
- 在柔性二维阵列的底部方形焊盘部分(连接器部分),确保六层结构由三层组成,包括顶部铜层(12.0 μm厚)、中间芯聚酰亚胺层(25.0 μm)和底部铜层(12.0 μm),它们夹在保护性聚酰亚胺层中,包括顶部和底部(均为12.5 μm)层。从底部连接一块 2 mm 聚酰亚胺板作为增强材料(图 1G,底部)。
注意:为了保持柔韧性,增强型聚酰亚胺板未安装在头部和连接器部分之间的柔性 2D 阵列的颈部部分。 - 同样,在连接器部分,使用湿法蚀刻和标准制造技术在顶部蚀刻铜和保护性聚酰亚胺层。
注:柔性 2D 阵列设备(包括连接器)的总重量为 0.84 g。在为灵活的2D阵列设计布局后,为了方便起见,有时建议使用商业制造商的基板(参见 材料表)。
- 在柔性基板上创建二维(2D)电极垫图案(整个尺寸,41.2 mm×19.9 mm;参见 材料表),以便读取螺杆电极。设计 2D 电极排列。 图1B 显示了本研究中使用的特定排列和基线点的相对坐标(在原点[0,0]处标记了十字)。
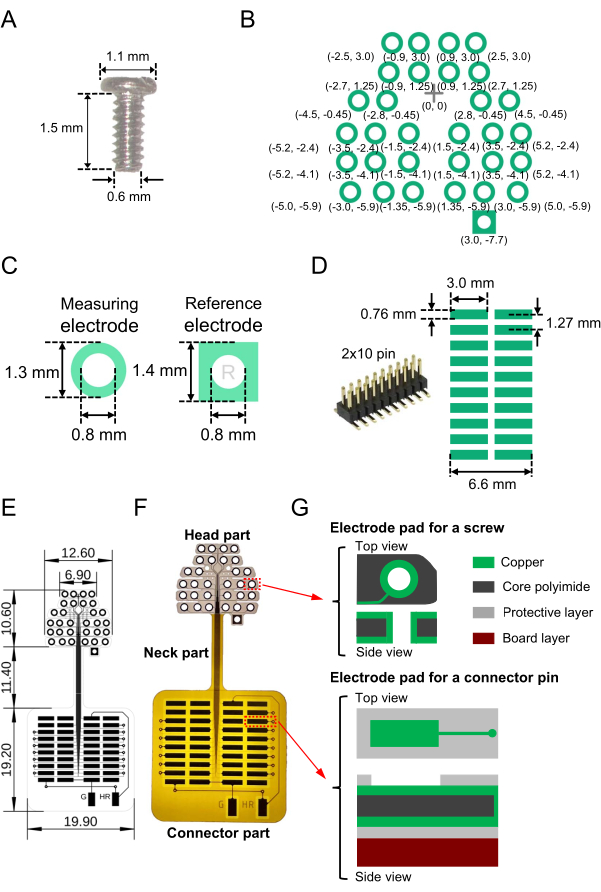
图 1:用于脑电图 (EEG) 记录的柔性二维 (2D) 阵列的组成部分和包括阵列在内的制造设备。 (A)嵌入小鼠头骨中的微型螺旋电极。(B)设计的用于测量大脑活动的电极垫(绿色圆圈)和参考通道(右下角的正方形)。显示了电极焊盘从原点(0, 0)处的参考点(十字标记)的相对坐标;括号中以毫米为单位的大小。电极焊盘的中心坐标相对于通过十字标记的垂直轴是对称的。(C) 图示了记录电极(左)和参比电极(右)的电极垫和钻孔。(D) 用于柔性 2D 阵列的表面贴装连接器(2 × 10 引脚)(左)以及基板上设计焊盘的图案和尺寸(右)。(E) 设计蓝图,每个零件的尺寸以毫米为单位。(F) E中蓝图所示的人造基板的图像。(G)柔性二维阵列的层结构(头部和连接器部分)。图示了螺旋电极垫(顶部)和读出垫(底部)的顶部和侧面视图。头部和连接器部分分别由三层结构(顶部)和六层结构(底部)组成。此外,颈部部分由五层结构组成;在顶部和背面表面安装保护性聚酰亚胺层,而加强聚酰亚胺板不安装在颈部部分。 请点击此处查看此图的大图。
2. 适配器构造和通道映射
- 按照以下步骤执行适配器构造。
- 在柔性基板上的 2 × 10 引脚表面贴装连接器(图 1D 左)和 2D 阵列的连接器焊盘(图 1D 右)(参见 材料表)上涂抹助焊剂。
- 将 2 × 10 引脚表面贴装连接器焊接到连接器焊盘上。特别是,确认 2D 阵列下部的两个焊盘与用作参考通道和接地通道的两个连接器引脚之间的连接(图 2A)。
- 将两个焊盘中的每一个连接到单独的引线,以将基线信号馈送到外部点(例如,连接到测量系统的接地通道的接地点; 图2A)。
注意:然而,在本研究中,其中一个带有螺旋电极的圆形电极垫被用作参比电极,而不是连接器部分中的方形电极。 - 焊接后,使用环氧树脂(见 材料表)覆盖焊接点,以保护暴露点并防止短路。
- 按照以下步骤固定连接器电缆和磁头放大器。
- 准备一个绝缘位移连接器 (IDC),该连接器具有 2 × 10 针脚和 1.27 mm 间距(图 2B,左上角)和扁平 20 针带状电缆(参见材料表),间距为 0.635 mm(图 2B,左下角)。将扁平带状电缆切割成所需的长度(例如 40 厘米)。
- 使用 IDC 压接工具压接 IDC 和扁平带状电缆的一端(图 2B,右上角)(参见 材料表)。
- 使用切割器将电缆另一端的每条线与尖端分开约 15 mm。从尖端剥离绝缘层 3 mm。
- 将压接的 IDC 连接到扁平带状电缆,并将 2 × 10 针连接器焊接到柔性基板上(图 2C)。
- 确认记录电极与电缆分隔线之间的对应关系。确保使用的每条线路都不会产生不正确的连接错误。
- 将与每个电极输出相对应的单条线路的裸露铜线焊接到测量系统的 20 针连接器(1.25 mm 间距),包括主放大器(图 2B,右下角)。
- 焊接后,使用测试设备(例如,LCR计;见 材料表)确认螺旋电极焊盘和连接器引脚之间的传导。
- 使用环氧树脂和屏蔽胶带覆盖焊接点,以保护它们免受损坏并防止与其他信号线接触。
- 使用环氧树脂,将细不锈钢棒(直径:1.1-1.2 mm;长度:100 mm)粘附在柔性基板上 2D 阵列连接器部分的背面。
注意:在实验过程中,该不锈钢棒可以通过显微操纵器支架抓住(图2C)。 - 最后,确认螺旋电极和信号输出通道之间的映射(图2D)。
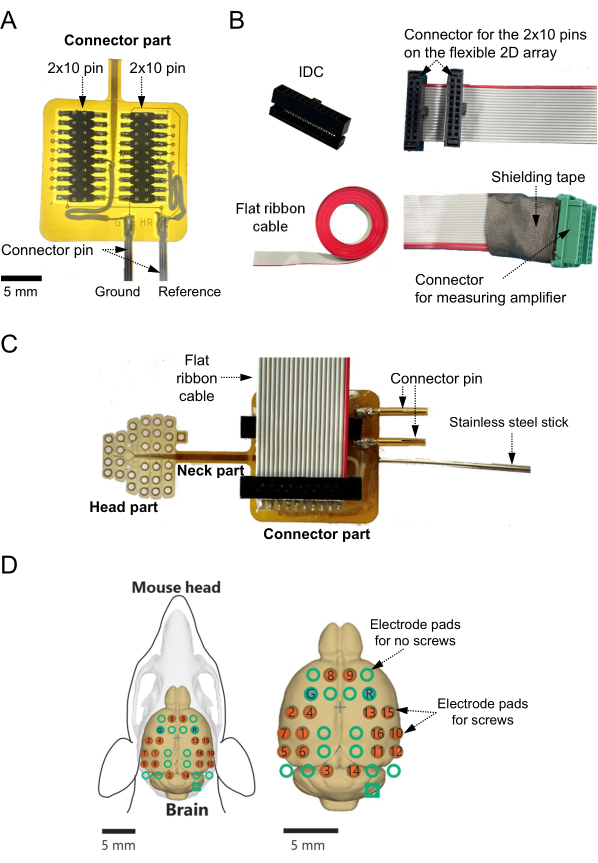
图 2:在柔性基板上构建二维 (2D) 电极阵列的适配器并记录通道映射。 (A) 在连接器部分,参考和接地通道通过引线连接到底部电极焊盘。如果事先确定了参考通道和接地通道,则应在设计阶段将通道连接到相应的底部电极焊盘。在这种情况下,无需将引线焊接到通道和电极焊盘上。(B) 绝缘位移连接器(左上)压接到扁平电缆的一端(左下),以连接测量放大器连接器(右上)。与要使用的通道相对应的所有线路都焊接到绿色连接器(右下角)。在这种情况下,由于连接到头部放大器的每个绿色连接器都被分配用于八通道测量,因此至少需要两个连接器来记录 16 通道的大脑活动信号。焊接点覆盖有环氧树脂和屏蔽胶带,以防止与其他信号线接触。(C)连接器和制造的电缆放置在柔性2D阵列基板的表面上。细不锈钢棒连接到柔性基板的背面。(D)显示小鼠大脑表面记录通道的空间位置以及测量系统每个点的通道图。在这种情况下,有 16 个带有螺旋电极(红色圆圈)的记录通道,尽管可能的记录站点总数为 32。其他16个非记录通道在大脑表面也显示为绿色圆圈。在映射图中,"G"和"R"分别表示为接地电极和参比电极设计的通道。 请点击此处查看此图的大图。
3. 动物手术
- 准备无菌手术环境。
- 在整个涉及动物的实验过程中穿戴防护设备,如乳胶手套。
- 对立体定位装置和手术器械进行消毒(见 材料表)。
- 手术器械消毒后,使用无菌盐水清洗。
- 麻醉动物。
- 手术前测量小鼠的重量。通过腹腔注射给予硫酸阿托品(0.04mg / kg;参见材料表)。
- 通过腹膜内注射美托咪定(0.3mg / kg),咪达唑仑(4.0mg / kg)和布托酚(5.0mg / kg)的混合物 麻醉 小鼠。
- 通过捏住脚趾 的反应 水平确认麻醉深度。
注意:麻醉将在大约 40 分钟后消失。如果小鼠对脚趾捏有反应,则通过腹膜内注射 给予 相同剂量的麻醉混合物。
- 为电极植入手术做准备。
- 剪掉老鼠胡须以防止触觉。
- 用眼药膏润滑双眼以防止干燥。闭上眼睑以阻碍视线,并通过用修补胶带粘附上下眼睑来保持闭合。
- 用电剪剃掉鼠标头上的毛发。将温度计插入直肠,并使用加热垫将体温保持在37°C。
- 将盐酸利多卡因作为局部局部麻醉剂施用于将要切开的小鼠头皮部分。
- 使用手术刀或手术剪刀沿咀嚼到尾部方向切开小鼠头皮(区域大小:7×10mm2)。
- 用镊子捏住切开部位附近的头皮并提起。使用手术刀或手术剪刀去除颅骨上的可见膜。手术过程中不要破坏眼睛周围的血管。
- 用镊子抓住头皮切口线中心附近的皮肤,并扩大切口部分以广泛暴露颅骨顶部。
- 确认用手术剪刀完全去除颅骨表面的所有膜和λ周围的组织。
- 用生理盐水润湿颅骨表面,以增强颅骨下大脑表面的可见性并定位横窦。
注意:将螺旋电极植入颅骨时,请记住不要将它们嵌入横窦上方和横窦中。
4. 电极植入
- 将安装在柔性基板背面的 2D 电极阵列上的不锈钢棒连接到显微操纵器上。将柔性基质放在头骨上。
- 调整阵列上通道 (Chs) 3 和 14(图 2D)的位置,以适合下部串。
注意:下丘位于横窦。我们建议提前使用小鼠脑图谱确认下丘的位置。 - 用永久性标记在头骨上的 Chs 3、8、9 和 14(图 2D)的位置绘制小圆圈,用作目标地标。
- 干燥颅骨表面以增强对牙科水泥的附着力,并将柔性基板上的 2D 电极阵列与小鼠头骨电隔离。
- 将牙科水泥(约1毫米厚;见 材料表)涂在颅骨表面。应用牙科水泥后,等待大约 30 分钟使其固化。
- 根据颅骨表面的小圆形标记对齐柔性基材。
- 将牙钻的尖端对准柔性基板上的每个电极垫孔。通过每个电极垫孔小心地钻入颅骨。
- 使用用于微型螺钉的专用螺丝刀将每个微型螺旋电极拧入颅骨上的钻孔中。
- 拧紧螺旋电极头和电极垫。最后,使用测试设备(例如LCR计)测量每个螺旋电极和连接器之间的电导率以确认电导率。
5.小线圈设计与施工
- 使用计算机辅助设计(CAD)软件(见材料表)设计一个圆环形圆盘(见补充编码文件1),中心有一个孔(内径:2毫米;外径:7毫米;厚度:1毫米)。
- 使用3D打印机打印两个由非耐热材料(例如聚乳酸丝)制成的磁盘(图3A,左);非耐热材料并不总是必需的(见下文)。
- 修剪一根坡摩合金-45 杆(直径:2 毫米;见 材料表)以形成短轴(长度:60 毫米)。
- 将轴插入两个 3D 打印圆盘的每个孔中(图 3A,右)。将一个圆盘放在轴的末端,另一个圆盘距离端 11 mm,使两个圆盘之间的距离为 10 mm。用即时胶水粘附磁盘(请参阅 材料表)。
- 将不带圆盘的轴端连接到冲击起子(图 3B)。将小磁铁连接到坡莫合金-45轴上。将霍尔效应传感器放置在距离轴 5 mm 的磁体附近。将霍尔效应传感器连接到数据采集(DAQ;参见 材料表)系统。
- 要计算匝数,请准备一个计算机程序(参见 材料表),用于分析霍尔效应传感器通过DAQ系统的输出信号。
- 将细铜线(直径:0.16 mm)连接到轴上,并用即时胶粘附在电线的顶端。
- 使用冲击起子,在两个圆盘之间缠绕铜线 1,000 圈。虽然转速是任意的,但通常使用大约每秒 5 转。然后,用即时胶水粘附在缠绕线上。
- 从轴上拆下两个圆盘。如果圆盘牢固地粘附在轴上,请使用热风枪熔化圆盘。
- 用环氧树脂覆盖线圈以绝缘和固定表面。然后,将未缠绕的轴部分作为多余的部分切掉。
- 确保获得的线圈高度为 10 mm,直径为 6 mm(图 3B,左)。对于线圈操作,要么构建线圈支架(图 3C,右),要么将不锈钢棒粘在线圈上(此处未显示)。
- 使用LCR计测量线圈的电阻和电感(参见 材料表)。例如,此处使用的线圈在 1 kHz 交流 (AC) 输入时的直流 (DC) 电阻为 18.3 Ω,电感为 7.9 mH。交流特性(电阻和电感)如图 3D所示。
- 使用函数发生器将双极方波施加到线圈上。输入电压的典型幅度为20 V,通过双极性电源,增益为10倍,跟随2 V发生器输出。产生的波形是振幅约为20 V(即峰峰值电压为40 V)的双极性方波(图3E)。
- 使用霍尔效应传感器和DAQ系统测量磁通密度。例如,在这种情况下,当线圈底部与霍尔效应传感器接触时,线圈的磁通密度 (B) 为 113.6 ±2.5 mT(平均 ± SEM)(图 3F)。
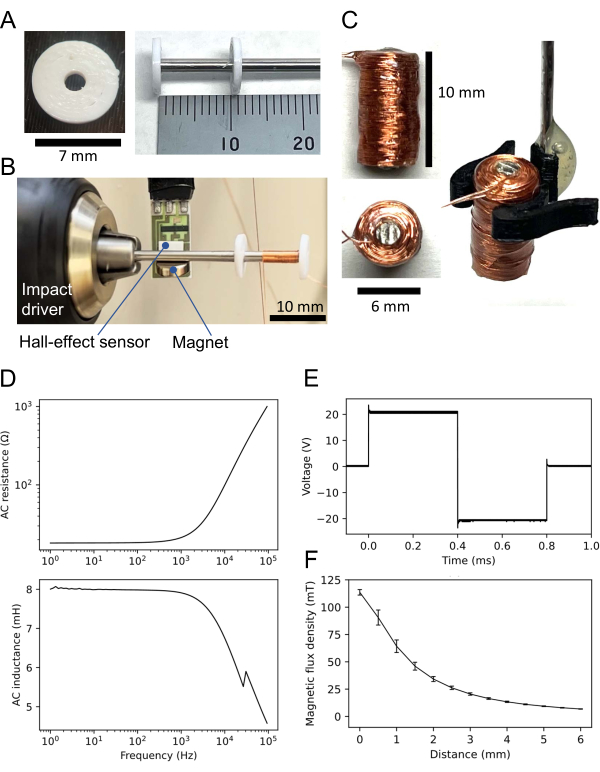
图 3:用于磁刺激的小线圈。 (A) 三维 (3D) 打印圆盘(左)。两个相同的圆盘粘附在坡摩合金-45轴上;一个在轴的末端,另一个在 10 毫米外(右)。(B) 线圈绕组的设置。带有两个圆盘的 60 mm 轴连接到冲击起子上。霍尔效应传感器放置在连接到轴上的小磁铁附近。铜线缠绕在两个圆盘之间。(c) 构造线圈。线圈高10毫米,直径6毫米,铜线1000圈。图的右侧显示了由3D打印线圈支架操纵的线圈。(D) LCR 仪表记录的线圈的交流特性:(顶部)电阻与正弦输入频率的关系;(下图)电感与输入频率的关系。典型线圈在 1 kHz 交流输入时的电阻和电感分别为 21.6 和 7.9 mH。(E) 双相矩形波形,用作示波器记录的线圈输入。(F) 磁通密度与构造线圈与霍尔效应传感器之间的距离之间的关系。磁通密度由五个不同的霍尔效应传感器记录,每个传感器一次。绘制了五个测量值的平均值,误差线表示平均值的标准误差。 请点击此处查看此图的大图。
6. 信号记录系统及程序
- 使用扁平带状电缆将柔性 2D 阵列连接到记录系统(参见 材料表)。
- 将安装在线圈上的不锈钢棒连接到显微操纵器(见 材料表)。
- 将线圈放在前膛上方,并调整尾部方向的位置,以将焦点定位在下丘上方。发射电场的焦点是线圈底面上绕线区域的中线(即从边缘到中心1mm)。
- 准备一个由双极电源和函数发生器组成的刺激系统(见 材料表),并将线圈连接到系统。
- 在函数发生器的输入端子和DAQ系统的输出端子之间连接一根电缆,以将DAQ系统的触发信号施加到函数发生器。准备适当的计算机程序,用于触发触发信号以启动刺激。此外,将DAQ系统连接到记录系统,以将刺激时间保存为时间戳。
- 启动记录系统的采集过程。
注:如果录音系统拾取噪音,请找到噪音源并降低噪音。 - 通过触发刺激系统来测试磁刺激。
注意:如果磁刺激产生的噪声使测量范围饱和,请正确调整范围。此外,确认记录系统正确保存刺激时间戳。 - 开始记录反应数据并开始刺激会话。每次刺激会话完成后停止记录。保存所有记录的数据以供后续分析。
注意:例如,为了使用五种不同的磁强度执行所有实验条件,所有会话所需的总时间约为75分钟。终点通常在所有录制会话结束后确定。然而,当动物出现咳嗽、呼吸困难和喘息等临床症状时,实验过程立即终止。对于安乐死,在动物麻醉下使用锋利、干净的剪刀进行斩首。
7. 数据分析
- 使用截止频率为200 Hz的低通滤波器滤波宽带(原始)信号。
- 在每个刺激时间戳周围的时间窗口内收集滤波波形。平均波形以获得事件相关电位(ERP)波形(图4 和 图5)。
结果
在麻醉的C57BL / 6J小鼠中记录的样品脑电图数据,柔性基质与螺旋电极相结合,如下所示。
作为一个典型的例子,在具有相同刺激的60项试验中,显示了响应声音刺激(8 kHz音爆,80 dB声压级[SPL])而产生的平均EEG波形(图4A)。记录通道映射的原理图也显示在图4A的中间。来自CHS 5,7,10和12的反应是从两个颞叶的听觉皮层附近区域记录?...
讨论
这项研究涉及多点脑电图记录系统与为小动物(包括小鼠)设计的磁刺激系统相结合。构建的系统成本低,易于在生理实验室中构建,并且可以扩展其现有的测量设置。如果这些实验室以前有标准电生理实验的经验,那么从小鼠记录系统获取数据所需的外科手术非常简单。
使用这种方法的一个优点是电极放置在单个动物的头部和头皮上的良好可重复性。用于将螺旋电极分配?...
披露声明
作者没有什么可透露的。
致谢
这项工作得到了村田科学基金会、铃轩纪念基金会、中谷生物医学工程测量技术促进基金会以及探索性研究(批准号21K19755,日本)和科学研究(B)(批准号23H03416,日本)的资助。
材料
| Name | Company | Catalog Number | Comments |
| 3D printer | Zhejiang Flashforge 3D Technology Co., Ltd | FFD-101 | The printer used for 3D-printing the donut-shaped disks |
| ATROPINE SULFATE 0.5 mg | NIPRO ES PHARMA CO., LTD. | - | Atropine sulfate |
| Bipolar amplifier | NF Corp. | KIT61380 | For amplifying waveforms for coil input |
| Butorphanol | Meiji Seika Pharma Co., Ltd., Tokyo, Japan | - | For anathesis of animals |
| Commercial manufacturer of flexible 2D array | p-ban.com Corp. | - | URL: https://www.p-ban.com/ |
| Computer prograom to analyze output signals | Natinal Instruments | NI-DAQ and NI-DAQmx Python | To analyze output signals from the hall-effect sensor |
| Connector | Harwin Inc. | G125-FV12005L0P | For connector to conect to the measuring system |
| Copper pad | p-ban.com Corp. | copper | Copper pad on each substrate |
| Copper wire | Kyowa Harmonet Ltd. | P644432 | The windings of the coil |
| DAQ board | National Instruments Corp. | USB-6343 | For measuring the magnitic flux density of the coil |
| Dental cement | SHOFU INC. | Quick Resin | Self-Curing Orthodontic Resin |
| ECoG electrode | NeuroNexus Inc. | HC32 | For reference to design of the flexible 2D array |
| Epoxy resin | Konishi Co. Ltd. | #16123 | For coil construction |
| Ethyl Carbamate | FUJIFILM Wako Pure Chemical Corp. | 050-05821 | For urethan anesthesia |
| Flat ribbon cable | Oki Electric Cable Co., Ltd. | FLEX-B2(20)-7/0.1 20028 5m | For cable to connect between surface-mount connector and measuring sysytem |
| flexible substrate | p-ban.com Corp. | polyimide | Baseplate of flexible substrate |
| Function generator | NF Corp. | WF1947 | For generating waveforms for coil input |
| Hall-effect sensor | Honeywell International Inc. | SS94A2D | For measuring the magnitic flux density of the coil |
| IDC crimping tool | Pro'sKit Industries Co. | 6PK-214 | To crimp the IDC and one end of the flat ribbon cable; Flat cable connector crimping tool |
| Instant glue | Konishi Co. Ltd. | #04612 | For coil construction |
| Insulation-displacement connector (IDC ) | Uxcell Japan | B07GDDG3XG | 2 × 10 pins and a 1.27 mm pitch |
| LCR meter | NF Corp. | ZM2376 | For measuring the AC properties of the coil |
| Manipulator | NARISHIGE Group. | SM-15L | For manipulating the coil |
| Medetomidine | Kobayashi Kako, Fukui, Japan | - | For anathesis of animals |
| Midazolam | Astellas Pharma, Tokyo, Japan | - | For anathesis of animals |
| Miniature screw | KOFUSEIBYO Co., Ltd. | S0.6*1.5 | For EEG-senseing and reference electrode |
| Mouse | Japan SLC, Inc. | C57BL/6J (C57BL/6JJmsSlc) | Experimental animal |
| Permalloy-45 rod | The Nilaco Corp. | 780544 | The core of the coil |
| Recording system | Plexon Inc. | OmniPlex | For EEG data acquisition |
| Stainless wire | Wakisangyo Co., Ltd. | HW-136 | For grasp by manipulator |
| Stereotaxic apparatus | NARISHIGE Group. | SR-5M-HT | To fix a mouse head |
| Surface-mount connector | Useconn Electronics Ltd. | PH127-2x10MG | For connector to mount on the flexible 2D array |
| Testing equipment (LCR meter) | NF Corp. | ZM2372 | Contact check and impedance measurements |
| White PLA filament | Zhejiang Flashforge 3D Technology Co., Ltd | PLA-F13 | The material used for 3D-printing the donut-shaped disks |
| Xylocaine Jelly 2% | Sandoz Pharma Co., Ltd. | - | lidocaine hydrochloride |
参考文献
- Ilmoniemi, R. J., et al. Neuronal responses to magnetic stimulation reveal cortical reactivity and connectivity. Neuroreport. 8 (16), 3537-3540 (1997).
- Hallett, M. Transcranial magnetic stimulation: a primer. Neuron. 55 (2), 187-199 (2007).
- Thut, G., Pascual-Leone, A. Integrating TMS with EEG: How and what for. Brain Topography. 22 (4), 215-218 (2010).
- Ilmoniemi, R. J., Kicic, D. Methodology for combined TMS and EEG. Brain Topograpy. 22 (4), 233-248 (2010).
- Daskalakis, Z. J., Farzan, F., Radhu, N., Fitzgerald, P. B. Combined transcranial magnetic stimulation and electroencephalography: its past, present and future. Brain Research. 1463, 93-107 (2012).
- Tremblay, S., et al. Clinical utility and prospective of TMS-EEG. Clinical Neurophysiology. 130 (5), 802-844 (2019).
- Pellicciari, M. C., Veniero, D., Miniussi, C. Characterizing the cortical oscillatory response to TMS pulse. Frontiers in Cellular Neuroscience. 11, 38 (2017).
- Lin, Y. J., Shukla, L., Dugue, L., Valero-Cabre, A., Carrasco, M. Transcranial magnetic stimulation entrains alpha oscillatory activity in occipital cortex. Scientific Reports. 11 (1), 18562 (2021).
- Takahashi, S., et al. Laminar responses in the auditory cortex using a multielectrode array substrate for simultaneous stimulation and recording. IEEJ Transactions Electrical and Electronic Engineering. 14 (2), 303-311 (2019).
- Yoshikawa, T., Higuchi, H., Furukawa, R., Tateno, T. Temporal and spatial profiles of evoked activity induced by magnetic stimulation using millimeter-sized coils in the mouse auditory cortex in vivo. Brain Research. 1796, 148092 (2022).
- Tang, A. D., et al. Construction and evaluation of rodent-specific rTMS coils. Frontiers in Neural Circuits. 10, 47 (2016).
- Li, L. Controlling annealing and magnetic treatment parameters to achieve high permeabilities in 55 Ni-Fe toroid cores. IEEE Transactions on Magnetics. 37 (4), 2315-2317 (2001).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。