È necessario avere un abbonamento a JoVE per visualizzare questo. Accedi o inizia la tua prova gratuita.
Method Article
Sistema di registrazione elettroencefalografica a basso costo combinato con una bobina di dimensioni millimetriche per stimolare transcranicamente il cervello del topo in vivo
In questo articolo
Riepilogo
Viene proposto un sistema di registrazione elettroencefalografica a basso costo combinato con una bobina di dimensioni millimetriche per guidare la stimolazione magnetica transcranica del cervello del topo in vivo. Utilizzando elettrodi a vite convenzionali con un substrato multielettrodo personalizzato, flessibile e multielettrodo, è possibile eseguire la registrazione multi-sito dal cervello del topo in risposta alla stimolazione magnetica transcranica.
Abstract
Un sistema di registrazione elettroencefalografico (EEG) a basso costo è proposto qui per guidare la stimolazione magnetica transcranica (TMS) del cervello del topo in vivo, utilizzando una bobina di dimensioni millimetriche. Utilizzando elettrodi a vite convenzionali combinati con un substrato multielettrodo personalizzato, flessibile e multielettrodo, è possibile eseguire la registrazione multi-sito dal cervello del topo. Inoltre, spieghiamo come viene prodotta una bobina di dimensioni millimetriche utilizzando attrezzature a basso costo che di solito si trovano nei laboratori. Vengono inoltre presentate le procedure pratiche per la fabbricazione del substrato flessibile multielettrodo e la tecnica di impianto chirurgico per elettrodi a vite, necessari per produrre segnali EEG a basso rumore. Sebbene la metodologia sia utile per la registrazione dal cervello di qualsiasi piccolo animale, il presente rapporto si concentra sull'implementazione di elettrodi in un cranio di topo anestetizzato. Inoltre, questo metodo può essere facilmente esteso a un piccolo animale sveglio che è collegato con cavi legati tramite un adattatore comune e fissato con un dispositivo TMS alla testa durante la registrazione. Viene descritta l'attuale versione del sistema EEG-TMS, che può includere un massimo di 32 canali EEG (un dispositivo con 16 canali è presentato come esempio con meno canali) e un dispositivo di canale TMS. Inoltre, vengono brevemente riportati i risultati tipici ottenuti dall'applicazione del sistema EEG-TMS a topi anestetizzati.
Introduzione
La stimolazione magnetica transcranica (TMS) è uno strumento promettente per la scienza del cervello umano, l'applicazione clinica e la ricerca su modelli animali a causa della sua non/bassa invasività. Durante la fase iniziale delle applicazioni della TMS, la misurazione dell'effetto corticale in risposta alla TMS a impulso singolo e accoppiato nell'uomo e negli animali era limitata alla corteccia motoria; L'output facilmente misurabile era limitato ai potenziali evocati motori e ai potenziali mioelettrici indotti che coinvolgevano la corteccia motoria 1,2. Per espandere le regioni cerebrali che possono essere misurate dalla modulazione TMS, la registrazione elettroencefalografica (EEG) è stata integrata con TMS a impulso singolo e accoppiato come metodo utile per esaminare direttamente l'eccitabilità, la connettività e le dinamiche spaziotemporali delle aree in tutto il cervello 3,4,5. Pertanto, l'applicazione simultanea della registrazione TMS e EEG (TMS-EEG) al cervello è stata utilizzata per sondare varie aree cerebrali corticali superficiali di esseri umani e animali per studiare i circuiti neurali intracorticali (vedi Tremblay et al.6). Inoltre, i sistemi TMS-EEG possono essere utilizzati per esaminare ulteriori caratteristiche spaziotemporali corticali, tra cui la propagazione di segnali ad altre aree corticali e la generazione di attività oscillatoria 7,8.
Tuttavia, il meccanismo d'azione della TMS nel cervello rimane speculativo a causa della non invasività della TMS, che limita la nostra conoscenza di come funziona il cervello durante le applicazioni della TMS. Pertanto, gli studi traslazionali invasivi in animali che vanno dai roditori all'uomo sono di cruciale importanza per comprendere il meccanismo degli effetti della TMS sui circuiti neurali e la loro attività. In particolare, per gli esperimenti combinati TMS-EEG negli animali, non è stato sviluppato in modo intensivo un sistema di stimolazione e misurazione simultanea per i piccoli animali. Pertanto, gli sperimentatori sono tenuti a costruire un tale sistema per tentativi ed errori in base alle loro specifiche esigenze sperimentali. Inoltre, i modelli murini sono utili tra gli altri modelli di specie animali in vivo perché molti ceppi di topi transgenici e isolati dal ceppo sono disponibili come risorse biologiche. Pertanto, un metodo conveniente per costruire un sistema di misurazione combinato TMS-EEG per topi sarebbe auspicabile per molti ricercatori di neuroscienze.
Questo studio propone un metodo combinato TMS-EEG che può essere applicato per la stimolazione simultanea e la registrazione del cervello del topo, che è il principale tipo di animale transgenico utilizzato nella ricerca e che può essere facilmente costruito nei tipici laboratori di neuroscienze. In primo luogo, viene descritto un sistema di registrazione EEG a basso costo utilizzando elettrodi a vite convenzionali e un substrato flessibile per assegnare in modo riproducibile una posizione di array di elettrodi in ogni esperimento. In secondo luogo, un sistema di stimolazione magnetica è costruito utilizzando una bobina di dimensioni millimetriche, che può essere facilmente realizzata su misura nei laboratori tipici. In terzo luogo, il sistema combinato TMS-EEG registra l'attività neurale in risposta alla stimolazione sonora e magnetica. Il metodo presentato in questo studio può rivelare i meccanismi che generano disturbi specifici nei piccoli animali e i risultati ottenuti nei modelli animali possono essere tradotti per comprendere i corrispondenti disturbi umani.
Protocollo
Nel presente studio, tutti gli esperimenti sugli animali sono stati eseguiti seguendo la Guida del National Institutes of Health per la cura e l'uso degli animali da laboratorio e con l'approvazione del Comitato istituzionale per la cura e l'uso degli animali dell'Università di Hokkaido. Per il presente studio sono stati utilizzati topi C57BL / 6J, due maschi e tre femmine, di età compresa tra 8 e 10 settimane. Questa è una procedura terminale. Gli animali sono stati ottenuti da una fonte commerciale (vedi Tabella dei materiali).
1. Progettazione e costruzione di array bidimensionali flessibili
- Preparare il numero richiesto di elettrodi a vite miniaturizzati (inossidabile, SUS XM7; vedere la tabella dei materiali) con le seguenti proprietà strutturali da utilizzare come elettrodi di registrazione EEG e di riferimento: diametro nominale, lunghezza del collo e diametro della testa rispettivamente di 0,6 mm, 1,5 mm e 1,1 mm (Figura 1A).
NOTA: Nel presente studio sono stati utilizzati 16 elettrodi a vite miniaturizzati. - Preparare un progetto di uno schema elettrico stampato su un substrato flessibile seguendo i passaggi seguenti.
- Creare un modello di elettrodi bidimensionale (2D) su un substrato flessibile (dimensioni intere, 41,2 mm × 19,9 mm; vedere la tabella dei materiali) per la lettura degli elettrodi a vite. Progettare la disposizione degli elettrodi 2D. La figura 1B mostra le disposizioni specifiche utilizzate in questo studio e le coordinate relative da un punto di riferimento (contrassegnato in croce all'origine [0, 0]).
NOTA: Nel presente studio, per registrare l'attività neurale nella corteccia uditiva all'interno dei lobi temporali, il posizionamento degli elettrodi nella direzione laterale-mediale (orizzontale) era più lungo di quello nella direzione rostrale-caudale (verticale) (Figura 1B). - Assicurarsi che per gli elettrodi di registrazione EEG, ogni tampone di rame (vedere Tabella dei materiali) sul substrato flessibile abbia una forma ad anello con un diametro esterno di 1,3 mm e un diametro interno di 0,8 mm (Figura 1C, a sinistra). Fare un piccolo foro (0,8 mm di diametro) al centro per ogni elettrodo a vite per passare attraverso il substrato. Per gli elettrodi di riferimento, ogni pad di rame dovrebbe avere una forma quadrata con una lunghezza laterale di 1,4 mm; allo stesso modo, praticare un piccolo foro (diametro di 0,8 mm) al centro affinché ciascuna vite passi attraverso il tampone quadrato sul substrato (Figura 1C, a destra).
- Successivamente, per saldare un connettore a montaggio superficiale (Figura 1D, a sinistra), progettare i pad di lettura (array 2D) che conducono al connettore (Figura 1D, a destra). Ad esempio, utilizzare un connettore con 2 × 10 pin e un passo di 1,27 mm tra pin adiacenti (Figura 1D, a destra).
- Collegare i cuscinetti degli elettrodi a vite e i pad dei connettori utilizzando sia la superficie che lo strato posteriore con una larghezza di linea di 0,03 mm e un intervallo di linea di 0,03 mm (linee sottili nella Figura 1E).
- Inoltre, per collegare i canali di riferimento e di terra all'amplificatore, collegare i pad degli elettrodi per gli elettrodi di riferimento e di massa alla parte isolata all'esterno dell'array 2D flessibile (due rettangoli verticali indicati da "G" e "HR" nella parte inferiore della Figura 1E). Dopo aver determinato i canali di riferimento e di terra, ricordarsi di saldare i cuscinetti degli elettrodi ai connettori corrispondenti (vedere il punto 2.1).
- Progettare correttamente un'area esposta che non sia coperta da uno strato protettivo (strato di poliimmide). Esporre i cuscinetti dei connettori nello strato superficiale mentre si espongono i cuscinetti degli elettrodi a vite sia nello strato superficiale che in quello posteriore. L'intero design dell'elettrodo, le dimensioni e l'array 2D flessibile fabbricato sono illustrati nella Figura 1E e l'immagine di un substrato fabbricato è mostrata nella Figura 1F.
- Nella parte superiore dell'elettrodo (parte della testa) della matrice 2D flessibile, assicurarsi che la struttura a tre strati dall'alto verso il basso sia composta da quanto segue (spessore totale di 49,0 μm): uno strato superiore di rame (spessore 12,0 μm), uno strato intermedio di poliimmide centrale (25,0 μm) e uno strato inferiore di rame (12,0 μm) (Figura 1G, in alto).
- Incidere gli strati di rame sulla superficie superiore e inferiore del substrato, ad esempio, utilizzando l'incisione a umido e la tecnica di fabbricazione standard9.
- Nella parte inferiore quadrata del pad (parte del connettore) della matrice 2D flessibile, assicurarsi che la struttura a sei strati sia composta da tre strati, tra cui uno strato superiore di rame (spessore 12,0 μm), uno strato centrale di poliimmide (25,0 μm) e uno strato inferiore di rame (12,0 μm), che sono inseriti da strati protettivi di poliimmide, inclusi strati superiore e inferiore (entrambi 12,5 μm). Attaccare un pannello di poliimmide da 2 mm dal basso come materiale di rinforzo (Figura 1G, in basso).
NOTA: per mantenere la flessibilità, la scheda di rinforzo in poliimmide non è montata sulla parte del collo dell'array 2D flessibile tra la testa e la parte del connettore. - Allo stesso modo, nella parte del connettore, incidere gli strati di rame e poliimmide protettiva sulla parte superiore utilizzando l'incisione a umido e la tecnica di fabbricazione standard.
NOTA: il peso totale del dispositivo array 2D flessibile fabbricato, incluso il connettore, è di 0,84 g. Dopo aver progettato un layout per un array 2D flessibile, i substrati di un produttore commerciale (vedere la tabella dei materiali) sono talvolta consigliati per comodità.
- Creare un modello di elettrodi bidimensionale (2D) su un substrato flessibile (dimensioni intere, 41,2 mm × 19,9 mm; vedere la tabella dei materiali) per la lettura degli elettrodi a vite. Progettare la disposizione degli elettrodi 2D. La figura 1B mostra le disposizioni specifiche utilizzate in questo studio e le coordinate relative da un punto di riferimento (contrassegnato in croce all'origine [0, 0]).
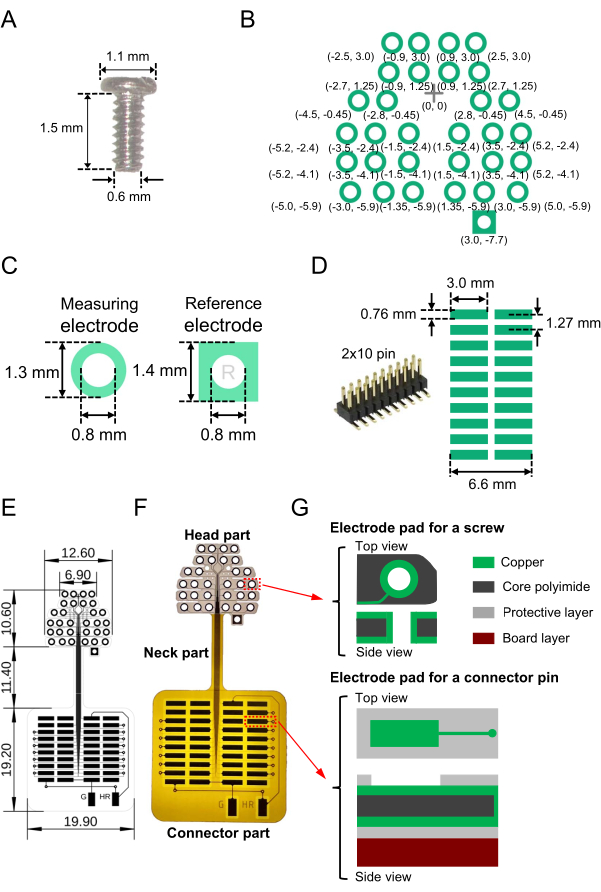
Figura 1: Parti componenti dell'array bidimensionale flessibile (2D) per la registrazione elettroencefalografica (EEG) e del dispositivo fabbricato, incluso l'array. (A) L'elettrodo a vite in miniatura incorporato nel cranio del topo. (B) Gli elettrodi progettati per misurare l'attività cerebrale (cerchi verdi) e il canale di riferimento (quadrato in basso a destra). Vengono mostrate le coordinate relative dei cuscinetti degli elettrodi da un punto di riferimento (croce) all'origine (0, 0); La dimensione in millimetri è illustrata tra parentesi. Le coordinate centrali dei cuscinetti degli elettrodi sono simmetriche rispetto all'asse verticale passante per il segno di croce. (C) Vengono illustrati i cuscinetti degli elettrodi e i fori per un elettrodo di registrazione (a sinistra) e un elettrodo di riferimento (a destra). (D) Un connettore a montaggio superficiale (2 × 10 pin) utilizzato per l'array 2D flessibile (a sinistra) e il modello e le dimensioni dei pad progettati sul substrato (a destra). (E) Progetto progettato con le dimensioni di ciascuna parte in millimetri. (F) Immagine di un substrato fabbricato indicato dal progetto in E. (G) La struttura a strati dell'array 2D flessibile (parti della testa e del connettore). Sono illustrate le viste superiore e laterale dei cuscinetti degli elettrodi a vite (in alto) e dei pad di lettura (in basso). La testa e le parti del connettore sono composte rispettivamente da una struttura a tre strati (in alto) e una struttura a sei strati (in basso). Inoltre, la parte del collo è composta da una struttura a cinque strati; Uno strato protettivo di poliimmide è montato sulla superficie superiore e posteriore e il pannello di poliimmide di rinforzo non è montato sulla parte del collo. Fare clic qui per visualizzare una versione più grande di questa figura.
2. Costruzione dell'adattatore e mappatura dei canali
- Eseguire la costruzione dell'adattatore seguendo i passaggi seguenti.
- Diffondere il flusso di saldatura sul connettore a montaggio superficiale a 2 × 10 pin (Figura 1D, a sinistra) e sui pad dei connettori dell'array 2D (Figura 1D, a destra) (vedere Tabella dei materiali) sul substrato flessibile.
- Saldare il connettore a montaggio superficiale a 2 × 10 pin ai pad dei connettori. In particolare, confermare la connessione tra i due pad nella parte inferiore dell'array 2D e i due pin del connettore utilizzati come canali di riferimento e di terra (Figura 2A).
- Collegare ciascuno dei due pad ai singoli fili conduttori per alimentare i segnali di base a un punto esterno (ad esempio, un punto di massa collegato al canale di terra del sistema di misura; Figura 2A).
NOTA: In questo studio, tuttavia, uno dei cuscinetti circolari con elettrodi a vite è stato utilizzato come elettrodo di riferimento anziché un elettrodo quadrato nella parte del connettore. - Dopo la saldatura, coprire i punti di saldatura utilizzando resina epossidica (vedi Tabella dei materiali) per proteggere i punti esposti ed evitare cortocircuiti.
- Fissare il cavo connettore e l'amplificatore della testa seguendo i passaggi seguenti.
- Preparare un connettore isolante-spostamento (IDC) con 2 × 10 pin e un passo di 1,27 mm (Figura 2B, in alto a sinistra) e un cavo piatto a nastro a 20 pin (vedere la tabella dei materiali) con un passo di 0,635 mm (Figura 2B, in basso a sinistra). Tagliare il cavo a nastro piatto alla lunghezza desiderata (ad esempio, 40 cm).
- Crimpare l'IDC e un'estremità del cavo a nastro piatto utilizzando uno strumento di crimpatura IDC (Figura 2B, in alto a destra) (vedere Tabella dei materiali).
- Separare ciascuna linea dell'altra estremità del cavo fino a circa 15 mm dall'estremità della punta utilizzando una fresa. Rimuovere l'isolamento di 3 mm dall'estremità della punta.
- Collegare l'IDC crimpato al cavo piatto a nastro e il connettore a 2 × 10 pin saldato al substrato flessibile (Figura 2C).
- Confermare la corrispondenza tra l'elettrodo di registrazione e la linea separata del cavo. Assicurarsi che ogni riga utilizzata non produca un errore di connessione errato.
- Saldare i fili di rame esposti delle singole linee corrispondenti all'uscita di ciascun elettrodo al connettore a 20 pin (passo 1,25 mm) del sistema di misura, compreso l'amplificatore principale (Figura 2B, in basso a destra).
- Dopo la saldatura, confermare la conduzione tra i cuscinetti degli elettrodi a vite e i pin del connettore utilizzando un'apparecchiatura di prova (ad esempio, un misuratore LCR; vedere la tabella dei materiali).
- Coprire i punti di saldatura utilizzando resina epossidica e nastro schermante per proteggerli da danni e impedire il contatto con altre linee di segnale.
- Utilizzando resina epossidica, far aderire una sottile asta di acciaio inossidabile (diametro: 1,1-1,2 mm; lunghezza: 100 mm) sul lato posteriore della parte del connettore dell'array 2D sul substrato flessibile.
NOTA: Questa asta di acciaio inossidabile può essere afferrata da un supporto per micromanipolatore durante gli esperimenti (Figura 2C). - Infine, confermare la mappatura tra gli elettrodi a vite e i canali di uscita del segnale (Figura 2D).
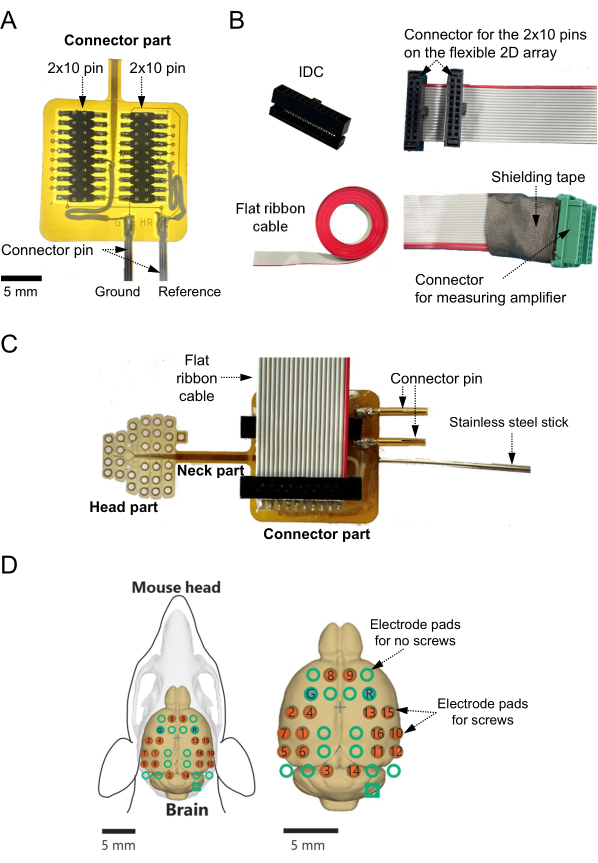
Figura 2: Costruzione dell'adattatore per un array di elettrodi bidimensionali (2D) sul substrato flessibile e registrazione della mappatura dei canali. (A) Nella parte del connettore, i canali di riferimento e di terra sono collegati ai pad degli elettrodi inferiori con fili conduttori. Se i canali di riferimento e di terra sono determinati in anticipo, i canali devono essere collegati ai corrispondenti elettrodi inferiori durante la fase di progettazione. In questi casi, non è necessario saldare fili di piombo ai canali e ai cuscinetti degli elettrodi. (B) I connettori isolante-spostamento (in alto a sinistra) sono aggraffati a un'estremità del cavo piatto (in basso a sinistra) per collegare il connettore dell'amplificatore di misura (in alto a destra). Tutte le linee che corrispondono ai canali da utilizzare sono saldate ai connettori verdi (in basso a destra). In questo caso, poiché ogni connettore verde collegato all'amplificatore di testa è assegnato per una misurazione a otto canali, sono necessari almeno due connettori per registrare i segnali di attività cerebrale a 16 canali. I punti saldati sono ricoperti con resina epossidica e nastro schermante per impedire il contatto con altre linee di segnale. (C) Il connettore e il cavo fabbricato sono posizionati sulla superficie del substrato flessibile dell'array 2D. La sottile asta in acciaio inossidabile è attaccata al lato posteriore del substrato flessibile. (D) Vengono mostrate le posizioni spaziali dei canali di registrazione sulla superficie cerebrale del topo e le mappe dei canali per ciascun punto del sistema di misurazione. In questo caso, ci sono 16 canali di registrazione con elettrodi a vite (cerchi rossi), sebbene il numero totale di possibili siti di registrazione sia 32. Gli altri 16 canali non di registrazione sono anche mostrati come cerchi verdi sulla superficie del cervello. Nel grafico di mappatura, "G" e "R" indicano rispettivamente i canali progettati per gli elettrodi di terra e di riferimento. Fare clic qui per visualizzare una versione ingrandita di questa figura.
3. Chirurgia animale
- Preparare l'ambiente chirurgico sterile.
- Indossare dispositivi di protezione, come guanti in lattice, durante l'intera procedura sperimentale che coinvolge gli animali.
- Sterilizzare l'apparato stereotassico e gli strumenti chirurgici (vedi Tabella dei materiali).
- Dopo aver sterilizzato gli strumenti chirurgici, lavarli con soluzione salina sterile.
- Anestetizzare gli animali.
- Misurare il peso del topo prima dell'intervento chirurgico. Somministrare atropina solfato (0,04 mg/kg; vedere Tabella dei materiali) tramite iniezione intraperitoneale.
- Anestetizzare il topo mediante iniezione intraperitoneale di una miscela di medetomidina (0,3 mg/kg), midazolam (4,0 mg/kg) e butorfanolo (5,0 mg/kg).
- Confermare la profondità dell'anestetico in base al livello di risposta pizzicando la punta.
NOTA: L'anestesia svanirà dopo circa 40 minuti. Se il topo risponde a un pizzico del piede, somministrare la stessa dose della miscela anestetica tramite un'iniezione intraperitoneale.
- Pre-prepararsi per l'intervento chirurgico di impianto dell'elettrodo.
- Tagliare i baffi del topo per evitare sensazioni tattili.
- Lubrificare entrambi gli occhi con un unguento oftalmico per prevenire l'essiccazione. Chiudere le palpebre per ostruire il senso della vista e mantenere la chiusura facendo aderire le palpebre superiori e inferiori con nastro di rammendo.
- Rasare i capelli sulla testa del mouse con tagliacapelli elettrici. Inserire un termometro nel retto e mantenere la temperatura corporea a 37 °C utilizzando un termoforo.
- Somministrare lidocaina cloridrato come anestetico locale topico alla parte del cuoio capelluto di topo che verrà incisa.
- Incidere il cuoio capelluto del topo usando un bisturi o forbici chirurgiche in direzione rostrale-caudale (dimensione dell'area: 7 × 10 mm2).
- Pizzicare il cuoio capelluto vicino alla parte incisa con una pinzetta e sollevare. Rimuovere la membrana visibile sul cranio usando un bisturi o forbici chirurgiche. Non rompere i vasi sanguigni intorno agli occhi durante l'operazione.
- Afferrare la pelle vicino a entrambi i centri della linea di incisione del cuoio capelluto con una pinza e allargare la parte incisa per esporre ampiamente la parte superiore del cranio.
- Confermare la rimozione completa di tutte le membrane sulla superficie del cranio e del tessuto intorno alla lambda con le forbici chirurgiche.
- Bagnare la superficie del cranio con soluzione fisiologica salina per migliorare la visibilità della superficie cerebrale sotto il cranio e localizzare il seno trasversale.
NOTA: Quando si impiantano elettrodi a vite nel cranio, ricordarsi di non incorporarli sopra e nel seno trasversale.
4. Impianto di elettrodi
- Collegare l'asta in acciaio inossidabile montata all'array di elettrodi 2D sul lato posteriore del substrato flessibile a un micromanipolatore. Posizionare il substrato flessibile sul cranio.
- Regolare la posizione dei canali (Chs) 3 e 14 (Figura 2D) sull'array per adattarla al collicolo inferiore.
NOTA: Il collicolo inferiore si trova lungo il seno trasversale. Si consiglia di confermare in anticipo la posizione del collicolo inferiore utilizzando un atlante cerebrale del topo. - Disegna piccoli cerchi nelle posizioni dei cap. 3, 8, 9 e 14 (Figura 2D) sul cranio con un pennarello permanente da utilizzare come punti di riferimento per il bersaglio.
- Asciugare la superficie del cranio per migliorare l'aderenza al cemento dentale e isolare elettricamente l'array di elettrodi 2D sul substrato flessibile dal cranio del topo.
- Applicare cemento dentale (circa 1 mm di spessore; vedi Tabella dei materiali) sulla superficie del cranio. Dopo aver applicato il cemento dentale, attendere circa 30 minuti affinché si polimerizzi.
- Allineare il substrato flessibile in base ai piccoli segni circolari sulla superficie del cranio.
- Allineare la punta di un trapano dentale a ciascun foro del tampone dell'elettrodo sul substrato flessibile. Forare con attenzione il cranio attraverso ciascuno dei fori del cuscinetto dell'elettrodo.
- Avvitare ciascuno degli elettrodi a vite in miniatura attraverso i fori praticati nel cranio utilizzando un cacciavite dedicato per viti in miniatura.
- Crimpare saldamente la testa dell'elettrodo a vite e il pad dell'elettrodo. Infine, misurare la conduttanza tra ciascun elettrodo a vite e il connettore con apparecchiature di prova (ad esempio, un misuratore LCR) per confermare la conduttività elettrica.
5. Progettazione e costruzione di bobine di piccole dimensioni
- Progettare un disco a forma di ciambella (vedere il file di codifica supplementare 1) con un foro al centro (diametro interno: 2 mm; diametro esterno: 7 mm; spessore: 1 mm) utilizzando un software di progettazione assistita da computer (CAD) (vedi Tabella dei materiali).
- Utilizzando una stampante 3D, stampare due dischi (Figura 3A, a sinistra) realizzati in materiale non resistente al calore (ad esempio, filamento di acido polilattico); Il materiale non resistente al calore non è sempre necessario (vedi sotto).
- Rifilate un'asta permalloy-45 (diametro: 2 mm; vedi tabella dei materiali) per formare un albero corto (lunghezza: 60 mm).
- Inserire l'albero in ciascun foro dei due dischi stampati in 3D (Figura 3A, a destra). Posizionare un disco all'estremità dell'albero e l'altro a 11 mm dall'estremità, ottenendo una distanza di 10 mm tra i due dischi. Far aderire i dischi con colla istantanea (vedi Tabella dei materiali).
- Collegare l'estremità dell'albero senza disco a un driver di impatto (Figura 3B). Attaccare un piccolo magnete all'albero permalloy-45. Posizionare un sensore a effetto Hall vicino al magnete a 5 mm dall'albero. Collegare il sensore a effetto Hall a un sistema di acquisizione dati (DAQ; vedere Tabella dei materiali).
- Per contare il numero di giri, preparare un programma per computer (vedi Tabella dei materiali) che analizzi i segnali di uscita dal sensore a effetto Hall attraverso il sistema DAQ.
- Collegare un sottile filo di rame (diametro: 0,16 mm) all'albero e aderire all'estremità superiore del filo con colla istantanea.
- Utilizzando il driver di impatto, avvolgere il filo di rame per 1.000 giri tra i due dischi. Sebbene la velocità di rotazione sia arbitraria, in genere vengono utilizzate circa 5 rotazioni al secondo. Quindi, aderire al filo avvolto con colla istantanea.
- Staccare i due dischi dall'albero. Se i dischi sono fortemente aderenti all'albero, fondere i dischi usando una pistola termica.
- Coprire la bobina con resina epossidica per isolare e fissare la superficie. Quindi, tagliare la parte dell'albero srotolata in eccesso.
- Assicurarsi che la bobina ottenuta abbia un'altezza di 10 mm e un diametro di 6 mm (Figura 3B, a sinistra). Per la manipolazione della bobina, costruire un portabobina (Figura 3C, a destra) o far aderire un'asta di acciaio inossidabile alla bobina (non mostrata qui).
- Misurare la resistenza e l'induttanza della bobina utilizzando un misuratore LCR (vedere Tabella dei materiali). Ad esempio, la bobina utilizzata qui aveva una resistenza in corrente continua (DC) di 18,3 Ω e un'induttanza di 7,9 mH a 1 kHz ingresso corrente alternata (CA). Le proprietà AC (resistenza e induttanza) sono mostrate in Figura 3D.
- Utilizzare un generatore di funzioni per applicare un'onda quadra bipolare alla bobina. L'ampiezza tipica della tensione di ingresso è di 20 V attraverso un alimentatore bipolare con un guadagno di 10x, a seguito di un'uscita del generatore di 2 V. La forma d'onda risultante è un'onda quadra bipolare con un'ampiezza approssimativa di 20 V (cioè una tensione picco-picco di 40 V) (Figura 3E).
- Misurare la densità del flusso magnetico utilizzando il sensore a effetto Hall e il sistema DAQ. In questo caso, ad esempio, la densità del flusso magnetico (B) della bobina era 113,6 ±2,5 mT (media ± SEM) quando il fondo della bobina era a contatto con il sensore a effetto Hall (Figura 3F).
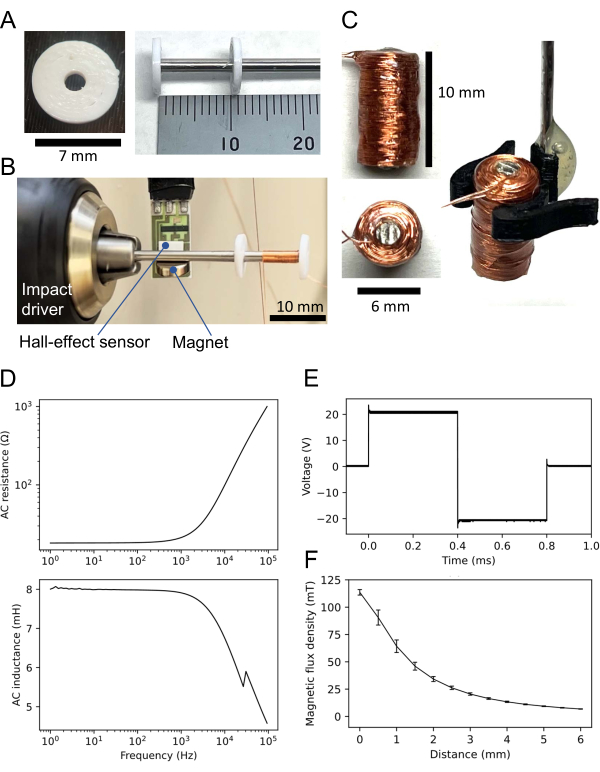
Figura 3: Piccola bobina per la stimolazione magnetica. (A) Disco tridimensionale (3D) stampato (a sinistra). Due dischi identici sono aderenti all'albero permalloy-45; Uno è alla fine dell'albero e l'altro è a 10 mm di distanza (a destra). (B) Configurazione per l'avvolgimento della bobina. L'albero da 60 mm con i due dischi è collegato a un driver a impatto. Un sensore ad effetto Hall è posizionato vicino al piccolo magnete collegato all'albero. Il filo di rame è avvolto tra i due dischi. (C) Bobine costruite. La bobina è alta 10 mm, ha un diametro di 6 mm e ha 1.000 giri di filo di rame. Il lato destro della figura mostra la bobina manipolata da un portabobina stampato in 3D. (D) Proprietà AC della bobina registrate da un misuratore LCR: resistenza (superiore) rispetto alla frequenza dell'ingresso sinusoidale; (in basso) induttanza rispetto alla frequenza di ingresso. Una bobina tipica ha una resistenza e un'induttanza di 21,6 e 7,9 mH, rispettivamente, a 1 kHz di ingresso CA. (E) Forma d'onda rettangolare bifasica utilizzata come ingresso bobina registrata da un oscilloscopio. (F) Relazione tra la densità del flusso magnetico e la distanza tra una bobina costruita e il sensore ad effetto Hall. La densità del flusso magnetico è stata registrata da cinque diversi sensori a effetto hall, una volta per ciascun sensore. Viene tracciata la media di cinque misurazioni e le barre di errore rappresentano gli errori standard della media. Fare clic qui per visualizzare una versione ingrandita di questa figura.
6. Sistema e procedura di registrazione del segnale
- Collegare l'array 2D flessibile al sistema di registrazione (vedere Tabella dei materiali) con il cavo a nastro piatto.
- Collegare l'asta di acciaio inossidabile montata sulla bobina a un micromanipolatore (vedere Tabella dei materiali).
- Posizionare la bobina sopra il bregma e regolare la posizione nella direzione caudale per individuare il punto focale sopra il collicolo inferiore. Il punto focale del campo elettrico che emette è la linea mediana dell'area avvolta sulla superficie inferiore della bobina (cioè 1 mm dal bordo al centro).
- Preparare un sistema di stimolazione costituito da un alimentatore bipolare e un generatore di funzioni (vedere Tabella dei materiali) e collegare la bobina al sistema.
- Collegare un cavo tra il terminale di ingresso del generatore di funzioni e il terminale di uscita del sistema DAQ per applicare segnali di trigger al generatore di funzioni dal sistema DAQ. Preparare un programma informatico appropriato per i segnali di attivazione per avviare gli stimoli. Inoltre, collegare il sistema DAQ al sistema di registrazione per salvare i tempi di stimolazione come timestamp.
- Avviare il processo di acquisizione per il sistema di registrazione.
NOTA: se il sistema di registrazione rileva il rumore, individuare la fonte del rumore e ridurlo. - Testare la stimolazione magnetica attivando il sistema di stimolazione.
NOTA: se il rumore prodotto dalla stimolazione magnetica satura l'intervallo di misurazione, regolare correttamente l'intervallo. Inoltre, verificare che il sistema di registrazione salvi correttamente i timestamp di stimolazione. - Inizia a registrare i dati di risposta e inizia le sessioni di stimolazione. Interrompere la registrazione al termine di ogni sessione di stimolazione. Salvare tutti i dati registrati per analisi successive.
NOTA: Per eseguire tutte le condizioni sperimentali con cinque diverse intensità magnetiche, ad esempio, il tempo totale richiesto per tutte le sessioni è stato di circa 75 minuti. L'endpoint è stato solitamente determinato al termine di tutte le sessioni di registrazione. Tuttavia, quando gli animali hanno mostrato segni clinici tra cui tosse, respiro affannoso e respiro ansimante, la sessione sperimentale è stata immediatamente interrotta. Per l'eutanasia, la decapitazione è stata eseguita usando forbici affilate e pulite mentre gli animali erano sotto anestesia.
7. Analisi dei dati
- Filtrare il segnale a banda larga (raw) utilizzando un filtro passa-basso con una frequenza di taglio di 200 Hz.
- Raccogli le forme d'onda filtrate durante una finestra temporale attorno a ciascun timestamp di stimolazione. Calcolare la media delle forme d'onda per ottenere le forme d'onda del potenziale correlato agli eventi (ERP) (Figura 4 e Figura 5).
Risultati
Di seguito sono presentati i dati EEG di esempio registrati in topi C57BL/6J anestetizzati con il substrato flessibile combinato con gli elettrodi a vite.
Come esempio tipico, le forme d'onda EEG medie generate in risposta alla stimolazione sonora (8 kHz tone-burst, 80 dB livello di pressione sonora [SPL]) sono mostrate per 60 prove con stimoli identici (Figura 4A). Uno schema della mappatura dei canali di registrazione è presentato anche al centro della
Discussione
Questo studio affronta un sistema di registrazione EEG multi-sito combinato con un sistema di stimolazione magnetica progettato per piccoli animali, compresi i topi. Il sistema costruito è a basso costo e facilmente costruibile nei laboratori fisiologici e può estendere le loro impostazioni di misurazione esistenti. La procedura chirurgica necessaria per ottenere dati dal sistema di registrazione del topo è profondamente semplice se tali laboratori hanno precedenti esperienze con esperimenti elettrofisiologici standar...
Divulgazioni
Gli autori non hanno nulla da rivelare.
Riconoscimenti
Questo lavoro è stato sostenuto dalla Murata Science Foundation, dalla Suzuken Memorial Foundation, dalla Nakatani Foundation for Advancement of Measuring Technologies in Biomedical Engineering e da una sovvenzione in aiuto per la ricerca esplorativa (numero di sovvenzione 21K19755, Giappone) e per la ricerca scientifica (B) (numero di sovvenzione 23H03416, Giappone) a T.T.
Materiali
| Name | Company | Catalog Number | Comments |
| 3D printer | Zhejiang Flashforge 3D Technology Co., Ltd | FFD-101 | The printer used for 3D-printing the donut-shaped disks |
| ATROPINE SULFATE 0.5 mg | NIPRO ES PHARMA CO., LTD. | - | Atropine sulfate |
| Bipolar amplifier | NF Corp. | KIT61380 | For amplifying waveforms for coil input |
| Butorphanol | Meiji Seika Pharma Co., Ltd., Tokyo, Japan | - | For anathesis of animals |
| Commercial manufacturer of flexible 2D array | p-ban.com Corp. | - | URL: https://www.p-ban.com/ |
| Computer prograom to analyze output signals | Natinal Instruments | NI-DAQ and NI-DAQmx Python | To analyze output signals from the hall-effect sensor |
| Connector | Harwin Inc. | G125-FV12005L0P | For connector to conect to the measuring system |
| Copper pad | p-ban.com Corp. | copper | Copper pad on each substrate |
| Copper wire | Kyowa Harmonet Ltd. | P644432 | The windings of the coil |
| DAQ board | National Instruments Corp. | USB-6343 | For measuring the magnitic flux density of the coil |
| Dental cement | SHOFU INC. | Quick Resin | Self-Curing Orthodontic Resin |
| ECoG electrode | NeuroNexus Inc. | HC32 | For reference to design of the flexible 2D array |
| Epoxy resin | Konishi Co. Ltd. | #16123 | For coil construction |
| Ethyl Carbamate | FUJIFILM Wako Pure Chemical Corp. | 050-05821 | For urethan anesthesia |
| Flat ribbon cable | Oki Electric Cable Co., Ltd. | FLEX-B2(20)-7/0.1 20028 5m | For cable to connect between surface-mount connector and measuring sysytem |
| flexible substrate | p-ban.com Corp. | polyimide | Baseplate of flexible substrate |
| Function generator | NF Corp. | WF1947 | For generating waveforms for coil input |
| Hall-effect sensor | Honeywell International Inc. | SS94A2D | For measuring the magnitic flux density of the coil |
| IDC crimping tool | Pro'sKit Industries Co. | 6PK-214 | To crimp the IDC and one end of the flat ribbon cable; Flat cable connector crimping tool |
| Instant glue | Konishi Co. Ltd. | #04612 | For coil construction |
| Insulation-displacement connector (IDC ) | Uxcell Japan | B07GDDG3XG | 2 × 10 pins and a 1.27 mm pitch |
| LCR meter | NF Corp. | ZM2376 | For measuring the AC properties of the coil |
| Manipulator | NARISHIGE Group. | SM-15L | For manipulating the coil |
| Medetomidine | Kobayashi Kako, Fukui, Japan | - | For anathesis of animals |
| Midazolam | Astellas Pharma, Tokyo, Japan | - | For anathesis of animals |
| Miniature screw | KOFUSEIBYO Co., Ltd. | S0.6*1.5 | For EEG-senseing and reference electrode |
| Mouse | Japan SLC, Inc. | C57BL/6J (C57BL/6JJmsSlc) | Experimental animal |
| Permalloy-45 rod | The Nilaco Corp. | 780544 | The core of the coil |
| Recording system | Plexon Inc. | OmniPlex | For EEG data acquisition |
| Stainless wire | Wakisangyo Co., Ltd. | HW-136 | For grasp by manipulator |
| Stereotaxic apparatus | NARISHIGE Group. | SR-5M-HT | To fix a mouse head |
| Surface-mount connector | Useconn Electronics Ltd. | PH127-2x10MG | For connector to mount on the flexible 2D array |
| Testing equipment (LCR meter) | NF Corp. | ZM2372 | Contact check and impedance measurements |
| White PLA filament | Zhejiang Flashforge 3D Technology Co., Ltd | PLA-F13 | The material used for 3D-printing the donut-shaped disks |
| Xylocaine Jelly 2% | Sandoz Pharma Co., Ltd. | - | lidocaine hydrochloride |
Riferimenti
- Ilmoniemi, R. J., et al. Neuronal responses to magnetic stimulation reveal cortical reactivity and connectivity. Neuroreport. 8 (16), 3537-3540 (1997).
- Hallett, M. Transcranial magnetic stimulation: a primer. Neuron. 55 (2), 187-199 (2007).
- Thut, G., Pascual-Leone, A. Integrating TMS with EEG: How and what for. Brain Topography. 22 (4), 215-218 (2010).
- Ilmoniemi, R. J., Kicic, D. Methodology for combined TMS and EEG. Brain Topograpy. 22 (4), 233-248 (2010).
- Daskalakis, Z. J., Farzan, F., Radhu, N., Fitzgerald, P. B. Combined transcranial magnetic stimulation and electroencephalography: its past, present and future. Brain Research. 1463, 93-107 (2012).
- Tremblay, S., et al. Clinical utility and prospective of TMS-EEG. Clinical Neurophysiology. 130 (5), 802-844 (2019).
- Pellicciari, M. C., Veniero, D., Miniussi, C. Characterizing the cortical oscillatory response to TMS pulse. Frontiers in Cellular Neuroscience. 11, 38 (2017).
- Lin, Y. J., Shukla, L., Dugue, L., Valero-Cabre, A., Carrasco, M. Transcranial magnetic stimulation entrains alpha oscillatory activity in occipital cortex. Scientific Reports. 11 (1), 18562 (2021).
- Takahashi, S., et al. Laminar responses in the auditory cortex using a multielectrode array substrate for simultaneous stimulation and recording. IEEJ Transactions Electrical and Electronic Engineering. 14 (2), 303-311 (2019).
- Yoshikawa, T., Higuchi, H., Furukawa, R., Tateno, T. Temporal and spatial profiles of evoked activity induced by magnetic stimulation using millimeter-sized coils in the mouse auditory cortex in vivo. Brain Research. 1796, 148092 (2022).
- Tang, A. D., et al. Construction and evaluation of rodent-specific rTMS coils. Frontiers in Neural Circuits. 10, 47 (2016).
- Li, L. Controlling annealing and magnetic treatment parameters to achieve high permeabilities in 55 Ni-Fe toroid cores. IEEE Transactions on Magnetics. 37 (4), 2315-2317 (2001).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneEsplora altri articoli
This article has been published
Video Coming Soon