需要订阅 JoVE 才能查看此. 登录或开始免费试用。
Method Article
3D生物打印光可调水凝胶研究成纤维细胞活化
摘要
本文介绍了如何 3D 生物打印光可调水凝胶来研究细胞外基质硬化和成纤维细胞活化。
摘要
光可调水凝胶可以响应光照在空间和时间上发生转变。将这些类型的生物材料纳入细胞培养平台并动态触发变化,例如增加微环境硬度,使研究人员能够模拟纤维化疾病进展过程中发生的细胞外基质 (ECM) 变化。本文提出了一种用于3D生物打印能够在明胶支持浴内进行两次连续聚合反应的光电可调水凝胶生物材料的方法。通过调节支持浴的pH值来适应悬浮水凝胶的自由形式可逆嵌入(FRESH)生物打印技术,以促进Michael加成反应。首先,将含有聚乙二醇-α-甲基丙烯酸酯(PEGαMA)的生物墨水与细胞可降解交联剂进行化学计量反应,形成软水凝胶。这些软水凝胶随后暴露在光引发剂和光下,以诱导未反应基团的均聚化并使水凝胶变硬。该协议涵盖水凝胶合成、3D 生物打印、光强化和终点表征,以评估 3D 结构内的成纤维细胞活化。这里介绍的方法使研究人员能够3D生物打印各种经历pH催化聚合反应的材料,并可用于设计组织稳态,疾病和修复的各种模型。
引言
3D生物打印是一项变革性技术,使研究人员能够精确地将细胞和生物材料沉积在3D体积内,并重建生物组织的复杂分层结构。在过去的十年中,3D生物打印的进步已经创造了跳动的人类心脏组织1,肾脏组织的功能模型2,肺内气体交换模型3,以及用于癌症研究的肿瘤模型4。嵌入式 3D 生物打印技术的发明,例如悬浮水凝胶的自由形式可逆嵌入 (FRESH) 生物打印,使得在 3D 中再现复杂的软组织结构(如肺血管5 甚至人类心脏6 )成为可能。 FRESH 3D 生物打印有助于通过挤出到剪切稀化支撑槽中逐层打印柔软和低粘度的生物墨水。支撑浴由紧密堆积的明胶微粒等材料组成,该微粒充当宾厄姆塑料,并在打印后保持生物墨水的预期形状和结构。一旦打印的结构凝固,就可以通过将温度升高到37°C来溶解支撑浴7。
最近的一篇评论文章总结了使用FRESH技术在各种出版物中进行3D生物打印的材料。这些天然来源的材料范围从 I 型胶原蛋白到甲基丙烯酸化透明质酸,代表了几种不同的凝胶机制7。使用这种3D生物打印技术进行的大多数研究都采用静态生物材料,这些材料不会因外部刺激而改变。动态光可调水凝胶生物材料已被我们的实验室和其他实验室使用8,9,10,11,12来模拟各种纤维化疾病。与静态生物材料不同,光可调生物墨水允许创建具有较低弹性模量值的软化模型,然后进行硬化以探索细胞对微环境硬化增加的反应。
纤维化疾病的特征是细胞外基质的产生增加,可导致瘢痕形成和硬化13。组织硬化会引发阻生组织的进一步损伤和破坏,导致永久性器官损伤甚至死亡;纤维化疾病占全球死亡人数的三分之一。成纤维细胞在这种疾病状态下产生过量和异常的细胞外基质14,15。成纤维细胞增殖增加和细胞外基质沉积进一步使组织变硬并激活促纤维化正反馈回路16,17,18,19。研究成纤维细胞活化对于了解纤维化疾病至关重要。在这里,我们将人类肺动脉高压(PAH)作为一种纤维化疾病的一个例子,其中使用3D生物打印模拟血管的3D几何形状非常重要,并介绍了光可调水凝胶的动态硬化能力。多环芳烃是一种主要肺动脉压力超过正常水平并对心脏施加压力,增加人肺动脉外膜成纤维细胞 (HPAAF) 活化并使血管组织变硬的疾病16,17,18,19。光可调聚乙二醇-α-甲基丙烯酸酯 (PEGαMA) 生物墨水配方允许构建体的时间硬化,并有助于模拟健康组织和疾病进展 5,8,9,10。利用这一独特特征能够量化 HPAAF 响应 3D 微环境硬化的激活和增殖,并可能为参与该疾病的细胞机制提供有价值的见解。这里描述的协议将允许研究人员创建3D模型,以概括疾病进展或组织修复期间细胞外微环境的变化,并研究成纤维细胞活化。
研究方案
1. PEGαMA的合成与表征
注:聚乙二醇-α-甲基丙烯酸酯(PEGαMA)的合成改编自Hewawasam 等人, 并在无水分条件下进行9。
- 称量反应物。
注:例如,称取 5 g 10 kg/mol 8 臂 PEG-羟基 (PEG-OH) 和 0.38 g 氢化钠 (NaH)(参见 材料表)。 - 向 250 mL 舒伦克烧瓶中加入搅拌棒,并用氩气吹扫。
- 将PEG-OH溶解在舒伦克烧瓶中溶解所需的最低体积的无水四氢呋喃(THF)中。
注意:大约 80 mL 的 THF 将溶解 5 g PEG-OH。加入溶解 PEG-OH 所需的最少量 THF。 - 向反应混合物中加入3倍摩尔过量的NaH,并在室温(RT)下搅拌30分钟。
- 将摩尔过量的 2-(溴甲基)丙烯酸乙酯(EBrMA,见 材料表)滴加到 Schlenk 烧瓶中,并用铝箔覆盖反应容器以保护其避光。在室温下搅拌反应约48小时。
注:对于 5 g PEG-OH 和 0.38 g NaH,使用 3.68 mL EBrMA 进行该反应。 - 加入几滴 1 N 乙酸以淬灭反应。通过助滤剂对溶液进行真空过滤。
注意:添加醋酸会产生气泡。当气泡停止形成时,停止添加醋酸滴,因为这表明混合物已成功淬火。 - 将滤液浓缩在旋转蒸发器上,并在4°C乙醚中沉淀。将沉淀物在4°C避光保存12-18小时。
- 将 Whatman 滤纸添加到 Buchner 漏斗中。将反应混合物缓慢倒在滤纸上,用真空抽吸将沉淀物与乙醚分离。将沉淀物收集在干燥清洁的过滤瓶中。
- 将产品真空干燥至少5小时或在室温下过夜,并溶解在所需的最小体积的去离子水中。将溶解的产物转移到透析管中(参见 材料表),并用 3.5 L 去离子水透析至少 4 天。每12小时更换一次透析水。
注意: 真空干燥后,产品将显示为完全干燥的纯白色固体粉末。 - 将产品快速冷冻并冻干约72小时或直到完全干燥。
- 将产物溶于氯仿D(CDCl3)中。使用 1H NMR运行样品,其方案以2.5秒的弛豫时间执行248次扫描。
- 通过将CDCl 3 溶剂峰校准至 7.26 PPM 来验证产品的功能化和纯度。对PEG骨架质子(d3.71)的峰进行积分,并将积分校准至114。
- 积分剩余峰:PEGαMA 1H NMR (300 MHz, CDCl 3): d (ppm) 1.36 (t, 3H, CH 3-),3.71 (s, 114H, PEG CH 2-CH 2), 4.29 (t, s, 4H, -CH 2-C(O)-O-O, -O-CH2-C(=CH 2)-), 5.93 (q, 1H, -C=CH 2), 6.34 (q, 1H, -C=CH 2),并将αMA烯烃端基峰的积分与基于PEG骨架校准的预期值(1H)进行比较(图1)。
注:将标记为“a”的两个峰取平均值(图1)并乘以100以获得平均PEGαMA功能化百分比。
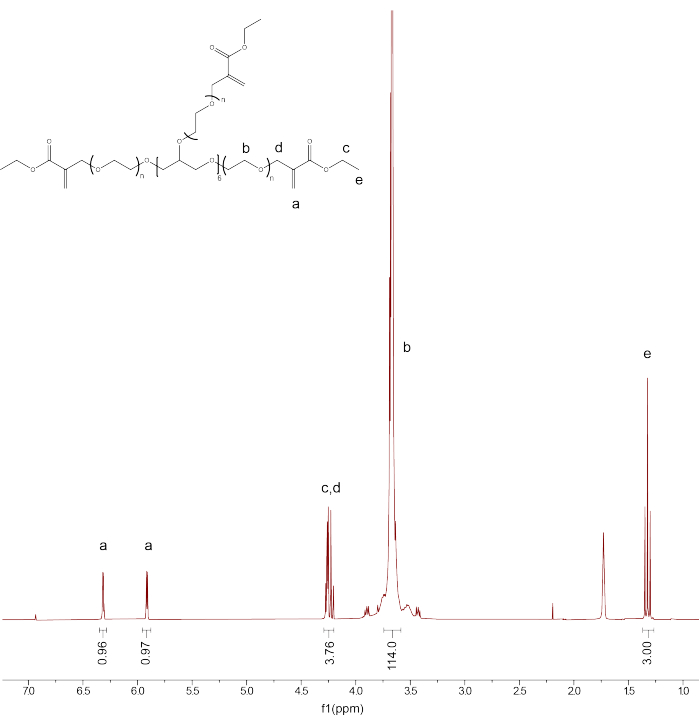
图 1:质子 NMR 证实 PEGαMA 功能化成功。在氯仿-D(CDCl 3)中进行NMR分析,显示功能化率为96.5%。PEGαMA 1H NMR (300 MHz, CDCl3): d (ppm) 1.36 (t, 3H, CH 3-),3.71 (s, 114H, PEG CH 2-CH 2), 4.29 (t, s, 4H, -CH 2-C(O)-O-O, -O-CH2-C(=CH 2)-), 5.93 (q, 1H, -C=CH 2), 6.34 (q, 1H, -C=CH 2).请点击这里查看此图的较大版本.
2. 模型设计和3D生物打印机设置
注:通过用定制的注射泵挤出机替换热塑性挤出机来修改市售的 3D 打印机(参见 材料表),并改编自 Hinton 等人 20。开源设计可在线获取:https://3d.nih.gov/users/awfeinberg。
- 打开 Fusion 360 软件(请参阅 材料表)并进行 3D 计算机辅助空心圆柱体设计。
注意:可用于此步骤并模拟血管几何形状的可下载文件可在 补充文件 1 中找到。 - 保存文件并在 Slic3r 软件中打开它(参见 材料表)。仔细检查所有参数是否符合要求,然后按下导出 G 代码按钮。将 G 代码保存到计算机。
- 打开 Pronterface 软件(参见 材料表)并上传 G 代码文件。
注意:Pronterface软件与生物打印机连接,并提供足够的硬件输入控制。可以在 补充文件 2 中找到可用的 G 代码文件。 - 使用无菌技术将生物打印机和所有相关部件转移到生物安全柜 (BSC) 中。
- 将 30 G 0.5 英寸长的钝针尖(参见 材料表)组装到打印玻璃注射器上并放在一边。
- 将生物打印机的电源线插入插座。按下生物打印机正面的红色电源按钮将其打开。在计算机和生物打印机之间连接通用串行总线 (USB) 线,并确保所有电线连接都已建立并插入。
3. 支持槽和试剂的制备
注意:使用无菌技术在生物安全柜中执行所有步骤。
- 根据制造商的说明,制备由 SmBM 基础培养基 (CC-3181) 和 SmGM-2 SingleQuots 补充剂 (CC-4149) 组成的细胞培养基,不包括胎牛血清 (FBS)。储存在4°C直至使用。
- 分装 50 mL 细胞培养基,加入 1% v/v 的 FBS (CC-4149)(参见 材料表)以制备低血清培养基。储存在4°C直至使用。
- 根据制造商的说明,使用不含FBS作为溶剂的无菌细胞培养基重悬明胶浆液粉末(参见 材料表)。使用前,使用2M氢氧化钾(KOH)和/或2M盐酸(HCl)将明胶浆料的最终pH值调节至pH 9,以根据需要使用pH计调节溶液pH值。
- 使用不带针头的注射器,每孔使用1 mL明胶浆液填充24孔板的所需孔数,每个孔大约一半满。
注意: 均匀填充孔的中心并确认不存在气穴。轻敲板以帮助均匀分布微粒浆料。根据需要调整每个孔浆液的高度和体积,以适应每种生物打印的大小和形状。用户可以创建一个自制的注射器,将明胶浆液转移到每个孔中。这可以通过将正确尺寸的注射器柱塞添加到底部已经包含压实明胶浆料的 50 mL 试管中来完成。插入柱塞时,在试管旁边插入一根小导丝以帮助空气逸出,然后在柱塞与明胶浆液接触时将其取出。使用前,用剃须刀片切掉试管的尖端,为明胶浆料挤出并压在柱塞上开一个孔。 - 将填充的 24 孔板放在生物打印机载物台的中心,并将其固定在载物台上。
注意: 图 2 显示了通用生物打印机设置。在打印台周围放置一根橡皮筋,将 24 孔板固定到平台上并防止移动。

图 2:基本的 3D 生物打印设置。 将生物打印机设置在无菌环境(例如生物安全柜)中,并组装打印头,以便将玻璃注射器和针头垂直降低到下面的支撑浴打印区域。 请点击这里查看此图的较大版本.
4. 细胞培养
注意:使用无菌技术在生物安全柜中执行所有步骤。
- 解冻HPAAF细胞(商业获得,参见 材料表),并在含有SmBM基础培养基(CC-3181)和所有SmGM-2 SingleQuots补充剂(CC-4149)的T-75组织培养处理的塑料烧瓶中扩增,根据制造商的说明(参见 材料表)。
注:应使用贴壁细胞的标准细胞培养方案,将细胞保持在37°C和5%CO2 ,并每隔几天补充培养基。 - 一旦HPAAF达到~80-90%汇合度,吸出培养基并用磷酸盐缓冲盐水(PBS)冲洗细胞一次。
- 向每个 T-75 烧瓶中加入约 4 mL 预热的 0.05% 胰蛋白酶-EDTA。倾斜烧瓶以确保整个细胞培养表面被0.05%胰蛋白酶-EDTA溶液覆盖。将烧瓶在37°C孵育3-5分钟,并检查细胞脱离。
- 细胞漂浮后,向每个烧瓶中加入至少 6 mL Dulbecco 改良 Eagle 培养基 (DMEM),并将细胞转移到 50 mL 锥形管中。
- 在室温下以300×g 离心细胞悬浮液5分钟以沉淀细胞。从细胞沉淀中吸出上清液,并使用 1000 μL 移液管将细胞重悬于 1-3 mL 培养基中,含 FBS,确保单细胞悬浮液。
- 将 10 μL 细胞悬液转移到微量离心管中。加入 10 μL 台盼蓝溶液并充分混合。使用倒置光学显微镜使用10μL该混合物对血细胞计数器内的细胞进行计数。
注:为了达到 4 x 106 个细胞/mL 的最终生物墨水浓度,每 200 μL 生物墨水留出 800,000 个成纤维细胞。
5.水凝胶生物墨水的制备
注:生物墨水制备改编自Davis-Hall等人5。步骤 5.1-5.2 可以与步骤 4.1-4.3 并行完成,以最大限度地减少细胞收集和重悬于生物墨水中之间的时间。使用无菌技术在生物安全柜中执行步骤。
- 制备20mM三(2-羧乙基)膦(TCEP,参见 材料表)pH 7溶液,并使用0.2μm注射器过滤器进行无菌过滤器。使用前,立即加入 2 M KOH 和/或 2 M HCl 以根据需要调节溶液 pH 值。用pH计测量并相应调整。
注:TCEP可减少二硫键。 - 制备重悬于不含FBS的无菌细胞培养基中的0.25mg / mLPEGαMA储备溶液,250mM的1,4-二硫苏糖醇(DTT),MMP2可降解交联剂和CGRGDS(RGD)肽的储备溶液(参见 材料表),将所有重悬于20mM无菌TCEP中,并根据需要使用移液管在蒸馏(DI)水中加入15wt%的聚环氧乙烷(PEO)储备溶液。
- 以 表 1 为指导,将 PEGαMA、DTT、MMP2 可降解交联剂、PEO、CGRGDS 和低血清细胞培养基所需的量与成纤维细胞一起放入 50 mL 锥形管中。
注意:建议在添加除细胞培养基以外的所有培养基后用pH条检查pH值,因为这种组合应使pH值非常接近6.2。如果需要进一步调整pH值,请跟踪需要多少额外体积来调节母体溶液的pH值。通过添加剩余的细胞培养基体积减去最终pH调节期间添加的任何体积,将总体积增加到200μL。 - 使用外置活塞式移液器将生物墨水混合在一起,以确保细胞是单细胞,并确认最终的前体溶液为 pH 值 6.2,以防止 3D 生物打印过程中碱催化的聚合。
- 通过卸下柱塞并使用带有 15 号 1.5 英寸长钝针尖的单独注射器(参见 材料表)将生物墨水从离心管转移到注射器中,将生物墨水从离心管转移到注射器中,注意避免在溶液中形成气泡。
- 将玻璃注射器放入打印头内并连接打印头组件,以便所有部件都牢固组装并准备好打印。
注意: 此时,打印头内的玻璃注射器应连接一个 30 号 0.5 英寸长的钝针尖用于打印。
| 元件 | 储备溶液浓度 | 要添加的金额 |
| 聚乙二醇αMA | 0.25毫克/毫升 | 140微升 |
| DTT电视 | 250毫米 | 12.24微升 |
| MMP2可降解交联剂 | 250毫米 | 5.25微升 |
| RGD系列 | 250毫米 | 1.6微升 |
| 专业雇主组织 | 15重量% | 33.33微升 |
| 活化介质和/或pH调节试剂 | - | 7.58微升 |
| 成纤维细胞 | - | 800000 个细胞 |
表 1:制备 200 μL 生物墨水(水凝胶前体溶液和成纤维细胞)所需的示例体积。
6.3D生物打印
注意:使用无菌技术在生物安全柜中执行所有步骤。
- 使用 Pronterface 软件中的方向箭头,手动调整挤出针在孔中心和支撑浴浆内的位置。在针尖下方留下至少 1 毫米的支撑浴浆。
注意:该软件无法分辨针头在空间中的位置。完全由用户通过手动单击软件中的箭头来移动针头(例如,单击向上箭头将针向上移动或远离打印 平台等)。小心地操纵针头,以确保它不会碰到孔的任何边界。 - 一旦针尖位于孔内浆液的中心,点击Pronterface内的开始按钮,等待打印完成以实现构建,如图 3A所示。
注意:要使用提供的文件(补充文件 1)对一个构建体进行生物打印,大约需要 3 分钟。定位和移动针大约需要 5 分钟,然后从头到尾完全打印一个结构。 - 重复步骤6.1-6.2,直到达到所需的生物打印构建体的数量。
注意:建议制作比需要更多的结构,以解决任何不成功的打印。如果发生故障,请移至下一个孔,重置所有内容,然后再次重复步骤 6.1-6.2。 - 将孔板置于室温下,并在打印完成后将其覆盖在BSC中1小时,以允许光电可调水凝胶的碱催化聚合。
- 将含有3D生物打印结构的孔板放入37°C无菌培养箱中,并放置12-18小时以融化支持浴浆。
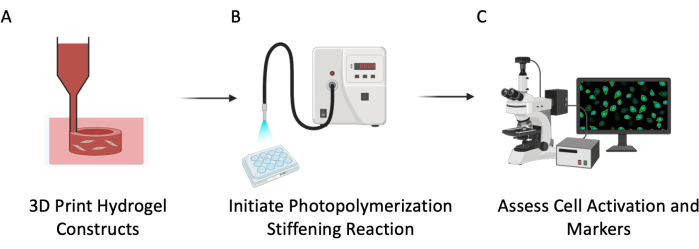
图 3:实验示意图。 该协议分为三个主要步骤:(A)3D生物打印具有嵌入细胞的PEGαMA空心管以模拟肺血管系统。(B)光引发均聚反应,使细胞微环境变硬。(C) 评估细胞标志物的增殖和活化。 请点击这里查看此图的较大版本.
7.3D 3D生物打印构建培养和光硬化
注意:所有步骤都应使用无菌技术在生物安全柜中执行。
- 使用0.2μm注射器过滤器在PBS和无菌过滤器中制备2.2mM苯基-2,4,6-三甲基苯甲酰次膦酸锂(LAP)(参见 材料表)储备溶液。保持 LAP 溶液避光。
- 12-18小时后,改变生物打印结构周围的培养基。手动去除孔内的培养基和熔化的明胶支持浴,并注意不要干扰生物打印结构。
注意:在将板保持在 45° 角的同时慢慢去除介质是有帮助的,这样结构就会出现在孔内并可以看到。在成功打印的每个孔中应可识别透明的水凝胶圆柱体(图4A)。 - 向每个孔中加入适量的低血清培养基。
注:对于 24 孔板,每孔 700 μL 培养基应完全覆盖生物打印的构建体。根据需要进行调整。 - 将板放回培养箱中,每3天或按照实验设计更换样品上的培养基。
- 在所需的硬化时间点前 24 小时,从样品中取出培养基,并用补充有 2.2 mM 无菌 LAP 的低血清培养基代替。
注:为了荧光标记结构,在补充有10μM甲基丙烯酰氧乙基硫代氨基甲酰罗丹明B(参见材料的T)的PBS中溶胀3D生物打印结构过夜,然后按照步骤7.6所述加固以荧光标记结构。在4°C下转移到PBS中2天,以除去过量的罗丹明并使用TRITC过滤器成像(图4B,C)。 - 在所需的加固时间点,从要加固的孔中取出一半的介质,并在紫外光下将板盖上盖子。打开紫外光并使用Omnicure(参见材料表)和365nm带通滤光片(图3B)施加10 mW/ cm 2 365 nm光5分钟,使这些结构变硬。
注意: 在将细胞暴露在紫外线下之前,使用辐射计/光度计确认光强度正确。 - 从这些孔中取出剩余的培养基,并向每个孔中加入新鲜的低血清培养基。将培养板放回培养箱。
- 从培养箱中取出板,并在步骤9之后的所需时间点进行成纤维细胞活化研究。
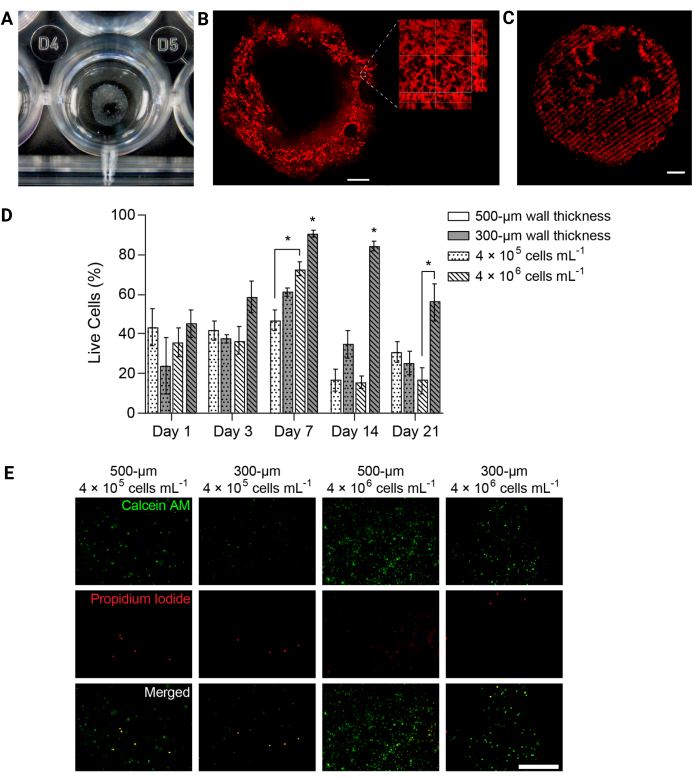
图 4:3D 生物打印的水凝胶结构随时间推移支持细胞活力。 (A) 3D 打印水凝胶结构在 24 孔板中的照片。(B)荧光标记的PEGαMA 3D打印水凝胶的最大强度投影。比例尺 = 1 毫米。更高倍率的显微镜显示,在FRESH生物打印支持浴中,明胶微粒诱导的水凝胶结构内存在孔隙。(C)在共聚焦显微镜上成像的具有荧光标记加固区域的3D打印PEGαMA管(100μm z堆栈显示为最大强度投影)显示了对3D硬化的空间控制。比例尺 = 500 μm。 (D) 通过活/死测定测量的 3D 生物打印构建体中的 HPAAF 活力。厚度为 300 μm 且 4 × 106 个细胞/mL 的构建体在每个时间点均优于所有其他条件。活力在第 7 天达到峰值。选择该条件和时间点用于未来的实验。列显示 SEM ±平均值,n = 3。*,p < 0.05,方差分析,Tukey HSD。(E) 在第 7 天(总体活力最大的时间点)用活/死试剂染色的 3D 构建体中细胞的代表性共聚焦图像。钙黄绿素AM用绿色标记活细胞,用红色标记碘化丙啶死细胞。最右边的一列显示性能最佳的条件具有均匀的细胞分布和高百分比的活细胞。比例尺 = 500 μm。经 Davis-Hall 等人许可转载5。请点击这里查看此图的较大版本.
8. 成纤维细胞活力的评估
- 在所需的活力时间点,使用钙黄绿素AM和碘化丙啶染色(参见 材料表)。
注意:总而言之,应从每个孔中取出培养基,并应用无菌PBS冲洗构建体。将构建体在活/死染色溶液中在 37°C 的摇床上孵育 40 分钟。染色液应含有钙黄绿素AM(1:1000稀释)和碘化丙啶(1:1000稀释),以便在成像时识别活细胞或死细胞。 - 将构建体转移到无菌PBS中,并立即在共聚焦荧光显微镜上成像。在每个时间点为每个样品采集三个不同的100μmz堆栈图像,并将活力表示为活细胞的平均百分比(图4D,E)。
9. 成纤维细胞活化的评估
- 在PBS中制备3%w / v牛血清白蛋白(BSA)和0.1%v / v 吐温20。该溶液将被称为免疫荧光 (IF) 溶液。
- 在所需的时间点,从样品孔中取出培养基并用PBS冲洗构建体。用4%多聚甲醛(PFA)代替PBS,并将这些样品在37°C下保持在摇床上30分钟。然后,在PBS中用100mM甘氨酸替换4%PFA,并将这些样品在室温(RT)下在摇床上再放置15分钟。
- 接下来,将这些样品转移到 Tissue-Tek Cryomolds 中,用最佳切割温度 (OCT) 溶液完全覆盖样品(参见 材料表),并让 OCT 在 4 °C 下扩散到样品中 12-18 小时。
- 使用液氮将OCT浸泡的样品在2-甲基丁烷中快速冷冻。用液氮填充聚苯乙烯泡沫塑料盒或其他适当的容器,然后在液氮中放置第二个装满 2-甲基丁烷的容器,使其至少浸没一半。使用镊子将每个含有OCT覆盖样品的冷冻模保持在液氮冷却的2-甲基丁烷中,直至明显冻结。这些样品可以储存在-80°C,直到它们准备好进行冷冻切片。
注意: 处理液氮时,应使用个人防护设备 (PPE),例如防寒手套、防寒围裙和低温安全套件中提供的面罩(参见 材料表)。 - 在-22°C下冷冻冷冻OCT样品,并将10μm厚的切片附着在带正电荷的玻璃显微镜载玻片上。为每个3D水凝胶样品准备三个显微镜载玻片,每个载玻片至少进行3-5次冷冻切片。
注意:如果需要作为停止点,显微镜载玻片可以在-80°C下储存。 - 将冷冻切片固定在冰冷的丙酮中15分钟,以帮助冷冻切片粘附在载玻片上。用室温水轻轻冲洗冷冻切片以去除任何残留的OCT。让这些样品干燥并用疏水笔勾勒出冷冻切片的轮廓(参见 材料表)。
- 在室温下用 0.2% v/v Triton X-100 在 PBS 中透化样品 10 分钟,然后在室温下用 5% BSA w/v 在 PBS 中封闭切片 1 小时。
- 将原代小鼠抗人α平滑肌肌动蛋白(αSMA)抗体(1:250稀释)(参见 材料表)加入IF溶液中。将这些切片样品与一抗一起储存在4°C下过夜。 用IF溶液冲洗样品3次。
- 将切片在含有二次山羊抗小鼠 Alexa Fluor 555 抗体(1:250 稀释)和每毫升 IF 溶液两滴 ActinGreen 488 ReadyProbe(参见 材料表)的 IF 溶液中孵育。用铝箔覆盖所有后续步骤的样品以保护它们免受光线照射,并让二抗溶液在室温下在样品上停留 1 小时。
- 用IF溶液冲洗切片3次。在室温下将它们在300nM 4',6-二脒基-2-叶吲哚(DAPI)的去离子水中孵育15分钟,用去离子水对切片进行3次最终冲洗。
- 使用 10 μL 市售的抗淬灭试剂(参见 材料表),使用标准方法盖玻片切片。
注意:安装的载玻片可以避光存放在-80°C冰箱中,直到需要成像。 - 使用荧光显微镜对冷冻切片进行成像(图3C 和 图5B)。使用 10 倍物镜对每张幻灯片的三个随机部分进行成像。
注意: 图像应在 DAPI、FITC 和 TRITC 通道中拍摄。 - 将图像上传到 ImageJ (NIH)。通过将αSMA阳性细胞的总数除以每个视野的细胞核总数,量化αSMA阳性细胞的百分比作为成纤维细胞活化的测量值(图5A)。
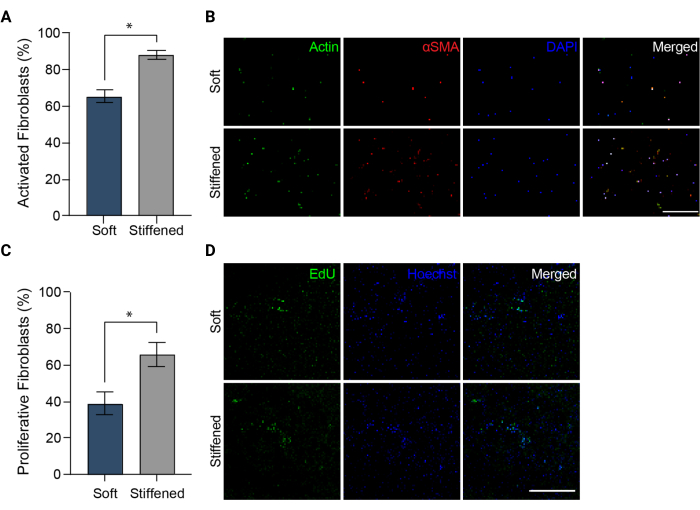
图 5:3D 生物打印肺动脉外膜炎模型中的成纤维细胞活化。 (A) 通过 αSMA 表达测量的软质和硬化 3D 水凝胶中的纤维化活化。与软结构中的细胞相比,硬化结构中的HPAAFs对αSMA的阳性率明显更高。列表示 SEM ±平均值,n = 3。*,p < 0.05,Mann-Whitney U 检验。(B) 软质和硬化 3D 水凝胶中 αSMA、肌动蛋白和 DAPI 免疫染色的代表性共聚焦图像。与软结构中的细胞相比,硬化结构中的HPAAF显示出更普遍的αSMA免疫荧光。比例尺 = 250 μm。 (C) 通过 EdU 阳性测量的柔软和硬化的 3D 生物打印结构中的成纤维细胞增殖。与软结构中的细胞相比,硬化结构中的HPAAFs对EdU的阳性率明显更高。列表示 SEM ±平均值,n = 3。*,p < 0.05,Mann-Whitney U 检验。(D) EdU 和 Hoechst 染料在软质和硬化 3D 水凝胶中的免疫染色的代表性共聚焦图像。与软结构中的细胞相比,硬化结构中的HPAAF显示出更普遍的EdU免疫荧光。比例尺 = 300 μm。经 Davis-Hall 等人许可转载5。请点击这里查看此图的较大版本.
10. 成纤维细胞增殖的评估
- 在所需的增殖时间点前 24 小时,从每个孔中取出细胞培养基,并用补充有市售细胞增殖试剂盒中的 10 μM EdU 溶液的低血清培养基代替(参见 材料表)。将样品放回培养箱中过夜孵育。
- 在所需的增殖时间点,将使用4%PFA在37°C下与EdU一起孵育的样品固定在摇床上30分钟。用PBS中的100mM甘氨酸代替4%PFA溶液,并将样品在37°C下孵育至少15分钟。加入适当浓度的Hoechst30分钟,然后用PBS冲洗构建体2次。
注意:样品可以在4°C避光储存,直到成像。 - 使用荧光显微镜和建议的细胞增殖试剂盒制造商设置和过滤器对所有固定和储存的 EdU 样品进行成像(图 3C 和 图 5D)。每个样品采集三个不同的 100 μm z 堆栈图像,并从每个 z 堆栈创建最大投影。通过计数EdU阳性细胞的数量并除以最大投影图像中Hoechst复染剂鉴定的细胞总数来测量HPAAF增殖(图5C)。
结果
该协议描述了如何在支撑浴中3D生物打印光可调水凝胶,以创建能够动态和时间加固的结构,以研究模拟人体组织的几何形状中的成纤维细胞活化。首先,该协议解释了如何合成PEGαMA,这是该光电互导聚合物系统的骨架。核磁共振(NMR)波谱测量显示PEGαMA功能化成功率为96.5%(图1)。对于此程序,90%或更高的功能化值是可以接受的。接下来,详细介绍了如何创建空心圆柱体...
讨论
响应受控光照的双阶段聚合反应可以通过空间和时间控制使生物材料变硬。一些研究利用这种技术来评估各种平台中的细胞-基质相互作用 5,8,9,10,11,21,22,23。更具体地说,光掩模或双光子激发方法?...
披露声明
作者没有任何利益冲突需要披露。本手稿部分经IOP Publishing https://doi.org/10.1088/1758-5090/aca8cf 许可©转载。5 保留所有权利。
致谢
作者要感谢 Adam Feinberg 博士(卡内基梅隆大学)和主持 3D 生物打印开源研讨会的人员。这些人使学习FRESH生物打印技术成为可能,并构建了用于这些研究的3D生物打印机。此外,作者要感谢 Biorender.com,它被用来制作本手稿中的数字。这项工作得到了多个团体或资金来源的支持,包括罗斯社区基金会(DDH 和 CMM)、科罗拉多州肺血管疾病研究奖(DDH 和 CMM)、1941401 奖下的国家科学基金会 (CMM)、W81XWH-20-1-0037 (CMM) 下陆军部、美国国立卫生研究院国家癌症研究所 R21 CA252172 奖 (CMM)、 科罗拉多大学安舒茨医学院的卢德曼家庭女性健康研究中心(DDH 和 CMM)、美国国立卫生研究院国家心肺血液研究所获得 R01 HL080396 (CMM)、R01 HL153096 (CMM)、F31 HL151122 (DDH) 和 T32 HL072738(DDH 和 AT)奖项。
材料
| Name | Company | Catalog Number | Comments |
| AccuMax Radiometer/Photometer Kit | Spectronics Corporation | XPR-3000 | To measure light intensity, used for photostiffening |
| Acetic Acid | Fisher Scientific | BP2401-500 | Used during PEGaMA synthesis |
| Acetone | Fisher Scientific | A184 | Used with the cryosections |
| ActinGreen 488 ReadyProbes | Fisher Scientific | R37110 | Used for staining |
| Aluminum Foil | Reynolds | F28028 | |
| Anhydrous Tetrahydrofuran (THF) | Sigma-Aldrich | 401757-1L | Used during PEGaMA synthesis |
| Argon Compressed Gas | Airgas | AR R300 | Used during PEGaMA synthesis |
| 8 Arm Poly(ethylene glycol)-hydroxyl (PEG-OH) | JenKem Technology | 8ARM-PEG-10K | Used during PEGaMA synthesis |
| 365 nm Bandpass Filter | Edmund Optics | 65-191 | Used for photostiffening |
| Bovine Serum Albumin (BSA) | Fisher Scientific | BP9700-100 | Used during staining process |
| Buchner Funnel | Quark Glass | QFN-8-14 | Used during PEGaMA synthesis |
| Calcein AM | Invitrogen | 65-0853-39 | Used during staining process |
| Celite 545 (Filtration Aid) | EMD Millipore | CX0574-1 | Used during PEGaMA synthesis |
| Charged Microscope Slides | Globe Scientific | 1358W | |
| Chloroform-d | Sigma-Aldrich | 151823-10X0.75ML | Used to characterize PEGaMA |
| Click-iT Plus EdU Cell Proliferation Kit | Invitrogen | C10637 | Used for staining |
| 50 mL Conical Tubes | CELLTREAT | 667050B | |
| Cryogenic Safety Kit | Cole-Parmer | EW-25000-85 | |
| Cryostat | Leica | CM 1850-3-1 | |
| Dialysis Tubing | Repligen | 132105 | |
| 4’,6-Diamidino-2-Phylindole (DAPI) | Sigma-Aldrich | D9542-1MG | Used for staining |
| Diethyl Ether | Fisher Scientific | E1384 | Used during PEGaMA synthesis |
| 1,4-Dithiothreitol (DTT) | Sigma-Aldrich | 10197777001 | Bioink component |
| Dulbecco's Modified Eagle's Medium (DMEM) | Cytiva | SH30271.FS | |
| Filter Paper | Whatman | 1001-090 | Used during PEGaMA synthesis |
| Freezone 2.5L Freeze Dry System | Labconco | LA-2.5LR | Lyophilizer |
| Fusion 360 | Autodesk | N/A | Software download |
| 2.5 mL Gastight Syringe | Hamilton | 81420 | Used for bioprinting |
| 15 Gauge 1.5" IT Series Tip | Jensen Global | JG15-1.5X | Used for bioprinting |
| 30 Gauge 0.5" HP Series Tip | Jensen Global | JG30-0.5HPX | Used for bioprinting |
| Goat Anti-Mouse Alexa Fluor 555 Antibody | Fisher Scientific | A21422 | Used for staining |
| Glycine | Fisher Scientific | C2H5NO2 | Used during staining process |
| Hemocytometer | Fisher Scientific | 1461 | |
| Hoechst | Thermo Scientific | 62249 | Used during staining process |
| Human Pulmonary Artery Adventitial Fibroblasts (HPAAFs) | AcceGen | ABC-TC3773 | From a 2-year-old male patient |
| Hydrochloric Acid (HCl) | Fisher Scientific | A144-500 | Used to pH adjust solutions |
| ImageJ | National Institutes of Health (NIH) | N/A | Free software download |
| ImmEdge® Pen | Vector Laboratories | H-4000 | Used during staining process |
| Incubator | VWR | VWR51014991 | |
| LifeSupport Gelatin Microparticle Slurry (Gelatin Slurry) | Advanced Biomatrix | 5244-10GM | Used for bioprinting |
| Light Microscope | Olympus | CKX53 | Inverted light microscope |
| Lithium Phenyl-2,4,6-Trimethylbenzoylphosphinate (LAP) | Sigma-Aldrich | 900889-5G | Photoinitiator used for photostiffening |
| Liquid Nitrogen | N/A | N/A | |
| LulzBot Mini 2 | LulzBot | N/A | Bioprinter adapted |
| Methacryloxyethyl Thiocarbamoyl Rhodamine B | Polysciences Inc. | 669775-30-8 | |
| 2-Methylbutane | Sigma-Aldrich | M32631-4L | |
| Microman Capillary Pistons CP1000 | VWR | 76178-166 | Positive displacement pipette tips |
| MMP2 Degradable Crosslinker (KCGGPQGIWGQGCK) | GL Biochem | N/A | Bioink component |
| Mouse Anti-Human αSMA Monoclonal Antibody | Fisher Scientific | MA5-11547 | Used for staining |
| OmniCure Series 2000 | Lumen Dynamics | S2000-XLA | UV light source used for photostiffening |
| Paraformaldehyde (PFA) | Electron Microscopy Sciences | 15710 | Used to fix samples |
| pH Meter | Mettler Toledo | FP20 | |
| pH Strips | Cytiva | 10362010 | |
| Phosphate Buffered Saline (PBS) | Hyclone Laboratories, Inc. | Cytiva SH30256.FS | |
| Pipette Set | Fisher Scientific | 14-388-100 | |
| 10 µL Pipette Tips | USA Scientific | 1120-3710 | |
| 20 µL Pipette Tips | USA Scientific | 1183-1510 | |
| 200 µL Pipette Tips | USA Scientific | 1111-0700 | |
| 1000 µL Pipette Tips | USA Scientific | 1111-2721 | |
| Poly(Ethylene Glycol)-Alpha Methacrylate (PEGαMA) | N/A | N/A | Refer to manuscript for synthesis steps |
| Poly(Ethylene Oxide) (PEO) | Sigma-Aldrich | 372773-250G | Bioink component |
| Positive Displacement Pipette | Fisher Scientific | FD10004G | 100-1000 µL |
| Potassium Hydroxide (KOH) | Sigma-Aldrich | 221473-500G | Used to pH adjust solutions |
| ProLong Gold Antifade Reagent | Invitrogen | P36930 | Used during staining process |
| Pronterface | All3DP | N/A | Software download |
| Propidium Iodide | Sigma-Aldrich | P4864-10ML | Used for staining |
| RGD Peptide (CGRGDS) | GL Biochem | N/A | Bioink component |
| Rocker | VWR | 10127-876 | |
| Rotary Evaporator | Thomas Scientific | 11100V2022 | Used during PEGaMA synthesis |
| Rubber Band | Staples | 808659 | |
| Schlenk Flask | Kemtech America | F902450 | Used during PEGaMA synthesis |
| Slic3r | Slic3r | N/A | Software download |
| Smooth Muscle Cell Growth Medium-2 (SmGM-2) BulletKit | Lonza | CC-3182 | Kit contains CC-3181 and CC-4149 components |
| Sodium Hydride | Sigma-Aldrich | 223441-50G | Used during PEGaMA synthesis |
| Sorvall ST 40R Centrifuge | Fisher Scientific | 75-004-525 | |
| Stir Bar | VWR | 58948-091 | |
| Syringe Filter | VWR | 28145-483 | Used to sterile filter solutions |
| T-75 Tissue-Cultured Treated Flask | VWR | 82050-856 | Used for cell culture work |
| Tissue-Tek Cyromold | Sakura | 4557 | |
| Tissue-Tek O.C.T Compound (OCT) | Sakura | 4583 | |
| Tris(2-Carboxyethyl) Phosphine (TCEP) | Sigma-Aldrich | C4706-2G | |
| Triton X-100 | Fisher Bioreagents | C34H622O11 | Used during staining process |
| Trypan Blue | Sigma-Aldrich | T8154-20ML | Used for cell culture work |
| 0.05% Trypsin-EDTA | Gibco | 25-300-062 | Used for cell culture work |
| Tween 20 | Fisher Bioreagents | C58H114O26 | Used during staining process |
| Upright Microscope | Olympus | BX63F | Fluorescent microscope capabilities |
| Water Bath | PolyScience | WBE20A11B | |
| 24-Well Tissue Culture Plates | Corning | 3527 |
参考文献
- Ahrens, J. H., et al. Programming cellular alignment in engineered cardiac tissue via bioprinting anisotropic organ building blocks. Advanced Materials. 34 (26), e2200217 (2022).
- Lin, N. Y. C., et al. Renal reabsorption in 3D vascularized proximal tubule models. Proceedings of the National Academy of Sciences of the United States of America. 116 (12), 5399-5404 (2019).
- Grigoryan, B., et al. Multivascular networks and functional intravascular topologies within biocompatible hydrogels. Science. 364 (6439), 458-464 (2019).
- Kang, Y., Datta, P., Shanmughapriya, S., Ozbolat, I. T. 3D bioprinting of tumor models for cancer research. ACS Applied Biomaterials. 3 (9), 5552-5573 (2020).
- Davis-Hall, D., Thomas, E., Pena, B., Magin, C. M. 3D-bioprinted, phototunable hydrogel models for studying adventitial fibroblast activation in pulmonary arterial hypertension. Biofabrication. 15 (1), (2022).
- Mirdamadi, E., Tashman, J. W., Shiwarski, D. J., Palchesko, R. N., Feinberg, A. W. FRESH 3D bioprinting of a full-size model of the human heart. ACS Biomaterials Science & Engineering. 6 (11), 6453-6459 (2020).
- Shiwarski, D. J., Hudson, A. R., Tashman, J. W., Feinberg, A. W. Emergence of FRESH 3D printing as a platform for advanced tissue biofabrication. APL Bioengineering. 5 (1), 010904 (2021).
- Petrou, C. L., et al. Clickable decellularized extracellular matrix as a new tool for building hybrid hydrogels to model chronic fibrotic diseases in vitro. Journal of Materials Chemistry B. 8 (31), 6814-6826 (2020).
- Hewawasam, R. S., Blomberg, R., Serbedzija, P., Magin, C. M. Chemical modification of human decellularized extracellular matrix for incorporation into phototunable hybrid hydrogel models of tissue fibrosis. ACS Applied Materials & Interfaces. 15 (12), 15071-15083 (2023).
- Saleh, K. S., et al. Engineering hybrid hydrogels comprised healthy or diseased decellularized extracellular matrix to study pulmonary fibrosis. Cellular and Molecular Bioengineering. 15 (5), 505-519 (2022).
- Guvendiren, M., Burdick, J. A. Stiffening hydrogels to probe short- and long-term cellular responses to dynamic mechanics. Nature Communications. 3, 792 (2012).
- Rosales, A. M., Vega, S. L., DelRio, F. W., Burdick, J. A., Anseth, K. S. Hydrogels with reversible mechanics to probe dynamic cell microenvironments. Angewandte Chemie International Edition English. 56 (40), 12132-12136 (2017).
- Wynn, T. A., Ramalingam, T. R. Mechanisms of fibrosis: therapeutic translation for fibrotic disease. Nature Medicine. 18 (7), 1028-1040 (2012).
- Huertas, A., Tu, L., Humbert, M., Guignabert, C. Chronic inflammation within the vascular wall in pulmonary arterial hypertension: more than a spectator. Cardiovascular Research. 116 (5), 885-893 (2020).
- Kendall, R. T., Feghali-Bostwick, C. A. Fibroblasts in fibrosis: novel roles and mediators. Frontiers in Pharmacology. 5, 123 (2014).
- Parker, M. W., et al. Fibrotic extracellular matrix activates a profibrotic positive feedback loop. The Journal of Clinical Investigation. 124 (4), 1622-1635 (2014).
- Habiel, D. M., Hogaboam, C. Heterogeneity in fibroblast proliferation and survival in idiopathic pulmonary fibrosis. Frontiers in Pharmacology. 5, 2 (2014).
- Hu, C. J., Zhang, H., Laux, A., Pullamsetti, S. S., Stenmark, K. R. Mechanisms contributing to persistently activated cell phenotypes in pulmonary hypertension. The Journal of Physiology. 597 (4), 1103-1119 (2019).
- Li, M., et al. Emergence of fibroblasts with a proinflammatory epigenetically altered phenotype in severe hypoxic pulmonary hypertension. The Journal of Immunology. 187 (5), 2711-2722 (2011).
- Hinton, T. J., et al. Three-dimensional printing of complex biological structures by freeform-reversible embedding of suspended hydrogels. Science Advances. 1 (9), e1500758 (2015).
- Brown, T. E., et al. Secondary photocrosslinking of click hydrogels to probe myoblast mechanotransduction in three dimensions. Journal of the American Chemical Society. 140 (37), 11585-11588 (2018).
- Ondeck, M. G., et al. Dynamically stiffened matrix promotes malignant transformation of mammary epithelial cells via collective mechanical signaling. Proceedings of the National Academy of Sciences of the United States of America. 116 (9), 3502-3507 (2019).
- Caliari, S. R., et al. Stiffening hydrogels for investigating the dynamics of hepatic stellate cell mechanotransduction during myofibroblast activation. Scientific Reports. 6, 21387 (2016).
- Liu, F., et al. Feedback amplification of fibrosis through matrix stiffening and COX-2 suppression. Journal of Cell Biology. 190 (4), 693-706 (2010).
- Tschumperlin, D. J., Ligresti, G., Hilscher, M. B., Shah, V. H. Mechanosensing and fibrosis. The Journal of Clinical Investigation. 128 (1), 74-84 (2018).
- Chelladurai, P., Seeger, W., Pullamsetti, S. S. Matrix metalloproteinases and their inhibitors in pulmonary hypertension. European Respiratory Journal. 40 (3), 766-782 (2012).
- Caracena, T., et al. Alveolar epithelial cells and microenvironmental stiffness synergistically drive fibroblast activation in three-dimensional hydrogel lung models. Biomaterials Science. 10 (24), 7133-7148 (2022).
- Ruskowitz, E. R., DeForest, C. A. Proteome-wide analysis of cellular response to ultraviolet light for biomaterial synthesis and modification. ACS Biomaterials Science & Engineering. 5 (5), 2111-2116 (2019).
- Kruse, C. R., et al. The effect of pH on cell viability, cell migration, cell proliferation, wound closure, and wound reepithelialization: In vitro and in vivo study. Wound Repair and Regeneration. 25 (2), 260-269 (2017).
- Filippi, M., et al. Perfusable biohybrid designs for bioprinted skeletal muscle tissue. Advanced Healthcare Materials. , e1500758 (2023).
- Matthiesen, I., et al. Astrocyte 3D culture and bioprinting using peptide-functionalized hyaluronan hydrogels. Science and Technology of Advanced Materials. 24 (1), 2165871 (2023).
- Xu, L., et al. Bioprinting a skin patch with dual-crosslinked gelatin (GelMA) and silk fibroin (SilMA): An approach to accelerating cutaneous wound healing. Materials Today Bio. 18, 100550 (2023).
- Bliley, J. M., Shiwarski, D. J., Feinberg, A. W. 3D-bioprinted human tissue and the path toward clinical translation. Science Translational Medicine. 14 (666), eabo7047 (2022).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。