このコンテンツを視聴するには、JoVE 購読が必要です。 サインイン又は無料トライアルを申し込む。
Method Article
線維芽細胞の活性化を研究するための3Dバイオプリンティング用フォトチューナブルハイドロゲル
要約
本稿では、フォトチューナブルハイドロゲルを3Dバイオプリントして、細胞外マトリックスの硬化と線維芽細胞の活性化を研究する方法について説明します。
要約
フォトチューナブルハイドロゲルは、光曝露に応答して空間的および時間的に変化します。これらのタイプの生体材料を細胞培養プラットフォームに組み込み、微小環境の剛性を高めるなどの変化を動的に引き起こすことで、研究者は線維性疾患の進行中に発生する細胞外マトリックス(ECM)の変化をモデル化することができます。本明細書では、ゼラチン支持体浴内で2つの連続重合反応が可能な光可変ヒドロゲル生体材料を3Dバイオプリンティングする方法を提示する。懸濁ハイドロゲルのフリーフォーム可逆的包埋(FRESH)バイオプリンティングの手法は、マイケル付加反応を促進するためにサポートバスのpHを調整することによって適応されました。まず、ポリ(エチレングリコール)-αメタクリレート(PEGαMA)を含むバイオインクを非化学量論的に細胞分解性架橋剤と反応させ、ソフトハイドロゲルを形成しました。これらの軟質ハイドロゲルは、後に光開始剤と光に曝露され、未反応基のホモ重合を誘導し、ヒドロゲルを硬くしました。このプロトコルは、ハイドロゲル合成、3Dバイオプリンティング、光硬化、および3D構造内の線維芽細胞の活性化を評価するためのエンドポイントの特性評価をカバーしています。今回紹介する手法により、研究者はpH触媒による重合反応を起こすさまざまな材料を3Dバイオプリントすることができ、組織の恒常性、疾患、修復のさまざまなモデルを設計するために実装することができます。
概要
3Dバイオプリンティングは、研究者が細胞や生体材料を3Dボリューム内に正確に堆積させ、生体組織の複雑な階層構造を再現することを可能にする革新的な技術です。過去10年間で、3Dバイオプリンティングの進歩により、鼓動するヒト心臓組織1、腎臓組織の機能モデル2、肺内のガス交換モデル3、がん研究用の腫瘍モデル4が作成されました。懸濁ハイドロゲルのフリーフォーム可逆埋め込み(FRESH)バイオプリンティングなどの組み込み3Dバイオプリンティング技術の発明により、肺血管5 やヒトの心臓6 などの複雑な軟部組織構造を3Dで再現することが可能になりました。 FRESH 3Dバイオプリンティングは、せん断希釈サポートバスへの押し出しにより、軟質および低粘度のバイオインクの層ごとの印刷を容易にします。サポートバスは、ビンガムプラスチックとして機能し、印刷後にバイオインクの意図した形状と構造を維持する、密集したゼラチン微粒子などの材料で構成されています。プリントされた構造物が固まったら、温度を37°Cに上げることでサポートバスを溶解することができます7。
最近の総説では、FRESH技術を使用してさまざまな出版物で3Dバイオプリントされた材料がまとめられています。これらの天然由来の物質は、I型コラーゲンからメタクリル化ヒアルロン酸まで多岐にわたり、いくつかの異なるゲル化メカニズムを表しています7。この3Dバイオプリンティング技術を使用して行われるほとんどの調査研究は、外部刺激に反応して変化しない静的な生体材料を使用しています。動的光可変ハイドロゲル生体材料は、さまざまな線維性疾患をモデル化するために、私たちの研究室や他の研究室で使用されています8,9,10,11,12。静的な生体材料とは異なり、光可変バイオインクでは、弾性率の低い軟化モデルを作成し、後で硬化させて、微小環境硬化の増加に対する細胞応答を調べることができます。
線維性疾患は、瘢痕化や硬化を引き起こす可能性のある細胞外マトリックス産生の増加を特徴としています13。組織の硬化は、影響を受けた組織のさらなる損傷と破壊を引き起こし、永久的な臓器損傷や死に至ることさえあります。線維化疾患は、世界の死亡率の3分の1を占めています。線維芽細胞は、この疾患状態で過剰で異常な細胞外マトリックスを産生します14,15。線維芽細胞の増殖の増加および細胞外マトリックスの沈着は、組織をさらに硬化させ、原線維化促進性の正のフィードバックループを活性化する16,17,18,19。線維芽細胞の活性化を研究することは、線維性疾患を理解するために不可欠です。ここでは、ヒト肺動脈性肺高血圧症(PAH)を線維化疾患の例として紹介し、3Dバイオプリンティングを使用して血管の3D形状を模倣し、光波長可変ハイドロゲルの動的硬化能力を紹介します。PAHは、主肺動脈の圧力が正常レベルを超え、心臓に負担がかかり、ヒト肺動脈外膜線維芽細胞(HPAAF)の活性化を増加させ、血管組織を硬化させる状態です16,17,18,19。光可変ポリ(エチレングリコール)-αメタクリレート(PEGαMA)バイオインク製剤は、コンストラクトの経時的な硬化を可能にし、健康な組織と疾患の進行の両方をモデル化するのに役立ちます5,8,9,10。このユニークな特徴を利用することで、微小環境硬化に応答したHPAAFの活性化と増殖を3Dで定量化することができ、この疾患に関与する細胞メカニズムに関する貴重な洞察が得られる可能性があります。ここで説明するプロトコルにより、研究者は、疾患の進行または組織修復中の細胞外微小環境の変化を再現する3Dモデルを作成し、線維芽細胞の活性化を研究することができます。
プロトコル
1. PEGαMAの合成と特性評価
注:ポリ(エチレングリコール)-αメタクリレート(PEGαMA)合成は、Hewawasam ら から採用され、水分のない条件下で実施されました9。
- 反応物の秤量を量ります。
注:例えば、5 g 10 kg/mol 8アームPEG-ヒドロキシル(PEG-OH)と0.38 gの水素化ナトリウム(NaH)を秤量します( 材料表を参照)。 - 250 mLのシュレンクフラスコに攪拌子を加え、アルゴンでパージします。
- PEG-OHを、シュレンクフラスコ内での溶解に必要な最小量の無水テトラヒドロフラン(THF)に溶解します。
注:約80 mLのTHFは5 gのPEG-OHを溶解します。PEG-OHを溶解するのに必要な最小限のTHFを加えます。 - 反応混合物に3倍モルの過剰NaHを加え、室温(RT)で30分間撹拌します。
- 6倍モルの過剰なエチル2-(ブロモメチル)アクリレート(EBrMA、 材料表を参照)をシュレンクフラスコに滴下し、反応容器をアルミホイルで覆って光から保護します。室温で約48時間撹拌します。
注:5 g の PEG-OH および 0.38 g NaH の場合、この反応には 3.68 mL の EBrMA を使用します。 - 反応を急冷するために1N酢酸を数滴加えます。濾過助剤で溶液を真空ろ過します。
注意: 酢酸を加えると気泡が発生します。気泡の形成が止まったら、混合物が正常に急冷されたことを示すため、酢酸滴の添加を停止します。 - ロータリーエバポレーターで濾液を濃縮し、4°Cのジエチルエーテルに沈殿させます。沈殿物を4°Cで12〜18時間光から保護しておきます。
- Whatman濾紙をBuchner漏斗に追加します。反応混合物を濾紙の上にゆっくりと注ぎ、真空吸引を使用してジエチルエーテルから沈殿物を分離します。乾燥した清潔なろ過フラスコに沈殿物を集めます。
- 製品を室温で少なくとも5時間または一晩真空乾燥させ、必要最小限の脱イオン水に溶解します。溶解した製品を透析チューブ( 材料表を参照)に移し、3.5Lの脱イオン水に対して少なくとも4日間透析します。透析水は12時間ごとに交換してください。
注:製品は、真空乾燥後、完全に乾燥した純白色の固体粉末として表示されます。 - 製品を急速凍結し、約72時間または完全に乾くまで凍結乾燥します。
- 生成物をクロロホルムD(CDCl3)に溶解する。 1H NMRを使用し、2.5秒の緩和時間で248回のスキャンを実行するプロトコルでサンプルを実行します。
- CDCl3 溶媒ピークを 7.26 PPM にキャリブレーションして、製品の官能基化と純度を検証します。PEG 骨格陽子 (d3.71) のピークを積分し、積分を 114 に較正します。
- 残りのピーク(PEGαMA 1H NMR(300 MHz、CDCl 3):d(ppm)1.36(t、3H、CH 3-)、3.71(s、114H、PEG CH 2-CH 2)、4.29(t、s、4H、-CH 2-C(O)-O-O、-O-CH 2-C(=CH 2)-)、5.93(q、1H、-C=CH 2)、6.34(q、1H、-C=CH 2)を積分し、αMAアルケン末端基ピークの積分を、PEGバックボーンキャリブレーション(図1)。
注:「a」とラベル付けされた 2 つのピークを平均化し(図 1)、100 を掛けて、平均 PEGαMA 官能基化率を求めます。
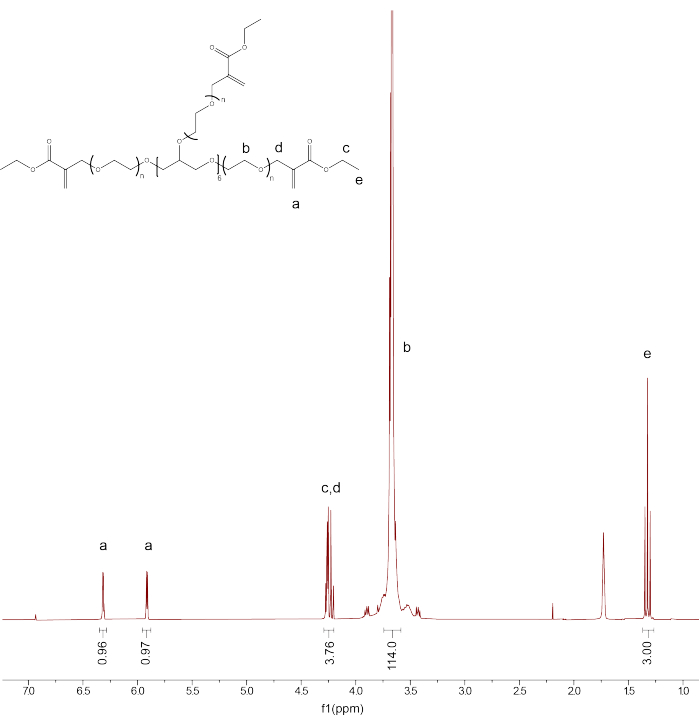
図1:プロトンNMRにより、PEGαMAの官能基化が成功したことが確認されました。クロロホルム-D(CDCl3)でNMR分析を行い、96.5%の機能化を示しました。PEGαMA 1H NMR (300 MHz, CDCl3): d (ppm) 1.36 (t, 3H, CH 3-),3.71 (s, 114H, PEG CH 2-CH 2), 4.29 (t, s, 4H, -CH 2-C(O)-O-O, -O-CH 2-C(=CH 2)-), 5.93 (q, 1H, -C=CH 2), 6.34 (q, 1H, -C=CH 2).この図の拡大版をご覧になるには、ここをクリックしてください。
2. モデル設計と3Dバイオプリンターのセットアップ
注:市販の3Dプリンター( 材料表を参照)は、熱可塑性押出機を特注のシリンジポンプ押出機に置き換えて変更し、Hintonら20から適合させました。オープンソースの設計はオンラインで入手できます: https://3d.nih.gov/users/awfeinberg.
- Fusion 360ソフトウェア( 「材料表」を参照)を開き、3Dコンピュータ支援中空円柱設計を作成します。
注:このステップに使用でき、血管の形状を模倣したダウンロード可能なファイルは、 補足ファイル1にあります。 - ファイルを保存し、Slic3rソフトウェア内で開きます( 材料表を参照)。すべてのパラメータが希望どおりであることを再確認してから、エクスポートGコードボタンを押します。Gコードをコンピューターに保存します。
- Pronterfaceソフトウェア( 材料表を参照)を開き、Gコードファイルをアップロードします。
注:Pronterfaceソフトウェアはバイオプリンターとインターフェースし、十分なハードウェア入力制御を提供します。使用可能なGコードファイルは、 補足ファイル2にあります。 - バイオプリンターとすべての関連部品を、無菌技術を使用してバイオセーフティキャビネット(BSC)に移します。
- 長さ30 G 0.5インチの鈍い針先( 材料表を参照)を印刷ガラスシリンジに組み立て、脇に置きます。
- バイオプリンターの電源コードをコンセントに差し込みます。バイオプリンターの前面にある赤い電源ボタンを押して電源を入れます。コンピューターとバイオプリンターの間にユニバーサルシリアルバス(USB)コードを接続し、すべての配線接続が確立され、接続されていることを確認します。
3. サポートバスと試薬の調製
注:バイオセーフティキャビネット内のすべてのステップは、無菌技術を使用して実行してください。
- メーカーの指示に従って、ウシ胎児血清(FBS)を除くSmBM基礎培地(CC-3181)およびSmGM-2 SingleQuotsサプリメント(CC-4149)からなる細胞培養培地を調製します。使用するまで4°Cで保管してください。
- 50 mLの細胞培養培地に分注し、1% v/vのFBS(CC-4149)( 材料表参照)を添加して、低血清培地を作製します。使用するまで4°Cで保管してください。
- 溶媒としてFBSを含まない滅菌細胞培養培地を使用して、メーカーの指示に従ってゼラチンスラリー粉末を再懸濁します( 材料表を参照)。使用直前に、2 M水酸化カリウム(KOH)および/または2 M塩酸(HCl)を使用してゼラチンスラリーの最終pHをpH9に調整し、pHメーターを使用して必要に応じて溶液のpHを調整します。
- ニードルなしのシリンジを使用して、ウェルあたり1 mLのゼラチンスラリーを使用して、24ウェルプレートの所望のウェル数をそれぞれ約半分に充填します。
注意: ウェルの中央を均一に充填し、エアポケットがないことを確認します。プレートを軽くたたくと、微粒子スラリーが均一に分散します。必要に応じて、ウェルごとにスラリーの高さと量を調整し、各バイオプリントのサイズと形状に対応します。ユーザーは、自家製のシリンジを作成して、ゼラチンスラリーを各ウェルに移すことができます。これは、底部に圧縮されたゼラチンスラリーがすでに含まれている50mLの試験管に、正しいサイズのシリンジプランジャーを追加することで行うことができます。プランジャーを挿入するときは、試験管に沿って小さなガイドワイヤーを挿入して空気を逃がし、プランジャーがゼラチンスラリーに接触したら取り外します。使用直前に、試験管の先端をカミソリの刃で切り取り、ゼラチンスラリーが押し出される穴を開けてプランジャーを押し下げます。 - 充填した24ウェルプレートをバイオプリンターステージの中央に置き、ステージに固定します。
メモ: 図 2 は、一般的なバイオプリンターのセットアップを示しています。プリントステージの周囲に輪ゴムを貼り、24ウェルプレートをプラットフォームに固定し、動きを防ぎます。

図2:基本的な3Dバイオプリンティングのセットアップ。 バイオプリンターは、バイオセーフティキャビネットなどの無菌環境内に設置し、ガラスシリンジとニードルを下のサポートバス印刷領域に垂直に下ろすようにプリントヘッドを組み立てました。 この図の拡大版をご覧になるには、ここをクリックしてください。
4. 細胞培養
注:バイオセーフティキャビネット内のすべてのステップは、無菌技術を使用して実行してください。
- HPAAF細胞(市販品、 材料表を参照)を融解し、メーカーの指示に従って、SmBM基礎培地(CC-3181)およびすべてのSmGM-2 SingleQuotsサプリメント(CC-4149)を含むT-75組織培養処理プラスチックフラスコで増殖させます( 材料表を参照)。
注:接着細胞には標準的な細胞培養プロトコルを使用し、細胞を 37 °C および 5% CO2 に維持し、数日ごとに培地を補充する必要があります。 - HPAAFの濃度が80~90%に達したら、培地を吸引し、リン酸緩衝生理食塩水(PBS)で細胞を1回すすぎます。
- 予熱した0.05%トリプシン-EDTAを約4 mL各T-75フラスコに加えます。フラスコを傾けて、細胞培養表面全体が0.05%トリプシン-EDTA溶液で覆われていることを確認します。フラスコを37°Cで3〜5分間インキュベートし、細胞の剥離を確認します。
- 細胞が浮遊したら、少なくとも6 mLのダルベッコ修飾イーグル培地(DMEM)を各フラスコに加え、細胞を50 mLのコニカルチューブに移します。
- 細胞懸濁液を室温で300 x g で5分間遠心分離し、細胞をペレット化します。細胞ペレットから上清を吸引し、1000 μLのピペットを使用してFBSで1〜3 mLの培地に細胞を再懸濁し、シングルセル懸濁液を確保します。
- 細胞懸濁液10 μLを微量遠心チューブに移します。10 μLのトリパンブルー溶液を加え、よく混合します。この混合物10 μLを使用して、倒立光学顕微鏡を使用して血球計算盤内の細胞をカウントします。
注:4 x 106 cells/mL の最終バイオインク濃度を達成するために、バイオインク 200 μL ごとに 800,000 本の線維芽細胞を確保しました。
5. ハイドロゲルバイオインクの調製
注:バイオインクの調製は、Davis-Hall et al.5から採用しました。ステップ5.1〜5.2は、ステップ4.1〜4.3と並行して完了することで、細胞の収集からバイオインクへの再懸濁までの時間を最小化することができます。バイオセーフティキャビネット内で、無菌技術を使用してステップを実行します。
- 0.2 μmシリンジフィルターを使用して、20 mMトリス(2-カルボキシエチル)ホスフィン(TCEP、 材料表を参照)pH 7溶液と滅菌フィルターを調製します。使用直前に、2 M KOHおよび/または2 M HClを添加し、必要に応じて溶液のpHを調整します。pHメーターで測定し、それに応じて調整します。
注:TCEPはジスルフィド結合を減少させます。 - FBSを含まない滅菌細胞培養培地に再懸濁したPEGαMAの0.25 mg/mLストック溶液、1,4-ジチオスレイトール(DTT)、MMP2分解性架橋剤、およびCGRGDS(RGD)ペプチドの250 mMストック溶液( 材料表を参照)を調製し、すべてを20 mMの滅菌済みTCEPに再懸濁し、必要に応じてピペットを使用して蒸留水(DI)にポリエチレンオキシド(PEO)の15 wt%ストック溶液を調製します。
- 表 1 を目安として、必要な量の PEGαMA、DTT、MMP2 分解性架橋剤、PEO、CGRGDS、および低血清細胞培養培地を線維芽細胞と 50 mL コニカルチューブに混ぜ合わせます。
注:細胞培養培地以外のすべてを添加した後は、pH が 6.2 に非常に近くなるため、pH ストリップで pH を確認することをお勧めします。さらに pH を調整する必要がある場合は、前駆体溶液の pH を調整するために必要な追加容量を追跡します。残りの細胞培養培地の容量から最終的なpH調整中に追加された容量を差し引いた量を加えて、総容量を200 μLにします。 - 容積式ピペットを使用してバイオインクを混合し、細胞が単一細胞であることを確認し、最終的な前駆体溶液がpH 6.2であることを確認して、3Dバイオプリンティング中の塩基触媒重合を防ぎます。
- プランジャーを取り外し、15ゲージ、長さ1.5インチの鈍い針先( 材料表を参照)が取り付けられた別のシリンジを使用して、溶液内に気泡が形成されないように注意しながら、バイオインクを遠心分離管からシリンジに移すことで、バイオインクをガラスシリンジにロードします。
- ガラスシリンジをプリントヘッド内に置き、プリントヘッドのコンポーネントを取り付けて、すべてがしっかりと組み立てられ、印刷の準備が整うようにします。
注意: この時点で、プリントヘッド内のガラスシリンジには、印刷用に30ゲージ0.5インチの長さの鈍い針先が取り付けられている必要があります。
| コンポーネント | 原液濃度 | 追加する金額 |
| PEGαMAの | 0.25のmg/ml | 140μL |
| DTTの | 250ミリメートル | 12.24 μL |
| MMP2分解性架橋剤 | 250ミリメートル | 5.25 μL |
| RGD(RGD) | 250ミリメートル | 1.6μL |
| 専門家雇用組織(PEO) | 15重量% | 33.33 μL |
| 活性化培地および/またはpH調整試薬 | - | 7.58 μL |
| 線維芽細胞 | - | 800000セル |
表1:200 μLのバイオインク(ハイドロゲル前駆体溶液および線維芽細胞)を調製するために必要な容量の例。
6.3D. 3Dバイオプリンティング
注:バイオセーフティキャビネット内のすべてのステップは、無菌技術を使用して実行してください。
- Pronterfaceソフトウェア内の方向矢印を使用して、押出針の位置をウェルの中心とサポートバススラリー内に手動で調整します。ニードルの先端の下に少なくとも1mmのサポートバススラリーを残します。
注意: ソフトウェアには、針が空間内のどこにあるかを知る機能はありません。ソフトウェア内の矢印を手動でクリックして針を動かすかどうかは、完全にユーザー次第です(たとえば、上矢印をクリックすると、針が印刷プラットフォームから上または遠ざかる など)。針が井戸の境界に当たらないように慎重に操作します。 - 針先がウェル内のスラリーの中心に配置されたら、プロンターフェース内のスタートボタンを押し、プリントが完了するのを待ってコンストラクトを達成します( 図3Aを参照)。
注:提供されたファイル(補足ファイル1)を使用して1つのコンストラクトをバイオプリントするには、約3分かかります。針の向きを変えて動かし、1つの構造物を最初から最後まで完全にプリントするには、約5分かかります。 - 目的のバイオプリントコンストラクトの数が満たされるまで、手順6.1〜6.2を繰り返します。
注:失敗したプリントを説明するために、必要以上の構成を作成することをお勧めします。障害が発生した場合は、次のウェルに移動し、すべてをリセットして、手順6.1〜6.2を再度繰り返します。 - ウェルプレートを室温で放置し、プリント終了後にBSCで1時間覆い、フォトチューナブルヒドロゲルの塩基触媒重合を可能にします。
- 3Dバイオプリントされたコンストラクトを含むウェルプレートを37°Cの滅菌インキュベーターに入れ、12〜18時間放置してサポートバススラリーを溶かします。
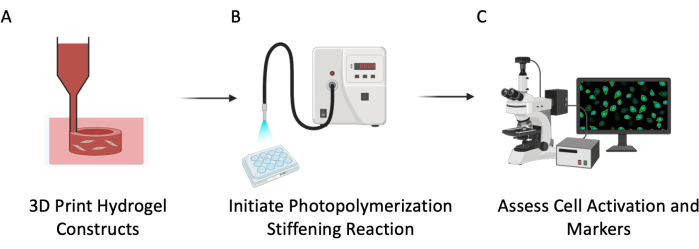
図3:実験回路図。このプロトコルは3つの主要なステップで記述されていた: (A) 肺のvasculatureをまねるために埋め込まれたセルが付いているPEGαMAの空の管を3Dバイオプリントする。(B)細胞微小環境を硬くするためのホモ重合反応の光開始。(C)増殖と活性化のための細胞マーカーの評価。この図の拡大版をご覧になるには、ここをクリックしてください。
7.3D bioprintedの構造物の文化およびphototiffening
注:すべてのステップは、無菌技術を使用してバイオセーフティキャビネットで実行する必要があります。
- 2.2 mM のフェニル-2,4,6-トリメチルベンゾイルホスフィン酸リチウム(LAP)( 材料表を参照)原液をPBSに調製し、0.2 μmのシリンジフィルターを使用して滅菌フィルターを調製します。LAP ソリューションを光から保護してください。
- 12〜18時間後、バイオプリントされたコンストラクトを囲むメディアを交換します。ウェル内の培地と溶けたゼラチンサポートバスを手動で除去し、バイオプリントされた構造物を乱さないように注意してください。
注意: プレートを45°の角度で保持しながらメディアをゆっくりと取り除くと、構造物がウェル内に現れて見えるようになります。透明なハイドロゲルシリンダーは、プリントが成功し、各ウェルで識別できるはずです(図4A)。 - 各ウェルに適切な量の低血清培地を添加します。
注:24ウェルプレートの場合、ウェルあたり700 μLの培地でバイオプリントコンストラクトを完全に覆う必要があります。必要に応じて調整します。 - プレートをインキュベーターに戻し、3日ごと、または実験計画に従ってサンプルの培地を交換します。
- 所望の硬化時点の24時間前に、サンプルから培地を除去し、2.2 mM滅菌LAPを添加した低血清培地と交換します。
注:構造を蛍光標識するには、10 μMのメタクリロキシエチルチオカルバモイルローダミンB(材料のTを参照)を添加したPBSで3Dバイオプリントコンストラクトを一晩膨潤させ、ステップ7.6の説明に従って硬化させて構造を蛍光標識します。PBSに移し、4°Cで2日間、余分なローダミンを除去し、TRITCフィルターを使用して画像化します(図4B、C)。 - 希望の硬化時間時点で、硬化するウェルからメディアの半分を取り除き、蓋を外した状態でプレートをUVライトの下に置きます。UVライトをオンにし、Omnicure(材料表を参照)と365nmバンドパスフィルター(図3B)を使用して、10 mW/cm2 365 nmの光を5分間照射して、これらの構造を硬化させます。
注意: 細胞をUV光にさらす前に、放射計/光度計を使用して光強度が正しいことを確認してください。 - これらのウェルから残りの培地を取り除き、各ウェルに新鮮な低血清培地を加えます。プレートをインキュベーターに戻します。
- インキュベーターからプレートを取り出し、ステップ9に続く所望の時点で線維芽細胞活性化研究を実施します。
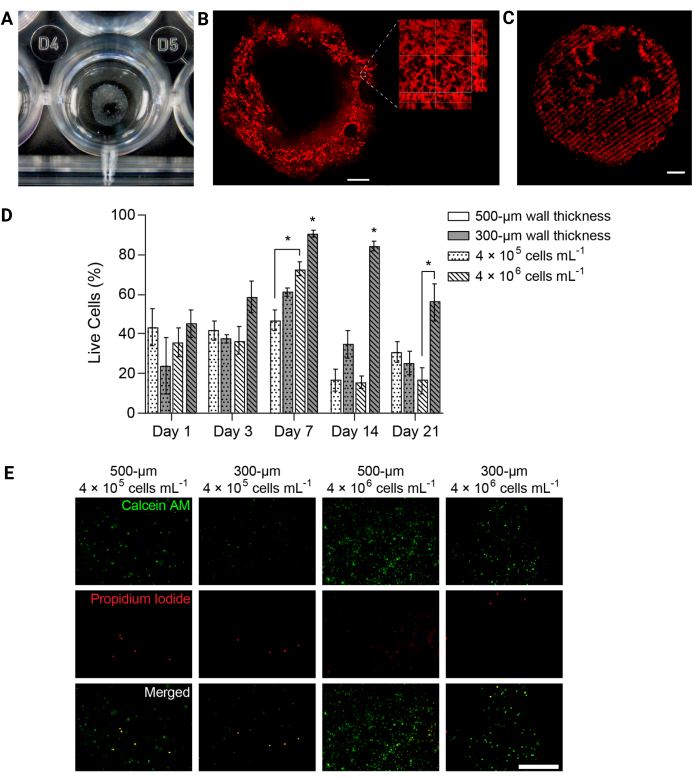
図4:3Dバイオプリントされたハイドロゲル構造は、経時的に細胞の生存率を支えました。 (A)24ウェルプレートに3Dプリントしたハイドロゲル構造の写真。(B)蛍光標識PEGαMA 3Dプリントハイドロゲルの最大強度投影。スケールバー = 1 mm。高倍率顕微鏡では、FRESHバイオプリンティングサポートバス内のゼラチン微粒子によって誘導されるヒドロゲル構造内の細孔が示されました。(C)共焦点顕微鏡で画像化された蛍光標識された硬化領域を含む3DプリントされたPEGαMAチューブ(最大強度投影として表示された100 μm zスタック)は、3Dで硬化の空間制御を示しました。スケールバー = 500 μm。 (D)ライブ/デッドアッセイで測定した3DバイオプリントコンストラクトにおけるHPAAF生存率。厚さ 300 μm で 4 × 106 cells/mL のコンストラクトは、すべての時点で他のすべての条件よりも優れた性能を示しました。生存率は7日目にピークに達しました。この条件と時点は、将来の実験のために選択されました。列はSEM±平均を示し、n = 3です。*, p < 0.05, ANOVA, テューキー HSD.(E)全体的な生存率が最も高い時点である7日目に生/死試薬で染色した3Dコンストラクト中の細胞の代表的な共焦点画像。カルセインAMは生細胞を緑色でマークし、ヨウ化プロピジウムは死細胞を赤色でマークしました。右端の列は、最もパフォーマンスの高い条件で、細胞分布が均一で、生細胞の割合が高いことを示しています。スケールバー = 500 μm。Davis-Hall et al.5の許可を得て転載。 この図の拡大版をご覧になるには、ここをクリックしてください。
8.線維芽細胞の生存率の評価
- 希望の生存率の時点で、カルセインAMおよびヨウ化プロピジウムを使用して染色します( 材料表を参照)。
注:要約すると、培地を各ウェルから取り除き、コンストラクトを滅菌PBSですすぐ必要があります。コンストラクトを生染色/死染色溶液中で、ロッカー上で37°Cで40分間インキュベートします。染色液には、イメージング時に生細胞または死細胞を同定するために、カルセインAM(1:1000希釈)およびヨウ化プロピジウム(1:1000希釈)が含まれている必要があります。 - コンストラクトを滅菌PBSに移し、すぐに共焦点蛍光顕微鏡で画像化します。サンプルごとに3つの異なる100 μmのzスタック画像を取得し、生細胞の平均割合として生存率を発現させます(図4D、E)。
9.線維芽細胞活性化の評価
- 3% w/v ウシ血清アルブミン (BSA) と 0.1% v/v Tween 20 を PBS で調製します。この溶液は、免疫蛍光(IF)溶液と呼ばれます。
- 希望の時点で、サンプルウェルから培地を除去し、コンストラクトをPBSですすぎます。PBSを4%パラホルムアルデヒド(PFA)と交換し、これらのサンプルをロッカー上で37°Cで30分間保持します。次に、4% PFA を PBS 中の 100 mM グリシンと交換し、これらのサンプルを室温(RT)のロッカーにさらに 15 分間放置します。
- 次に、これらのサンプルをTissue-Tekクライオモールドに移し、サンプルを最適切削温度(OCT)溶液( 材料表を参照)で完全に覆い、OCTを4°Cで12〜18時間サンプルに拡散させます。
- OCTに浸したサンプルを液体窒素を用いて2-メチルブタンで急速凍結します。発泡スチロールの箱またはその他の適切な容器に液体窒素を入れ、次に2-メチルブタンで満たされた2番目の容器を液体窒素内に置き、少なくとも半分が水没するようにします。鉗子を使用して、OCTで覆われたサンプルを含む各クライオモールドを、液体窒素で冷却された2-メチルブタン中で目に見えて凍結するまで保持します。これらのサンプルは、凍結解剖の準備が整うまで-80°Cで保存できます。
注意: 液体窒素を取り扱うときは、極低温安全キット( 材料表を参照)に付属の防寒手袋、防寒エプロン、フェイスシールドなどの個人用保護具(PPE)を使用する必要があります。 - 凍結したOCTサンプルを-22°Cで凍結切片し、厚さ10 μmのスライスを正電荷を帯びたガラス顕微鏡スライドに貼り付けます。各3Dハイドロゲルサンプルについて、スライドごとに少なくとも3〜5回のクライオ切片を含む3枚の顕微鏡スライドを準備します。
注:顕微鏡スライドは、必要に応じて停止点として-80°Cでこの時点で保管できます。 - 凍結切片を氷冷アセトンで15分間固定し、凍結切片がスライドに密着するのを助けます。凍結切片をRT水で静かにすすぎ、残っているOCTを取り除きます。これらのサンプルを乾燥させ、疎水性ペンで凍結切片の輪郭を描きます( 材料表を参照)。
- サンプルを室温で 0.2% v/v Triton X-100 in PBS で 10 分間透過処理した後、室温で 5% BSA w/v in PBS で切片を 1 時間ブロックします。
- 初代マウス抗ヒトα平滑筋アクチン(αSMA)抗体(1:250希釈)( 材料表参照)をIF溶液に加えます。これらの切片サンプルを一次抗体とともに4°Cで一晩保管します。 サンプルをIF溶液で3回すすぎます。
- 二次ヤギ抗マウスAlexa Fluor 555抗体(希釈倍率1:250)とActinGreen 488 ReadyProbe( 材料表参照)をIF溶液1ミリリットルあたり2滴含むIF溶液中で切片をインキュベートします。以降のすべてのステップでサンプルをアルミホイルで覆って光から保護し、室温で二次抗体溶液をサンプル上に1時間留置します。
- 切片をIF溶液で3回すすぎます。300 nM 4',6-ジアミジノ-2-フィリンドール(DAPI)中で脱イオン水に15分間インキュベートし、切片を脱イオン水で3回洗浄します。
- 市販の褪色防止剤10 μL( 材料表を参照)を使用して、標準的な方法で切片をカバースリップします。
注:取り付けられたスライドは、イメージングが必要になるまで、-80°Cの冷凍庫で光から保護して保管できます。 - 蛍光顕微鏡を使用してクライオ切片を画像化します(図3C および 図5B)。10倍の対物レンズを使用して、スライドごとに3つのランダムなセクションを画像化します。
注:画像は、DAPI、FITC、およびTRITCチャネルで撮影する必要があります。 - 画像をImageJ(NIH)にアップロードします。線維芽細胞活性化の測定値として、αSMA陽性細胞の総数を各視野の細胞核の総数で割ることにより、αSMA陽性細胞の割合を定量化します(図5A)。
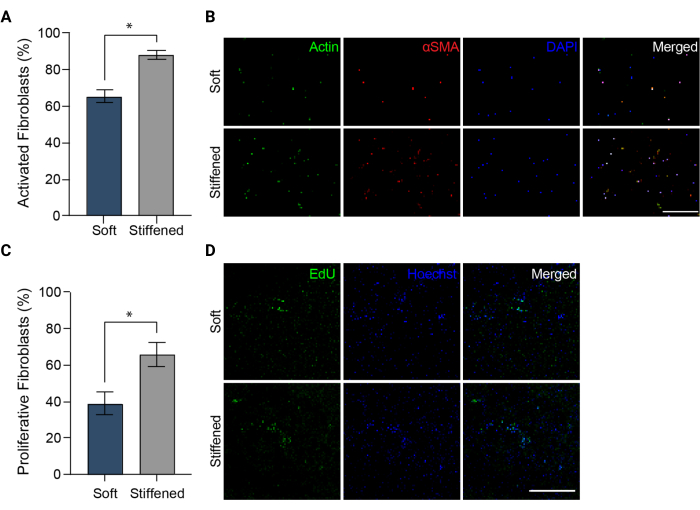
図5:肺動脈外膜の3Dバイオプリントモデルにおける線維芽細胞の活性化。 (A)αSMA発現で測定した軟質および硬化した3Dハイドロゲルの線維化活性化。硬化したコンストラクトのHPAAFは、ソフトコンストラクトの細胞よりもαSMAに対して有意に陽性でした。列はSEM±平均、n = 3を表します。*, p < 0.05, Mann-Whitney U検定。(B)軟質および硬化した3DハイドロゲルにおけるαSMA、アクチン、およびDAPIの免疫染色の代表的な共焦点画像。硬化したコンストラクトのHPAAFは、ソフトコンストラクトの細胞よりも一般的なαSMA免疫蛍光を示しました。スケールバー = 250 μm。 (C)EdU陽性率によって測定された、柔らかく硬化した3Dバイオプリントコンストラクトにおける線維芽細胞の増殖。硬いコンストラクトのHPAAFは、ソフトコンストラクトの細胞よりもEdUに対して有意に陽性でした。列はSEM±平均、n = 3を表します。*, p < 0.05, Mann-Whitney U検定。(D)軟質および硬化した3DハイドロゲルにおけるEdUおよびHoechst色素の免疫染色の代表的な共焦点画像。硬化したコンストラクトのHPAAFは、ソフトコンストラクトの細胞よりもEdU免疫蛍光の蔓延を示しました。スケールバー = 300 μm。Davis-Hall et al.5の許可を得て転載。この図の拡大版をご覧になるには、ここをクリックしてください。
10.線維芽細胞増殖の評価
- 目的の増殖時点の24時間前に、各ウェルから細胞培養培地を取り出し、市販の細胞増殖キットから10 μM EdU溶液を添加した低血清培地と交換します( 材料表を参照)。サンプルをインキュベーターに戻し、一晩インキュベートします。
- 目的の増殖時点で、4% PFA、37°C、30分間、ロッカーでEdUとインキュベートしたサンプルを固定します。4% PFA 溶液を PBS 中の 100 mM グリシンと交換し、サンプルを 37 °C で 15 分以上インキュベートします。ヘキストを適切な濃度で30分間添加し、コンストラクトをPBSで2回すすぎます。
注:サンプルは、イメージングするまで4°Cで光から保護して保存できます。 - 蛍光顕微鏡と細胞増殖キットメーカーの推奨設定およびフィルターを使用して、固定および保存されたすべてのEdUサンプルを画像化します(図3C および 図5D)。サンプルごとに 3 つの異なる 100 μm z スタック画像を取得し、これらの各 z スタックから最大の投影を作成します。HPAAFの増殖を測定するには、EdU陽性細胞の数をカウントし、最大投影画像内でHoechst対比染色で同定した細胞の総数で除算します(図5C)。
結果
このプロトコルは、サポートバス内の光可変ヒドロゲルを3Dバイオプリントして、人間の組織を模倣する形状の線維芽細胞の活性化を研究するための動的および一時的な硬化が可能な構造物を作成する方法について説明します。まず、このプロトコルでは、この光可変ポリマー系のバックボーンであるPEGαMAを合成する方法が説明されました。核磁気共鳴(NMR)分光法測定では、96.5%でPEGαMAの官?...
ディスカッション
制御された光照射に応答する二段重合反応は、空間的および時間的制御によって生体材料を硬化させることができます。いくつかの研究では、この手法を利用して、さまざまなプラットフォーム5、8、9、10、11、21、22、
開示事項
著者らには、開示すべき利益相反はありません。この原稿の一部は、IOP Publishing https://doi.org/10.1088/1758-5090/aca8cf の©許可を得て転載しています。5 無断転載を禁じます。
謝辞
著者らは、Adam Feinberg博士(カーネギーメロン大学)と3Dバイオプリンティングオープンソースワークショップを主催した人々に感謝の意を表したいと思います。これらの人々は、FRESHバイオプリンティングの技術を学び、これらの研究に使用される3Dバイオプリンターを構築することを可能にしました。さらに、著者らは、この原稿の図を作成するために使用された Biorender.com に感謝したいと思います。この研究は、ローズコミュニティ財団(DDHおよびCMM)、コロラド肺血管疾患研究賞(DDHおよびCMM)、全米科学財団賞1941401(CMM)、陸軍省賞W81XWH-20-1-0037(CMM)、米国国立がん研究所(NIH賞R21 CA252172(CMM)など、複数のグループまたは資金源によって支援されました。 コロラド大学アンシュッツメディカルキャンパスのルードマンファミリーセンター(DDHおよびCMM)、国立衛生研究所の国立心臓、肺、血液研究所(R01 HL080396(CMM)、R01 HL153096(CMM)、F31 HL151122(DDH)、およびT32 HL072738(DDHおよびAT)の賞。
資料
| Name | Company | Catalog Number | Comments |
| AccuMax Radiometer/Photometer Kit | Spectronics Corporation | XPR-3000 | To measure light intensity, used for photostiffening |
| Acetic Acid | Fisher Scientific | BP2401-500 | Used during PEGaMA synthesis |
| Acetone | Fisher Scientific | A184 | Used with the cryosections |
| ActinGreen 488 ReadyProbes | Fisher Scientific | R37110 | Used for staining |
| Aluminum Foil | Reynolds | F28028 | |
| Anhydrous Tetrahydrofuran (THF) | Sigma-Aldrich | 401757-1L | Used during PEGaMA synthesis |
| Argon Compressed Gas | Airgas | AR R300 | Used during PEGaMA synthesis |
| 8 Arm Poly(ethylene glycol)-hydroxyl (PEG-OH) | JenKem Technology | 8ARM-PEG-10K | Used during PEGaMA synthesis |
| 365 nm Bandpass Filter | Edmund Optics | 65-191 | Used for photostiffening |
| Bovine Serum Albumin (BSA) | Fisher Scientific | BP9700-100 | Used during staining process |
| Buchner Funnel | Quark Glass | QFN-8-14 | Used during PEGaMA synthesis |
| Calcein AM | Invitrogen | 65-0853-39 | Used during staining process |
| Celite 545 (Filtration Aid) | EMD Millipore | CX0574-1 | Used during PEGaMA synthesis |
| Charged Microscope Slides | Globe Scientific | 1358W | |
| Chloroform-d | Sigma-Aldrich | 151823-10X0.75ML | Used to characterize PEGaMA |
| Click-iT Plus EdU Cell Proliferation Kit | Invitrogen | C10637 | Used for staining |
| 50 mL Conical Tubes | CELLTREAT | 667050B | |
| Cryogenic Safety Kit | Cole-Parmer | EW-25000-85 | |
| Cryostat | Leica | CM 1850-3-1 | |
| Dialysis Tubing | Repligen | 132105 | |
| 4’,6-Diamidino-2-Phylindole (DAPI) | Sigma-Aldrich | D9542-1MG | Used for staining |
| Diethyl Ether | Fisher Scientific | E1384 | Used during PEGaMA synthesis |
| 1,4-Dithiothreitol (DTT) | Sigma-Aldrich | 10197777001 | Bioink component |
| Dulbecco's Modified Eagle's Medium (DMEM) | Cytiva | SH30271.FS | |
| Filter Paper | Whatman | 1001-090 | Used during PEGaMA synthesis |
| Freezone 2.5L Freeze Dry System | Labconco | LA-2.5LR | Lyophilizer |
| Fusion 360 | Autodesk | N/A | Software download |
| 2.5 mL Gastight Syringe | Hamilton | 81420 | Used for bioprinting |
| 15 Gauge 1.5" IT Series Tip | Jensen Global | JG15-1.5X | Used for bioprinting |
| 30 Gauge 0.5" HP Series Tip | Jensen Global | JG30-0.5HPX | Used for bioprinting |
| Goat Anti-Mouse Alexa Fluor 555 Antibody | Fisher Scientific | A21422 | Used for staining |
| Glycine | Fisher Scientific | C2H5NO2 | Used during staining process |
| Hemocytometer | Fisher Scientific | 1461 | |
| Hoechst | Thermo Scientific | 62249 | Used during staining process |
| Human Pulmonary Artery Adventitial Fibroblasts (HPAAFs) | AcceGen | ABC-TC3773 | From a 2-year-old male patient |
| Hydrochloric Acid (HCl) | Fisher Scientific | A144-500 | Used to pH adjust solutions |
| ImageJ | National Institutes of Health (NIH) | N/A | Free software download |
| ImmEdge® Pen | Vector Laboratories | H-4000 | Used during staining process |
| Incubator | VWR | VWR51014991 | |
| LifeSupport Gelatin Microparticle Slurry (Gelatin Slurry) | Advanced Biomatrix | 5244-10GM | Used for bioprinting |
| Light Microscope | Olympus | CKX53 | Inverted light microscope |
| Lithium Phenyl-2,4,6-Trimethylbenzoylphosphinate (LAP) | Sigma-Aldrich | 900889-5G | Photoinitiator used for photostiffening |
| Liquid Nitrogen | N/A | N/A | |
| LulzBot Mini 2 | LulzBot | N/A | Bioprinter adapted |
| Methacryloxyethyl Thiocarbamoyl Rhodamine B | Polysciences Inc. | 669775-30-8 | |
| 2-Methylbutane | Sigma-Aldrich | M32631-4L | |
| Microman Capillary Pistons CP1000 | VWR | 76178-166 | Positive displacement pipette tips |
| MMP2 Degradable Crosslinker (KCGGPQGIWGQGCK) | GL Biochem | N/A | Bioink component |
| Mouse Anti-Human αSMA Monoclonal Antibody | Fisher Scientific | MA5-11547 | Used for staining |
| OmniCure Series 2000 | Lumen Dynamics | S2000-XLA | UV light source used for photostiffening |
| Paraformaldehyde (PFA) | Electron Microscopy Sciences | 15710 | Used to fix samples |
| pH Meter | Mettler Toledo | FP20 | |
| pH Strips | Cytiva | 10362010 | |
| Phosphate Buffered Saline (PBS) | Hyclone Laboratories, Inc. | Cytiva SH30256.FS | |
| Pipette Set | Fisher Scientific | 14-388-100 | |
| 10 µL Pipette Tips | USA Scientific | 1120-3710 | |
| 20 µL Pipette Tips | USA Scientific | 1183-1510 | |
| 200 µL Pipette Tips | USA Scientific | 1111-0700 | |
| 1000 µL Pipette Tips | USA Scientific | 1111-2721 | |
| Poly(Ethylene Glycol)-Alpha Methacrylate (PEGαMA) | N/A | N/A | Refer to manuscript for synthesis steps |
| Poly(Ethylene Oxide) (PEO) | Sigma-Aldrich | 372773-250G | Bioink component |
| Positive Displacement Pipette | Fisher Scientific | FD10004G | 100-1000 µL |
| Potassium Hydroxide (KOH) | Sigma-Aldrich | 221473-500G | Used to pH adjust solutions |
| ProLong Gold Antifade Reagent | Invitrogen | P36930 | Used during staining process |
| Pronterface | All3DP | N/A | Software download |
| Propidium Iodide | Sigma-Aldrich | P4864-10ML | Used for staining |
| RGD Peptide (CGRGDS) | GL Biochem | N/A | Bioink component |
| Rocker | VWR | 10127-876 | |
| Rotary Evaporator | Thomas Scientific | 11100V2022 | Used during PEGaMA synthesis |
| Rubber Band | Staples | 808659 | |
| Schlenk Flask | Kemtech America | F902450 | Used during PEGaMA synthesis |
| Slic3r | Slic3r | N/A | Software download |
| Smooth Muscle Cell Growth Medium-2 (SmGM-2) BulletKit | Lonza | CC-3182 | Kit contains CC-3181 and CC-4149 components |
| Sodium Hydride | Sigma-Aldrich | 223441-50G | Used during PEGaMA synthesis |
| Sorvall ST 40R Centrifuge | Fisher Scientific | 75-004-525 | |
| Stir Bar | VWR | 58948-091 | |
| Syringe Filter | VWR | 28145-483 | Used to sterile filter solutions |
| T-75 Tissue-Cultured Treated Flask | VWR | 82050-856 | Used for cell culture work |
| Tissue-Tek Cyromold | Sakura | 4557 | |
| Tissue-Tek O.C.T Compound (OCT) | Sakura | 4583 | |
| Tris(2-Carboxyethyl) Phosphine (TCEP) | Sigma-Aldrich | C4706-2G | |
| Triton X-100 | Fisher Bioreagents | C34H622O11 | Used during staining process |
| Trypan Blue | Sigma-Aldrich | T8154-20ML | Used for cell culture work |
| 0.05% Trypsin-EDTA | Gibco | 25-300-062 | Used for cell culture work |
| Tween 20 | Fisher Bioreagents | C58H114O26 | Used during staining process |
| Upright Microscope | Olympus | BX63F | Fluorescent microscope capabilities |
| Water Bath | PolyScience | WBE20A11B | |
| 24-Well Tissue Culture Plates | Corning | 3527 |
参考文献
- Ahrens, J. H., et al. Programming cellular alignment in engineered cardiac tissue via bioprinting anisotropic organ building blocks. Advanced Materials. 34 (26), e2200217 (2022).
- Lin, N. Y. C., et al. Renal reabsorption in 3D vascularized proximal tubule models. Proceedings of the National Academy of Sciences of the United States of America. 116 (12), 5399-5404 (2019).
- Grigoryan, B., et al. Multivascular networks and functional intravascular topologies within biocompatible hydrogels. Science. 364 (6439), 458-464 (2019).
- Kang, Y., Datta, P., Shanmughapriya, S., Ozbolat, I. T. 3D bioprinting of tumor models for cancer research. ACS Applied Biomaterials. 3 (9), 5552-5573 (2020).
- Davis-Hall, D., Thomas, E., Pena, B., Magin, C. M. 3D-bioprinted, phototunable hydrogel models for studying adventitial fibroblast activation in pulmonary arterial hypertension. Biofabrication. 15 (1), (2022).
- Mirdamadi, E., Tashman, J. W., Shiwarski, D. J., Palchesko, R. N., Feinberg, A. W. FRESH 3D bioprinting of a full-size model of the human heart. ACS Biomaterials Science & Engineering. 6 (11), 6453-6459 (2020).
- Shiwarski, D. J., Hudson, A. R., Tashman, J. W., Feinberg, A. W. Emergence of FRESH 3D printing as a platform for advanced tissue biofabrication. APL Bioengineering. 5 (1), 010904 (2021).
- Petrou, C. L., et al. Clickable decellularized extracellular matrix as a new tool for building hybrid hydrogels to model chronic fibrotic diseases in vitro. Journal of Materials Chemistry B. 8 (31), 6814-6826 (2020).
- Hewawasam, R. S., Blomberg, R., Serbedzija, P., Magin, C. M. Chemical modification of human decellularized extracellular matrix for incorporation into phototunable hybrid hydrogel models of tissue fibrosis. ACS Applied Materials & Interfaces. 15 (12), 15071-15083 (2023).
- Saleh, K. S., et al. Engineering hybrid hydrogels comprised healthy or diseased decellularized extracellular matrix to study pulmonary fibrosis. Cellular and Molecular Bioengineering. 15 (5), 505-519 (2022).
- Guvendiren, M., Burdick, J. A. Stiffening hydrogels to probe short- and long-term cellular responses to dynamic mechanics. Nature Communications. 3, 792 (2012).
- Rosales, A. M., Vega, S. L., DelRio, F. W., Burdick, J. A., Anseth, K. S. Hydrogels with reversible mechanics to probe dynamic cell microenvironments. Angewandte Chemie International Edition English. 56 (40), 12132-12136 (2017).
- Wynn, T. A., Ramalingam, T. R. Mechanisms of fibrosis: therapeutic translation for fibrotic disease. Nature Medicine. 18 (7), 1028-1040 (2012).
- Huertas, A., Tu, L., Humbert, M., Guignabert, C. Chronic inflammation within the vascular wall in pulmonary arterial hypertension: more than a spectator. Cardiovascular Research. 116 (5), 885-893 (2020).
- Kendall, R. T., Feghali-Bostwick, C. A. Fibroblasts in fibrosis: novel roles and mediators. Frontiers in Pharmacology. 5, 123 (2014).
- Parker, M. W., et al. Fibrotic extracellular matrix activates a profibrotic positive feedback loop. The Journal of Clinical Investigation. 124 (4), 1622-1635 (2014).
- Habiel, D. M., Hogaboam, C. Heterogeneity in fibroblast proliferation and survival in idiopathic pulmonary fibrosis. Frontiers in Pharmacology. 5, 2 (2014).
- Hu, C. J., Zhang, H., Laux, A., Pullamsetti, S. S., Stenmark, K. R. Mechanisms contributing to persistently activated cell phenotypes in pulmonary hypertension. The Journal of Physiology. 597 (4), 1103-1119 (2019).
- Li, M., et al. Emergence of fibroblasts with a proinflammatory epigenetically altered phenotype in severe hypoxic pulmonary hypertension. The Journal of Immunology. 187 (5), 2711-2722 (2011).
- Hinton, T. J., et al. Three-dimensional printing of complex biological structures by freeform-reversible embedding of suspended hydrogels. Science Advances. 1 (9), e1500758 (2015).
- Brown, T. E., et al. Secondary photocrosslinking of click hydrogels to probe myoblast mechanotransduction in three dimensions. Journal of the American Chemical Society. 140 (37), 11585-11588 (2018).
- Ondeck, M. G., et al. Dynamically stiffened matrix promotes malignant transformation of mammary epithelial cells via collective mechanical signaling. Proceedings of the National Academy of Sciences of the United States of America. 116 (9), 3502-3507 (2019).
- Caliari, S. R., et al. Stiffening hydrogels for investigating the dynamics of hepatic stellate cell mechanotransduction during myofibroblast activation. Scientific Reports. 6, 21387 (2016).
- Liu, F., et al. Feedback amplification of fibrosis through matrix stiffening and COX-2 suppression. Journal of Cell Biology. 190 (4), 693-706 (2010).
- Tschumperlin, D. J., Ligresti, G., Hilscher, M. B., Shah, V. H. Mechanosensing and fibrosis. The Journal of Clinical Investigation. 128 (1), 74-84 (2018).
- Chelladurai, P., Seeger, W., Pullamsetti, S. S. Matrix metalloproteinases and their inhibitors in pulmonary hypertension. European Respiratory Journal. 40 (3), 766-782 (2012).
- Caracena, T., et al. Alveolar epithelial cells and microenvironmental stiffness synergistically drive fibroblast activation in three-dimensional hydrogel lung models. Biomaterials Science. 10 (24), 7133-7148 (2022).
- Ruskowitz, E. R., DeForest, C. A. Proteome-wide analysis of cellular response to ultraviolet light for biomaterial synthesis and modification. ACS Biomaterials Science & Engineering. 5 (5), 2111-2116 (2019).
- Kruse, C. R., et al. The effect of pH on cell viability, cell migration, cell proliferation, wound closure, and wound reepithelialization: In vitro and in vivo study. Wound Repair and Regeneration. 25 (2), 260-269 (2017).
- Filippi, M., et al. Perfusable biohybrid designs for bioprinted skeletal muscle tissue. Advanced Healthcare Materials. , e1500758 (2023).
- Matthiesen, I., et al. Astrocyte 3D culture and bioprinting using peptide-functionalized hyaluronan hydrogels. Science and Technology of Advanced Materials. 24 (1), 2165871 (2023).
- Xu, L., et al. Bioprinting a skin patch with dual-crosslinked gelatin (GelMA) and silk fibroin (SilMA): An approach to accelerating cutaneous wound healing. Materials Today Bio. 18, 100550 (2023).
- Bliley, J. M., Shiwarski, D. J., Feinberg, A. W. 3D-bioprinted human tissue and the path toward clinical translation. Science Translational Medicine. 14 (666), eabo7047 (2022).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved