Zum Anzeigen dieser Inhalte ist ein JoVE-Abonnement erforderlich. Melden Sie sich an oder starten Sie Ihre kostenlose Testversion.
Method Article
3D-Bioprinting von phototunbaren Hydrogelen zur Untersuchung der Fibroblastenaktivierung
In diesem Artikel
Zusammenfassung
In diesem Artikel wird beschrieben, wie phototunbare Hydrogele in 3D biogedruckt werden, um die Versteifung der extrazellulären Matrix und die Aktivierung von Fibroblasten zu untersuchen.
Zusammenfassung
Phototunbare Hydrogele können sich als Reaktion auf Lichteinwirkung räumlich und zeitlich verändern. Die Integration dieser Art von Biomaterialien in Zellkulturplattformen und das dynamische Auslösen von Veränderungen, wie z. B. die Erhöhung der Steifigkeit der Mikroumgebung, ermöglicht es den Forschern, Veränderungen in der extrazellulären Matrix (EZM) zu modellieren, die während des Fortschreitens der fibrotischen Erkrankung auftreten. Hierin wird ein Verfahren zum 3D-Bioprinting eines phototunbaren Hydrogel-Biomaterials vorgestellt, das in der Lage ist, zwei aufeinanderfolgende Polymerisationsreaktionen innerhalb eines Gelatineträgerbades durchzuführen. Die Technik des FRESH-Bioprintings (Freeform Reversible Embedding of Suspended Hydrogels) wurde angepasst, indem der pH-Wert des Stützbades angepasst wurde, um eine Michael-Additionsreaktion zu ermöglichen. Zunächst wurde die Biotinte, die Poly(ethylenglykol)-alphamethacrylat (PEGαMA) enthielt, außerhalb der Stöchiometrie mit einem zellabbaubaren Vernetzer umgesetzt, um weiche Hydrogele zu bilden. Diese weichen Hydrogele wurden später Photoinitator und Licht ausgesetzt, um die Homopolymerisation nicht umgesetzter Gruppen zu induzieren und das Hydrogel zu versteifen. Dieses Protokoll umfasst die Hydrogelsynthese, das 3D-Bioprinting, die Photoversteifung und die Charakterisierung von Endpunkten zur Beurteilung der Fibroblastenaktivierung in 3D-Strukturen. Die hier vorgestellte Methode ermöglicht es Forschern, eine Vielzahl von Materialien, die pH-katalysierten Polymerisationsreaktionen durchlaufen, in 3D zu drucken und könnten zur Entwicklung verschiedener Modelle der Gewebehomöostase, -krankheit und -reparatur eingesetzt werden.
Einleitung
3D-Bioprinting ist eine transformative Technologie, die es Forschern ermöglicht, Zellen und Biomaterialien präzise in 3D-Volumina abzulegen und die komplexe hierarchische Struktur biologischer Gewebe nachzubilden. In den letzten zehn Jahren haben Fortschritte im 3D-Bioprinting schlagendes menschliches Herzgewebe1, Funktionsmodelle von Nierengewebe2, Modelle des Gasaustauschs in der Lunge3 und Tumormodelle für die Krebsforschung4 hervorgebracht. Die Erfindung eingebetteter 3D-Bioprinting-Techniken, wie z. B. das Freeform Reversible Embedding of Suspended Hydrogel (FRESH) Bioprinting, hat es ermöglicht, komplexe Weichteilstrukturen wie Lungenblutgefäße5 und sogar das menschliche Herz6 in 3D zu reproduzieren. Der FRESH 3D-Biodruck ermöglicht den schichtweisen Druck von weichen und niedrigviskosen Biotinten durch Extrusion in ein scherverdünnendes Stützbad. Das Trägerbad besteht aus einem Material, wie z. B. dicht gepackten Gelatine-Mikropartikeln, die als Bingham-Kunststoff fungieren und die beabsichtigte Form und Struktur der Biotinte nach dem Druck beibehalten. Sobald das gedruckte Konstrukt erstarrt ist, kann das Stützbad durch Erhöhung der Temperatur auf 37 °Cweggelöst werden 7.
In einem kürzlich erschienenen Übersichtsartikel wurden die Materialien zusammengefasst, die in verschiedenen Publikationen mit der FRESH-Technik in 3D biogedruckt wurden. Diese natürlich gewonnenen Materialien reichen von Kollagen Typ I bis hin zu methacrylierter Hyaluronsäure und repräsentieren verschiedene Gelierungsmechanismen7. Die meisten Forschungsstudien, die mit dieser 3D-Bioprinting-Technik durchgeführt werden, verwenden statische Biomaterialien, die sich als Reaktion auf äußere Reize nicht verändern. Dynamische, phototunbare Hydrogel-Biomaterialien wurden von unserem Labor und anderen 8,9,10,11,12 verwendet, um eine Vielzahl von fibrotischen Erkrankungen zu modellieren. Im Gegensatz zu statischen Biomaterialien ermöglichen phototunable Biotinten die Erstellung eines weichgezeichneten Modells mit niedrigerem Elastizitätsmodulwert und späterer Versteifung, um zelluläre Reaktionen auf eine Zunahme der Versteifung der Mikroumgebung zu untersuchen.
Fibrotische Erkrankungen sind gekennzeichnet durch eine Zunahme der Produktion der extrazellulären Matrix, die zu Narbenbildung und Versteifung führen kann13. Eine Versteifung des Gewebes kann weitere Verletzungen und Zerstörungen des betroffenen Gewebes auslösen, was zu dauerhaften Organschäden und sogar zum Tod führen kann. Fibrotische Erkrankungen sind weltweit für ein Drittel der Sterblichkeit verantwortlich. Fibroblasten produzieren in diesem Krankheitszustand überschüssige und abnorme extrazelluläre Matrix14,15. Erhöhte Fibroblastenproliferation und extrazelluläre Matrixablagerung versteifen das Gewebe weiter und aktivieren eine profibrotische positive Rückkopplungsschleife16,17,18,19. Die Untersuchung der Aktivierung von Fibroblasten ist für das Verständnis fibrotischer Erkrankungen von entscheidender Bedeutung. Hier stellen wir die humane pulmonale arterielle Hypertonie (PAH) als Beispiel für eine fibrotische Erkrankung vor, bei der es wichtig ist, die 3D-Geometrie des Blutgefäßes mittels 3D-Bioprinting nachzuahmen und die dynamischen Versteifungsfähigkeiten von phototunbaren Hydrogelen vorzustellen. PAH ist eine Erkrankung, bei der der Druck in den Hauptpulmonalarterien über das normale Niveau hinausgeht und das Herz belastet, wodurch die Aktivierung der adventitialen Fibroblasten der menschlichen Lungenarterie (HPAAF) erhöht und das Blutgefäßgewebe versteiftwird 16,17,18,19. Eine phototunbare Poly(ethylenglykol)-alpha-methacrylat (PEGαMA)-Biotintenformulierung ermöglicht eine zeitliche Versteifung in Konstrukten und hilft bei der Modellierung von gesundem Gewebe und dem Fortschreiten der Krankheit 5,8,9,10. Die Ausnutzung dieser einzigartigen Eigenschaft ermöglicht die Quantifizierung der HPAAF-Aktivierung und -Proliferation als Reaktion auf die Versteifung der Mikroumgebung in 3D und könnte wertvolle Einblicke in die zellulären Mechanismen liefern, die an dieser Krankheit beteiligt sind. Das hier beschriebene Protokoll wird es den Forschern ermöglichen, 3D-Modelle zu erstellen, die Veränderungen in der extrazellulären Mikroumgebung während des Fortschreitens der Krankheit oder der Gewebereparatur rekapitulieren und die Aktivierung von Fibroblasten untersuchen.
Protokoll
1. PEGαMA-Synthese und -Charakterisierung
ANMERKUNG: Die Synthese von Poly(ethylenglykol)-alphamethacrylat (PEGαMA) wurde von Hewawasam et al . übernommen und unter feuchtigkeitsfreien Bedingungen durchgeführt9.
- Wiegen Sie die Reaktanten.
HINWEIS: Wiegen Sie z. B. 5 g 10 kg/mol 8-armiges PEG-Hydroxyl (PEG-OH) und 0,38 g Natriumhydrid (NaH) ab (siehe Materialtabelle). - Einen Rührstab in den 250-ml-Schlenk-Kolben geben und mit Argon reinigen.
- Das PEG-OH wird in dem niedrigsten Volumen des wasserfreien Tetrahydrofurans (THF) gelöst, das für die Auflösung im Schlenkkolben erforderlich ist.
HINWEIS: Etwa 80 ml THF lösen 5 g PEG-OH auf. Fügen Sie die minimale Menge THF hinzu, die erforderlich ist, um das PEG-OH aufzulösen. - Man gibt 3-mal molaren NaH-Überschuss zur Reaktionsmischung und rührt bei Raumtemperatur (RT) 30 min.
- 6-fach molaren Überschuss Ethyl-2-(Brommethyl)acrylat (EBrMA, siehe Materialtabelle) tropfenweise in den Schlenkkolben geben und das Reaktionsgefäß lichtgeschützt mit Aluminiumfolie abdecken. Die Reaktion wird bei Raumtemperatur für ca. 48 h gerührt.
HINWEIS: Für 5 g PEG-OH und 0,38 g NaH verwenden Sie 3,68 ml EBrMA für diese Reaktion. - Fügen Sie einige Tropfen 1 N Essigsäure hinzu, um die Reaktion zu unterdrücken. Vakuumfiltrieren Sie die Lösung durch ein Filtrationshilfsmittel.
HINWEIS: Durch die Zugabe von Essigsäure entstehen Gasblasen. Hören Sie auf, Essigsäuretropfen hinzuzufügen, wenn sich keine Blasen mehr bilden, da dies darauf hinweist, dass die Mischung erfolgreich abgeschreckt wurde. - Das Filtrat wird auf einem Rotationsverdampfer konzentriert und in 4 °C Diethylether ausgefällt. Niederschlag lichtgeschützt bei 4 °C 12-18 h stehen lassen.
- Fügen Sie ein Whatman-Filterpapier zu einem Buchner-Trichter hinzu. Gießen Sie das Reaktionsgemisch langsam über das Filterpapier und trennen Sie den Niederschlag durch Vakuumabsaugung vom Diethylether. Der Niederschlag wird in einem trockenen und sauberen Filterkolben aufgefangen.
- Trocknen Sie das Produkt mindestens 5 Stunden oder über Nacht bei Raumtemperatur und lösen Sie es in der erforderlichen Mindestmenge an deionisiertem Wasser auf. Das gelöste Produkt wird in einen Dialyseschlauch (siehe Materialtabelle) überführt und mindestens vier Tage lang gegen 3,5 l deionisiertes Wasser dialysiert. Wechseln Sie das Dialysewasser alle 12 Stunden.
HINWEIS: Das Produkt erscheint nach der Vakuumtrocknung als vollständig trockenes, reinweißes festes Pulver. - Das Produkt schockgefrieren und ca. 72 h lang gefrieren, bis es vollständig getrocknet ist.
- Das Produkt wird in Chloroform D (CDCl3) gelöst. Führen Sie die Probe mit einer 1-Stunden-NMR mit einem Protokoll durch, das 248 Scans mit einerRelaxationszeit von 2,5 s durchführt.
- Überprüfen Sie die Funktionalisierung und Reinheit des Produkts, indem Sie denCDCl 3-Lösungsmittelpeak auf 7,26 ppm kalibrieren. Integrieren Sie den Peak für PEG-Backbone-Protonen (d3.71) und kalibrieren Sie die Integration auf 114.
- Integrieren Sie die restlichen Peaks: PEGαMA 1 H NMR (300 MHz, CDCl 3): d (ppm) 1,36(t, 3H, CH 3-),3,71 (s, 114H, PEG CH 2-CH 2), 4,29 (t, s, 4H, -CH 2-C(O)-O-O, -O-CH 2-C(=CH 2)-), 5,93 (q, 1H, -C=CH 2), 6,34 (q, 1H, -C=CH 2) und vergleichen Sie die Integration für die αMA-Alken-Endgruppen-Peaks mit dem Erwartungswert (1H) basierend auf der PEG-Backbone-Kalibrierung (Abbildung 1).
HINWEIS: Mitteln Sie die beiden als "a" gekennzeichneten Peaks (Abbildung 1) und multiplizieren Sie sie mit 100, um den durchschnittlichen Prozentsatz der PEGαMA-Funktionalisierung zu erhalten.
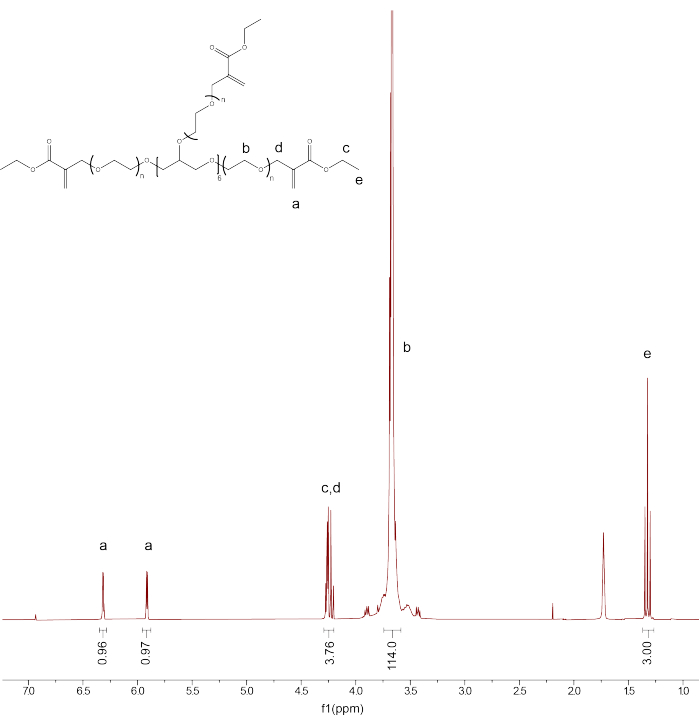
Abbildung 1: Die Protonen-NMR bestätigte die erfolgreiche PEGαMA-Funktionalisierung. Die NMR-Analyse wurde in Chloroform-D (CDCl3) durchgeführt und zeigte eine Funktionalisierung von 96,5%. PEGαMA 1 H NMR (300 MHz, CDCl3): d (ppm) 1,36(t, 3H, CH 3-),3,71 (s, 114H, PEG CH 2-CH 2), 4,29 (t, s, 4H, -CH 2-C(O)-O-O, -O-CH 2-C(=CH 2)-), 5,93 (q, 1H, -C=CH 2), 6,34 (q, 1H, -C=CH 2). Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
2. Modelldesign und Einrichtung des 3D-Biodruckers
HINWEIS: Ein handelsüblicher 3D-Drucker (siehe Materialtabelle) wurde modifiziert, indem der thermoplastische Extruder durch einen speziell angefertigten Spritzenpumpenextruder ersetzt und von Hinton et al.20 übernommen wurde. Open-Source-Designs sind online verfügbar: https://3d.nih.gov/users/awfeinberg.
- Öffnen Sie die Fusion 360-Software (siehe Materialtabelle) und erstellen Sie eine computergestützte 3D-Hohlzylinderkonstruktion.
HINWEIS: Eine herunterladbare Datei, die für diesen Schritt verwendet werden kann und die Geometrie der Blutgefäße nachahmt, finden Sie in der Zusatzdatei 1. - Speichern Sie die Datei und öffnen Sie sie in der Slic3r-Software (siehe Materialtabelle). Vergewissern Sie sich, dass alle Parameter wie gewünscht sind, und drücken Sie dann die Schaltfläche zum Exportieren von G-Code. Speichern Sie den G-Code auf dem Computer.
- Öffnen Sie die Pronterface-Software (siehe Materialtabelle) und laden Sie die G-Code-Datei hoch.
HINWEIS: Die Pronterface-Software ist mit dem Bioprinter verbunden und bietet eine ausreichende Hardware-Eingabesteuerung. Eine brauchbare G-Code-Datei finden Sie in der Ergänzungsdatei 2. - Übertragen Sie den Bioprinter und alle zugehörigen Teile mit aseptischen Techniken in eine Biosicherheitswerkbank (BSC).
- Montieren Sie eine 30 g 0,5" lange stumpfe Nadelspitze (siehe Materialtabelle) an der Druckglasspritze und legen Sie sie beiseite.
- Stecken Sie das Netzkabel des Bioprinters in eine Steckdose. Drücken Sie den roten Netzschalter an der Vorderseite des Bioprinters, um ihn einzuschalten. Schließen Sie das USB-Kabel (Universal Serial Bus) zwischen dem Computer und dem Biodrucker an und stellen Sie sicher, dass alle Kabelverbindungen hergestellt und eingesteckt sind.
3. Vorbereitung des Stützbades und der Reagenzien
HINWEIS: Führen Sie alle Schritte in einer Biosicherheitswerkbank mit aseptischen Techniken durch.
- Bereiten Sie ein Zellkulturmedium bestehend aus SmBM-Basalmedium (CC-3181) und SmGM-2 SingleQuots-Ergänzungen (CC-4149), ausgenommen fötales Kälberserum (FBS), gemäß den Anweisungen des Herstellers vor. Bis zur Verwendung bei 4 °C lagern.
- Aliquotieren Sie 50 ml des Zellkulturmediums und fügen Sie 1 % v/v FBS (CC-4149) hinzu (siehe Materialtabelle), um ein Medium mit niedrigem Serumgehalt herzustellen. Bis zur Verwendung bei 4 °C lagern.
- Resuspendieren Sie das Gelatineaufschlämmungspulver gemäß den Anweisungen des Herstellers mit sterilen Zellkulturmedien ohne FBS als Lösungsmittel (siehe Materialtabelle). Unmittelbar vor Gebrauch den endgültigen pH-Wert der Gelatineaufschlämmung mit 2 M Kaliumhydroxid (KOH) und/oder 2 M Salzsäure (HCl) auf pH 9 einstellen, um den pH-Wert der Lösung mit einem pH-Messgerät nach Bedarf anzupassen.
- Füllen Sie die gewünschte Anzahl von Vertiefungen einer 24-Well-Platte, von denen jede etwa zur Hälfte gefüllt ist, mit 1 ml Gelatineaufschlämmung pro Well, indem Sie eine Spritze ohne Nadel verwenden.
HINWEIS: Füllen Sie die Mitte der Vertiefungen gleichmäßig aus und vergewissern Sie sich, dass keine Lufteinschlüsse vorhanden sind. Klopfen Sie auf die Platte, um die Mikropartikelaufschlämmung gleichmäßig zu verteilen. Passen Sie die Höhe und das Volumen der Aufschlämmung pro Vertiefung nach Bedarf an, um sie an jede Bioprint-Größe und -Form anzupassen. Benutzer können eine selbstgemachte Spritze herstellen, um die Gelatineaufschlämmung in jede Vertiefung zu übertragen. Dies kann erreicht werden, indem ein richtig dimensionierter Spritzenkolben in ein 50-ml-Reagenzglas gegeben wird, das bereits die verdichtete Gelatineaufschlämmung am Boden enthält. Führen Sie beim Einsetzen des Kolbens einen kleinen Führungsdraht neben das Reagenzglas ein, damit die Luft entweichen kann, und entfernen Sie ihn dann, wenn der Kolben mit der Gelatineaufschlämmung in Kontakt kommt. Unmittelbar vor Gebrauch die Spitze des Reagenzglases mit einer Rasierklinge abschneiden, um ein Loch zu schaffen, aus dem die Gelatineaufschlämmung herausragen und auf den Kolben drücken kann. - Platzieren Sie die gefüllte 24-Well-Platte in der Mitte des Bioprinter-Tisches und befestigen Sie sie am Tisch.
HINWEIS: Abbildung 2 zeigt ein generisches Bioprinter-Setup. Legen Sie ein Gummiband um den Drucktisch, um eine 24-Well-Platte an der Plattform zu befestigen und ein Verrutschen zu verhindern.

Abbildung 2: Grundlegender Aufbau des 3D-Bioprintings. Der Biodrucker wurde in einer sterilen Umgebung, wie z. B. einer Biosicherheitswerkbank, aufgestellt, und der Druckkopf wurde so montiert, dass die Glasspritze und die Nadel vertikal in den darunter liegenden Druckbereich des Stützbades abgesenkt wurden. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
4. Zellkultur
HINWEIS: Führen Sie alle Schritte in einer Biosicherheitswerkbank mit aseptischen Techniken durch.
- HPAAF-Zellen (kommerziell erhältlich, siehe Materialtabelle) auftauen und in T-75-Gewebekultur-behandelten Kunststoffkolben expandieren, die SmBM-Basalmedium (CC-3181) und alle SmGM-2 SingleQuots-Ergänzungen (CC-4149) gemäß den Anweisungen des Herstellers enthalten (siehe Materialtabelle).
HINWEIS: Es sollten Standard-Zellkulturprotokolle für adhärente Zellen verwendet werden, wobei die Zellen bei 37 °C und 5 % CO2 gehalten und die Medien alle paar Tage aufgefüllt werden sollten. - Sobald die HPAAFs ~80-90% Konfluenz erreicht haben, saugen Sie das Medium an und spülen Sie die Zellen einmal mit phosphatgepufferter Kochsalzlösung (PBS).
- Etwa 4 ml vorgewärmtes 0,05%iges Trypsin-EDTA in jeden T-75-Kolben geben. Kippen Sie den Kolben, um sicherzustellen, dass die gesamte Zellkulturoberfläche mit 0,05%iger Trypsin-EDTA-Lösung bedeckt ist. Die Kolben 3-5 min bei 37 °C inkubieren und auf Zellablösung prüfen.
- Sobald die Zellen schwimmen, geben Sie mindestens 6 ml Dulbecco's Modified Eagle Medium (DMEM) in jeden Kolben und überführen Sie die Zellen in ein konisches 50-ml-Röhrchen.
- Zentrifugieren Sie die Zellsuspension bei 300 x g für 5 Minuten bei Raumtemperatur, um die Zellen zu pelletieren. Saugen Sie den Überstand aus dem Zellpellet ab und resuspendieren Sie die Zellen in 1-3 ml Medien mit FBS unter Verwendung einer 1000-μl-Pipette, um eine Einzelzellsuspension zu gewährleisten.
- 10 μl der Zellsuspension in ein Mikrozentrifugenröhrchen überführen. Fügen Sie 10 μl Trypanblau-Lösung hinzu und mischen Sie sie gut. Verwenden Sie 10 μl dieser Mischung, um Zellen in einem Hämozytometer mit einem inversen Lichtmikroskop zu zählen.
HINWEIS: Um eine Endkonzentration von 4 x 106 Zellen/ml Biotinte zu erreichen, wurden 800.000 Fibroblasten pro 200 μl Biotinte beiseite gelegt.
5. Herstellung von Hydrogel-Biotinte
ANMERKUNG: Die Biotintenpräparation wurde von Davis-Hall et al.5 übernommen. Die Schritte 5.1 bis 5.2 können parallel zu den Schritten 4.1 bis 4.3 ausgeführt werden, um die Zeit zwischen der Zellentnahme und der Resuspension in der Biotinte zu minimieren. Führen Sie Schritte in einer Biosicherheitswerkbank mit einer aseptischen Technik durch.
- Bereiten Sie eine 20 mM Tris(2-carboxyethyl)phosphin-Lösung (TCEP, siehe Materialtabelle) pH 7 und einen Sterilfilter mit einem 0,2 μm Spritzenvorsatzfilter vor. Unmittelbar vor der Anwendung 2 M KOH und/oder 2 M HCl hinzufügen, um den pH-Wert der Lösung nach Bedarf anzupassen. Mit dem pH-Messgerät messen und entsprechend anpassen.
HINWEIS: TCEP reduziert Disulfidbrücken. - Herstellen einer 0,25 mg/ml-Stammlösung von PEGαMA, resuspendiert in sterilen Zellkulturmedien ohne FBS, 250 mM Stammlösungen von 1,4-Dithiothreitol (DTT), MMP2-abbaubarem Vernetzer und CGRGDS (RGD)-Peptid (siehe Materialtabelle), Resuspendierung in 20 mM sterilem TCEP und einer 15 Gew.-%igen Stammlösung von Polyethylenoxid (PEO) in destilliertem (DI) Wasser mit Pipetten nach Bedarf.
- Kombinieren Sie anhand von Tabelle 1 die jeweils benötigten Mengen an PEGαMA, DTT, MMP2-abbaubarem Vernetzer, PEO, CGRGDS und Zellkulturmedien mit niedrigem Serum zusammen mit den Fibroblasten in einem konischen 50-ml-Röhrchen.
HINWEIS: Es wird empfohlen, den pH-Wert mit pH-Streifen zu überprüfen, nachdem alle außer den Zellkulturmedien hinzugefügt wurden, da diese Kombination dazu führen sollte, dass der pH-Wert sehr nahe bei 6,2 liegt. Wenn weitere pH-Einstellungen erforderlich sind, achten Sie darauf, wie viel zusätzliches Volumen benötigt wird, um den pH-Wert der Vorläuferlösung anzupassen. Erhöhen Sie das Gesamtvolumen auf 200 μl, indem Sie das verbleibende Volumen des Zellkulturmediums abzüglich des bei der letzten pH-Einstellung hinzugefügten Volumens hinzufügen. - Mischen Sie die Biotinte mit einer Verdrängungspipette, um sicherzustellen, dass es sich bei den Zellen um Einzelzellen handelt, und vergewissern Sie sich, dass die endgültige Vorläuferlösung einen pH-Wert von 6,2 hat, um eine basenkatalysierte Polymerisation während des 3D-Biodrucks zu verhindern.
- Füllen Sie die Biotinte in die Glasspritze, indem Sie den Kolben entfernen und eine separate Spritze mit einer 15-Gauge-Nadelspitze mit einer Länge von 1,5 Zoll (siehe Materialtabelle) verwenden, um die Biotinte aus dem Zentrifugenröhrchen in die Spritze zu übertragen, wobei Sie darauf achten müssen, dass sich keine Luftblasen in der Lösung bilden.
- Platzieren Sie die Glasspritze im Druckkopf und befestigen Sie Druckkopfkomponenten, damit alles fest montiert und druckfertig ist.
HINWEIS: Zu diesem Zeitpunkt sollte an der Glasspritze im Druckkopf eine stumpfe 30-Gauge-Nadelspitze mit einer Länge von 0,5 Zoll zum Drucken angebracht sein.
| Bestandteil | Konzentration von Stammlösungen | Hinzuzufügender Betrag |
| PEGαMA | 0,25 mg/ml | 140 μl |
| DVB-T | 250 mM | 12,24 μl |
| MMP2 abbaubarer Vernetzer | 250 mM | 5,25 μl |
| RGD | 250 mM | 1,6 μl |
| PEO | 15 Gew.-% | 33,33 μl |
| Aktivierungsmedien und/oder Reagenzien zur pH-Einstellung | - | 7,58 μl |
| Fibroblasten | - | 800000 Zellen |
Tabelle 1: Beispielvolumina, die für die Herstellung von 200 μl Biotinte (Hydrogel-Vorläuferlösung und Fibroblastenzellen) erforderlich sind.
6.3D Bioprinting
HINWEIS: Führen Sie alle Schritte in einer Biosicherheitswerkbank mit aseptischen Techniken durch.
- Passen Sie mithilfe der Richtungspfeile in der Pronterface-Software die Position der Extrusionsnadel in der Mitte eines Wells und innerhalb der Stützbadaufschlämmung manuell an. Lassen Sie mindestens 1 mm Stützbadbrei unterhalb der Nadelspitze stehen.
HINWEIS: Die Software ist nicht in der Lage, zu erkennen, wo sich die Nadel im Raum befindet. Es liegt ganz im Ermessen des Benutzers, die Nadel zu bewegen, indem er manuell auf die Pfeile in der Software klickt (z. B. wird die Nadel durch Klicken auf den Pfeil nach oben oder von der Druckplattform weg bewegt usw.). Manövrieren Sie die Nadel vorsichtig, um sicherzustellen, dass sie keine Grenzen des Brunnens trifft. - Sobald sich die Nadelspitze in der Mitte der Aufschlämmung innerhalb der Vertiefung befindet, drücken Sie den Startknopf in der Vorlauffläche und warten Sie, bis der Druck abgeschlossen ist, um Konstrukte zu erhalten, wie in Abbildung 3A gezeigt.
HINWEIS: Der Biodruck eines Konstrukts mit der bereitgestellten Datei (Ergänzungsdatei 1) dauert ca. 3 Minuten. Es dauert ca. 5 Minuten, um die Nadel auszurichten und zu bewegen und dann ein Konstrukt von Anfang bis Ende vollständig zu drucken. - Wiederholen Sie die Schritte 6.1 bis 6.2, bis die gewünschte Anzahl biogedruckter Konstrukte erreicht ist.
HINWEIS: Es wird empfohlen, mehr Konstrukte als nötig zu erstellen, um fehlgeschlagene Drucke zu berücksichtigen. Wenn ein Fehler auftritt, wechseln Sie zur nächsten Vertiefung, setzen Sie alles zurück, und wiederholen Sie die Schritte 6.1 bis 6.2 erneut. - Lassen Sie die Well-Platte bei Raumtemperatur und decken Sie sie nach Beendigung des Drucks 1 Stunde lang in der BSC ab, um eine basenkatalysierte Polymerisation des phototunbaren Hydrogels zu ermöglichen.
- Legen Sie die Well-Platte mit den 3D-biogedruckten Konstrukten in einen sterilen Inkubator bei 37 °C und lassen Sie sie 12-18 Stunden lang die Stützbadaufschlämmung schmelzen.
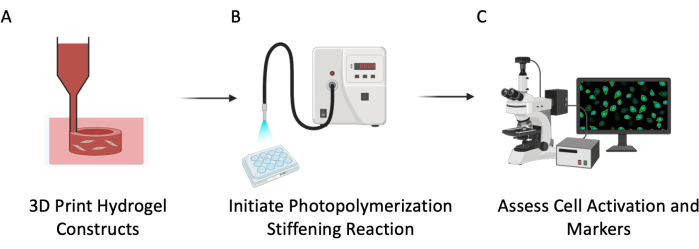
Abbildung 3: Experimentelles Schema. Dieses Protokoll wurde in drei Hauptschritten beschrieben: (A) 3D-Bioprinting von PEGαMA-Hohlröhrchen mit eingebetteten Zellen, um das Lungengefäßsystem nachzuahmen. (B) Photoinitiierung der Homopolymerisationsreaktion zur Versteifung der zellulären Mikroumgebung. (C) Bewertung zellulärer Marker für Proliferation und Aktivierung. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
7. .3D biogedruckte Konstruktkultur und Photoversteifung
HINWEIS: Alle Schritte sollten in einer Biosicherheitswerkbank mit aseptischen Techniken durchgeführt werden.
- 2,2 mM Lithiumphenyl-2,4,6-trimethylbenzoylphosphinat (LAP) Stammlösung (siehe Materialtabelle) in PBS und sterilem Filter mit einem 0,2 μm Spritzenvorsatzfilter herstellen. Bewahren Sie die LAP-Lösung lichtgeschützt auf.
- Wechseln Sie nach 12-18 h das Medium, das die biogedruckten Konstrukte umgibt. Entfernen Sie das Medium und das Trägerbad der geschmolzenen Gelatine manuell in den Vertiefungen und achten Sie darauf, die biogedruckten Konstrukte nicht zu stören.
HINWEIS: Es ist hilfreich, das Medium langsam zu entfernen, während die Platte in einem 45°-Winkel gehalten wird, damit die Konstrukte innerhalb der Vertiefung austreten und gesehen werden können. Ein durchsichtiger Hydrogelzylinder sollte in jeder Vertiefung mit erfolgreichem Druck erkennbar sein (Abbildung 4A). - Geben Sie ein angemessenes Volumen an Medien mit niedrigem Serumgehalt in jede Vertiefung.
HINWEIS: Bei einer 24-Well-Platte sollten 700 μl Medien pro Well die biogedruckten Konstrukte vollständig abdecken. Passen Sie die Einstellungen nach Bedarf an. - Legen Sie die Platte wieder in den Inkubator und wechseln Sie die Medien auf den Proben alle 3 Tage oder in Übereinstimmung mit dem Versuchsplan.
- Vierundzwanzig Stunden vor dem gewünschten Versteifungszeitpunkt entfernen Sie Medien aus den Proben und ersetzen Sie sie durch Medien mit niedrigem Serumgehalt, die mit 2,2 mM sterilem LAP ergänzt werden.
ANMERKUNG: Um die Struktur fluoreszierend zu markieren, werden 3D-biogedruckte Konstrukte in PBS, ergänzt mit 10 μM Methacryloxyethylthiocarbamoylrhodamin B (siehe Table of Materials), über Nacht aufgequollen und dann wie in Schritt 7.6 beschrieben versteift, um die Struktur fluoreszierend zu markieren. 2 Tage lang bei 4 °C in PBS umfüllen, um überschüssiges Rhodamin zu entfernen und mit einem TRITC-Filter abzubilden (Abbildung 4B,C). - Entnehmen Sie zum gewünschten Versteifungszeitpunkt die Hälfte des Mediums aus den zu versteifenden Vertiefungen und legen Sie die Platte mit abgenommenem Deckel unter UV-Licht. Schalten Sie das UV-Licht ein und versteifen Sie diese Konstrukte, indem Sie 5 Minuten lang 10 mW/cm2 365-nm-Licht mit Omnicure (siehe Materialtabelle) und einem 365-nm-Bandpassfilter (Abbildung 3B) auftragen.
HINWEIS: Verwenden Sie das Radiometer/Photometer, um zu überprüfen, ob die Lichtintensität korrekt ist, bevor Sie die Zellen UV-Licht aussetzen. - Entfernen Sie das verbleibende Medium aus diesen Vertiefungen und geben Sie frisches Medium mit niedrigem Serumgehalt in jede Vertiefung. Legen Sie die Platte wieder in den Inkubator.
- Nehmen Sie die Platte aus dem Inkubator und führen Sie die Fibroblastenaktivierungsstudie zum gewünschten Zeitpunkt nach Schritt 9 durch.
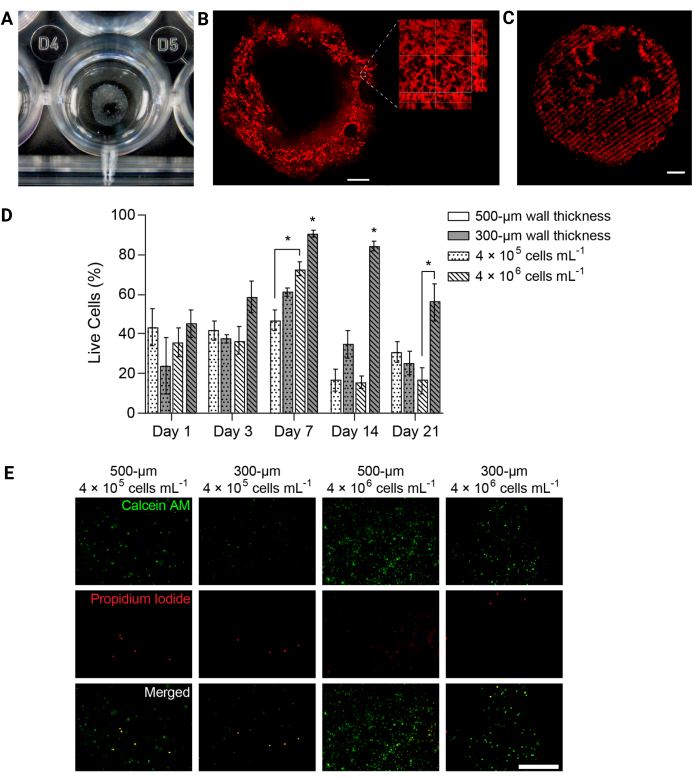
Abbildung 4: 3D-biogedruckte Hydrogelstrukturen unterstützten die Lebensfähigkeit der Zellen im Laufe der Zeit. (A) Foto einer 3D-gedruckten Hydrogelstruktur in einer 24-Well-Platte. (B) Projektion mit maximaler Intensität von fluoreszenzmarkiertem PEGαMA 3D-gedrucktem Hydrogel. Maßstabsleiste = 1 mm. Die Mikroskopie mit höherer Vergrößerung zeigte Poren innerhalb der Hydrogelstruktur, die durch Gelatine-Mikropartikel im FRESH-Bioprinting-Trägerbad induziert wurden. (C) 3D-gedruckte PEGαMA-Röhren mit fluoreszenzmarkierten versteiften Bereichen, die auf einem konfokalen Mikroskop (100 μm Z-Stapel als Projektion mit maximaler Intensität) aufgenommen wurden, zeigten eine räumliche Kontrolle über die Versteifung in 3D. Maßstabsbalken = 500 μm. (D) HPAAF-Viabilität in 3D-biogedruckten Konstrukten, gemessen mit Lebend-/Tot-Assays. Konstrukte mit einer Dicke von 300 μm und 4 × 106 Zellen/ml übertrafen alle anderen Bedingungen zu jedem Zeitpunkt. Die Lebensfähigkeit erreichte am 7. Tag ihren Höhepunkt. Diese Bedingung und dieser Zeitpunkt wurden für zukünftige Experimente ausgewählt. Die Spalten zeigen den Mittelwert ± SEM, n = 3. *, p < 0,05, ANOVA, Tukey HSD. (E) Repräsentative konfokale Bilder von Zellen in 3D-Konstrukten, die mit Lebend-/Totreagenz gefärbt wurden, an Tag 7, dem Zeitpunkt mit der größten Gesamtlebensfähigkeit. Calcein AM markierte lebende Zellen in grün und Propidiumiodid markierte tote Zellen in rot. Die Spalte ganz rechts zeigt, dass die leistungsstärkste Bedingung eine gleichmäßige Zellverteilung und einen hohen Prozentsatz an lebenden Zellen aufwies. Maßstabsleiste = 500 μm. Nachdruck mit freundlicher Genehmigung von Davis-Hall et al.5. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
8. Die Bewertung der Lebensfähigkeit von Fibroblasten
- Zu den gewünschten Zeitpunkten der Lebensfähigkeit mit Calcein AM und Propidiumiodid färben (siehe Materialtabelle).
HINWEIS: Zusammenfassend lässt sich sagen, dass Medien aus jeder Vertiefung entfernt und die Konstrukte mit sterilem PBS gespült werden sollten. Inkubieren Sie die Konstrukte in einer Lebend-/Totfärbelösung für 40 Minuten bei 37 °C auf einer Wippe. Die Färbelösung sollte Calcein AM (1:1000 Verdünnung) und Propidiumiodid (1:1000 Verdünnung) enthalten, um lebende oder tote Zellen bei der Bildgebung zu identifizieren. - Übertragen Sie die Konstrukte in ein steriles PBS und bilden Sie sie sofort auf einem konfokalen Fluoreszenzmikroskop ab. Erfassen Sie drei verschiedene 100-μm-Z-Stapelbilder pro Probe und Zeitpunkt und drücken Sie die Lebensfähigkeit als durchschnittlichen Prozentsatz lebender Zellen aus (Abbildung 4D,E).
9. Die Bewertung der Fibroblastenaktivierung
- Bereiten Sie 3 % w/v Rinderserumalbumin (BSA) und 0,1 % v/v Tween 20 in PBS vor. Diese Lösung wird als Immunfluoreszenzlösung (IF) bezeichnet.
- Entfernen Sie zu den gewünschten Zeitpunkten Medien aus den Probenvertiefungen und spülen Sie die Konstrukte mit PBS. Ersetzen Sie das PBS durch 4 % Paraformaldehyd (PFA) und bewahren Sie diese Proben 30 Minuten lang bei 37 °C auf einer Wippe auf. Ersetzen Sie dann die 4%ige PFA durch 100 mM Glycin in PBS und lassen Sie diese Proben weitere 15 Minuten bei Raumtemperatur (RT) auf einer Wippe.
- Als nächstes werden diese Proben in Tissue-Tek Kryoformen überführt, die Probe vollständig mit der Lösung der optimalen Schneidtemperatur (OCT) bedeckt (siehe Materialtabelle) und die OCT 12-18 h bei 4 °C in die Proben diffundieren lassen.
- Die OCT-getränkten Proben werden mit flüssigem Stickstoff in 2-Methylbutan schockgefroren. Füllen Sie eine Styroporbox oder einen anderen geeigneten Behälter mit flüssigem Stickstoff und stellen Sie dann einen zweiten mit 2-Methylbutan gefüllten Behälter in den flüssigen Stickstoff, so dass er mindestens zur Hälfte untergetaucht ist. Halten Sie jedes Kryomol, das eine OCT-bedeckte Probe enthält, mit einer Pinzette in flüssigem stickstoffgekühltem 2-Methylbutan fest, bis es sichtbar gefroren ist. Diese Proben können bei -80 °C gelagert werden, bis sie für die Kryosektion bereit sind.
VORSICHT: Persönliche Schutzausrüstung (PSA) wie Kälteschutzhandschuhe, eine Kälteschutzschürze und ein Gesichtsschutzschild, die im kryogenen Sicherheitskit enthalten sind (siehe Materialtabelle), sollten beim Umgang mit flüssigem Stickstoff verwendet werden. - Kryosektion der eingefrorenen OCT-Proben bei -22 °C und Befestigen von 10 μm dicken Scheiben auf positiv geladenen Objektträgern. Bereiten Sie drei Objektträger mit mindestens 3-5 Kryoschnitten pro Objektträger für jede 3D-Hydrogelprobe vor.
HINWEIS: Die Objektträger können an dieser Stelle bei Bedarf bei -80 °C gelagert werden. - Fixieren Sie die Kryoschnitte 15 Minuten lang in eiskaltem Aceton, damit die Kryoschnitte an den Objektträgern haften. Spülen Sie die Kryoschnitte vorsichtig mit RT-Wasser ab, um das verbleibende OCT zu entfernen. Lassen Sie diese Proben trocknen und skizzieren Sie die Kryoschnitte mit einem hydrophoben Stift (siehe Materialtabelle).
- Permeabilisieren Sie die Proben bei Raumtemperatur mit 0,2 % v/v Triton X-100 in PBS für 10 min und blockieren Sie dann die Abschnitte mit 5 % BSA w/v in PBS für 1 h bei RT.
- Geben Sie den primären Maus-Anti-Human-Alpha-Glattmuskel-Aktin-Antikörper (αSMA) (1:250-Verdünnung) (siehe Materialtabelle) in die IF-Lösung. Lagern Sie diese geschnittenen Proben mit dem Primärantikörper über Nacht bei 4 °C. Spülen Sie die Proben 3x mit IF-Lösung.
- Inkubieren Sie die Abschnitte in IF-Lösung, die den sekundären Ziegen-Anti-Maus-Antikörper Alexa Fluor 555 (1:250-Verdünnung) und zwei Tropfen ActinGreen 488 ReadyProbe (siehe Materialtabelle) pro Milliliter IF-Lösung enthält. Decken Sie die Proben für alle weiteren Schritte mit Aluminiumfolie ab, um sie vor Licht zu schützen, und lassen Sie die sekundäre Antikörperlösung 1 h lang bei RT auf den Proben verbleiben.
- Spülen Sie die Abschnitte 3x mit IF-Lösung ab. Inkubieren Sie sie in 300 nM 4',6-Diamidino-2-phylindol (DAPI) in DI-Wasser für 15 min bei RT. Führen Sie eine letzte Spülung der Abschnitte 3x mit DI-Wasser durch.
- Verwenden Sie 10 μl eines handelsüblichen Antifade-Reagenzes (siehe Materialtabelle), decken Sie die Abschnitte mit Standardmethoden ab.
HINWEIS: Die eingefassten Objektträger können lichtgeschützt in einem Gefrierschrank bei -80 °C gelagert werden, bis sie für die Bildgebung benötigt werden. - Bilden Sie die Kryoschnitte mit einem Fluoreszenzmikroskop ab (Abbildung 3C und Abbildung 5B). Bilden Sie drei zufällige Abschnitte pro Dia mit einem 10-fach-Objektiv ab.
HINWEIS: Die Bilder sollten in den DAPI-, FITC- und TRITC-Kanälen aufgenommen werden. - Laden Sie die Bilder in ImageJ (NIH) hoch. Quantifizieren Sie den Prozentsatz der αSMA-positiven Zellen als Maß für die Fibroblastenaktivierung (Abbildung 5A), indem Sie die Gesamtzahl der αSMA-positiven Zellen durch die Gesamtzahl der Zellkerne für jedes Sichtfeld dividieren.
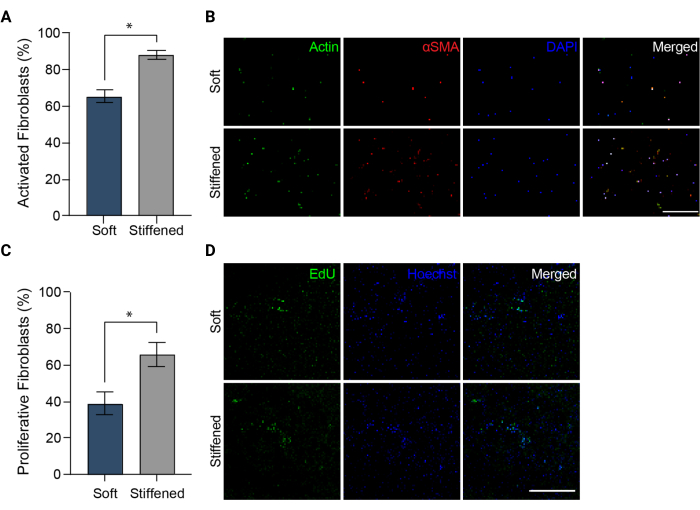
Abbildung 5: Fibroblastenaktivierung in 3D-biogedruckten Modellen der pulmonal-arteriellen Adventitia . (A) Fibrotische Aktivierung in weichen und versteiften 3D-Hydrogelen, gemessen durch αSMA-Expression. HPAAFs in versteiften Konstrukten waren signifikant positiver für αSMA als Zellen in weichen Konstrukten. Die Spalten stellen den Mittelwert ± SEM dar, n = 3. *, S . < 0,05, Mann-Whitney-U-Test. (B) Repräsentative konfokale Bilder der Immunfärbung für αSMA, Aktin und DAPI in weichen und versteiften 3D-Hydrogelen. HPAAFs in versteiften Konstrukten zeigten eine häufigere αSMA-Immunfluoreszenz als Zellen in weichen Konstrukten. Maßstabsbalken = 250 μm. (C) Fibroblastenproliferation in weichen und versteiften biogedruckten 3D-Konstrukten, gemessen durch EdU-Positivität. HPAAFs in versteiften Konstrukten waren signifikant positiver für EdU als Zellen in weichen Konstrukten. Die Spalten stellen den Mittelwert ± SEM dar, n = 3. *, S . < 0,05, Mann-Whitney-U-Test. (D) Repräsentative konfokale Bilder der Immunfärbung für EdU- und Hoechst-Farbstoff in weichen und versteiften 3D-Hydrogelen. HPAAFs in versteiften Konstrukten zeigten eine häufigere EdU-Immunfluoreszenz als Zellen in weichen Konstrukten. Maßstabsbalken = 300 μm. Nachdruck mit freundlicher Genehmigung von Davis-Hall et al.5. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
10. Die Bewertung der Fibroblastenproliferation
- Vierundzwanzig Stunden vor einem gewünschten Proliferationszeitpunkt werden die Zellkulturmedien aus jeder Vertiefung entnommen und durch Medien mit niedrigem Serumgehalt ersetzt, die mit einer 10-μM-EdU-Lösung aus dem im Handel erhältlichen Zellproliferationskit ergänzt werden (siehe Materialtabelle). Geben Sie die Proben zur Inkubation über Nacht in den Inkubator zurück.
- Zum gewünschten Proliferationszeitpunkt werden die mit EdU inkubierten Proben unter Verwendung von 4 % PFA bei 37 °C für 30 Minuten auf einem Wippen fixiert. Ersetzen Sie die 4%ige PFA-Lösung durch 100 mM Glycin in PBS und inkubieren Sie die Proben bei 37 °C für mindestens 15 Minuten. Geben Sie den Hoechst in geeigneter Konzentration für 30 min hinzu und spülen Sie die Konstrukte dann 2x mit PBS.
HINWEIS: Die Proben können bis zur Bildgebung lichtgeschützt bei 4 °C gelagert werden. - Bilden Sie alle fixierten und gelagerten EdU-Proben mit einem Fluoreszenzmikroskop ab und schlagen Sie die Einstellungen und Filter des Herstellers des Zellproliferationskits vor (Abbildung 3C und Abbildung 5D). Erfassen Sie drei verschiedene 100-μm-Z-Stack-Bilder pro Probe und erstellen Sie maximale Projektionen aus jedem dieser Z-Stacks. Messen Sie die HPAAF-Proliferation, indem Sie die Anzahl der EdU-positiven Zellen zählen und durch die Gesamtzahl der Zellen dividieren, die durch die Hoechst-Gegenfärbung in den maximalen Projektionsbildern identifiziert wurden (Abbildung 5C).
Ergebnisse
Dieses Protokoll beschreibt, wie phototunbare Hydrogele in einem Trägerbad in 3D biogedruckt werden, um Konstrukte zu erstellen, die in der Lage sind, dynamisch und zeitlich versteift zu werden, um die Fibroblastenaktivierung in Geometrien zu untersuchen, die menschliches Gewebe nachahmen. Zunächst erklärte das Protokoll, wie PEGαMA, das Rückgrat dieses photoabstimmbaren Polymersystems, synthetisiert wird. Kernspinresonanzspektroskopie-Messungen (NMR) zeigten eine erfolgreiche PEGαMA-Funktionalisierung bei 96,5 % (...
Diskussion
Zweistufige Polymerisationsreaktionen als Reaktion auf kontrollierte Lichtexposition können Biomaterialien räumlich und zeitlich kontrollierend versteifen. Mehrere Studien haben diese Technik genutzt, um Zell-Matrix-Interaktionen auf verschiedenen Plattformen zu bewerten 5,8,9,10,11,21,22,23.
Offenlegungen
Die Autoren haben keine Interessenkonflikte offenzulegen. Teile dieses Manuskripts werden mit Genehmigung von © IOP Publishing https://doi.org/10.1088/1758-5090/aca8cf reproduziert. 5 Alle Rechte vorbehalten.
Danksagungen
Die Autoren bedanken sich bei Dr. Adam Feinberg (Carnegie Mellon University) und den Gastgebern des Open-Source-Workshops zum Thema 3D-Bioprinting. Diese Personen ermöglichten es, die Techniken des FRESH-Bioprintings zu erlernen und den 3D-Biodrucker zu bauen, der für diese Studien verwendet wurde. Darüber hinaus möchten die Autoren Biorender.com würdigen, die für die Herstellung von Abbildungen in diesem Manuskript verwendet wurden. Diese Arbeit wurde von mehreren Gruppen oder Finanzierungsquellen unterstützt, darunter die Rose Community Foundation (DDH und CMM), ein Colorado Pulmonary Vascular Disease Research Award (DDH und CMM), die National Science Foundation unter Award 1941401 (CMM), das Department of the Army unter dem Award W81XWH-20-1-0037 (CMM), das National Cancer Institute der NIH unter dem Award R21 CA252172 (CMM), das Ludeman Family Center for Women's Health Research am Anschutz Medical Campus der University of Colorado (DDH und CMM), das National Heart, Lung, and Blood Institute der National Institutes of Health unter den Auszeichnungen R01 HL080396 (CMM), R01 HL153096 (CMM), F31 HL151122 (DDH) und T32 HL072738 (DDH und AT).
Materialien
| Name | Company | Catalog Number | Comments |
| AccuMax Radiometer/Photometer Kit | Spectronics Corporation | XPR-3000 | To measure light intensity, used for photostiffening |
| Acetic Acid | Fisher Scientific | BP2401-500 | Used during PEGaMA synthesis |
| Acetone | Fisher Scientific | A184 | Used with the cryosections |
| ActinGreen 488 ReadyProbes | Fisher Scientific | R37110 | Used for staining |
| Aluminum Foil | Reynolds | F28028 | |
| Anhydrous Tetrahydrofuran (THF) | Sigma-Aldrich | 401757-1L | Used during PEGaMA synthesis |
| Argon Compressed Gas | Airgas | AR R300 | Used during PEGaMA synthesis |
| 8 Arm Poly(ethylene glycol)-hydroxyl (PEG-OH) | JenKem Technology | 8ARM-PEG-10K | Used during PEGaMA synthesis |
| 365 nm Bandpass Filter | Edmund Optics | 65-191 | Used for photostiffening |
| Bovine Serum Albumin (BSA) | Fisher Scientific | BP9700-100 | Used during staining process |
| Buchner Funnel | Quark Glass | QFN-8-14 | Used during PEGaMA synthesis |
| Calcein AM | Invitrogen | 65-0853-39 | Used during staining process |
| Celite 545 (Filtration Aid) | EMD Millipore | CX0574-1 | Used during PEGaMA synthesis |
| Charged Microscope Slides | Globe Scientific | 1358W | |
| Chloroform-d | Sigma-Aldrich | 151823-10X0.75ML | Used to characterize PEGaMA |
| Click-iT Plus EdU Cell Proliferation Kit | Invitrogen | C10637 | Used for staining |
| 50 mL Conical Tubes | CELLTREAT | 667050B | |
| Cryogenic Safety Kit | Cole-Parmer | EW-25000-85 | |
| Cryostat | Leica | CM 1850-3-1 | |
| Dialysis Tubing | Repligen | 132105 | |
| 4’,6-Diamidino-2-Phylindole (DAPI) | Sigma-Aldrich | D9542-1MG | Used for staining |
| Diethyl Ether | Fisher Scientific | E1384 | Used during PEGaMA synthesis |
| 1,4-Dithiothreitol (DTT) | Sigma-Aldrich | 10197777001 | Bioink component |
| Dulbecco's Modified Eagle's Medium (DMEM) | Cytiva | SH30271.FS | |
| Filter Paper | Whatman | 1001-090 | Used during PEGaMA synthesis |
| Freezone 2.5L Freeze Dry System | Labconco | LA-2.5LR | Lyophilizer |
| Fusion 360 | Autodesk | N/A | Software download |
| 2.5 mL Gastight Syringe | Hamilton | 81420 | Used for bioprinting |
| 15 Gauge 1.5" IT Series Tip | Jensen Global | JG15-1.5X | Used for bioprinting |
| 30 Gauge 0.5" HP Series Tip | Jensen Global | JG30-0.5HPX | Used for bioprinting |
| Goat Anti-Mouse Alexa Fluor 555 Antibody | Fisher Scientific | A21422 | Used for staining |
| Glycine | Fisher Scientific | C2H5NO2 | Used during staining process |
| Hemocytometer | Fisher Scientific | 1461 | |
| Hoechst | Thermo Scientific | 62249 | Used during staining process |
| Human Pulmonary Artery Adventitial Fibroblasts (HPAAFs) | AcceGen | ABC-TC3773 | From a 2-year-old male patient |
| Hydrochloric Acid (HCl) | Fisher Scientific | A144-500 | Used to pH adjust solutions |
| ImageJ | National Institutes of Health (NIH) | N/A | Free software download |
| ImmEdge® Pen | Vector Laboratories | H-4000 | Used during staining process |
| Incubator | VWR | VWR51014991 | |
| LifeSupport Gelatin Microparticle Slurry (Gelatin Slurry) | Advanced Biomatrix | 5244-10GM | Used for bioprinting |
| Light Microscope | Olympus | CKX53 | Inverted light microscope |
| Lithium Phenyl-2,4,6-Trimethylbenzoylphosphinate (LAP) | Sigma-Aldrich | 900889-5G | Photoinitiator used for photostiffening |
| Liquid Nitrogen | N/A | N/A | |
| LulzBot Mini 2 | LulzBot | N/A | Bioprinter adapted |
| Methacryloxyethyl Thiocarbamoyl Rhodamine B | Polysciences Inc. | 669775-30-8 | |
| 2-Methylbutane | Sigma-Aldrich | M32631-4L | |
| Microman Capillary Pistons CP1000 | VWR | 76178-166 | Positive displacement pipette tips |
| MMP2 Degradable Crosslinker (KCGGPQGIWGQGCK) | GL Biochem | N/A | Bioink component |
| Mouse Anti-Human αSMA Monoclonal Antibody | Fisher Scientific | MA5-11547 | Used for staining |
| OmniCure Series 2000 | Lumen Dynamics | S2000-XLA | UV light source used for photostiffening |
| Paraformaldehyde (PFA) | Electron Microscopy Sciences | 15710 | Used to fix samples |
| pH Meter | Mettler Toledo | FP20 | |
| pH Strips | Cytiva | 10362010 | |
| Phosphate Buffered Saline (PBS) | Hyclone Laboratories, Inc. | Cytiva SH30256.FS | |
| Pipette Set | Fisher Scientific | 14-388-100 | |
| 10 µL Pipette Tips | USA Scientific | 1120-3710 | |
| 20 µL Pipette Tips | USA Scientific | 1183-1510 | |
| 200 µL Pipette Tips | USA Scientific | 1111-0700 | |
| 1000 µL Pipette Tips | USA Scientific | 1111-2721 | |
| Poly(Ethylene Glycol)-Alpha Methacrylate (PEGαMA) | N/A | N/A | Refer to manuscript for synthesis steps |
| Poly(Ethylene Oxide) (PEO) | Sigma-Aldrich | 372773-250G | Bioink component |
| Positive Displacement Pipette | Fisher Scientific | FD10004G | 100-1000 µL |
| Potassium Hydroxide (KOH) | Sigma-Aldrich | 221473-500G | Used to pH adjust solutions |
| ProLong Gold Antifade Reagent | Invitrogen | P36930 | Used during staining process |
| Pronterface | All3DP | N/A | Software download |
| Propidium Iodide | Sigma-Aldrich | P4864-10ML | Used for staining |
| RGD Peptide (CGRGDS) | GL Biochem | N/A | Bioink component |
| Rocker | VWR | 10127-876 | |
| Rotary Evaporator | Thomas Scientific | 11100V2022 | Used during PEGaMA synthesis |
| Rubber Band | Staples | 808659 | |
| Schlenk Flask | Kemtech America | F902450 | Used during PEGaMA synthesis |
| Slic3r | Slic3r | N/A | Software download |
| Smooth Muscle Cell Growth Medium-2 (SmGM-2) BulletKit | Lonza | CC-3182 | Kit contains CC-3181 and CC-4149 components |
| Sodium Hydride | Sigma-Aldrich | 223441-50G | Used during PEGaMA synthesis |
| Sorvall ST 40R Centrifuge | Fisher Scientific | 75-004-525 | |
| Stir Bar | VWR | 58948-091 | |
| Syringe Filter | VWR | 28145-483 | Used to sterile filter solutions |
| T-75 Tissue-Cultured Treated Flask | VWR | 82050-856 | Used for cell culture work |
| Tissue-Tek Cyromold | Sakura | 4557 | |
| Tissue-Tek O.C.T Compound (OCT) | Sakura | 4583 | |
| Tris(2-Carboxyethyl) Phosphine (TCEP) | Sigma-Aldrich | C4706-2G | |
| Triton X-100 | Fisher Bioreagents | C34H622O11 | Used during staining process |
| Trypan Blue | Sigma-Aldrich | T8154-20ML | Used for cell culture work |
| 0.05% Trypsin-EDTA | Gibco | 25-300-062 | Used for cell culture work |
| Tween 20 | Fisher Bioreagents | C58H114O26 | Used during staining process |
| Upright Microscope | Olympus | BX63F | Fluorescent microscope capabilities |
| Water Bath | PolyScience | WBE20A11B | |
| 24-Well Tissue Culture Plates | Corning | 3527 |
Referenzen
- Ahrens, J. H., et al. Programming cellular alignment in engineered cardiac tissue via bioprinting anisotropic organ building blocks. Advanced Materials. 34 (26), e2200217 (2022).
- Lin, N. Y. C., et al. Renal reabsorption in 3D vascularized proximal tubule models. Proceedings of the National Academy of Sciences of the United States of America. 116 (12), 5399-5404 (2019).
- Grigoryan, B., et al. Multivascular networks and functional intravascular topologies within biocompatible hydrogels. Science. 364 (6439), 458-464 (2019).
- Kang, Y., Datta, P., Shanmughapriya, S., Ozbolat, I. T. 3D bioprinting of tumor models for cancer research. ACS Applied Biomaterials. 3 (9), 5552-5573 (2020).
- Davis-Hall, D., Thomas, E., Pena, B., Magin, C. M. 3D-bioprinted, phototunable hydrogel models for studying adventitial fibroblast activation in pulmonary arterial hypertension. Biofabrication. 15 (1), (2022).
- Mirdamadi, E., Tashman, J. W., Shiwarski, D. J., Palchesko, R. N., Feinberg, A. W. FRESH 3D bioprinting of a full-size model of the human heart. ACS Biomaterials Science & Engineering. 6 (11), 6453-6459 (2020).
- Shiwarski, D. J., Hudson, A. R., Tashman, J. W., Feinberg, A. W. Emergence of FRESH 3D printing as a platform for advanced tissue biofabrication. APL Bioengineering. 5 (1), 010904 (2021).
- Petrou, C. L., et al. Clickable decellularized extracellular matrix as a new tool for building hybrid hydrogels to model chronic fibrotic diseases in vitro. Journal of Materials Chemistry B. 8 (31), 6814-6826 (2020).
- Hewawasam, R. S., Blomberg, R., Serbedzija, P., Magin, C. M. Chemical modification of human decellularized extracellular matrix for incorporation into phototunable hybrid hydrogel models of tissue fibrosis. ACS Applied Materials & Interfaces. 15 (12), 15071-15083 (2023).
- Saleh, K. S., et al. Engineering hybrid hydrogels comprised healthy or diseased decellularized extracellular matrix to study pulmonary fibrosis. Cellular and Molecular Bioengineering. 15 (5), 505-519 (2022).
- Guvendiren, M., Burdick, J. A. Stiffening hydrogels to probe short- and long-term cellular responses to dynamic mechanics. Nature Communications. 3, 792 (2012).
- Rosales, A. M., Vega, S. L., DelRio, F. W., Burdick, J. A., Anseth, K. S. Hydrogels with reversible mechanics to probe dynamic cell microenvironments. Angewandte Chemie International Edition English. 56 (40), 12132-12136 (2017).
- Wynn, T. A., Ramalingam, T. R. Mechanisms of fibrosis: therapeutic translation for fibrotic disease. Nature Medicine. 18 (7), 1028-1040 (2012).
- Huertas, A., Tu, L., Humbert, M., Guignabert, C. Chronic inflammation within the vascular wall in pulmonary arterial hypertension: more than a spectator. Cardiovascular Research. 116 (5), 885-893 (2020).
- Kendall, R. T., Feghali-Bostwick, C. A. Fibroblasts in fibrosis: novel roles and mediators. Frontiers in Pharmacology. 5, 123 (2014).
- Parker, M. W., et al. Fibrotic extracellular matrix activates a profibrotic positive feedback loop. The Journal of Clinical Investigation. 124 (4), 1622-1635 (2014).
- Habiel, D. M., Hogaboam, C. Heterogeneity in fibroblast proliferation and survival in idiopathic pulmonary fibrosis. Frontiers in Pharmacology. 5, 2 (2014).
- Hu, C. J., Zhang, H., Laux, A., Pullamsetti, S. S., Stenmark, K. R. Mechanisms contributing to persistently activated cell phenotypes in pulmonary hypertension. The Journal of Physiology. 597 (4), 1103-1119 (2019).
- Li, M., et al. Emergence of fibroblasts with a proinflammatory epigenetically altered phenotype in severe hypoxic pulmonary hypertension. The Journal of Immunology. 187 (5), 2711-2722 (2011).
- Hinton, T. J., et al. Three-dimensional printing of complex biological structures by freeform-reversible embedding of suspended hydrogels. Science Advances. 1 (9), e1500758 (2015).
- Brown, T. E., et al. Secondary photocrosslinking of click hydrogels to probe myoblast mechanotransduction in three dimensions. Journal of the American Chemical Society. 140 (37), 11585-11588 (2018).
- Ondeck, M. G., et al. Dynamically stiffened matrix promotes malignant transformation of mammary epithelial cells via collective mechanical signaling. Proceedings of the National Academy of Sciences of the United States of America. 116 (9), 3502-3507 (2019).
- Caliari, S. R., et al. Stiffening hydrogels for investigating the dynamics of hepatic stellate cell mechanotransduction during myofibroblast activation. Scientific Reports. 6, 21387 (2016).
- Liu, F., et al. Feedback amplification of fibrosis through matrix stiffening and COX-2 suppression. Journal of Cell Biology. 190 (4), 693-706 (2010).
- Tschumperlin, D. J., Ligresti, G., Hilscher, M. B., Shah, V. H. Mechanosensing and fibrosis. The Journal of Clinical Investigation. 128 (1), 74-84 (2018).
- Chelladurai, P., Seeger, W., Pullamsetti, S. S. Matrix metalloproteinases and their inhibitors in pulmonary hypertension. European Respiratory Journal. 40 (3), 766-782 (2012).
- Caracena, T., et al. Alveolar epithelial cells and microenvironmental stiffness synergistically drive fibroblast activation in three-dimensional hydrogel lung models. Biomaterials Science. 10 (24), 7133-7148 (2022).
- Ruskowitz, E. R., DeForest, C. A. Proteome-wide analysis of cellular response to ultraviolet light for biomaterial synthesis and modification. ACS Biomaterials Science & Engineering. 5 (5), 2111-2116 (2019).
- Kruse, C. R., et al. The effect of pH on cell viability, cell migration, cell proliferation, wound closure, and wound reepithelialization: In vitro and in vivo study. Wound Repair and Regeneration. 25 (2), 260-269 (2017).
- Filippi, M., et al. Perfusable biohybrid designs for bioprinted skeletal muscle tissue. Advanced Healthcare Materials. , e1500758 (2023).
- Matthiesen, I., et al. Astrocyte 3D culture and bioprinting using peptide-functionalized hyaluronan hydrogels. Science and Technology of Advanced Materials. 24 (1), 2165871 (2023).
- Xu, L., et al. Bioprinting a skin patch with dual-crosslinked gelatin (GelMA) and silk fibroin (SilMA): An approach to accelerating cutaneous wound healing. Materials Today Bio. 18, 100550 (2023).
- Bliley, J. M., Shiwarski, D. J., Feinberg, A. W. 3D-bioprinted human tissue and the path toward clinical translation. Science Translational Medicine. 14 (666), eabo7047 (2022).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenWeitere Artikel entdecken
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten