È necessario avere un abbonamento a JoVE per visualizzare questo. Accedi o inizia la tua prova gratuita.
Method Article
Idrogel fotoregistrabili in bioprinting 3D per studiare l'attivazione dei fibroblasti
In questo articolo
Riepilogo
Questo articolo descrive come biostampare in 3D idrogel fototabili per studiare l'irrigidimento della matrice extracellulare e l'attivazione dei fibroblasti.
Abstract
Gli idrogel fototabili possono trasformarsi spazialmente e temporalmente in risposta all'esposizione alla luce. L'incorporazione di questi tipi di biomateriali nelle piattaforme di coltura cellulare e l'innesco dinamico dei cambiamenti, come l'aumento della rigidità microambientale, consente ai ricercatori di modellare i cambiamenti nella matrice extracellulare (ECM) che si verificano durante la progressione della malattia fibrotica. In questo articolo, viene presentato un metodo per la biostampa 3D di un biomateriale idrogel fototabile in grado di eseguire due reazioni di polimerizzazione sequenziale all'interno di un bagno di supporto di gelatina. La tecnica di bioprinting FRESH (Freeform Reversible Embedding of Suspended Hydrogels) è stata adattata regolando il pH del bagno di supporto per facilitare una reazione di addizione di Michael. In primo luogo, il bioink contenente poli(glicole etilenico)-alfa metacrilato (PEGαMA) è stato fatto reagire fuori stechiometria con un reticolante degradabile in cella per formare idrogel morbidi. Questi idrogel morbidi sono stati successivamente esposti al fotoinitatore e alla luce per indurre l'omopolimerizzazione di gruppi non reagiti e irrigidire l'idrogel. Questo protocollo copre la sintesi dell'idrogel, la biostampa 3D, il fotoirrigidimento e la caratterizzazione degli endpoint per valutare l'attivazione dei fibroblasti all'interno di strutture 3D. Il metodo qui presentato consente ai ricercatori di biostampare in 3D una varietà di materiali che subiscono reazioni di polimerizzazione catalizzate dal pH e potrebbe essere implementato per progettare vari modelli di omeostasi, malattia e riparazione dei tessuti.
Introduzione
La biostampa 3D è una tecnologia trasformativa che consente ai ricercatori di depositare con precisione cellule e biomateriali all'interno di volumi 3D e ricreare la complessa struttura gerarchica dei tessuti biologici. Nell'ultimo decennio, i progressi nella biostampa 3D hanno creato tessuti cardiaci umani1 battenti, modelli funzionali di tessuti renali2, modelli di scambio gassoso all'interno del polmone3 e modelli tumorali per la ricerca sul cancro4. L'invenzione di tecniche di bioprinting 3D embedded, come la bioprinting FRESH (Freeform Reversible Embedding of Suspended Hydrogel), ha reso possibile la riproduzione di strutture complesse dei tessuti molli come i vasi sanguigni polmonari5 e persino il cuore umano6 in 3D. La biostampa 3D FRESH facilita la stampa strato per strato di bioink morbidi e a bassa viscosità attraverso l'estrusione in un bagno di supporto per assottigliamento al taglio. Il bagno di supporto è costituito da un materiale come microparticelle di gelatina strettamente impacchettate che funge da plastica Bingham e mantiene la forma e la struttura previste del bioink dopo la stampa. Una volta che il costrutto stampato si è solidificato, il bagno di supporto può essere sciolto aumentando la temperatura a 37 °C7.
Un recente articolo di revisione ha riassunto i materiali che sono stati biostampati in 3D in varie pubblicazioni utilizzando la tecnica FRESH. Questi materiali di derivazione naturale vanno dal collagene di tipo I all'acido ialuronico metacrilato e rappresentano diversi meccanismi di gelificazione7. La maggior parte degli studi di ricerca eseguiti utilizzando questa tecnica di bioprinting 3D impiegano biomateriali statici che non cambiano in risposta a stimoli esterni. I biomateriali idrogel fototunable dinamici sono stati utilizzati dal nostro laboratorio e da altri 8,9,10,11,12 per modellare una varietà di malattie fibrotiche. A differenza dei biomateriali statici, i bioink fotoregistrabili consentono di creare un modello ammorbidito con un valore di modulo elastico inferiore e successivamente irrigidito per esplorare le risposte cellulari all'aumento dell'irrigidimento microambientale.
Le malattie fibrotiche sono caratterizzate da un aumento della produzione di matrice extracellulare che può causare cicatrici e irrigidimenti13. L'irrigidimento dei tessuti può causare ulteriori lesioni e la distruzione del tessuto colpito, causando danni permanenti agli organi e persino la morte; I disturbi fibrotici sono responsabili di un terzo della mortalità in tutto il mondo. I fibroblasti producono una matrice extracellulare in eccesso e aberrante in questo stato di malattia14,15. L'aumento della proliferazione dei fibroblasti e la deposizione di matrice extracellulare irrigidiscono ulteriormente il tessuto e attivano un ciclo di feedback positivo profibrotico16,17,18,19. Lo studio dell'attivazione dei fibroblasti è fondamentale per comprendere le malattie fibrotiche. Qui presentiamo l'ipertensione arteriosa polmonare umana (PAH) come esempio di un disturbo fibrotico in cui è importante imitare la geometria 3D del vaso sanguigno utilizzando la biostampa 3D e introdurre le capacità di irrigidimento dinamico degli idrogel fototabili. La PAH è una condizione in cui la pressione nelle arterie polmonari principali supera i livelli normali e applica uno sforzo al cuore, aumentando l'attivazione dei fibroblasti avventiziali dell'arteria polmonare umana (HPAAF) e irrigidendo i tessuti dei vasi sanguigni16,17,18,19. Una formulazione fototabile di poli(glicole etilenico)-alfa metacrilato (PEGαMA) bioink consente l'irrigidimento temporale nei costrutti e aiuta a modellare sia il tessuto sano che la progressione della malattia 5,8,9,10. Lo sfruttamento di questa caratteristica unica consente di quantificare l'attivazione e la proliferazione dell'HPAAF in risposta all'irrigidimento microambientale in 3D e può fornire preziose informazioni sui meccanismi cellulari coinvolti in questa malattia. Il protocollo qui descritto consentirà ai ricercatori di creare modelli 3D che ricapitolano i cambiamenti nel microambiente extracellulare durante la progressione della malattia o la riparazione dei tessuti e studiano l'attivazione dei fibroblasti.
Protocollo
1. Sintesi e caratterizzazione di PEGαMA
NOTA: La sintesi del poli(glicole etilenico)-alfa metacrilato (PEGαMA) è stata adattata da Hewawasam et al . ed eseguita in condizioni di assenza di umidità9.
- Pesare i reagenti.
NOTA: Ad esempio, pesare 5 g di ossidrile PEG a 8 bracci da 10 g e 10 kg/mol e 0,38 g di idruro di sodio (NaH) (vedere la tabella dei materiali). - Aggiungere una barra di agitazione al pallone di Schlenk da 250 ml e spurgare con argon.
- Sciogliere il PEG-OH nel volume più basso di tetraidrofurano anidro (THF) necessario per la dissoluzione all'interno del pallone di Schlenk.
NOTA: Circa 80 ml di THF sciolgono 5 g di PEG-OH. Aggiungere la quantità minima di THF necessaria per sciogliere il PEG-OH. - Aggiungere 3 volte l'eccesso molare di NaH alla miscela di reazione e mescolare a temperatura ambiente (RT) per 30 min.
- Aggiungere 6 volte l'eccesso molare di 2-(bromomil)acrilato di etile (EBrMA, vedi Tabella dei materiali) goccia a goccia nel pallone di Schlenk e coprire il recipiente di reazione con un foglio di alluminio per proteggerlo dalla luce. Agitare la reazione a temperatura ambiente per circa 48 ore.
NOTA: Per 5 g di PEG-OH e 0,38 g di NaH, utilizzare 3,68 mL di EBrMA per questa reazione. - Aggiungere alcune gocce di acido acetico 1 N per spegnere la reazione. Filtrare sottovuoto la soluzione attraverso un coadiuvante di filtrazione.
NOTA: L'aggiunta di acido acetico produrrà bolle di gas. Interrompere l'aggiunta di gocce di acido acetico quando le bolle smettono di formarsi poiché ciò indica che la miscela è stata spenta con successo. - Concentrare il filtrato su un evaporatore rotante e precipitare in etere etilico a 4 °C. Lasciare il precipitato al riparo dalla luce a 4 °C per 12-18 ore.
- Aggiungi una carta da filtro Whatman a un imbuto Buchner. Versare lentamente la miscela di reazione sulla carta da filtro e utilizzare l'aspirazione sottovuoto per separare il precipitato dall'etere etilico. Raccogliere il precipitato in un pallone di filtrazione asciutto e pulito.
- Asciugare sottovuoto il prodotto per almeno 5 ore o per una notte a temperatura ambiente e sciogliere in volume minimo l'acqua deionizzata necessaria. Trasferire il prodotto disciolto nel tubo per dialisi (vedere la tabella dei materiali) e dializzare con 3,5 L di acqua deionizzata per almeno quattro giorni. Cambiare l'acqua di dialisi ogni 12 ore.
NOTA: Il prodotto apparirà come polvere solida bianca pura completamente asciutta dopo l'essiccazione sottovuoto. - Congelare il prodotto e liofilizzare per circa 72 ore o fino a completa asciugatura.
- Sciogliere il prodotto in cloroformio D (CDCl3). Eseguire il campione utilizzando 1H NMR con un protocollo che esegue 248 scansioni con un tempo di rilassamento di 2,5 s.
- Verificare la funzionalizzazione e la purezza del prodotto calibrando il picco del solvente CDCl3 a 7,26 PPM. Integrare il picco per i protoni della spina dorsale PEG (d3.71) e calibrare l'integrazione a 114.
- Integrare i picchi rimanenti: PEGαMA 1 H NMR (300 MHz, CDCl 3): d (ppm) 1,36(t, 3H, CH 3-),3,71 (s, 114H, PEG CH 2-CH 2), 4,29 (t, s, 4H, -CH 2-C(O)-O-O, -O-CH 2-C(=CH 2)-), 5,93 (q, 1H, -C=CH 2), 6,34 (q, 1H, -C=CH 2) e confrontare l'integrazione per i picchi del gruppo terminale dell'alchene αMA con il valore atteso (1H) in base alla calibrazione della spina dorsale PEG (Figura 1).
NOTA: Calcolare la media dei due picchi etichettati come "a" (Figura 1) e moltiplicare per 100 per ottenere la percentuale media di funzionalizzazione del PEGαMA.
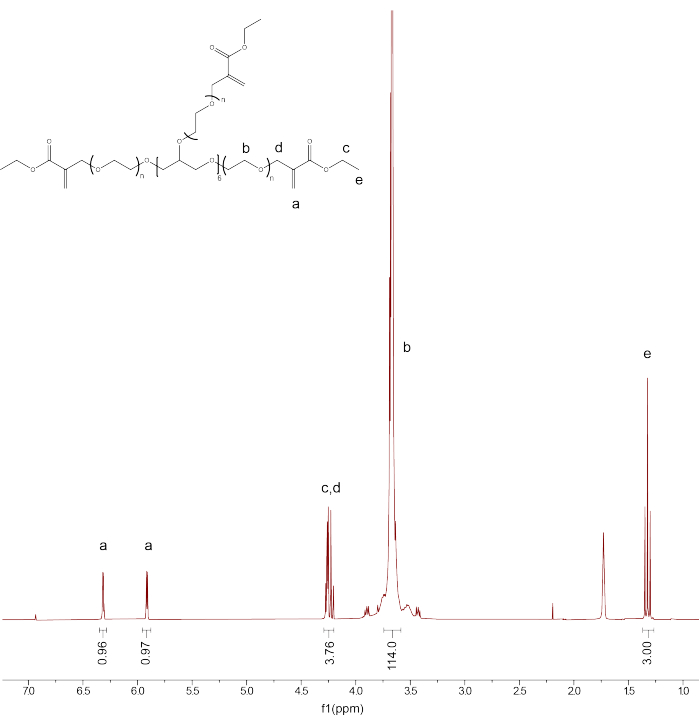
Figura 1: La RMN protonica ha confermato il successo della funzionalizzazione di PEGαMA. L'analisi NMR è stata eseguita nel cloroformio-D (CDCl3) e ha mostrato la funzionalizzazione del 96,5%. PEGαMA 1 H NMR (300 MHz, CDCl3): d (ppm) 1.36(t, 3H, CH 3-),3.71 (s, 114H, PEG CH 2-CH 2), 4.29 (t, s, 4H, -CH 2-C(O)-O-O, -O-CH2-C(=CH 2)-), 5.93 (q, 1H, -C=CH 2), 6.34 (q, 1H, -C=CH 2). Fare clic qui per visualizzare una versione più grande di questa figura.
2. Progettazione del modello e configurazione della biostampante 3D
NOTA: Una stampante 3D disponibile in commercio (vedi Tabella dei materiali) è stata modificata sostituendo l'estrusore termoplastico con un estrusore a pompa a siringa costruito su misura e adattato da Hinton et al.20. I progetti open source sono disponibili online: https://3d.nih.gov/users/awfeinberg.
- Aprire il software Fusion 360 (vedere Tabella dei materiali) e creare un progetto 3D di cilindri cavi assistiti da computer.
NOTA: Un file scaricabile che può essere utilizzato per questo passaggio e che imita la geometria dei vasi sanguigni è disponibile nel file supplementare 1. - Salvare il file e aprirlo all'interno del software Slic3r (vedi Tabella dei materiali). Ricontrolla che tutti i parametri siano come desiderato, quindi premi il pulsante di esportazione G-code. Salvare il codice G sul computer.
- Aprire il software Pronterface (vedere Tabella dei materiali) e caricare il file G-code.
NOTA: Il software Pronterface si interfaccia con la biostampante e fornisce un controllo dell'input hardware sufficiente. Un file G-code utilizzabile può essere trovato in File supplementare 2. - Trasferire la biostampante e tutte le parti associate in una cabina di biosicurezza (BSC) utilizzando tecniche asettiche.
- Assemblare una punta di ago smussata da 30 g di lunghezza 0,5" (vedere Tabella dei materiali) alla siringa di vetro da stampa e mettere da parte.
- Collegare il cavo di alimentazione della biostampante a una presa. Premere il pulsante di accensione rosso sulla parte anteriore della biostampante per accenderla. Collegare il cavo USB (Universal Serial Bus) tra il computer e la biostampante e assicurarsi che tutti i collegamenti dei cavi siano stabiliti e collegati.
3. Preparazione del bagno di supporto e dei reagenti
NOTA: Eseguire tutte le fasi in una cabina di biosicurezza utilizzando tecniche asettiche.
- Preparare il terreno di coltura cellulare costituito da SmBM Basal Medium (CC-3181) e integratori SmGM-2 SingleQuots (CC-4149), escluso il siero fetale bovino (FBS), secondo le istruzioni del produttore. Conservare a 4 °C fino al momento dell'utilizzo.
- Aliquotare 50 mL del terreno di coltura cellulare e aggiungere l'1% v/v di FBS (CC-4149) (vedere la tabella dei materiali) per ottenere un terreno a basso contenuto di siero. Conservare a 4 °C fino al momento dell'utilizzo.
- Risospendere il liquame di gelatina in polvere secondo le istruzioni del produttore utilizzando terreni di coltura cellulare sterili senza FBS come solvente (vedere la tabella dei materiali). Immediatamente prima dell'uso, regolare il pH finale dell'impasto di gelatina a pH 9 utilizzando idrossido di potassio (KOH) 2 M e/o acido cloridrico (HCl) 2 M per regolare il pH della soluzione secondo necessità utilizzando un pHmetro.
- Riempire il numero desiderato di pozzetti di una piastra da 24 pozzetti ciascuno riempito per circa metà utilizzando 1 mL di impasto di gelatina per pozzetto utilizzando una siringa senza ago.
NOTA: Riempire uniformemente il centro dei pozzetti e verificare che non esistano sacche d'aria. Picchiettare la piastra per distribuire uniformemente il liquame di microparticelle. Regolare l'altezza e il volume del liquame per pozzetto in base alle esigenze per adattarsi alle dimensioni e alla forma di ogni bioprint. Gli utenti possono creare una siringa fatta in casa per trasferire l'impasto di gelatina in ogni pozzetto. Questo può essere fatto aggiungendo uno stantuffo della siringa di dimensioni corrette in una provetta da 50 mL già contenente l'impasto di gelatina compattato sul fondo. Durante l'inserimento dello stantuffo, inserire un piccolo filo guida lungo la provetta per favorire la fuoriuscita dell'aria, quindi rimuoverlo quando lo stantuffo è a contatto con l'impasto di gelatina. Immediatamente prima dell'uso, tagliare la punta della provetta con una lama di rasoio per creare un foro da cui l'impasto di gelatina possa estrudere e premere sullo stantuffo. - Posizionare la piastra a 24 pozzetti riempita al centro del tavolino della biostampante e fissarla al tavolino.
NOTA: La Figura 2 mostra una configurazione generica della biostampante. Posizionare un elastico attorno alla fase di stampa per fissare una piastra a 24 pozzetti alla piattaforma e impedirne il movimento.

Figura 2: Configurazione di base della biostampa 3D. La biostampante è stata installata all'interno di un ambiente sterile, come una cabina di biosicurezza, e la testina di stampa è stata assemblata in modo che la siringa di vetro e l'ago venissero abbassati verticalmente nell'area di stampa del bagno di supporto sottostante. Fare clic qui per visualizzare una versione più grande di questa figura.
4. Colture cellulari
NOTA: Eseguire tutte le fasi in una cabina di biosicurezza utilizzando tecniche asettiche.
- Scongelare le cellule HPAAF (ottenute commercialmente, vedere la tabella dei materiali) ed espanderle in matracci di plastica trattati con coltura tissutale T-75 contenenti SmBM Basal Medium (CC-3181) e tutti gli integratori SmGM-2 SingleQuots (CC-4149) secondo le istruzioni del produttore (vedere la tabella dei materiali).
NOTA: Devono essere utilizzati protocolli di coltura cellulare standard per le cellule aderenti, mantenendo le cellule a 37 °C e 5% di CO2 e reintegrando il terreno ogni pochi giorni. - Una volta che gli HPAAF hanno raggiunto ~80-90% di confluenza, aspirare il terreno e risciacquare le cellule una volta con soluzione salina tamponata con fosfato (PBS).
- Aggiungere circa 4 mL di tripsina-EDTA allo 0,05% preriscaldato a ciascun matraccio T-75. Inclinare il matraccio per assicurarsi che l'intera superficie della coltura cellulare sia ricoperta da una soluzione di tripsina-EDTA allo 0,05%. Incubare i palloni per 3-5 minuti a 37 °C e controllare il distacco delle cellule.
- Una volta che le cellule galleggiano, aggiungere almeno 6 mL di Dulbecco's Modified Eagle Medium (DMEM) a ciascun matraccio e trasferire le cellule in una provetta conica da 50 mL.
- Centrifugare la sospensione cellulare a 300 x g per 5 minuti a temperatura ambiente per pellettare le cellule. Aspirare il surnatante dal pellet cellulare e risospendere le cellule in terreni da 1-3 mL con FBS utilizzando una pipetta da 1000 μL, garantendo una sospensione a cellula singola.
- Trasferire 10 μL della sospensione cellulare in una provetta per microcentrifuga. Aggiungere 10 μL di soluzione di Trypan Blue e mescolare bene. Utilizzare 10 μL di questa miscela per contare le cellule all'interno di un emocitometro utilizzando un microscopio ottico invertito.
NOTA: Per ottenere una concentrazione finale di bioink di 4 x 106 cellule/mL, sono stati messi da parte 800.000 fibroblasti per ogni 200 μL di bioink.
5. Preparazione del bioink idrogel
NOTA: La preparazione del bioink è stata adattata da Davis-Hall et al.5. I passaggi 5.1-5.2 possono essere completati in parallelo con i passaggi 4.1-4.3 per ridurre al minimo il tempo tra la raccolta delle cellule e la risospensione nel bioink. Eseguire le fasi in una cabina di biosicurezza utilizzando una tecnica asettica.
- Preparare una soluzione di tris(2-carbossietil) fosfina (TCEP) a pH 7 da 20 mM e un filtro sterile utilizzando un filtro per siringa da 0,2 μm. Immediatamente prima dell'uso, aggiungere 2 M KOH e/o 2 M HCl per regolare il pH della soluzione secondo necessità. Misurare con il pHmetro e regolare di conseguenza.
NOTA: TCEP riduce i legami disolfuro. - Preparare una soluzione madre 0,25 mg/mL di PEGαMA risosspesa in terreni di coltura cellulare sterili senza FBS, soluzioni madre 250 mM di 1,4-ditiotreitolo (DTT), reticolante degradabile MMP2 e peptide CGRGDS (RGD) (vedere Tabella dei materiali), risospendendo il tutto in TCEP sterile da 20 mM e una soluzione madre al 15% in peso di poli(ossido di etilene) (PEO) in acqua distillata (DI) utilizzando pipette secondo necessità.
- Seguendo la Tabella 1 come guida, combinare le rispettive quantità necessarie di PEGαMA, DTT, linker degradabile MMP2, PEO, CGRGDS e terreni di coltura cellulare a basso contenuto di siero insieme ai fibroblasti in una provetta conica da 50 mL.
NOTA: Si consiglia di controllare il pH con strisce di pH dopo aver aggiunto tutti i terreni di coltura cellulare tranne quelli in quanto questa combinazione dovrebbe portare a un pH molto vicino a 6,2. Se sono necessarie ulteriori regolazioni del pH, tenere traccia della quantità di volume aggiuntivo necessaria per regolare il pH della soluzione precursore. Portare il volume totale a 200 μL aggiungendo il volume rimanente del terreno di coltura cellulare meno l'eventuale volume aggiunto durante la regolazione finale del pH. - Mescolare il bioink utilizzando una pipetta a spostamento positivo per assicurarsi che le celle siano singole e confermare che la soluzione finale del precursore sia a pH 6,2 per prevenire la polimerizzazione catalizzata dalla base durante la biostampa 3D.
- Caricare il bioink nella siringa di vetro rimuovendo lo stantuffo e utilizzando una siringa separata con una punta dell'ago smussata da 1,5" di lunghezza 15 gauge (vedere la tabella dei materiali) attaccata per trasferire il bioink dalla provetta da centrifuga alla siringa, facendo attenzione a non formare bolle d'aria all'interno della soluzione.
- Posizionare la siringa di vetro all'interno della testina di stampa e collegare i componenti della testina di stampa in modo che tutto sia saldamente assemblato e pronto per la stampa.
NOTA: A questo punto, la siringa di vetro all'interno della testina di stampa dovrebbe avere una punta dell'ago smussata da 30 gauge e 0.5" di lunghezza attaccata ad essa per la stampa.
| Componente | Concentrazione della soluzione madre | Importo da aggiungere |
| PEGαMA | 0,25 mg/ml | 140 μL |
| Digitale terrestre | 250 mM | 12,24 μL |
| Reticolante degradabile MMP2 | 250 mM | 5,25 μL |
| RGD (Visualizzazione del materiale RG | 250 mM | 1,6 μL |
| PEO (Elettroerosione) | 15% in peso | 33,33 μL |
| Terreni di attivazione e/o reagenti per la regolazione del pH | - | 7,58 μL |
| Fibroblasti | - | 800000 celle |
Tabella 1: Esempi di volumi necessari per preparare 200 μL di bioink (soluzione di precursori di idrogel e cellule di fibroblasti).
6.3D bioprinting
NOTA: Eseguire tutte le fasi in una cabina di biosicurezza utilizzando tecniche asettiche.
- Utilizzando le frecce direzionali all'interno del software Pronterface, regolare manualmente la posizione dell'ago di estrusione al centro di un pozzetto e all'interno del liquame del bagno di supporto. Lasciare almeno 1 mm di fango di supporto sotto la punta dell'ago.
NOTA: Il software non è in grado di dire dove si trova l'ago all'interno dello spazio. Spetta completamente all'utente spostare l'ago facendo clic manualmente sulle frecce all'interno del software (ad esempio, facendo clic sulla freccia su si sposterà l'ago verso l'alto o lontano dalla piattaforma di stampa, ecc.). Manovrare l'ago con attenzione per assicurarsi che non colpisca alcun bordo del pozzo. - Una volta che la punta dell'ago si trova al centro del liquame all'interno del pozzetto, premere il pulsante di avvio all'interno della superficie di alimentazione e attendere il completamento della stampa per ottenere i costrutti, come dimostrato nella Figura 3A.
NOTA: Per biostampare un costrutto utilizzando il file fornito (File supplementare 1), ci vorranno circa 3 minuti. Ci vogliono circa 5 minuti per orientare e spostare l'ago e quindi stampare un costrutto completamente dall'inizio alla fine. - Ripetere i passaggi da 6.1 a 6.2 fino a raggiungere il numero di costrutti bioprinted desiderati.
NOTA: Si consiglia di creare più costrutti del necessario per tenere conto di eventuali stampe non riuscite. Se si verifica un guasto, passare al pozzetto successivo, ripristinare tutto e ripetere nuovamente i passaggi 6.1-6.2. - Lasciare la piastra a temperatura ambiente e coprirla nel BSC per 1 ora dopo che la stampa è terminata per consentire la polimerizzazione catalizzata dalla base dell'idrogel fototabile.
- Posizionare la piastra del pozzetto contenente i costrutti biostampati in 3D in un incubatore sterile a 37 °C e lasciarli per 12-18 ore per sciogliere il liquame del bagno di supporto.
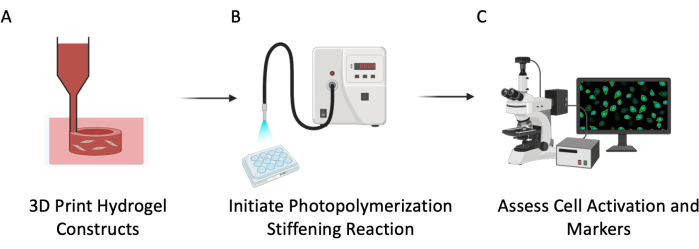
Figura 3: Schema sperimentale. Questo protocollo è stato descritto in tre fasi principali: (A) tubi cavi PEGαMA di bioprinting 3D con cellule incorporate per imitare la vascolarizzazione polmonare. (B) Fotoinizio della reazione di omopolimerizzazione per irrigidire il microambiente cellulare. (C) Valutazione dei marcatori cellulari per la proliferazione e l'attivazione. Fare clic qui per visualizzare una versione più grande di questa figura.
7.3D coltura costruttiva biostampata e fotoirrigidimento
NOTA: Tutte le fasi devono essere eseguite in una cabina di biosicurezza utilizzando tecniche asettiche.
- Preparare una soluzione madre di 2,2 mM di litio fenil-2,4,6-trimetilbenzoilfosfinato (LAP) (vedere Tabella dei materiali) in PBS e filtro sterile utilizzando un filtro a siringa da 0,2 μm. Tenere la soluzione LAP al riparo dalla luce.
- Dopo 12-18 ore, cambiare il supporto che circonda i costrutti biostampati. Rimuovere manualmente il terreno e il bagno di supporto in gelatina sciolta all'interno dei pozzetti e fare attenzione a non disturbare i costrutti biostampati.
NOTA: È utile rimuovere lentamente il supporto tenendo la piastra con un angolo di 45° in modo che i costrutti emergano all'interno del pozzetto e possano essere visti. Una bombola di idrogel trasparente dovrebbe essere identificabile in ogni pozzetto con una stampa corretta (Figura 4A). - Aggiungere un volume appropriato di terreno a basso contenuto di siero a ciascun pozzetto.
NOTA: Per una piastra a 24 pozzetti, 700 μL di terreno per pozzetto devono coprire completamente i costrutti biostampati. Regolare secondo necessità. - Rimettere la piastra nell'incubatore e cambiare il terreno sui campioni ogni 3 giorni o in conformità con il disegno sperimentale.
- Ventiquattro ore prima del momento di irrigidimento desiderato, rimuovere i terreni dai campioni e sostituirli con terreni a basso contenuto di siero integrati con 2,2 mM di LAP sterile.
NOTA: Per etichettare in modo fluorescente la struttura, gonfiare i costrutti biostampati in 3D in PBS integrato con 10 μM di metacrilossietiltiocarbamil rodamina B (vedere Table dei materiali) durante la notte, quindi irrigidire come descritto nel passaggio 7.6 per etichettare fluorescente la struttura. Trasferire in PBS per 2 giorni a 4 °C per rimuovere la rodamina in eccesso e l'immagine utilizzando un filtro TRITC (Figura 4B,C). - Al momento dell'irrigidimento desiderato, rimuovere metà del materiale dai pozzetti da irrigidire e posizionare la piastra con il coperchio fuori dalla luce UV. Accendi la luce UV e irrigidisci questi costrutti applicando una luce da 10 mW/cm2 a 365 nm per 5 minuti utilizzando Omnicure (vedi Tabella dei materiali) e un filtro passa-banda da 365 nm (Figura 3B).
NOTA: Utilizzare il radiometro/fotometro per verificare che l'intensità della luce sia corretta prima di esporre le cellule alla luce UV. - Rimuovere i terreni rimanenti da questi pozzetti e aggiungere terreni freschi a basso contenuto di siero in ciascun pozzetto. Rimettere la piastra nell'incubatrice.
- Estrarre la piastra dall'incubatrice ed eseguire lo studio di attivazione dei fibroblasti nel momento desiderato dopo il passaggio 9.
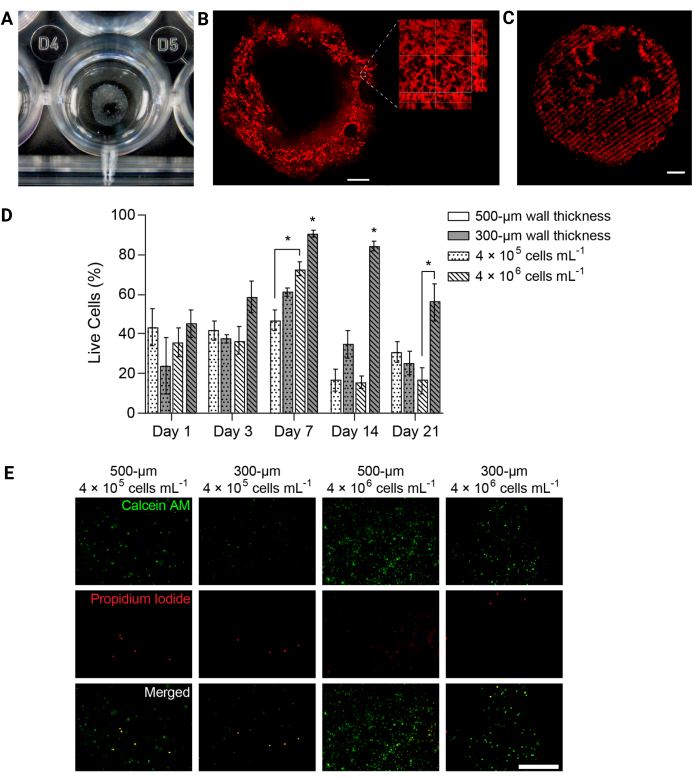
Figura 4: Le strutture idrogel biostampate in 3D hanno supportato la vitalità cellulare nel tempo. (A) Fotografia della struttura dell'idrogel stampata in 3D in una piastra a 24 pozzetti. (B) Proiezione di massima intensità dell'idrogel stampato in 3D PEGαMA marcato in modo fluorescente. Barra della scala = 1 mm. La microscopia a ingrandimento più elevato ha mostrato pori all'interno della struttura dell'idrogel indotti da microparticelle di gelatina nel bagno di supporto per la biostampa FRESH. (C) Il tubo PEGαMA stampato in 3D con regioni irrigidite marcate in fluorescenza ripreso su un microscopio confocale (z-stack da 100 μm visualizzato come proiezione di massima intensità) ha mostrato il controllo spaziale sull'irrigidimento in 3D. Barra della scala = 500 μm. (D) Vitalità HPAAF in costrutti biostampati in 3D misurata mediante saggi Vivi/Morti. I costrutti con uno spessore di 300 μm e 4 × 106 cellule/mL hanno superato tutte le altre condizioni in ogni momento. La vitalità ha raggiunto il picco il giorno 7. Questa condizione e il punto temporale sono stati selezionati per esperimenti futuri. Le colonne mostrano la media ± SEM, n = 3. *, p < 0,05, ANOVA, Tukey HSD. (E) Immagini confocali rappresentative di cellule in costrutti 3D colorati con reagente vivo/morto al giorno 7, il punto temporale con la maggiore vitalità complessiva. La calceina AM ha marcato le cellule vive in verde e lo ioduro di propidio ha contrassegnato le cellule morte in rosso. La colonna più a destra mostra che la condizione più performante aveva una distribuzione cellulare uniforme e un'alta percentuale di cellule vive. Barra della scala = 500 μm. Riprodotto con il permesso di Davis-Hall et al.5. Fare clic qui per visualizzare una versione più grande di questa figura.
8. La valutazione della vitalità dei fibroblasti
- Nei punti temporali di vitalità desiderati, colorare con calceina AM e ioduro di propidio (vedi Tabella dei materiali).
NOTA: Per riassumere, i terreni devono essere rimossi da ciascun pozzetto e i costrutti devono essere risciacquati con PBS sterile. Incubare i costrutti in una soluzione colorante viva/morta per 40 minuti a 37°C su un bilanciere. La soluzione colorante deve contenere calceina AM (diluizione 1:1000) e ioduro di propidio (diluizione 1:1000) per identificare le cellule vive o morte all'imaging. - Trasferire i costrutti in PBS sterile e visualizzarli immediatamente su un microscopio a fluorescenza confocale. Acquisire tre diverse immagini z-stack da 100 μm per campione per punto temporale ed esprimere la vitalità come percentuale media di cellule vive (Figura 4D,E).
9. La valutazione dell'attivazione dei fibroblasti
- Preparare il 3% p/v di albumina sierica bovina (BSA) e lo 0,1% v/v di Tween 20 in PBS. Questa soluzione sarà indicata come soluzione di immunofluorescenza (IF).
- Nei momenti desiderati, rimuovere i terreni dai pozzetti dei campioni e risciacquare i costrutti con PBS. Sostituire il PBS con il 4% di paraformaldeide (PFA) e mantenere questi campioni a 37 °C per 30 minuti su un bilanciere. Quindi, sostituire il 4% di PFA con 100 mM di glicina in PBS e lasciare questi campioni su un bilanciere a temperatura ambiente (RT) per altri 15 minuti.
- Successivamente, trasferire questi campioni nei criostampi Tissue-Tek, coprire completamente il campione con una soluzione a temperatura di taglio ottimale (OCT) (vedere la tabella dei materiali) e lasciare che l'OCT si diffonda nei campioni per 12-18 ore a 4 °C.
- Congelare i campioni imbevuti di OCT in 2-metilbutano utilizzando azoto liquido. Riempire una scatola di polistirolo o un altro contenitore appropriato con azoto liquido e quindi posizionare un secondo contenitore riempito con 2-metilbutano all'interno dell'azoto liquido in modo che sia sommerso almeno a metà. Utilizzare una pinza per tenere ogni criostampaggio contenente un campione coperto da OCT in 2-metilbutano raffreddato con azoto liquido fino a quando non è visibilmente congelato. Questi campioni possono essere conservati a -80 °C fino a quando non sono pronti per la criosezione.
ATTENZIONE: I dispositivi di protezione individuale (DPI) come guanti protettivi dal freddo, un grembiule protettivo dal freddo e una visiera forniti nel kit di sicurezza criogenica (vedere la tabella dei materiali) devono essere utilizzati durante la manipolazione dell'azoto liquido. - Criosezione dei campioni OCT congelati a -22 °C e fissaggio di fette spesse 10 μm su vetrini da microscopio caricati positivamente. Preparare tre vetrini da microscopio con almeno 3-5 criosezioni per vetrino per ogni campione di idrogel 3D.
NOTA: I vetrini del microscopio possono essere conservati in questo punto a -80 °C, se necessario, come punto di arresto. - Fissare le criosezioni in acetone ghiacciato per 15 minuti per aiutare le criosezioni ad aderire ai vetrini. Sciacquare delicatamente le criosezioni con acqua RT per rimuovere eventuali residui di OCT. Lasciare asciugare questi campioni e delineare le criosezioni con una penna idrofobica (vedi Tabella dei materiali).
- Permeabilizzare i campioni a temperatura ambiente con Triton X-100 allo 0,2% v/v in PBS per 10 minuti e quindi bloccare le sezioni con BSA al 5% p/v in PBS per 1 ora a RT.
- Aggiungere l'anticorpo primario di topo anti-actina alfa muscolare liscia umana (αSMA) (diluizione 1:250) (vedere Tabella dei materiali) alla soluzione IF. Conservare questi campioni sezionati con l'anticorpo primario per una notte a 4 °C. Risciacquare i campioni 3 volte con una soluzione IF.
- Incubare le sezioni in soluzione IF contenente l'anticorpo secondario anti-topo Alexa Fluor 555 (diluizione 1:250) e due gocce di ActinGreen 488 ReadyProbe (vedere Tabella dei materiali) per millilitro di soluzione IF. Coprire i campioni per tutte le fasi successive con un foglio di alluminio per proteggerli dalla luce e lasciare che la soluzione anticorpale secondaria rimanga sui campioni per 1 ora a RT.
- Risciacquare le sezioni 3 volte con una soluzione di digiuno intermittente. Incubarli in 300 nM 4',6-diamidino-2-filindolo (DAPI) in acqua deionizzata per 15 minuti a RT. Eseguire un risciacquo finale delle sezioni 3 volte con acqua deionizzata.
- Utilizzando 10 μL di un reagente antisbiadimento disponibile in commercio (vedere la tabella dei materiali), coprire le sezioni utilizzando metodi standard.
NOTA: I vetrini montati possono essere conservati al riparo dalla luce in un congelatore a -80 °C fino al momento dell'imaging. - Visualizzare le criosezioni utilizzando un microscopio a fluorescenza (Figura 3C e Figura 5B). Immagine di tre sezioni casuali per diapositiva utilizzando un obiettivo 10x.
NOTA: Le immagini devono essere scattate nei canali DAPI, FITC e TRITC. - Caricare le immagini in ImageJ (NIH). Quantificare la percentuale di cellule αSMA positive come misura dell'attivazione dei fibroblasti (Figura 5A) dividendo il numero totale di cellule αSMA-positive per il numero totale di nuclei cellulari per ciascun campo visivo.
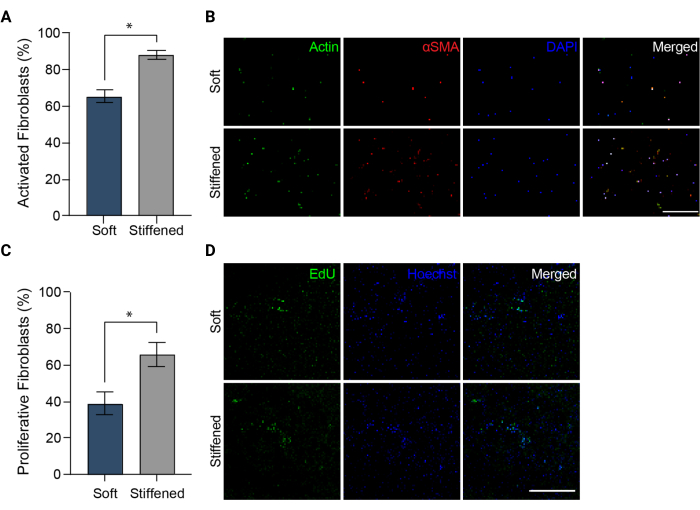
Figura 5: Attivazione dei fibroblasti in modelli biostampati in 3D di avventizia arteriosa polmonare. (A) Attivazione fibrotica in idrogel 3D morbidi e irrigiditi misurata mediante espressione di αSMA. Gli HPAAF nei costrutti irrigiditi erano significativamente più positivi per l'αSMA rispetto alle cellule nei costrutti morbidi. Le colonne rappresentano la media ± SEM, n = 3. *, p < 0,05, test U di Mann-Whitney. (B) Immagini confocali rappresentative dell'immunocolorazione per αSMA, actina e DAPI in idrogel 3D morbidi e irrigiditi. Gli HPAAF nei costrutti irrigiditi hanno mostrato un'immunofluorescenza αSMA più prevalente rispetto alle cellule nei costrutti morbidi. Barra della scala = 250 μm. (C) Proliferazione dei fibroblasti in costrutti biostampati 3D morbidi e irrigiditi misurata dalla positività all'EdU. Gli HPAAF nei costrutti irrigiditi erano significativamente più positivi per le EdU rispetto alle cellule nei costrutti morbidi. Le colonne rappresentano la media ± SEM, n = 3. *, p < 0,05, test U di Mann-Whitney. (D) Immagini confocali rappresentative dell'immunocolorazione per coloranti EdU e Hoechst in idrogel 3D morbidi e irrigiditi. Gli HPAAF nei costrutti irrigiditi hanno mostrato un'immunofluorescenza EdU più prevalente rispetto alle cellule nei costrutti morbidi. Barra della scala = 300 μm. Riprodotto con il permesso di Davis-Hall et al.5. Fare clic qui per visualizzare una versione più grande di questa figura.
10. La valutazione della proliferazione dei fibroblasti
- Ventiquattro ore prima del momento di proliferazione desiderato, rimuovere il terreno di coltura cellulare da ciascun pozzetto e sostituirlo con un terreno a basso contenuto di siero integrato con una soluzione di 10 μM EdU dal kit di proliferazione cellulare disponibile in commercio (vedere Tabella dei materiali). Rimettere i campioni nell'incubatrice per l'incubazione notturna.
- Al momento della proliferazione desiderato, fissare i campioni incubati con EdU utilizzando PFA al 4% a 37 °C per 30 minuti su un bilanciere. Sostituire la soluzione di PFA al 4% con 100 mM di glicina in PBS e incubare i campioni a 37 °C per almeno 15 minuti. Aggiungere l'Hoechst a una concentrazione appropriata per 30 minuti e poi risciacquare i costrutti 2 volte con PBS.
NOTA: I campioni possono essere conservati al riparo dalla luce a 4 °C fino all'imaging. - Immagine di tutti i campioni EdU fissati e conservati utilizzando un microscopio a fluorescenza e le impostazioni e i filtri suggeriti dal produttore del kit di proliferazione cellulare (Figura 3C e Figura 5D). Acquisisci tre diverse immagini z-stack da 100 μm per campione e crea il massimo delle proiezioni da ciascuna di queste z-stack. Misurare la proliferazione dell'HPAAF contando il numero di cellule EdU-positive e dividendo per il numero totale di cellule identificate dalla colorazione di contrasto Hoechst all'interno delle immagini di massima proiezione (Figura 5C).
Risultati
Questo protocollo descrive come biostampare in 3D idrogel fototabili all'interno di un bagno di supporto per creare costrutti in grado di irrigidirsi dinamici e temporali per studiare l'attivazione dei fibroblasti in geometrie che imitano i tessuti umani. In primo luogo, il protocollo ha spiegato come sintetizzare PEGαMA, la spina dorsale di questo sistema polimerico fototabile. Le misurazioni della spettroscopia di risonanza magnetica nucleare (NMR) hanno mostrato una funzionalizzazione riuscita del PEGαMA al 96,5% (<...
Discussione
Le reazioni di polimerizzazione a doppio stadio in risposta all'esposizione controllata alla luce possono irrigidire i biomateriali con controllo spaziale e temporale. Diversi studi hanno sfruttato questa tecnica per valutare le interazioni cellula-matrice in varie piattaforme 5,8,9,10,11,21,22,23.
Divulgazioni
Gli autori non hanno conflitti di interesse da rivelare. Parti di questo manoscritto sono riprodotte con il permesso di © IOP Publishing https://doi.org/10.1088/1758-5090/aca8cf. 5 Tutti i diritti riservati.
Riconoscimenti
Gli autori desiderano ringraziare il Dr. Adam Feinberg (Carnegie Mellon University) e coloro che hanno ospitato il 3D Bioprinting Open-Source Workshop. Queste persone hanno reso possibile l'apprendimento delle tecniche di bioprinting FRESH e la costruzione della biostampante 3D utilizzata per questi studi. Inoltre, gli autori vorrebbero riconoscere Biorender.com, che è stato utilizzato per produrre figure in questo manoscritto. Questo lavoro è stato sostenuto da più gruppi o fonti di finanziamento, tra cui la Rose Community Foundation (DDH e CMM), un Colorado Pulmonary Vascular Disease Research Award (DDH e CMM), la National Science Foundation nell'ambito dell'Award 1941401 (CMM), il Dipartimento dell'Esercito nell'ambito del premio W81XWH-20-1-0037 (CMM), il National Cancer Institute del NIH nell'ambito del premio R21 CA252172 (CMM), il Ludeman Family Center for Women's Health Research presso l'Università del Colorado Anschutz Medical Campus (DDH e CMM), il National Heart, Lung, and Blood Institute del National Institutes of Health con i premi R01 HL080396 (CMM), R01 HL153096 (CMM), F31 HL151122 (DDH) e T32 HL072738 (DDH e AT).
Materiali
| Name | Company | Catalog Number | Comments |
| AccuMax Radiometer/Photometer Kit | Spectronics Corporation | XPR-3000 | To measure light intensity, used for photostiffening |
| Acetic Acid | Fisher Scientific | BP2401-500 | Used during PEGaMA synthesis |
| Acetone | Fisher Scientific | A184 | Used with the cryosections |
| ActinGreen 488 ReadyProbes | Fisher Scientific | R37110 | Used for staining |
| Aluminum Foil | Reynolds | F28028 | |
| Anhydrous Tetrahydrofuran (THF) | Sigma-Aldrich | 401757-1L | Used during PEGaMA synthesis |
| Argon Compressed Gas | Airgas | AR R300 | Used during PEGaMA synthesis |
| 8 Arm Poly(ethylene glycol)-hydroxyl (PEG-OH) | JenKem Technology | 8ARM-PEG-10K | Used during PEGaMA synthesis |
| 365 nm Bandpass Filter | Edmund Optics | 65-191 | Used for photostiffening |
| Bovine Serum Albumin (BSA) | Fisher Scientific | BP9700-100 | Used during staining process |
| Buchner Funnel | Quark Glass | QFN-8-14 | Used during PEGaMA synthesis |
| Calcein AM | Invitrogen | 65-0853-39 | Used during staining process |
| Celite 545 (Filtration Aid) | EMD Millipore | CX0574-1 | Used during PEGaMA synthesis |
| Charged Microscope Slides | Globe Scientific | 1358W | |
| Chloroform-d | Sigma-Aldrich | 151823-10X0.75ML | Used to characterize PEGaMA |
| Click-iT Plus EdU Cell Proliferation Kit | Invitrogen | C10637 | Used for staining |
| 50 mL Conical Tubes | CELLTREAT | 667050B | |
| Cryogenic Safety Kit | Cole-Parmer | EW-25000-85 | |
| Cryostat | Leica | CM 1850-3-1 | |
| Dialysis Tubing | Repligen | 132105 | |
| 4’,6-Diamidino-2-Phylindole (DAPI) | Sigma-Aldrich | D9542-1MG | Used for staining |
| Diethyl Ether | Fisher Scientific | E1384 | Used during PEGaMA synthesis |
| 1,4-Dithiothreitol (DTT) | Sigma-Aldrich | 10197777001 | Bioink component |
| Dulbecco's Modified Eagle's Medium (DMEM) | Cytiva | SH30271.FS | |
| Filter Paper | Whatman | 1001-090 | Used during PEGaMA synthesis |
| Freezone 2.5L Freeze Dry System | Labconco | LA-2.5LR | Lyophilizer |
| Fusion 360 | Autodesk | N/A | Software download |
| 2.5 mL Gastight Syringe | Hamilton | 81420 | Used for bioprinting |
| 15 Gauge 1.5" IT Series Tip | Jensen Global | JG15-1.5X | Used for bioprinting |
| 30 Gauge 0.5" HP Series Tip | Jensen Global | JG30-0.5HPX | Used for bioprinting |
| Goat Anti-Mouse Alexa Fluor 555 Antibody | Fisher Scientific | A21422 | Used for staining |
| Glycine | Fisher Scientific | C2H5NO2 | Used during staining process |
| Hemocytometer | Fisher Scientific | 1461 | |
| Hoechst | Thermo Scientific | 62249 | Used during staining process |
| Human Pulmonary Artery Adventitial Fibroblasts (HPAAFs) | AcceGen | ABC-TC3773 | From a 2-year-old male patient |
| Hydrochloric Acid (HCl) | Fisher Scientific | A144-500 | Used to pH adjust solutions |
| ImageJ | National Institutes of Health (NIH) | N/A | Free software download |
| ImmEdge® Pen | Vector Laboratories | H-4000 | Used during staining process |
| Incubator | VWR | VWR51014991 | |
| LifeSupport Gelatin Microparticle Slurry (Gelatin Slurry) | Advanced Biomatrix | 5244-10GM | Used for bioprinting |
| Light Microscope | Olympus | CKX53 | Inverted light microscope |
| Lithium Phenyl-2,4,6-Trimethylbenzoylphosphinate (LAP) | Sigma-Aldrich | 900889-5G | Photoinitiator used for photostiffening |
| Liquid Nitrogen | N/A | N/A | |
| LulzBot Mini 2 | LulzBot | N/A | Bioprinter adapted |
| Methacryloxyethyl Thiocarbamoyl Rhodamine B | Polysciences Inc. | 669775-30-8 | |
| 2-Methylbutane | Sigma-Aldrich | M32631-4L | |
| Microman Capillary Pistons CP1000 | VWR | 76178-166 | Positive displacement pipette tips |
| MMP2 Degradable Crosslinker (KCGGPQGIWGQGCK) | GL Biochem | N/A | Bioink component |
| Mouse Anti-Human αSMA Monoclonal Antibody | Fisher Scientific | MA5-11547 | Used for staining |
| OmniCure Series 2000 | Lumen Dynamics | S2000-XLA | UV light source used for photostiffening |
| Paraformaldehyde (PFA) | Electron Microscopy Sciences | 15710 | Used to fix samples |
| pH Meter | Mettler Toledo | FP20 | |
| pH Strips | Cytiva | 10362010 | |
| Phosphate Buffered Saline (PBS) | Hyclone Laboratories, Inc. | Cytiva SH30256.FS | |
| Pipette Set | Fisher Scientific | 14-388-100 | |
| 10 µL Pipette Tips | USA Scientific | 1120-3710 | |
| 20 µL Pipette Tips | USA Scientific | 1183-1510 | |
| 200 µL Pipette Tips | USA Scientific | 1111-0700 | |
| 1000 µL Pipette Tips | USA Scientific | 1111-2721 | |
| Poly(Ethylene Glycol)-Alpha Methacrylate (PEGαMA) | N/A | N/A | Refer to manuscript for synthesis steps |
| Poly(Ethylene Oxide) (PEO) | Sigma-Aldrich | 372773-250G | Bioink component |
| Positive Displacement Pipette | Fisher Scientific | FD10004G | 100-1000 µL |
| Potassium Hydroxide (KOH) | Sigma-Aldrich | 221473-500G | Used to pH adjust solutions |
| ProLong Gold Antifade Reagent | Invitrogen | P36930 | Used during staining process |
| Pronterface | All3DP | N/A | Software download |
| Propidium Iodide | Sigma-Aldrich | P4864-10ML | Used for staining |
| RGD Peptide (CGRGDS) | GL Biochem | N/A | Bioink component |
| Rocker | VWR | 10127-876 | |
| Rotary Evaporator | Thomas Scientific | 11100V2022 | Used during PEGaMA synthesis |
| Rubber Band | Staples | 808659 | |
| Schlenk Flask | Kemtech America | F902450 | Used during PEGaMA synthesis |
| Slic3r | Slic3r | N/A | Software download |
| Smooth Muscle Cell Growth Medium-2 (SmGM-2) BulletKit | Lonza | CC-3182 | Kit contains CC-3181 and CC-4149 components |
| Sodium Hydride | Sigma-Aldrich | 223441-50G | Used during PEGaMA synthesis |
| Sorvall ST 40R Centrifuge | Fisher Scientific | 75-004-525 | |
| Stir Bar | VWR | 58948-091 | |
| Syringe Filter | VWR | 28145-483 | Used to sterile filter solutions |
| T-75 Tissue-Cultured Treated Flask | VWR | 82050-856 | Used for cell culture work |
| Tissue-Tek Cyromold | Sakura | 4557 | |
| Tissue-Tek O.C.T Compound (OCT) | Sakura | 4583 | |
| Tris(2-Carboxyethyl) Phosphine (TCEP) | Sigma-Aldrich | C4706-2G | |
| Triton X-100 | Fisher Bioreagents | C34H622O11 | Used during staining process |
| Trypan Blue | Sigma-Aldrich | T8154-20ML | Used for cell culture work |
| 0.05% Trypsin-EDTA | Gibco | 25-300-062 | Used for cell culture work |
| Tween 20 | Fisher Bioreagents | C58H114O26 | Used during staining process |
| Upright Microscope | Olympus | BX63F | Fluorescent microscope capabilities |
| Water Bath | PolyScience | WBE20A11B | |
| 24-Well Tissue Culture Plates | Corning | 3527 |
Riferimenti
- Ahrens, J. H., et al. Programming cellular alignment in engineered cardiac tissue via bioprinting anisotropic organ building blocks. Advanced Materials. 34 (26), e2200217 (2022).
- Lin, N. Y. C., et al. Renal reabsorption in 3D vascularized proximal tubule models. Proceedings of the National Academy of Sciences of the United States of America. 116 (12), 5399-5404 (2019).
- Grigoryan, B., et al. Multivascular networks and functional intravascular topologies within biocompatible hydrogels. Science. 364 (6439), 458-464 (2019).
- Kang, Y., Datta, P., Shanmughapriya, S., Ozbolat, I. T. 3D bioprinting of tumor models for cancer research. ACS Applied Biomaterials. 3 (9), 5552-5573 (2020).
- Davis-Hall, D., Thomas, E., Pena, B., Magin, C. M. 3D-bioprinted, phototunable hydrogel models for studying adventitial fibroblast activation in pulmonary arterial hypertension. Biofabrication. 15 (1), (2022).
- Mirdamadi, E., Tashman, J. W., Shiwarski, D. J., Palchesko, R. N., Feinberg, A. W. FRESH 3D bioprinting of a full-size model of the human heart. ACS Biomaterials Science & Engineering. 6 (11), 6453-6459 (2020).
- Shiwarski, D. J., Hudson, A. R., Tashman, J. W., Feinberg, A. W. Emergence of FRESH 3D printing as a platform for advanced tissue biofabrication. APL Bioengineering. 5 (1), 010904 (2021).
- Petrou, C. L., et al. Clickable decellularized extracellular matrix as a new tool for building hybrid hydrogels to model chronic fibrotic diseases in vitro. Journal of Materials Chemistry B. 8 (31), 6814-6826 (2020).
- Hewawasam, R. S., Blomberg, R., Serbedzija, P., Magin, C. M. Chemical modification of human decellularized extracellular matrix for incorporation into phototunable hybrid hydrogel models of tissue fibrosis. ACS Applied Materials & Interfaces. 15 (12), 15071-15083 (2023).
- Saleh, K. S., et al. Engineering hybrid hydrogels comprised healthy or diseased decellularized extracellular matrix to study pulmonary fibrosis. Cellular and Molecular Bioengineering. 15 (5), 505-519 (2022).
- Guvendiren, M., Burdick, J. A. Stiffening hydrogels to probe short- and long-term cellular responses to dynamic mechanics. Nature Communications. 3, 792 (2012).
- Rosales, A. M., Vega, S. L., DelRio, F. W., Burdick, J. A., Anseth, K. S. Hydrogels with reversible mechanics to probe dynamic cell microenvironments. Angewandte Chemie International Edition English. 56 (40), 12132-12136 (2017).
- Wynn, T. A., Ramalingam, T. R. Mechanisms of fibrosis: therapeutic translation for fibrotic disease. Nature Medicine. 18 (7), 1028-1040 (2012).
- Huertas, A., Tu, L., Humbert, M., Guignabert, C. Chronic inflammation within the vascular wall in pulmonary arterial hypertension: more than a spectator. Cardiovascular Research. 116 (5), 885-893 (2020).
- Kendall, R. T., Feghali-Bostwick, C. A. Fibroblasts in fibrosis: novel roles and mediators. Frontiers in Pharmacology. 5, 123 (2014).
- Parker, M. W., et al. Fibrotic extracellular matrix activates a profibrotic positive feedback loop. The Journal of Clinical Investigation. 124 (4), 1622-1635 (2014).
- Habiel, D. M., Hogaboam, C. Heterogeneity in fibroblast proliferation and survival in idiopathic pulmonary fibrosis. Frontiers in Pharmacology. 5, 2 (2014).
- Hu, C. J., Zhang, H., Laux, A., Pullamsetti, S. S., Stenmark, K. R. Mechanisms contributing to persistently activated cell phenotypes in pulmonary hypertension. The Journal of Physiology. 597 (4), 1103-1119 (2019).
- Li, M., et al. Emergence of fibroblasts with a proinflammatory epigenetically altered phenotype in severe hypoxic pulmonary hypertension. The Journal of Immunology. 187 (5), 2711-2722 (2011).
- Hinton, T. J., et al. Three-dimensional printing of complex biological structures by freeform-reversible embedding of suspended hydrogels. Science Advances. 1 (9), e1500758 (2015).
- Brown, T. E., et al. Secondary photocrosslinking of click hydrogels to probe myoblast mechanotransduction in three dimensions. Journal of the American Chemical Society. 140 (37), 11585-11588 (2018).
- Ondeck, M. G., et al. Dynamically stiffened matrix promotes malignant transformation of mammary epithelial cells via collective mechanical signaling. Proceedings of the National Academy of Sciences of the United States of America. 116 (9), 3502-3507 (2019).
- Caliari, S. R., et al. Stiffening hydrogels for investigating the dynamics of hepatic stellate cell mechanotransduction during myofibroblast activation. Scientific Reports. 6, 21387 (2016).
- Liu, F., et al. Feedback amplification of fibrosis through matrix stiffening and COX-2 suppression. Journal of Cell Biology. 190 (4), 693-706 (2010).
- Tschumperlin, D. J., Ligresti, G., Hilscher, M. B., Shah, V. H. Mechanosensing and fibrosis. The Journal of Clinical Investigation. 128 (1), 74-84 (2018).
- Chelladurai, P., Seeger, W., Pullamsetti, S. S. Matrix metalloproteinases and their inhibitors in pulmonary hypertension. European Respiratory Journal. 40 (3), 766-782 (2012).
- Caracena, T., et al. Alveolar epithelial cells and microenvironmental stiffness synergistically drive fibroblast activation in three-dimensional hydrogel lung models. Biomaterials Science. 10 (24), 7133-7148 (2022).
- Ruskowitz, E. R., DeForest, C. A. Proteome-wide analysis of cellular response to ultraviolet light for biomaterial synthesis and modification. ACS Biomaterials Science & Engineering. 5 (5), 2111-2116 (2019).
- Kruse, C. R., et al. The effect of pH on cell viability, cell migration, cell proliferation, wound closure, and wound reepithelialization: In vitro and in vivo study. Wound Repair and Regeneration. 25 (2), 260-269 (2017).
- Filippi, M., et al. Perfusable biohybrid designs for bioprinted skeletal muscle tissue. Advanced Healthcare Materials. , e1500758 (2023).
- Matthiesen, I., et al. Astrocyte 3D culture and bioprinting using peptide-functionalized hyaluronan hydrogels. Science and Technology of Advanced Materials. 24 (1), 2165871 (2023).
- Xu, L., et al. Bioprinting a skin patch with dual-crosslinked gelatin (GelMA) and silk fibroin (SilMA): An approach to accelerating cutaneous wound healing. Materials Today Bio. 18, 100550 (2023).
- Bliley, J. M., Shiwarski, D. J., Feinberg, A. W. 3D-bioprinted human tissue and the path toward clinical translation. Science Translational Medicine. 14 (666), eabo7047 (2022).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneEsplora altri articoli
This article has been published
Video Coming Soon