需要订阅 JoVE 才能查看此. 登录或开始免费试用。
Method Article
用于过度使用诱导的肌腱病 体内 模型的被动踝关节背屈测试系统
摘要
该协议提出了一种测试系统,用于在大鼠跟腱中诱导可量化和受控的疲劳损伤,用于过度使用诱导的肌腱病 的体内 模型。该过程包括将大鼠的脚踝固定到关节致动器上,该致动器使用定制编写的 MATLAB 脚本执行被动踝关节背屈。
摘要
肌腱病是一种慢性肌腱疾病,会导致疼痛和功能丧失,由肌腱反复超负荷和恢复时间有限引起。该协议描述了一种测试系统,该系统通过被动背屈对大鼠跟腱周期性地施加机械载荷。定制编写的代码包括循环加载前和循环加载后测量,以评估加载协议以及基于反馈控制的循环疲劳加载方案的影响。
我们使用了 25 只 Sprague-Dawley 大鼠进行这项研究,每组 5 只大鼠接受 500、1,000、2,000、3,600 或 7,200 个循环的疲劳负荷。计算了滞后、峰值应力和加载和卸载模量的循环加载前和循环加载后测量值之间的百分比差异。结果表明,该系统可以根据施加的载荷数量对跟腱造成不同程度的损伤。该系统提供了一种创新方法,可将量化和生理上不同程度的循环载荷应用于跟腱,用于疲劳引起的过度使用肌腱损伤 的体内 模型。
引言
由于肌腱将肌肉与骨骼连接起来,并在其一生中经历日常重复运动,因此它们极易出现过度使用性损伤,这些损伤是疼痛和限制性的,并导致机械功能受损,影响 30-50% 的人口1。肌腱病是一种慢性疾病,由于重复的疲劳运动和愈合不足到受伤前的水平而被认为是过度使用性损伤。上肢和下肢均常受累,包括肩袖、肘部、跟腱和髌腱2、3、4、5。跟腱病常见于涉及跑步和跳跃的活动中,尤其是参与田径、中长跑、网球和其他球类运动的运动员,影响 7-9% 的跑步者 6,7。跑步和跳跃造成的损伤也可能导致踝关节背屈受限,这是跟腱和髌腱病的危险因素 8,9,10。因此,需要更好地评估和表征肌腱病,本研究可以将其作为过度使用性跟腱损伤的被动踝背屈的大鼠模型。
以前使用小动物模型的工作旨在研究肌腱病的发展和标志物。这些包括跑步机运动、重复伸展、直接肌腱负荷、胶原酶注射、手术和体外研究 11,12,13,14,15,16。尽管文献受益于使用这些肌腱病模型来识别损伤标志物,但局限性包括在不生理相关的关节运动中加载肌腱,例如肌腱的直接加载,不直接测量施加的负载,例如跑步机研究,以及不使用生理过度使用,例如胶原酶注射, 除其他外。为此,本研究旨在开发一种系统,该系统可无创地将量化负荷施加到跟腱上,并应用于过度使用诱导的肌腱病研究,以填补先前开发的肌腱病小动物模型的空白。我们进行了一项试点研究,以证明该系统在一系列加载周期内会引起机械性能的可重复变化。该系统使生理相关的运动和负荷能够诱发过度使用,同时量化和测量在负荷方案中施加在肌腱上和承受的力。
Access restricted. Please log in or start a trial to view this content.
研究方案
这项研究是根据机构动物护理和使用委员会 (IACUC) 在贝丝以色列女执事医疗中心的批准进行的。使用5%异氟醚麻醉动物进行诱导,2.5%异氟醚维持,并注意避免体温过低。
1. 设置测试系统
- 通过步进电机控制被动踝关节旋转,以施加一致的旋转和扭矩。使用微控制器控制步进电机。使用 3D 位置和方向系统的输入来标记旋转度数。使用扭矩传感器的输出提供反馈控制,以便在未达到阈值限制时增加背屈角度。
- 首先,将微控制器、扭矩传感器、3D 电磁定位和定向系统连接到计算机和电源。使用内部开发的 MATLAB 代码控制定制系统(图 1)。从 GitHub 下载 MATLAB 代码文件,并按照 GitHub 页面说明 (https://github.com/Nazarian-Lab/PassiveAnkleDorsiflexionSystem) 中运行代码的具体说明进行操作。
- 使用代码文件打开 MATLAB。打开 PDImfc 软件,将 3D 电磁定位和定向系统连接到 MATLAB 程序。单击 “连接”|”连续 P&O |StartSockExport()中。使应用程序在后台保持打开状态。
2. 离体和死后
- 通过吸入 CO2 对 6 只 13 周龄的 Sprague-Dawley 大鼠实施安乐死,并通过开胸术对安乐死的辅助方法。解剖右跟腱,跟骨和肌腱交界处完好无损。在-20°C下冷冻,以便稍后进行机械测试。在肌腱解冻、精细解剖并准备进行机械测试后,进行拉伸载荷至失效,以获得肌腱的极限抗拉强度 (UTS)(预紧力为 0.1N,从 0.1 - 1 N 预处理 10 个周期,以 0.1 mm/s 的恒定位移斜坡到失效)。使用15%的UTS作为系统的输入,为后续步骤执行预处理,如步骤3.4所述。
- 对另一组五只动物实施安乐死,使用相同的程序进行力矩、手臂和应变测量。对左腿进行 X 线检查,脚踝背屈 90°,靠近尺子作为参考。打开斐济的X射线图像,以图像中的尺子为参考,测量从踝关节旋转中心到踝关节后部的肌腱力矩臂,作为MATLAB代码中的输入,将步骤2.1中描述的用于预处理的输入力转换为相应的扭矩值,以及输出扭矩和力之间的转换,以进行数据分析。
- 用胶带固定左后肢,用胶带固定膝盖,使膝盖完全伸展。通过推动脚趾轻轻背屈脚踝,以确保踝关节旋转是由于孤立的肌腱而不是涉及周围的软组织而发生的,并且处于张力状态。如果没有紧张或膝盖有运动,请重新贴上夹板。
- 通过去除跟腱周围的皮肤来暴露肌腱。将胶水放在 1/32 英寸的铝珠上,将其放在最靠近跟腱肌腱交界处的游离肌腱上,然后用棉签蘸有生理盐水去除多余的胶水。在整个剩余的手术过程中,反复将生理盐水涂抹在跟腱上,以确保组织的湿润。
- 在施加任何负载之前,使用数字卡尺测量肌腱的横截面积。假设肌腱是一个椭圆形,并一式三份测量宽度和厚度。
- 将大鼠以俯卧姿势放在全身平台上。用一条扎带将脚踝固定在关节致动器上,另一条扎带缠绕在脚趾上,并用两条扎带固定膝盖开叉。旋转车轴,使脚踝完全跖屈。
- 将3D电磁定位定向系统的数字化笔连接到电脑,并打开电源。
- 在指定的循环次数内运行系统代码(在步骤3中更详细地描述)(在这项研究中,六只安乐死的大鼠接受了7,200个循环)。
- 在 0、500、1,000、2,000、3,600 和 7,200 个离体应变测量周期时,暂停循环加载方案,并使用 3D 数字化笔以 5° 的增量测量从跟骨到铝珠的肌腱长度从背屈的 0 到 40°(由于系统的物理限制导致的致动极限)使用 3D 数字化笔交替一式三份。
- 使用从步骤 2.9 获得的长度计算不同角度的肌腱应变,其中每个周期数的初始长度为 0° 背屈。执行线性拟合以获得每个周期数的背屈角和应变之间的关系。使用此关系将原始角度数据转换为应变以进行数据分析。
- 假设肌腱长度测量值为 0° 和 40°,测量横截面积为 0°,使用数字卡尺在 40° 背屈处使用数字卡尺计算肌腱横截面积。在每个循环次数处使用此横截面积将力转换为应力以进行数据分析(应力 = 力/横截面积)。
3.机械加载协议
- 在研究的这一部分,我们使用了 25 只雌性 Sprague-Dawley 11 周龄大鼠,每只 5 只大鼠被随机分配接受 500、1,000、2,000、3,600 或 7,200 个周期的疲劳负荷。
注意:预处理、初始校准以及预测量和后测量大约需要 15 分钟才能运行,循环疲劳载荷方案每个周期需要 1 秒。因此,大鼠麻醉的最长时间约为 2 小时,这是在 IACUC 批准的方案下进行的。 - 将微控制器、扭矩传感器、3D 电磁定位和定向系统连接到计算机和电源。使用内部开发的 MATLAB 代码控制定制系统(图 1)。
- 打开计算机,然后打开包含代码文件的 MATLAB。打开 PDImfc 软件,将 3D 电磁定位和定向系统连接到 MATLAB 程序。单击 “连接”|”连续 P&O | StartSockExport()中。使应用程序在后台保持打开状态。
- 通过在诱导室中吸入用 5% 异氟醚诱导麻醉。诱导后,将动物固定在全身平台上,并附有水基加热元件以保持温度并通过鼻锥附件用 2.5% 异氟醚维持麻醉。在眼睛上使用湿软膏,以防止麻醉期间干燥。
- 将大鼠以俯卧姿势放在全身平台上。用一条扎带将脚踝固定在关节致动器上,另一条扎带缠绕在脚趾上,并用两条扎带固定膝盖开叉。旋转车轴,使脚踝完全跖屈。
注意: 确保扎带不会引起收缩或损伤,注意收紧,如果需要,在扎带和皮肤之间放置纱布以提供一层保护。 - 对于以下涉及运行系统代码的步骤,请单击与特定加载测试对应的代码的每个部分的“在 MATLAB 上运行”。
- 根据跟腱的极限拉伸应力值,将脚踝循环 50 次至极限拉伸应力的 15%,从离 体 拉力到基于步骤 2.1 测量的失效测试。
- 通过将肌腱背屈三次至 12° 对肌腱进行初始校准。使用滞后曲线载荷区域线性区域的斜率来计算曲线的指数区域。
- 以增加的角度逐渐背屈脚踝,直到通过计算曲线载荷区域峰值的斜率(使用内部开发的 MATLAB 代码计算)获得曲线的指数区域,或者直到它旋转到 40°,以先发生者为准。
- 在最终获得的角度处,执行五次循环机械测量作为预紧基线。
- 执行指定次数的循环疲劳载荷方案(在本研究中,为 500、1,000、2,000、3,600 或 7,200 次循环)。
- 每 50 个周期计算磁滞曲线载荷部分的斜率(通过内部开发的 MATLAB 代码计算),以确保其仍处于指数区域。将背屈角增加 1°,除非它已经处于 40°,直到达到这个指数区域。
- 循环加载方案完成后,在最初选择的角度进行五次循环机械测量作为后加载测量,以测量肌腱机械性能。
- 取下扎带和夹板。将动物送回回收室。在动物恢复足够的意识之前,它不会无人看管,然后将其放回笼子。每天监测动物是否有任何不良临床症状,如果存在,则每 72 小时皮下注射一次剂量为 1.2 mg/kg 的丁丙诺啡或进行早期安乐死。在笼子活动 7 天后通过吸入 CO2 对动物实施安乐死,并通过开胸术进行安乐死的辅助方法。
注意:循环载荷应用和机械测量是通过定制的夹具获得的,该夹具由扭矩传感器、3D 打印的踝关节执行器和动物床、3D 电磁定位和定向系统以及旋转轴以实现背屈的步进电机获得,正如我们之前报道的那样 17 组。该系统由步骤 1.2 中提到的 MATLAB 脚本控制。扭矩传感器以及位置和方向系统在整个系统的加载协议中捕获扭矩和位置数据。
4. 数据分析
- 将测量前和测量后数据分别加载到 MATLAB 中。
- 使用公式(1)和(2),根据步骤2.2中测得的力矩臂和在施加的指定载荷数量下测量的横截面积,将扭矩转换为应力:
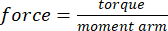 (一)
(一)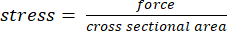 (2)
(2) - 根据从步骤 2.10 获得的转换将角度转换为应变。
- 计算测量前和测量后循环的平均滞后(加载和卸载曲线之间的面积)、峰值应力(循环的最大应力值)和加载和卸载模量(加载的最后 50% 和卸载曲线的前 60% 的线性拟合)。
- 计算步骤 4.4 在测量前和测量后周期之间机械性能的百分比变化。
Access restricted. Please log in or start a trial to view this content.
结果
随着应用循环次数的增加, 体内 肌腱机械性能的降低幅度更大。与 3,600 和 7,200 周期组相比,500 周期组的滞后和加载和卸载模量的降低显着降低 (p < 0.05)(图 2)。虽然从500循环组到3,600循环组,每个循环的峰值应力显着降低,但500和7,200循环组之间没有显着减少。3,600 和 7,200 循环组的滞后、峰值应力以及加载和卸载模量的百分比一致下降。苏木精、曙红和 Masson ?...
Access restricted. Please log in or start a trial to view this content.
讨论
本研究提出了一种使用被动踝关节背屈系统循环加载大鼠跟腱的方法,用于 体内 过度使用诱导的肌腱病模型。该系统的重要性在于它能够隔离跟腱,在不通过手术进入肌腱的情况下施加可量化的载荷,并测量 体内 肌腱特性。
2010 年,Fung 等人提出了大鼠髌腱疲劳模型,并建立了定制测试系统14。他们的研究提出了一种通过暴露肌腱直接加载髌...
Access restricted. Please log in or start a trial to view this content.
披露声明
作者没有利益冲突需要声明。
致谢
我们要感谢我们的资金支持:Joe Fallon 研究基金、Louis Meeks 博士 BIDMC 运动医学实习生研究基金和校内赠款 (AN),均来自 BIDMC 骨科,以及美国国立卫生研究院的支持 (2T32AR055885 (PMW))。
Access restricted. Please log in or start a trial to view this content.
材料
| Name | Company | Catalog Number | Comments |
| 1/32'' Aluminum beads | |||
| 2.5% isoflurane | |||
| 3D digitizing pen | Polhemus, Vermont, NH, USA | ||
| 3D electromagnetic positioning and orientation sensor | Polhemus, Vermont, NH, USA | ||
| 5% isoflurane | |||
| Customized device: 1) Assembly, sensors, 3D printed animal bed and ankle mount actuator | Assembled as described in manuscript | ||
| MATLAB code | MATLAB, Natick, MA, USA | ||
| Microcontroller | Ivrea, Italy | Arduino UNO, Rev3 | |
| Nose cone | |||
| Scalpel and scalpel holder | No. 11 scalpel | ||
| Sprague-Dawley rats | Charles River Laboratories, Wilmington, MA, USA | 11-13 weeks old | |
| Stepper driver | SparkFun Electronics, Niwot, CO 80503 | DM542T | |
| Stepper motor | SparkFun Electronics, Niwot, CO 80503 | 23HE30-2804S | |
| Straight forceps | |||
| Torque sensor assembly | Futek Inc., Irvine, CA, USA | FSH03985, FSH04473, FSH03927 | |
| Water heating pad |
参考文献
- Kaux, J. F., Forthomme, B., Goff, C. L., Crielaard, J. M., Croisier, J. L. Current opinions on tendinopathy. J Sports Sci Med. 10 (2), 238-253 (2011).
- Maffulli, N., Longo, U. G., Kadakia, A., Spiezia, F. Achilles tendinopathy. Foot Ankle Surg. 26 (3), 240-249 (2020).
- Teunis, T., Lubberts, B., Reilly, B. T., Ring, D. A systematic review and pooled analysis of the prevalence of rotator cuff disease with increasing age. J Shoulder Elbow Surg. 23 (12), 1913-1921 (2014).
- von Rickenbach, K. J., Borgstrom, H., Tenforde, A., Borg-Stein, J., McInnis, K. C. Achilles tendinopathy: evaluation, rehabilitation, and prevention. Curr Sports Med Rep. 20 (6), 327-334 (2021).
- Aicale, R., Oliviero, A., Maffulli, N. Management of Achilles and patellar tendinopathy: what we know, what we can do. J Foot Ankle Res. 13 (1), 59(2020).
- Jarvinen, T. A., et al. Achilles tendon injuries. Curr Opin Rheumatol. 13 (2), 150-155 (2001).
- Silbernagel, K. G., Hanlon, S., Sprague, A. Current clinical concepts: conservative management of Achilles tendinopathy. J Athl Train. 55 (5), 438-447 (2020).
- Tayfur, A., et al. Are landing patterns in jumping athletes associated with patellar tendinopathy? A systematic review with evidence gap map and meta-analysis. Sports Med. 52 (1), 123-137 (2022).
- Malliaras, P., Cook, J. L., Kent, P. Reduced ankle dorsiflexion range may increase the risk of patellar tendon injury among volleyball players. J Sci Med Sport. 9 (4), 304-309 (2006).
- Backman, L. J., Danielson, P. Low range of ankle dorsiflexion predisposes for patellar tendinopathy in junior elite basketball players: a 1-year prospective study. Am J Sports Med. 39 (12), 2626-2633 (2011).
- Glazebrook, M. A., Wright, J. R. Jr, Langman, M., Stanish, W. D., Lee, J. M. Histological analysis of achilles tendons in an overuse rat model. J Orthop Res. 26 (6), 840-846 (2008).
- Carpenter, J. E., Flanagan, C. L., Thomopoulos, S., Yian, E. H., Soslowsky, L. J. The effects of overuse combined with intrinsic or extrinsic alterations in an animal model of rotator cuff tendinosis. Am J Sports Med. 26 (6), 801-807 (1998).
- Gao, H. G., et al. Increased serum and musculotendinous fibrogenic proteins following persistent low-grade inflammation in a rat model of long-term upper extremity overuse. PLoS One. 8 (8), e71875(2013).
- Fung, D., et al. Early response to tendon fatigue damage accumulation in a novel in vivo model. J Biomech. 43 (2), 274-279 (2010).
- Ueda, Y., et al. Molecular changes to tendons after collagenase-induced acute tendon injury in a senescence-accelerated mouse model. BMC Musculoskelet Disord. 20 (1), 120(2019).
- Bloom, E., et al. Overload in a rat in vivo model of synergist ablation induces tendon multi-scale structural and functional degeneration. J Biomech Eng. 145 (8), 081003(2023).
- Williamson, P. M., et al. A passive ankle dorsiflexion testing system to assess mechanobiological and structural response to cyclic loading in rat Achilles tendon. J Biomech. 156, 111664(2023).
- Oliveira, L. F., Peixinho, C. C., Silva, G. A., Menegaldo, L. L. In vivo passive mechanical properties estimation of Achilles tendon using ultrasound. J Biomech. 49 (4), 507-513 (2016).
Access restricted. Please log in or start a trial to view this content.
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。