É necessária uma assinatura da JoVE para visualizar este conteúdo. Faça login ou comece sua avaliação gratuita.
Method Article
Um Sistema de Teste de Dorsiflexão de Tornozelo Passivo para um Modelo In Vivo de Tendinopatia Induzida por Overuse
Neste Artigo
Resumo
Este protocolo apresenta um sistema de teste usado para induzir lesões por fadiga quantificáveis e controladas em um tendão de Aquiles de ratos para um modelo in vivo de tendinopatia induzida por uso excessivo. O procedimento consiste em prender o tornozelo do rato a um atuador articular que realiza a dorsiflexão passiva do tornozelo com um script MATLAB personalizado.
Resumo
A tendinopatia é uma condição crônica do tendão que resulta em dor e perda de função e é causada por sobrecarga repetida do tendão e tempo limitado de recuperação. Este protocolo descreve um sistema de teste que aplica ciclicamente cargas mecânicas via dorsiflexão passiva no tendão de Aquiles de ratos. O código escrito sob medida consiste em medições de carregamento pré e pós-cíclico para avaliar os efeitos do protocolo de carregamento, juntamente com o regime de carregamento de fadiga cíclica baseado em controle de realimentação.
Usamos 25 ratos Sprague-Dawley para este estudo, com 5 ratos por grupo recebendo 500, 1.000, 2.000, 3.600 ou 7.200 ciclos de cargas de fadiga. Foram calculadas as diferenças percentuais entre as medidas de carregamento pré e pós-carga cíclica dos módulos histerese, pico de tensão e carga e descarga. Os resultados demonstram que o sistema pode induzir graus variados de dano ao tendão de Aquiles com base no número de cargas aplicadas. Este sistema oferece uma abordagem inovadora para aplicar graus variáveis quantificados e fisiológicos de cargas cíclicas ao tendão de Aquiles para um modelo in vivo de lesão tendínea por overuse induzida por fadiga.
Introdução
Como os tendões conectam o músculo ao osso e experimentam movimentos repetitivos diários ao longo de sua vida, eles são altamente propensos a lesões por uso excessivo que são dolorosas e limitantes e resultam em função mecânica prejudicada, afetando 30-50% da população1. As tendinopatias são condições crônicas consideradas lesões por overuse devido a movimentos repetitivos de fadiga e cicatrização inadequada aos níveis pré-lesão. Tanto os membros superiores quanto os inferiores são comumente afetados, incluindo o manguito rotador, cotovelo, tendão de Aquiles e tendão patelar 2,3,4,5. A tendinopatia de Aquiles é comum em atividades que envolvem corrida e salto, especialmente atletas envolvidos em atletismo, corrida de média e longa distância, tênis e outros esportes com bola, afetando 7-9% dos corredores 6,7. Lesões decorrentes de corrida e salto também podem causar limitação da dorsiflexão do tornozelo, fator de risco para tendinopatias aquiles e patelares8,9,10. Assim, há necessidade de uma melhor avaliação e caracterização das tendinopatias, que este estudo pode fornecer como modelo de dorsiflexão passiva do tornozelo em ratos para lesões do tendão de Aquiles por overuse.
Trabalhos anteriores utilizando modelos de pequenos animais têm como objetivo estudar o desenvolvimento e marcadores de tendinopatia. Estes incluem exercícios em esteira rolante, alcance repetitivo, carga direta do tendão, injeções de colagenase, cirurgia e estudos in vitro 11,12,13,14,15,16. Embora a literatura tenha se beneficiado da identificação de marcadores de dano com o emprego desses modelos de tendinopatias, as limitações incluem carregar o tendão em movimentos articulares não fisiologicamente relevantes, como no caso da carga direta do tendão, não medir diretamente as cargas aplicadas, como para estudos em esteira, e não utilizar o uso excessivo fisiológico, como no caso das injeções de colagenase, entre outros. Para esse fim, este estudo teve como objetivo desenvolver um sistema que aplique cargas quantificadas de forma não invasiva no tendão de Aquiles com a aplicação de estudos de tendinopatia induzida por uso excessivo para preencher as lacunas em modelos de pequenos animais previamente desenvolvidos para tendinopatia. Realizamos um estudo piloto para demonstrar que o sistema induz mudanças reprodutíveis nas propriedades mecânicas ao longo de uma série de ciclos de carregamento. Esse sistema permite que movimentos e cargas fisiologicamente relevantes induzam o uso excessivo e, ao mesmo tempo, quantificam e medem as forças aplicadas e experimentadas pelo tendão durante o regime de carga.
Protocolo
Este estudo foi conduzido de acordo com a aprovação do Comitê Institucional de Cuidados e Uso de Animais (IACUC) no Beth Israel Deaconess Medical Center. Os animais foram anestesiados com isoflurano a 5% para indução e 2,5% para manutenção, e cuidados para evitar hipotermia.
1. Configuração do sistema de ensaio
- Controle a rotação passiva do tornozelo por um motor de passo para aplicar rotação e torque consistentes. Controle o motor de passo com um microcontrolador. Use as entradas do sistema de posição e orientação 3D para marcar os graus de rotação. Use as saídas do sensor de torque para fornecer controle de realimentação para aumentar o ângulo de dorsiflexão se o limite para o limiar não for atingido.
- Para começar, conecte o microcontrolador, o sensor de torque, o posicionamento eletromagnético 3D e o sistema de orientação a um computador e à fonte de alimentação. Controle o sistema customizado usando um código MATLAB desenvolvido internamente (Figura 1). Baixe os arquivos de código do MATLAB do GitHub e siga instruções específicas sobre como executar o código a partir das instruções da página do GitHub (https://github.com/Nazarian-Lab/PassiveAnkleDorsiflexionSystem).
- Abra o MATLAB com os arquivos de código. Abra o software PDImfc para conectar o sistema de posicionamento e orientação eletromagnética 3D ao programa MATLAB. Clique em Conectar | P&O Contínuo | StartSockExport(). Mantenha o aplicativo aberto em segundo plano.
2. Ex-vivo e post mortem
- Eutanásia de seis ratos Sprague-Dawley com 13 semanas de idade por inalação de CO2 e um método secundário de eutanásia por toracotomia. Dissecar o tendão de Aquiles direito com o calcâneo e a junção miotendínea intactos. Congelar a -20°C para realizar testes mecânicos posteriormente. Após o tendão ser descongelado, dissecado fino e preparado para o ensaio mecânico, realizar o carregamento de tração até a não obtenção da força máxima de tração (UTS) do tendão (Pré-carga até 0,1N, Pré-condicionamento por 10 ciclos de 0,1 - 1 N, Rampa até a ruptura a um deslocamento constante de 0,1 mm/s). Use 15% do UTS como entrada para que o sistema realize o pré-condicionamento para uma etapa posterior, conforme descrito na etapa 3.4.
- Eutanásia de outro grupo de cinco animais com o mesmo procedimento para medidas de braço e deformação. Realizar radiografia da perna esquerda com dorsiflexão de 90° ao lado de uma régua como referência. Abra a imagem de raios-X em Fiji, usando a régua na imagem como referência, meça o braço do momento tendíneo do centro de rotação da articulação do tornozelo até a parte posterior do tornozelo para ser usado como entrada no código MATLAB para converter a força de entrada para pré-condicionamento descrita na etapa 2.1 para o valor de torque correspondente, bem como a conversão entre torque de saída e força para análise dos dados.
- Imobilizar o membro posterior esquerdo com duas talas para colocar o joelho em extensão total. Dorsiflexe levemente o tornozelo, empurrando os dedos dos pés para garantir que a rotação do tornozelo ocorra devido ao tendão isolado em vez de envolver os tecidos moles circundantes e esteja em tensão. Se não estiver em tensão ou se houver movimento no joelho, retape a tala.
- Exponha o tendão removendo a pele ao redor do tendão de Aquiles. Coloque cola em um talão de alumínio de 1/32 polegada, coloque-o no tendão livre mais próximo da junção miotendínea do tendão de Aquiles e use um cotonete com soro fisiológico para remover o excesso de cola. Aplique repetidamente soro fisiológico no tendão de Aquiles durante todo o procedimento restante para garantir a umidade do tecido.
- Medir a área de secção transversa do tendão usando um paquímetro digital antes de aplicar qualquer carga. Suponha que o tendão seja uma elipse e meça a largura e a espessura em triplicatas.
- Coloque o rato na plataforma de corpo inteiro em decúbito ventral. Fixe o tornozelo no atuador articular com uma gravata de zíper ao redor do tornozelo e outra ao redor dos dedos dos pés, e prenda o joelho dividido com duas amarras de zíper. Gire o eixo de modo que o tornozelo esteja em plena flexão plantar.
- Conecte a caneta digitalizadora do sistema de posição e orientação eletromagnética 3D ao computador e ligue a fonte de alimentação.
- Execute o código do sistema (descrito em mais detalhes na Etapa 3) para o número especificado de ciclos (neste estudo, seis ratos eutanasiados receberam 7.200 ciclos).
- Em 0, 500, 1.000, 2.000, 3.600 e 7.200 ciclos para as medidas de deformação ex vivo, pause o regime de carregamento cíclico e meça o comprimento do tendão do calcâneo ao cordão de alumínio em incrementos de 5° de 0 a 40° de dorsiflexão (o limite de atuação devido a restrições físicas do sistema) usando a caneta digitalizadora 3D em triplicatos de forma alternada.
- Calcular a deformação tendínea em ângulos variados utilizando os comprimentos obtidos a partir do passo 2.9, em que o comprimento inicial é de 0° dorsiflexão para cada número de ciclo. Realizar um ajuste linear para obter a relação entre o ângulo de dorsiflexão e a deformação em cada número de ciclo. Use essa relação para converter dados brutos de ângulo em tensão para análise de dados.
- Calcular a área de secção transversa do tendão usando um paquímetro digital a 40° de dorsiflexão assumindo incompressibilidade (volume constante) com as medidas de comprimento do tendão a 0° e 40° e a área de secção transversa medida a 0°. Use esta área de secção transversal em cada número de ciclos para converter força em tensão para análise de dados (tensão = força / área de secção transversal).
3. Protocolo de carregamento mecânico
- Para esta seção do estudo, foram utilizadas 25 ratas Sprague-Dawley com 11 semanas de idade, com 5 ratos alocados aleatoriamente para receber 500, 1.000, 2.000, 3.600 ou 7.200 ciclos de carga de fadiga.
NOTA: O pré-condicionamento, a calibração inicial e a pré e pós-medição levam cerca de 15 minutos para serem executados, e o regime de carga de fadiga cíclica leva 1 segundo por ciclo. Assim, o maior tempo de anestesia do rato é em torno de 2 h, o que foi realizado sob protocolos aprovados pela IACUC. - Conecte o microcontrolador, o sensor de torque, o posicionamento eletromagnético 3D e o sistema de orientação a um computador e à fonte de alimentação. Controle o sistema customizado usando o código MATLAB desenvolvido internamente (Figura 1).
- Ligue o computador e abra o MATLAB com os arquivos de código. Abra o software PDImfc para conectar o sistema de posicionamento e orientação eletromagnética 3D ao programa MATLAB. Clique em Conectar | P&O Contínuo | StartSockExport(). Mantenha o aplicativo aberto em segundo plano.
- Induzir anestesia com isoflurano a 5% por inalação em câmara de indução. Após a indução, prenda o animal na plataforma de corpo inteiro com um elemento de aquecimento à base de água acoplado para manter a temperatura e sustentar a anestesia com isoflurano a 2,5% através de um acessório de cone nasal. Use uma pomada úmida nos olhos para evitar o ressecamento durante a anestesia.
- Coloque o rato na plataforma de corpo inteiro em decúbito ventral. Fixe o tornozelo no atuador articular com uma gravata de zíper ao redor do tornozelo e outra ao redor dos dedos dos pés, e prenda o joelho dividido com duas amarras de zíper. Gire o eixo de modo que o tornozelo esteja em plena flexão plantar.
OBS: Certifique-se de que as gravatas de zíper não causem constrição ou lesões, tome cuidado no aperto e, se necessário, coloque gaze entre a gravata e a pele para uma camada de proteção. - Para as etapas a seguir envolvendo a execução do código do sistema, clique em Executar no MATLAB para cada seção do código correspondente ao teste de carregamento específico.
- Ciclar o tornozelo 50 vezes a 15% da tensão de tração final com base no valor da tensão de tração final do tendão de Aquiles desde os testes de tração ex vivo até aos ensaios de falha, medidos com base no passo 2.1.
- Realizar uma calibração inicial do tendão dorsiflexando-o três vezes a 12°. Use a inclinação da região linear da região de carregamento da curva de histerese para calcular a região exponencial da curva.
- Dorsiflexe incrementalmente o tornozelo em ângulos crescentes até que a região exponencial da curva seja obtida calculando-se a inclinação do pico da região de carregamento da curva (calculada usando o código MATLAB desenvolvido internamente) ou até que ele seja girado para 40°, o que ocorrer primeiro.
- No ângulo final obtido, realizar cinco medidas mecânicas cíclicas como linha de base de pré-carregamento.
- Executar o regime de carga de fadiga cíclica para um número especificado de ciclos (neste estudo, para 500, 1.000, 2.000, 3.600 ou 7.200 ciclos).
- A cada 50 ciclos, calcule a inclinação da porção de carregamento da curva de histerese (calculada através do código MATLAB desenvolvido internamente) para garantir que ela ainda esteja na região exponencial. Aumente o ângulo de dorsiflexão em 1°, a menos que já esteja em 40° até que essa região exponencial seja alcançada.
- Após o regime de carregamento cíclico estar completo, execute cinco medidas mecânicas cíclicas como medidas pós-carga no ângulo inicialmente escolhido para medir as propriedades mecânicas do tendão.
- Retire as gravatas e talas. Devolver o animal à câmara de recuperação. O animal não é deixado desassistido até que tenha recuperado a consciência suficiente, seguido pelo qual é devolvido à sua gaiola. Monitorar os animais diariamente quanto a quaisquer sinais clínicos adversos e, se presente, administrar buprenorfina na dose de 1,2 mg/kg por via subcutânea uma vez a cada 72 h ou realizar eutanásia precoce. Eutanásia dos animais após 7 dias de atividade em gaiola via inalação de CO2 e um meio secundário de eutanásia via toracotomia.
NOTA: A aplicação de carregamento cíclico e as medidas mecânicas foram obtidas com um gabarito feito sob medida composto por um sensor de torque, atuador de articulação do tornozelo impresso em 3D e leito animal, um sistema eletromagnético de posição e orientação 3D e um motor de passo girando um eixo para alcançar a dorsiflexão, como relatado anteriormente por nosso grupo17. Este sistema é controlado por um script MATLAB mencionado na etapa 1.2. O sensor de torque e o sistema de posição e orientação capturam dados de torque e posição em todo o protocolo de carregamento do sistema.
4. Análise dos dados
- Carregue os dados pré e pós-medição separadamente no MATLAB.
- Converter o torque em tensão com base no braço de momento medido do passo 2.2 e na área de secção transversal medida no número especificado de cargas aplicadas obtidas do passo 2.11 usando as equações (1) e (2):
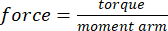 (1º)
(1º)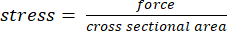 (2º)
(2º) - Converter o ângulo em tensão com base na conversão obtida a partir da etapa 2.10.
- Calcular a histerese média (área entre as curvas de carga e descarga), tensão de pico (valor máximo de tensão do ciclo) e módulos de carga e descarga (ajuste linear dos últimos 50% da carga e dos primeiros 60% das curvas de descarga) para os ciclos pré e pós-medição.
- Calcular a variação percentual das propriedades mecânicas a partir do passo 4.4 entre os ciclos pré e pós-medição.
Resultados
Com o aumento do número de ciclos aplicados, houve maior redução nas propriedades mecânicas tendíneas in vivo . Houve redução significativamente menor da histerese e dos módulos de carga e descarga no grupo de 500 ciclos em comparação aos grupos de 3.600 e 7.200 ciclos (p < 0,05) (Figura 2). Embora tenha havido uma redução significativa no pico de estresse por ciclo do grupo de 500 ciclos para o grupo de 3.600 ciclos, não houve redução significativa entre os grupos de...
Discussão
Este estudo apresenta um método para carregar ciclicamente o tendão de Aquiles de ratos com um sistema passivo de dorsiflexão do tornozelo para um modelo de tendinopatia induzida por overuse in vivo . A importância do sistema reside em sua capacidade de isolar o tendão de Aquiles, aplicar cargas quantificáveis sem acessar cirurgicamente o tendão e medir as propriedades do tendão in vivo .
Em 2010, Fung e col. apresentaram um modelo de fadiga do tendão patelar de rat...
Divulgações
Os autores declaram não haver conflitos de interesse.
Agradecimentos
Gostaríamos de agradecer nossos apoios de financiamento: o Joe Fallon Research Fund, o Dr. Louis Meeks BIDMC Sports Medicine Trainee Research Fund e uma bolsa intramuros (AN), todos da BIDMC Orthopaedics, juntamente com o apoio dos Institutos Nacionais de Saúde (2T32AR055885 (PMW)).
Materiais
| Name | Company | Catalog Number | Comments |
| 1/32'' Aluminum beads | |||
| 2.5% isoflurane | |||
| 3D digitizing pen | Polhemus, Vermont, NH, USA | ||
| 3D electromagnetic positioning and orientation sensor | Polhemus, Vermont, NH, USA | ||
| 5% isoflurane | |||
| Customized device: 1) Assembly, sensors, 3D printed animal bed and ankle mount actuator | Assembled as described in manuscript | ||
| MATLAB code | MATLAB, Natick, MA, USA | ||
| Microcontroller | Ivrea, Italy | Arduino UNO, Rev3 | |
| Nose cone | |||
| Scalpel and scalpel holder | No. 11 scalpel | ||
| Sprague-Dawley rats | Charles River Laboratories, Wilmington, MA, USA | 11-13 weeks old | |
| Stepper driver | SparkFun Electronics, Niwot, CO 80503 | DM542T | |
| Stepper motor | SparkFun Electronics, Niwot, CO 80503 | 23HE30-2804S | |
| Straight forceps | |||
| Torque sensor assembly | Futek Inc., Irvine, CA, USA | FSH03985, FSH04473, FSH03927 | |
| Water heating pad |
Referências
- Kaux, J. F., Forthomme, B., Goff, C. L., Crielaard, J. M., Croisier, J. L. Current opinions on tendinopathy. J Sports Sci Med. 10 (2), 238-253 (2011).
- Maffulli, N., Longo, U. G., Kadakia, A., Spiezia, F. Achilles tendinopathy. Foot Ankle Surg. 26 (3), 240-249 (2020).
- Teunis, T., Lubberts, B., Reilly, B. T., Ring, D. A systematic review and pooled analysis of the prevalence of rotator cuff disease with increasing age. J Shoulder Elbow Surg. 23 (12), 1913-1921 (2014).
- von Rickenbach, K. J., Borgstrom, H., Tenforde, A., Borg-Stein, J., McInnis, K. C. Achilles tendinopathy: evaluation, rehabilitation, and prevention. Curr Sports Med Rep. 20 (6), 327-334 (2021).
- Aicale, R., Oliviero, A., Maffulli, N. Management of Achilles and patellar tendinopathy: what we know, what we can do. J Foot Ankle Res. 13 (1), 59 (2020).
- Jarvinen, T. A., et al. Achilles tendon injuries. Curr Opin Rheumatol. 13 (2), 150-155 (2001).
- Silbernagel, K. G., Hanlon, S., Sprague, A. Current clinical concepts: conservative management of Achilles tendinopathy. J Athl Train. 55 (5), 438-447 (2020).
- Tayfur, A., et al. Are landing patterns in jumping athletes associated with patellar tendinopathy? A systematic review with evidence gap map and meta-analysis. Sports Med. 52 (1), 123-137 (2022).
- Malliaras, P., Cook, J. L., Kent, P. Reduced ankle dorsiflexion range may increase the risk of patellar tendon injury among volleyball players. J Sci Med Sport. 9 (4), 304-309 (2006).
- Backman, L. J., Danielson, P. Low range of ankle dorsiflexion predisposes for patellar tendinopathy in junior elite basketball players: a 1-year prospective study. Am J Sports Med. 39 (12), 2626-2633 (2011).
- Glazebrook, M. A., Wright, J. R., Langman, M., Stanish, W. D., Lee, J. M. Histological analysis of achilles tendons in an overuse rat model. J Orthop Res. 26 (6), 840-846 (2008).
- Carpenter, J. E., Flanagan, C. L., Thomopoulos, S., Yian, E. H., Soslowsky, L. J. The effects of overuse combined with intrinsic or extrinsic alterations in an animal model of rotator cuff tendinosis. Am J Sports Med. 26 (6), 801-807 (1998).
- Gao, H. G., et al. Increased serum and musculotendinous fibrogenic proteins following persistent low-grade inflammation in a rat model of long-term upper extremity overuse. PLoS One. 8 (8), e71875 (2013).
- Fung, D., et al. Early response to tendon fatigue damage accumulation in a novel in vivo model. J Biomech. 43 (2), 274-279 (2010).
- Ueda, Y., et al. Molecular changes to tendons after collagenase-induced acute tendon injury in a senescence-accelerated mouse model. BMC Musculoskelet Disord. 20 (1), 120 (2019).
- Bloom, E., et al. Overload in a rat in vivo model of synergist ablation induces tendon multi-scale structural and functional degeneration. J Biomech Eng. 145 (8), 081003 (2023).
- Williamson, P. M., et al. A passive ankle dorsiflexion testing system to assess mechanobiological and structural response to cyclic loading in rat Achilles tendon. J Biomech. 156, 111664 (2023).
- Oliveira, L. F., Peixinho, C. C., Silva, G. A., Menegaldo, L. L. In vivo passive mechanical properties estimation of Achilles tendon using ultrasound. J Biomech. 49 (4), 507-513 (2016).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoExplore Mais Artigos
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados