Method Article
离体胎盘外植体流动培养 - 模拟子宫内的动态条件
摘要
这是在恒定流动条件下培养胎盘外植体的方案。这种方法通过复制动态生理环境来增强传统的静态绒毛培养系统。
摘要
现有的离体胎盘外植 体 培养模型主要基于使用孔板的静态培养系统。然而,这些模型不能充分反映 子宫内 的动态,胎盘由于血浆或血流而遇到持续的轻微剪切应力。为了解决这一限制,设计了一种流动培养系统,使离体胎盘外植 体 培养更接近母体内经历的 子宫内 流动条件。在这种方法中,胎盘外植体在五个相互连接的流动室中培养。此设置可保持生理氧浓度和一致的流速。收集的数据表明,在流动条件下,与传统的静态方法相比,组织形态的保存表现出显着的增强。这项创新技术引入了一种直接的离体胎盘外植 体 培养方法,提供了更忠实的 体内 动态环境。此外,本研究为研究胎儿-母体界面的功能动力学提供了新的可能性。通过采用可行的动态方法,有助于更深入地理解胎盘生物学,强调其与母胎健康的相关性。
引言
自 1960 年代以来,在孔板底部培养胎盘外植体已被用于研究胎儿-母体界面 1,2,3。这种方法是成熟且直接的,除了单细胞培养外,还可以将人体组织用于各种研究 2,3。随着时间的流逝,胎盘外植体培养物的实验设计在氧浓度方面进行了修改4 并防止组织沉降在孔板的底部 2,5,6。然而,这种方法尚未适应子宫内的体内条件,特别是恒定流量的存在3。
怀孕的成功取决于用母体血液充分和一致地灌注绒毛间隙,建立血液和血源性物质连续流入和流出的动态回路7,8,9,10,11,12。胎盘具有两种不同的血液供应系统,一种用于母体血液,一种用于胎儿血液,导致胎儿和母体系统双重灌注13。母体血液在孕早期结束时开始灌注胎盘的绒毛间隙,缓慢流过扩大的子宫螺旋动脉10,11,14。因此,胎盘绒毛树沐浴在母体血液中,为胎儿输送营养和氧气。这种母体血液流经绒毛间隙,然后通过子宫胎盘静脉返回母体循环。在通过绒毛间隙的过程中,氧气和营养物质扩散和主动吸收到胎儿血液中会导致母体血液中的氧气和营养水平降低12,15。然而,绒毛间隙的血液完全被新鲜的、富氧的血液所取代,大约每分钟两到三次,确保营养物质和气体的持续供应13。值得注意的是,胎盘屏障的最外层合体滋养层是直接暴露于母体血液的胎盘绒毛树的唯一成分15,16,17。因此,合体滋养层会受到来自流动的母体血液的持续温和剪切应力 3,14。
目前关于胎盘流动环境的科学知识和现代技术进步现在允许在流动条件下对胎盘外植体进行适应和生理近似的培养。此外,有证据表明剪切力会影响合体滋养层18,19,20,21 的生物学功能。解释血流的一种众所周知的方法是胎盘双叶灌注系统22。然而,这些实验需要大量的专业知识,有时间限制(仅进行几个小时),并且仅适用于妊娠晚期胎盘样本3,23。相比之下,我们开发了一种简单且非侵入性的技术,用于在恒定流量设置下进行离体胎盘绒毛外植体培养,以适应孕早期和孕晚期胎盘组织3。在这种设置中,胎盘外植体在五个串联的流动室中培养。绒毛状外植体使用薄金属板上的针状立面固定在腔室的底部。随后将构建的流路转移到生物反应器中,在生物反应器中调节氧气浓度和流速3.流式培养结果表明,与通常使用的静态方法3 相比,组织完整性得到更好的保留。此外,这种动态方法为组织外植体培养提供了新颖和适应性的实验设计,允许更密切地模拟自然环境的体外实验3.
研究方案
格拉茨医科大学伦理委员会批准了这项研究(31-019 ex 18/19 版本 1.2 和 29-319 ex 16/17)。已获得参与研究的所有受试者的知情同意。
1. 流动实验的准备工作
注意:实验在带有集成蠕动泵的生物反应器中进行(参见 材料表)。生物反应器内的湿度、温度和气体水平可以调节。
- 打开生物反应器并根据生物反应器的手册为实验进行所有预先安排(例如,泵的校准、预热、气体条件和湿度)。在开始实验之前,所需的设置(温度、气体含量、湿度)应稳定几个小时或过夜。为此,请启动生物反应器和软件,然后单击菜单项"培养箱"下的 "更改设定点 "。
- 将PBS和所需培养基(补充有提供的补充剂hEGF-5,HC-500以及5%外泌体耗尽的胎牛血清,1%青霉素/链霉素)预热至37°C(见 材料表)。
2.胎盘样本夹层
- 分娩后立即从胎盘中部区域切下 3 次 2 cm 3 胎盘样品,如 Kupper 等人 3 所述,简而言之,将样品保存在 PBS 中。丢弃绒毛膜板,母体蜕膜和标本上可见的梗死区域。
- 将剩余的组织标本解剖成横截直径约为0.5厘米(湿重约7.5mg)的绒毛状外植体。将它们转移到装有新鲜PBS的培养皿中。
- 用镊子在液体中轻轻摇晃外植体,在PBS中清洗外植体,以去除血液残留物。
注意:用PBS在培养皿中解剖样品以预洗并防止它们变干,并使用灭菌/高压灭菌工具处理组织。
3.流动实验
- 在无菌罩下,根据流动室的用户手册(参见 材料表),使用鲁尔锁将五个室串联到储液瓶上。
注意: 使用前根据相应的手册对所有材料进行消毒和/或高压灭菌。使用储液瓶上的空气过滤器进行无菌气体交换。要打开和关闭腔室,请轻轻挤压腔室的凸耳。步骤 3.1.也可以更早地准备。 - 将腔室倒置并通过取下底部打开它们。使用镊子将金属板转移到腔室顶部的中央,销钉朝上。
- 用1mL预热培养基(37°C)填充腔室。然后再向储液器中加注 20 mL。该回路总共需要 25 mL,包括每个流室、试管和储液瓶中的体积。在流动下,填充室中培养基的最终体积为 2 mL。
- 使用镊子,在腔室中金属板的针头之间转移一个接一个的绒毛外植体。让针头在胎盘绒毛之间滑动,以避免刺穿组织。将四个外植体转移到一个腔室中。小心地重新安装底部,关闭腔室。一个完整的回路总共包含 20 个外植体。腔室需要保持倒置位置。
注意:用镊子轻轻抓住外植体;尽量不要挤压它们。确保腔室和电路完全密封,以防止泄漏。腔室总是倒置使用。每个腔室的外植体数量和腔室本身的数量是可变的。孕早期组织的程序与孕晚期组织的程序相似,但增加了少量:为了固定绒毛,在组织转移到金属板后,将针头稍微弯曲到外植体上(个人交流 Brugger 等人)。这样可以将脆弱的组织固定在金属板上,并防止样品滑落。 - 将流动组件转移到生物反应器中。
- 通过将泵管连接到泵,将流动回路连接到生物反应器内的蠕动泵。将其固定在第4 级( 人们会听到它咔嗒四次)。
- 如果需要静电控制,则还将孔板放入生物反应器中。
注:对于静态培养,六孔板的五个孔每孔填充 4 mL 培养基,每孔填充 4 个绒毛外植体。填充的孔板也被放置在生物反应器中,并在与流动培养外植体相同的气氛中培养。Kupper等人3中描述了更多细节 - 在菜单项"泵"下将泵模式设置为 手动 。然后将泵速设置为 1 mL/min,然后单击 "运行"开始将培养基泵入管道。当电路充满介质时,将腔室保持一定角度,使它们完全充满介质。
注:有关胎盘绒毛流动和静态培养的实验设置,请参见 补充表 1 。流量和静态系统的规格见 附表2。
注意: 在填充过程中小心倾斜腔室,以防止试样从针头上滑落。 - 填充完成后,腔室保持倒置位置。确保腔室牢固直立,并关闭生物反应器的两个盖子。
注:填充流槽中培养基的最终体积为 2 mL。实验设置以及实验中使用的流动室和孔板的规格在Kupper等人3中进行了描述 - 将组织孵育所需时间。
注意: 无需再次打开生物反应器盖即可在计算机上监控温度、气体水平和流速。 - 在组织孵育所需时间后,通过单击菜单项"泵"下的 "中止 "停止泵。打开生物反应器的两个盖子,然后一次打开一个流动室。使用镊子小心地从金属板上取出外植体。
- 根据选定的下游分析处理组织和上清液。在这种情况下,进行了免疫组织化学染色和电子显微镜检查3.有关用于免疫组化和免疫荧光的抗体的详细信息,请参见 补充表3 。
注意: 取出组织后,通过逆时针旋转泵将介质从回路中排出。 - 根据制造商对流室和管道的说明拆卸和清洁流动回路。
结果
本出版物的部分内容及其结果已经发表(见参考文献3和23)。
实验装置
实验装置如 图 1 所示。复合流动循环由五个串联互连的流动室组成(图1A)。在每个流动室内,培养四个外植体,每个外植体的横截面直径约为0.5厘米(图1 A,C)。对于静态控制实验,将外植体培养在六孔板的单个孔中(图1B)。为了防止外植体被冲洗掉,它们被固定在具有窄针状突起的金属板上(图1 D,E)。为了使外植体受到介质的直接流动,腔室倒置,入口和出口位于头部部分(图1 F,G)。在生物反应器内,流动循环与蠕动泵相连。为了比较流动培养组织和常规静态培养组织之间的组织完整性,将外植体放置在与流动循环相邻的六孔板中。这确保了在氧气、温度和湿度方面验证一致的培养条件(图1A)3。
形态学分析
β-肌动蛋白
进行了各种免疫组织化学染色程序,以检查与不同培养条件相关的组织完整性的组织学差异(图2)。解剖后迅速嵌入的外植体可作为基线参考。为了分析绒毛状外植体内的肌动蛋白细胞骨架,执行β-肌动蛋白染色(图2A-E)。描述性分析揭示了新获得的组织中细胞骨架的结构良好且有组织的视觉呈现(图2A)。随着时间的流逝,随着培养的进行,出现了可观察到的微丝聚集,表明细胞骨架结构的退化。在经历静态培养的绒毛外植体中始终观察到这种现象3(图2C,E,用星号表示)。
H&E染色
H&E染色进一步强化了组织完整性在静态培养过程中降低的观察结果,这一趋势在流动培养的背景下得到了改善(图2F-J)。新鲜组织表现出绒毛状外植体的结构化和特征性组织学表现,其特征是致密且紧密堆积的基质(图2F)。此外,合体滋养层牢固地粘附在下面的基质上(图2F)。在流动环境中培养24小时的绒毛外植体中观察到类似的外观(图2G)。然而,在流动下培养48小时后,观察到部分合胞滋养层部分分离(图2I,箭头表示),并伴有基质内零星的小空隙。对组织的组织学检查表明,在静态培养条件下24小时后组织的完整性没有得到充分保留(图2H)。此外,在静态培养中,这种完整性在48小时后进一步显着下降(图2J)。基质表现出多孔和凹陷的外观,并且在较大的区域中明显可见合胞滋养层与基质的显着分离(图2J,箭头)3。
CD34II型
CD34II染色用于观察内皮细胞,从而观察绒毛状外植体内的胎盘血管(图2K-O)。解剖后直接嵌入的组织显示出内皮细胞的独特组织排列(图2K)。胎盘血管的形态完整性在流式培养 24 小时后保持良好,甚至在 48 小时后也经常保持良好,尽管在流式条件下偶尔会出现血管塌陷的情况(图 2 L,N)。然而,在静态培养24小时后,血管表现出部分塌陷,正如其破坏的视觉外观所证明的那样(图2M,由箭头表示)。在静态培养环境中,血管的这种恶化似乎随着培养时间的延长而加剧。总之,在流动和静态培养后对绒毛外植体的描述性形态学评估表明,与静态培养模式3 相比,组织完整性似乎更有效地保存在流动系统中。
培养组织的超微结构分析
透射电子显微镜
为了对绒毛外植体的形态进行更详细的检查,使用透射电子显微镜(TEM)进行了额外的超微结构分析(图3A-E)。这些发现证实了组织学检查的结果。在制备后立即直接包埋的组织中,形态保存得非常好(图3A)。在合胞滋养层表面可清晰辨别出微绒毛。合体滋养层呈现出其独特的连续层,没有侧向细胞边界,与基底膜建立直接接触。新鲜组织的基质表现出致密的堆积,没有明显的穿孔或破裂。此外,血管和个体化血管内红细胞的超微结构外观也显示出出色的保存效果(图3A)。
即使在流式培养24小时后,组织样品的整体形态仍然保持相对较好(图3D)。虽然与新鲜组织相比,合胞滋养层表面的微绒毛略少,但合胞滋养层仍然主要附着在基底膜上。在合体滋养层的内部可观察到细胞核和偶尔的小液泡。胎盘绒毛内的基质看起来保存完好,与新鲜组织非常相似(图3D)。即使在流式培养48小时后,基质细胞也表现出相对较好的保存,尽管存在一些穿孔(图3E)。有趣的是,在组织内检测到脂滴。虽然合胞滋养层显示液泡和微绒毛数量减少,但它仍然附着在许多区域的基底膜上,合胞体和细胞核清晰可见(图3E)。
与流动培养的组织形成鲜明对比的是,经过静态培养的绒毛组织的形态早在24小时就表现出恶化(图3B)。合体滋养层在多个部位与基底膜分离,并显示出相对明显的穿孔。此外,脂滴在合体滋养层和基质中都经常很明显(图3B)。静态培养48小时后,超微结构明显下降(图3C)。合体滋养层在相当大的程度上表现出许多穿孔和与基底膜的分离。识别基质内的细胞以及构成血管的内皮细胞变得具有挑战性。此外,在静态培养48小时后,绒毛外植体内有明显的脂滴积累(图3C)。综上所述,静态培养中的组织超微结构在培养期间表现出连续恶化,这种趋势在流动条件下的培养得到了缓解3.
扫描电子显微镜
利用扫描电子显微镜(SEM),有助于对绒毛外植体表面进行详细检查(图4A-J)。新包埋的组织在其表面表现出密集的微绒毛阵列(图4 A,B)。一些区域表现出囊泡样结构。相反,来自静态培养物的组织在24小时后表现出微绒毛的显着减少(图4C,D),这种减少在48小时后持续存在(图4E,F)。虽然某些区域显示出未释放的囊泡状结构的聚集,但其他区域似乎裸露并被侵蚀(图4D,F)。在经过流动培养的组织中,微绒毛在24小时后(图4G,H)和48小时后(图4I,J)仍存在于表面上,尽管程度低于新鲜组织。与静态培养相比,表面囊泡样结构的流行率降低。有趣的是,这些囊泡状结构明显集中在特定的凹槽中,在这些凹槽中,流动可能减少或不存在(图4H,J),这表明由于培养基3的流动,它们可能已经从流动暴露的组织表面脱落。

图 1:流量系统的设置 。 (A) 由储液罐和五个流动室组成的组装式流动系统连接到其中一个蠕动泵。右侧是一个六孔板,其中静态培养外植体。(乙,三)对于这两种培养方法,将胎盘样品解剖成约0.5cm2的绒毛状外植体,然后每个孔或腔室使用四个外植体。在实验方法中,使用五个腔室或孔。(D,E)对于流动培养,使用具有窄针状隆起的金属板来固定外植体。(女,克)管子的开口位于腔室的头部,因此倒置使用以保证组织暴露于直接流动。该图转载自 Kupper 等人 3。 请点击这里查看此图的较大版本.
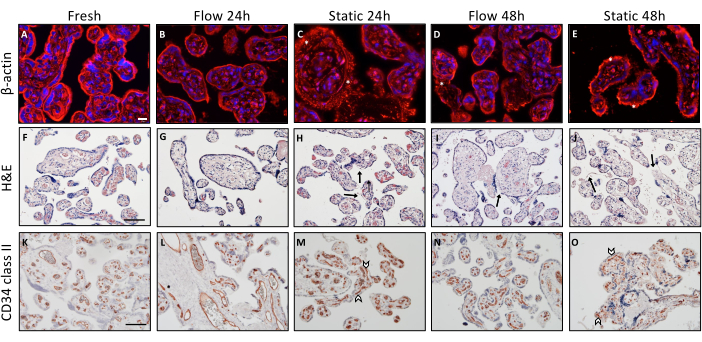
图2:流动和静态培养时胎盘绒毛外植体的形态学分析。 (A-E)β-肌动蛋白的免疫荧光染色,以在培养后观察外植体的细胞骨架。对于分析,每张载玻片使用六个随机选择的点。显示具有代表性的图像。(A)制备后直接包埋组织的细胞骨架的可视化。比例尺:20μm。 (B-E) 流动和静态培养的培养外植体中肌动蛋白细胞骨架的时间依赖性和培养模式依赖性变性的代表性描述。(C-E)星号表示肌动蛋白微丝积累增加,这是肌动蛋白细胞骨架降解的指示。(F-J)绒毛状外植体的苏木精-伊红染色。比例尺:100μm。 (F,G) 新鲜包埋的组织 (F) 和流动培养外植体 24 小时 (G) 显示绒毛外植体保存完好的形态。(I) 流动培养的外植体 48 小时显示合胞滋养层的间歇性分离区域(箭头)。(H,J)静态外植体培养后结构完整性的时间依赖性恶化,表现为合体滋养层(箭头)和穿孔基质的移位。(K-O)CD34 II用于绒毛状内皮细胞染色。比例尺:100μm。 (K,L) 在流动条件下培养 24 小时的新鲜组织 (K) 和外植体 (L) 表现出特征性结构排列的内皮细胞模式。(N)在流式培养48小时后,血管完整性在一定程度上下降。(男,男)在静态培养中,塌陷的血管在24小时(M)后已经可见,观察到随着静态培养时间(O)的延长而增加。该图转载自 Kupper 等人 3。请点击这里查看此图的较大版本.
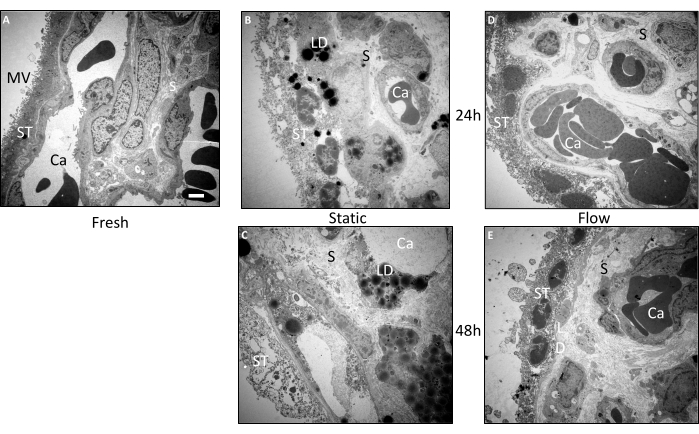
图3:使用透射电子显微镜对绒毛外植体进行培养前和培养后的超微结构检查。 来自三个独立实验的组织用于分析图像。(A) 新包埋组织的代表性图像显示合胞体滋养层 (ST) 表面有大量微绒毛 (MV)。结构完整的毛细血管 (Ca) 在保存完好的基质 (S) 中可见。(B) 在静态培养 24 小时的组织中,合体滋养层的结构完整性恶化,在某些区域似乎与基底膜断开连接。脂滴(LD)也有明显的积累。(C) 静态培养 48 小时后,观察到严重的超微结构恶化。基质和合胞滋养层被穿孔,脂滴的大量积累是显而易见的。血管几乎无法追踪。(D,E)流式培养物组织的超微结构在24小时(D)和48小时(E)后保存得相对较好。比例尺:2μm。 MV:微绒毛,ST:合胞滋养层,S:基质,Ca:毛细管,LD:脂滴。该图转载自 Kupper 等人 3。 请点击这里查看此图的较大版本.

图4:使用扫描电子显微镜对绒毛外植体进行培养前和培养后的超微结构检查。 (A,C,E,G,I) 胎盘绒毛树表面的概览图像以及相应的详细图像(B,D,F,H,J)。(甲,乙)新包埋的组织表现出致密的微绒毛接缝。(B)在某些位置可以观察到囊泡状结构。(C-F)在静态培养中24小时和48小时后,可见合体滋养层表面微绒毛的减少。引人注目的是囊泡状颗粒在外植体表面的广泛积累。(F)颗粒在静态培养48小时后出现枯萎。(G-J)与静态培养相比,流式培养的组织表面在24小时(G,H)和48小时(I,J)后似乎保存得更好。微绒毛在表面可见 (H,J),但密度与新鲜组织不同。(B) 可以看到水泡颗粒散落在生态位中,流量减少。该图转载自 Kupper 等人 3。请点击这里查看此图的较大版本.
补充表1:胎盘绒毛流动和静态培养的实验设置。请点击这里下载此文件。
附表2:流动和静态系统规格。请点击这里下载此文件。
补充表3:用于本研究的免疫组化和免疫荧光抗体。请点击这里下载此文件。
讨论
本研究为胎盘外植体的流动培养技术引入了独特的视角,该技术旨在复制子宫内环境的动态3,23。研究结果表明,与传统的静态培养方法相比,在流动条件下培养的组织形态保存得更好3.值得注意的是,尽管静态和流动培养条件都不利于胎盘血管的灌注,但在静态培养中主要观察到绒毛基质内胎盘血管的破坏,而在流动培养中,血管的完整性似乎在较长时间内得到更好的维持3。
对这一观察结果的一种可能的解释可能与合体滋养层的关键保护和内分泌作用有关,这一功能在文献 12,24,25,26 中得到了充分的记录。鉴于此,可以想象绒毛外层的整体完整性对维持下面的基质(包括血管)有显着贡献。因此,血管在流动条件下的持续细胞完整性可能归因于介质的连续流动。这种运动有助于外植体的被动运动,促进气体、营养物质和纳米颗粒(如细胞外囊泡)穿过胎盘屏障的交换。反过来,这可能会对血管形态的保存产生积极影响。此外,机械感觉现象在各种组织的组织形态发生中起作用27,28。研究表明,机械敏感性在多个层面上影响细胞过程,触发一系列最终影响组织和器官功能的生化反应29。值得注意的是,机械敏感蛋白在整个妊娠过程中由合体滋养层表达28。此外,该研究表明,组织表面的微绒毛可能与这种情况有关28。
另一个值得考虑的观点是线粒体在细胞对流动的反应中的潜在作用。例如,在内皮细胞中,线粒体作为细胞对环境刺激的反应的信号转导器30。通过 TEM3 在静态培养组织中观察到脂滴积累增加,与线粒体功能障碍引起的细胞凋亡诱导有关31。有必要进一步研究以揭示潜在的机制和关键因素,将它们与下游信号通路联系起来。这种探索可以增强我们对组织如何感知和反应剪切应力的理解,从而转化为培养中绒毛外植体的活力和完整性的提高23。
必须重申并谨慎执行几个关键的协议步骤。胎盘娩出后,应尽快培养组织。在外植体准备过程中,避开有可见梗死的区域至关重要。用镊子轻轻处理外植体以防止挤压很重要。建议在整个手术过程中保持组织被液体覆盖并快速进行。
重要的是要承认,本研究无法指定所呈现的流动系统内的确切剪切应力,这应该被视为未来研究的局限性 3,23。然而,重要的是要认识到,体内特定胎盘绒毛的精确流速和剪切应力受到许多参数的影响,例如绒毛间空间的几何特征、绒毛在该空间中的位置以及它与母体螺旋动脉和子宫静脉的接近度和角度 3,19,23,32 .胎盘几何结构的复杂性因人而异,也必须考虑在内23,32。估计绒毛间隙内血流的数学模型32和合体滋养层19,28的壁剪切应力计算已经存在。有趣的是,一项研究预测,与妊娠早期相比,妊娠晚期合体滋养层的剪切应力较低28,而另一项研究则表明合胞滋养层19 在空间上存在异质壁剪切应力。确定特定胎盘绒毛的精确流速和剪切应力仍然是一个挑战 3,19,23,32。这种计算为未来的研究提供了剪切应力范围的近似值,但它们可能需要持续的解剖调整和优化23。此外,未来的研究可能会开发新的和改进的流通培养技术,以解释绒毛间空间的复杂几何形状和增加每个实验标本数量的策略3。预计流动系统将持续取得进展和发展,可能会采用替代流动室(Brugger 等人,未发表的数据,2023 年)。
总之,本研究通过展示一种易于实施的离体流培养技术奠定了坚实的基础,该技术维护了培养绒毛外植体的结构完整性。它强调了动态技术在胎盘功能生物学研究中的重要性,为流动培养系统的进一步发展以及新想法和假设的产生铺平了道路3,23。
披露声明
作者声明没有利益冲突。
致谢
作者非常感谢 Bettina Amtmann 和 Petra Winkler 对组织取样的出色技术支持。这项研究由奥地利科学基金FWF(DOC 31-B26)和奥地利格拉茨医科大学通过妊娠期炎症性疾病博士项目(DP-iDP)资助。
材料
| Name | Company | Catalog Number | Comments |
| 6-well plates | NUNC, ThermoFisher Scientific, Waltham, MA, USA | 140675 | |
| Alexa Fluor 555 goat-anti-mouse | ThermoFisher Scientific, Waltham, MA, USA | A21422 | Diluted in PBS, 1:200 |
| antibody diluent | Dako, Santa Clara, CA, USA | S3022 | |
| anti-β-actin (AC-15) | Abcam, Cambridge, UK | ab6276 | Stock concentration: 2.1 mg/mL, diluted in antibody diluent, 1:10,000 |
| Bioreactor TEB500 | TEB500, EBERS Medical Technology SL, Zaragoza, Spain | Serial Number: TEB505 / 1000EW/ 117 | |
| CD34 Class II (QBEnd-10) | Dako, Santa Clara, CA, USA | M7165 | Stock concentration: 12 mg/l, diluted in antibody diluent, 1:500 |
| CPD 030 critically point dryer | Bal-Tec, Balzers, Liechtenstein) | Critically point dryer | |
| DAPI | ThermoFisher Scientific, Waltham, MA, USA | D21490 | Diluted in PBS, 1:1000 |
| Ebers TEB505 Series Software | TEB500, EBERS Medical Technology SL, Zaragoza, Spain | Series Software 1.4 | |
| Endothelial Cell Growth Medium MV | PromoCell PC-C-22120, Heidelberg, Germany; | C-22120 | Used without EGCS/h and FCS, any other medium suitable for the tissue can be used |
| Excelsior AS Tissue Processor | ThermoFisher Scientific, Waltham, MA, USA | ||
| Exosome-depleted fetal bovine serum | Gibco by Life Technologies, ThermoFisher Scientific, Waltham, MA, USA | A2720803 | |
| Histolab Clear | Histolab, Askim, Sweden | 14250-TY | |
| Hydrogen Peroxide Block | ThermoFisher Scientific, Waltham, MA, USA | TA125H202Q | |
| Kaiser’s Glycerin Gelatine | Merck, Darmstadt, Germany | 1092420100 | |
| Leica DM 6000 B microscope | Leica, Wetzlar, Germany | Equipped with an Olympus DP 72 Camera | |
| Leica UC7 ultramicrotome | Leica Microsystems, Vienna, Austria) | ||
| Metal plate with needles | In-house construction | ||
| Microtome | Microtome Microm HM 355 S, ThermoFisher Scientific, Waltham, MA, USA | ||
| Microwave oven | Miele, Guetersloh, Germany | ||
| Olympus microscope (BX63) | Olympus, Hamburg, Germany | Serial Number: 1A52421 | |
| PBS | ThermoFisher Scientific, Waltham, MA, USA | 10010015 | |
| Penicillin/Streptomycin | Gibco by Life Technologies, ThermoFisher Scientific, Waltham, MA, USA | 2585627 | |
| Primary antibody enhancer | ThermoFisher Scientific, Waltham, MA, USA | TL-125-PB | |
| ProLong Gold Antifade Reagent | ThermoFisher Scientific, Waltham, MA, USA | P36934 | |
| Pumping tube | Tygon, Bartelt, Graz, Austria | 6.078 175 | 1.02 mm diameter |
| QV500 Flow chambers | Kirkstall Ltd., Quasi Vivo, North Yorkshire, UK | QV500 | Other chambers would work as well |
| SCD 500, sputter coater | Bal-Tec, Balzers, Liechtenstein | Sputter coater | |
| Substrate amino-ethyl carbazole, AEC substrate kit | Abcam, Cambridge, UK | ab64252 | |
| Superfrost Plus slides | Menzel-Glaeser, Braunschweig, Germany | J1800AMNZ | |
| Syringe Filter | Corning Incorporated, NY, USA | 431219 | 0.2 µm Pore SFCA Membrane, air filter for the reservoir bottle |
| TAAB epoxy resin | Agar Scientific, Stansted, Essex, UK | T001 | |
| UltraVision LP-Detection System HRP-Polymer | ThermoFisher Scientific, Waltham, MA, USA | TL-125-HL | |
| UltraVision Protein Block | ThermoFisher Scientific, Waltham, MA, USA | TA125BPQ | |
| Zeiss EM 900 transmission electron microscope | Zeiss, Oberkochen, Germany | ||
| Zeiss Sigma 500 field emission scanning electron microscope | Zeiss, Cambridge, UK | Used with a back-scattered electron detector at 5 kV acceleration voltage |
参考文献
- Villee, C. A. The metabolism of human placenta in vitro. Journal of Biological Chemistry. 205 (1), 113-123 (1953).
- Miller, R. K., et al. Human placental explants in culture: Approaches and assessments. Placenta. 26 (6), 439-448 (2005).
- Kupper, N., Pritz, E., Siwetz, M., Guettler, J., Huppertz, B. Placental villous explant culture 2.0: flow culture allows studies closer to the in vivo situation. International Journal of Molecular Sciences. 22 (14), 7464 (2021).
- Reti, N. G., et al. Effect of high oxygen on placental function in short-term explant cultures. Cell and Tissue Research. 328 (3), 607-616 (2007).
- Simán, C. M., Sibley, C. P., Jones, C. J. P., Turner, M. A., Greenwood, S. L. The functional regeneration of syncytiotrophoblast in cultured explants of term placenta. American Journal of Physiology-Regulatory, Integrative and Comparative Physiology. 280 (4), R1116-R1122 (2001).
- Toro, A. R., et al. Leptin is an anti-apoptotic effector in placental cells involving p53 downregulation. PLoS ONE. 9 (6), e99187 (2014).
- Morley, L. C., Debant, M., Walker, J. J., Beech, D. J., Simpson, N. A. B. Placental blood flow sensing and regulation in fetal growth restriction. Placenta. 113, 23-28 (2021).
- Wang, Y. Z. S., Wang, Y., Zhao, S. Placental blood circulation. Vascular biology of the placenta. Chapter 2, (2010).
- Huppertz, B. The anatomy of the normal placenta. Journal of Clinical Pathology. 61 (12), 1296-1302 (2008).
- Weiss, G., Sundl, M., Glasner, A., Huppertz, B., Moser, G. The trophoblast plug during early pregnancy: a deeper insight. Histochemistry and Cell Biology. 146 (6), 749-756 (2016).
- Burton, G. J., Woods, A. W., Jauniaux, E., Kingdom, J. C. P. Rheological and physiological consequences of conversion of the maternal spiral arteries for uteroplacental blood flow during human pregnancy. Placenta. 30 (6), 473-482 (2009).
- Gude, N. M., Roberts, C. T., Kalionis, B., King, R. G. Growth and function of the normal human placenta. Thrombosis Research. 114 (5-6), 397-407 (2004).
- Wang, Y. Vascular biology of the placenta. Colloquium Series on Integrated Systems Physiology: From Molecule to Function. 2 (1), 1-98 (2010).
- Moser, G., Windsperger, K., Pollheimer, J., de Sousa Lopes, S. C., Huppertz, B. Human trophoblast invasion: new and unexpected routes and functions. Histochemistry and Cell Biology. 150 (4), 361-370 (2018).
- Kupper, N., Huppertz, B. The endogenous exposome of the pregnant mother: Placental extracellular vesicles and their effect on the maternal system. Molecular Aspects of Medicine. 87 (October 2020), 100955 (2022).
- Huppertz, B. IFPA award in placentology lecture: biology of the placental syncytiotrophoblast - myths and facts. Placenta. 31 (SUPPL), S75-S81 (2010).
- Gauster, M., Moser, G., Wernitznig, S., Kupper, N., Huppertz, B. Early human trophoblast development: from morphology to function. Cellular and Molecular Life Sciences. 79 (6), 345 (2022).
- Lecarpentier, E., et al. Fluid shear stress promotes placental growth factor upregulation in human syncytiotrophoblast through the cAMP-pKA signaling pathway. Hypertension. 68 (6), 1438-1446 (2016).
- Lecarpentier, E., et al. Computational fluid dynamic simulations of maternal circulation: wall shear stress in the human placenta and its biological implications. PLOS ONE. 11 (1), e0147262 (2016).
- Miura, S., Sato, K., Kato-Negishi, M., Teshima, T., Takeuchi, S. Fluid shear triggers microvilli formation via mechanosensitive activation of TRPV6. Nature Communications. 6 (1), 8871 (2015).
- Jauniaux, E., et al. Onset of maternal arterial blood flow and placental oxidative stress. The American Journal of Pathology. 157 (6), 2111-2122 (2000).
- Sodha, R. J., Proegler, M., Schneider, H. Transfer and metabolism of norepinephrine studied from maternal-to-fetal and fetal-to-maternal sides in the in vitro perfused human placental lobe. American Journal of Obstetrics and Gynecology. 148 (4), 474-481 (1984).
- Kupper, N. . Extracellular vesicles from advanced placental explant flow culture and their role in preeclampsia [Dissertation]. , (2022).
- Burton, G. J., Fowden, A. L. The placenta: a multifaceted, transient organ. Philosophical Transactions of the Royal Society B: Biological Sciences. 370 (1663), 20140066 (2015).
- Arora, N., Sadovsky, Y., Dermody, T. S., Coyne, C. B. Microbial vertical transmission during human pregnancy. Cell Host & Microbe. 21 (5), 561-567 (2017).
- Cheong, M. L., et al. A Positive feedback loop between glial cells missing 1 and human chorionic gonadotropin (hCG) regulates placental hCGβ expression and cell differentiation. Molecular and Cellular Biology. 36 (1), 197-209 (2016).
- Heisenberg, C. P., Bellaïche, Y. Forces in tissue morphogenesis and patterning. Cell. 153 (5), 948-962 (2013).
- Lee, T. C., Moulvi, A., James, J. L., Clark, A. R. Multi-scale modelling of shear stress on the syncytiotrophoblast: could maternal blood flow impact placental function across gestation. Annals of Biomedical Engineering. 51 (6), 1256-1269 (2023).
- Kluge, M. A., Fetterman, J. L., Vita, J. A. Mitochondria and endothelial function. Circulation Research. 112 (8), 1171-1188 (2013).
- Boren, J., Brindle, K. M. Apoptosis-induced mitochondrial dysfunction causes cytoplasmic lipid droplet formation. Cell Death & Differentiation. 19 (9), 1561-1570 (2012).
- Chernyavsky, I. L., Jensen, O. E., Leach, L. A Mathematical model of intervillous blood flow in the human placentone. Placenta. 31 (1), 44-52 (2010).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。