Method Article
אקס ויוו תרבית זרימת חציל שליה - חיקוי התנאים הדינמיים ברחם
In This Article
Summary
הנה פרוטוקול לגידול צמחי שליה בתנאי זרימה קבועים. גישה זו משפרת את מערכות התרביות הסטטיות המסורתיות בכך שהיא מאפשרת שכפול של סביבות פיזיולוגיות דינמיות.
Abstract
המודלים הקיימים של תרבית צמח השליה ex vivo מבוססים בעיקר על מערכות תרבית סטטיות המשתמשות בלוחות באר. עם זאת, מודלים אלה אינם משקפים כראוי את הדינמיקה בסביבת הרחם , שבה השליה נתקלת בלחץ גזירה קל מתמיד עקב פלזמה או זרימת דם. כדי להתמודד עם מגבלה זו, פותחה מערכת תרביות זרימה כדי לקרב את גידול השליה ex vivo לתנאי זרימת הרחם שחווים בגוף האם. במסגרת גישה זו, צמחי שליה מעובדים ברצף של חמישה תאי זרימה המחוברים זה לזה. הגדרה זו שומרת על ריכוזי חמצן פיזיולוגיים וקצב זרימה עקבי. הנתונים שנאספו מגלים כי בתנאי זרימה, שימור המורפולוגיה של הרקמה מציג שיפור ניכר בהשוואה לשיטות סטטיות קונבנציונליות. טכניקה חדשנית זו מציגה אמצעי פשוט של תרבית השליה ex vivo, המציעה ייצוג נאמן יותר של הסביבה הדינמית in vivo . יתר על כן, מחקר זה מציג אפשרויות חדשות לחקר הדינמיקה התפקודית של הממשק העוברי-אימהי. על ידי אימוץ מתודולוגיות דינמיות אפשריות, מתאפשרת הבנה עמוקה יותר של ביולוגיית השליה, המדגישה את הרלוונטיות שלה לבריאות האם-עובר.
Introduction
מאז שנות ה-60 של המאה ה-20 נעשה שימוש בגידול שליה בתחתית צלחת באר לחקר הממשק העוברי-אימהי 1,2,3. שיטה זו מבוססת ופשוטה, ומאפשרת ניצול רקמה אנושית למחקרים שונים, בנוסף לתרביות של תאים בודדים 2,3. עם הזמן, עיצובים ניסיוניים לתרביות צמחי שליה שונו ביחס לריכוז חמצן4 וכדי למנוע מהרקמה להתיישב בתחתית צלחת הבאר 2,5,6. עם זאת, שיטה זו לא הותאמה לתנאי in vivo בתוך הרחם, במיוחד נוכחות של זרימה קבועה3.
הצלחת ההריון תלויה בזילוח הולם ועקבי של החלל הבין-ורידי עם הדם האימהי, יצירת מעגל דינמי עם זרימה ויציאה רציפה של דם וחומרים הנישאים בדם 7,8,9,10,11,12. השליה כוללת שתי מערכות אספקת דם נפרדות, אחת לדם האם ואחת לדם העובר, וכתוצאה מכך זילוח כפול הן על ידי המערכת העוברית והן על ידי המערכת האימהית13. הדם האימהי מתחיל לחלחל לחלל הבין-ורידי של השליה בסוף השליש הראשון, זורם לאט דרך עורקי הרחם הספירליים המורחבים10,11,14. כתוצאה מכך, עצי השליה שטופים בדם אימהי, ומספקים חומרי מזון וחמצן לעובר. דם אימהי זה זורם דרך החלל הבין-ורידי לפני שהוא חוזר למחזור הדם האימהי דרך ורידי השליה. במהלך מעברו בחלל הבין-ורידי, דיפוזיה וספיגה פעילה של חמצן וחומרים מזינים לדם העובר מובילים לרמות חמצן וחומרים מזינים נמוכות יותר בדם האם12,15. עם זאת, הדם של החלל הבין-יבשתי מוחלף לחלוטין בדם טרי ועשיר בחמצן בערך פעמיים עד שלוש פעמים בדקה, מה שמבטיח אספקה רציפה של חומרי מזון וגזים13. יש לציין כי הסינסיטיוטרופובלסט, החלק החיצוני ביותר של מחסום השליה, הוא המרכיב היחיד בעץ השליה החשוף ישירות לדם האימהי15,16,17. כתוצאה מכך, הסינקיטיוטרופובלסט חווה לחץ גזירה קל קבוע מהדם האימהי הזורם 3,14.
הידע המדעי הנוכחי לגבי סביבת זרימת השליה וההתקדמות הטכנית המודרנית מאפשרים כיום גידול מותאם ומשוער פיזיולוגית של צמחי שליה בתנאי זרימה. יתר על כן, ראיות מצביעות על כך שכוחות גזירה משפיעים על התפקודים הביולוגיים של סינקיטיוטרופובלסט 18,19,20,21. גישה ידועה האחראית לזרימת הדם היא מערכת זילוח האנייה הכפולה השליה22. עם זאת, ניסויים אלה דורשים מומחיות משמעותית, הם מוגבלים בזמן (נערכים רק כמה שעות), והם אפשריים רק עם דגימות שליה שליש שלישי 3,23. לעומת זאת, פיתחנו טכניקה פשוטה ולא פולשנית לתרבית צמחי שליה ex vivo תחת הגדרות זרימה קבועות, המתאימה הן לרקמות שליה בשליש הראשון והן בשליש השלישי3. במערך זה, צמחי שליה מעובדים בחמישה תאי זרימה המחוברים לסדרה. צמחים וילוס מאובטחים לתחתית התא באמצעות הגבהות בצורת מחט על לוחות מתכת דקים. מעגל הזרימה שנבנה מועבר לאחר מכן לביוריאקטור, שבו ריכוז החמצן וקצב הזרימה מווסתים3. תוצאות תרבית הזרימה מראות כי שלמות הרקמה נשמרת טוב יותר בהשוואה לשיטה סטטית3 המשמשת בדרך כלל. יתר על כן, גישה דינמית זו מאפשרת עיצובים ניסיוניים חדשניים ומותאמים לתרבית צמחי רקמות, ומאפשרת ניסויים במבחנה המחקים בצורה קרובה יותר את הסביבה הטבעית3.
Protocol
ועדת האתיקה של האוניברסיטה הרפואית של גראץ אישרה מחקר זה (31-019 ex 18/19 גרסה 1.2 ו- 29-319 ex 16/17). הסכמה מדעת התקבלה מכל הנבדקים המעורבים במחקר.
1. הכנה לניסוי הזרימה
הערה: הניסויים נערכים בביוריאקטור עם משאבות פריסטלטיות משולבות (ראה טבלת חומרים). ניתן לכוונן את הלחות, הטמפרטורה ורמת הגזים בתוך הביוריאקטור.
- הפעל את הביוריאקטור ובצע את כל הסידורים המוקדמים (למשל, כיול המשאבות, התחממות מוקדמת, תנאי גז ולחות) לניסוי בהתאם למדריך של הביוריאקטור. לפני תחילת הניסוי, יש לייצב את ההגדרות הנדרשות (טמפרטורה, תכולת גז, לחות) למשך מספר שעות או לילה. לשם כך, הפעל את הביוריאקטור ואת התוכנה ולאחר מכן לחץ על Change SetPoints תחת פריט התפריט "אינקובטור".
- PBS טרום חם והמדיום הנדרש (מדיום צמיחת תאי אנדותל בתוספת תוספי hEGF-5, HC-500 וכן 5% סרום בקר עוברי מדולדל אקסוזום, 1% פניצילין/סטרפטומיצין) (ראה טבלת חומרים) עד 37 מעלות צלזיוס.
2. דיסקציה של דגימת שליה
- מיד לאחר הלידה, לחתוך שלוש פעמים 2 ס"מ 3 דגימות שליה מאזור השליה האמצעית כמתואר Kupper et al.3 בקצרה, לשמור את הדגימות PBS. השליכו את הצלחת הכוריונית, את ההחלטה האימהית ואזורים של אוטמים גלויים מהדגימה.
- מנתחים את דגימת הרקמה הנותרת לחצילים ויליים בקוטר חתך של כ-0.5 ס"מ (משקל רטוב של כ-7.5 מ"ג). מעבירים אותם לצלחת פטרי עם PBS טרי.
- שטפו את החצילים ב-PBS על ידי ניעור עדין שלהם בנוזל עם פינצטה כדי להסיר שאריות דם.
הערה: נתחו את הדגימות בצלחת פטרי עם PBS כדי לשטוף מראש ולמנוע מהן להתייבש והשתמשו בכלים מעוקרים/אוטומטיים לעיבוד הרקמה.
3. ניסוי זרימה
- מתחת למכסה מנוע סטרילי, חברו חמישה תאים בסדרות לבקבוק המאגר באמצעות מנעולי הפיתוי בהתאם למדריך למשתמש של תאי הזרימה (ראו טבלת חומרים).
הערה: יש לעקר ו/או לבצע אוטוקלאבינג של כל החומרים לפני השימוש, בהתאם למדריך המתאים. השתמש במסנן אוויר על בקבוק המאגר להחלפת גזים סטריליים. כדי לפתוח ולסגור את החדרים, לסחוט בעדינות את lugs של החדרים. שלב 3.1. ניתן להכין גם מוקדם יותר. - הפוך את התאים ופתח אותם על ידי הסרת התחתית. השתמשו במלקחיים כדי להעביר את לוחות המתכת למרכז בחלק העליון של התאים כאשר הפינים מכוונים כלפי מעלה.
- ממלאים את התאים עם 1 מ"ל של בינוני מחומם מראש (37 ° C). לאחר מכן למלא את המאגר עם 20 מ"ל נוספים. המעגל דורש סך של 25 מ"ל, כולל הנפח בכל תא זרימה, בצינורות, ובקבוק המאגר. תחת הזרימה, הנפח הסופי של המדיום בתא מלא הוא 2 מ"ל.
- השתמשו במלקחיים והעבירו חציל אחד אחרי השני בין המחטים של צלחת המתכת בחדר. תן למחטים להחליק בין וילי השליה כדי למנוע נקב של הרקמה. מעבירים ארבעה אקספורטים לתא אחד. סגור את החדרים על ידי התאמה מחדש של התחתית בזהירות. מעגל שלם מכיל בסך הכל 20 explants. החדרים צריכים להישאר במצב הפוך.
הערה: אחזו בצמחים בעדינות עם המלקחיים; נסו לא לסחוט אותם. ודא שהתאים והמעגל אטומים לחלוטין כדי למנוע דליפה. החדרים משמשים תמיד הפוך. מספר הצמחים לתא ומספר התאים עצמם משתנים. ההליך עבור רקמת השליש הראשון דומה לזה של רקמת השליש השלישי עם תוספת קטנה: כדי לתקן את villi, לכופף את המחטים מעט מעל explants לאחר הרקמה הועברה לצלחת מתכת (תקשורת אישית Brugger et al). פעולה זו מקבעת את הרקמה השברירית על לוח המתכת ומונעת מהדגימות להחליק. - מעבירים את מכלול הזרימה לתוך הביוריאקטור.
- חבר את מעגל הזרימה למשאבה הפריסטלטית בתוך הביוריאקטור על ידי חיבור צינור המשאבה למשאבה. תקן אותו בשלבהרביעי (אחד ישמע אותו לוחץ ארבע פעמים).
- אם נדרשת בקרה סטטית, אז גם למקם את צלחת הבאר לתוך bioreactor.
הערה: עבור תרבית סטטית, חמש בארות של צלחת שש בארות מלאות 4 מ"ל של בינוני לכל באר ו 4 explants villous לכל באר. צלחת הבאר המלאה ממוקמת גם היא בביוריאקטור ומתורבתת באותה אטמוספירה שבה מתרבה תרבית הזרימה. פרטים נוספים מתוארים בספר Kupper et al.3 - הגדר את מצב המשאבה לידני תחת פריט התפריט "משאבות". לאחר מכן הגדר את מהירות המשאבה ל -1 מ"ל / דקה והתחל לשאוב את המדיום לתוך הצינור על ידי לחיצה על הפעל. בזמן שהמעגל מתמלא בתווך, החזק את התאים בזווית כך שהם יתמלאו לחלוטין בתווך.
הערה: ראה טבלה משלימה 1 להגדרות הניסוי עבור זרימת שליה ותרבית סטטית. פירוט המערכת הזרימית והסטטית מופיע בטבלה משלימה 2.
אזהרה: יש להטות בזהירות את התא במהלך המילוי כדי למנוע מהדגימות להחליק מהמחטים. - לאחר השלמת המילוי, החדרים נשארים במקומם ההפוך. ודא שהתאים עומדים בצורה בטוחה וזקופה, וסגור את שני העפעפיים של הביוריאקטור.
הערה: הנפח הסופי של התווך בתא זרימה מלא הוא 2 מ"ל. הגדרות הניסוי והמפרט של תאי הזרימה ולוחות הבארות ששימשו בניסויים מתוארים ב-Kupper et al.3 - לדגור על הרקמה לזמן הרצוי.
הערה: ניתן לנטר את הטמפרטורה, רמת הגז וקצב הזרימה במחשב מבלי לפתוח שוב את מכסה הביוריאקטור. - עצור את המשאבה לאחר הדגירה של הרקמה לזמן הרצוי על ידי לחיצה על הפלה תחת פריט התפריט "משאבות". פתח את שני המכסים של הביוריאקטור ולאחר מכן תא זרימה אחד בכל פעם. בזהירות להסיר את explants מן צלחת מתכת באמצעות מלקחיים.
- לעבד את הרקמה ואת supernatant על פי ניתוח במורד הזרם שנבחר. במקרה זה, צביעה אימונוהיסטוכימית ומיקרוסקופ אלקטרונים בוצעו3. ראה טבלה משלימה 3 לפירוט הנוגדנים המשמשים לאימונוהיסטוכימיה ואימונופלואורסנציה.
הערה: לאחר הסרת הרקמה, נקז את התווך מהמעגל על ידי סיבוב נגד כיוון השעון של המשאבה. - יש לפרק ולנקות את מעגל הזרימה בהתאם להוראות היצרן לתאי הזרימה והצינורות.
תוצאות
חלקים מפרסום זה ותוצאותיו כבר פורסמו (ראו הפניות 3 ו-23).
מערך ניסיוני
מערך ניסויי מומחש באיור 1. מחזור זרימה מרוכב מורכב מחמישה תאי זרימה המחוברים זה לזה בסדרות (איור 1A). בתוך כל תא זרימה מעובדים ארבעה צמחים, כל אחד בקוטר חתך של כ-0.5 ס"מ (איור 1 A,C). עבור ניסוי הבקרה הסטטית, הצמחים מעובדים בבארות נפרדות של צלחת בת שש בארות (איור 1B). כדי למנוע מהצמחים להישטף החוצה, הם מודבקים על לוחות מתכת עם בליטות צרות בצורת מחט (איור 1 D,E). כדי לחשוף את הצמחים לזרימה ישירה של התווך, החדרים הפוכים, כאשר הפתחים והשקעים ממוקמים באזור הראש (איור 1 F,G). בתוך הביוריאקטור, מחזור הזרימה קשור למשאבה פריסטלטית. לצורך השוואת שלמות הרקמה בין רקמה בתרבית זרימה לבין רקמה בתרבית סטטית קונבנציונלית, מניחים את הצמחים בצלחת בת שש בארות הצמודה למחזור הזרימה. זה מבטיח אימות של תנאי תרבית עקביים במונחים של חמצן, טמפרטורה ולחות (איור 1A)3.
ניתוח מורפולוגי
β-אקטין
הליכי צביעה אימונוהיסטוכימיים שונים נערכו כדי לבחון הבחנות היסטולוגיות בשלמות רקמות הקשורות לתנאי גידול מגוונים (איור 2). צמחים שהוטבעו מיד לאחר הדיסקציה שימשו כהפניה הבסיסית. לצורך ניתוח שלד האקטין בתוך צמחילים ויליים, בוצעה צביעת β-אקטין (איור 2A-E). ניתוח תיאורי חשף הצגה חזותית מובנית ומאורגנת היטב של שלד הציטו-שלד ברקמה שזה עתה התקבלה (איור 2A). עם הזמן, ככל שהטיפוח התקדם, הייתה הצטברות נצפית של מיקרופילמנטים, המסמלת השפלה של מבנה השלד הציטו-שלד. התופעה הזו נצפתה באופן עקבי בצמחי וילי שעברו טיפוח סטטי3 (איור 2C,E, מסומן בכוכביות).
צביעת H&E
צביעת H&E סיפקה חיזוק נוסף לתצפית ששלמות הרקמה פוחתת במהלך התרבית הסטטית, מגמה שמשתפרת בהקשר של תרבית זרימה (איור 2F-J). רקמה טרייה הציגה הצגה היסטולוגית מובנית ואופיינית של החצילים הוויליים, המאופיינת בסטרומה צפופה וצפופה (איור 2F). נוסף על כך, הסינקיטוטרופובלסט היה דבוק היטב לסטרומה הבסיסית (איור 2F). הופעה דומה נצפתה בצמחים ויליים שגודלו בתרבית בסביבת זרימה במשך 24 שעות (איור 2G). אולם לאחר 48 שעות של טיפוח תחת הזרימה, חלקים מהסינקיטיוטרופובלסטים נצפו מנותקים חלקית (איור 2I, מסומן בחץ), מלווים בלאקונה קטנה ספורדית בתוך הסטרומה. בדיקה היסטולוגית של הרקמה הצביעה על כך ששלמות הרקמה לאחר 24 שעות במצב של תרבית סטטית לא השתמרה כראוי (איור 2H). יתר על כן, שלמות זו התדרדרה במידה ניכרת לאחר 48 שעות בתרבית סטטית (איור 2J). הסטרומה הפגינה מראה נקבובי ומגולען, וניתוק משמעותי של הסינקיטיוטרופובלסט מהסטרומה ניכר באזורים גדולים יותר (איור 2J, חצים)3.
CD34II
צביעת CD34II שימשה כדי להמחיש תאי אנדותל, וכתוצאה מכך, את כלי הדם העובריים-שליה בתוך הצמחים הוורידים (איור 2K-O). רקמה שהוטבעה ישירות מיד לאחר הדיסקציה הציגה סידור מאורגן באופן ייחודי של תאי האנדותל (איור 2K). השלמות המורפולוגית של כלי הדם העובריים-שליה נותרה נשמרת היטב לאחר 24 שעות של תרבית זרימה ולעתים קרובות גם לאחר 48 שעות, אם כי מקרים מזדמנים של כלי דם שקרסו נצפו בתנאי זרימה (איור 2 L,N). אולם לאחר 24 שעות של תרבית סטטית, כלי הדם הפגינו קריסה חלקית, כפי שמעידה המראה החזותי המשובש שלהם (איור 2M, מסומן על-ידי ראשי חץ). נראה כי הידרדרות זו של כלי הדם במסגרת התרבית הסטטית החמירה עם זמן גידול ממושך. לסיכום, ההערכה המורפולוגית התיאורית של הצמחים הווריליים לאחר הזרימה והתרבות הסטטית הצביעה על כך שנראה כי שלמות הרקמה נשמרת בצורה יעילה יותר בתוך מערכת הזרימה כאשר היא מנוגדת למצב התרבית הסטטית3.
ניתוח אולטרה-סטרוקטורלי של הרקמה המעובדת
מיקרוסקופ אלקטרונים תמסורת
כדי לבצע בדיקה מפורטת יותר של המורפולוגיה של הצמחים הוויליים, בוצעו ניתוחים אולטרה-מבניים נוספים באמצעות מיקרוסקופ אלקטרונים תמסורת (TEM) (איור 3A-E). ממצאים אלה איששו את תוצאות החקירות ההיסטולוגיות. ברקמה שהוטבעה ישירות מיד לאחר ההכנה, המורפולוגיה השתמרה בצורה יוצאת דופן (איור 3A). מיקרוווילי ניתן היה להבחין בבירור על פני השטח של הסינקיטיוטרופובלסט. הסינסיטיוטרופובלסט הציג את השכבה הרציפה הייחודית שלו ללא גבולות התא הרוחביים, ויצר מגע ישיר עם קרום המרתף. הסטרומה של הרקמה הטרייה הציגה אריזה צפופה ללא נקבים או קרעים משמעותיים. יתר על כן, המראה האולטרה-סטרוקטורלי של כלי הדם ואריתרוציטים תוך-וסקולריים אינדיבידואליים הדגימו גם הם שימור מצוין (איור 3A).
אפילו לאחר 24 שעות של תרבית זרימה, המורפולוגיה הכוללת של דגימות הרקמה נותרה יחסית מטופחת (איור 3D). בעוד שהיו מעט פחות מיקרוווילים על פני השטח של הסינקיטיוטרופובלסט בהשוואה לרקמה טרייה, הסינקיטיוטרופובלסט נשאר מחובר בעיקר לקרום הבסיס. גרעינים ומדי פעם נצפו חללים קטנים בתוך החלק הפנימי של הסינקיטיוטרופובלסט. הסטרומה בתוך וילי השליה נראתה שמורה היטב ודמתה מאוד לרקמה טרייה (איור 3D). אפילו לאחר 48 שעות של תרבית זרימה, תאי הסטרומה הראו השתמרות טובה יחסית, אם כי עם כמה נקבים נוכחים (איור 3E). באופן מסקרן, טיפות שומנים התגלו בתוך הרקמה. בעוד שהסינקיטיוטרופובלסט הראה vacuoles וירידה במספר המיקרוווילי, הוא נשאר מחובר לקרום הבסיס באזורים רבים, וגרעיני סינציאלי וגרעיני תאים נראו בבירור (איור 3E).
בניגוד מוחלט לרקמה מתרבית הזרימה, המורפולוגיה של רקמת הווריון שהייתה נתונה לתרבית סטטית הראתה הידרדרות כבר לפני 24 שעות (איור 3B). הסינקיטוטרופובלסט התנתק מקרום הבסיס במספר אתרים והציג נקבים משמעותיים יחסית. נוסף על כך, טיפות שומנים ניכרו לעתים קרובות גם בסינקיטיוטרופובלסט וגם בסטרומה (איור 3B). לאחר 48 שעות של תרבית סטטית, נצפתה ירידה הדרגתית במבנה האולטרה (איור 3C). הסינקיטיוטרופובלסט הציג נקבים רבים וניתוק מהקרום הבסיסי במידה ניכרת. זיהוי תאים בתוך הסטרומה, כמו גם תאי אנדותל המרכיבים את כלי הדם, הפך למאתגר. יתר על כן, הייתה הצטברות ניכרת של טיפות שומנים בתוך הצמחים הוויליים לאחר 48 שעות של תרבית סטטית (איור 3C). לסיכום, מבנה העל של הרקמה בתרבית סטטית הציג הידרדרות רצופה לאורך תקופת הגידול, מגמה שהתמתנה על ידי טיפוח בתנאי זרימה3.
מיקרוסקופ אלקטרונים סורק
באמצעות שימוש במיקרוסקופ אלקטרונים סורק (SEM), התאפשרה בחינה מפורטת של פני השטח של הצמחים הווריליים (איור 4A-J). רקמה שזה עתה הוטמעה הציגה מערך מאוכלס בצפיפות של מיקרוווילי על פני השטח שלה (איור 4 A,B). אזורים מסוימים הציגו מבנים דמויי שלפוחית. לעומת זאת, רקמה מהתרבית הסטטית הראתה ירידה משמעותית במיקרוווילי לאחר 24 שעות (איור 4C,D), ירידה שנמשכה לאחר 48 שעות (איור 4E,F). בעוד שאזורים מסוימים הראו הצטברות של מבנים דמויי שלפוחית שלא שוחררו, אזורים אחרים נראו חשופים ונשחקו (איור 4D,F). ברקמה שהייתה נתונה לתרבית זרימה, מיקרו-וילי עדיין היו נוכחים על פני השטח אחרי 24 שעות (איור 4G,H), כמו גם אחרי 48 שעות (איור 4I,J), אם כי במידה פחותה מאשר ברקמה טרייה. בהשוואה לתרבית הסטטית, השכיחות של מבנים דמויי שלפוחית על פני השטח פחתה. באופן מסקרן, המבנים דמויי השלפוחית האלה התרכזו בעיקר בגומחות ספציפיות שבהן הזרימה יכולה להיות מופחתת או נעדרת (איור 4H,J), מה שמרמז על כך שייתכן שהם נעקרו משטח הרקמה החשופה לזרימה עקב זרימת התווך3.

איור 1: הגדרת מערכת הזרימה . (A) מערכת הזרימה המורכבת, המורכבת מהמאגר ומחמישה תאי זרימה, מחוברת לאחת המשאבות הפריסטלטיות. בצד ימין צלחת שש בארות שבה הצמחים מתורבתים באופן סטטי. (ב,ג) עבור שתי שיטות הגידול, דגימות השליה מנותחות לצמחים ויליים של כ 0.5 ס"מ2, מתוכם ארבעה explants משמשים לאחר מכן לכל באר או חדר. בגישה ניסיונית, חמישה תאים או בארות משמשים. (ד,ה) עבור תרבות זרימה, צלחת מתכת עם הגבהים צרים בצורת מחט משמש כדי לאבטח את explants. (ו,ז) פתחי הצינורות ממוקמים בראש החדרים, ולכן משתמשים בהם הפוך כדי להבטיח שהרקמה תהיה חשופה לזרימה ישירה. נתון זה משוכפל מתוך Kupper et al.3. אנא לחץ כאן כדי להציג גרסה גדולה יותר של איור זה.
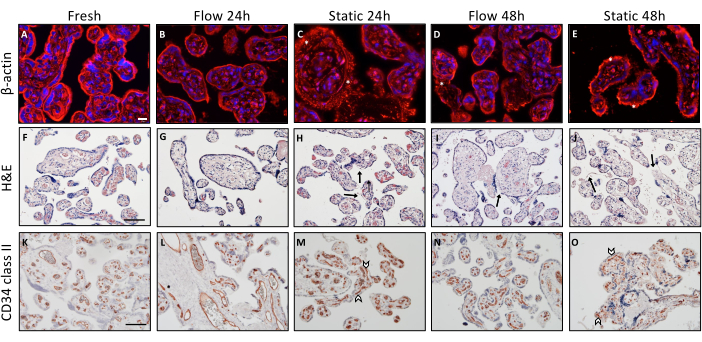
איור 2: ניתוח מורפולוגי של צמחי שליה בזרימה ובתרבית סטטית. (א-ה) צביעה אימונופלואורסצנטית עבור β-אקטין כדי לדמיין את השלד הציטו-שלד של צמחים על תרבית. לצורך הניתוח נעשה שימוש בשישה כתמים שנבחרו באופן אקראי בכל שקופית. מוצגות תמונות מייצגות. (A) הדמיה של שלד הציטו-שלד של הרקמה המשובצת מיד לאחר ההכנה. סרגל קנה מידה: 20 מיקרומטר. (B-E) תיאור מייצג של ניוון תלוי זמן ותלוי-מצב טיפוח של שלד האקטין בצמחים מתורבתים של זרימה ותרבית סטטית. (ג-ה) כוכביות מסמלות הצטברות מוגברת של מיקרופילמנט אקטין (actin microfilament), המהווה אינדיקציה להתפרקות שלד אקטין (actin cytoskeleton). (פ-י) צביעת Hematoxylin-eosin של explants villous. סרגל קנה מידה: 100 מיקרומטר. (F,G) צמחי רקמה משובצים טריים (F) וצמחי תרבית זרימה במשך 24 שעות (G) מראים מורפולוגיה שמורה היטב של צמח וילוס. (I) צמחים בתרבית זרימה במשך 48 שעות מראים אזורים מנותקים לסירוגין של הסינקיטיוטרופובלסט (חץ). (ח,י) הידרדרות תלוית זמן של שלמות מבנית לאחר תרבית אקספלנט סטטית, המסומנת על ידי התפוגגות של סינקיטיוטרופובלסט (חץ) וסטרומה מחוררת. (יא-ו) CD34 II שימש להכתמת תאי אנדותל וילוס. סרגל קנה מידה: 100 מיקרומטר (K,L) רקמה טרייה (K) וצמחים בתרבית במשך 24 שעות בתנאי זרימה (L) מציגים תבנית אופיינית של תאי אנדותל מיושרים מבנית. (N) לאחר 48 שעות בתרבית זרימה, שלמות כלי הדם יורדת במידה מסוימת. (ז,א) בתרבית סטטית, כלי דם שקרסו נראים כבר לאחר 24 שעות (M), אשר נצפתה עולה עם זמן גידול סטטי ארוך יותר (O). נתון זה משוכפל מתוך Kupper et al.3. אנא לחץ כאן כדי להציג גרסה גדולה יותר של איור זה.
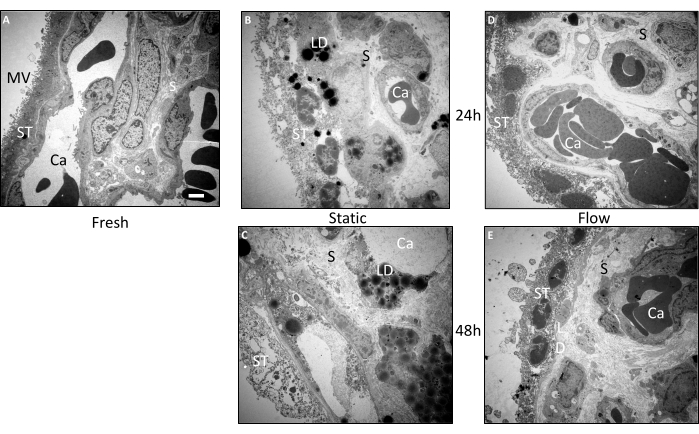
איור 3: בדיקה אולטרה-מבנית לפני ואחרי הטיפוח של צמחי וילי באמצעות מיקרוסקופ אלקטרונים תמסורת. רקמות משלושה ניסויים עצמאיים שימשו לניתוח התמונות. (A) תמונה מייצגת של רקמה משובצת טרייה מראה כמות גדולה של מיקרוווילי (MV) על פני השטח של הסינקיטיוטרופובלסט (ST). נימים שלמים מבחינה מבנית (Ca) נראים בסטרומה (S) שהשתמרה היטב. (B) ברקמה שעברה תרבית סטטית במשך 24 שעות, יש הידרדרות בשלמות המבנית של הסינקיטיוטרופובלסט, שנראה מנותק מהקרום הבסיסי באזורים מסוימים. יש גם הצטברות ניכרת של טיפות שומנים (LD). (C) לאחר 48 שעות בתרבית סטטית, נצפתה הידרדרות אולטרה-מבנית חמורה. הסטרומה, כמו גם הסינקיטיוטרופובלסט, מחוררים וניכרת הצטברות מסיבית של טיפות שומנים. בקושי ניתן היה לאתר כלי דם. (ד,ה) מבנה העל של הרקמה מתרבית הזרימה השתמר טוב יחסית לאחר 24 שעות (D) וכן לאחר 48 שעות (E). סרגל קנה מידה: 2 מיקרומטר. MV: Microvilli, ST: Syncytiotrophoblast, S: Stroma, Ca: נימים, LD: טיפות שומנים. נתון זה משוכפל מתוך Kupper et al.3. אנא לחץ כאן כדי להציג גרסה גדולה יותר של איור זה.

איור 4: בדיקה אולטרה-מבנית לפני ואחרי הטיפוח של צמחי וילוס באמצעות מיקרוסקופ אלקטרונים סורק. (A,C,E,G,I) סקירה כללית של פני השטח של עצי השליה עם תמונות מפורטות בהתאמה (B,D,F,H,J). (א,ב) רקמה משובצת טרייה מציגה תפר צפוף של מיקרוווילי. (B) ניתן להבחין במבנים דמויי שלפוחית במיקומים מסוימים. (ג-ו) לאחר 24 שעות ו 48 שעות בתרבית סטטית, ירידה microvilli על פני השטח של syncytiotrophoblast גלוי. בולטת היא הצטברות נרחבת של חלקיקים דמויי שלפוחית על פני השטח של explant. (F) נראה שהחלקיקים קמלים לאחר 48 שעות בתרבית סטטית. (ג-י) פני הרקמה מתרבית הזרימה נראים שמורים טוב יותר לאחר 24 שעות (G,H) וכן לאחר 48 שעות (I,J) בהשוואה לתרבית הסטטית. מיקרוווילי נראים על פני השטח (H,J), אם כי לא באותה צפיפות גבוהה כמו ברקמה הטרייה. (B) ניתן לראות חלקיקי שלפוחית מפוזרים בגומחות עם זרימה מופחתת. נתון זה משוכפל מתוך Kupper et al.3. אנא לחץ כאן כדי להציג גרסה גדולה יותר של איור זה.
טבלה משלימה 1: הגדרות ניסוי לזרימת שליה ותרבית סטטית. אנא לחץ כאן כדי להוריד קובץ זה.
טבלה משלימה 2: מפרט המערכת הזרימית והסטטית. אנא לחץ כאן כדי להוריד קובץ זה.
טבלה משלימה 3: נוגדנים לאימונוהיסטוכימיה ואימונופלואורסנציה ששימשו במחקר זה. אנא לחץ כאן כדי להוריד קובץ זה.
Discussion
מחקר זה מציג נקודת מבט ייחודית על טכניקת תרבית זרימה לצמחי שליה שנועדה לשכפל את הדינמיקה בסביבת הרחם 3,23. הממצאים מגלים כי המורפולוגיה של רקמה בתרבית בתנאי זרימה נשמרת טוב יותר בהשוואה לשיטת הגידול הסטטית המסורתית3. יש לציין כי אף על פי שלא תנאי תרבית סטטיים ולא תנאי תרבית זרימה מאפשרים זילוח של כלי השליה, הרס כלי הדם העובריים-שלייתיים בתוך הסטרומה הוורידית נצפה בעיקר בתרבית סטטית, בעוד ששלמות כלי הדם נראתה נשמרת טוב יותר לאורך זמן רב יותר בתרבית זרימה3.
הסבר אפשרי אחד לתצפית זו יכול להיות קשור לתפקיד ההגנתי והאנדוקריני המכריע של הסינקיטיוטרופובלסט, פונקציה שתועדה היטב בספרות 12,24,25,26. בהתחשב בכך, ניתן להעלות על הדעת כי השלמות הכוללת של השכבה החיצונית של הווילי תורמת באופן משמעותי לשמירה על הסטרומה הבסיסית, כולל כלי הדם. כתוצאה מכך, ניתן לייחס את השלמות התאית המתמשכת של כלי הדם בתנאי זרימה לזרימה רציפה של התווך. תנועה זו מסייעת לתנועה פסיבית של הצמחים, ומקלה על חילופי גזים, חומרי מזון וננו-חלקיקים (כמו שלפוחיות חוץ-תאיות) על פני מחסום השליה. זה, בתורו, יכול להשפיע באופן חיובי על שימור המורפולוגיה של כלי הדם. יתר על כן, תופעת המכנוסנסציה ממלאת תפקיד במורפוגנזה של רקמות על פני רקמות שונות27,28. מחקרים הראו כי רגישות למכנו משפיעה על תהליכים תאיים ברמות רבות, ומעוררת מגוון תגובות ביוכימיות המשפיעות בסופו של דבר על תפקוד הרקמות והאיברים29. יש לציין כי חלבונים רגישים למכנו באים לידי ביטוי על ידי סינקיטיוטרופובלסט במהלך ההיריון28. יתר על כן, המחקר מציע כי microvilli על פני הרקמה עשוי להיות מעורב בהקשר זה28.
נקודת מבט נוספת שכדאי לשקול היא התפקיד הפוטנציאלי של המיטוכונדריה בתגובה התאית לזרימה. לדוגמה, בתאי אנדותל, מיטוכונדריה משמשים כמתמרי אותות לתגובות תאיות לגירויים סביבתיים30. הצטברות מוגברת של טיפות שומנים, שנצפתה ברקמה סטטית בתרבית באמצעות TEM3, נקשרה להשראת אפופטוזיס עקב תפקוד לקוי של המיטוכונדריה31. חקירות נוספות נחוצות כדי לחשוף את המנגנונים הבסיסיים ואת גורמי המפתח, ולקשר אותם למסלולי איתות במורד הזרם. חקירה זו עשויה לשפר את הבנתנו כיצד הרקמה תופסת ומגיבה לעקה גזירה, ולתרגם אותה לשיפור הכדאיות והשלמות של צמחי וילוס בתרבית23.
יש לחזור על מספר צעדי פרוטוקול קריטיים ולבצע אותם בזהירות. לאחר מסירת שליה, רקמה צריכה להיות בתרבית מהר ככל האפשר. במהלך הכנת explant, הימנעות מאזורים עם אוטם גלוי הוא חיוני. חשוב לטפל בעדינות בעציצים עם מלקחיים למניעת סחיטה. מומלץ לשמור על הרקמה מכוסה בנוזלים לאורך כל ההליך ולבצע אותו במהירות.
חשוב להכיר בכך שמחקר זה אינו מסוגל לציין את לחץ הגזירה המדויק בתוך מערכת הזרימה המוצגת, דבר שיש להתייחס אליו כמגבלה בחקירות עתידיות 3,23. עם זאת, חשוב להכיר בכך שמהירות זרימה מדויקת ומתח גזירה עבור וילוס שליה ספציפי in vivo מושפעים מפרמטרים רבים, כגון המאפיינים הגיאומטריים של המרחב הבין-ווילי, מיקומו של הווילוס בתוך מרחב זה, וקרבתו וזוויתו לעורקים ספירליים וורידי רחם 3,19,23,32 . יש לקחת בחשבון גם את מורכבות המבנה הגיאומטרי של השליה, המשתנה בין פרטים,23,32. מודלים מתמטיים המעריכים את זרימת הדם בתוך המרחב הבין-וילי32 וחישובים על לחץ גזירת הקיר על סינקיטיוטרופובלסט19,28 כבר קיימים. באופן מעניין, מחקר אחד חזה כי לחץ הגזירה על הסינקיטיוטרופובלסט נמוך יותר בשליש השלישי בהשוואה לשליש הראשון28, בעוד שמחקר אחר הדגים לחץ גזירה הטרוגנית מרחבית על הסינקיטיוטרופובלסט19. קביעת מהירות הזרימה המדויקת ולחץ הגזירה עבור וילוס שליה ספציפי נותרה אתגר 3,19,23,32. חישובים כאלה מציעים קירוב של טווח מתח הגזירה לחקירות עתידיות, אך הם עשויים לדרוש התאמות אנטומיות מתמשכות ואופטימיזציה23. יתר על כן, מחקרים עתידיים עשויים לפתח טכניקות חדשות ומעודנות של תרבית זרימה המתחשבות בגיאומטריה המורכבת של המרחב הבין-יבשתי ואסטרטגיות להגדלת מספר הדגימות לניסוי3. צפויה התקדמות ופיתוח מתמשכים של מערכת הזרימה, תוך שימוש פוטנציאלי בתאי זרימה חלופיים (Brugger et al., נתונים שלא פורסמו, 2023).
לסיכום, מחקר זה מניח בסיס איתן על ידי הדגמת טכניקת תרבות זרימה ex vivo הניתנת ליישום בקלות השומרת על השלמות המבנית של צמחי וילוס מתורבתים. הוא מדגיש את חשיבותן של טכניקות דינמיות בלימודי ביולוגיה פונקציונלית של שליה, וסולל את הדרך להתקדמות נוספת במערכות תרבות זרימה וליצירת רעיונות והשערות חדשות 3,23.
Disclosures
המחברים מצהירים כי אין ניגוד עניינים.
Acknowledgements
המחברים מודים על התמיכה הטכנית המצוינת של בטינה אמטמן ופטרה וינקלר לדגימת רקמות. מחקר זה מומן על ידי קרן המדע האוסטרית FWF (DOC 31-B26) והאוניברסיטה הרפואית של גראץ, אוסטריה, באמצעות תוכנית הדוקטורט הפרעות דלקתיות בהריון (DP-iDP).
Materials
| Name | Company | Catalog Number | Comments |
| 6-well plates | NUNC, ThermoFisher Scientific, Waltham, MA, USA | 140675 | |
| Alexa Fluor 555 goat-anti-mouse | ThermoFisher Scientific, Waltham, MA, USA | A21422 | Diluted in PBS, 1:200 |
| antibody diluent | Dako, Santa Clara, CA, USA | S3022 | |
| anti-β-actin (AC-15) | Abcam, Cambridge, UK | ab6276 | Stock concentration: 2.1 mg/mL, diluted in antibody diluent, 1:10,000 |
| Bioreactor TEB500 | TEB500, EBERS Medical Technology SL, Zaragoza, Spain | Serial Number: TEB505 / 1000EW/ 117 | |
| CD34 Class II (QBEnd-10) | Dako, Santa Clara, CA, USA | M7165 | Stock concentration: 12 mg/l, diluted in antibody diluent, 1:500 |
| CPD 030 critically point dryer | Bal-Tec, Balzers, Liechtenstein) | Critically point dryer | |
| DAPI | ThermoFisher Scientific, Waltham, MA, USA | D21490 | Diluted in PBS, 1:1000 |
| Ebers TEB505 Series Software | TEB500, EBERS Medical Technology SL, Zaragoza, Spain | Series Software 1.4 | |
| Endothelial Cell Growth Medium MV | PromoCell PC-C-22120, Heidelberg, Germany; | C-22120 | Used without EGCS/h and FCS, any other medium suitable for the tissue can be used |
| Excelsior AS Tissue Processor | ThermoFisher Scientific, Waltham, MA, USA | ||
| Exosome-depleted fetal bovine serum | Gibco by Life Technologies, ThermoFisher Scientific, Waltham, MA, USA | A2720803 | |
| Histolab Clear | Histolab, Askim, Sweden | 14250-TY | |
| Hydrogen Peroxide Block | ThermoFisher Scientific, Waltham, MA, USA | TA125H202Q | |
| Kaiser’s Glycerin Gelatine | Merck, Darmstadt, Germany | 1092420100 | |
| Leica DM 6000 B microscope | Leica, Wetzlar, Germany | Equipped with an Olympus DP 72 Camera | |
| Leica UC7 ultramicrotome | Leica Microsystems, Vienna, Austria) | ||
| Metal plate with needles | In-house construction | ||
| Microtome | Microtome Microm HM 355 S, ThermoFisher Scientific, Waltham, MA, USA | ||
| Microwave oven | Miele, Guetersloh, Germany | ||
| Olympus microscope (BX63) | Olympus, Hamburg, Germany | Serial Number: 1A52421 | |
| PBS | ThermoFisher Scientific, Waltham, MA, USA | 10010015 | |
| Penicillin/Streptomycin | Gibco by Life Technologies, ThermoFisher Scientific, Waltham, MA, USA | 2585627 | |
| Primary antibody enhancer | ThermoFisher Scientific, Waltham, MA, USA | TL-125-PB | |
| ProLong Gold Antifade Reagent | ThermoFisher Scientific, Waltham, MA, USA | P36934 | |
| Pumping tube | Tygon, Bartelt, Graz, Austria | 6.078 175 | 1.02 mm diameter |
| QV500 Flow chambers | Kirkstall Ltd., Quasi Vivo, North Yorkshire, UK | QV500 | Other chambers would work as well |
| SCD 500, sputter coater | Bal-Tec, Balzers, Liechtenstein | Sputter coater | |
| Substrate amino-ethyl carbazole, AEC substrate kit | Abcam, Cambridge, UK | ab64252 | |
| Superfrost Plus slides | Menzel-Glaeser, Braunschweig, Germany | J1800AMNZ | |
| Syringe Filter | Corning Incorporated, NY, USA | 431219 | 0.2 µm Pore SFCA Membrane, air filter for the reservoir bottle |
| TAAB epoxy resin | Agar Scientific, Stansted, Essex, UK | T001 | |
| UltraVision LP-Detection System HRP-Polymer | ThermoFisher Scientific, Waltham, MA, USA | TL-125-HL | |
| UltraVision Protein Block | ThermoFisher Scientific, Waltham, MA, USA | TA125BPQ | |
| Zeiss EM 900 transmission electron microscope | Zeiss, Oberkochen, Germany | ||
| Zeiss Sigma 500 field emission scanning electron microscope | Zeiss, Cambridge, UK | Used with a back-scattered electron detector at 5 kV acceleration voltage |
References
- Villee, C. A. The metabolism of human placenta in vitro. Journal of Biological Chemistry. 205 (1), 113-123 (1953).
- Miller, R. K., et al. Human placental explants in culture: Approaches and assessments. Placenta. 26 (6), 439-448 (2005).
- Kupper, N., Pritz, E., Siwetz, M., Guettler, J., Huppertz, B. Placental villous explant culture 2.0: flow culture allows studies closer to the in vivo situation. International Journal of Molecular Sciences. 22 (14), 7464 (2021).
- Reti, N. G., et al. Effect of high oxygen on placental function in short-term explant cultures. Cell and Tissue Research. 328 (3), 607-616 (2007).
- Simán, C. M., Sibley, C. P., Jones, C. J. P., Turner, M. A., Greenwood, S. L. The functional regeneration of syncytiotrophoblast in cultured explants of term placenta. American Journal of Physiology-Regulatory, Integrative and Comparative Physiology. 280 (4), R1116-R1122 (2001).
- Toro, A. R., et al. Leptin is an anti-apoptotic effector in placental cells involving p53 downregulation. PLoS ONE. 9 (6), e99187 (2014).
- Morley, L. C., Debant, M., Walker, J. J., Beech, D. J., Simpson, N. A. B. Placental blood flow sensing and regulation in fetal growth restriction. Placenta. 113, 23-28 (2021).
- Wang, Y. Z. S., Wang, Y., Zhao, S. Placental blood circulation. Vascular biology of the placenta. Chapter 2, (2010).
- Huppertz, B. The anatomy of the normal placenta. Journal of Clinical Pathology. 61 (12), 1296-1302 (2008).
- Weiss, G., Sundl, M., Glasner, A., Huppertz, B., Moser, G. The trophoblast plug during early pregnancy: a deeper insight. Histochemistry and Cell Biology. 146 (6), 749-756 (2016).
- Burton, G. J., Woods, A. W., Jauniaux, E., Kingdom, J. C. P. Rheological and physiological consequences of conversion of the maternal spiral arteries for uteroplacental blood flow during human pregnancy. Placenta. 30 (6), 473-482 (2009).
- Gude, N. M., Roberts, C. T., Kalionis, B., King, R. G. Growth and function of the normal human placenta. Thrombosis Research. 114 (5-6), 397-407 (2004).
- Wang, Y. Vascular biology of the placenta. Colloquium Series on Integrated Systems Physiology: From Molecule to Function. 2 (1), 1-98 (2010).
- Moser, G., Windsperger, K., Pollheimer, J., de Sousa Lopes, S. C., Huppertz, B. Human trophoblast invasion: new and unexpected routes and functions. Histochemistry and Cell Biology. 150 (4), 361-370 (2018).
- Kupper, N., Huppertz, B. The endogenous exposome of the pregnant mother: Placental extracellular vesicles and their effect on the maternal system. Molecular Aspects of Medicine. 87 (October 2020), 100955 (2022).
- Huppertz, B. IFPA award in placentology lecture: biology of the placental syncytiotrophoblast - myths and facts. Placenta. 31 (SUPPL), S75-S81 (2010).
- Gauster, M., Moser, G., Wernitznig, S., Kupper, N., Huppertz, B. Early human trophoblast development: from morphology to function. Cellular and Molecular Life Sciences. 79 (6), 345 (2022).
- Lecarpentier, E., et al. Fluid shear stress promotes placental growth factor upregulation in human syncytiotrophoblast through the cAMP-pKA signaling pathway. Hypertension. 68 (6), 1438-1446 (2016).
- Lecarpentier, E., et al. Computational fluid dynamic simulations of maternal circulation: wall shear stress in the human placenta and its biological implications. PLOS ONE. 11 (1), e0147262 (2016).
- Miura, S., Sato, K., Kato-Negishi, M., Teshima, T., Takeuchi, S. Fluid shear triggers microvilli formation via mechanosensitive activation of TRPV6. Nature Communications. 6 (1), 8871 (2015).
- Jauniaux, E., et al. Onset of maternal arterial blood flow and placental oxidative stress. The American Journal of Pathology. 157 (6), 2111-2122 (2000).
- Sodha, R. J., Proegler, M., Schneider, H. Transfer and metabolism of norepinephrine studied from maternal-to-fetal and fetal-to-maternal sides in the in vitro perfused human placental lobe. American Journal of Obstetrics and Gynecology. 148 (4), 474-481 (1984).
- Kupper, N. . Extracellular vesicles from advanced placental explant flow culture and their role in preeclampsia [Dissertation]. , (2022).
- Burton, G. J., Fowden, A. L. The placenta: a multifaceted, transient organ. Philosophical Transactions of the Royal Society B: Biological Sciences. 370 (1663), 20140066 (2015).
- Arora, N., Sadovsky, Y., Dermody, T. S., Coyne, C. B. Microbial vertical transmission during human pregnancy. Cell Host & Microbe. 21 (5), 561-567 (2017).
- Cheong, M. L., et al. A Positive feedback loop between glial cells missing 1 and human chorionic gonadotropin (hCG) regulates placental hCGβ expression and cell differentiation. Molecular and Cellular Biology. 36 (1), 197-209 (2016).
- Heisenberg, C. P., Bellaïche, Y. Forces in tissue morphogenesis and patterning. Cell. 153 (5), 948-962 (2013).
- Lee, T. C., Moulvi, A., James, J. L., Clark, A. R. Multi-scale modelling of shear stress on the syncytiotrophoblast: could maternal blood flow impact placental function across gestation. Annals of Biomedical Engineering. 51 (6), 1256-1269 (2023).
- Kluge, M. A., Fetterman, J. L., Vita, J. A. Mitochondria and endothelial function. Circulation Research. 112 (8), 1171-1188 (2013).
- Boren, J., Brindle, K. M. Apoptosis-induced mitochondrial dysfunction causes cytoplasmic lipid droplet formation. Cell Death & Differentiation. 19 (9), 1561-1570 (2012).
- Chernyavsky, I. L., Jensen, O. E., Leach, L. A Mathematical model of intervillous blood flow in the human placentone. Placenta. 31 (1), 44-52 (2010).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved