Method Article
Ex Vivo Cultivo de flujo de explante placentario: imitación de las condiciones dinámicas en el útero
En este artículo
Resumen
A continuación se presenta un protocolo para el cultivo de explantes placentarios en condiciones de flujo constante. Este enfoque mejora los sistemas tradicionales de cultivo estático de vellosidades al permitir la replicación de entornos fisiológicos dinámicos.
Resumen
Los modelos de cultivo de explantes placentarios ex vivo existentes se basan principalmente en sistemas de cultivo estáticos que utilizan placas de pocillos. Sin embargo, estos modelos no reflejan adecuadamente la dinámica en el entorno uterino , donde la placenta se encuentra con un ligero estrés de cizallamiento constante debido al plasma o al flujo sanguíneo. Para hacer frente a esta limitación, se ha ideado un sistema de cultivo de flujo para acercar el cultivo de explantes placentarios ex vivo a las condiciones de flujo intrauterina experimentadas en el cuerpo materno. Dentro de este enfoque, los explantes placentarios se cultivan en una secuencia de cinco cámaras de flujo interconectadas. Este ajuste mantiene las concentraciones fisiológicas de oxígeno y un caudal constante. Los datos recopilados revelan que, en condiciones de flujo, la preservación de la morfología de los tejidos presenta una mejora notable en comparación con los métodos estáticos convencionales. Esta técnica innovadora introduce un medio sencillo de cultivo de explantes placentarios ex vivo, ofreciendo una representación más fiel del entorno dinámico in vivo . Además, este estudio introduce nuevas posibilidades para investigar la dinámica funcional de la interfase feto-materna. Al adoptar metodologías dinámicas factibles, se facilita una comprensión más profunda de la biología placentaria, subrayando su relevancia para la salud materno-fetal.
Introducción
Desde la década de 1960, el cultivo de explantes placentarios en el fondo de una placa de pocillose ha utilizado para estudiar la interfase feto-materna 1,2,3. Este método está bien establecido y es sencillo, lo que permite la utilización de tejido humano para diversos estudios, además de cultivos de células individuales 2,3. A lo largo del tiempo, los diseños experimentales de cultivos de explantes placentarios se han modificado con respecto a la concentración de oxígeno4 y para evitar que el tejido se asiente en el fondo de la placa del pocillo 2,5,6. Sin embargo, este método no se ha adaptado a las condiciones in vivo dentro del útero, específicamente a la presencia de un flujo constante3.
El éxito de un embarazo depende de una adecuada y consistente perfusión del espacio intervelloso con la sangre materna, estableciendo un circuito dinámico con entrada y salida continua de sangre y sustancias transmitidas por la sangre 7,8,9,10,11,12. La placenta presenta dos sistemas distintos de irrigación sanguínea, uno para la sangre materna y otro para la sangre fetal, lo que resulta en una doble perfusión por parte de los sistemas fetal y materno13. La sangre materna comienza a perfundir el espacio intervelloso de la placenta al final del primer trimestre, fluyendo lentamente a través de las arterias espirales uterinas ensanchadas10,11,14. En consecuencia, los árboles vellosos placentarios se bañan en sangre materna, entregando nutrientes y oxígeno al feto. Esta sangre materna fluye a través del espacio intervelloso antes de regresar a la circulación materna a través de las venas uteroplacentarias. Durante su paso a través del espacio intervelloso, la difusión y la absorción activa de oxígeno y nutrientes en la sangre fetal conducen a niveles más bajos de oxígeno y nutrientes en la sangre materna12,15. Sin embargo, la sangre del espacio intervelloso es completamente reemplazada por sangre fresca y rica en oxígeno aproximadamente dos o tres veces por minuto, lo que garantiza un suministro continuo de nutrientes y gases13. Cabe destacar que el sincitiotrofoblasto, la parte más externa de la barrera placentaria, es el único componente del árbol velloso placentario directamente expuesto a la sangre materna15,16,17. En consecuencia, el sincitiotrofoblasto experimenta un leve estrés de cizallamiento constante debido al flujo de sangre materna 3,14.
Los conocimientos científicos actuales sobre el entorno del flujo placentario y los avances técnicos modernos permiten ahora un cultivo adaptado y fisiológicamente aproximado de explantes placentarios en condiciones de flujo. Además, la evidencia sugiere que las fuerzas de cizallamiento influyen en las funciones biológicas del sincitiotrofoblasto 18,19,20,21. Un enfoque bien conocido que tiene en cuenta el flujo sanguíneo es el sistema de perfusión placentaria de doble lóbulo22. Sin embargo, estos experimentos requieren una experiencia significativa, están restringidos en el tiempo (se realizan solo durante unas pocas horas) y son factibles solo con muestras de placenta del tercer trimestre 3,23. Por el contrario, hemos desarrollado una técnica sencilla y no intrusiva para el cultivo ex vivo de explantes de vellosidades placentarias en entornos de flujo constante, que se adapta a los tejidos placentarios del primer y tercer trimestre3. En esta configuración, los explantes placentarios se cultivan en cinco cámaras de flujo conectadas en serie. Los explantes vellosos se fijan al fondo de la cámara mediante elevaciones en forma de aguja sobre placas metálicas delgadas. El circuito de flujo construido se transfiere posteriormente a un biorreactor, donde se regulan tanto la concentración de oxígeno como el caudal3. Los resultados del cultivo de flujo demuestran que la integridad de los tejidos se conserva mejor en comparación con el método estático utilizado normalmente3. Además, este enfoque dinámico permite diseños experimentales novedosos y adaptados para el cultivo de explantes de tejidos, lo que permite experimentos in vitro que imitan más de cerca el entorno natural3.
Protocolo
El comité de ética de la Universidad Médica de Graz aprobó este estudio (31-019 ex 18/19 versión 1.2 y 29-319 ex 16/17). Se obtuvo el consentimiento informado de todos los sujetos involucrados en el estudio.
1. Preparación para el experimento de flujo
NOTA: Los experimentos se llevan a cabo en un biorreactor con bombas peristálticas integradas (ver Tabla de Materiales). La humedad, la temperatura y el nivel de gas dentro del biorreactor se pueden ajustar.
- Encienda el biorreactor y haga todos los arreglos previos (por ejemplo, calibración de las bombas, precalentamiento, condiciones de gas y humedad) para el experimento de acuerdo con el manual del biorreactor. Antes de comenzar el experimento, los ajustes requeridos (temperatura, contenido de gas, humedad) deben estabilizarse durante unas horas o durante la noche. Para hacer esto, inicie el biorreactor y el software y luego haga clic en Cambiar puntos de ajuste en la opción de menú "Incubadora".
- Precalentar PBS y el medio requerido (medio de crecimiento de células endoteliales suplementado con los suplementos provistos hEGF-5, HC-500, así como suero fetal bovino empobrecido al 5%, penicilina/estreptomicina al 1%) a 37 °C.
2. Disección de la muestra placentaria
- Inmediatamente después del parto, corte tres veces 2 cm 3 muestras de placenta de la región media de la placenta como se describe en Kupper et al.3 Brevemente, mantenga las muestras en PBS. Deseche la placa coriónica, la decidua materna y las áreas de infartos visibles del espécimen.
- Diseccionar la muestra de tejido restante en explantes vellosos con un diámetro de sección transversal de aproximadamente 0,5 cm (peso húmedo de aproximadamente 7,5 mg). Transfiéralos a una placa de Petri con PBS fresco.
- Lave los explantes en PBS agitándolos suavemente en el líquido con pinzas para eliminar los residuos de sangre.
NOTA: Diseccione las muestras en una placa de Petri con PBS para prelavarlas y evitar que se sequen y use herramientas esterilizadas/esterilizadas en autoclave para procesar el tejido.
3. Experimento de flujo
- Bajo una campana estéril, conecte cinco cámaras en serie a la botella de depósito utilizando los cierres luer de acuerdo con el manual de usuario de las cámaras de flujo (consulte la Tabla de materiales).
NOTA: Esterilice y/o autoclave todos los materiales antes de su uso, de acuerdo con el manual respectivo. Utilice un filtro de aire en la botella del depósito para el intercambio de gases estériles. Para abrir y cerrar las cámaras, apriete suavemente las lengüetas de las cámaras. Paso 3.1. también se puede preparar antes. - Dale la vuelta a las cámaras y ábrelas quitando la parte inferior. Use pinzas para transferir las placas de metal en el centro de la parte superior de las cámaras con los clavos apuntando hacia arriba.
- Llene las cámaras con 1 ml de medio precalentado (37 °C). A continuación, llene el depósito con 20 ml adicionales. El circuito requiere un total de 25 mL, incluyendo el volumen en cada cámara de flujo, en los tubos y en la botella de depósito. Bajo el flujo, el volumen final del medio en una cámara llena es de 2 mL.
- Use fórceps y transfiera un explante velloso tras otro entre las agujas de la placa de metal en la cámara. Deje que las agujas se deslicen entre las vellosidades placentarias para evitar la punción del tejido. Transfiera cuatro explantes a una cámara. Cierre las cámaras volviendo a colocar el fondo con cuidado. Un circuito completo contiene un total de 20 explantes. Las cámaras deben permanecer en posición invertida.
NOTA: Sujete los explantes suavemente con las pinzas; Trate de no apretarlos. Asegúrese de que las cámaras y el circuito estén completamente sellados para evitar fugas. Las cámaras siempre se utilizan al revés. El número de explantes por cámara y el número de cámaras en sí son variables. El procedimiento para el tejido del primer trimestre es similar al del tejido del tercer trimestre con una pequeña adición: para fijar las vellosidades, doblar las agujas ligeramente sobre los explantes después de que el tejido se haya transferido a la placa metálica (comunicación personal Brugger et al.). Esto fija el tejido frágil en la placa de metal y evita que las muestras se deslicen. - Transfiera el conjunto de flujo al biorreactor.
- Conecte el circuito de flujo a la bomba peristáltica dentro del biorreactor conectando la tubería de la bomba a la bomba. Fíjalo en la4ª etapa (se oirá hacer clic cuatro veces).
- Si se requiere un control estático, coloque también la placa de pocillos en el biorreactor.
NOTA: Para el cultivo estático, se llenan cinco pocillos de una placa de seis pocillos con 4 mL de medio por pocillo y 4 explantes vellosos por pocillo. La placa de pocillo llena también se coloca en el biorreactor y se cultiva en la misma atmósfera que los explantes de cultivo de flujo. Más detalles se describen en Kupper et al.3 - Ajuste el modo de bomba a Manual en la opción de menú "Bombas". A continuación, ajuste la velocidad de la bomba a 1 ml/min y comience a bombear el medio en el tubo haciendo clic en Ejecutar. Mientras se llena el circuito con medio, sostenga las cámaras en ángulo para que estén completamente llenas de medio.
NOTA: Véase la Tabla Suplementaria 1 para conocer los ajustes experimentales para el flujo velloso placentario y el cultivo estático. Las especificaciones del sistema de flujo y estático se proporcionan en la Tabla Suplementaria 2.
PRECAUCIÓN: Incline con cuidado la cámara durante el llenado para evitar que las muestras se salgan de las agujas. - Una vez completado el llenado, las cámaras permanecen en su posición invertida. Asegúrese de que las cámaras estén de pie de forma segura y en posición vertical, y cierre ambas tapas del biorreactor.
NOTA: El volumen final del medio en una cámara de flujo llena es de 2 ml. Los ajustes experimentales y las especificaciones de las cámaras de flujo y las placas de pocillos utilizadas en los experimentos se describen en Kupper et al.3 - Incubar el tejido durante el tiempo deseado.
NOTA: La temperatura, el nivel de gas y el caudal se pueden controlar en el ordenador sin necesidad de volver a abrir la tapa del biorreactor. - Detenga la bomba después de la incubación del tejido durante el tiempo deseado haciendo clic en Abortar en la opción de menú "Bombas". Abra las dos tapas del biorreactor y luego una cámara de flujo a la vez. Retire con cuidado los explantes de la placa de metal con pinzas.
- Procese el tejido y el sobrenadante de acuerdo con el análisis posterior seleccionado. En este caso, se realizó tinción inmunohistoquímica y microscopía electrónica3. Consulte la Tabla suplementaria 3 para obtener los detalles de los anticuerpos utilizados para la inmunohistoquímica y la inmunofluorescencia.
NOTA: Después de retirar el pañuelo, drene el medio del circuito girando la bomba en sentido contrario a las agujas del reloj. - Desmonte y limpie el circuito de flujo de acuerdo con las instrucciones del fabricante para las cámaras de flujo y la tubería.
Resultados
Partes de esta publicación y sus resultados ya han sido publicados (Ver referencias 3 y 23).
Configuración experimental
En la Figura 1 se ilustra una configuración experimental. Un ciclo de flujo compuesto consta de cinco cámaras de flujo que están interconectadas en serie (Figura 1A). Dentro de cada cámara de flujo, se cultivan cuatro explantes, cada uno con un diámetro de sección transversal de aproximadamente 0,5 cm (Figura 1 A,C). Para el experimento de control estático, los explantes se cultivan en pocillos individuales de una placa de seis pocillos (Figura 1B). Para evitar que los explantes se eliminen, se fijan en placas metálicas con protuberancias estrechas en forma de aguja (Figura 1 D,E). Con el fin de someter los explantes a un flujo directo del medio, las cámaras se invierten, con las entradas y salidas colocadas en la sección de la cabeza (Figura 1 F,G). Dentro del biorreactor, el ciclo de flujo está vinculado a una bomba peristáltica. Con el fin de comparar la integridad del tejido entre el tejido cultivado en flujo y el tejido cultivado estáticamente convencionalmente, los explantes se colocan en una placa de seis pocillos adyacente al ciclo de flujo. Esto garantiza la verificación de condiciones de cultivo consistentes en términos de oxígeno, temperatura y humedad (Figura 1A)3.
Análisis morfológico
β-actina
Se llevaron a cabo varios procedimientos de tinción inmunohistoquímica para examinar las distinciones histológicas en la integridad de los tejidos asociadas con diversas condiciones de cultivo (Figura 2). Los explantes que se incluyeron rápidamente después de la disección sirvieron como referencia de referencia. Para el análisis del citoesqueleto de actina dentro de explantes vellosos se realizó una tinción de β-actina (Figura 2A-E). El análisis descriptivo reveló una presentación visual bien estructurada y organizada del citoesqueleto en tejido recién obtenido (Figura 2A). Con el tiempo, a medida que avanzaba el cultivo, se observó una agregación de microfilamentos, lo que significa una degradación de la estructura del citoesqueleto. Este fenómeno se observó consistentemente en explantes vellosos que se sometieron a cultivo estático3 (Figura 2C, E, indicada con asteriscos).
Tinción de H&E
La tinción con H&E reforzó aún más la observación de que la integridad del tejido disminuye en el transcurso del cultivo estático, una tendencia que mejora en el contexto del cultivo de flujo (Figura 2F-J). El tejido fresco presentaba una presentación histológica estructurada y característica de los explantes vellosos, caracterizada por un estroma denso y apretado (Figura 2F). Además, el sincitiotrofoblasto estaba firmemente adherido al estroma subyacente (Figura 2F). Se observó una apariencia comparable en explantes vellosos cultivados en un ambiente de flujo durante 24 h (Figura 2G). Sin embargo, después de 48 h de cultivo bajo el flujo, se observó que porciones del sincitiotrofoblasto se desprendían parcialmente (Figura 2I, indicada con flecha), acompañadas de pequeñas lagunas esporádicas dentro del estroma. El escrutinio histológico del tejido indicó que la integridad del tejido después de 24 h en una condición de cultivo estático no se conservó adecuadamente (Figura 2H). Además, esta integridad se degradó notablemente después de 48 h en cultivo estático (Figura 2J). El estroma exhibió una apariencia porosa y picada, y se evidenció un desprendimiento significativo del sincitiotrofoblasto del estroma en regiones más grandes (Figura 2J, flechas)3.
CD34II
Se empleó la tinción con CD34II para visualizar las células endoteliales y, en consecuencia, los vasos sanguíneos feto-placentarios dentro de los explantes vellosos (Figura 2K-O). El tejido que se incrustó directamente inmediatamente después de la disección mostró una disposición distintivamente organizada de las células endoteliales (Figura 2K). La integridad morfológica de los vasos sanguíneos feto-placentarios se mantuvo bien después de 24 h de cultivo de flujo y con frecuencia incluso después de 48 h, aunque se observaron casos ocasionales de colapso de vasos sanguíneos en condiciones de flujo (Figura 2 L,N). Sin embargo, después de 24 h de cultivo estático, los vasos sanguíneos exhibieron un colapso parcial, como lo demuestra su apariencia visual alterada (Figura 2M, indicada por puntas de flecha). Este deterioro de los vasos sanguíneos dentro del entorno de cultivo estático pareció exacerbarse con el tiempo de cultivo prolongado. En resumen, la evaluación morfológica descriptiva de los explantes vellosos después del cultivo de flujo y estático indicó que la integridad del tejido parece preservarse de manera más efectiva dentro del sistema de flujo cuando se contrasta con el modo de cultivo estático3.
Análisis ultraestructural del tejido cultivado
Microscopía electrónica de transmisión
Para llevar a cabo un examen más detallado de la morfología de los explantes vellosos, se realizaron análisis ultraestructurales adicionales mediante microscopía electrónica de transmisión (TEM) (Figura 3A-E). Estos hallazgos corroboraron los resultados de las investigaciones histológicas. En el tejido que se incrustó directamente inmediatamente después de la preparación, la morfología se conservó excepcionalmente bien (Figura 3A). Las microvellosidades eran claramente discernibles en la superficie del sincitiotrofoblasto. El sincitiotrofoblasto presentó su característica capa continua sin límites celulares laterales, estableciendo contacto directo con la membrana basal. El estroma del tejido fresco exhibió un empaquetamiento denso sin perforaciones o rupturas significativas. Además, el aspecto ultraestructural de los vasos sanguíneos y los eritrocitos intravasculares individualizados también demostraron una excelente conservación (Figura 3A).
Incluso después de 24 h de cultivo de flujo, la morfología general de las muestras de tejido se mantuvo relativamente bien (Figura 3D). Si bien había un poco menos de microvellosidades en la superficie del sincitiotrofoblasto en comparación con el tejido fresco, el sincitiotrofoblasto permaneció principalmente unido a la membrana basal. Se observaron núcleos y pequeñas vacuolas ocasionales dentro de la porción interna del sincitiotrofoblasto. El estroma dentro de las vellosidades placentarias parecía estar bien conservado y se parecía mucho al tejido fresco (Figura 3D). Incluso después de 48 h de cultivo de flujo, las células estromales mostraron una conservación relativamente buena, aunque con algunas perforaciones presentes (Figura 3E). Curiosamente, se detectaron gotas de lípidos dentro del tejido. Si bien el sincitiotrofoblasto mostró vacuolas y una reducción en el número de microvellosidades, permaneció unido a la membrana basal en numerosas regiones, y los núcleos sincitial y celular fueron claramente visibles (Figura 3E).
En marcado contraste con el tejido del cultivo de flujo, la morfología del tejido velloso sometido al cultivo estático mostró deterioro a las 24 h (Figura 3B). El sincitiotrofoblasto se disoció de la membrana basal en múltiples sitios y mostró perforaciones relativamente sustanciales. Además, las gotas lipídicas fueron frecuentemente evidentes tanto en el sincitiotrofoblasto como en el estroma (Figura 3B). Después de 48 h de cultivo estático, se evidenció una disminución progresiva de la ultraestructura (Figura 3C). El sincitiotrofoblasto presentaba numerosas perforaciones y desprendimiento de la membrana basal en gran medida. La identificación de las células dentro del estroma, así como de las células endoteliales que componen los vasos sanguíneos, se convirtió en un desafío. Además, hubo una notable acumulación de gotas lipídicas dentro de los explantes vellosos después de 48 h de cultivo estático (Figura 3C). En resumen, la ultraestructura del tejido en cultivo estático exhibió un deterioro sucesivo a lo largo del período de cultivo, tendencia que fue mitigada por el cultivo en condiciones de flujo3.
Microscopía electrónica de barrido
Utilizando microscopía electrónica de barrido (SEM), se facilitó un examen detallado de la superficie de los explantes vellosos (Figura 4A-J). El tejido que había sido recién incrustado exhibía una densa variedad de microvellosidades en toda su superficie (Figura 4 A, B). Algunas regiones exhibían estructuras similares a vesículas. Por el contrario, el tejido del cultivo estático manifestó una reducción sustancial de las microvellosidades después de 24 h (Figura 4C,D), reducción que persistió después de 48 h (Figura 4E,F). Mientras que ciertas áreas mostraban una agregación de estructuras en forma de vesículas que no habían sido liberadas, otras regiones aparecían desnudas y erosionadas (Figura 4D, F). En el tejido sometido a cultivo de flujo, las microvellosidades seguían presentes en la superficie después de 24 h (Figura 4G,H), así como después de 48 h (Figura 4I,J), aunque en menor medida que en el tejido fresco. En comparación con el cultivo estático, la prevalencia de estructuras en forma de vesículas en la superficie disminuyó. Curiosamente, estas estructuras en forma de vesícula se concentraron notablemente en huecos específicos donde el flujo podría reducirse o estar ausente (Figura 4H, J), lo que sugiere que podrían haber sido desalojadas de la superficie del tejido expuesto al flujo debido al flujodel medio 3.

Figura 1: Configuración del sistema de flujo. (A) El sistema de flujo ensamblado, que consta del depósito y cinco cámaras de flujo, está conectado a una de las bombas peristálticas. En el lado derecho hay una placa de seis pocillos en la que los explantes se cultivan estáticamente. (B,C) Para ambos métodos de cultivo, las muestras de placenta se diseccionan en explantes vellosos de aproximadamente 0,5cm2, de los cuales se utilizan cuatro explantes por pocillo o cámara. En un enfoque experimental, se utilizan cinco cámaras o pocillos. (D,E) Para el cultivo de flujo, se utiliza una placa metálica con elevaciones estrechas en forma de aguja para asegurar los explantes. (F,G) Las aberturas de los tubos se encuentran en la cabeza de las cámaras y, por lo tanto, se utilizan al revés para garantizar que el tejido esté expuesto al flujo directo. Esta figura es una reproducción de Kupper et al.3. Haga clic aquí para ver una versión más grande de esta figura.
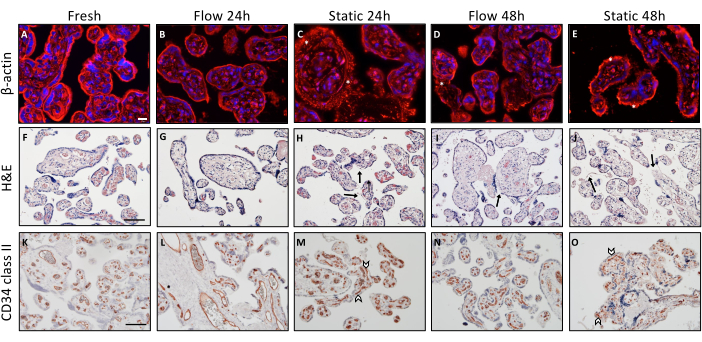
Figura 2: Análisis morfológico de los explantes de vellosidades placentarias tras el flujo y el cultivo estático. (A-E) Tinción de inmunofluorescencia para β-actina para visualizar el citoesqueleto de los explantes en el cultivo. Para el análisis, se utilizaron seis puntos seleccionados al azar por portaobjetos. Se muestran imágenes representativas. (A) Visualización del citoesqueleto del tejido incrustado directamente después de la preparación. Barra de escala: 20 μm. (B-E) Representación representativa de la degeneración del citoesqueleto de actina dependiente del tiempo y del modo de cultivo en explantes cultivados de flujo y cultivo estático. (C-E) Los asteriscos significan un aumento de la acumulación de microfilamentos de actina, que es una indicación de la degradación del citoesqueleto de actina. (De izquierda a derecha) Tinción con hematoxilina-eosina de explantes vellosos. Barra de escamas: 100 μm. (F,G) El tejido recién embebido (F) y los explantes de cultivo de flujo durante 24 h (G) muestran una morfología bien conservada de un explante velloso. (I) Los explantes cultivados en flujo durante 48 h muestran áreas del sincitiotrofoblasto desprendidas intermitentemente (flecha). (H,J) Deterioro de la integridad estructural dependiente del tiempo después del cultivo estático de explantes, indicado por el desplazamiento del sincitiotrofoblasto (flecha) y el estroma perforado. (K-O) CD34 II se utilizó para teñir células endoteliales vellosas. Barra de escala: 100 μm. (K,L) El tejido fresco (K) y los explantes cultivados durante 24 h en condiciones de flujo (L) presentan un patrón característico de células endoteliales estructuralmente alineadas. (N) Después de 48 h en cultivo de flujo, la integridad vascular disminuye en cierta medida. (M,O) En cultivo estático, los vasos sanguíneos colapsados ya son visibles después de 24 h (M), lo que se observó que aumentaba con un tiempo de cultivo estático (O) más largo. Esta figura es una reproducción de Kupper et al.3. Haga clic aquí para ver una versión más grande de esta figura.
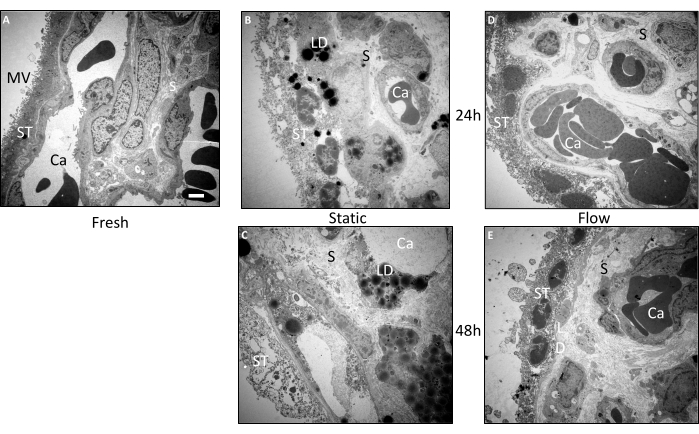
Figura 3: Examen ultraestructural antes y después del cultivo de explantes vellosos mediante microscopía electrónica de transmisión. Para analizar las imágenes se utilizó tejido de tres experimentos independientes. (A) Una imagen representativa del tejido recién incrustado muestra una gran cantidad de microvellosidades (MV) en la superficie del sincitiotrofoblasto (ST). Los capilares estructuralmente intactos (Ca) son visibles en el estroma (S) bien conservado. (B) En el tejido que ha sido cultivado estáticamente durante 24 h, se produce un deterioro de la integridad estructural del sincitiotrofoblasto, que parece estar desconectado de la membrana basal en algunas zonas. También hay una notable acumulación de gotas de lípidos (LD). (C) Después de 48 h en cultivo estático, se observa un deterioro ultraestructural severo. Tanto el estroma como el sincitiotrofoblasto están perforados y se evidencia una acumulación masiva de gotas lipídicas. Los vasos sanguíneos apenas podían ser rastreados. (D,E) La ultraestructura del tejido del cultivo de flujo se conservó relativamente bien después de 24 h (D) y después de 48 h (E). Barra de escala: 2 μm. MV: Microvellosidades, ST: Sincitotrofoblasto, S: Estroma, Ca: Capilar, LD: Gotas lipídicas. Esta figura es una reproducción de Kupper et al.3. Haga clic aquí para ver una versión más grande de esta figura.

Figura 4: Examen ultraestructural antes y después del cultivo de explantes vellosos mediante microscopía electrónica de barrido. (A,C,E,G,I) Imágenes generales de la superficie de los árboles vellosos placentarios con sus respectivas imágenes detalladas (B,D,F,H,J). (A,B) El tejido recién incrustado exhibe una densa costura de microvellosidades. (B) Se pueden observar estructuras similares a vehículos en algunos lugares. (C-F) Después de 24 h y 48 h en cultivo estático, es visible una disminución de las microvellosidades en la superficie del sincitiotrofoblasto. Llama la atención la extensa acumulación de partículas vesiculares en la superficie del explante. (F) Las partículas parecen marchitarse después de 48 h en cultivo estático. (G-J) La superficie del tejido del cultivo de flujo parece estar mejor conservada después de 24 h (G,H) y después de 48 h (I,J) en comparación con el cultivo estático. Las microvellosidades son visibles en la superficie (H,J), aunque no en la misma alta densidad que en el tejido fresco. (B) Se pueden ver partículas vesiculares dispersas en los nichos con flujo reducido. Esta figura es una reproducción de Kupper et al.3. Haga clic aquí para ver una versión más grande de esta figura.
Tabla complementaria 1: Ajustes experimentales para el flujo velloso placentario y el cultivo estático. Haga clic aquí para descargar este archivo.
Tabla complementaria 2: Especificaciones del sistema de flujo y estático. Haga clic aquí para descargar este archivo.
Tabla suplementaria 3: Anticuerpos para inmunohistoquímica e inmunofluorescencia utilizados para este estudio. Haga clic aquí para descargar este archivo.
Discusión
Este estudio presenta una perspectiva única sobre una técnica de cultivo de flujo para explantes placentarios diseñada para replicar la dinámica en el ambiente uterino 3,23. Los hallazgos revelan que la morfología de los tejidos cultivados en condiciones de flujo está mejor conservada en comparación con el método tradicional de cultivo estático3. Cabe destacar que, a pesar de que ni las condiciones estáticas ni las de cultivo de flujo facilitan la perfusión de los vasos placentarios, la destrucción de los vasos sanguíneos feto-placentarios dentro del estroma velloso se observó predominantemente en el cultivo estático, mientras que la integridad de los vasos sanguíneos pareció mantenerse mejor durante un período más largo en el cultivo de flujo3.
Una posible explicación para esta observación podría estar relacionada con el crucial papel protector y endocrino del sincitiotrofoblasto, una función bien documentada en la literatura 12,24,25,26. Teniendo en cuenta esto, es concebible que la integridad general de la capa externa de las vellosidades contribuya significativamente al mantenimiento del estroma subyacente, incluidos los vasos sanguíneos. En consecuencia, la integridad celular sostenida de los vasos sanguíneos en condiciones de flujo podría atribuirse al flujo continuo del medio. Este movimiento ayuda en el movimiento pasivo de los explantes, facilitando el intercambio de gases, nutrientes y nanopartículas (como vesículas extracelulares) a través de la barrera placentaria. Esto, a su vez, podría tener un impacto positivo en la preservación de la morfología de los vasos sanguíneos. Además, el fenómeno de la mecanosensación desempeña un papel en la morfogénesis tisular en varios tejidos27,28. Los estudios han demostrado que la mecanosensibilidad influye en los procesos celulares en múltiples niveles, desencadenando una serie de respuestas bioquímicas que, en última instancia, influyen en la funcionalidad de los tejidos y órganos29. Cabe destacar que las proteínas mecanosensibles son expresadas por el sincitiotrofoblasto a lo largo de la gestación28. Además, el estudio sugiere que las microvellosidades en la superficie del tejido pueden estar implicadas en este contexto28.
Una perspectiva adicional que vale la pena considerar es el papel potencial de las mitocondrias en la respuesta celular al flujo. Por ejemplo, en las células endoteliales, las mitocondrias sirven como transductores de señales para las respuestas celulares a los estímulos ambientales30. El aumento de la acumulación de gotas lipídicas, observado en el tejido cultivado estático a través de TEM3, se ha asociado con la inducción de apoptosis debido a la disfunción mitocondrial31. Se necesitan más investigaciones para desvelar los mecanismos subyacentes y los factores clave, vinculándolos a las vías de señalización posteriores. Esta exploración podría mejorar nuestra comprensión de cómo el tejido percibe y reacciona al estrés cortante, lo que se traduce en una mejor viabilidad e integridad de los explantes vellosos en cultivo23.
Varios pasos críticos del protocolo deben reiterarse y ejecutarse con cuidado. Después de la expulsión de la placenta, el tejido debe cultivarse lo más rápido posible. Durante la preparación del explante, es crucial evitar las áreas con infartos visibles. Es importante manipular suavemente los explantes con fórceps para evitar que se aprieten. Se recomienda mantener el tejido cubierto de líquido durante todo el procedimiento y llevarlo a cabo rápidamente.
Es importante reconocer que este estudio no puede especificar el esfuerzo cortante exacto dentro del sistema de flujo presentado, lo que debe ser considerado como una limitación en futuras investigaciones 3,23. Sin embargo, es importante reconocer que la velocidad precisa del flujo y el esfuerzo cortante para una vellosidad placentaria específica in vivo están influenciados por numerosos parámetros, como las características geométricas del espacio intervelloso, la ubicación de las vellosidades dentro de este espacio y su proximidad y ángulo a las arterias espirales maternas y las venas uterinas 3,19,23,32 . También hay que tener en cuenta la complejidad de la estructura geométrica de la placenta, que varía entre los individuos23,32. Ya existen modelos matemáticos que estiman el flujo sanguíneo dentro del espacio intervelloso32 y cálculos sobre el esfuerzo cortante de la pared en el sincitiotrofoblasto 19,28. Curiosamente, un estudio predijo que el esfuerzo cortante en el sincitiotrofoblasto es menor en el tercer trimestre en comparación con el primer trimestre28, mientras que otro demostró un esfuerzo cortante de pared espacialmente heterogéneo en el sincitiotrofoblasto19. Determinar la velocidad de flujo precisa y el esfuerzo cortante para una vellosidad placentaria específica sigue siendo un desafío 3,19,23,32. Estos cálculos ofrecen una aproximación del rango de esfuerzo cortante para futuras investigaciones, pero pueden requerir ajustes anatómicos continuos y optimización23. Además, los estudios futuros pueden desarrollar nuevas y refinadas técnicas de cultivo de flujo continuo que tengan en cuenta la intrincada geometría del espacio intervelloso y estrategias para aumentar el número de especímenes por experimento3. Se prevé un progreso y desarrollo continuos del sistema de flujo, que podrían emplear cámaras de flujo alternativas (Brugger et al., datos no publicados, 2023).
En conclusión, este estudio sienta una base sólida al demostrar una técnica de cultivo de flujo ex vivo fácilmente implementable que mantiene la integridad estructural de los explantes vellosos cultivados. Subraya la importancia de las técnicas dinámicas en los estudios de biología funcional placentaria, allanando el camino para nuevos avances en los sistemas de cultivo de flujo y la generación de nuevas ideas e hipótesis 3,23.
Divulgaciones
Los autores declaran no tener ningún conflicto de intereses.
Agradecimientos
Los autores agradecen el excelente apoyo técnico de Bettina Amtmann y Petra Winkler para la toma de muestras de tejidos. Esta investigación fue financiada por el Fondo Austriaco para la Ciencia FWF (DOC 31-B26) y la Universidad Médica de Graz, Austria, a través del Programa de Doctorado Trastornos Inflamatorios en el Embarazo (DP-iDP).
Materiales
| Name | Company | Catalog Number | Comments |
| 6-well plates | NUNC, ThermoFisher Scientific, Waltham, MA, USA | 140675 | |
| Alexa Fluor 555 goat-anti-mouse | ThermoFisher Scientific, Waltham, MA, USA | A21422 | Diluted in PBS, 1:200 |
| antibody diluent | Dako, Santa Clara, CA, USA | S3022 | |
| anti-β-actin (AC-15) | Abcam, Cambridge, UK | ab6276 | Stock concentration: 2.1 mg/mL, diluted in antibody diluent, 1:10,000 |
| Bioreactor TEB500 | TEB500, EBERS Medical Technology SL, Zaragoza, Spain | Serial Number: TEB505 / 1000EW/ 117 | |
| CD34 Class II (QBEnd-10) | Dako, Santa Clara, CA, USA | M7165 | Stock concentration: 12 mg/l, diluted in antibody diluent, 1:500 |
| CPD 030 critically point dryer | Bal-Tec, Balzers, Liechtenstein) | Critically point dryer | |
| DAPI | ThermoFisher Scientific, Waltham, MA, USA | D21490 | Diluted in PBS, 1:1000 |
| Ebers TEB505 Series Software | TEB500, EBERS Medical Technology SL, Zaragoza, Spain | Series Software 1.4 | |
| Endothelial Cell Growth Medium MV | PromoCell PC-C-22120, Heidelberg, Germany; | C-22120 | Used without EGCS/h and FCS, any other medium suitable for the tissue can be used |
| Excelsior AS Tissue Processor | ThermoFisher Scientific, Waltham, MA, USA | ||
| Exosome-depleted fetal bovine serum | Gibco by Life Technologies, ThermoFisher Scientific, Waltham, MA, USA | A2720803 | |
| Histolab Clear | Histolab, Askim, Sweden | 14250-TY | |
| Hydrogen Peroxide Block | ThermoFisher Scientific, Waltham, MA, USA | TA125H202Q | |
| Kaiser’s Glycerin Gelatine | Merck, Darmstadt, Germany | 1092420100 | |
| Leica DM 6000 B microscope | Leica, Wetzlar, Germany | Equipped with an Olympus DP 72 Camera | |
| Leica UC7 ultramicrotome | Leica Microsystems, Vienna, Austria) | ||
| Metal plate with needles | In-house construction | ||
| Microtome | Microtome Microm HM 355 S, ThermoFisher Scientific, Waltham, MA, USA | ||
| Microwave oven | Miele, Guetersloh, Germany | ||
| Olympus microscope (BX63) | Olympus, Hamburg, Germany | Serial Number: 1A52421 | |
| PBS | ThermoFisher Scientific, Waltham, MA, USA | 10010015 | |
| Penicillin/Streptomycin | Gibco by Life Technologies, ThermoFisher Scientific, Waltham, MA, USA | 2585627 | |
| Primary antibody enhancer | ThermoFisher Scientific, Waltham, MA, USA | TL-125-PB | |
| ProLong Gold Antifade Reagent | ThermoFisher Scientific, Waltham, MA, USA | P36934 | |
| Pumping tube | Tygon, Bartelt, Graz, Austria | 6.078 175 | 1.02 mm diameter |
| QV500 Flow chambers | Kirkstall Ltd., Quasi Vivo, North Yorkshire, UK | QV500 | Other chambers would work as well |
| SCD 500, sputter coater | Bal-Tec, Balzers, Liechtenstein | Sputter coater | |
| Substrate amino-ethyl carbazole, AEC substrate kit | Abcam, Cambridge, UK | ab64252 | |
| Superfrost Plus slides | Menzel-Glaeser, Braunschweig, Germany | J1800AMNZ | |
| Syringe Filter | Corning Incorporated, NY, USA | 431219 | 0.2 µm Pore SFCA Membrane, air filter for the reservoir bottle |
| TAAB epoxy resin | Agar Scientific, Stansted, Essex, UK | T001 | |
| UltraVision LP-Detection System HRP-Polymer | ThermoFisher Scientific, Waltham, MA, USA | TL-125-HL | |
| UltraVision Protein Block | ThermoFisher Scientific, Waltham, MA, USA | TA125BPQ | |
| Zeiss EM 900 transmission electron microscope | Zeiss, Oberkochen, Germany | ||
| Zeiss Sigma 500 field emission scanning electron microscope | Zeiss, Cambridge, UK | Used with a back-scattered electron detector at 5 kV acceleration voltage |
Referencias
- Villee, C. A. The metabolism of human placenta in vitro. Journal of Biological Chemistry. 205 (1), 113-123 (1953).
- Miller, R. K., et al. Human placental explants in culture: Approaches and assessments. Placenta. 26 (6), 439-448 (2005).
- Kupper, N., Pritz, E., Siwetz, M., Guettler, J., Huppertz, B. Placental villous explant culture 2.0: flow culture allows studies closer to the in vivo situation. International Journal of Molecular Sciences. 22 (14), 7464 (2021).
- Reti, N. G., et al. Effect of high oxygen on placental function in short-term explant cultures. Cell and Tissue Research. 328 (3), 607-616 (2007).
- Simán, C. M., Sibley, C. P., Jones, C. J. P., Turner, M. A., Greenwood, S. L. The functional regeneration of syncytiotrophoblast in cultured explants of term placenta. American Journal of Physiology-Regulatory, Integrative and Comparative Physiology. 280 (4), R1116-R1122 (2001).
- Toro, A. R., et al. Leptin is an anti-apoptotic effector in placental cells involving p53 downregulation. PLoS ONE. 9 (6), e99187 (2014).
- Morley, L. C., Debant, M., Walker, J. J., Beech, D. J., Simpson, N. A. B. Placental blood flow sensing and regulation in fetal growth restriction. Placenta. 113, 23-28 (2021).
- Wang, Y. Z. S., Wang, Y., Zhao, S. Placental blood circulation. Vascular biology of the placenta. Chapter 2, (2010).
- Huppertz, B. The anatomy of the normal placenta. Journal of Clinical Pathology. 61 (12), 1296-1302 (2008).
- Weiss, G., Sundl, M., Glasner, A., Huppertz, B., Moser, G. The trophoblast plug during early pregnancy: a deeper insight. Histochemistry and Cell Biology. 146 (6), 749-756 (2016).
- Burton, G. J., Woods, A. W., Jauniaux, E., Kingdom, J. C. P. Rheological and physiological consequences of conversion of the maternal spiral arteries for uteroplacental blood flow during human pregnancy. Placenta. 30 (6), 473-482 (2009).
- Gude, N. M., Roberts, C. T., Kalionis, B., King, R. G. Growth and function of the normal human placenta. Thrombosis Research. 114 (5-6), 397-407 (2004).
- Wang, Y. Vascular biology of the placenta. Colloquium Series on Integrated Systems Physiology: From Molecule to Function. 2 (1), 1-98 (2010).
- Moser, G., Windsperger, K., Pollheimer, J., de Sousa Lopes, S. C., Huppertz, B. Human trophoblast invasion: new and unexpected routes and functions. Histochemistry and Cell Biology. 150 (4), 361-370 (2018).
- Kupper, N., Huppertz, B. The endogenous exposome of the pregnant mother: Placental extracellular vesicles and their effect on the maternal system. Molecular Aspects of Medicine. 87 (October 2020), 100955 (2022).
- Huppertz, B. IFPA award in placentology lecture: biology of the placental syncytiotrophoblast - myths and facts. Placenta. 31 (SUPPL), S75-S81 (2010).
- Gauster, M., Moser, G., Wernitznig, S., Kupper, N., Huppertz, B. Early human trophoblast development: from morphology to function. Cellular and Molecular Life Sciences. 79 (6), 345 (2022).
- Lecarpentier, E., et al. Fluid shear stress promotes placental growth factor upregulation in human syncytiotrophoblast through the cAMP-pKA signaling pathway. Hypertension. 68 (6), 1438-1446 (2016).
- Lecarpentier, E., et al. Computational fluid dynamic simulations of maternal circulation: wall shear stress in the human placenta and its biological implications. PLOS ONE. 11 (1), e0147262 (2016).
- Miura, S., Sato, K., Kato-Negishi, M., Teshima, T., Takeuchi, S. Fluid shear triggers microvilli formation via mechanosensitive activation of TRPV6. Nature Communications. 6 (1), 8871 (2015).
- Jauniaux, E., et al. Onset of maternal arterial blood flow and placental oxidative stress. The American Journal of Pathology. 157 (6), 2111-2122 (2000).
- Sodha, R. J., Proegler, M., Schneider, H. Transfer and metabolism of norepinephrine studied from maternal-to-fetal and fetal-to-maternal sides in the in vitro perfused human placental lobe. American Journal of Obstetrics and Gynecology. 148 (4), 474-481 (1984).
- Kupper, N. . Extracellular vesicles from advanced placental explant flow culture and their role in preeclampsia [Dissertation]. , (2022).
- Burton, G. J., Fowden, A. L. The placenta: a multifaceted, transient organ. Philosophical Transactions of the Royal Society B: Biological Sciences. 370 (1663), 20140066 (2015).
- Arora, N., Sadovsky, Y., Dermody, T. S., Coyne, C. B. Microbial vertical transmission during human pregnancy. Cell Host & Microbe. 21 (5), 561-567 (2017).
- Cheong, M. L., et al. A Positive feedback loop between glial cells missing 1 and human chorionic gonadotropin (hCG) regulates placental hCGβ expression and cell differentiation. Molecular and Cellular Biology. 36 (1), 197-209 (2016).
- Heisenberg, C. P., Bellaïche, Y. Forces in tissue morphogenesis and patterning. Cell. 153 (5), 948-962 (2013).
- Lee, T. C., Moulvi, A., James, J. L., Clark, A. R. Multi-scale modelling of shear stress on the syncytiotrophoblast: could maternal blood flow impact placental function across gestation. Annals of Biomedical Engineering. 51 (6), 1256-1269 (2023).
- Kluge, M. A., Fetterman, J. L., Vita, J. A. Mitochondria and endothelial function. Circulation Research. 112 (8), 1171-1188 (2013).
- Boren, J., Brindle, K. M. Apoptosis-induced mitochondrial dysfunction causes cytoplasmic lipid droplet formation. Cell Death & Differentiation. 19 (9), 1561-1570 (2012).
- Chernyavsky, I. L., Jensen, O. E., Leach, L. A Mathematical model of intervillous blood flow in the human placentone. Placenta. 31 (1), 44-52 (2010).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoExplorar más artículos
This article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados