需要订阅 JoVE 才能查看此. 登录或开始免费试用。
Methods Article
通过生物精炼方法对红海藻 gracilaria gracilis 进行增值
摘要
在这里,我们描述了旨在对 Gracilaria gracilis进行综合增值的几种协议:野生物种收获,内部生长和生物活性成分的提取。评估了提取物的抗氧化、抗菌和细胞毒性作用,以及富含全海藻生物质和色素的食物的营养和稳定性评估。
摘要
人们对海藻作为一种丰富的原料,以获得有价值的多目标生物活性成分的兴趣不断增长。在这项工作中,我们探索了 Gracilaria gracilis的潜力,这是一种可食用的红海藻,因其商业利益而在全球范围内种植,作为化妆品、药理学、食品和饲料应用的琼脂和其他成分的来源。
通过无性繁殖和孢子形成优化了G. gracilis的生长条件,同时操纵了物理化学条件,以实现较大的生物量储量。在海藻生物质上使用乙醇和水进行绿色提取方法。通过一组关于提取物细胞毒性、抗氧化和抗菌特性的体外测定来评估提取物的生物活性潜力。此外,干海藻生物质被纳入意大利面配方中,以增加食物的营养价值。从G. gracilis中提取的色素也已作为天然着色剂掺入酸奶中,并对其稳定性进行了评估。这两款产品都经过了半培训的感官小组的评估,旨在在进入市场之前实现最佳的最终配方。
结果支持 G. gracilis 的多功能性,无论是作为整个生物质,提取物和/或色素使用。通过实施几个优化的协议,这项工作允许开发具有潜在利润的产品,以促进食品、化妆品和水产养殖市场,促进环境可持续性和蓝色循环经济。
此外,根据生物精炼方法,残留的海藻生物质将用作植物生长的生物刺激剂或转化为碳材料,用于葡萄牙莱里亚MARE-Polytechnic内部水产养殖系统的水净化。
引言
海藻可以被视为一种有趣的天然原料,可以从制药、食品、饲料和环境部门获利。它们生物合成了一整套分子,其中许多分子在陆地生物中没有发现,具有相关的生物学特性1,2。然而,需要实施海藻优化的养殖方案,以确保大量的生物量储存。
栽培方法必须始终考虑海藻菌体的性质和整体形态。 Gracilaria gracilis 是一个克隆类群,这意味着附着器官产生多个营养轴。因此,实现了通过碎片化(无性繁殖)的繁殖,因为这些轴中的每一个都完全能够采用独立于主菌体3 的生命。克隆类群可以通过简单快速的一步培养方法成功整合,因为通过将菌体分解成小片段来获得大量的生物量,这些碎片可以快速再生并生长成新的、基因相同的个体。在此过程中可以使用单倍体和双倍体。尽管该属表现出复杂的单倍双克隆同构三相生命周期,但很少需要孢子形成,除非需要对种群进行遗传更新以实现改良作物。在这种情况下,四孢子(由减数分裂形成的单倍孢子)和果孢子(由有丝分裂形成的双孢子)都会产生宏观的菌体,然后可以通过无性繁殖生长和繁殖4。生长周期取决于环境条件和个体的生理状态,以及其他生物因素,例如附生植物的出现和其他生物的粘附。因此,优化生长条件对于确保高生产力和生产优质生物质至关重要5.
从海藻中提取生物活性化合物,包括G. gracilis,可以通过各种方法实现6,7。提取方法的选择取决于目标化合物的具体化合物、目标应用和海藻的特性。在这项研究中,我们专注于溶剂萃取,这涉及使用绿色溶剂,如水或乙醇,从海藻生物质中溶解和提取生物活性化合物。萃取可以通过浸渍以通用且有效的方式进行,可用于多种化合物。这是一种简单且广泛使用的方法,涉及将生物质长时间浸泡在溶剂中,通常在室温或略高的温度下。搅拌溶剂以增强提取过程。在所需的提取时间之后,通过过滤或离心将溶剂与固体材料分离。
水是食品应用中常用的溶剂,因为它具有安全性、可用性和与各种食品的相容性。水萃取适用于多糖、肽和某些酚类化合物等极性化合物。然而,它可能无法有效地提取非极性化合物。乙醇也是食品应用中广泛使用的溶剂,可有效提取各种生物活性分子,包括酚类化合物、类黄酮和某些色素。乙醇通常被认为是安全的,可以安全地用于食品中,并且很容易蒸发,留下提取的化合物。值得注意的是,提取方法的选择应考虑效率、选择性、成本效益和环境影响等因素。优化提取参数,如溶剂浓度、提取时间、温度和压力,对于从 G. gracilis 或其他海藻中获得最佳生物活性化合物的产量至关重要。
已发现海藻对多种微生物(包括细菌、真菌和病毒)表现出抗菌活性8.这种活性归因于生物活性成分,包括酚类、多糖、肽和脂肪酸。多项研究表明,它们对大肠杆菌、金黄色葡萄球菌、沙门氏菌属和铜绿假单胞菌等病原体具有功效9。海藻的抗菌活性归因于生物活性化合物的存在,这些化合物会干扰微生物细胞壁、膜、酶和信号通路10。这些化合物可能会破坏微生物生长,抑制生物膜形成,并调节免疫反应。
红海藻,也称为红藻,是一组可以对多种微生物表现出抗菌活性的藻类。在该组中, G. gracilis 含有各种生物活性化合物,可能有助于其报告的抗菌活性。虽然具体分子可能有所不同,但已报道的 G. gracilis 中可能具有抗菌特性的常见类别是多糖、酚类、萜类化合物和色素11。然而,需要注意的是,这些成分的存在和数量可能因海藻收集地点、季节性、海藻的生理条件和环境条件等因素而异。因此, G. gracilis 中抗菌化合物的具体类别和浓度可能会相应变化。
G. gracilis 还被发现具有抗氧化特性,含有各种酚类化合物,已被证明可以清除自由基并减少氧化应激12。抗氧化剂有助于保护细胞免受活性氧造成的损害,并具有潜在的健康益处。抗氧化能力可以通过不同的方法直接评估,包括 2,2-二苯基-1-三硝基肼 (DPPH) 自由基清除活性,以及间接通过总多酚含量 (TPC) 的定量13。
尽管据报道一种成分具有突出的生物活性,但其细胞毒性评估在评估与活细胞或组织接触的天然和合成物质时是必不可少的。有几种测量细胞毒性的方法,每种方法都有优点和局限性。总体而言,它们提供了一系列选择来评估许多物质对细胞的有害影响,同时研究细胞损伤和死亡的机制14。
在这项工作中,我们使用3-(4,5-二甲基噻唑-2-基)-2,5-二苯基四唑溴化物(MTT)测定法,这是Mosmann(1983)15引入的比色法。该方法测量代谢活性细胞将四唑盐还原为紫色甲瓒产物的过程。甲臜晶体的量越高,活细胞的数量就越多,从而提供了细胞毒性的间接测量14。由于在这项工作中, G. gracilis 水和乙醇提取物旨在掺入皮肤化妆品配方中,因此在角质形成细胞 (HaCaT) 细胞系中进行 体外 细胞毒性评估。
在食品应用方面,海藻通常热量低,营养丰富,富含膳食纤维、必需元素和氨基酸、多糖、多不饱和脂肪酸、多酚和维生素 2,16。G. gracilis 也不例外,具有有趣的营养价值。Freitas et al. (2021)4 发现,与野生海藻相比,栽培的 G. gracilis 具有更高水平的蛋白质和维生素 C,并维持了总脂质的水平。这可能代表了一种经济和环境优势,因为从营养上讲,生产比开发野生资源更可取。此外,消费者越来越关注他们所吃的食物类型,因此引入新的成分来丰富食物,并使用新的资源来获得可以为产品增加价值并声称"清洁标签"的提取物非常重要。此外,当前市场竞争非常激烈,需要开发新产品和创新策略,以将制造商与竞争对手区分开来17.
将意大利面等营养价值低的产品与海藻等海洋资源进行富集,是一种通过具有不同营养价值的产品将这种资源作为新食品引入的战略和市场差异化战略。另一方面, G. gracilis 是天然红色素的来源,例如藻胆蛋白18,在食品工业中具有很高的应用潜力。这种海藻在多个领域表现出浓厚的兴趣,其应用可以使用整个海藻、提取物和/或剩余的生物质进行。在这项工作中,我们演示了此类应用的一些示例。
研究方案
1. 生物质收获和制备
- 在退潮时收获 G. gracilis 标本,并将它们迅速运送到实验室,装在黑暗、冷却的盒子里,以避免干燥、光线和空气暴露。
- 在实验室中,用流动的海水清洗每个菌体并彻底清洁以去除表面的碎屑、坏死部分、附生植物和其他生物。
- 将野生生物量保持在恒定充气的海水(31-35 psu)中,在气候室(20±1°C)中,由日光冷白光和荧光灯提供低辐照度,光周期设置为16:08(光:暗)7天。在此期间,不要提供任何营养培养基;这使海藻能够慢慢适应新的室内条件。
2. 库存维护
- 适应期过后,用无菌刀片切开健康的海藻尖端。按照Redmond等人(2014)19 ,在无菌条件下,将每个尖端拖过先前在培养皿中制备的琼脂凝胶(1.0%细菌琼脂,蒸馏水/海水比例为1:1)以除去任何残留的污染物。对每个吸头进行三次琼脂拖动,并始终将吸头拖过琼脂凝胶的未使用部分。
- 用盐酸溶液(HCl,15%)酸洗玻璃器皿,并用蒸馏水彻底冲洗。通过高压灭菌器(121°C,15分钟)对清洁过程中使用的所有工具,玻璃器皿,琼脂,海水和蒸馏水进行消毒。
注意:请参阅供应商提供的 HCl 安全数据表。 - 根据 Redmond 等人 (2014)19 的说法,尖端在 35 psu 的灭菌海水中生长,并辅以针对红海藻改良的 Von Stosch 富集溶液 (VSE)。向培养基(1mL/L)中加入二氧化锗(GeO2)以防止附生硅藻的生长。
注意: 请参阅供应商提供的 GeO2 安全数据表。
注意:通过部分或全部变色观察到色素沉着丧失的尖端处于压力下或已经死亡,应丢弃。
3. 培育和扩大规模
- 适应期过后,在20±1°C的气候室中,用20±0.5μmol光子m-2s-1(1500lux)的白冷光,将约8-10个健康尖端随机分配到250mL平底烧瓶中,光周期设置为16小时:8小时(光:暗),并每周更新富含VSE培养基的无菌海水。
- 每周进行体重测量,避免过度拉紧thalli 20。为此,小心地从培养基中取出尖端,轻轻冲洗,并在实验室秤上称量毫克。
注意:此过程可以与培养基每周更新一起执行。 - Thalli 可以在这些烧瓶中生长,密度可达 2 g/L。此时,执行受体放大(250 mL、1 L 和 5 L)。当体积达到 50 L 时,将培养物转移到 50 L 或更大的室外开放式白色容器中。
- 根据 Patarra 等人 (2017)21 计算相对增长率 (RGR):
RGR (% fw/天) = ([Ln (fw) - Ln (iw)]/t) x 100
其中 iw 和 fw 分别是初始和最终鲜重,以克表示,t 是以天为单位的时间。
注意:在这种实验室设置下,RGR每天达到21%的值。生物质收获可以随时进行。生物质必须快速加工,以防止降解,方法是烘箱干燥、冷冻干燥或简单地冷冻储存(-20°C),具体取决于预期用途。干燥的生物质可以在室温(RT)下保存或冷冻储存。
4. 提取程序
注:为了评估G. gracils提取物的体外细胞毒性,抗氧化和抗菌特性,其制备考虑了两个不同的参数:提取温度和溶剂类型。
- 为了进行提取,将 G. gracilis 生物质烘干并研磨生物质(例如,在家用咖啡研磨机中),直到粉末通过200μm筛子。
- 称取干燥的生物质(10g)并将其溶解在100mL溶剂(无水乙醇或无菌水)中。
- 在避光容器中搅拌30分钟。
- 在室温,40°C和70°C下进行连续乙醇>水和水>乙醇提取。
- 对于每个温度,分别用乙醇和水进行两次提取。
- 通过滤纸(Whatman No.1)过滤,将液体提取物从剩余的生物质中分离出来,然后在室温下以8000× g 离心10分钟。
- 重复使用剩余的藻类生物质,用其他溶剂进一步提取。如果首先用乙醇提取样品,则接下来用水提取,反之亦然。
- 冷冻干燥水提取物,并在40°C的旋转蒸发器中蒸发乙醇提取物。
- 将干燥的提取物储存在4°C。
- 以50mg / mL(抗菌测定)或10mg / mL(抗氧化测定)的浓度溶解提取物。将水提取物溶解在无菌水中,将乙醇提取物溶解在无水乙醇中。
5.抗菌活性
注:乙醇和水提取物应分别针对 枯草芽孢杆 菌亚种 spizizenii (DSM 347)、 大肠杆菌 (DSM 5922) 和 Listonella anguillarum (DSM 21597) 进行测试。抗菌测试必须根据国家临床实验室标准委员会 (NCCLS, 2012)22 的建议进行。所有培养物均来自德国微生物和细胞培养物保藏库(DSMZ)。 在 补充有 1% 氯化钠 (NaCl) 的胰蛋白酶大豆肉汤 (TSB) 或胰蛋白酶大豆琼脂 (TSA) 上生长。其余两种菌株在LB培养基(VWR Chemicals)上生长。枯草芽孢 杆菌亚种 spizizenii (DSM 347)和 李斯特菌 (DSM 21597)培养物在30°C下孵育,而 大肠杆菌 (DSM 5922)在37°C下孵育,根据供应商的说明。肉汤微量稀释法可用于测定液体培养基中的抗菌活性,这应该在微量尺度上进行,以便快速有效地测定抗菌潜力。这种低成本的方法允许在短短24小时内获得结果,因此适用于在早期阶段确定最佳提取条件,从而允许给定的微生物菌株获得生长抑制作用方面的结果。然而,该方法需要使用带有专门用于微生物生长的盖子的无菌微孔板,以及用于 600 nm 波长的酶标仪。
- 使用未经处理的圆底 96 孔微孔板和 170 μL Muller-Hinton 肉汤 (MHB),接种 10 μL 标准化接种物(0.5 McFarland 标准品)和 20 μL 每种提取物 (50 mg/mL)。
- 将板在每种菌株的最佳温度下孵育24小时。
- 通过在0小时和24小时在微孔板分光光度计中记录光密度(OD 600)测量的可见浊度的降低来检测抗菌活性。
- 将结果表示为抑制百分比:
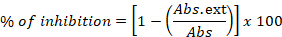
其中,Abs. ext 是在 0 小时和 24 小时之间在含有在提取物存在下生长的细菌菌株的孔中测量的吸光度的差异,Abs 是指在含有细菌菌株和溶剂的孔中测量的吸光度的差异。 - 在该方法中,包括对照反应,孔中仅含有作为阴性对照的培养基,但也包括接种了加入溶剂(乙醇或水)的标准菌株的培养基和含有细菌菌株和阳性对照抗生素(氯霉素)的培养基的孔。
6.抗氧化活性及总多酚的定量
- 总多酚含量
注:总多酚含量(TPC)使用Folin-Ciocalteu方法23 进行,并适用于微观尺度。- 向避光的 96 孔微孔板的每个孔中加入 158 μL 超纯水、2 μL 样品和 10 μL Folin-Ciocalteu 试剂。
注意:请参阅供应商提供的 Folin-Ciocalteu 试剂的安全数据表。 - 2 分钟后,加入 30 μL Na2CO3 (20%)。
- 在室温下在黑暗中孵育1小时后,在755nm处用分光光度法测量样品。
- 使用没食子酸(可以绘制校准曲线)或超纯水(2μL)作为对照。
- 将结果表示为没食子酸当量(mg GAE/g提取物)。
- 向避光的 96 孔微孔板的每个孔中加入 158 μL 超纯水、2 μL 样品和 10 μL Folin-Ciocalteu 试剂。
- 2,2-二苯基-1-三硝基肼(DPPH)自由基清除活性
注:提取物的抗氧化活性按照Duan等人(2006)24的描述进行评估,适用于微观尺度- 在避光的 96 孔微孔板中,放置 2 μL 每个样品(浓度为 10 mg/mL)和 198 μL DPPH 溶解在无水乙醇 (0.1 mM) 中。
注意: 请参阅供应商提供的 DPPH 安全数据表。 - 在室温下在黑暗中运行反应30分钟。在微孔板分光光度计中测量517nm处的吸光度。
- 用 2 μL 无水乙醇/蒸馏水和 198 μL DPPH 溶液进行对照反应。用 2 μL 提取物和 198 μL 无水乙醇进行空白测量。
- 使用以下公式将结果表示为DPPH抑制的百分比:
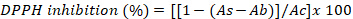
其中As是藻类提取物的吸光度,Ab是空白样品的吸光度,Ac是对照的吸光度。
- 在避光的 96 孔微孔板中,放置 2 μL 每个样品(浓度为 10 mg/mL)和 198 μL DPPH 溶解在无水乙醇 (0.1 mM) 中。
7. 表皮细胞的细胞毒性评价
注:如前所述,通过MTT比色测定法在人角质形成细胞(HaCaT细胞-300493)中评估G. gracilis的水和乙醇提取物的体外细胞毒性作用25。细胞购自德国细胞系服务公司(CLS),该方法按照机构指南和CLS说明进行。
注意:请参阅供应商提供的 MTT 安全数据表)
- 细胞培养维护
- 在补充有10%胎牛血清(FBS)和1%抗生素/抗真菌溶液(两性霉素B,0.25mM;青霉素,60mM;链霉素,100mM)的Dulbecco改良Eagle高葡萄糖培养基(DMEM)中培养HaCaT细胞。
- 使用胰蛋白酶-EDTA解离细胞。
注:HaCaT细胞的传代培养在细胞达到完全汇合后完成。 - 在37°C,5%CO2 和95%湿度的腔室中培养细胞。
- 每当培养物达到 80%-85% 汇合度时,根据生物库说明对细胞进行传代培养。
- 细胞毒性评估
- 将细胞接种在 96 孔板中并孵育过夜后,用先前溶解在 DMSO (100 mg/mL) 中的干燥提取物处理 HaCaT 细胞(4 x 104 个细胞/孔)。然后,将 2 μL 提取物溶液加入 198 μL 培养基中,并将板孵育 24 小时。
- 取出培养基,向细胞中加入 100 μL MTT (0.5 mg/mL)。在上述常规培养条件下,将细胞在黑暗中孵育30分钟。
- 除去MTT溶液,用100μLDMSO溶解细胞内甲瓒晶体。
- 使用酶标仪测量570nm处的吸光度。将结果表示为对照未处理细胞的百分比。
8. 食品创新
- 新食品:海苔意大利面
- 配料和意大利面配方的选择
注意:配料选择是与一家意大利面公司合作进行的。关键成分的选择(在第 8.2 节中描述)是考虑到它们易于获取和与现有生产线的兼容性,利用海洋资源获得具有附加营养价值的意大利面。- 选择成分后,通过使用电子表格分析配方的理论化学成分,按照预期的营养价值(纤维、维生素和矿物质元素的来源、低饱和脂肪)设计配方。
- 当满足理论要求时,按照步骤8.1.2所述进行实验室规模生产。
- 与半训练有素的小组(>10 名品尝师)一起进行感官测试,以验证是否需要重新配制或接受以下步骤的配方。
注意:该小组之前接受过意大利面品尝的培训,并愉快地评估了所呈现的配方,包括风味、味道、气味、质地和外观等属性。
- 意大利面生产
注意: 使用意大利面挤出机生产 Chifferi 意大利面样品。- 在设备中,混合先前定义的米粉、 G. gracilis 和 小球藻部分,并在混合物中加入约 30% 的水。
- 为了获得干燥的意大利面,在68°C下干燥 Cifferi42 分钟,然后在76°C下干燥5小时,30分钟,模拟工业过程。
- 最后,将样品包装并真空密封,并将其储存在室温下的黑暗处,直到进一步分析。
- 营养分析
注意:对于营养成分分析,使用干燥和浸渍的样品,一式三份。- 粗蛋白含量:通过 凯氏定氮 法进行总蛋白测定,该方法改编自Duarte等人(2022)26,遵循步骤8.1.3.2-8.1.3.6。
- 准确称取 1.0 g 样品(或用于空白测定的蒸馏水),并在消解管中与两片凯氏定氮片和 25 mL H2SO4 混合。
注意: 请参阅供应商提供的 H2SO4 安全数据表。 - 在凯氏定氮酶解器中在220°C下消化样品30分钟,然后在400°C下消化90分钟。
- 冷却至室温后,加入 80 mL 蒸馏水,将形成的氨蒸馏成 30 mL 含有溴甲酚绿和甲基红的 4%H 3 BO3 溶液。该步骤在碱性条件下进行(使用凯氏定氮蒸馏器用 40% NaOH 蒸馏。
注意:请参阅供应商提供的含有溴甲酚绿、甲基红和 40% NaOH 的 H3BO3 溶液的安全数据表。 - 用HCl 0.1M滴定蒸馏样品,直到观察到颜色变为灰粉色。
- 计算粗蛋白含量,由样品的氮含量表示,并使用以下公式将其表示为每 100 克克:
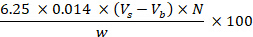
其中 Vs 对应于样品滴定中使用的 HCl 体积 (mL);Vb 对应于坯料中使用的体积;N对应于HCl正态性;W对应于样品重量(g)。 - 总脂肪含量:使用Folch方法确定总脂肪含量,该方法改编自Folch等人(1957)27,遵循步骤8.1.3.8-8.1.3.14。
- 通过将CHCl 3 和 MeOH 以 2:1 (v:v) 的比例混合来制备 Folch 试剂。
注意:请参阅供应商提供的 Folch 试剂的安全数据表。 - 要试管中含有 1 g 等分试样的样品,加入 5 mL Folch 试剂和 0.8 mL 蒸馏水。在涡旋中混合1分钟。
- 然后,再加入 5 mL Folch 试剂并匀浆 5 分钟,加入 1.2 mL 0.8% NaCl 溶液并匀浆 2 分钟。
- 将样品以7000× g 离心10分钟。将有机相(下相)通过亲水棉和无水硫酸钠过滤到圆底玻璃烧瓶中。
- 为避免样品损失,在相同条件下重复加入 5 mLCHCl 3、匀浆、离心和过滤的步骤。
- 通过低压蒸发从收集的有机相中除去有机溶剂,并在105°C的烘箱中放置4小时。在干燥器中冷却样品。
- 使用以下公式计算脂肪含量,以每 100 克克表示:
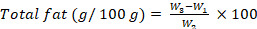
式中,W1 为空圆底玻璃烧瓶重量;W2 是样品的初始重量;W3 是带有样品重量的圆底玻璃烧瓶。 - 粗纤维含量:按照步骤 8.1.3.16-8.1.3.22,使用改编自 ISO 6865 (2000)28 的方法确定粗纤维含量。
- 称取 1 g 样品 (W0) 放入带有过滤器底部(参考 P2)的玻璃坩埚中,并将其放入纤维分析仪中。
- 第一步是酸水解:在每个坩埚的柱中加入150 mL 1.25% H 2 SO4,预热,2mL消泡剂(正辛醇);加热至沸腾,保持30分钟。
- 除去该溶剂后,用去离子水洗涤三次,进行基本水解。向无液柱中加入 150 mL 预热的 1.25% NaOH 和 5 mL 消泡剂,并执行与酸水解相同的加热程序。
- 最后,用 150 mL 丙酮进行三重洗涤以进行冷提取。
- 在此过程之后,小心地从系统中取出坩埚,并将它们放入150°C的烘箱中1小时。记录最终重量(W1)。
- 将坩埚置于500°C的马弗炉中3小时,然后记录最终重量(W 2)。
- 计算粗纤维含量,并使用以下公式以百分比表示结果:
粗纤维百分比 = 100 x (W1-W2)/W0 - 脂肪酸(FA)谱:根据Fernández等人(2015)29,按照步骤8.1.3.24-8.1.3.29确定脂肪酸谱。
注:脂肪酸甲酯(FAMEs)是通过研磨的冻干样品的直接酸催化转甲基化获得的。所有分析一式三份。 - 将2mL的2%(v / v)H 2 SO4甲醇溶液加入50mg样品中,并在连续搅拌下将混合物在80°C下倒入2小时。
注意:请参阅供应商提供的甲醇安全数据表。 - 冷却至室温后,向每个样品中加入 1 mL 超纯水和 2 mL 正庚烷,涡旋混合物 1 分钟,离心 5 分钟。
注意: 请参阅供应商提供的正庚烷安全数据表。 - 回收含有FAME的上 正庚烷相(有机物),并将其转移到气相色谱(GC)小瓶中。
- 在配备TR-FAME毛细管柱(60 m×0.25 mm内径,0.25μm膜厚)、自动进样器和火焰离子化检测器(FID)的气相色谱仪中进行分析。
- 将进样器(不分流模式)设置为250°C,将检测器设置为280°C。 将色谱柱的初始温度设置为75°C并保持1分钟。然后以5°C / min升至170°C并保持10分钟。然后以5°C / min升高至190°C,再保持10分钟。最后,以2°C / min升高至240°C并保持10分钟。使用氦气作为载气,流速为 1.5 mL/min。分别以 350 和 35 mL/min 的流速供应空气和氢气。
- 通过将得到的保留时间与标准品进行比较来确定 FA 曲线,并将结果表示为占总脂肪的百分比。
- 矿物元素分布:按照Pinto等人(2022)30的方法,按照步骤8.1.3.31-8.1.3.34,确定ICP-OES分析的矿物元素(Ca、P、Mg、Na、K、Fe、Cu、Mn、Zn)。
- 准确称取每个干燥样品约0.4g,加入7.5mL HNO3 和2.5mL HCl。
注意: 请参阅供应商提供的 HNO3 和 HCl 安全数据表。 - 消解遵循两个阶段的过程:在30分钟内将温度从室温升高到90°C(并在该温度下再保持30分钟),然后在105°C下60分钟。
- 冷却样品溶液,将其稀释至 25 mL,然后过滤并保存在标记的试管中。在每次消解中,使用参考物质和空白处执行相同的过程。通过ICP-OES获得不同元素的浓度。
- 以每 100 克 fw 的毫克表示结果。
- 碳水化合物含量:按照步骤8.1.3.36-8.1.3.37计算碳水化合物含量。
- 根据联合国粮食及农业组织(粮农组织,2003年)31,使用以下公式,通过先前确定的每100克系数的差值计算有效碳水化合物(不包括纤维)含量

- 以每 100 克的克数表示结果。
- 水分和灰分含量:按照步骤8.1.3.39-8.1.3.45估算水分和灰分含量。
- 将瓷坩埚在105°C孵育3小时,在干燥器中冷却并称重。
- 称取10g样品放入坩埚中,并将其置于105°C的干燥箱中3小时循环,直到连续称重的值相差不超过10mg。
- 使用以下公式计算水分含量,以每 100 g fw 的 g 表示:
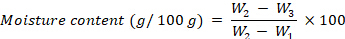
其中 W1 是空坩埚的重量,W2 是坩埚与新鲜样品的重量,W3 是坩埚与干燥样品的重量。 - 水分含量测定后,将坩埚与干燥的样品一起置于525°C的焚烧炉中4小时。
- 重复此过程,直到连续重量相差不超过1mg。
- 在干燥器中将样品冷却至室温,然后称量。
- 使用以下公式计算灰分含量,以每 100 g fw 的 g 表示:
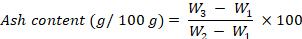
其中 W1 是空坩埚的重量,W2 是装有新鲜样品的坩埚的重量,W3 是坩埚的重量。 - 能量值:按照步骤8.1.3.47-8.1.3.48计算能量值。
- 根据欧盟法规:向消费者提供食品信息(第 1169/2011 号法规)32,使用以下公式计算样品的能量值:
能量 (kcal/ 100 g) = 4 x (g 蛋白质) + 4 x (g 碳水化合物) + 9 x (g 脂肪) + 2 x (g 纤维)
能量 (kJ/ 100 g) = 17 x (g 蛋白质) + 17 x (g 碳水化合物) + 37 x (g 脂肪) + 8 x (g 纤维) - 以每 100 克千卡和每 100 克千焦耳表示结果。
- 消费者接受度
- 使用在蒸馏水中煮 8 分钟的意大利面样品评估消费者接受度。
- 进行消费者接受度测试:评估样品的视觉外观、颜色、质地、气味、海味、整体味道、整体评价和购买意向。
注意:消费者接受度测试基于享乐测试,以 1-9 的等级评估视觉外观、颜色、质地、气味、海味、整体味道、总体评价和购买意向,其中 1 表示较差的评价,9 表示非常好的评价。 - 在感官分析实验室的各个感官室(带温度和照明控制)进行感官测试。提供餐具、餐巾纸和玻璃杯矿泉水,以清洁样品之间的味觉。
注意:品酒师年龄在16-64岁之间,来自各种背景(>80岁)。
- 配料和意大利面配方的选择
- 酸奶
- 色素提取
注:通过Pereira等人(2020)18中描述的方法进行色素提取。- 用磷酸氢二钠(0.03M)和磷酸二氢钠(0.07M)制备0.1M的萃取溶剂磷酸钠缓冲液。使用 NaOH 或 HCl 将 pH 值设置为 pH 值 6.8。
- 称取 1 g gracilis 并加入 50 mL 磷酸钠缓冲液 (pH 6.8)。匀浆10分钟,然后用研钵和研杵浸渍10分钟。
- 将溶液转移到试管中,并在12,298× g (4°C)下离心20分钟。
- 汇集上清液并缓慢加入65%硫酸铵。当所有硫酸铵溶解时,用铝板覆盖溶液,使其在4°C沉淀过夜。
注意: 请参阅供应商提供的硫酸铵安全数据表。 - 将沉淀物在12,298× g (4°C)下离心20分钟。回收沉淀并溶解在蒸馏水(约5mL)中。
- 使用管膜(14kDa)对水进行提取物透析24小时,然后冷冻干燥。将冷冻干燥的提取物在4°C避光储存直至使用。
- 酸奶制备
- 将1升巴氏杀菌牛奶、120克天然酸奶、20克糖和50克奶粉在热搅拌器中混合5分钟,50°C,速度3来制备天然酸奶。
- 将混合物放入热混合罐中,在37°C的培养箱中12小时。
- 通过将提取物以 0.21% 的浓度混合在酸奶中来掺入提取物。将样品储存在4°C的单个玻璃烧瓶中直至分析。
- 将不含色素(对照)的酸奶的单个部分储存在4°C直至分析。
- 颜色稳定性
注意:通过颜色分析评估酸奶中色素的稳定性 12 天。使用反射率色度计、2 度标准观察器和 D65 光源进行颜色分析。结果以 CIELab 坐标表示,参数为 L(亮度,黑色 - 白色,0 - 100)、a*(绿色 - 红色,-60 - 60)和 b*(蓝色 - 黄色,-60 - 60)参数。参数 a* 对红色为正值,对绿色为负值。参数 b* 对黄色取正值,对蓝色取负值。L*是亮度的参数,根据该参数,每种颜色可以被认为是等价于黑白33之间的灰度成员。- 使用制造商提供的白色陶瓷板(L* 88.5、a* 0.32、b* 0.33)校准色度计。
- 用大约 28 g 的样品(或对照)填充细胞,并使用颜色数据分析软件分析颜色。
注意:用于颜色数据分析的软件是SpectraMagic NX。 - 在样品/对照一式三份中执行读数 5 次。
- 感官分析
注:使用三角形测试(ISO 4120,2004)34 对加入色素的酸奶进行感官评估,并对颜色、味道和整体欣赏进行享乐评估。- 对于三角测试,给小组成员三个样品(一个色素酸奶样品和两个对照样品,或两个色素酸奶样品和一个对照样品),并要求他们根据香气、质地和味道选择不同的样品。提供用随机 3 位数字代码标识的相似体积的样品。
- 对于含色素酸奶的享乐评估,请给小组成员一份含色素酸奶样品,并要求他们使用 9 点享乐量表(从极度不喜欢到极度喜欢)评估颜色、味道和整体欣赏。
- 色素提取
结果
抗菌活性
在解释获得的结果时,应记住,抑制百分比越高,提取物在抑制该特定菌株生长方面的功效就越大,因此,提取物作为抗菌剂就越有趣。通过这种方法,我们可以快速确定哪些提取物对某些细菌菌株具有更大的活性,并确定未来使用中最有趣的提取物。因此,我们可以为进一步研究同一提取物提供一个起...
讨论
液体介质中的抗菌活性测试用于评估抗菌物质对悬浮在液体介质中的微生物的有效性,通常用于确定物质抑制生长或杀死微生物的能力35,36,37,38.它们用于评估微生物对抗菌剂的敏感性,并在试管或微量滴定板中进行,其中不同浓度的抗微生物物质针对目标微生物的标准化悬浮液进行测试2...
披露声明
作者没有什么可透露的。
致谢
这项工作得到了葡萄牙科学技术基金会(FCT)的支持,通过授予MARE-海洋与环境科学中心的战略项目(UIDP/04292/2020和UIDB/04292/2020)和副实验室ARNET(LA/P/0069/2020)。FCT 还资助了授予 Marta V. Freitas (UI/BD/150957/2021) 和 Tatiana Pereira (2021.07791. BD)。这项工作还得到了HP4A--全民健康意大利面项目(共同推广第039952号)的财政支持,该项目由ERDF--欧洲区域发展基金在葡萄牙2020年计划下通过COMPETE 2020--竞争力和国际化运营计划共同资助。
材料
| Name | Company | Catalog Number | Comments |
| Absolute Ethanol | Aga, Portugal | 64-17-5 | |
| Ammonium Chloride | PanReac | 12125-02-9 | |
| Amphotericin B | Sigma-Aldrich | 1397-89-3 | |
| Analytical scale balance | Sartorius, TE124S | 22105307 | |
| Bacillus subtilis subsp. spizizenii | German Collection of Microorganisms and Cell Cultures (DSMZ) | DSM 347 | |
| Biotin | Panreac AppliChem | 58-85-5 | |
| Centrifuge | Eppendorf, 5810R | 5811JH490481 | |
| Chloramphenicol | PanReac | 56-75-7 | |
| CO2 Chamber | Memmert | N/A | |
| Cool White Fluorescent Lamps | OSRAM Lumilux Skywhite | N/A | |
| Densitometer McFarland | Grant Instruments | N/A | |
| DMEM medium | Sigma-Aldrich | D5796 | |
| DMSO | Sigma-Aldrich | 67-68-5 | |
| DPPH | Sigma, Steinheim, Germany | 1898-66-4 | |
| Escherichia coli (DSM 5922) | German Collection of Microorganisms and Cell Cultures (DSMZ) | DSM5922 | |
| Ethanol 96% | AGA-Portugal | 64-17-5 | |
| Ethylenediaminetetraacetic Acid Disodium Salt Dihydrate (Na2EDTA) | J.T.Baker | 6381-92-6 | |
| Fetal Bovine Serum (FBS) | Sigma-Aldrich | F7524 | |
| Filter Paper (Whatman No.1) | Whatman | WHA1001320 | |
| Flasks | VWR International, Alcabideche, Portugal | N/A | |
| Folin-Ciocalteu | VWR Chemicals | 31360.264 | |
| Gallic Acid | Merck | 149-91-7 | |
| Germanium (IV) Oxide, 99.999% | AlfaAesar | 1310-53-8 | |
| HaCaT cells – 300493 | CLS-Cell Lines Services, Germany | 300493 | |
| Hot Plate Magnetic Stirrer | IKA, C-MAG HS7 | 06.090564 | |
| Iron Sulfate | VWR Chemicals | 10124-49-9 | |
| Laminar flow hood | TelStar, Portugal | 526013 | |
| LB Medium | VWR Chemicals | J106 | |
| Listonella anguillarum | German Collection of Microorganisms and Cell Cultures (DSMZ) | DSM 21597 | |
| Manganese Chloride | VWR Chemicals | 7773.01.5 | |
| Micropipettes | Eppendorf, Portugal | N/A | |
| Microplates | VWR International, Alcabideche, Portugal | 10861-666 | |
| Microplates | Greiner | 738-0168 | |
| Microplates (sterile) | Fisher Scientific | 10022403 | |
| Microplate reader | Epoch Microplate Spectrophotometer, BioTek, Vermont, USA | 1611151E | |
| MTT | Sigma-Aldrich | 289-93-1 | |
| Muller-Hinton Broth (MHB) | VWR Chemicals | 90004-658 | |
| Oven | Binder, FD115 | 12-04490 | |
| Oven | Binder, BD115 | 04-62615 | |
| Penicillin | Sigma-Aldrich | 1406-05-9 | |
| pH meter Inolab | VWR International, Alcabideche, Portugal | 15212099 | |
| Pippete tips | Eppendorf, Portugal | 5412307 | |
| Pyrex Bottles Media Storage | VWR International, Alcabideche, Portugal | 16157-169 | |
| Rotary Evaporator | Heidolph, Laborota 4000 | 80409287 | |
| Rotavapor | IKA HB10, VWR International, Alcabideche, Portugal | 07.524254 | |
| Sodium Carbonate (Na2CO3) | Chem-Lab | 497-19-8 | |
| Sodium Chloride (NaCl) | Normax Chem | 7647-14-5 | |
| Sodium Phosphate Dibasic | Riedel-de Haën | 7558-79-4 | |
| SpectraMagic NX | Konica Minolta, Japan | color data analysis software | |
| Spectrophotometer | Evolution 201, Thermo Scientific, Madison, WI, USA | 5A4T092004 | |
| Streptomycin | Sigma-Aldrich | 57-92-1 | |
| Thiamine | Panreac AppliChem | 59-43-8 | |
| Trypsin-EDTA | Sigma-Aldrich | T4049 | |
| Tryptic Soy Agar (TSA) | VWR Chemicals | ICNA091010617 | |
| Tryptic Soy Broth (TSB) | VWR Chemicals | 22091 | |
| Ultrapure water | Advantage A10 Milli-Q lab, Merck, Darmstadt, Germany | F5HA17360B | |
| Vacuum pump | Buchi, Switzerland | FIS05-402-103 | |
| Vitamin B12 | Merck | 68-19-9 |
参考文献
- Charoensiddhi, S., Abraham, R. E., Su, P., Zhang, W. Seaweed and seaweed-derived metabolites as prebiotics. Advances in Food and Nutrition Research. 91, 97-156 (2020).
- Roohinejad, S., Koubaa, M., Barba, F. J., Saljoughian, S., Amid, M., Greiner, R. Application of seaweeds to develop new food products with enhanced shelf-life, quality, and health-related beneficial properties. Food Research International. 99, 1066-1083 (2017).
- Hurd, C. L., Harrison, P. J., Bischof, K., Lobban, C. S. . Seaweed Ecology and Physiology. (second). , (2014).
- Freitas, M. V., Mouga, T., Correia, A. P., Afonso, C., Baptista, T. New insights on the sporulation, germination, and nutritional profile of Gracilaria gracilis (Rhodophyta) grown under controlled conditions. Journal of Marine Science and Engineering. 9 (6), 562 (2021).
- Friedlander, M. Advances in cultivation of Gelidiales. Journal of Applied Phycology. 20 (5), 451-456 (2008).
- Matos, G. S., Pereira, S. G., Genisheva, Z. A., Gomes, A. M., Teixeira, J. A., Rocha, C. M. R. Advances in extraction methods to recover added-value compounds from seaweeds: Sustainability and functionality. Foods. 10, 516 (2021).
- Ummat, V., Sivagnanam, S. P., Rajauria, G., O'Donnell, C., Tiwari, B. K. Advances in pre-treatment techniques and green extraction technologies for bioactives from seaweeds. Trends in Food Science & Technology. 110, 90-106 (2021).
- Pérez, M. J., Falqué, E., Domínguez, H., Ravishankar, G., Ambati, R. R. Seaweed Antimicrobials, Present Status and Future Perspectives. Handbook of Algal Technologies andPhytochemicals:Volume I Food, Health and Nutraceutical Applications. , (2019).
- Cavallo, R. A., Acquaviva, M. I., Stabili, L., Cecere, E., Petrocelli, A., Narracci, M. Antibacterial activity of marine macroalgae against fish pathogenic Vibrio species. Central European Journal of Biology. 8, 646-653 (2013).
- Shannon, E., Abu-Ghannam, N. Antibacterial derivatives of marine algae: An overview of pharmacological mechanisms and applications. Marine Drugs. 14 (4), 81 (2016).
- Capillo, G., et al. New insights into the culture method and antibacterial potential of Gracilaria gracilis. Marine Drugs. 16 (12), 492 (2018).
- Francavilla, M., Franchi, M., Monteleone, M., Caroppo, C. The red seaweed Gracilaria gracilis as a multi products source. Marine Drugs. 11 (10), 3754-3776 (2013).
- Sánchez-Ayora, H., Pérez-Jiménez, J., Pérez-Correa, J. R., Mateos, R., Domínguez, R. Antioxidant Capacity of Seaweeds: In Vitro and In Vivo Assessment. Marine Phenolic Compounds. , 299-341 (2023).
- Anil, S., Sweety, V. K., Vikas, B., Betsy-Joseph, B. . Cytotoxicity and Cell Viability Assessment of Biomaterials. Cytotoxicity. , 111822 (2023).
- Mosmann, T. Rapid colorimetric assay for cellular growth and survival: Application to proliferation and cytotoxicity assays. Journal of Immunological Methods. 65 (1-2), 55-63 (1983).
- Roleda, M. Y., et al. Variations in polyphenol and heavy metal contents of wild-harvested and cultivated seaweed bulk biomass: Health risk assessment and implication for food applications. Food Control. 95, 121-134 (2019).
- Souza, K. D., et al. Gastronomy and the development of new food products: Technological prospection. International Journal of Gastronomy and Food Science. 33, 100769 (2023).
- Pereira, T., et al. Optimization of phycobiliprotein pigments extraction from red algae Gracilaria gracilis for substitution of synthetic food colorants. Food Chemistry. 321, 126688 (2020).
- Redmond, S., Green, L., Yarish, C., Kim, J., Neefus, C., Redmond, S., Green, L., Yarish, C., Kim, J., Neefus, C. . New England Seaweed Culture Handbook-Nursery Systems. , (2014).
- Yong, Y. S., Yong, W. T. L., Anton, A. Analysis of formulae for determination of seaweed growth rate. Journal of Applied Phycology. 25 (6), 1831-1834 (2013).
- Patarra, R. F., Carreiro, A. S., Lloveras, A. A., Abreu, M. H., Buschmann, A. H., Neto, A. I. Effects of light, temperature and stocking density on Halopteris scoparia growth. Journal of Applied Phycology. 29 (1), 405-411 (2017).
- NCCLS, National Committee for Clinical Laboratory Standards, Clinical and Laboratory Standards Institute. . Performance Standards for Antimicrobial Disk Susceptibility Tests: Approved Standard. 32, M02-M11 (2012).
- Singleton, V. L., Rossi, J. A. J. Colorimetry to total phenolics with phosphomolybdic acid reagents. American Journal of Enology and Viticulture. 16, 144-158 (1965).
- Duan, X. J., Zhang, W. W., Li, X. M., Wang, B. G. Evaluation of antioxidant property of extract and fractions obtained from a red alga, Polysiphonia urceolata. Food Chemistry. 95 (1), 37-43 (2006).
- Freitas, R., et al. Highlighting the biological potential of the brown seaweed Fucus spiralis for skin applications. Antioxidants. 9 (7), 611 (2020).
- Duarte, A., et al. Seasonal study of the nutritional composition of unexploited and low commercial value fish species from the Portuguese coast. Food Science and Nutrition. 10 (10), 3368-3379 (2020).
- Folch, J., Lees, M., Stanley, G. A simple method for the isolation and purification of total lipides from animal tissues. Journal of Biological Chemistry. 226 (1), 497-509 (1957).
- ISO 6865. Animal feeding stuffs - Determination of crude fibre content - Method with intermediate filtration. Bureau of Indian Standards (BIS). , (2000).
- Fernández, A., Grienke, U., Soler-Vila, A., Guihéneuf, F., Stengel, D. B., Tasdemir, D. Seasonal and geographical variations in the biochemical composition of the blue mussel (Mytilus edulis L.) from Ireland. Food Chemistry. 177, 43-52 (2015).
- Pinto, F., et al. Annual variations in the mineral element content of five fish species from the Portuguese coast. Food Research International. 158, 111482 (2022).
- Food energy - methods of analysis and conversion factors. Available from: https://www.fao.org/fileadmin/templates/food_composition/documents/book_abstracts/Food_energy.pdf (2003)
- . 1169/2011 of the European Parliament and of the Council of 25 -10-2011 Available from: https://eur-lex.europa.eu/legal-content/EN/ALL/?uri=CELEX%3A32011R1169 (2011)
- Pathare, P. B., Opara, U. L., Al-Said, F. A. J. Colour measurement and analysis in fresh and processed foods: A review. Food and Bioprocess Technology. 6 (1), 36-60 (2013).
- ISO 4120. Sensory analysis - Methodology - Triangle test. International Standard. , (2004).
- Reller, L. B., Weinstein, M., Jorgensen, J. H., Ferraro, M. J. Antimicrobial susceptibility testing: A review of general principles and contemporary practices. Clinical Infectious Diseases. 49 (11), 1749-1755 (2009).
- Balouiri, M., Sadiki, M., Ibnsouda, S. K. Methods for in vitro evaluating antimicrobial activity: A review. Journal of Pharmaceutical Analysis. 6 (2), 71-79 (2016).
- Gajic, I., et al. Antimicrobial susceptibility testing: A comprehensive review of currently used methods. Antibiotics. 11 (4), 427 (2022).
- Gonzalez-Pastor, R., et al. Current landscape of methods to evaluate antimicrobial activity of natural extracts. Molecules. 28 (3), 1068 (2023).
- Li, J., et al. Antimicrobial activity and resistance: Influencing factors. Frontiers in Pharmacology. 13 (8), 364 (2017).
- Silva, A., et al. Macroalgae as a source of valuable antimicrobial compounds: Extraction and applications. Antibiotics. 9 (10), 642 (2020).
- Munteanu, I. G., Apetrei, C. Analytical methods used in determining antioxidant activity: A review. International Journal of Molecular Sciences. 22 (7), 3380 (2021).
- Ma, S., et al. Comparison of common analytical methods for the quantification of total polyphenols and flavanols in fruit juices and ciders. Journal of Food Science. 84 (8), 2147-2158 (2019).
- Tziveleka, L. A., Tammam, M. A., Tzakou, O., Roussis, V., Ioannou, E. Metabolites with antioxidant activity from marine macroalgae. Antioxidants. 10 (9), 1431 (2021).
- Ghasemi, M., Turnbull, T., Sebastian, S., Kempson, I. The MTT assay: Utility, limitations, pitfalls, and interpretation in bulk and single-cell analysis. International Journal of Molecular Sciences. 22 (23), 12827 (2021).
- Pereira, T., Barroso, S., Mendes, S., Gil, M. M. Stability, kinetics, and application study of phycobiliprotein pigments extracted from red algae Gracilaria gracilis. Journal of Food Science. 85 (10), 3400-3405 (2020).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。