Zum Anzeigen dieser Inhalte ist ein JoVE-Abonnement erforderlich. Melden Sie sich an oder starten Sie Ihre kostenlose Testversion.
Methods Article
Aufwertung der Rotalge Gracilaria gracilis durch einen Bioraffinerieansatz
In diesem Artikel
Zusammenfassung
Hier beschreiben wir verschiedene Protokolle, die auf eine integrierte Aufwertung von Gracilaria gracilis abzielen: Ernte von Wildarten, Eigenzucht und Extraktion von bioaktiven Inhaltsstoffen. Die antioxidative, antimikrobielle und zytotoxische Wirkung der Extrakte wird ebenso bewertet wie die Nährwert- und Stabilitätsbewertung von Lebensmitteln, die mit ganzer Algenbiomasse und Pigmenten angereichert sind.
Zusammenfassung
Das Interesse an Algen als reichlich vorhandener Rohstoff zur Gewinnung wertvoller und zielführender bioaktiver Inhaltsstoffe wächst kontinuierlich. In dieser Arbeit untersuchen wir das Potenzial von Gracilaria gracilis, einer essbaren Rotalge, die weltweit wegen ihres kommerziellen Interesses als Quelle für Agar und andere Inhaltsstoffe für kosmetische, pharmakologische, Lebensmittel- und Futtermittelanwendungen angebaut wird.
Die Wachstumsbedingungen von G. gracilis wurden durch vegetative Vermehrung und Sporulation optimiert, während die physikalisch-chemischen Bedingungen manipuliert wurden, um einen großen Biomassebestand zu erreichen. Grüne Extraktionsmethoden mit Ethanol und Wasser wurden über die Algenbiomasse durchgeführt. Das bioaktive Potenzial der Extrakte wurde durch eine Reihe von In-vitro-Assays hinsichtlich ihrer Zytotoxizität, ihrer antioxidativen und antimikrobiellen Eigenschaften bewertet. Darüber hinaus wurde getrocknete Algenbiomasse in Nudelformulierungen eingearbeitet, um den Nährwert der Lebensmittel zu erhöhen. Aus G. gracilis extrahierte Pigmente wurden auch als natürlicher Farbstoff in Joghurt eingearbeitet und ihre Stabilität bewertet. Beide Produkte wurden einer halbgeschulten sensorischen Jury unterzogen, die darauf abzielt, die beste Endformulierung zu erreichen, bevor sie auf den Markt kommen.
Die Ergebnisse belegen die Vielseitigkeit von G. gracilis , unabhängig davon, ob es als Gesamtbiomasse, Extrakte und/oder Pigmente angewendet wird. Durch die Implementierung mehrerer optimierter Protokolle ermöglicht diese Arbeit die Entwicklung von Produkten mit dem Potenzial, von den Lebensmittel-, Kosmetik- und Aquakulturmärkten zu profitieren und die ökologische Nachhaltigkeit und eine blaue Kreislaufwirtschaft zu fördern.
Darüber hinaus wird die verbleibende Algenbiomasse im Einklang mit einem Bioraffinerieansatz als Biostimulans für das Pflanzenwachstum verwendet oder in Kohlenstoffmaterialien umgewandelt, die bei der Wasseraufbereitung der hauseigenen Aquakultursysteme von MARE-Polytechnic in Leiria, Portugal, verwendet werden.
Einleitung
Algen können als interessanter natürlicher Rohstoff angesehen werden, von dem die Pharma-, Lebensmittel-, Futtermittel- und Umweltbranche profitieren kann. Sie biosynthetisieren eine Vielzahl von Molekülen, von denen viele in terrestrischen Organismen nicht vorkommen und relevante biologische Eigenschaften aufweisen 1,2. Es müssen jedoch Algen-optimierte Anbauprotokolle implementiert werden, um einen großen Biomassebestand zu gewährleisten.
Die Anbaumethoden müssen immer die Art der Algen-Thalli und die allgemeine Morphologie berücksichtigen. Gracilaria gracilis ist ein klonales Taxon, d.h. das Bindungsorgan produziert mehrere vegetative Achsen. Die Fortpflanzung durch Fragmentierung (vegetative Fortpflanzung) wird somit erreicht, da jede dieser Achsen vollständig in der Lage ist, ein unabhängiges Leben vom Hauptthallus3 anzunehmen. Klonale Taxa können mit einfachen und schnellen einstufigen Kultivierungsmethoden erfolgreich integriert werden, da große Mengen an Biomasse durch die Spaltung des Thallus in kleine Fragmente gewonnen werden, die sich schnell regenerieren und zu neuen, genetisch identischen Individuen heranwachsen. Dabei können sowohl haplontische als auch diplontische Thalli verwendet werden. Obwohl die Gattung einen komplexen haplo-diplontischen isomorphen triphasischen Lebenszyklus aufweist, ist eine Sporulation nur selten erforderlich, es sei denn, eine genetische Erneuerung der Bestände ist erforderlich, um verbesserte Ernten zu erzielen. In diesem Fall entstehen sowohl Tetrasporen (haplontische Sporen, die durch Meiose gebildet werden) als auch Carposporen (diplontische Sporen, die durch Mitose gebildet werden) makroskopische Thalli, die dann durch vegetative Vermehrung gezüchtet und vermehrt werden können4. Wachstumszyklen werden von den Umweltbedingungen und dem physiologischen Zustand der Individuen bestimmt, neben anderen biologischen Faktoren wie der Entstehung von Epiphyten und der Adhäsion anderer Organismen. Daher ist die Optimierung der Wachstumsbedingungen von entscheidender Bedeutung, um eine hohe Produktivität zu gewährleisten und Biomasse von guter Qualität zu produzieren5.
Die Extraktion bioaktiver Verbindungen aus Algen, einschließlich G. gracilis, kann durch verschiedene Methoden erreichtwerden 6,7. Die Wahl der Extraktionsmethode hängt von den spezifischen Verbindungen von Interesse, der Zielanwendung und den Eigenschaften der Algen ab. In dieser Studie konzentrierten wir uns auf die Lösungsmittelextraktion, bei der grüne Lösungsmittel wie Wasser oder Ethanol verwendet werden, um bioaktive Verbindungen aus der Algenbiomasse aufzulösen und zu extrahieren. Die Extraktion kann durch Mazeration vielseitig und effektiv durchgeführt werden und kann für eine Vielzahl von Verbindungen verwendet werden. Es handelt sich um eine einfache und weit verbreitete Methode, bei der Biomasse über einen längeren Zeitraum in einem Lösungsmittel eingeweicht wird, typischerweise bei Raum- oder leicht erhöhten Temperaturen. Das Lösungsmittel wird gerührt, um den Extraktionsprozess zu verbessern. Nach der gewünschten Extraktionszeit wird das Lösungsmittel durch Filtration oder Zentrifugation vom Feststoff getrennt.
Wasser ist aufgrund seiner Sicherheit, Verfügbarkeit und Kompatibilität mit einer Vielzahl von Lebensmitteln ein häufig verwendetes Lösungsmittel in Lebensmittelanwendungen. Die Wasserextraktion eignet sich für polare Verbindungen wie Polysaccharide, Peptide und bestimmte Phenole. Es kann jedoch sein, dass es unpolare Verbindungen nicht effektiv extrahiert. Ethanol ist auch ein weit verbreitetes Lösungsmittel in Lebensmittelanwendungen und kann für die Extraktion einer Vielzahl von bioaktiven Molekülen, einschließlich phenolischer Verbindungen, Flavonoide und bestimmter Pigmente, wirksam sein. Ethanol ist allgemein als sicher für die Verwendung in Lebensmitteln anerkannt und kann leicht verdampft werden, wobei die extrahierten Verbindungen zurückbleiben. Es ist erwähnenswert, dass bei der Wahl der Extraktionsmethode Faktoren wie Effizienz, Selektivität, Kosteneffizienz und Umweltauswirkungen berücksichtigt werden sollten. Die Optimierung von Extraktionsparametern wie Lösungsmittelkonzentration, Extraktionszeit, Temperatur und Druck ist entscheidend, um optimale Ausbeuten an bioaktiven Verbindungen aus G. gracilis oder anderen Algen zu erzielen.
Es wurde festgestellt, dass Algen eine antimikrobielle Aktivität gegen eine Vielzahl von Mikroorganismen aufweisen, darunter Bakterien, Pilze und Viren8. Diese Aktivität wird bioaktiven Komponenten zugeschrieben, darunter Phenole, Polysaccharide, Peptide und Fettsäuren. Mehrere Studien haben ihre Wirksamkeit gegen Krankheitserreger wie Escherichia coli, Staphylococcus aureus, Salmonella sp. und Pseudomonas aeruginosa unter anderem nachgewiesen9. Die antimikrobielle Aktivität von Algen wird auf das Vorhandensein bioaktiver Verbindungen zurückgeführt, die mikrobielle Zellwände, Membranen, Enzyme und Signalwege stören können10. Diese Verbindungen können das mikrobielle Wachstum stören, die Bildung von Biofilmen hemmen und die Immunantwort modulieren.
Rote Algen, auch Rhodophyten genannt, sind eine Gruppe von Algen, die eine antimikrobielle Aktivität gegen eine Vielzahl von Mikroorganismen aufweisen können. Innerhalb dieser Gruppe enthält G. gracilis verschiedene bioaktive Verbindungen, die zu seiner berichteten antimikrobiellen Aktivität beitragen können. Während die spezifischen Moleküle variieren können, sind die gemeinsamen Klassen, über die in G. gracilis berichtet wurde und antimikrobielle Eigenschaften besitzen können, Polysaccharide, Phenole, Terpenoide und Pigmente11. Es ist jedoch wichtig zu beachten, dass das Vorhandensein und die Mengen dieser Komponenten je nach Faktoren wie dem Ort der Algensammlung, der Saisonalität, dem physiologischen Zustand des Thallis und den Umweltbedingungen variieren können. Daher können die spezifische Klasse und Konzentration der antimikrobiellen Verbindungen in G. gracilis entsprechend variieren.
Es wurde auch festgestellt, dass G. gracilis antioxidative Eigenschaften besitzt, die verschiedene phenolische Verbindungen enthalten, von denen gezeigt wurde, dass sie freie Radikale abfangen und oxidativen Stress reduzieren12.Antioxidantien tragen dazu bei, die Zellen vor Schäden durch reaktive Sauerstoffspezies zu schützen und haben potenzielle gesundheitliche Vorteile. Die antioxidative Kapazität kann direkt durch verschiedene Methoden bewertet werden, einschließlich der 2,2-Diphenyl-1-picrylhydrazyl (DPPH)-Radikalfängeraktivität und indirekt durch die Quantifizierung des Gesamtpolyphenolgehalts (TPC)13.
Auch wenn ein Inhaltsstoff eine ausgeprägte Bioaktivität aufweist, ist seine Zytotoxizitätsbewertung bei der Bewertung natürlicher und synthetischer Substanzen, die in Kontakt mit lebenden Zellen oder Geweben verwendet werden sollen, unerlässlich. Es gibt mehrere Methoden zur Messung der Zytotoxizität, jede mit Vor- und Nachteilen. Insgesamt bieten sie eine Reihe von Möglichkeiten, die schädlichen Auswirkungen vieler Substanzen auf Zellen zu bewerten und gleichzeitig die Mechanismen von Zellschädigung und Zelltod zu untersuchen14.
In dieser Arbeit verwenden wir den 3-(4,5-Dimethylthiazol-2-yl)-2,5-diphenyltetrazoliumbromid (MTT)-Assay, eine kolorimetrische Methode, die von Mosmann (1983)15 eingeführt wurde. Diese Methode misst die Reduktion von Tetrazoliumsalzen zu einem violetten Formazanprodukt durch stoffwechselaktive Zellen. Je höher die Menge an Formazankristallen, desto höher ist die Anzahl lebensfähiger Zellen, was ein indirektes Maß für die Zytotoxizität darstellt14. Da in dieser Arbeit G. gracilis-Wasser und Ethanolextrakte in dermokosmetische Formulierungen eingearbeitet werden sollen, wird die in vitro Zytotoxizitätsbewertung in einer Keratinozyten (HaCaT)-Zelllinie durchgeführt.
In Bezug auf die Lebensmittelanwendung sind Algen im Allgemeinen kalorienarm und nährstoffreich an Ballaststoffen, essentiellen Elementen und Aminosäuren, Polysacchariden, mehrfach ungesättigten Fettsäuren, Polyphenolen und Vitaminen 2,16. G. gracilis ist da keine Ausnahme und hat einen interessanten Nährwert. Freitas et al. (2021)4 fanden heraus, dass kultivierte G. gracilis im Vergleich zu wilden Algen einen höheren Protein- und Vitamin-C-Gehalt aufwies und den Gesamtlipidspiegel beibehielt. Dies kann einen wirtschaftlichen und ökologischen Vorteil darstellen, da die Produktion ernährungsphysiologisch der Ausbeutung wilder Ressourcen vorzuziehen ist. Darüber hinaus sind die Verbraucher zunehmend besorgt über die Art der Lebensmittel, die sie essen, daher ist es wichtig, neue Zutaten für die Anreicherung von Lebensmitteln einzuführen und neue Ressourcen zu verwenden, um Extrakte zu erhalten, die einem Produkt einen Mehrwert verleihen und ein "sauberes Etikett" beanspruchen können. Außerdem ist der derzeitige Markt sehr wettbewerbsintensiv und erfordert die Entwicklung neuer Produkte und innovativer Strategien, um die Hersteller von ihren Mitbewerbern abzuheben17.
Die Anreicherung von Produkten mit geringem Nährwert, wie z. B. Nudeln, mit Meeresressourcen, einschließlich Algen, ist eine Strategie, um diese Ressource als neues Lebensmittel einzuführen, und eine Marktdifferenzierungsstrategie durch ein Produkt mit ausgeprägtem Nährwert. Auf der anderen Seite ist G. gracilis eine Quelle für natürliche rote Pigmente wie Phycobiliproteine18, die ein hohes Potenzial für Anwendungen in der Lebensmittelindustrie haben. Diese Algen haben in mehreren Bereichen großes Interesse gezeigt, und ihre Anwendung kann mit den gesamten Algen, Extrakten und/oder der verbleibenden Biomasse erfolgen. In dieser Arbeit zeigen wir einige Beispiele für solche Anwendungen.
Protokoll
1. Ernte und Aufbereitung von Biomasse
- Ernten Sie die Proben von G. gracilis bei Ebbe und transportieren Sie sie schnell in dunklen, gekühlten Boxen ins Labor, um Trocknung, Licht und Lufteinwirkung zu vermeiden.
- Waschen Sie jeden Thallus im Labor mit fließendem Meerwasser und reinigen Sie ihn gründlich, um Ablagerungen, nekrotische Teile, Epiphyten und andere Organismen von der Oberfläche zu entfernen.
- Halten Sie die wilde Biomasse in konstant belüftetem Meerwasser (31-35 PSU) in einem Klimaraum (20 ± 1 °C) mit geringer Bestrahlungsstärke durch Tageslicht, kaltweiße Lampen und Leuchtstofflampen und photoperiodisch auf 16:08 Uhr (hell: dunkel) für 7 Tage. Während dieser Zeit dürfen keine Nährmedien zugeführt werden. So können sich die Algen langsam an die neuen Bedingungen im Innenraum gewöhnen.
2. Bestandspflege
- Schneiden Sie nach der Eingewöhnungszeit gesunde Algenspitzen mit einer sterilen Klinge ab. In Anlehnung an Redmond et al. (2014)19 und unter sterilen Bedingungen wird jede Spitze durch ein zuvor in Petrischalen zubereitetes Agar-Gel (1,0 % bakteriologischer Agar, im Verhältnis 1:1 destilliertes Wasser/Meerwasser) gezogen, um alle verbleibenden Verunreinigungen zu entfernen. Führen Sie den Agar-Zug dreimal für jede Spitze durch und ziehen Sie die Spitze immer durch unbenutzte Teile des Agar-Gels.
- Gläser in Salzsäurelösung (HCl, 15%) sauer waschen und gründlich mit destilliertem Wasser abspülen. Sterilisieren Sie alle Werkzeuge, Glaswaren, Agar, Meerwasser und destilliertes Wasser, die im Reinigungsprozess verwendet werden, im Autoklaven (121 °C, 15 min).
ACHTUNG: Beachten Sie das vom Lieferanten gelieferte Sicherheitsdatenblatt von HCl. - Die Spitzen wachsen in sterilisiertem Meerwasser bei 35 psu, ergänzt mit Von Stosch Enriched Solution (VSE), die für rote Algen modifiziert wurde, nach Redmond et al. (2014)19. Geben Sie Germaniumdioxid (GeO2) in das Medium (1 ml/L), um das Wachstum von epiphytischen Kieselalgen zu verhindern.
ACHTUNG: Beachten Sie das vom Lieferanten gelieferte Sicherheitsdatenblatt von GeO2 .
HINWEIS: Spitzen, die einen Pigmentverlust aufweisen, wie er durch teilweise oder vollständige Verfärbungen beobachtet wird, stehen unter Stress oder sind bereits tot und sollten entsorgt werden.
3. Anbau und Scale-up
- Nach der Akklimatisierungsphase werden nach dem Zufallsprinzip etwa 8-10 gesunde Spitzen in 250-ml-Flachbodenkolben in einem Klimaraum verteilt, der auf 20 ± 1 °C eingestellt ist, mit dem weißen kühlen Licht von 20 ± 0,5 μmol Photonen m-2 s-1 (1500 Lux), einer Photoperiode von 16 h: 8 h (hell: dunkel) und sterilem Meerwasser, das mit VSE-Nährmedien angereichert ist, die jede Woche erneuert werden.
- Führen Sie wöchentliche Gewichtsmessungen durch und vermeiden Sie es, die Thalli übermäßig zu belasten20. Entfernen Sie dazu vorsichtig die Spitzen aus dem Nährmedium, spülen Sie sie vorsichtig ab und wiegen Sie die Milligramm auf einer Laborwaage ab.
HINWEIS: Dieses Verfahren kann zusammen mit der wöchentlichen Erneuerung der Nährmedien durchgeführt werden. - Thalli kann in diesen Kolben bis zu einer Dichte von 2 g/L wachsen. Führen Sie an dieser Stelle eine Empfängerskalierung durch (250 ml, 1 l und 5 l). Füllen Sie den Anbau in offene weiße Behälter von 50 l und mehr im Freien, wenn das Volumen 5 l erreicht.
- Berechnen Sie die relative Wachstumsrate (RGR) nach Patarra et al. (2017)21 :
RGR (% vw/Tag) = ([Ln (fw) - Ln (iw)]/t) x 100
Dabei sind iw und fw das Anfangs- bzw. Endfrischgewicht, ausgedrückt in Gramm, und t die Zeit in Tagen.
HINWEIS: In diesem Laboraufbau erreicht die RGR Werte von bis zu 21 % pro Tag. Die Biomasseernte kann jederzeit durchgeführt werden. Biomasse muss schnell aufbereitet werden, um einen Abbau zu verhindern, entweder durch Ofentrocknung, Gefriertrocknung oder einfach gefroren (-20 °C), je nach Verwendungszweck. Die getrocknete Biomasse kann bei Raumtemperatur (RT) konserviert oder auch gefroren gelagert werden.
4. Extraktionsverfahren
HINWEIS: Um die In-vitro-Zytotoxizität, die antioxidativen und antimikrobiellen Eigenschaften von G. gracils-Extrakten zu bewerten, werden bei der Herstellung zwei verschiedene Parameter berücksichtigt: die Extraktionstemperatur und die Art des Lösungsmittels.
- Um die Extraktionen durchzuführen, wird die Biomasse von G. gracilis im Ofen getrocknet und die Biomasse gemahlen (z. B. in einer Haushaltskaffeemühle), bis das Pulver durch ein 200-μm-Sieb läuft.
- Die getrocknete Biomasse (10 g) wird gewogen und in 100 ml Lösungsmittel (absolutes Ethanol oder steriles Wasser) aufgelöst.
- In einem lichtgeschützten Gefäß 30 min einrühren.
- Führen Sie sequentielle Ethanol- > Wasser und Wasser- > Ethanolextraktionen bei RT, 40 °C und 70 °C durch.
- Führen Sie für jede Temperatur die Extraktionen mit Ethanol und Wasser zweimal getrennt durch.
- Trennen Sie die flüssigen Extrakte von der verbleibenden Biomasse durch Filtration durch Filterpapier (Whatman No.1), gefolgt von Zentrifugation bei 8000 x g für 10 min bei RT.
- Verwenden Sie die verbleibende Algenbiomasse für die weitere Extraktion mit dem anderen Lösungsmittel wieder. Wenn eine Probe zuerst mit Ethanol extrahiert wurde, extrahieren Sie sie anschließend mit Wasser und umgekehrt.
- Die wässrigen Extrakte werden gefriergetrocknet und die Ethanolextrakte in einem Rotationsverdampfer bei 40 °C eingedampft.
- Lagern Sie die getrockneten Extrakte bei 4 °C.
- Lösen Sie die Extrakte in einer Konzentration von 50 mg/ml (antimikrobielle Assays) oder 10 mg/ml (antioxidative Assays) auf. Die wässrigen Extrakte werden in sterilem Wasser und die ethanolischen Extrakte in absolutem Ethanol gelöst.
5. Antimikrobielle Aktivität
HINWEIS: Die ethanolischen und wässrigen Extrakte sollten einzeln gegen Bacillus subtilis subsp. spizizenii (DSM 347), Escherichia coli (DSM 5922) und Listonella anguillarum (DSM 21597) getestet werden. Antimikrobielle Tests müssen gemäß den Empfehlungen des National Committee for Clinical Laboratory Standards (NCCLS, 2012)22 durchgeführt werden. Alle Kulturen stammen aus der Deutschen Sammlung von Mikroorganismen und Zellkulturen (DSMZ). L. anguillarum wurde auf tryptischer Sojabrühe (TSB) oder tryptischem Sojaagar (TSA) gezüchtet, die mit 1 % Natriumchlorid (NaCl) ergänzt wurde. Die restlichen beiden Stämme wurden auf LB-Medium (VWR Chemicals) gezüchtet. Die Kulturen Bacillus subtilis subsp. spizizenii (DSM 347) und Listonella anguillarum (DSM 21597) wurden bei 30 °C inkubiert, während Escherichia coli (DSM 5922) bei 37 °C gemäß den Anweisungen des Lieferanten inkubiert wurde. Die Bouillon-Mikrodilutionsmethode kann zur Bestimmung der antimikrobiellen Aktivität in einem flüssigen Medium verwendet werden, und dies sollte auf der Mikroskala durchgeführt werden, damit das antimikrobielle Potenzial schnell und effizient bestimmt werden kann. Diese kostengünstige Methode ermöglicht es, Ergebnisse in nur 24 Stunden zu erhalten, und eignet sich daher, um in einem frühen Stadium die besten Extraktionsbedingungen zu bestimmen, die es ermöglichen, für einen bestimmten mikrobiellen Stamm Ergebnisse in Bezug auf die wachstumshemmende Wirkung zu erzielen. Die Methodik erfordert jedoch die Verwendung steriler Mikrotiterplatten mit einem Deckel, der speziell für das mikrobielle Wachstum geeignet ist, sowie die Verfügbarkeit eines Mikroplatten-Readers für die Wellenlänge von 600 nm.
- Führen Sie die Bouillon-Mikrodilutionstests mit unbehandelten und runden 96-Well-Mikrotiterplatten mit 170 μl Muller-Hinton-Bouillon (MHB) durch, die mit 10 μl standardisiertem Inokulum (bei 0,5 McFarland-Standard) und 20 μl jedes Extrakts (50 mg/ml) beimpft wurden.
- Inkubieren Sie die Platten 24 Stunden lang bei der optimalen Temperatur für jeden Stamm.
- Nachweis der antimikrobiellen Aktivität durch Verringerung der sichtbaren Trübung, gemessen durch Aufzeichnung der optischen Dichte (OD 600) in einem Mikroplatten-Spektralphotometer bei 0 h und 24 h.
- Drücken Sie die Ergebnisse als Prozentsatz der Hemmung aus:
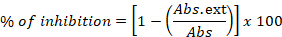
wobei Abs. ext die Differenz in der gemessenen Absorption zwischen 0 h und 24 h in den Vertiefungen ist, die einen Bakterienstamm enthalten, der in Gegenwart des Extrakts wächst, und Abs sich auf dasselbe Maß in Vertiefungen bezieht, die den Bakterienstamm und das Lösungsmittel enthalten. - Zu dieser Methode gehören Kontrollreaktionen, wobei Vertiefungen nur das Kulturmedium enthalten, das die Negativkontrolle darstellt, aber auch Vertiefungen mit Medium, das mit dem Standardstamm beimpft wurde, der dem Lösungsmittel (Ethanol oder Wasser) zugesetzt wurde, und Medium mit dem Bakterienstamm und dem Positivkontrollantibiotikum (Chloramphenicol).
6. Antioxidative Aktivität und Quantifizierung der Gesamtpolyphenole
- Gesamtgehalt an Polyphenolen
HINWEIS: Der Gesamtpolyphenolgehalt (TPC) wird mit der Folin-Ciocalteu-Methode23 berechnet und an den Mikromaßstab angepasst.- In jede Vertiefung einer lichtgeschützten 96-Well-Mikrotiterplatte werden 158 μl Reinstwasser, 2 μl der Probe und 10 μl Folin-Ciocalteu-Reagenz gegeben.
ACHTUNG: Beachten Sie das Sicherheitsdatenblatt des vom Lieferanten gelieferten Folin-Ciocalteu-Reagenz. - Nach 2 min werden 30 μl Na2CO3 (20 %) zugegeben.
- Nach 1 h Inkubation im Dunkeln bei RT werden die Proben spektrophotometrisch bei 755 nm gemessen.
- Verwenden Sie Gallussäure (mit der die Kalibrierungskurve gezeichnet werden kann) oder Reinstwasser (2 μl) als Kontrollen.
- Die Ergebnisse werden als Gallussäure-Äquivalente (mg GAE/g-Extrakt) ausgedrückt.
- In jede Vertiefung einer lichtgeschützten 96-Well-Mikrotiterplatte werden 158 μl Reinstwasser, 2 μl der Probe und 10 μl Folin-Ciocalteu-Reagenz gegeben.
- 2,2 Diphenyl-1-picrylhydrazyl (DPPH) Radikalfängeraktivität
HINWEIS: Die antioxidative Aktivität der Extrakte wird wie von Duan et al. (2006)24 beschrieben bewertet, angepasst an die Mikroskala- In eine lichtgeschützte 96-Well-Mikroplatte geben Sie 2 μl jeder Probe (in einer Konzentration von 10 mg/ml) und 198 μl DPPH, gelöst in absolutem Ethanol (0,1 mM).
ACHTUNG: Beachten Sie das vom Lieferanten gelieferte Sicherheitsdatenblatt von DPPH. - Lassen Sie die Reaktion 30 Minuten lang bei RT im Dunkeln laufen. Messen Sie die Absorption bei 517 nm in einem Mikroplatten-Spektralphotometer.
- Führen Sie eine Kontrollreaktion mit 2 μl absolutem Ethanol/destilliertem Wasser und 198 μl DPPH-Lösung durch. Führen Sie eine Blindmessung mit 2 μl Extrakt und 198 μl absolutem Ethanol durch.
- Drücken Sie die Ergebnisse als Prozentsatz der DPPH-Hemmung mit der folgenden Gleichung aus:
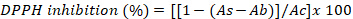
wobei As die Absorption des Algenextrakts, Ab die Absorption der Blindproben und Ac die Absorption der Kontrolle ist.
- In eine lichtgeschützte 96-Well-Mikroplatte geben Sie 2 μl jeder Probe (in einer Konzentration von 10 mg/ml) und 198 μl DPPH, gelöst in absolutem Ethanol (0,1 mM).
7. Bewertung der Zytotoxizität in Epidermiszellen
HINWEIS: Die zytotoxische Wirkung der wässrigen und Ethanolextrakte von G. gracilis in vitro wird in menschlichen Keratinozyten (HaCaT-Zellen - 300493) durch den kolorimetrischen MTT-Assay untersucht, wie zuvor beschrieben25. Die Zellen wurden von Cell Lines Services, Germany (CLS) erworben und die Methode wurde in Übereinstimmung mit den institutionellen Richtlinien und CLS-Anweisungen durchgeführt.
ACHTUNG: Siehe das vom Lieferanten gelieferte Sicherheitsdatenblatt von MTT)
- Pflege von Zellkulturen
- Kultivierung von HaCaT-Zellen in Dulbecco's Modified Eagle High Glucose Medium (DMEM), ergänzt mit 10 % fötalem Kälberserum (FBS) und 1 % antibiotischer/antimykotischer Lösung (Amphotericin B, 0,25 mM; Penicillin, 60 mM; Streptomycin, 100 mM).
- Verwenden Sie Trypsin-EDTA, um die Zellen zu dissoziieren.
HINWEIS: Die Subkultur von HaCaT-Zellen wird durchgeführt, nachdem die Zellen eine vollständige Konfluenz erreicht haben. - Die Zellen werden in einer Kammer bei 37 °C mit 5 %CO2 und 95 % Luftfeuchtigkeit kultiviert.
- Subkulturieren Sie die Zellen gemäß den Anweisungen der Biobank, wenn die Kulturen eine Konfluenz von 80 % bis 85 % erreichen.
- Bewertung der Zytotoxizität
- Nach der Aussaat der Zellen in 96-Well-Platten und der Inkubation über Nacht werden die HaCaT-Zellen (4 x 104 Zellen/Well) mit den zuvor in DMSO (100 mg/ml) gelösten getrockneten Extrakten behandelt. Dann werden 2 μl der Extraktlösung zu 198 μl Medium gegeben und die Platten 24 h lang inkubiert.
- Entfernen Sie das Kulturmedium und geben Sie 100 μl MTT (0,5 mg/ml) zu den Zellen. Inkubieren Sie die Zellen für 30 Minuten im Dunkeln bei den oben genannten normalen Kulturbedingungen.
- Entfernen Sie die MTT-Lösung und lösen Sie die intrazellulären Formazankristalle mit 100 μl DMSO auf.
- Messen Sie die Absorption bei 570 nm mit einem Mikroplatten-Reader. Drücken Sie die Ergebnisse als Prozentsatz der unbehandelten Kontrollzellen aus.
8. Innovation in der Lebensmittelindustrie
- Neues Lebensmittelprodukt: Nudeln mit Algen
- Auswahl der Zutaten und Pasta-Formulierung
HINWEIS: Die Auswahl der Zutaten wurde in Zusammenarbeit mit einer Nudelfirma getroffen. Die Auswahl der Hauptzutaten (siehe Abschnitt 8.2) erfolgte unter Berücksichtigung ihrer leichten Zugänglichkeit und Kompatibilität mit den bestehenden Produktionslinien, wobei Meeresressourcen genutzt wurden, um Nudeln mit Mehrwert zu erhalten.- Entwerfen Sie nach der Auswahl der Inhaltsstoffe die Formulierung nach dem beabsichtigten Nährwert (Quelle von Ballaststoffen, Vitaminen und Mineralstoffen, niedrig gesättigte Fette), indem Sie die theoretische chemische Zusammensetzung der Formulierungen mithilfe einer Tabelle analysieren.
- Wenn die theoretischen Voraussetzungen erfüllt sind, fahren Sie mit der Produktion im Labormaßstab fort, wie in Schritt 8.1.2 beschrieben.
- Führen Sie einen sensorischen Test mit einem halbgeschulten Panel (>10 Verkoster) durch, um die Notwendigkeit einer Neuformulierung oder die Akzeptanz der Formulierung für die folgenden Schritte zu validieren.
HINWEIS: Das Gremium wurde zuvor für die Verkostung von Nudeln geschult und bewertete die vorgestellten Rezepturen hedonisch in Bezug auf Eigenschaften wie Aroma, Geschmack, Geruch, Textur und Aussehen.
- Herstellung von Teigwaren
HINWEIS: Produzieren Sie Chifferi-Nudelproben mit einem Nudelextruder.- Mischen Sie im Gerät zuvor definierte Portionen Reismehl, G. gracilis und Chlorella vulgaris und fügen Sie der Mischung etwa 30 % Wasser hinzu.
- Um trockene Teigwaren zu erhalten, trocknen Sie Chifferi 42 Minuten lang bei 68 °C, gefolgt von 5 h und 30 Minuten bei 76 °C, wobei ein industrieller Prozess simuliert wird.
- Zum Schluss verpacken und vakuumieren Sie die Proben und lagern sie bis zur weiteren Analyse an einem dunklen Ort bei RT.
- Nährwertanalyse
HINWEIS: Für die Analyse des Nährwertprofils sind getrocknete und mazerierte Proben in dreifacher Ausführung zu verwenden.- Rohproteingehalt: Führen Sie den Gesamtprotein-Assay nach der Kjeldahl-Methode durch, die von Duarte et al. (2022) 26 übernommen wurde, und befolgen Sie die Schritte 8.1.3.2-8.1.3.6.
- 1,0 g der Probe (oder destilliertes Wasser für den Blind-Assay) genau abwiegen und mit zwei Kjeldahl-Tabletten und 25 mlH2SO4 inAufschlussröhrchen mischen.
ACHTUNG: Beachten Sie das vom Lieferanten gelieferte Sicherheitsdatenblatt von H2 SO4. - Führen Sie den Aufschluss der Proben in einem Kjeldahl-Fermenter bei 220 °C für 30 Minuten durch, gefolgt von 90 Minuten bei 400 °C.
- Nach dem Abkühlen auf RT fügt man 80 ml destilliertes Wasser hinzu und destilliert das gebildete Ammoniak zu 30 ml einer 4%igenH3BO3-Lösung, die Bromkresolgrün und Methylrot enthält. Dieser Schritt erfolgt unter alkalischen Bedingungen (Destillation mit 40% NaOH mit einem Kjeldahl-Destilliergerät).
VORSICHT: Beachten Sie das Sicherheitsdatenblatt der vom Lieferanten gelieferten H3BO3-Lösung mit Bromkresolgrün, Methylrot und 40 % NaOH. - Die destillierten Proben werden mit HCl 0,1 M titriert, bis ein Farbumschlag zu einem gräulichen Rosa beobachtet wird.
- Berechnen Sie den Rohproteingehalt, der durch den Stickstoffgehalt der Probe dargestellt wird, und drücken Sie ihn in g pro 100 g mit der folgenden Gleichung aus:
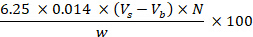
wobei Vs dem HCl-Volumen (mL) entspricht, das bei der Probentitration verwendet wird; Vb entspricht dem Volumen, das im Rohling verwendet wird; N entspricht der HCl-Normalität; w entspricht dem Probengewicht (g). - Gesamtfettgehalt: Bestimmen Sie den Gesamtfettgehalt mit der Folch-Methode, die von Folch et al. (1957)27 übernommen wurde, nach den Schritten 8.1.3.8-8.1.3.14.
- Bereiten Sie das Folch-Reagenz vor, indem Sie CHCl3 und MeOH in einem Verhältnis von 2:1 (v:v) mischen.
VORSICHT: Beachten Sie das Sicherheitsdatenblatt des vom Lieferanten gelieferten Folch-Reagenzes. - Zu Reagenzgläsern mit 1 g Aliquot Proben werden 5 ml Folch-Reagenz und 0,8 ml destilliertes Wasser hinzugefügt. 1 Min. in einem Wirbel mischen.
- Dann weitere 5 ml Folch-Reagenz hinzufügen und 5 Minuten lang homogenisieren. 1,2 ml 0,8%ige NaCl-Lösung hinzufügen und 2 Minuten lang homogenisieren.
- Die Proben werden bei 7000 x g für 10 min zentrifugiert. Die organische Phase (untere Phase) wird durch hydrophile Baumwolle und wasserfreies Natriumsulfat in einen Glaskolben mit rundem Boden filtriert.
- Um Probenverluste zu vermeiden, wiederholen Sie die Schritte der Zugabe von 5 ml CHCl3, der Homogenisierung, Zentrifugation und Filtration unter den gleichen Bedingungen.
- Das organische Lösungsmittel wird durch Niederdruckverdampfung aus den gesammelten organischen Phasen entfernt und 4 h bei 105 °C im Ofen gelassen. Kühlen Sie die Proben in einem Exsikkator ab.
- Berechnen Sie den Fettgehalt, ausgedrückt in g pro 100 g, mit der folgenden Gleichung:
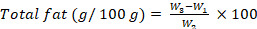
wobei W1 das Gewicht des leeren Glaskolbens mit rundem Boden ist; W2 ist das Ausgangsgewicht der Probe; W3 ist der Glaskolben mit rundem Boden und dem Probengewicht. - Rohfasergehalt: Bestimmung des Rohfasergehalts nach einer von ISO 6865 (2000) 28 übernommenen Methode gemäß den Schritten 8.1.3.16-8.1.3.22.
- 1 g der Probe (W0) wird in einen Glastiegel mit Filterboden (Referenz P2) eingewogen und in den Faseranalysator gegeben.
- Der erste Schritt ist die Säurehydrolyse: 150 ml 1,25 %H2SO4, vorgewärmt, und 2 ml Antischaummittel (n-Octanol) in die Säule jedes Tiegels geben; Bis zum Kochen erhitzen und 30 Minuten ruhen lassen.
- Nach dem Entfernen dieses Lösungsmittels dreimal mit deionisiertem Wasser waschen, um mit der basischen Hydrolyse fortzufahren. Geben Sie 150 ml 1,25 % vorgewärmtes NaOH und 5 ml Antischaummittel in die flüssigkeitsfreie Säule und führen Sie den gleichen Erhitzungsvorgang wie bei der Säurehydrolyse durch.
- Zum Schluss machen Sie eine dreifache Wäsche mit 150 ml Aceton für die Kaltextraktion.
- Nach diesem Vorgang werden die Tiegel vorsichtig aus dem System entnommen und für 1 h bei 150 °C in den Ofen gegeben. Notieren Sie das Endgewicht (W1).
- Die Tiegel werden für 3 h bei 500 °C in einen Muffelofen gestellt und anschließend das Endgewicht (W2) notiert.
- Berechnen Sie den Rohfasergehalt und drücken Sie die Ergebnisse in Prozent mit der folgenden Gleichung aus:
% Rohfaser = 100 x (W1-W2)/W0 - Fettsäureprofil (FA): Bestimmen Sie das Fettsäureprofil gemäß Fernández et al.(2015)29, indem Sie die Schritte 8.1.3.24-8.1.3.29 befolgen.
ANMERKUNG: Die Fettsäuremethylester (FAMEs) werden durch direkte säurekatalysierte Transmethylierung der gemahlenen gefriergetrockneten Proben gewonnen. Alle Analysen werden in dreifacher Ausfertigung durchgeführt. - Zu einer 50 mg Probe werden 2 ml einer 2%igenH2SO4-Lösung in Methanol gegeben und das Gemisch bei 80 °C 2 h lang unter ständigem Rühren eingegossen.
ACHTUNG: Beachten Sie das Sicherheitsdatenblatt des vom Lieferanten gelieferten Methanols. - Nach dem Abkühlen auf RT wird 1 ml Reinstwasser und 2 ml n-Heptan zu jeder Probe gegeben, das Gemisch 1 Minute lang gewirbelt und 5 Minuten lang zentrifugiert.
ACHTUNG: Beachten Sie das vom Lieferanten gelieferte Sicherheitsdatenblatt von n-Heptan. - Die obere n-Heptan-Phase (organisch), die die FAMEs enthält, wird zurückgewonnen und in Gaschromatographie-Fläschchen (GC) überführt.
- Die Analyse erfolgt in einem Gaschromatographen, der mit einer TR-FAME-Kapillarsäule (60 m × 0,25 mm ID, 0,25 μm Schichtdicke), einem Autosampler und einem Flammenionisationsdetektor (FID) ausgestattet ist.
- Stellen Sie den Injektor (Splitless-Modus) auf 250 °C und den Detektor auf 280 °C ein. Stellen Sie die Anfangstemperatur der Säule auf 75 °C ein und halten Sie sie 1 Minute lang. Dann bei 5 °C/min auf 170 °C erhöhen und 10 min halten. Dann bei 5 °C/min auf 190 °C erhöhen und weitere 10 min halten. Zum Schluss bei 2 °C/min auf 240 °C erhöhen und 10 min halten. Verwenden Sie Helium als Trägergas mit einer Durchflussrate von 1,5 ml/min. Zuluft und Wasserstoff mit Durchflussraten von 350 bzw. 35 ml/min.
- Bestimmen Sie das FA-Profil, indem Sie die resultierenden Retentionszeiten mit einem Standard vergleichen und die Ergebnisse als Prozentsatz des Gesamtfetts ausdrücken.
- Mineralelementprofil: Bestimmen Sie die mit ICP-OES analysierten Mineralelemente (Ca, P, Mg, Na, K, Fe, Cu, Mn, Zn) nach der von Pinto et al. (2022)30 adaptierten Methode und befolgen Sie die Schritte 8.1.3.31-8.1.3.34.
- Wiegen Sie etwa 0,4 g jeder trockenen Probe genau ab und fügen Sie 7,5 ml HNO3 und 2,5 ml HCl hinzu.
ACHTUNG: Beachten Sie das vom Lieferanten gelieferte Sicherheitsdatenblatt von HNO3 und HCl. - Der Aufschluss erfolgt in zwei Schritten: Die Temperatur wird in 30 Minuten von RT auf 90 °C erhöht (und weitere 30 Minuten bei dieser Temperatur gehalten), gefolgt von 60 Minuten bei 105 °C.
- Kühlen Sie die Probenlösungen ab, verdünnen Sie sie auf 25 ml, filtern Sie sie und bewahren Sie sie in beschrifteten Röhrchen auf. Führen Sie bei jedem Aufschluss den gleichen Prozess mit einem Referenzmaterial und einem Rohling durch. Ermitteln Sie die Konzentration der verschiedenen Elemente mittels ICP-OES.
- Die Ergebnisse werden in mg pro 100 g fw ausgedrückt.
- Kohlenhydratgehalt: Berechnen Sie den Kohlenhydratgehalt gemäß den Schritten 8.1.3.36-8.1.3.37.
- Berechnen Sie den Gehalt an verfügbaren Kohlenhydraten (ohne Ballaststoffe) durch die Differenz der zuvor ermittelten Faktoren pro 100 g nach der folgenden Gleichung gemäß der Ernährungs- und Landwirtschaftsorganisation der Vereinten Nationen (FAO; 2003)31

- Die Ergebnisse werden in g pro 100 g angegeben.
- Feuchtigkeits- und Aschegehalt: Schätzen Sie den Feuchtigkeits- und Aschegehalt gemäß den Schritten 8.1.3.39-8.1.3.45.
- Porzellantiegel 3 h bei 105 °C inkubieren, in einem Exsikkator abkühlen und wiegen.
- 10 g der Probe werden in den Tiegel eingewogen und 3 Stunden lang bei 105 °C in einen Trockenschrank gestellt, bis die Werte der aufeinanderfolgenden Wägungen nicht mehr als 10 mg voneinander abweichen.
- Berechnen Sie den Feuchtigkeitsgehalt, ausgedrückt in g pro 100 g fw, mit der folgenden Gleichung:
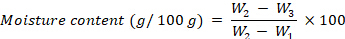
wobeiW1 das Gewicht des leeren Tiegels,W2 das Gewicht des Tiegels mit der frischen Probe und W3 das Gewicht des Tiegels mit der getrockneten Probe ist. - Nach der Feuchtigkeitsgehaltsbestimmung werden die Tiegel mit den getrockneten Proben für 4 h in eine Verbrennungsanlage bei 525 °Cgegeben.
- Wiederholen Sie diesen Vorgang, bis sich die aufeinanderfolgenden Gewichtungen nicht mehr als 1 mg unterscheiden.
- Kühlen Sie die Proben in einem Exsikkator auf RT ab und wiegen Sie sie dann.
- Der Aschegehalt, ausgedrückt in g je 100 g fw, wird nach folgender Gleichung berechnet:
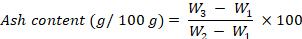
wobeiW1 das Gewicht des leeren Tiegels,W2 das Gewicht des Tiegels mit frischer Probe, W3 das Gewicht des Tiegels mit Gewicht ist. - Energiewert: Berechnen Sie den Energiewert gemäß den Schritten 8.1.3.47-8.1.3.48.
- Berechnen Sie den energetischen Wert der Proben gemäß der EU-Verordnung: Die Bereitstellung von Lebensmittelinformationen für Verbraucher (Verordnung 1169/2011)32 unter Verwendung der Gleichungen:
Energie (kcal/ 100 g) = 4 x (g Proteine) + 4 x (g Kohlenhydrate) + 9 x (g Fett) + 2 x (g Ballaststoffe)
Energie (kJ/ 100 g) = 17 x (g Proteine) + 17 x (g Kohlenhydrate) + 37 x (g Fett) + 8 x (g Ballaststoffe) - Drücken Sie die Ergebnisse in Kilokalorien pro 100 g und Kilojoule pro 100 g aus.
- Verbraucherakzeptanz
- Bewerten Sie die Verbraucherakzeptanz anhand von Nudelproben, die 8 Minuten lang in destilliertem Wasser gekocht wurden.
- Führen Sie einen Verbraucherakzeptanztest durch: Bewerten Sie das visuelle Erscheinungsbild, die Farbe, die Textur, den Geruch, den Meeresgeschmack, den Gesamtgeschmack, die Gesamtbewertung und die Kaufabsicht der Proben.
HINWEIS: Der Verbraucherakzeptanztest basiert auf hedonischen Tests, bei denen das visuelle Erscheinungsbild, die Farbe, die Textur, der Geruch, der Meeresgeschmack, der Gesamtgeschmack, die Gesamtbewertung und die Kaufabsicht auf einer Skala von 1 bis 9 bewertet werden, wobei 1 eine schlechte Bewertung und 9 eine sehr gute Bewertung ist. - Durchführung von sensorischen Tests in einzelnen sensorischen Kabinen in einem sensorischen Analyselabor (mit Temperatur- und Lichtregelung). Stellen Sie Besteck, Servietten und Glasbecher mit Mineralwasser bereit, um den Gaumen zwischen den Proben zu reinigen.
HINWEIS: Die Verkoster sind zwischen 16 und 64 Jahre alt und kommen aus allen Bereichen (n > 80).
- Auswahl der Zutaten und Pasta-Formulierung
- Joghurt
- Pigment-Extraktion
HINWEIS: Führen Sie die Pigmentextraktion mit der in Pereira et al. (2020)18 beschriebenen Methode durch.- Das Extraktionslösungsmittel, Natriumphosphatpuffer, wird mit 0,1 M Natriumphosphat dibasisch (0,03 M) und einbasischem Natriumphosphat (0,07 M) hergestellt. Stellen Sie den pH-Wert mit NaOH oder HCl auf pH 6,8 ein.
- Wiegen Sie 1 g G. gracilis ab und fügen Sie 50 ml Natriumphosphatpuffer (pH 6,8) hinzu. 10 Minuten homogenisieren, gefolgt von 10 Minuten Mazeration mit Mörser und Stößel.
- Die Lösung wird in ein Röhrchen überführt und 20 Minuten lang bei 12.298 x g (4 °C) zentrifugiert.
- Den Überstand in einem Pool zusammenfassen und langsam 65% Ammoniumsulfat hinzufügen. Wenn das gesamte Ammoniumsulfat gelöst ist, wird die Lösung mit einem Aluminiumblech bedeckt und über Nacht bei 4 °C ausgefällt.
ACHTUNG: Beachten Sie das vom Lieferanten gelieferte Sicherheitsdatenblatt von Ammoniumsulfat. - Der Niederschlag wird 20 min lang bei 12.298 x g (4 °C) zentrifugiert. Das Pellet wird zurückgewonnen und in destilliertem Wasser (ca. 5 ml) aufgelöst.
- Dialyse des Extrakts mit einer Schlauchmembran (14 kDa) gegen Wasser für 24 Stunden, gefolgt von Gefriertrocknung. Lagern Sie den gefriergetrockneten Extrakt bis zur Verwendung lichtgeschützt bei 4 °C.
- Zubereitung von Joghurt
- Bereiten Sie Naturjoghurt zu, indem Sie 1 l pasteurisierte Milch, 120 g Naturjoghurt, 20 g Zucker und 50 g Milchpulver in einem Thermomixer 5 min, 50 °C, Stufe 3, mischen.
- Die Mischung im Thermomixer-Glas bei 37 °C für 12 h in einen Inkubator geben.
- Nehmen Sie den Extrakt auf, indem Sie ihn in einer Konzentration von 0,21 % in Joghurt mischen. Lagern Sie die Proben bis zur Analyse in einzelnen Glaskolben bei 4 °C.
- Einzelne Portionen Joghurt ohne Pigment (Kontrolle) bis zur Analyse bei 4 °C lagern.
- Farbstabilität
HINWEIS: Bewerten Sie die Stabilität des Pigments in den Joghurts durch Farbanalyse für 12 Tage. Führen Sie eine Farbanalyse mit einem Reflexionskolorimeter, einem 2-Grad-Standardbeobachter und einer D65-Lichtart durch. Die Ergebnisse werden als CIELab-Koordinaten mit den Parametern L (Helligkeit, Schwarz-Weiß, 0 - 100), a* (Grün - Rot, -60 - 60) und b* (Blau - Gelb, -60 - 60) dargestellt. Parameter a* hat positive Werte für rötliche Farben und negative Werte für grünliche Farben. Parameter b* nimmt positive Werte für gelbliche Farben und negative Werte für bläuliche Farben an. L* ist der Parameter der Leuchtkraft, d. h. die Eigenschaft, nach der jede Farbe als äquivalent zu einem Element der Grauskala zwischen Schwarz und Weiß33 angesehen werden kann.- Kalibrieren Sie das Kolorimeter mit einer weißen Keramikplatte (L* 88,5, a* 0,32, b* 0,33), die vom Hersteller geliefert wird.
- Füllen Sie eine Zelle mit ca. 28 g der Probe (oder Kontrolle) und analysieren Sie die Farbe mit einer Farbdatenanalysesoftware.
HINWEIS: Die für die Farbdatenanalyse verwendete Software war die SpectraMagic NX. - Führen Sie 5 Messwerte in Proben-/Kontrolldreifachen durch.
- Sensorische Analyse
HINWEIS: Führen Sie eine sensorische Bewertung von Joghurts mit Pigmenteinarbeitung mithilfe eines Dreieckstests (ISO 4120, 2004)34 und einer hedonischen Bewertung von Farbe, Geschmack und Gesamtwertschätzung durch.- Geben Sie den Panelisten für den Dreieckstest drei Proben (eine Probe Joghurt mit Pigment und zwei Proben der Kontrolle oder zwei Proben von Joghurt mit Pigment und eine Kontrolle) und bitten Sie sie, eine andere Probe basierend auf Aroma, Textur und Geschmack auszuwählen. Stellen Sie Proben in ähnlichen Volumina zur Verfügung, die mit zufälligen 3-Zahlen-Codes gekennzeichnet sind.
- Für die hedonische Bewertung des Joghurts mit Pigment geben Sie den Panelisten eine Probe von Joghurt mit Pigment und bitten Sie sie, die Farbe, den Geschmack und die allgemeine Wertschätzung anhand einer 9-stufigen hedonischen Skala (von extremer Abneigung bis extrem mögen) zu bewerten.
- Pigment-Extraktion
Ergebnisse
Antimikrobielle Aktivität
Bei der Interpretation der erzielten Ergebnisse ist zu berücksichtigen, dass je höher der Prozentsatz der Hemmung ist, desto größer ist die Wirksamkeit des Extrakts bei der Hemmung des Wachstums dieses spezifischen Stammes und desto interessanter ist der Extrakt folglich als antimikrobielles Mittel. Durch diese Methodik können wir schnell feststellen, welche Extrakte eine größer...
Diskussion
Die antimikrobiellen Aktivitätstests in einem flüssigen Medium werden verwendet, um die Wirksamkeit antimikrobieller Substanzen gegen Mikroorganismen zu bewerten, die in einem flüssigen Medium suspendiert sind, und werden in der Regel durchgeführt, um die Fähigkeit einer Substanz zu bestimmen, das Wachstum zu hemmen oder Mikroorganismen abzutöten35,36,37,38. Sie werden verwendet, um die E...
Offenlegungen
Die Autoren haben nichts zu verraten.
Danksagungen
Diese Arbeit wurde von der portugiesischen Stiftung für Wissenschaft und Technologie (FCT) im Rahmen der strategischen Projekte unterstützt, die dem MARE-Zentrum für Meeres- und Umweltwissenschaften (UIDP/04292/2020 und UIDB/04292/2020) und dem assoziierten Labor ARNET (LA/P/0069/2020) gewährt wurden. FCT finanzierte auch die individuellen Promotionsstipendien für Marta V. Freitas (UI/BD/150957/2021) und Tatiana Pereira (2021). 07791. BD). Diese Arbeit wurde auch durch das Projekt HP4A - GESUNDE PASTA FÜR ALLE (Co-Promotion Nr. 039952) finanziell unterstützt, das vom EFRE - Europäischer Fonds für regionale Entwicklung im Rahmen des Programms Portugal 2020 im Rahmen des operationellen Programms COMPETE 2020 - Wettbewerbsfähigkeit und Internationalisierung kofinanziert wird.
Materialien
| Name | Company | Catalog Number | Comments |
| Absolute Ethanol | Aga, Portugal | 64-17-5 | |
| Ammonium Chloride | PanReac | 12125-02-9 | |
| Amphotericin B | Sigma-Aldrich | 1397-89-3 | |
| Analytical scale balance | Sartorius, TE124S | 22105307 | |
| Bacillus subtilis subsp. spizizenii | German Collection of Microorganisms and Cell Cultures (DSMZ) | DSM 347 | |
| Biotin | Panreac AppliChem | 58-85-5 | |
| Centrifuge | Eppendorf, 5810R | 5811JH490481 | |
| Chloramphenicol | PanReac | 56-75-7 | |
| CO2 Chamber | Memmert | N/A | |
| Cool White Fluorescent Lamps | OSRAM Lumilux Skywhite | N/A | |
| Densitometer McFarland | Grant Instruments | N/A | |
| DMEM medium | Sigma-Aldrich | D5796 | |
| DMSO | Sigma-Aldrich | 67-68-5 | |
| DPPH | Sigma, Steinheim, Germany | 1898-66-4 | |
| Escherichia coli (DSM 5922) | German Collection of Microorganisms and Cell Cultures (DSMZ) | DSM5922 | |
| Ethanol 96% | AGA-Portugal | 64-17-5 | |
| Ethylenediaminetetraacetic Acid Disodium Salt Dihydrate (Na2EDTA) | J.T.Baker | 6381-92-6 | |
| Fetal Bovine Serum (FBS) | Sigma-Aldrich | F7524 | |
| Filter Paper (Whatman No.1) | Whatman | WHA1001320 | |
| Flasks | VWR International, Alcabideche, Portugal | N/A | |
| Folin-Ciocalteu | VWR Chemicals | 31360.264 | |
| Gallic Acid | Merck | 149-91-7 | |
| Germanium (IV) Oxide, 99.999% | AlfaAesar | 1310-53-8 | |
| HaCaT cells – 300493 | CLS-Cell Lines Services, Germany | 300493 | |
| Hot Plate Magnetic Stirrer | IKA, C-MAG HS7 | 06.090564 | |
| Iron Sulfate | VWR Chemicals | 10124-49-9 | |
| Laminar flow hood | TelStar, Portugal | 526013 | |
| LB Medium | VWR Chemicals | J106 | |
| Listonella anguillarum | German Collection of Microorganisms and Cell Cultures (DSMZ) | DSM 21597 | |
| Manganese Chloride | VWR Chemicals | 7773.01.5 | |
| Micropipettes | Eppendorf, Portugal | N/A | |
| Microplates | VWR International, Alcabideche, Portugal | 10861-666 | |
| Microplates | Greiner | 738-0168 | |
| Microplates (sterile) | Fisher Scientific | 10022403 | |
| Microplate reader | Epoch Microplate Spectrophotometer, BioTek, Vermont, USA | 1611151E | |
| MTT | Sigma-Aldrich | 289-93-1 | |
| Muller-Hinton Broth (MHB) | VWR Chemicals | 90004-658 | |
| Oven | Binder, FD115 | 12-04490 | |
| Oven | Binder, BD115 | 04-62615 | |
| Penicillin | Sigma-Aldrich | 1406-05-9 | |
| pH meter Inolab | VWR International, Alcabideche, Portugal | 15212099 | |
| Pippete tips | Eppendorf, Portugal | 5412307 | |
| Pyrex Bottles Media Storage | VWR International, Alcabideche, Portugal | 16157-169 | |
| Rotary Evaporator | Heidolph, Laborota 4000 | 80409287 | |
| Rotavapor | IKA HB10, VWR International, Alcabideche, Portugal | 07.524254 | |
| Sodium Carbonate (Na2CO3) | Chem-Lab | 497-19-8 | |
| Sodium Chloride (NaCl) | Normax Chem | 7647-14-5 | |
| Sodium Phosphate Dibasic | Riedel-de Haën | 7558-79-4 | |
| SpectraMagic NX | Konica Minolta, Japan | color data analysis software | |
| Spectrophotometer | Evolution 201, Thermo Scientific, Madison, WI, USA | 5A4T092004 | |
| Streptomycin | Sigma-Aldrich | 57-92-1 | |
| Thiamine | Panreac AppliChem | 59-43-8 | |
| Trypsin-EDTA | Sigma-Aldrich | T4049 | |
| Tryptic Soy Agar (TSA) | VWR Chemicals | ICNA091010617 | |
| Tryptic Soy Broth (TSB) | VWR Chemicals | 22091 | |
| Ultrapure water | Advantage A10 Milli-Q lab, Merck, Darmstadt, Germany | F5HA17360B | |
| Vacuum pump | Buchi, Switzerland | FIS05-402-103 | |
| Vitamin B12 | Merck | 68-19-9 |
Referenzen
- Charoensiddhi, S., Abraham, R. E., Su, P., Zhang, W. Seaweed and seaweed-derived metabolites as prebiotics. Advances in Food and Nutrition Research. 91, 97-156 (2020).
- Roohinejad, S., Koubaa, M., Barba, F. J., Saljoughian, S., Amid, M., Greiner, R. Application of seaweeds to develop new food products with enhanced shelf-life, quality, and health-related beneficial properties. Food Research International. 99, 1066-1083 (2017).
- Hurd, C. L., Harrison, P. J., Bischof, K., Lobban, C. S. . Seaweed Ecology and Physiology. (second). , (2014).
- Freitas, M. V., Mouga, T., Correia, A. P., Afonso, C., Baptista, T. New insights on the sporulation, germination, and nutritional profile of Gracilaria gracilis (Rhodophyta) grown under controlled conditions. Journal of Marine Science and Engineering. 9 (6), 562 (2021).
- Friedlander, M. Advances in cultivation of Gelidiales. Journal of Applied Phycology. 20 (5), 451-456 (2008).
- Matos, G. S., Pereira, S. G., Genisheva, Z. A., Gomes, A. M., Teixeira, J. A., Rocha, C. M. R. Advances in extraction methods to recover added-value compounds from seaweeds: Sustainability and functionality. Foods. 10, 516 (2021).
- Ummat, V., Sivagnanam, S. P., Rajauria, G., O'Donnell, C., Tiwari, B. K. Advances in pre-treatment techniques and green extraction technologies for bioactives from seaweeds. Trends in Food Science & Technology. 110, 90-106 (2021).
- Pérez, M. J., Falqué, E., Domínguez, H., Ravishankar, G., Ambati, R. R. Seaweed Antimicrobials, Present Status and Future Perspectives. Handbook of Algal Technologies andPhytochemicals:Volume I Food, Health and Nutraceutical Applications. , (2019).
- Cavallo, R. A., Acquaviva, M. I., Stabili, L., Cecere, E., Petrocelli, A., Narracci, M. Antibacterial activity of marine macroalgae against fish pathogenic Vibrio species. Central European Journal of Biology. 8, 646-653 (2013).
- Shannon, E., Abu-Ghannam, N. Antibacterial derivatives of marine algae: An overview of pharmacological mechanisms and applications. Marine Drugs. 14 (4), 81 (2016).
- Capillo, G., et al. New insights into the culture method and antibacterial potential of Gracilaria gracilis. Marine Drugs. 16 (12), 492 (2018).
- Francavilla, M., Franchi, M., Monteleone, M., Caroppo, C. The red seaweed Gracilaria gracilis as a multi products source. Marine Drugs. 11 (10), 3754-3776 (2013).
- Sánchez-Ayora, H., Pérez-Jiménez, J., Pérez-Correa, J. R., Mateos, R., Domínguez, R. Antioxidant Capacity of Seaweeds: In Vitro and In Vivo Assessment. Marine Phenolic Compounds. , 299-341 (2023).
- Anil, S., Sweety, V. K., Vikas, B., Betsy-Joseph, B. . Cytotoxicity and Cell Viability Assessment of Biomaterials. Cytotoxicity. , 111822 (2023).
- Mosmann, T. Rapid colorimetric assay for cellular growth and survival: Application to proliferation and cytotoxicity assays. Journal of Immunological Methods. 65 (1-2), 55-63 (1983).
- Roleda, M. Y., et al. Variations in polyphenol and heavy metal contents of wild-harvested and cultivated seaweed bulk biomass: Health risk assessment and implication for food applications. Food Control. 95, 121-134 (2019).
- Souza, K. D., et al. Gastronomy and the development of new food products: Technological prospection. International Journal of Gastronomy and Food Science. 33, 100769 (2023).
- Pereira, T., et al. Optimization of phycobiliprotein pigments extraction from red algae Gracilaria gracilis for substitution of synthetic food colorants. Food Chemistry. 321, 126688 (2020).
- Redmond, S., Green, L., Yarish, C., Kim, J., Neefus, C., Redmond, S., Green, L., Yarish, C., Kim, J., Neefus, C. . New England Seaweed Culture Handbook-Nursery Systems. , (2014).
- Yong, Y. S., Yong, W. T. L., Anton, A. Analysis of formulae for determination of seaweed growth rate. Journal of Applied Phycology. 25 (6), 1831-1834 (2013).
- Patarra, R. F., Carreiro, A. S., Lloveras, A. A., Abreu, M. H., Buschmann, A. H., Neto, A. I. Effects of light, temperature and stocking density on Halopteris scoparia growth. Journal of Applied Phycology. 29 (1), 405-411 (2017).
- NCCLS, National Committee for Clinical Laboratory Standards, Clinical and Laboratory Standards Institute. . Performance Standards for Antimicrobial Disk Susceptibility Tests: Approved Standard. 32, M02-M11 (2012).
- Singleton, V. L., Rossi, J. A. J. Colorimetry to total phenolics with phosphomolybdic acid reagents. American Journal of Enology and Viticulture. 16, 144-158 (1965).
- Duan, X. J., Zhang, W. W., Li, X. M., Wang, B. G. Evaluation of antioxidant property of extract and fractions obtained from a red alga, Polysiphonia urceolata. Food Chemistry. 95 (1), 37-43 (2006).
- Freitas, R., et al. Highlighting the biological potential of the brown seaweed Fucus spiralis for skin applications. Antioxidants. 9 (7), 611 (2020).
- Duarte, A., et al. Seasonal study of the nutritional composition of unexploited and low commercial value fish species from the Portuguese coast. Food Science and Nutrition. 10 (10), 3368-3379 (2020).
- Folch, J., Lees, M., Stanley, G. A simple method for the isolation and purification of total lipides from animal tissues. Journal of Biological Chemistry. 226 (1), 497-509 (1957).
- ISO 6865. Animal feeding stuffs - Determination of crude fibre content - Method with intermediate filtration. Bureau of Indian Standards (BIS). , (2000).
- Fernández, A., Grienke, U., Soler-Vila, A., Guihéneuf, F., Stengel, D. B., Tasdemir, D. Seasonal and geographical variations in the biochemical composition of the blue mussel (Mytilus edulis L.) from Ireland. Food Chemistry. 177, 43-52 (2015).
- Pinto, F., et al. Annual variations in the mineral element content of five fish species from the Portuguese coast. Food Research International. 158, 111482 (2022).
- Food energy - methods of analysis and conversion factors. Available from: https://www.fao.org/fileadmin/templates/food_composition/documents/book_abstracts/Food_energy.pdf (2003)
- . 1169/2011 of the European Parliament and of the Council of 25 -10-2011 Available from: https://eur-lex.europa.eu/legal-content/EN/ALL/?uri=CELEX%3A32011R1169 (2011)
- Pathare, P. B., Opara, U. L., Al-Said, F. A. J. Colour measurement and analysis in fresh and processed foods: A review. Food and Bioprocess Technology. 6 (1), 36-60 (2013).
- ISO 4120. Sensory analysis - Methodology - Triangle test. International Standard. , (2004).
- Reller, L. B., Weinstein, M., Jorgensen, J. H., Ferraro, M. J. Antimicrobial susceptibility testing: A review of general principles and contemporary practices. Clinical Infectious Diseases. 49 (11), 1749-1755 (2009).
- Balouiri, M., Sadiki, M., Ibnsouda, S. K. Methods for in vitro evaluating antimicrobial activity: A review. Journal of Pharmaceutical Analysis. 6 (2), 71-79 (2016).
- Gajic, I., et al. Antimicrobial susceptibility testing: A comprehensive review of currently used methods. Antibiotics. 11 (4), 427 (2022).
- Gonzalez-Pastor, R., et al. Current landscape of methods to evaluate antimicrobial activity of natural extracts. Molecules. 28 (3), 1068 (2023).
- Li, J., et al. Antimicrobial activity and resistance: Influencing factors. Frontiers in Pharmacology. 13 (8), 364 (2017).
- Silva, A., et al. Macroalgae as a source of valuable antimicrobial compounds: Extraction and applications. Antibiotics. 9 (10), 642 (2020).
- Munteanu, I. G., Apetrei, C. Analytical methods used in determining antioxidant activity: A review. International Journal of Molecular Sciences. 22 (7), 3380 (2021).
- Ma, S., et al. Comparison of common analytical methods for the quantification of total polyphenols and flavanols in fruit juices and ciders. Journal of Food Science. 84 (8), 2147-2158 (2019).
- Tziveleka, L. A., Tammam, M. A., Tzakou, O., Roussis, V., Ioannou, E. Metabolites with antioxidant activity from marine macroalgae. Antioxidants. 10 (9), 1431 (2021).
- Ghasemi, M., Turnbull, T., Sebastian, S., Kempson, I. The MTT assay: Utility, limitations, pitfalls, and interpretation in bulk and single-cell analysis. International Journal of Molecular Sciences. 22 (23), 12827 (2021).
- Pereira, T., Barroso, S., Mendes, S., Gil, M. M. Stability, kinetics, and application study of phycobiliprotein pigments extracted from red algae Gracilaria gracilis. Journal of Food Science. 85 (10), 3400-3405 (2020).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten