Se requiere una suscripción a JoVE para ver este contenido. Inicie sesión o comience su prueba gratuita.
Methods Article
Valorización del alga roja Gracilaria gracilis a través de un enfoque de biorrefinería
En este artículo
Resumen
Aquí, describimos varios protocolos que apuntan a una valorización integrada de Gracilaria gracilis: recolección de especies silvestres, crecimiento interno y extracción de ingredientes bioactivos. Se evalúan los efectos antioxidantes, antimicrobianos y citotóxicos de los extractos, junto con la evaluación nutricional y de estabilidad de los alimentos enriquecidos con biomasa y pigmentos de algas marinas enteras.
Resumen
El interés por las algas marinas como materia prima abundante para obtener ingredientes bioactivos valiosos y multiobjetivo está en continuo crecimiento. En este trabajo, exploramos el potencial de Gracilaria gracilis, un alga roja comestible cultivada en todo el mundo por su interés comercial como fuente de agar y otros ingredientes para aplicaciones cosméticas, farmacológicas, alimentarias y de piensos.
Las condiciones de crecimiento de G. gracilis se optimizaron a través de la propagación vegetativa y la esporulación, mientras se manipulaban las condiciones fisicoquímicas para lograr un gran stock de biomasa. Se realizaron metodologías de extracción verde con etanol y agua sobre la biomasa de algas. El potencial bioactivo de los extractos se evaluó a través de un conjunto de ensayos in vitro sobre sus propiedades citotóxicas, antioxidantes y antimicrobianas. Además, se incorporó biomasa seca de algas marinas en las formulaciones de pasta para aumentar el valor nutricional de los alimentos. Los pigmentos extraídos de G. gracilis también se han incorporado al yogur como colorante natural, y se evaluó su estabilidad. Ambos productos fueron sometidos a la apreciación de un panel sensorial semi-entrenado con el objetivo de lograr la mejor formulación final antes de llegar al mercado.
Los resultados respaldan la versatilidad de G. gracilis ya sea que se aplique como biomasa completa, extractos y/o pigmentos. A través de la implementación de varios protocolos optimizados, este trabajo permite el desarrollo de productos con potencial para beneficiar a los mercados de alimentos, cosméticos y acuicultura, promoviendo la sostenibilidad ambiental y una economía circular azul.
Además, y en línea con un enfoque de biorrefinería, la biomasa residual de algas marinas se utilizará como bioestimulante para el crecimiento de las plantas o se convertirá en materiales de carbono que se utilizarán en la purificación del agua de los sistemas acuícolas internos del MARE-Polytechnic de Leiria, Portugal.
Introducción
Las algas marinas pueden considerarse como una materia prima natural interesante para ser aprovechada por los sectores farmacéutico, alimentario, de piensos y medioambiental. Biosintetizan una panoplia de moléculas, muchas de las cuales no se encuentran en los organismos terrestres, con propiedades biológicas relevantes 1,2. Sin embargo, es necesario implementar protocolos de cultivo optimizados para algas marinas para garantizar un gran stock de biomasa.
Los métodos de cultivo siempre deben tener en cuenta la naturaleza de las algas marinas, los talos y la morfología general. Gracilaria gracilis es un taxón clonal, lo que significa que el órgano de unión produce múltiples ejes vegetativos. De este modo, se consigue la propagación por fragmentación (reproducción vegetativa), ya que cada uno de estos ejes es plenamente capaz de adoptar una vida independiente del talo principal3. Los taxones clonales pueden integrarse con éxito con metodologías de cultivo sencillas y rápidas de un solo paso, ya que se obtienen grandes cantidades de biomasa dividiendo el talo en pequeños fragmentos que se regeneran rápidamente y crecen en nuevos individuos genéticamente idénticos. En este proceso se pueden utilizar tanto talos haplónicos como diplónicos. Aunque el género exhibe un ciclo de vida trifásico isomorfo haplo-diplónico complejo, la esporulación rara vez es necesaria, excepto cuando se requiere la renovación genética de las cepas para lograr cultivos mejorados. En este caso, tanto las tetrasporas (esporas haplónicas formadas por meiosis) como las carposporas (esporas diplónicas formadas por mitosis) dan lugar a talos macroscópicos que luego pueden crecer y propagarse por reproducción vegetativa4. Los ciclos de crecimiento están dictados por las condiciones ambientales y el estado fisiológico de los individuos, entre otros factores biológicos como la aparición de epífitas y la adhesión de otros organismos. Por lo tanto, optimizar las condiciones de cultivo es crucial para garantizar una alta productividad y producir biomasa de buena calidad5.
La extracción de compuestos bioactivos de algas marinas, incluyendo G. gracilis, puede lograrse a través de varios métodos 6,7. La elección del método de extracción depende de los compuestos específicos de interés, la aplicación objetivo y las características de las algas marinas. En este estudio, nos centramos en la extracción con disolventes, que implica el uso de disolventes verdes, como el agua o el etanol, para disolver y extraer compuestos bioactivos de la biomasa de algas. La extracción se puede realizar mediante maceración de forma versátil y eficaz y se puede utilizar para una amplia gama de compuestos. Es un método simple y ampliamente utilizado que consiste en remojar la biomasa en un solvente durante un período prolongado, generalmente a temperatura ambiente o ligeramente elevada. El disolvente se agita para mejorar el proceso de extracción. Después del tiempo de extracción deseado, el solvente se separa del material sólido por filtración o centrifugación.
El agua es un disolvente de uso común en aplicaciones alimentarias debido a su seguridad, disponibilidad y compatibilidad con una amplia gama de productos alimenticios. La extracción de agua es adecuada para compuestos polares como polisacáridos, péptidos y ciertos fenólicos. Sin embargo, es posible que no extraiga eficazmente compuestos no polares. El etanol también es un disolvente ampliamente utilizado en aplicaciones alimentarias y puede ser eficaz para extraer una variedad de moléculas bioactivas, incluidos compuestos fenólicos, flavonoides y ciertos pigmentos. El etanol es generalmente reconocido como seguro para su uso en alimentos y puede evaporarse fácilmente, dejando atrás los compuestos extraídos. Vale la pena señalar que la elección del método de extracción debe considerar factores como la eficiencia, la selectividad, la rentabilidad y el impacto ambiental. La optimización de los parámetros de extracción, como la concentración de disolventes, el tiempo de extracción, la temperatura y la presión, es crucial para lograr rendimientos óptimos de compuestos bioactivos de G. gracilis u otras algas marinas.
Se ha descubierto que las algas marinas exhiben actividad antimicrobiana contra una amplia gama de microorganismos, incluidas bacterias, hongos y virus8. Esta actividad se atribuye a componentes bioactivos, incluidos fenólicos, polisacáridos, péptidos y ácidos grasos. Diversos estudios han demostrado su eficacia frente a patógenos como Escherichia coli, Staphylococcus aureus, Salmonella sp. y Pseudomonas aeruginosa, entre otros9. La actividad antimicrobiana de las algas marinas se atribuye a la presencia de compuestos bioactivos que pueden interferir con las paredes celulares microbianas, las membranas, las enzimas y las vías de señalización10. Estos compuestos pueden interrumpir el crecimiento microbiano, inhibir la formación de biopelículas y modular las respuestas inmunitarias.
Las algas rojas, también conocidas como rodófitas, son un grupo de algas que pueden exhibir actividad antimicrobiana contra una variedad de microorganismos. Dentro de este grupo, G. gracilis contiene varios compuestos bioactivos que pueden contribuir a su actividad antimicrobiana reportada. Si bien las moléculas específicas pueden variar, las clases comunes que se han reportado en G. gracilis y que pueden poseer propiedades antimicrobianas son los polisacáridos, los fenólicos, los terpenoides y los pigmentos11. Sin embargo, es importante tener en cuenta que la presencia y las cantidades de estos componentes pueden variar dependiendo de factores como la ubicación de la recolección de algas, la estacionalidad, la condición fisiológica de los talos y las condiciones ambientales. Por lo tanto, la clase específica y la concentración de compuestos antimicrobianos en G. gracilis pueden variar en consecuencia.
También se ha descubierto que G. gracilis tiene propiedades antioxidantes, ya que contiene varios compuestos fenólicos, que se ha demostrado que eliminan los radicales libres y reducenel estrés oxidativo.Los antioxidantes ayudan a proteger las células del daño causado por las especies reactivas de oxígeno y tienen beneficios potenciales para la salud. La capacidad antioxidante puede ser evaluada directamente a través de diferentes métodos, incluyendo la actividad de eliminación de radicales libres de 2,2-difenil-1-picrilhidrazilo (DPPH) e, indirectamente, a través de la cuantificación del contenido polifenólico total (TPC)13.
A pesar de que se informa que un ingrediente tiene una bioactividad prominente, su evaluación de citotoxicidad es indispensable para evaluar sustancias naturales y sintéticas que se utilizarán en contacto con células o tejidos vivos. Existen varios métodos para medir la citotoxicidad, cada uno con ventajas y limitaciones. En general, ofrecen una gama de opciones para evaluar los efectos nocivos de muchas sustancias en las células y, al mismo tiempo, para investigar los mecanismos de daño y muerte celular14.
En este trabajo se utiliza el ensayo de bromuro de 3-(4,5-dimetiltiazol-2-il)-2,5-difeniltetrazolio (MTT), método colorimétrico introducido por Mosmann (1983)15. Este método mide la reducción de las sales de tetrazolio a un producto de formazano púrpura por parte de células metabólicamente activas. Cuanto mayor es la cantidad de cristales de formazano, mayor es el número de células viables, proporcionando así una medida indirecta de citotoxicidad14. Dado que en este trabajo, los extractos de agua y etanol de G. gracilis están destinados a ser incorporados en formulaciones dermocosméticas, la evaluación de citotoxicidad in vitro se realiza en una línea celular de queratinocitos (HaCaT).
En cuanto a la aplicación alimentaria, las algas marinas son generalmente bajas en calorías y nutricionalmente ricas en fibras dietéticas, elementos esenciales y aminoácidos, polisacáridos, ácidos grasos poliinsaturados, polifenoles y vitaminas 2,16. G. gracilis no es una excepción, ya que tiene un valor nutricional interesante. Freitas et al. (2021)4 encontraron que G. gracilis cultivada tenía niveles más altos de proteína y vitamina C y mantenía el nivel de lípidos totales en comparación con las algas silvestres. Esto puede representar una ventaja económica y ambiental, ya que nutricionalmente hablando, la producción es preferible a la explotación de recursos silvestres. Además, los consumidores están cada vez más preocupados por el tipo de alimentos que consumen, por lo que es importante introducir nuevos ingredientes para el enriquecimiento de los alimentos y utilizar nuevos recursos para obtener extractos que puedan agregar valor a un producto y reclamar una "etiqueta limpia". Además, el mercado actual es muy competitivo, lo que requiere el desarrollo de nuevos productos y estrategias innovadoras para diferenciar a los fabricantes de sus competidores17.
El enriquecimiento de productos con escaso valor nutricional, como la pasta, con recursos marinos, incluidas las algas marinas, es una estrategia para introducir este recurso como un nuevo alimento y una estrategia de diferenciación en el mercado a través de un producto con un valor nutricional diferenciado. Por otro lado, G. gracilis es una fuente de pigmentos rojos naturales como las ficobiliproteínas18, con un alto potencial de aplicaciones en la industria alimentaria. Esta alga ha mostrado un gran interés en varias zonas, y su aplicación se puede realizar utilizando las algas enteras, extractos y/o la biomasa restante. En este trabajo, mostramos algunos ejemplos de tales aplicaciones.
Protocolo
1. Recolección y preparación de biomasa
- Coseche los especímenes de G. gracilis durante la marea baja y transpórtelos rápidamente al laboratorio en cajas oscuras y refrigeradas para evitar el secado, la luz y la exposición al aire.
- En el laboratorio, lave cada talo con agua corriente de mar y limpie a fondo para eliminar los desechos, las partes necróticas, las epífitas y otros organismos de la superficie.
- Mantener la biomasa silvestre en agua de mar constantemente aireada (31-35 psu) en una sala climática (20 ± 1 °C) con baja irradiancia proporcionada por la luz del día, lámparas blancas frías y fluorescentes y fotoperiodo fijado a las 16:08 (claro: oscuro) durante 7 días. Durante este período, no suministre ningún medio nutritivo; Esto permite que las algas se adapten lentamente a las nuevas condiciones interiores.
2. Mantenimiento de existencias
- Después del período de aclimatación, corte puntas sanas de talos de algas marinas con una cuchilla estéril. Siguiendo a Redmond et al. (2014)19 y en condiciones estériles, se debe arrastrar cada punta a través de un gel de agar previamente preparado en placas de Petri (agar bacteriológico al 1,0%, en una proporción de agua destilada/agua de mar de 1:1) para eliminar cualquier resto de contaminantes. Realice el arrastre de agar tres veces para cada punta y siempre arrastre la punta a través de las partes no utilizadas del gel de agar.
- Lave con ácido la cristalería en una solución de ácido clorhídrico (HCl, 15%) y enjuague bien con agua destilada. Esterilizar todas las herramientas, cristalería, agar, agua de mar y agua destilada utilizadas en el proceso de limpieza en autoclave (121 °C, 15 min).
PRECAUCIÓN: Consulte la ficha de datos de seguridad de HCl entregada por el proveedor. - Las puntas crecen en agua de mar esterilizada a 35 psu, suplementada con solución enriquecida de Von Stosch (VSE) modificada para algas rojas, según Redmond et al. (2014)19. Agregue dióxido de germanio (GeO2) al medio (1 mL/L) para evitar el crecimiento de diatomeas epífitas.
PRECAUCIÓN: Consulte la ficha de datos de seguridad de GeO2 entregada por el proveedor.
NOTA: Las puntas que muestran pérdida de pigmentación, como se observa por decoloración parcial o total, están bajo estrés o ya están muertas y deben desecharse.
3. Cultivo y escalado
- Después del período de aclimatación, distribuir aleatoriamente unas 8-10 puntas sanas en matraces de fondo plano de 250 ml en una sala climática a 20 ± 1 °C con la luz blanca fría de 20 ± 0,5 μmol fotones m-2 s-1 (1500 lux), un fotoperiodo fijado a 16 h: 8 h (claro: oscuro) y agua de mar estéril enriquecida con medios de cultivo VSE renovados cada semana.
- Realizar mediciones de peso semanales, evitando forzar excesivamente los talos20. Para ello, retire con cuidado las puntas del medio de cultivo, enjuague suavemente y pese los miligramos en una báscula de laboratorio.
NOTA: Este procedimiento se puede realizar junto con la renovación semanal de los medios de cultivo. - Los talos pueden crecer en estos matraces hasta una densidad de 2 g/L. En este punto, realice un escalado del receptor (250 ml, 1 l y 5 l). Transfiera el cultivo a contenedores blancos abiertos al aire libre de 50 L y más grandes cuando el volumen alcance los 5 L.
- Calcular la tasa de crecimiento relativo (RGR) según Patarra et al. (2017)21 :
RGR (% fw/día) = ([Ln (fw) - Ln (iw)]/t) x 100
donde iw y fw son el peso fresco inicial y final, respectivamente, expresados en gramos, y t es el tiempo en días.
NOTA: Bajo esta configuración de laboratorio, la RGR alcanza valores de hasta 21% por día. La recolección de biomasa se puede realizar en cualquier momento. La biomasa debe procesarse rápidamente para evitar su degradación, ya sea mediante secado al horno, liofilización o simplemente almacenado congelado (-20 °C), según el uso previsto. La biomasa seca puede conservarse a temperatura ambiente (RT) o almacenarse congelada.
4. Procedimiento de extracción
NOTA: Para evaluar la citotoxicidad in vitro , las propiedades antioxidantes y antimicrobianas de los extractos de G. gracils , su preparación considera dos parámetros diferentes: la temperatura de extracción y el tipo de solvente.
- Para llevar a cabo las extracciones, seque la biomasa de G. gracilis en horno y muela la biomasa (por ejemplo, en un molinillo de café doméstico) hasta que el polvo pase a través de un tamiz de 200 μm.
- Pesar la biomasa seca (10 g) y disolverla en 100 mL de disolvente (etanol absoluto o agua estéril).
- Revuelva en un recipiente protegido de la luz durante 30 min.
- Realice extracciones secuenciales de etanol > agua y agua > etanol a RT, 40 °C y 70 °C.
- Para cada temperatura, realice las extracciones con etanol y agua por separado dos veces.
- Separar los extractos líquidos de la biomasa restante mediante filtración a través de papel de filtro (Whatman No.1), seguido de centrifugación a 8000 x g durante 10 min a RT.
- Reutilice la biomasa de algas restante para su posterior extracción con el otro disolvente. Si una muestra se extrajo primero con etanol, extráigala con agua a continuación, y viceversa.
- Liofilizar los extractos acuosos y evaporar los extractos de etanol en un evaporador rotativo a 40 °C.
- Conservar los extractos secos a 4 °C.
- Disolver los extractos a una concentración de 50 mg/ml (ensayos antimicrobianos) o 10 mg/ml (ensayos antioxidantes). Disolver los extractos acuosos en agua estéril y los extractos etanólicos en etanol absoluto.
5. Actividad antimicrobiana
NOTA: Los extractos etanólicos y acuosos deben probarse individualmente contra Bacillus subtilis subsp . spizizenii (DSM 347), Escherichia coli (DSM 5922) y Listonella anguillarum (DSM 21597). Las pruebas antimicrobianas deben realizarse de acuerdo con las recomendaciones del Comité Nacional de Estándares de Laboratorio Clínico (NCCLS, 2012)22. Todos los cultivos se obtuvieron de la Colección Alemana de Microorganismos y Cultivos Celulares (DSMZ). L. anguillarum se cultivó en caldo de soja tríptico (TSB) o agar de soja tríptico (TSA) suplementado con cloruro de sodio (NaCl) al 1%. Las dos cepas restantes se cultivaron en medio LB (VWR Chemicals). Spizizenii (DSM 347) y Listonella anguillarum (DSM 21597) se incubaron a 30 °C, mientras que Escherichia coli (DSM 5922) se incubó a 37 °C, de acuerdo con las instrucciones del proveedor. El método de microdilución en caldo se puede utilizar para la determinación de la actividad antimicrobiana en un medio líquido, y esto debe llevarse a cabo a microescala, lo que permite determinar el potencial antimicrobiano de manera rápida y eficiente. Este método de bajo coste permite obtener resultados en tan solo 24 h, siendo por tanto adecuado para determinar, en una fase temprana, las mejores condiciones de extracción que permitan, para una determinada cepa microbiana, obtener resultados en términos de acción inhibidora del crecimiento. Sin embargo, la metodología requiere el uso de microplacas estériles con una tapa específica para el crecimiento microbiano, así como la disponibilidad de un lector de microplacas para la longitud de onda de 600 nm.
- Realizar las pruebas de microdilución del caldo utilizando microplacas de 96 pocillos no tratadas y de fondo redondo con 170 μL de Caldo Muller-Hinton (MHB), inoculado con 10 μL de inóculo estandarizado (a 0,5 estándar de McFarland) y 20 μL de cada extracto (50 mg/mL).
- Incubar las placas durante 24 h a la temperatura óptima para cada cepa.
- Detectar la actividad antimicrobiana mediante la reducción de la turbidez visible medida mediante el registro de la densidad óptica (OD 600) en un espectrofotómetro de microplacas, a 0 h y 24 h.
- Exprese los resultados como un porcentaje de inhibición:
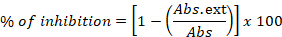
donde Abs. ext es la diferencia en la absorbancia medida, entre 0 h y 24 h, en los pocillos que contienen cepa bacteriana que crece en presencia del extracto, y Abs se refiere a la misma medida en pocillos que contienen la cepa bacteriana y el disolvente. - En este método, se incluyen las reacciones de control, con pocillos que contienen solo el medio de cultivo que será el control negativo, pero también pocillos con medio inoculado con la cepa estándar agregada al solvente (etanol o agua) y el medio con la cepa bacteriana y el antibiótico de control positivo (cloranfenicol).
6. Actividad antioxidante y cuantificación de polifenoles totales
- Contenido polifenólico total
NOTA: El contenido polifenólico total (CTP) se realiza mediante el método Folin-Ciocalteu23 y se adapta a microescala.- Añadir a cada pocillo de una microplaca de 96 pocillos, protegida de la luz, 158 μL de agua ultrapura, 2 μL de la muestra y 10 μL de reactivo Folin-Ciocalteu.
PRECAUCIÓN: Consulte la ficha de datos de seguridad del reactivo Folin-Ciocalteu entregada por el proveedor. - Después de 2 min, añadir 30 μL deNa2CO3 (20%).
- Después de la incubación en la oscuridad a RT durante 1 h, mida las muestras espectrofotométricamente a 755 nm.
- Utilice ácido gálico (que permite trazar la curva de calibración) o agua ultrapura (2 μL) como controles.
- Exprese los resultados como equivalentes de ácido gálico (mg GAE/g de extracto).
- Añadir a cada pocillo de una microplaca de 96 pocillos, protegida de la luz, 158 μL de agua ultrapura, 2 μL de la muestra y 10 μL de reactivo Folin-Ciocalteu.
- Actividad eliminatoria de radicales de 2,2 difenil-1-picrilhidrazilo (DPPH)
NOTA: La actividad antioxidante de los extractos se evalúa según lo descrito por Duan et al. (2006)24, adaptado a microescala- En una microplaca de 96 pocillos protegida de la luz, colocar 2 μL de cada muestra (a una concentración de 10 mg/mL) y 198 μL de DPPH disueltos en etanol absoluto (0,1 mM).
PRECAUCIÓN: Consulte la ficha de datos de seguridad de DPPH entregada por el proveedor. - Ejecute la reacción durante 30 minutos en RT en la oscuridad. Mida la absorbancia a 517 nm en un espectrofotómetro de microplacas.
- Realice una reacción de control con 2 μL de etanol absoluto/agua destilada y 198 μL de solución de DPPH. Realice una medición en blanco con 2 μL de extracto y 198 μL de etanol absoluto.
- Exprese los resultados como el porcentaje de inhibición de DPPH utilizando la siguiente ecuación:
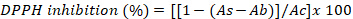
donde As es la absorbancia del extracto de algas, Ab es la absorbancia de las muestras en blanco y Ac es la absorbancia del testigo.
- En una microplaca de 96 pocillos protegida de la luz, colocar 2 μL de cada muestra (a una concentración de 10 mg/mL) y 198 μL de DPPH disueltos en etanol absoluto (0,1 mM).
7. Evaluación de la citotoxicidad en células epidérmicas
NOTA: Se evalúa el efecto citotóxico in vitro de los extractos acuoso y etanólico de G. gracilis en queratinocitos humanos (células HaCaT - 300493) a través del ensayo colorimétrico MTT como se describió anteriormente25. Las células se adquirieron de Cell Lines Services, Alemania (CLS) y el método se realizó de acuerdo con las directrices institucionales y las instrucciones de CLS.
PRECAUCIÓN: Consulte la ficha de datos de seguridad de MTT entregada por el proveedor)
- Mantenimiento de cultivos celulares
- Cultivo de células HaCaT en medio de alto contenido glucémico (DMEM) de Dulbecco Modified Eagle suplementado con suero fetal bovino (FBS) al 10% y solución antibiótica/antimicótica al 1% (anfotericina B, 0,25 mM; penicilina, 60 mM; estreptomicina, 100 mM).
- Use tripsina-EDTA para disociar las células.
NOTA: El subcultivo de células HaCaT se realiza después de que las células alcanzan la confluencia total. - Cultivar las células en una cámara a 37 °C con 5% de CO2 y 95% de humedad.
- Subcultive las células de acuerdo con las instrucciones del biobanco siempre que los cultivos alcancen el 80%-85% de confluencia.
- Evaluación de citotoxicidad
- Después de sembrar las células en placas de 96 pocillos e incubarlas durante la noche, trate las células HaCaT (4 x 104 células/pocillo) con los extractos secos previamente disueltos en DMSO (100 mg/mL). A continuación, añadir 2 μL de la solución de extracto a 198 μL de medio e incubar las placas durante 24 h.
- Retirar el medio de cultivo y añadir 100 μL de MTT (0,5 mg/mL) a las células. Incubar las células durante 30 minutos en la oscuridad en las condiciones regulares de cultivo mencionadas anteriormente.
- Retirar la solución de MTT y solubilizar los cristales de formazano intracelular con 100 μL de DMSO.
- Mida la absorbancia a 570 nm con un lector de microplacas. Exprese los resultados como un porcentaje de células de control no tratadas.
8. Innovación alimentaria
- Nuevo producto alimenticio: Pasta con algas
- Selección de ingredientes y formulación de la pasta
NOTA: La selección de ingredientes se realizó en colaboración con una empresa de pastas. La elección de los ingredientes clave (descritos en la sección 8.2) se realizó teniendo en cuenta su fácil accesibilidad y compatibilidad con las líneas de producción existentes, utilizando recursos marinos para obtener pastas con valor nutricional agregado.- Después de la elección de los ingredientes, diseñe la formulación siguiendo el valor nutricional deseado (fuente de fibra, vitaminas y elementos minerales, bajo en grasas saturadas) analizando la composición química teórica de las formulaciones utilizando una hoja de cálculo.
- Cuando se cumplan los requisitos teóricos, se procederá a la producción a escala de laboratorio como se describe en el paso 8.1.2.
- Realizar una prueba sensorial con un panel semientrenado (>10 catadores) para validar la necesidad de reformulación o la aceptación de la formulación para los siguientes pasos.
NOTA: El panel fue previamente capacitado para la degustación de pastas y evaluó hedónicamente las formulaciones presentadas en cuanto a atributos como sabor, sabor, olor, textura y apariencia.
- Producción de pasta
NOTA: Produzca muestras de pasta Chifferi utilizando una extrusora de pasta.- En el equipo, mezcle porciones previamente definidas de harina de arroz , G. gracilis y Chlorella vulgaris, y agregue aproximadamente un 30% de agua a la mezcla.
- Para obtener pasta seca, seque Chifferi a 68 °C durante 42 min, seguido de 5 h, 30 min a 76 °C, simulando un proceso industrial.
- Finalmente, empaque y selle al vacío las muestras y guárdelas en un lugar oscuro en RT hasta su posterior análisis.
- Análisis nutricional
NOTA: Para los análisis del perfil nutricional, utilizar muestras secas y maceradas por triplicado.- Contenido de proteína bruta: Realizar el ensayo de proteína total a través del método Kjeldahl , adaptado de Duarte et al. (2022)26, siguiendo los pasos 8.1.3.2-8.1.3.6.
- Pesar con precisión 1,0 g de muestra (o agua destilada para el ensayo en blanco) y mezclar con dos comprimidos de Kjeldahl y 25 ml deH2SO4 en tubos de digestión.
PRECAUCIÓN: Consulte la ficha de datos de seguridad de H2SO4 entregada por el proveedor. - Realizar la digestión de muestras en un digestor Kjeldahl a 220 °C durante 30 min, seguido de 90 min a 400 °C.
- Después de enfriar a RT, agregue 80 ml de agua destilada y destile el amoníaco formado en 30 ml de una solución de H 3 BO3al 4% que contenga verde de bromocresol y rojo de metilo. Este paso se lleva a cabo en condiciones alcalinas (destilación con 40% de NaOH utilizando un destilador Kjeldahl.
PRECAUCIÓN: Consulte la ficha de datos de seguridad de la soluciónH 3 BO3 que contiene verde de bromocresol, rojo de metilo y NaOH al 40% suministrada por el proveedor. - Valorar las muestras destiladas con HCl 0,1 M hasta que se observe un cambio de color a un rosa grisáceo.
- Calcule el contenido de proteína bruta, representado por el contenido de nitrógeno de la muestra, y expréselo como g por 100 g utilizando la siguiente ecuación:
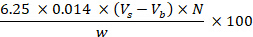
donde Vs corresponde al volumen de HCl (ml) utilizado en la valoración de la muestra; Vb corresponde al volumen utilizado en la pieza en bruto; N corresponde a la normalidad de HCl; w corresponde al peso de la muestra (g). - Contenido de grasa total: Determinar el contenido de grasa total utilizando el método de Folch, adaptado de Folch et al. (1957)27, siguiendo los pasos 8.1.3.8-8.1.3.14.
- Preparar el reactivo Folch mezclando CHCl3 y MeOH en una proporción de 2:1 (v:v).
PRECAUCIÓN: Consulte la ficha de datos de seguridad del reactivo Folch entregada por el proveedor. - A los tubos de ensayo que contengan 1 g de alícuotas de muestras, añadir 5 ml de reactivo Folch y 0,8 ml de agua destilada. Mezcle en un vórtice durante 1 min.
- A continuación, añadir otros 5 mL de reactivo Folch y homogeneizar durante 5 min. Añadir 1,2 mL de solución de NaCl al 0,8% y homogeneizar durante 2 min.
- Centrifugar las muestras a 7000 x g durante 10 min. Filtrar la fase orgánica (fase inferior) a través de algodón hidrófilo y sulfato de sodio anhidro en un matraz de vidrio de fondo redondo.
- Para evitar la pérdida de muestra, repita los pasos de adición de 5 mL de CHCl3, homogeneización, centrifugación y filtración en las mismas condiciones.
- Retirar el disolvente orgánico de las fases orgánicas recogidas por evaporación a baja presión y dejar en el horno a 105 °C durante 4 h. Enfríe las muestras en un desecador.
- Calcule el contenido de grasa, expresado como g por 100 g, utilizando la siguiente ecuación:
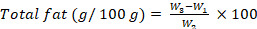
donde W1 es el peso del matraz de vidrio de fondo redondo vacío; W2 es el peso inicial de la muestra; W3 es el matraz de vidrio de fondo redondo con el peso de la muestra. - Contenido de fibra bruta: Determinar el contenido de fibra bruta utilizando una metodología adaptada de la norma ISO 6865 (2000)28, siguiendo los pasos 8.1.3.16-8.1.3.22.
- Pesar 1 g de la muestra (W0) en un crisol de vidrio con fondo filtrante (referencia P2) y colocarlo en el analizador de fibras.
- El primer paso es la hidrólisis ácida: Agregue 150 mL de 1.25% H 2 SO4, precalentado, y2mL de agente antiespumante (n-octanol) a la columna de cada crisol; Calentar hasta que hierva y mantener durante 30 min.
- Después de la eliminación de este disolvente, lavar tres veces con agua desionizada para proceder a la hidrólisis básica. Agregue 150 ml de NaOH al 1,25%, precalentado, y 5 ml de agente antiespumante a la columna libre de líquido y realice el mismo procedimiento de calentamiento que para la hidrólisis ácida.
- Por último, realizar un triple lavado con 150 mL de acetona para la extracción en frío.
- Después de este proceso, retire con cuidado los crisoles del sistema y colóquelos en un horno a 150 °C durante 1 h. Registre el peso final (W1).
- Coloque los crisoles en un horno de mufla a 500 °C durante 3 h y luego registre el peso final (W2).
- Calcule el contenido de fibra bruta y exprese los resultados en porcentajes utilizando la siguiente ecuación:
% de fibra bruta = 100 x (W1-W2)/W0 - Perfil de ácidos grasos (AG): Determinar el perfil de ácidos grasos según Fernández et al.(2015)29, siguiendo los pasos 8.1.3.24-8.1.3.29.
NOTA: Los ésteres metílicos de ácidos grasos (FAME) se obtienen mediante transmetilación directa catalizada por ácido de las muestras liofilizadas molidas. Todos los análisis se realizan por triplicado. - Añadir 2 ml de una solución de H 2 SO4 al 2% (v/v) en metanol a una muestra de 50 mg y verter la mezcla a 80 °C durante2h con agitación continua.
PRECAUCIÓN: Consulte la ficha de datos de seguridad del metanol entregada por el proveedor. - Después de enfriar a RT, agregue 1 ml de agua ultrapura y 2 ml de n-heptano a cada muestra, haga vórtice a la mezcla durante 1 minuto y centrifugue durante 5 minutos.
PRECAUCIÓN: Consulte la ficha de datos de seguridad del n-heptano entregada por el proveedor. - Recuperar la fase n-heptano superior (orgánica) que contiene los FAME y transferirla a viales de cromatografía de gases (GC).
- Análisis en un cromatógrafo de gases equipado con una columna capilar TR-FAME (60 m × 0,25 mm de diámetro interior, 0,25 μm de espesor de película), un muestreador automático y un detector de ionización de llama (FID).
- Ajuste el inyector (modo splitless) a 250 °C y el detector a 280 °C. Ajuste la temperatura inicial de la columna a 75 °C y manténgala durante 1 min. A continuación, suba a 5 °C/min a 170 °C y mantenga la posición durante 10 min. A continuación, suba a 5 °C/min a 190 °C y mantenga otros 10 min. Por último, elevar a 2 °C/min a 240 °C y mantener durante 10 min. Utilice helio como gas portador a un caudal de 1,5 ml/min. Suministra aire e hidrógeno a caudales de 350 y 35 mL/min, respectivamente.
- Determine el perfil de AF comparando los tiempos de retención resultantes con un estándar y exprese los resultados como un porcentaje de la grasa total.
- Perfil de elementos minerales: Determinar los elementos minerales (Ca, P, Mg, Na, K, Fe, Cu, Mn, Zn) analizados por ICP-OES, siguiendo el método adaptado de Pinto et al. (2022)30, siguiendo los pasos 8.1.3.31-8.1.3.34.
- Pesar con precisión alrededor de 0,4 g de cada muestra seca y añadir 7,5 ml deHNO3 y 2,5 ml de HCl.
PRECAUCIÓN: Consulte la ficha de datos de seguridad de HNO3 y HCl entregada por el proveedor. - La digestión sigue un proceso de dos etapas: aumentar la temperatura de RT a 90 °C en 30 minutos (y mantener otros 30 minutos a esta temperatura) seguido de 60 minutos a 105 °C.
- Enfríe las soluciones de muestra, dilúyalas a 25 ml y fíltrelas y guárdelas en tubos etiquetados. En cada digestión, realice el mismo proceso con un material de referencia y un blanco. Obtener la concentración de los diferentes elementos mediante ICP-OES.
- Expresa los resultados en mg por 100 g de peso corporal.
- Contenido de hidratos de carbono: Calcule el contenido de hidratos de carbono siguiendo los pasos 8.1.3.36-8.1.3.37.
- Calcular el contenido de hidratos de carbono disponibles (excluyendo fibra) por la diferencia de los factores previamente determinados por cada 100 g, utilizando la siguiente ecuación, según la Organización de las Naciones Unidas para la Alimentación y la Agricultura (FAO; 2003)31

- Expresa los resultados en g por 100 g.
- Contenido de humedad y cenizas: Calcule el contenido de humedad y cenizas siguiendo los pasos 8.1.3.39-8.1.3.45.
- Incubar crisoles de porcelana durante 3 h a 105 °C, enfriarlos en un desecador y pesarlos.
- Pesar 10 g de la muestra en el crisol y colocarla en un horno de secado a 105 °C durante ciclos de 3 h hasta que los valores de las ponderaciones sucesivas no difieran en más de 10 mg.
- Calcule el contenido de humedad, expresado como g por 100 g de fw, utilizando la siguiente ecuación:
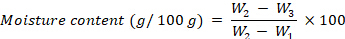
donde W1 es el peso del crisol vacío, W2 es el peso del crisol con la muestra fresca y W3 es el peso del crisol con la muestra seca. - Después del ensayo del contenido de humedad, coloque los crisoles con las muestras secas en un incinerador a 525 °Cdurante 4 h.
- Repita este procedimiento hasta que las ponderaciones sucesivas no difieran en más de 1 mg.
- Enfríe las muestras a RT en un desecador y luego péselas.
- Calcule el contenido de cenizas, expresado como g por 100 g de fw, utilizando la siguiente ecuación:
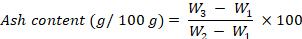
donde W1 es el peso del crisol vacío, W2 es el peso del crisol con muestra fresca, W3 es el peso del crisol con peso. - Valor de energía: Calcule el valor de energía siguiendo los pasos 8.1.3.47-8.1.3.48.
- Calcular el valor energético de las muestras según el reglamento de la UE: El suministro de información alimentaria a los consumidores (Reglamento 1169/2011)32, utilizando las ecuaciones:
Energía (kcal/ 100 g) = 4 x (g de proteínas) + 4 x (g de hidratos de carbono) + 9 x (g de grasas) + 2 x (g de fibra)
Energía (kJ/ 100 g) = 17 x (g de proteínas) + 17 x (g de carbohidratos) + 37 x (g de grasas) + 8 x (g de fibra) - Expresa los resultados en kilocalorías por 100 g y kilojulios por 100 g.
- Aceptación por parte de los consumidores
- Evalúe la aceptación del consumidor utilizando muestras de pasta cocidas en agua destilada durante 8 min.
- Realice una prueba de aceptación del consumidor: evalúe la apariencia visual, el color, la textura, el olor, el sabor a mar, el sabor general, la evaluación general y la intención de compra de las muestras.
NOTA: La prueba de aceptación del consumidor se basa en pruebas hedónicas que evalúan la apariencia visual, el color, la textura, el olor, el sabor del mar, el sabor general, la evaluación general y la intención de compra en una escala del 1 al 9, donde 1 es una evaluación deficiente y 9 es una evaluación muy buena. - Realizar pruebas sensoriales en cabinas sensoriales individuales en un laboratorio de análisis sensorial (con control de temperatura e iluminación). Proporcione cubiertos, servilletas y vasos de vidrio con agua mineral para limpiar el paladar entre muestras.
NOTA: Los catadores tienen entre 16 y 64 años de todos los orígenes (n > 80).
- Selección de ingredientes y formulación de la pasta
- Yogur
- Extracción de pigmentos
NOTA: Realizar la extracción del pigmento a través de la metodología descrita en Pereira et al. (2020)18.- Preparar el disolvente de extracción, tampón fosfato sódico a 0,1 M, con fosfato sódico dibásico (0,03 M) y fosfato sódico monobásico (0,07 M). Ajuste el pH a pH 6.8 usando NaOH o HCl.
- Pesar 1 g de G. gracilis y añadir 50 ml de tampón fosfato sódico (pH 6,8). Homogeneizar durante 10 min, seguido de 10 min de maceración con mortero.
- Transfiera la solución a un tubo y centrifugue durante 20 minutos a 12,298 x g (4 °C).
- Agrupe el sobrenadante y agregue lentamente un 65% de sulfato de amonio. Cuando todo el sulfato de amonio esté disuelto, cubra la solución con una lámina de aluminio y déjela precipitar a 4 °C durante la noche.
PRECAUCIÓN: Consulte la ficha de datos de seguridad del sulfato de amonio entregada por el proveedor. - Centrifugar el precipitado durante 20 min a 12.298 x g (4 °C). Recuperar el pellet y disolver en agua destilada (aproximadamente 5 mL).
- Realizar la diálisis del extracto utilizando una membrana tubular (14 kDa) contra agua durante 24 h, seguida de liofilización. Conservar el extracto liofilizado protegido de la luz a 4 °C hasta su uso.
- Preparación del yogur
- Preparar yogur natural mezclando 1 L de leche pasteurizada, 120 g de yogur natural, 20 g de azúcar y 50 g de leche en polvo en una termobatidora durante 5 min, 50 °C, velocidad 3.
- Coloque la mezcla en el frasco de la batidora en una incubadora a 37 °C durante 12 h.
- Incorporar el extracto mezclándolo con yogur a una concentración del 0,21%. Almacenar las muestras en matraces de vidrio individuales a 4 °C hasta el análisis.
- Conservar porciones individuales de yogur sin pigmento (control) a 4 °C hasta su análisis.
- Estabilidad del color
NOTA: Evaluar la estabilidad del pigmento en los yogures a través del análisis de color durante 12 días. Realice análisis de color con un colorímetro de reflectancia, con un observador estándar de 2 grados y un iluminador D65. Los resultados se presentan como coordenadas CIELab con los parámetros L (luminosidad, blanco - negro, 0 - 100), a* (verde - rojo, -60 - 60) y b* (azul - amarillo, -60 - 60). El parámetro a* tiene valores positivos para los colores rojizos y valores negativos para los colores verdosos. El parámetro b* toma valores positivos para los colores amarillentos y valores negativos para los colores azulados. L* es el parámetro de luminosidad, que es la propiedad según la cual cada color puede considerarse equivalente a un miembro de la escala de grises entre el blanco y el negro33.- Calibre el colorímetro utilizando una placa de cerámica blanca (L* 88.5, a* 0.32, b* 0.33) proporcionada por el fabricante.
- Llene una celda con aproximadamente 28 g de la muestra (o control) y analice el color utilizando un software de análisis de datos de color.
NOTA: El software utilizado para el análisis de datos de color fue el SpectraMagic NX. - Realice lecturas 5 veces por triplicado de muestra/control.
- Análisis sensorial
NOTA: Realice una evaluación sensorial de los yogures con incorporación de pigmentos utilizando una prueba de triángulo (ISO 4120, 2004)34 y una evaluación hedónica del color, el sabor y la apreciación general.- Para la prueba del triángulo, entregue a los panelistas tres muestras (una muestra de yogur con pigmento y dos muestras de control, o dos muestras de yogur con pigmento y un control) y pídales que elijan una muestra diferente según el aroma, la textura y el sabor. Proporcione muestras en volúmenes similares identificados con códigos aleatorios de 3 números.
- Para la evaluación hedónica del yogur con pigmento, entregue a los panelistas una muestra de yogur con pigmento y pídales que evalúen el color, el sabor y la apreciación general utilizando una escala hedónica de 9 puntos (de extremadamente desagradable a extremadamente similar).
- Extracción de pigmentos
Resultados
Actividad antimicrobiana
A la hora de interpretar los resultados obtenidos, hay que tener en cuenta que cuanto mayor sea el porcentaje de inhibición, mayor será la eficacia del extracto para inhibir el crecimiento de esa cepa concreta y, en consecuencia, más interesante será el extracto como antimicrobiano. A través de esta metodología, podemos identificar rápidamente qué extractos tienen mayor actividad...
Discusión
Las pruebas de actividad antimicrobiana en un medio líquido se utilizan para evaluar la eficacia de las sustancias antimicrobianas contra los microorganismos suspendidos en un medio líquido y generalmente se realizan para determinar la capacidad de una sustancia para inhibir el crecimiento o matar microorganismos35,36,37,38. Se utilizan para evaluar la sensibilidad de los microorganismos a lo...
Divulgaciones
Los autores no tienen nada que revelar.
Agradecimientos
Este trabajo contó con el apoyo de la Fundación Portuguesa para la Ciencia y la Tecnología (FCT) a través de los Proyectos Estratégicos concedidos al MARE-Centro de Ciencias Marinas y Ambientales (UIDP/04292/2020 y UIDB/04292/2020), y al Laboratorio Asociado ARNET (LA/P/0069/2020). La FCT también financió las becas individuales de doctorado otorgadas a Marta V. Freitas (UI/BD/150957/2021) y Tatiana Pereira (2021). 07791. BD). Este trabajo también contó con el apoyo financiero del proyecto HP4A - PASTA SALUDABLE PARA TODOS (copromoción nº 039952), cofinanciado por el FEDER - Fondo Europeo de Desarrollo Regional, en el marco del Programa Portugal 2020, a través del Programa Operativo COMPETE 2020 - Competitividad e Internacionalización.
Materiales
| Name | Company | Catalog Number | Comments |
| Absolute Ethanol | Aga, Portugal | 64-17-5 | |
| Ammonium Chloride | PanReac | 12125-02-9 | |
| Amphotericin B | Sigma-Aldrich | 1397-89-3 | |
| Analytical scale balance | Sartorius, TE124S | 22105307 | |
| Bacillus subtilis subsp. spizizenii | German Collection of Microorganisms and Cell Cultures (DSMZ) | DSM 347 | |
| Biotin | Panreac AppliChem | 58-85-5 | |
| Centrifuge | Eppendorf, 5810R | 5811JH490481 | |
| Chloramphenicol | PanReac | 56-75-7 | |
| CO2 Chamber | Memmert | N/A | |
| Cool White Fluorescent Lamps | OSRAM Lumilux Skywhite | N/A | |
| Densitometer McFarland | Grant Instruments | N/A | |
| DMEM medium | Sigma-Aldrich | D5796 | |
| DMSO | Sigma-Aldrich | 67-68-5 | |
| DPPH | Sigma, Steinheim, Germany | 1898-66-4 | |
| Escherichia coli (DSM 5922) | German Collection of Microorganisms and Cell Cultures (DSMZ) | DSM5922 | |
| Ethanol 96% | AGA-Portugal | 64-17-5 | |
| Ethylenediaminetetraacetic Acid Disodium Salt Dihydrate (Na2EDTA) | J.T.Baker | 6381-92-6 | |
| Fetal Bovine Serum (FBS) | Sigma-Aldrich | F7524 | |
| Filter Paper (Whatman No.1) | Whatman | WHA1001320 | |
| Flasks | VWR International, Alcabideche, Portugal | N/A | |
| Folin-Ciocalteu | VWR Chemicals | 31360.264 | |
| Gallic Acid | Merck | 149-91-7 | |
| Germanium (IV) Oxide, 99.999% | AlfaAesar | 1310-53-8 | |
| HaCaT cells – 300493 | CLS-Cell Lines Services, Germany | 300493 | |
| Hot Plate Magnetic Stirrer | IKA, C-MAG HS7 | 06.090564 | |
| Iron Sulfate | VWR Chemicals | 10124-49-9 | |
| Laminar flow hood | TelStar, Portugal | 526013 | |
| LB Medium | VWR Chemicals | J106 | |
| Listonella anguillarum | German Collection of Microorganisms and Cell Cultures (DSMZ) | DSM 21597 | |
| Manganese Chloride | VWR Chemicals | 7773.01.5 | |
| Micropipettes | Eppendorf, Portugal | N/A | |
| Microplates | VWR International, Alcabideche, Portugal | 10861-666 | |
| Microplates | Greiner | 738-0168 | |
| Microplates (sterile) | Fisher Scientific | 10022403 | |
| Microplate reader | Epoch Microplate Spectrophotometer, BioTek, Vermont, USA | 1611151E | |
| MTT | Sigma-Aldrich | 289-93-1 | |
| Muller-Hinton Broth (MHB) | VWR Chemicals | 90004-658 | |
| Oven | Binder, FD115 | 12-04490 | |
| Oven | Binder, BD115 | 04-62615 | |
| Penicillin | Sigma-Aldrich | 1406-05-9 | |
| pH meter Inolab | VWR International, Alcabideche, Portugal | 15212099 | |
| Pippete tips | Eppendorf, Portugal | 5412307 | |
| Pyrex Bottles Media Storage | VWR International, Alcabideche, Portugal | 16157-169 | |
| Rotary Evaporator | Heidolph, Laborota 4000 | 80409287 | |
| Rotavapor | IKA HB10, VWR International, Alcabideche, Portugal | 07.524254 | |
| Sodium Carbonate (Na2CO3) | Chem-Lab | 497-19-8 | |
| Sodium Chloride (NaCl) | Normax Chem | 7647-14-5 | |
| Sodium Phosphate Dibasic | Riedel-de Haën | 7558-79-4 | |
| SpectraMagic NX | Konica Minolta, Japan | color data analysis software | |
| Spectrophotometer | Evolution 201, Thermo Scientific, Madison, WI, USA | 5A4T092004 | |
| Streptomycin | Sigma-Aldrich | 57-92-1 | |
| Thiamine | Panreac AppliChem | 59-43-8 | |
| Trypsin-EDTA | Sigma-Aldrich | T4049 | |
| Tryptic Soy Agar (TSA) | VWR Chemicals | ICNA091010617 | |
| Tryptic Soy Broth (TSB) | VWR Chemicals | 22091 | |
| Ultrapure water | Advantage A10 Milli-Q lab, Merck, Darmstadt, Germany | F5HA17360B | |
| Vacuum pump | Buchi, Switzerland | FIS05-402-103 | |
| Vitamin B12 | Merck | 68-19-9 |
Referencias
- Charoensiddhi, S., Abraham, R. E., Su, P., Zhang, W. Seaweed and seaweed-derived metabolites as prebiotics. Advances in Food and Nutrition Research. 91, 97-156 (2020).
- Roohinejad, S., Koubaa, M., Barba, F. J., Saljoughian, S., Amid, M., Greiner, R. Application of seaweeds to develop new food products with enhanced shelf-life, quality, and health-related beneficial properties. Food Research International. 99, 1066-1083 (2017).
- Hurd, C. L., Harrison, P. J., Bischof, K., Lobban, C. S. . Seaweed Ecology and Physiology. (second). , (2014).
- Freitas, M. V., Mouga, T., Correia, A. P., Afonso, C., Baptista, T. New insights on the sporulation, germination, and nutritional profile of Gracilaria gracilis (Rhodophyta) grown under controlled conditions. Journal of Marine Science and Engineering. 9 (6), 562 (2021).
- Friedlander, M. Advances in cultivation of Gelidiales. Journal of Applied Phycology. 20 (5), 451-456 (2008).
- Matos, G. S., Pereira, S. G., Genisheva, Z. A., Gomes, A. M., Teixeira, J. A., Rocha, C. M. R. Advances in extraction methods to recover added-value compounds from seaweeds: Sustainability and functionality. Foods. 10, 516 (2021).
- Ummat, V., Sivagnanam, S. P., Rajauria, G., O'Donnell, C., Tiwari, B. K. Advances in pre-treatment techniques and green extraction technologies for bioactives from seaweeds. Trends in Food Science & Technology. 110, 90-106 (2021).
- Pérez, M. J., Falqué, E., Domínguez, H., Ravishankar, G., Ambati, R. R. Seaweed Antimicrobials, Present Status and Future Perspectives. Handbook of Algal Technologies andPhytochemicals:Volume I Food, Health and Nutraceutical Applications. , (2019).
- Cavallo, R. A., Acquaviva, M. I., Stabili, L., Cecere, E., Petrocelli, A., Narracci, M. Antibacterial activity of marine macroalgae against fish pathogenic Vibrio species. Central European Journal of Biology. 8, 646-653 (2013).
- Shannon, E., Abu-Ghannam, N. Antibacterial derivatives of marine algae: An overview of pharmacological mechanisms and applications. Marine Drugs. 14 (4), 81 (2016).
- Capillo, G., et al. New insights into the culture method and antibacterial potential of Gracilaria gracilis. Marine Drugs. 16 (12), 492 (2018).
- Francavilla, M., Franchi, M., Monteleone, M., Caroppo, C. The red seaweed Gracilaria gracilis as a multi products source. Marine Drugs. 11 (10), 3754-3776 (2013).
- Sánchez-Ayora, H., Pérez-Jiménez, J., Pérez-Correa, J. R., Mateos, R., Domínguez, R. Antioxidant Capacity of Seaweeds: In Vitro and In Vivo Assessment. Marine Phenolic Compounds. , 299-341 (2023).
- Anil, S., Sweety, V. K., Vikas, B., Betsy-Joseph, B. . Cytotoxicity and Cell Viability Assessment of Biomaterials. Cytotoxicity. , 111822 (2023).
- Mosmann, T. Rapid colorimetric assay for cellular growth and survival: Application to proliferation and cytotoxicity assays. Journal of Immunological Methods. 65 (1-2), 55-63 (1983).
- Roleda, M. Y., et al. Variations in polyphenol and heavy metal contents of wild-harvested and cultivated seaweed bulk biomass: Health risk assessment and implication for food applications. Food Control. 95, 121-134 (2019).
- Souza, K. D., et al. Gastronomy and the development of new food products: Technological prospection. International Journal of Gastronomy and Food Science. 33, 100769 (2023).
- Pereira, T., et al. Optimization of phycobiliprotein pigments extraction from red algae Gracilaria gracilis for substitution of synthetic food colorants. Food Chemistry. 321, 126688 (2020).
- Redmond, S., Green, L., Yarish, C., Kim, J., Neefus, C., Redmond, S., Green, L., Yarish, C., Kim, J., Neefus, C. . New England Seaweed Culture Handbook-Nursery Systems. , (2014).
- Yong, Y. S., Yong, W. T. L., Anton, A. Analysis of formulae for determination of seaweed growth rate. Journal of Applied Phycology. 25 (6), 1831-1834 (2013).
- Patarra, R. F., Carreiro, A. S., Lloveras, A. A., Abreu, M. H., Buschmann, A. H., Neto, A. I. Effects of light, temperature and stocking density on Halopteris scoparia growth. Journal of Applied Phycology. 29 (1), 405-411 (2017).
- NCCLS, National Committee for Clinical Laboratory Standards, Clinical and Laboratory Standards Institute. . Performance Standards for Antimicrobial Disk Susceptibility Tests: Approved Standard. 32, M02-M11 (2012).
- Singleton, V. L., Rossi, J. A. J. Colorimetry to total phenolics with phosphomolybdic acid reagents. American Journal of Enology and Viticulture. 16, 144-158 (1965).
- Duan, X. J., Zhang, W. W., Li, X. M., Wang, B. G. Evaluation of antioxidant property of extract and fractions obtained from a red alga, Polysiphonia urceolata. Food Chemistry. 95 (1), 37-43 (2006).
- Freitas, R., et al. Highlighting the biological potential of the brown seaweed Fucus spiralis for skin applications. Antioxidants. 9 (7), 611 (2020).
- Duarte, A., et al. Seasonal study of the nutritional composition of unexploited and low commercial value fish species from the Portuguese coast. Food Science and Nutrition. 10 (10), 3368-3379 (2020).
- Folch, J., Lees, M., Stanley, G. A simple method for the isolation and purification of total lipides from animal tissues. Journal of Biological Chemistry. 226 (1), 497-509 (1957).
- ISO 6865. Animal feeding stuffs - Determination of crude fibre content - Method with intermediate filtration. Bureau of Indian Standards (BIS). , (2000).
- Fernández, A., Grienke, U., Soler-Vila, A., Guihéneuf, F., Stengel, D. B., Tasdemir, D. Seasonal and geographical variations in the biochemical composition of the blue mussel (Mytilus edulis L.) from Ireland. Food Chemistry. 177, 43-52 (2015).
- Pinto, F., et al. Annual variations in the mineral element content of five fish species from the Portuguese coast. Food Research International. 158, 111482 (2022).
- Food energy - methods of analysis and conversion factors. Available from: https://www.fao.org/fileadmin/templates/food_composition/documents/book_abstracts/Food_energy.pdf (2003)
- . 1169/2011 of the European Parliament and of the Council of 25 -10-2011 Available from: https://eur-lex.europa.eu/legal-content/EN/ALL/?uri=CELEX%3A32011R1169 (2011)
- Pathare, P. B., Opara, U. L., Al-Said, F. A. J. Colour measurement and analysis in fresh and processed foods: A review. Food and Bioprocess Technology. 6 (1), 36-60 (2013).
- ISO 4120. Sensory analysis - Methodology - Triangle test. International Standard. , (2004).
- Reller, L. B., Weinstein, M., Jorgensen, J. H., Ferraro, M. J. Antimicrobial susceptibility testing: A review of general principles and contemporary practices. Clinical Infectious Diseases. 49 (11), 1749-1755 (2009).
- Balouiri, M., Sadiki, M., Ibnsouda, S. K. Methods for in vitro evaluating antimicrobial activity: A review. Journal of Pharmaceutical Analysis. 6 (2), 71-79 (2016).
- Gajic, I., et al. Antimicrobial susceptibility testing: A comprehensive review of currently used methods. Antibiotics. 11 (4), 427 (2022).
- Gonzalez-Pastor, R., et al. Current landscape of methods to evaluate antimicrobial activity of natural extracts. Molecules. 28 (3), 1068 (2023).
- Li, J., et al. Antimicrobial activity and resistance: Influencing factors. Frontiers in Pharmacology. 13 (8), 364 (2017).
- Silva, A., et al. Macroalgae as a source of valuable antimicrobial compounds: Extraction and applications. Antibiotics. 9 (10), 642 (2020).
- Munteanu, I. G., Apetrei, C. Analytical methods used in determining antioxidant activity: A review. International Journal of Molecular Sciences. 22 (7), 3380 (2021).
- Ma, S., et al. Comparison of common analytical methods for the quantification of total polyphenols and flavanols in fruit juices and ciders. Journal of Food Science. 84 (8), 2147-2158 (2019).
- Tziveleka, L. A., Tammam, M. A., Tzakou, O., Roussis, V., Ioannou, E. Metabolites with antioxidant activity from marine macroalgae. Antioxidants. 10 (9), 1431 (2021).
- Ghasemi, M., Turnbull, T., Sebastian, S., Kempson, I. The MTT assay: Utility, limitations, pitfalls, and interpretation in bulk and single-cell analysis. International Journal of Molecular Sciences. 22 (23), 12827 (2021).
- Pereira, T., Barroso, S., Mendes, S., Gil, M. M. Stability, kinetics, and application study of phycobiliprotein pigments extracted from red algae Gracilaria gracilis. Journal of Food Science. 85 (10), 3400-3405 (2020).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoExplorar más artículos
This article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados