Для просмотра этого контента требуется подписка на Jove Войдите в систему или начните бесплатную пробную версию.
Method Article
Повышение ценности красных морских водорослей Gracilaria gracilis с помощью биоперерабатывающего подхода
В этой статье
Резюме
Здесь мы опишем несколько протоколов, направленных на комплексную оценку Gracilaria gracilis: сбор дикорастущих видов, выращивание в домашних условиях и экстракция биологически активных ингредиентов. Оценивается антиоксидантное, антимикробное и цитотоксическое действие экстрактов, а также оценка питательности и стабильности пищи, обогащенной биомассой и пигментами цельных морских водорослей.
Аннотация
Интерес к морским водорослям как к обильному исходному материалу для получения ценных и многоцелевых биологически активных ингредиентов постоянно растет. В этой работе мы исследуем потенциал Gracilaria gracilis, съедобных красных водорослей, культивируемых во всем мире из-за их коммерческого интереса в качестве источника агара и других ингредиентов для косметических, фармакологических, пищевых и кормовых применений.
Условия роста G. gracilis были оптимизированы за счет вегетативного размножения и спороношения при одновременном манипулировании физико-химическими условиями для достижения большого запаса биомассы. Методы «зеленой» экстракции с использованием этанола и воды были выполнены над биомассой морских водорослей. Биоактивный потенциал экстрактов оценивали с помощью комплекса анализов in vitro на предмет их цитотоксичности, антиоксидантных и антимикробных свойств. Кроме того, высушенная биомасса морских водорослей была включена в рецептуры макаронных изделий для повышения питательной ценности пищи. Пигменты, извлеченные из G. gracilis , также были включены в йогурт в качестве натурального красителя, и была оценена их стабильность. Оба продукта были представлены на суд полуобученной сенсорной комиссии, целью которой было достижение наилучшей конечной формулы до выхода на рынок.
Результаты подтверждают универсальность G. gracilis независимо от того, применяется ли он в виде целой биомассы, экстрактов и/или пигментов. Благодаря внедрению нескольких оптимизированных протоколов эта работа позволяет разрабатывать продукты, которые могут принести прибыль рынкам продуктов питания, косметики и аквакультуры, способствуя экологической устойчивости и «голубой» экономике замкнутого цикла.
Кроме того, в соответствии с подходом к биопереработке, остаточная биомасса морских водорослей будет использоваться в качестве биостимулятора для роста растений или преобразована в углеродные материалы, которые будут использоваться для очистки воды в собственных системах аквакультуры MARE-Polytechnic в Лейрии, Португалия.
Введение
Морские водоросли можно рассматривать как интересное природное сырье для фармацевтической, пищевой, кормовой и экологической отраслей. Они биосинтезируют множество молекул, многие из которых не встречаются в наземных организмах, обладающих соответствующими биологическими свойствами 1,2. Тем не менее, для обеспечения большого запаса биомассы необходимо внедрить оптимизированные для морских водорослей протоколы выращивания.
Методы выращивания всегда должны учитывать природу слоевищ водорослей и общую морфологию. Gracilaria gracilis является клональным таксоном, что означает, что орган прикрепления производит несколько вегетативных осей. Таким образом, достигается размножение путем фрагментации (вегетативное размножение), так как каждая из этих осей полностью способна к самостоятельной жизни от основного слоевища3. Клональные таксоны могут быть успешно интегрированы с помощью простых и быстрых одноэтапных методологий культивирования, так как большое количество биомассы получается путем расщепления слоевища на мелкие фрагменты, которые быстро регенерируют и вырастают в новых, генетически идентичных особей. В этом процессе могут использоваться как гаплонтические, так и диплонтические слоевища. Несмотря на то, что род демонстрирует сложный гапло-диплонтический изоморфный трехфазный жизненный цикл, спороношение редко требуется, за исключением тех случаев, когда требуется генетическое обновление запасов для получения улучшенных урожаев. В этом случае как тетраспоры (гаплонтические споры, образующиеся мейозом), так и карпоспоры (диплонтические споры, образующиеся в результате митоза) дают начало макроскопическим слоевищам, которые затем могут быть выращены и размножаться путем вегетативного размножения4. Циклы роста диктуются условиями окружающей среды и физиологическим состоянием особей, а также другими биологическими факторами, такими как появление эпифитов и сцепление других организмов. Таким образом, оптимизация условий выращивания имеет решающее значение для обеспечения высокой продуктивности и производства высококачественной биомассы5.
Извлечение биологически активных соединений из морских водорослей, включая G. gracilis, может быть достигнуто различными методами 6,7. Выбор метода экстракции зависит от конкретных интересующих соединений, целевого применения и характеристик морских водорослей. В этом исследовании мы сосредоточились на жидкостной экстракции, которая включает в себя использование зеленых растворителей, таких как вода или этанол, для растворения и извлечения биологически активных соединений из биомассы морских водорослей. Экстракция может осуществляться с помощью мацерации универсальным и эффективным способом и может использоваться для широкого спектра соединений. Это простой и широко используемый метод, включающий замачивание биомассы в растворителе в течение длительного периода времени, как правило, при комнатной или слегка повышенной температуре. Растворитель перемешивают для усиления процесса экстракции. По истечении требуемого времени экстракции растворитель отделяется от твердого материала путем фильтрации или центрифугирования.
Вода является широко используемым растворителем в пищевой промышленности из-за ее безопасности, доступности и совместимости с широким спектром пищевых продуктов. Водная экстракция подходит для полярных соединений, таких как полисахариды, пептиды и некоторые фенольные соединения. Однако он не может эффективно извлекать неполярные соединения. Этанол также широко используется в качестве растворителя в пищевых продуктах и может быть эффективным для извлечения различных биологически активных молекул, включая фенольные соединения, флавоноиды и некоторые пигменты. Этанол в целом признан безопасным для использования в пищевых продуктах и может легко испаряться, оставляя после себя извлеченные соединения. Стоит отметить, что при выборе метода экстракции следует учитывать такие факторы, как эффективность, селективность, экономичность и воздействие на окружающую среду. Оптимизация параметров экстракции, таких как концентрация растворителя, время экстракции, температура и давление, имеет решающее значение для достижения оптимального выхода биологически активных соединений из G. gracilis или других морских водорослей.
Было обнаружено, что морские водоросли проявляют антимикробную активность в отношении широкого спектра микроорганизмов, включая бактерии, грибки и вирусы8. Эта активность объясняется биологически активными компонентами, включая фенольные соединения, полисахариды, пептиды и жирные кислоты. Несколько исследований продемонстрировали их эффективность против таких патогенов, как Escherichia coli, Staphylococcus aureus, Salmonella sp. и Pseudomonas aeruginosa, среди прочих9. Антимикробная активность морских водорослей объясняется присутствием биологически активных соединений, которые могут вмешиваться в микробные клеточные стенки, мембраны, ферменты и сигнальные пути10. Эти соединения могут нарушать рост микробов, ингибировать образование биопленки и модулировать иммунные реакции.
Красные водоросли, также известные как родофиты, представляют собой группу водорослей, которые могут проявлять антимикробную активность против различных микроорганизмов. В этой группе G. gracilis содержит различные биологически активные соединения, которые могут способствовать его антимикробной активности. В то время как конкретные молекулы могут варьироваться, общими классами, которые были зарегистрированы у G. gracilis и могут обладать антимикробными свойствами, являются полисахариды, фенолы, терпеноиды и пигменты11. Однако важно отметить, что наличие и количество этих компонентов может варьироваться в зависимости от таких факторов, как место сбора водорослей, сезонность, физиологическое состояние слоевища и условия окружающей среды. Таким образом, конкретный класс и концентрация антимикробных соединений в G. gracilis могут варьироваться соответствующим образом.
Также было обнаружено, что G. gracilis обладает антиоксидантными свойствами, содержа различные фенольные соединения, которые, как было показано, поглощают свободные радикалы и снижают окислительныйстресс.Антиоксиданты помогают защитить клетки от повреждений, вызванных активными формами кислорода, и имеют потенциальную пользу для здоровья. Антиоксидантная способность может быть оценена непосредственно с помощью различных методов, включая активность 2,2-дифенил-1-пикрилгидразила (ДФПГ) по удалению свободных радикалов и, косвенно, через количественное определение общего содержания полифенольных соединений (TPC)13.
Несмотря на то, что ингредиент, как сообщается, обладает выраженной биологической активностью, оценка его цитотоксичности необходима при оценке натуральных и синтетических веществ, используемых в контакте с живыми клетками или тканями. Существует несколько методов измерения цитотоксичности, каждый из которых имеет свои преимущества и ограничения. В целом, они предлагают ряд возможностей для оценки вредного воздействия многих веществ на клетки и, в то же время, для исследования механизмов поврежденияи гибели клеток.
В этой работе мы используем 3-(4,5-диметилтиазол-2-ил)-2,5-дифенилтетразолий бромид (МТТ), колориметрический метод, введенный Мосманном (1983)15. Этот метод измеряет восстановление солей тетразолия до пурпурного формазана метаболически активными клетками. Чем выше количество кристаллов формазана, тем выше число жизнеспособных клеток, что обеспечивает косвенную меру цитотоксичности14. Поскольку в данной работе водные и этаноловые экстракты G. gracilis предназначены для включения в дермокосметические составы, оценка цитотоксичности in vitro проводится в клеточной линии кератиноцитов (HaCaT).
Что касается применения в пищу, морские водоросли, как правило, низкокалорийны и богаты питательными веществами пищевыми волокнами, незаменимыми элементами и аминокислотами, полисахаридами, полиненасыщенными жирными кислотами, полифенолами и витаминами 2,16. G. gracilis не является исключением, обладая интересной пищевой ценностью. Freitas et al. (2021)4 обнаружили, что культивируемый G. gracilis имеет более высокий уровень белка и витамина С и поддерживает уровень общих липидов по сравнению с дикими морскими водорослями. Это может представлять собой экономическое и экологическое преимущество, поскольку с точки зрения питания производство предпочтительнее, чем эксплуатация диких ресурсов. Кроме того, потребители все больше обеспокоены типом пищи, которую они едят, поэтому важно вводить новые ингредиенты для обогащения пищевых продуктов и использовать новые ресурсы для получения экстрактов, которые могут повысить ценность продукта и претендовать на «чистую этикетку». Кроме того, современный рынок характеризуется высокой конкуренцией, требующей разработки новых продуктов и инновационных стратегий, позволяющих дифференцировать производителей от их конкурентов17.
Обогащение продуктов с низкой питательной ценностью, таких как макаронные изделия, морскими ресурсами, в том числе морскими водорослями, является стратегией внедрения этого ресурса в качестве нового продукта питания и стратегии дифференциации рынка за счет продукта с определенной питательной ценностью. С другой стороны, G. gracilis является источником природных красных пигментов, таких как фикобилипротеины18, обладающие высоким потенциалом для применения в пищевой промышленности. Эта водоросль проявила большой интерес в нескольких областях, и ее применение может быть произведено с использованием целых водорослей, экстрактов и/или оставшейся биомассы. В данной работе мы демонстрируем некоторые примеры таких приложений.
протокол
1. Заготовка и подготовка биомассы
- Собирайте образцы G. gracilis во время отлива и быстро транспортируйте их в лабораторию в темных, охлаждаемых боксах, чтобы избежать высыхания, воздействия света и воздуха.
- В лаборатории промойте каждое слоевище проточной морской водой и тщательно очистите, чтобы удалить с поверхности мусор, некротические части, эпифиты и другие организмы.
- Хранить дикую биомассу в постоянно аэрируемой морской воде (31-35 psu) в климатическом помещении (20 ± 1 °C) с низкой освещенностью, обеспечиваемой дневным светом, прохладными, белыми и люминесцентными лампами и фотопериодом, установленным на 16:08 (свет: темно) в течение 7 дней. В течение этого периода не поставляйте питательные среды; Это позволяет водорослям медленно приспосабливаться к новым условиям в помещении.
2. Поддержание складских запасов
- После периода акклиматизации стерильным лезвием срежьте здоровые кончики слоевищ морских водорослей. В соответствии с Redmond et al. (2014)19 и в стерильных условиях протащите каждый наконечник через агаровый гель, предварительно приготовленный в чашках Петри (1,0% бактериологический агар, в соотношении дистиллированная вода/морская вода 1:1), чтобы удалить все оставшиеся загрязнения. Выполняйте перетаскивание агара три раза для каждого наконечника и всегда протаскивайте наконечник через неиспользованные участки агарового геля.
- Кислоту моют стеклянную посуду в растворе соляной кислоты (HCl, 15%) и тщательно ополаскивают дистиллированной водой. Стерилизовать все инструменты, стеклянную посуду, агар, морскую воду и дистиллированную воду, используемые в процессе очистки, в автоклаве (121 °C, 15 мин).
ВНИМАНИЕ: См. паспорт безопасности HCl, поставляемый поставщиком. - По данным Redmond et al. (2014)19, кончики растут в стерилизованной морской воде при концентрации 35 psu, дополненной обогащенным раствором фон Стоша (VSE), модифицированным для красных водорослей. Добавьте диоксид германия (GeO2) в среду (1 мл/л) для предотвращения роста эпифитных диатомовых водорослей.
ВНИМАНИЕ: Ознакомьтесь с паспортом безопасности GeO2 , поставляемым поставщиком.
ПРИМЕЧАНИЕ: Кончики, которые показывают потерю пигментации, что наблюдается в виде частичного или полного обесцвечивания, находятся в состоянии стресса или уже мертвы, и их следует выбросить.
3. Выращивание и масштабирование
- После периода акклиматизации случайным образом распределить около 8-10 здоровых наконечников по 250 мл плоскодонных колб в климатическом помещении, установленном при температуре 20 ± 1 °С с белым холодным светом 20 ± 0,5 мкмоль фотонов м-2 с-1 (1500 люкс), фотопериодом 16 ч: 8 ч (светлый: темный) и стерильной морской водой, обогащенной питательными средами ВСЭ, обновляемой каждую неделю.
- Выполняйте еженедельные измерения веса, избегая чрезмерного напряжения слоевища20. Для этого аккуратно извлеките кончики из питательной среды, аккуратно промойте и взвесьте миллиграммы на лабораторных весах.
ПРИМЕЧАНИЕ: Эту процедуру можно проводить вместе с еженедельным обновлением питательной среды. - Слоевища могут расти в этих колбах до плотности до 2 г/л. На этом этапе выполните увеличение масштаба реципиента (250 мл, 1 л и 5 л). Перенесите культивацию в открытые открытые белые емкости объемом 50 л и больше, когда объем достигнет 5 л.
- Рассчитать относительный темп роста (RGR) по Patarra et al. (2017)21 :
RGR (% fw/день) = ([Ln (fw) - Ln (iw)]/t) x 100
где iw и fw — начальный и конечный свежий вес соответственно, выраженный в граммах, а t — время в днях.
ПРИМЕЧАНИЕ: При такой лабораторной установке РВЖ достигает значений до 21% в день. Заготовка биомассы может быть произведена в любое время. Биомасса должна быть быстро переработана, чтобы предотвратить разложение, путем сушки в печи, сублимационной сушки или просто хранения в замороженном виде (-20 °C), в зависимости от предполагаемого использования. Высушенную биомассу можно консервировать при комнатной температуре (RT) или хранить в замороженном виде.
4. Процедура экстракции
ПРИМЕЧАНИЕ: Для оценки цитотоксичности, антиоксидантных и антимикробных свойств экстрактов G. gracils in vitro при его приготовлении учитывают два различных параметра: температуру экстракции и тип растворителя.
- Для проведения экстракции высушите биомассу G. gracilis в духовке и измельчите биомассу (например, в бытовой кофемолке) до тех пор, пока порошок не пройдет через сито 200 мкм.
- Взвесьте высушенную биомассу (10 г) и растворите ее в 100 мл растворителя (абсолютного этанола или стерильной воды).
- Перемешать в сосуде, защищенном от света, в течение 30 минут.
- Последовательная экстракция этанола > водой и водой > этанолом при RT, 40 °C и 70 °C.
- Для каждой температуры проводите экстракцию с этанолом и водой отдельно дважды.
- Жидкие экстракты отделяют от оставшейся биомассы фильтрацией через фильтровальную бумагу (ватман No 1) с последующим центрифугированием при 8000 х г в течение 10 мин при RT.
- Повторно используйте оставшуюся биомассу водорослей для дальнейшей экстракции другим растворителем. Если образец был сначала экстрагирован с помощью этанола, затем экстрагируйте его водой, и наоборот.
- Водные экстракты сублимировать и выпарить экстракты этанола во вращающемся испарителе при температуре 40 °C.
- Храните высушенные экстракты при температуре 4 °C.
- Растворяют экстракты в концентрации 50 мг/мл (антимикробные анализы) или 10 мг/мл (антиоксидантные анализы). Водные экстракты растворяют в стерильной воде, а этанольные экстракты — в абсолютном этаноле.
5. Антимикробная активность
ПРИМЕЧАНИЕ: Этанольные и водные экстракты должны быть протестированы по отдельности против Bacillus subtilis subsp . spizizenii (DSM 347), Escherichia coli (DSM 5922) и Listonella anguillarum (DSM 21597). Антимикробные испытания должны проводиться в соответствии с рекомендациями Национального комитета по клиническим лабораторным стандартам (NCCLS, 2012)22. Все культуры были получены из Немецкой коллекции микроорганизмов и клеточных культур (DSMZ). L. anguillarum выращивали на триптическом соевом бульоне (TSB) или триптическом соевом агаре (TSA) с добавлением 1% хлорида натрия (NaCl). Оставшиеся два штамма были выращены на среде LB (VWR Chemicals). Культуры Bacillus subtilis subsp . spizizenii (DSM 347) и Listonella anguillarum (DSM 21597) инкубировали при 30 °C, а Escherichia coli (DSM 5922) — при 37 °C, в соответствии с инструкциями поставщика. Метод микроразведения бульона может быть использован для определения антимикробной активности в жидкой среде, и это должно проводиться в микромасштабе, что позволяет быстро и эффективно определять антимикробный потенциал. Этот недорогой метод позволяет получить результаты всего за 24 часа, поэтому он подходит для определения на ранней стадии наилучших условий экстракции, которые позволяют для данного штамма микроорганизмов получить результаты с точки зрения ингибирующего роста действия. Однако методика требует использования стерильных микропланшетов с крышкой, специфичной для роста микроорганизмов, а также наличия считывателя микропланшетов для длины волны 600 нм.
- Проводят испытания микроразведения бульона с использованием необработанных и круглодонных 96-луночных микропланшетов со 170 мкл бульона Мюллера-Хинтона (MHB), инокулированных 10 мкл стандартизированного посевного материала (при стандарте 0,5 по Мак-Фарланду) и 20 мкл каждого экстракта (50 мг/мл).
- Выдерживают пластины в течение 24 ч при оптимальной температуре для каждого штамма.
- Определение антимикробной активности путем снижения видимой мутности, измеренного путем регистрации оптической плотности (OD 600) в микропланшетном спектрофотометре через 0 ч и 24 ч.
- Выразим результаты в процентах от торможения:
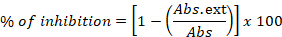
где Abs. ext - это разница в измеренной абсорбции между 0 ч и 24 ч в лунках, содержащих бактериальный штамм, растущий в присутствии экстракта, а Abs относится к той же мере в лунках, содержащих бактериальный штамм и растворитель. - В этом методе включают контрольные реакции, при этом лунки содержат только питательную среду, которая будет отрицательным контролем, а также лунки со средой, выделенной стандартным штаммом, добавленным к растворителю (этанол или вода), и средой с бактериальным штаммом и положительным контрольным антибиотиком (левомицетин).
6. Антиоксидантная активность и количественное определение общих полифенолов
- Общее содержание полифенольных соединений
ПРИМЕЧАНИЕ: Общее содержание полифенольных соединений (TPC) проводят с помощью метода Фолина-Чокальтеу23 и адаптировали к микромасштабу.- Добавьте в каждую лунку 96-луночного микропланшета, защищенного от света, 158 мкл сверхчистой воды, 2 мкл образца и 10 мкл реактива Фолина-Чокальтеу.
ВНИМАНИЕ: Ознакомьтесь с паспортом безопасности реагента Фолина-Чокальтеу, поставляемого поставщиком. - Через 2 мин добавляют 30 мклNa2CO3 (20%).
- После инкубации в темноте при РТ в течение 1 ч измеряют образцы спектрофотометрически при длине волны 755 нм.
- Используйте галловую кислоту (которая позволяет построить калибровочную кривую) или сверхчистую воду (2 мкл) в качестве контроля.
- Выразите результаты в эквивалентах галловой кислоты (мг GAE/г экстракта).
- Добавьте в каждую лунку 96-луночного микропланшета, защищенного от света, 158 мкл сверхчистой воды, 2 мкл образца и 10 мкл реактива Фолина-Чокальтеу.
- 2,2-дифенил-1-пикрилгидразил (ДФПГ) радикальная поглощающая активность
ПРИМЕЧАНИЕ: Антиоксидантная активность экстрактов оценивается в соответствии с описанием Duan et al. (2006)24, адаптированным к микромасштабу- В 96-луночный микропланшет, защищенный от света, помещают по 2 мкл каждого образца (в концентрации 10 мг/мл) и 198 мкл DPPH, растворенного в абсолютном этаноле (0,1 мМ).
ВНИМАНИЕ: См. паспорт безопасности DPPH, поставляемый поставщиком. - Запустите реакцию в течение 30 минут на RT в темноте. Измерьте поглощение на длине волны 517 нм в микропланшетном спектрофотометре.
- Проведите контрольную реакцию с 2 мкл абсолютного этанола/дистиллированной воды и 198 мкл раствора DPPH. Выполните холостое измерение с 2 мкл экстракта и 198 мкл абсолютного этанола.
- Выразите результаты в процентах ингибирования ДФПГ, используя следующее уравнение:
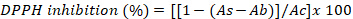
где As - абсорбция экстракта водорослей, Ab - поглощение пустых образцов и Ac - поглощение контроля.
- В 96-луночный микропланшет, защищенный от света, помещают по 2 мкл каждого образца (в концентрации 10 мг/мл) и 198 мкл DPPH, растворенного в абсолютном этаноле (0,1 мМ).
7. Оценка цитотоксичности в клетках эпидермиса
ПРИМЕЧАНИЕ: Цитотоксический эффект in vitro водного и этанолового экстрактов G. gracilis оценивают в кератиноцитах человека (клетки HaCaT - 300493) с помощью колориметрического анализа МТТ, как описано ранее25. Ячейки были получены от Cell Lines Services, Германия (CLS), и метод был выполнен в соответствии с институциональными рекомендациями и инструкциями CLS.
ВНИМАНИЕ: См. паспорт безопасности MTT, поставляемый поставщиком.
- Поддержание клеточных культур
- Культивирование клеток HaCaT в модифицированной среде с высоким содержанием глюкозы (DMEM) Dulbecco с добавлением 10% фетальной бычьей сыворотки (FBS) и 1% раствора антибиотика/антимикотика (амфотерицин B, 0,25 мМ; пенициллин, 60 мМ; стрептомицин, 100 мМ).
- Используйте трипсин-ЭДТА для диссоциации клеток.
ПРИМЕЧАНИЕ: Субкультивирование клеток HaCaT осуществляется после того, как клетки достигают полного слияния. - Культивирование клеток в камере при температуре 37 °C с содержаниемCO2 5% и влажностью 95%.
- Субкультивирование клеток в соответствии с инструкциями биобанка всякий раз, когда культуры достигают 80%-85% слияния.
- Оценка цитотоксичности
- После посева клеток в 96-луночные планшеты и инкубации в течение ночи обработать клетки HaCaT (4 x 104 клеток/лунку) высушенными экстрактами, предварительно растворенными в ДМСО (100 мг/мл). Затем добавляют 2 мкл раствора экстракта к 198 мкл среды и инкубируют планшеты в течение 24 ч.
- Извлеките питательную среду и добавьте 100 мкл МТТ (0,5 мг/мл) к клеткам. Инкубируют клетки в течение 30 мин в темноте при обычных условиях культивирования, упомянутых выше.
- Раствор МТТ удалить и растворить внутриклеточные кристаллы формазана со 100 мкл ДМСО.
- Измерьте поглощение при длине волны 570 нм с помощью микропланшетного ридера. Выразите результаты в процентах от контрольных необработанных клеток.
8. Инновации в пищевой промышленности
- Новый пищевой продукт: Паста с морскими водорослями
- Выбор ингредиентов и рецептуры макаронных изделий
ПРИМЕЧАНИЕ: Выбор ингредиентов был сделан в сотрудничестве с компанией по производству макаронных изделий. Выбор ключевых ингредиентов (описанных в разделе 8.2) был сделан с учетом их легкой доступности и совместимости с существующими производственными линиями, использованием морских ресурсов для получения макаронных изделий с добавленной питательной ценностью.- После выбора ингредиентов разработайте рецептуру в соответствии с предполагаемой питательной ценностью (источник клетчатки, витаминов и минеральных элементов, низкое содержание насыщенных жиров), проанализировав теоретический химический состав состава с помощью электронной таблицы.
- Когда теоретические требования будут выполнены, приступайте к лабораторному производству, как описано в шаге 8.1.2.
- Проведите органолептический тест с полуобученной группой (>10 дегустаторов), чтобы подтвердить необходимость изменения рецептуры или приемлемости рецептуры для следующих этапов.
ПРИМЕЧАНИЕ: Группа ранее была обучена дегустации макаронных изделий и гедонистически оценивала представленные рецептуры в отношении таких атрибутов, как аромат, вкус, запах, текстура и внешний вид.
- Производство макаронных изделий
ПРИМЕЧАНИЕ: Изготовьте образцы макаронных изделий Chifferi с помощью экструдера для макаронных изделий.- В оборудовании смешайте предварительно определенные порции рисовой муки, G. gracilis, и Chlorella vulgaris и добавьте в смесь около 30% воды.
- Для получения сухих макаронных изделий высушите чиффери при 68 °C в течение 42 мин, а затем 5 ч, 30 мин при 76 °C, имитируя промышленный процесс.
- Наконец, упакуйте и запечатайте образцы в вакууме и храните их в темном месте в RT до дальнейшего анализа.
- Анализ питательной ценности
ПРИМЕЧАНИЕ: Для анализа профиля питательной ценности используйте высушенные и мацерированные образцы в трех экземплярах.- Содержание сырого протеина: Проведите анализ общего белка с помощью метода Кьельдаля , адаптированного из Duarte et al. (2022)26, выполнив шаги 8.1.3.2-8.1.3.6.
- Точно взвесьте 1,0 г образца (или дистиллированной воды для бланкового анализа) и смешайте с двумя таблетками Кьельдаля и 25 млH2SO4 в пробирках для сбраживания.
ВНИМАНИЕ: Ознакомьтесь с паспортом безопасности H2SO4 , поставляемым поставщиком. - Проводят разложение образцов в дигесторе по Кьельдалю при 220 °C в течение 30 мин, а затем 90 мин при 400 °C.
- После охлаждения до RT добавляют 80 мл дистиллированной воды и перегоняют сформированный аммиак в 30 мл 4%-ного раствораH3BO3, содержащего бромкрезол зеленый и метиловый красный. Этот этап проходит в щелочных условиях (дистилляция с 40% NaOH с использованием дистиллятора Кьельдаля).
ВНИМАНИЕ: См. паспорт безопасности раствора H 3 BO3,содержащего бромкрезол зеленый, метиловый красный и 40% NaOH, поставляемого поставщиком. - Титруют дистиллированные образцы HCl 0,1 М до тех пор, пока не будет наблюдаться изменение цвета на серовато-розовый.
- Рассчитайте содержание сырого протеина, представленное содержанием азота в образце, и выразите его в г на 100 г по следующему уравнению:
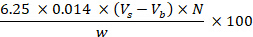
где Vs соответствует объему HCl (мл), используемому при титровании образца; Vb соответствует объему, используемому в заготовке; N соответствует нормальности HCl; w соответствует весу образца (g). - Общее содержание жира: Определите общее содержание жира с помощью метода Фолча, адаптированного из Folch et al. (1957)27, выполнив шаги 8.1.3.8-8.1.3.14.
- Приготовьте реактив Folch, смешав CHCl3 и MeOH в пропорции 2:1 (v:v).
ВНИМАНИЕ: См. Паспорт безопасности реагента Folch, поставляемого поставщиком. - К пробиркам, содержащим 1 г аликвот образцов, добавляют 5 мл реактива Фолч и 0,8 мл дистиллированной воды. Перемешивайте в вихревом в течение 1 мин.
- Затем добавьте еще 5 мл реагента Folch и гомогенизируйте в течение 5 мин. Добавьте 1,2 мл 0,8% раствора NaCl и гомогенизируйте в течение 2 мин.
- Центрифугируют образцы при 7000 х г в течение 10 мин. Органическую фазу (нижнюю фазу) фильтруют через гидрофильную вату и безводный сульфат натрия в стеклянную колбу с круглым дном.
- Чтобы избежать потери образца, повторите этапы добавления 5 мл CHCl3, гомогенизации, центрифугирования и фильтрации в тех же условиях.
- Органический растворитель удалить из собранных органических фаз путем выпаривания под низким давлением и оставить в духовке при 105 °C на 4 часа. Охладите образцы в эксикаторе.
- Рассчитайте содержание жира, выраженное в г на 100 г, используя следующее уравнение:
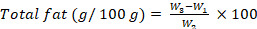
гдеW1 – пустая круглодонная стеклянная колба; W2 — начальный вес образца; W3 — круглодонная стеклянная колба с массой образца. - Содержание сырой клетчатки: Определите содержание сырой клетчатки с помощью методологии, адаптированной из ISO 6865 (2000)28, выполнив шаги 8.1.3.16-8.1.3.22.
- Взвесьте 1 г образца (W0) в стеклянный тигель с фильтрующим дном (ссылка P2) и поместите его в анализатор волокон.
- Первый этап - кислотный гидролиз: добавьте 150 мл предварительно нагретого 1,25%H2SO4 и 2 мл пеногасителя (n-октанола) в колонку каждого тигля; Нагреть до закипания и держать 30 мин.
- После удаления этого растворителя трижды промыть деионизированной водой, чтобы приступить к основному гидролизу. Добавьте 150 мл предварительно подогретого 1,25% NaOH и 5 мл пеногасителя в безжидкостную колонку и выполните ту же процедуру нагрева, что и для кислотного гидролиза.
- Наконец, сделайте тройную стирку со 150 мл ацетона для холодного отжима.
- После этого процесса осторожно извлеките тигли из системы и поместите их в духовку при температуре 150 °C на 1 час. Запишите окончательный вес (W1).
- Поместите тигли в муфельную печь при температуре 500 °C на 3 ч, а затем запишите окончательный вес (W2).
- Рассчитайте содержание сырой клетчатки и выразите результаты в процентах, используя следующее уравнение:
% сырой клетчатки = 100 x (W1-W2)/W0 - Профиль жирных кислот (ЖК): Определите профиль жирных кислот в соответствии с Fernández et al.(2015)29, выполнив шаги 8.1.3.24-8.1.3.29.
ПРИМЕЧАНИЕ: Метиловые эфиры жирных кислот (FAME) получают путем прямого кислотно-катализируемого трансметилирования измельченных лиофилизированных образцов. Все анализы проводятся в трех экземплярах. - Добавьте 2 мл 2% (v/v) раствораH2SO4 в метаноле к образцу 50 мг и залейте смесь при 80 °C в течение 2 ч при непрерывном перемешивании.
ВНИМАНИЕ: См. паспорт безопасности метанола, поставляемого поставщиком. - После охлаждения до RT добавляют 1 мл сверхчистой воды и 2 мл н-гептана в каждый образец, перемешивают смесь в течение 1 мин и центрифугируют в течение 5 мин.
ВНИМАНИЕ: См. паспорт безопасности н-гептана, поставляемый поставщиком. - Восстановите верхнюю фазу н-гептана (органическую), содержащую FAMEs, и перенесите ее во флаконы для газовой хроматографии (ГХ).
- Анализ проводится в газовом хроматографе, оснащенном капиллярной колонкой TR-FAME (внутренний диаметр 60 м × 0,25 мм, толщина пленки 0,25 мкм), автосамплером и пламенно-ионизационным детектором (FID).
- Установите инжектор (безраздельный режим) на 250 °C, а детектор на 280 °C. Установите начальную температуру колонны на 75 °C и держите 1 минуту. Затем поднять при 5 °C/мин до 170 °C и выдержать 10 мин. Затем поднять при 5 °С/мин до 190 °С и подержать еще 10 мин. Наконец, поднимите при 2 °C/мин до 240 °C и держите 10 мин. Используйте гелий в качестве газа-носителя со скоростью потока 1,5 мл/мин. Подача воздуха и водорода со скоростью потока 350 и 35 мл/мин соответственно.
- Определите профиль ЖК, сравнив полученное время удержания со стандартом, и выразите результаты в процентах от общего количества жира.
- Профиль минеральных элементов: Определите минеральные элементы (Ca, P, Mg, Na, K, Fe, Cu, Mn, Zn), проанализированные с помощью ICP-OES, в соответствии с методом, адаптированным из Pinto et al. (2022)30, выполнив шаги 8.1.3.31-8.1.3.34.
- Точно взвесьте около 0,4 г каждого сухого образца и добавьте 7,5 мл HNO3 и 2,5 мл HCl.
ВНИМАНИЕ: См. паспорт безопасности HNO3 и HCl, предоставленный поставщиком. - Разложение происходит в два этапа: повышение температуры от RT до 90 °C в течение 30 минут (и поддержание этой температуры еще 30 минут), а затем 60 минут при 105 °C.
- Растворы для образцов охладить, разбавить их до 25 мл, отфильтровать и хранить в пробирках с этикетками. В каждом разложении выполняйте один и тот же процесс с эталонным материалом и заготовкой. Получение концентрации различных элементов с помощью ИСП-ОЭС.
- Выражают результаты в мг на 100 г фв.
- Содержание углеводов: Рассчитайте содержание углеводов, выполнив шаги 8.1.3.36-8.1.3.37.
- Рассчитайте содержание доступных углеводов (без клетчатки) по разности ранее определенных коэффициентов на 100 г, используя следующее уравнение, согласно Продовольственной и сельскохозяйственной организации ООН (FAO; 2003)31

- Выразите результаты в г на 100 г.
- Влажность и зольность: Оцените содержание влаги и золы, выполнив шаги 8.1.3.39-8.1.3.45.
- Фарфоровые тигли инкубируют в течение 3 ч при 105 °С, охлаждают их в эксикаторе и взвешивают.
- Взвесьте 10 г образца в тигле и поместите его в сушильный шкаф при температуре 105 °C на 3 цикла до тех пор, пока значения последовательных взвешиваний не будут отличаться более чем на 10 мг.
- Рассчитайте содержание влаги, выраженное в г на 100 г fw, используя следующее уравнение:
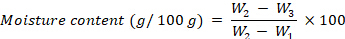
гдеW1 — вес пустого тигля,W2 — вес тигля со свежим образцом,W3 — вес тигля с высушенным образцом. - После определения содержания влаги тигли с высушенными образцами помещают в печь для сжигания при температуре 525 °Cна 4 ч.
- Повторяйте эту процедуру до тех пор, пока последующие взвешивания не будут отличаться более чем на 1 мг.
- Охладите образцы до RT в эксикаторе, а затем взвесьте их.
- Рассчитайте зольность, выраженную в г на 100 г fw, используя следующее уравнение:
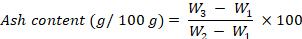
гдеW1 — вес пустого тигля,W2 — вес тигля со свежим образцом,W3 — вес тигля с весом. - Энергетическая ценность: Рассчитайте энергетическую ценность, выполнив шаги 8.1.3.47-8.1.3.48.
- Рассчитайте энергетическую ценность образцов в соответствии с регламентом ЕС:Предоставление информации о пищевых продуктах потребителям (Регламент 1169/2011)32, используя уравнения:
Энергетическая ценность (ккал / 100 г) = 4 х (г белков) + 4 х (г углеводов) + 9 х (г жиров) + 2 х (г клетчатки)
Энергетическая ценность (кДж / 100 г) = 17 x (г белков) + 17 x (г углеводов) + 37 x (г жиров) + 8 x (г клетчатки) - Выразите результаты в килокалориях на 100 г и килоджоулях на 100 г.
- Принятие потребителями
- Оцените потребительскую приемлемость с помощью образцов макаронных изделий, приготовленных в дистиллированной воде в течение 8 минут.
- Проведите потребительские приемочные испытания: оцените внешний вид, цвет, текстуру, запах, морской вкус, общий вкус, общую оценку и намерение покупки образцов.
ПРИМЕЧАНИЕ: Потребительский тест основан на гедонистических тестах, оценивающих внешний вид, цвет, текстуру, запах, морской вкус, общий вкус, общую оценку и намерение совершить покупку по шкале от 1 до 9, где 1 - плохая оценка, а 9 - очень хорошая оценка. - Проводите сенсорные тесты в отдельных сенсорных кабинах в лаборатории сенсорного анализа (с контролем температуры и освещения). Обеспечьте столовые приборы, салфетки и стеклянные чашки с минеральной водой, чтобы очистить нёбо между образцами.
ПРИМЕЧАНИЕ: Дегустаторы в возрасте от 16 до 64 лет из всех слоев общества (n > 80).
- Выбор ингредиентов и рецептуры макаронных изделий
- Йогурт
- Экстракция пигмента
ПРИМЕЧАНИЕ: Выполняйте экстракцию пигмента с помощью метода, описанного в Pereira et al. (2020)18.- Приготовьте растворитель для экстракции, натрий-фосфатный буфер при 0,1 М, с двухосновным (0,03 М) фосфатом натрия (0,03 М) и одноосновным фосфатом натрия (0,07 М). Установите рН на уровне рН 6,8 с помощью NaOH или HCl.
- Взвесьте 1 г G. gracilis и добавьте 50 мл натрий-фосфатного буфера (pH 6,8). Гомогенизируйте в течение 10 минут, затем 10 минут мацерации в ступке и пестике.
- Переложите раствор в пробирку и центрифугу на 20 мин при 12,298 x g (4 °C).
- Смешайте надосадочную жидкость и медленно добавьте 65% сульфата аммония. Когда весь сульфат аммония растворится, накройте раствор алюминиевым листом и оставьте осаждаться при температуре 4 °C на ночь.
ВНИМАНИЕ: См. паспорт безопасности сульфата аммония, поставляемый поставщиком. - Центрифугируют осадок в течение 20 мин при 12,298 x g (4 °C). Извлеките гранулу и растворите в дистиллированной воде (примерно 5 мл).
- Проводят диализ экстракта с помощью трубчатой мембраны (14 кДа) против воды в течение 24 ч с последующей сублимационной сушкой. Храните лиофилизированный экстракт в защищенном от света месте при температуре 4 °C до использования.
- Приготовление йогурта
- Приготовьте натуральный йогурт, смешав 1 л пастеризованного молока, 120 г натурального йогурта, 20 г сахара и 50 г сухого молока в термомиксере в течение 5 мин, 50 °C, скорость 3.
- Поместите смесь в банку-термомиксер в инкубатор при температуре 37 °C на 12 ч.
- Добавьте экстракт, смешав его с йогуртом в концентрации 0,21%. Хранят образцы в отдельных стеклянных колбах при температуре 4 °C до проведения анализа.
- Отдельные порции йогурта без пигмента (контроль) хранить при температуре 4 °C до анализа.
- Стабильность цвета
ПРИМЕЧАНИЕ: Оцените стабильность пигмента в йогуртах с помощью анализа цвета в течение 12 дней. Выполните анализ цвета с помощью колориметра отражения, стандартного наблюдателя с температурой 2 градуса и источника света D65. Результаты представлены в виде координат CIELab с параметрами L (яркость, черно-белый, 0 - 100), a* (зеленый - красный, -60 - 60) и b* (синий - желтый, -60 - 60). Параметр a* имеет положительные значения для красноватых цветов и отрицательные значения для зеленоватых цветов. Параметр b* принимает положительные значения для желтоватых цветов и отрицательные значения для голубоватых. L* — параметр яркости, которая является свойством, согласно которому каждый цвет может считаться эквивалентным элементу оттенков серого между черным и белым33.- Откалибруйте колориметр с помощью белой керамической пластины (L* 88,5, a* 0,32, b* 0,33), предоставленной производителем.
- Заполните ячейку примерно 28 г образца (или контрольной группы) и проанализируйте цвет с помощью программного обеспечения для анализа цветовых данных.
ПРИМЕЧАНИЕ: Для анализа цветовых данных использовалось программное обеспечение SpectraMagic NX. - Выполните показания 5 раз в образцах/контрольных тройках.
- Органолептический анализ
ПРИМЕЧАНИЕ: Проводите органолептическую оценку йогуртов с включением пигмента с помощью треугольного теста (ISO 4120, 2004)34 и гедонистической оценки цвета, вкуса и общей оценки.- Для треугольного теста дайте участникам дискуссии три образца (один образец йогурта с пигментом и два образца контроля или два образца йогурта с пигментом и один контроль) и попросите их выбрать другой образец в зависимости от аромата, текстуры и вкуса. Предоставьте образцы в аналогичных объемах, идентифицированных случайными 3-значными кодами.
- Для гедонистической оценки йогурта с пигментом дайте участникам дискуссии образец йогурта с пигментом и попросите их оценить цвет, вкус и общую оценку по 9-балльной гедонистической шкале (от крайне неприязни до крайней симпатии).
- Экстракция пигмента
Результаты
Антимикробная активность
При интерпретации полученных результатов следует иметь в виду, что чем выше процент ингибирования, тем больше эффективность экстракта в ингибировании роста данного конкретного штамма и, следователь...
Обсуждение
Испытания на антимикробную активность в жидкой среде используются для оценки эффективности антимикробных веществ против микроорганизмов, взвешенных в жидкой среде, и обычно проводятся для определения способности вещества подавлять рост или убивать микроорганизмы35,36,37,38
Раскрытие информации
Авторам нечего раскрывать.
Благодарности
Эта работа была поддержана Португальским фондом науки и технологий (FCT) в рамках стратегических проектов, предоставленных Центру морских и экологических наук MARE-(UIDP/04292/2020 и UIDB/04292/2020) и ассоциированной лаборатории ARNET (LA/P/0069/2020). FCT также профинансировал индивидуальные докторские гранты, присужденные Марте В. Фрейтас (UI/BD/150957/2021) и Татьяне Перейре (2021. 07791. БД). Эта работа также была финансово поддержана проектом HP4A - ЗДОРОВЫЕ МАКАРОНЫ ДЛЯ ВСЕХ (совместная реклама No 039952), софинансируемым ЕФРР - Европейским фондом регионального развития в рамках Программы Португалия 2020 в рамках Оперативной программы конкурентоспособности и интернационализации COMPETE 2020.
Материалы
| Name | Company | Catalog Number | Comments |
| Absolute Ethanol | Aga, Portugal | 64-17-5 | |
| Ammonium Chloride | PanReac | 12125-02-9 | |
| Amphotericin B | Sigma-Aldrich | 1397-89-3 | |
| Analytical scale balance | Sartorius, TE124S | 22105307 | |
| Bacillus subtilis subsp. spizizenii | German Collection of Microorganisms and Cell Cultures (DSMZ) | DSM 347 | |
| Biotin | Panreac AppliChem | 58-85-5 | |
| Centrifuge | Eppendorf, 5810R | 5811JH490481 | |
| Chloramphenicol | PanReac | 56-75-7 | |
| CO2 Chamber | Memmert | N/A | |
| Cool White Fluorescent Lamps | OSRAM Lumilux Skywhite | N/A | |
| Densitometer McFarland | Grant Instruments | N/A | |
| DMEM medium | Sigma-Aldrich | D5796 | |
| DMSO | Sigma-Aldrich | 67-68-5 | |
| DPPH | Sigma, Steinheim, Germany | 1898-66-4 | |
| Escherichia coli (DSM 5922) | German Collection of Microorganisms and Cell Cultures (DSMZ) | DSM5922 | |
| Ethanol 96% | AGA-Portugal | 64-17-5 | |
| Ethylenediaminetetraacetic Acid Disodium Salt Dihydrate (Na2EDTA) | J.T.Baker | 6381-92-6 | |
| Fetal Bovine Serum (FBS) | Sigma-Aldrich | F7524 | |
| Filter Paper (Whatman No.1) | Whatman | WHA1001320 | |
| Flasks | VWR International, Alcabideche, Portugal | N/A | |
| Folin-Ciocalteu | VWR Chemicals | 31360.264 | |
| Gallic Acid | Merck | 149-91-7 | |
| Germanium (IV) Oxide, 99.999% | AlfaAesar | 1310-53-8 | |
| HaCaT cells – 300493 | CLS-Cell Lines Services, Germany | 300493 | |
| Hot Plate Magnetic Stirrer | IKA, C-MAG HS7 | 06.090564 | |
| Iron Sulfate | VWR Chemicals | 10124-49-9 | |
| Laminar flow hood | TelStar, Portugal | 526013 | |
| LB Medium | VWR Chemicals | J106 | |
| Listonella anguillarum | German Collection of Microorganisms and Cell Cultures (DSMZ) | DSM 21597 | |
| Manganese Chloride | VWR Chemicals | 7773.01.5 | |
| Micropipettes | Eppendorf, Portugal | N/A | |
| Microplates | VWR International, Alcabideche, Portugal | 10861-666 | |
| Microplates | Greiner | 738-0168 | |
| Microplates (sterile) | Fisher Scientific | 10022403 | |
| Microplate reader | Epoch Microplate Spectrophotometer, BioTek, Vermont, USA | 1611151E | |
| MTT | Sigma-Aldrich | 289-93-1 | |
| Muller-Hinton Broth (MHB) | VWR Chemicals | 90004-658 | |
| Oven | Binder, FD115 | 12-04490 | |
| Oven | Binder, BD115 | 04-62615 | |
| Penicillin | Sigma-Aldrich | 1406-05-9 | |
| pH meter Inolab | VWR International, Alcabideche, Portugal | 15212099 | |
| Pippete tips | Eppendorf, Portugal | 5412307 | |
| Pyrex Bottles Media Storage | VWR International, Alcabideche, Portugal | 16157-169 | |
| Rotary Evaporator | Heidolph, Laborota 4000 | 80409287 | |
| Rotavapor | IKA HB10, VWR International, Alcabideche, Portugal | 07.524254 | |
| Sodium Carbonate (Na2CO3) | Chem-Lab | 497-19-8 | |
| Sodium Chloride (NaCl) | Normax Chem | 7647-14-5 | |
| Sodium Phosphate Dibasic | Riedel-de Haën | 7558-79-4 | |
| SpectraMagic NX | Konica Minolta, Japan | color data analysis software | |
| Spectrophotometer | Evolution 201, Thermo Scientific, Madison, WI, USA | 5A4T092004 | |
| Streptomycin | Sigma-Aldrich | 57-92-1 | |
| Thiamine | Panreac AppliChem | 59-43-8 | |
| Trypsin-EDTA | Sigma-Aldrich | T4049 | |
| Tryptic Soy Agar (TSA) | VWR Chemicals | ICNA091010617 | |
| Tryptic Soy Broth (TSB) | VWR Chemicals | 22091 | |
| Ultrapure water | Advantage A10 Milli-Q lab, Merck, Darmstadt, Germany | F5HA17360B | |
| Vacuum pump | Buchi, Switzerland | FIS05-402-103 | |
| Vitamin B12 | Merck | 68-19-9 |
Ссылки
- Charoensiddhi, S., Abraham, R. E., Su, P., Zhang, W. Seaweed and seaweed-derived metabolites as prebiotics. Advances in Food and Nutrition Research. 91, 97-156 (2020).
- Roohinejad, S., Koubaa, M., Barba, F. J., Saljoughian, S., Amid, M., Greiner, R. Application of seaweeds to develop new food products with enhanced shelf-life, quality, and health-related beneficial properties. Food Research International. 99, 1066-1083 (2017).
- Hurd, C. L., Harrison, P. J., Bischof, K., Lobban, C. S. . Seaweed Ecology and Physiology. (second). , (2014).
- Freitas, M. V., Mouga, T., Correia, A. P., Afonso, C., Baptista, T. New insights on the sporulation, germination, and nutritional profile of Gracilaria gracilis (Rhodophyta) grown under controlled conditions. Journal of Marine Science and Engineering. 9 (6), 562 (2021).
- Friedlander, M. Advances in cultivation of Gelidiales. Journal of Applied Phycology. 20 (5), 451-456 (2008).
- Matos, G. S., Pereira, S. G., Genisheva, Z. A., Gomes, A. M., Teixeira, J. A., Rocha, C. M. R. Advances in extraction methods to recover added-value compounds from seaweeds: Sustainability and functionality. Foods. 10, 516 (2021).
- Ummat, V., Sivagnanam, S. P., Rajauria, G., O'Donnell, C., Tiwari, B. K. Advances in pre-treatment techniques and green extraction technologies for bioactives from seaweeds. Trends in Food Science & Technology. 110, 90-106 (2021).
- Pérez, M. J., Falqué, E., Domínguez, H., Ravishankar, G., Ambati, R. R. Seaweed Antimicrobials, Present Status and Future Perspectives. Handbook of Algal Technologies andPhytochemicals:Volume I Food, Health and Nutraceutical Applications. , (2019).
- Cavallo, R. A., Acquaviva, M. I., Stabili, L., Cecere, E., Petrocelli, A., Narracci, M. Antibacterial activity of marine macroalgae against fish pathogenic Vibrio species. Central European Journal of Biology. 8, 646-653 (2013).
- Shannon, E., Abu-Ghannam, N. Antibacterial derivatives of marine algae: An overview of pharmacological mechanisms and applications. Marine Drugs. 14 (4), 81 (2016).
- Capillo, G., et al. New insights into the culture method and antibacterial potential of Gracilaria gracilis. Marine Drugs. 16 (12), 492 (2018).
- Francavilla, M., Franchi, M., Monteleone, M., Caroppo, C. The red seaweed Gracilaria gracilis as a multi products source. Marine Drugs. 11 (10), 3754-3776 (2013).
- Sánchez-Ayora, H., Pérez-Jiménez, J., Pérez-Correa, J. R., Mateos, R., Domínguez, R. Antioxidant Capacity of Seaweeds: In Vitro and In Vivo Assessment. Marine Phenolic Compounds. , 299-341 (2023).
- Anil, S., Sweety, V. K., Vikas, B., Betsy-Joseph, B. . Cytotoxicity and Cell Viability Assessment of Biomaterials. Cytotoxicity. , 111822 (2023).
- Mosmann, T. Rapid colorimetric assay for cellular growth and survival: Application to proliferation and cytotoxicity assays. Journal of Immunological Methods. 65 (1-2), 55-63 (1983).
- Roleda, M. Y., et al. Variations in polyphenol and heavy metal contents of wild-harvested and cultivated seaweed bulk biomass: Health risk assessment and implication for food applications. Food Control. 95, 121-134 (2019).
- Souza, K. D., et al. Gastronomy and the development of new food products: Technological prospection. International Journal of Gastronomy and Food Science. 33, 100769 (2023).
- Pereira, T., et al. Optimization of phycobiliprotein pigments extraction from red algae Gracilaria gracilis for substitution of synthetic food colorants. Food Chemistry. 321, 126688 (2020).
- Redmond, S., Green, L., Yarish, C., Kim, J., Neefus, C., Redmond, S., Green, L., Yarish, C., Kim, J., Neefus, C. . New England Seaweed Culture Handbook-Nursery Systems. , (2014).
- Yong, Y. S., Yong, W. T. L., Anton, A. Analysis of formulae for determination of seaweed growth rate. Journal of Applied Phycology. 25 (6), 1831-1834 (2013).
- Patarra, R. F., Carreiro, A. S., Lloveras, A. A., Abreu, M. H., Buschmann, A. H., Neto, A. I. Effects of light, temperature and stocking density on Halopteris scoparia growth. Journal of Applied Phycology. 29 (1), 405-411 (2017).
- NCCLS, National Committee for Clinical Laboratory Standards, Clinical and Laboratory Standards Institute. . Performance Standards for Antimicrobial Disk Susceptibility Tests: Approved Standard. 32, M02-M11 (2012).
- Singleton, V. L., Rossi, J. A. J. Colorimetry to total phenolics with phosphomolybdic acid reagents. American Journal of Enology and Viticulture. 16, 144-158 (1965).
- Duan, X. J., Zhang, W. W., Li, X. M., Wang, B. G. Evaluation of antioxidant property of extract and fractions obtained from a red alga, Polysiphonia urceolata. Food Chemistry. 95 (1), 37-43 (2006).
- Freitas, R., et al. Highlighting the biological potential of the brown seaweed Fucus spiralis for skin applications. Antioxidants. 9 (7), 611 (2020).
- Duarte, A., et al. Seasonal study of the nutritional composition of unexploited and low commercial value fish species from the Portuguese coast. Food Science and Nutrition. 10 (10), 3368-3379 (2020).
- Folch, J., Lees, M., Stanley, G. A simple method for the isolation and purification of total lipides from animal tissues. Journal of Biological Chemistry. 226 (1), 497-509 (1957).
- ISO 6865. Animal feeding stuffs - Determination of crude fibre content - Method with intermediate filtration. Bureau of Indian Standards (BIS). , (2000).
- Fernández, A., Grienke, U., Soler-Vila, A., Guihéneuf, F., Stengel, D. B., Tasdemir, D. Seasonal and geographical variations in the biochemical composition of the blue mussel (Mytilus edulis L.) from Ireland. Food Chemistry. 177, 43-52 (2015).
- Pinto, F., et al. Annual variations in the mineral element content of five fish species from the Portuguese coast. Food Research International. 158, 111482 (2022).
- Food energy - methods of analysis and conversion factors. Available from: https://www.fao.org/fileadmin/templates/food_composition/documents/book_abstracts/Food_energy.pdf (2003)
- . 1169/2011 of the European Parliament and of the Council of 25 -10-2011 Available from: https://eur-lex.europa.eu/legal-content/EN/ALL/?uri=CELEX%3A32011R1169 (2011)
- Pathare, P. B., Opara, U. L., Al-Said, F. A. J. Colour measurement and analysis in fresh and processed foods: A review. Food and Bioprocess Technology. 6 (1), 36-60 (2013).
- ISO 4120. Sensory analysis - Methodology - Triangle test. International Standard. , (2004).
- Reller, L. B., Weinstein, M., Jorgensen, J. H., Ferraro, M. J. Antimicrobial susceptibility testing: A review of general principles and contemporary practices. Clinical Infectious Diseases. 49 (11), 1749-1755 (2009).
- Balouiri, M., Sadiki, M., Ibnsouda, S. K. Methods for in vitro evaluating antimicrobial activity: A review. Journal of Pharmaceutical Analysis. 6 (2), 71-79 (2016).
- Gajic, I., et al. Antimicrobial susceptibility testing: A comprehensive review of currently used methods. Antibiotics. 11 (4), 427 (2022).
- Gonzalez-Pastor, R., et al. Current landscape of methods to evaluate antimicrobial activity of natural extracts. Molecules. 28 (3), 1068 (2023).
- Li, J., et al. Antimicrobial activity and resistance: Influencing factors. Frontiers in Pharmacology. 13 (8), 364 (2017).
- Silva, A., et al. Macroalgae as a source of valuable antimicrobial compounds: Extraction and applications. Antibiotics. 9 (10), 642 (2020).
- Munteanu, I. G., Apetrei, C. Analytical methods used in determining antioxidant activity: A review. International Journal of Molecular Sciences. 22 (7), 3380 (2021).
- Ma, S., et al. Comparison of common analytical methods for the quantification of total polyphenols and flavanols in fruit juices and ciders. Journal of Food Science. 84 (8), 2147-2158 (2019).
- Tziveleka, L. A., Tammam, M. A., Tzakou, O., Roussis, V., Ioannou, E. Metabolites with antioxidant activity from marine macroalgae. Antioxidants. 10 (9), 1431 (2021).
- Ghasemi, M., Turnbull, T., Sebastian, S., Kempson, I. The MTT assay: Utility, limitations, pitfalls, and interpretation in bulk and single-cell analysis. International Journal of Molecular Sciences. 22 (23), 12827 (2021).
- Pereira, T., Barroso, S., Mendes, S., Gil, M. M. Stability, kinetics, and application study of phycobiliprotein pigments extracted from red algae Gracilaria gracilis. Journal of Food Science. 85 (10), 3400-3405 (2020).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеСмотреть дополнительные статьи
This article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены