Method Article
用于半水培根系渗出物分析的多功能玻璃罐系统
摘要
我们提出了一种基于玻璃的半水培实验系统的方案,该系统支持各种系统发育上不同的植物的生长,有或没有微生物。该系统与不同的生长培养基兼容,并允许对下游分析进行无损根系渗出物采样。
摘要
根系分泌物塑造植物-土壤界面,参与养分循环并调节与土壤生物的相互作用。根系渗出物是动态的,并受生物、环境和实验条件的影响。由于其广泛的多样性和低浓度,准确的渗出物谱很难确定,在存在其他生物的自然环境中更是如此,将植物衍生的化合物翻转并自行产生其他化合物。这里介绍的半水培玻璃罐实验系统可以控制生物、环境和实验因素。它允许各种系统发育不同的植物物种在各种不同的生长培养基中生长长达数月,无论有没有微生物。玻璃基设计提供低代谢物背景,可重复使用,因此可重复使用,因此具有高灵敏度和低环境影响。渗出物可以无损取样,如果需要,可以在实验过程中改变条件。该装置与质谱分析和其他下游分析程序兼容。总之,我们提出了一种多功能生长系统,适用于各种条件下的敏感根系渗出物分析。
引言
在人口稠密的土壤中,根际呈现出富含碳的生态位。它由植物根系通过渗出高达 20% 的同化碳形成,并含有与常驻土壤微生物组1、2、3、4、5、6 不同的微生物群落。随着研究人员正在挖掘根系相关微生物的有益功能以及随之而来的可持续农业潜力7,这种通常被称为根际效应的观察结果一直是日益增长的科学努力的焦点。然而,到目前为止,微生物和植物之间的化学对话被认为是根际效应的驱动因素,仍然知之甚少,因此,对农业中开发可靠微生物解决方案的机理理解是有限的8,9,10。
在土壤环境中破译根系分泌物并不容易,因为土壤环境中的代谢物很容易被土壤颗粒吸收并迅速被微生物群落转化,特别是对于具有细根系的植物物种,例如模式植物 拟南芥11。 这就是为什么在大多数研究中,根系渗出物是从水培系统中取样的。在这些微观世界中,植物的地上部分由定制的植物支架或更低调的材料(如网状、琼脂和玻璃珠)固定到位。使用的容器范围从多孔板上的培养皿到带或不带曝气过滤器的各种定制和商业箱12、13、14、15、16、17、18、19。根据系统的不同,植物的生长条件会有很大的不同,并或多或少地反映自然条件。
在这里,我们提出了一种基于玻璃的半水培系统,该系统在实验上是可行的,并产生高度可重复的结果。它易于组装和使用,并且基于常用材料。该系统基于一个装满玻璃珠的玻璃罐,利用了玻璃器皿的可重复使用性和低结合特性(图1)。与水培装置相比,珠子为生长中的植物提供物理支撑并模拟机械阻抗,有助于形成更像土壤的根系结构19,20,21。如果接种了微生物,玻璃珠会呈现细菌附着的表面。
玻璃罐可以关闭以保持无菌,系统的设计允许足够的顶部空间和空气流通,避免湿度饱和的环境。这些罐子适合不同植物物种的长期生长,可以使用不同尺寸的罐子按比例放大和缩小。这里显示了六种植物的应用,涵盖 C3 和 C4 草、双子叶植物和豆科植物。其中包括模式种拟南芥(双子叶植物)、短足双子叶植物(C3单子叶植物)、蒺藜(豆科植物),以及番茄、双子叶植物、小麦(小麦、C3单子叶植物)和双色高粱(高粱、C4单子叶植物)等作物物种。提出的方案包括系统的实验设置、六种植物物种的种子灭菌和发芽、将幼苗移植到罐子、不同的生长培养基、微生物接种、根系分泌物取样和分泌物处理以进行分析。
研究方案
1.幼苗的准备:种子的表面灭菌
注意:除非另有说明,否则种子的表面灭菌和所有后续步骤必须在无菌条件下进行。步骤 1.1 至 1.4 专门用于 拟南芥 种子的表面灭菌。其他植物物种在管大小(取决于种子数量和种子大小)、溶液时间和灭菌溶液方面具有替代变化(表1)。
- 将种子加入微量离心管(最大20mg种子)中,并用70%乙醇覆盖种子。
注意:乙醇是易燃的。请勿在明火附近使用。 - 将封闭的微量离心管移至振荡器中15分钟,并设置旋转,使种子轻轻搅拌。
- 用移液管小心地除去70%乙醇,并用100%乙醇代替。重复步骤 1.2。
- 除去100%乙醇,将微量离心管盖在无菌气流中打开,使种子干燥。
- 种子干燥后,通过轻弹试管或使用无菌镊子将它们均匀地铺在含有 0.7% 植物琼脂的 0.5x Murashige 和 Skoog (MS) 培养基上。关闭琼脂平板并用1.25cm微孔胶带密封。
- 将平板水平放置在生长室的架子上(16小时光照/ 8小时黑暗,22°C白天/18°C夜间,150-160μmolm-2 s-1)。
2.幼苗的准备:将发芽的种子转移到新鲜的盘子中
注意:以下步骤是针对 拟南芥 的,其他物种不需要。
- 发芽后,将5至6株幼苗转移到新的0.7%植物琼脂平板上,用0.5x MS培养基将幼苗线性放置,距顶部约3厘米(参见 图2D中莲座结的位置)。
- 用1.25cm微孔胶带密封琼脂平板,并在生长室中垂直生长(图2D),直到幼苗准备好在发芽后15-18天转移到罐中(表2)。
3.水培系统的准备:罐子设置
- 向每个干净的罐子中加入150mL干净的5mm玻璃珠,并用盖子盖上(图1A)。
注意:在本协议中,5 mm玻璃珠适用于大多数物种22,但可以根据需要调整珠子尺寸。 - 在封闭的罐子上放置足够的铝箔,以覆盖盖子到罐子的连接处并高压灭菌(121°C20分钟)(图1B)。
- 将准备好的罐子盖上盖子,直到植物准备好转移(表2)。
4.水培系统的准备:添加幼苗
- 当幼苗准备好转移到罐子中时(表2),在无菌工作台上取下铝箔和罐子的盖子。
- 如果要在罐子中接种细菌,请在继续执行步骤 4.3 之前执行以下步骤;否则,请跳过步骤 4.2。
- 使用无菌接种环,从琼脂平板上的纯细菌培养物中挑选单个菌落,并将它们悬浮在750μL无菌10mM MgCl2中。重复直到溶液浑浊。
- 可选:用 750 μL 无菌 10 mM MgCl2 洗涤悬浮液 3 次,在 1,000 × g 和室温下离心 5 分钟,然后除去上清液并将沉淀重悬于 750 μL 10 mM MgCl2 中。
- 可选:如果接种几种不同的细菌种类,则在继续之前以相等的比例混合步骤4.2.1-4.2.2中制备的单一菌株的悬浮液。
- 在0.5x MS培养基(pH 5.7至5.9,用KOH调节)或其他选择的生长培养基中将波长为600nm(OD600)的光密度调节至0.2-0.4(参见步骤4.3)。再次测量OD600 以检查溶液是否正确稀释。
注意:KOH具有腐蚀性;戴上手套和实验室外套。 - 在同一培养基中将悬浮液进一步稀释至OD600 0.002-0.004(1:100稀释)。
注意:最终细胞密度将取决于所使用的细菌菌株,但根据我们的经验,该接种物大约相当于 3-6 × 105 个细胞 mL-1。 - 每罐加入 35 mL 最终稀释液。加入 35 mL 无菌生长培养基以对照罐。在植物转移之前,搅拌珠子以均匀地涂上0.5x MS培养基,使根部不会干燥。继续执行步骤 4.4。
- 向每个罐中加入 35 mL 0.5x MS 培养基(pH 5.7 至 5.9,用 KOH 调节)。在植物转移之前,搅拌珠子以均匀地涂上0.5x MS培养基,使根部不会干燥。
注意:生长培养基可以进行修改,例如,通过去除营养物质,添加渗透压以诱导盐胁迫,或使用不同的pH值或生长培养基。注意:KOH具有腐蚀性;戴上手套和实验室外套。 - 将 3-5 株拟南芥 植物放入罐子中,将根系放在玻璃珠之间。
注意:其他物种每个罐子的植物数量不同(表2)。 - 用无菌镊子或勺子移动珠子以覆盖根部并将叶子从培养基中取出(图1C)。
注意: 小心移动植物和珠子,以免折断根部并给植物带来压力。 - 在罐子顶部添加 2 条 1.25 厘米的微孔胶带,然后轻轻地将盖子放在顶部(图 1D-F)。
注意: 请勿向下推盖子,以免阻碍空气交换。 - 用2.5cm微孔胶带覆盖盖子和罐子之间的间隙,以保持无菌,同时允许空气交换,并将罐子放入生长室中(图1G,H)。
- 每个实验条件设置 4-8 个罐子,具体取决于生物学问题和预期的变异性。
- 确保包括生物阴性对照(例如,没有植物的罐子)以解释实验系统的代谢物背景。为阴性对照设置与实验处理(例如,四份)相同的重复数。
- 对于延长的生长期,每周更换生长培养基:用 25 mL 容量移液管取出剩余的生长培养基,并加入 35 mL 新鲜培养基。
5. 根系渗出物的收集
- 当植物达到所需的年龄时,在无菌工作台上取下2.5厘米的微孔胶带和盖子。
注意:对于在我们的生长条件下的 拟南芥 ,发芽后 21 天代表开花前的成熟营养阶段。营养发育阶段因植物种类而异,生长期随植物种类而变化;这个时间可以根据研究问题进行修改。 - 对于无菌测试,将 20 μL 生长培养基等分试样并移液到 LB 琼脂平板上。
- 对于接种罐,分装 100 μL 生长培养基以用于菌落形成单位 (CFU) 计数(例如,在稀释系列23 中)。
注意:根据我们的经验,细菌密度在生长培养基的 10 5-10 8 活细胞 mL-1 以内。
- 对于接种罐,分装 100 μL 生长培养基以用于菌落形成单位 (CFU) 计数(例如,在稀释系列23 中)。
- 用 25 mL 容量移液管尽可能多地去除生长培养基,避免损坏根部。
- 加入 50 mL 收集培养基(例如,20 mM 醋酸铵;pH 5.7-5.9,用 HCl 调节),沿罐壁移液以避免弄湿叶子。用盖子关闭罐子,并在无菌条件下孵育,以获得所需的渗出液收集时间。对于时间敏感的实验,2小时是一个很好的收集窗口。
注意: HCl 具有腐蚀性;戴上手套和实验室外套。为了延长根系渗出物收集时间,再次用胶带包裹盖子,然后将罐子移至生长室。 - 2 小时后,将所需量的收集培养基移入试管中(例如,50 mL 用于使用浓缩渗出物进行测定或分析,或 2 mL 用于直接使用)。将收集的根系渗出物储存在-80°C直至进一步处理或分析。
- 当使用接种罐时,将收集的渗出物在5,000× g 和4°C下离心10分钟,并且仅使用上清液进行分析。或者,用 0.22 μm 或 0.45 μm 过滤器对渗出物进行过滤灭菌。
- 如果实验是时间序列的一部分,则从罐中取出所有剩余的收集培养基,并加入 35 mL 0.5x MS 培养基。在将罐子放回生长室之前,更换盖子和 2.5 厘米胶带。
- 在一个罐子中测量所有植物的根部和芽鲜重,以便稍后按植物重量使根系分泌物正常化。
注意:如果需要,可以另外对植物组织进行采样。
6. 处理根系渗出物进行质谱分析
- 根据分析方法,冷冻干燥根系渗出物以浓缩并除去收集介质(-80°C,0.37mbar,直到不存在液体)。储存在-80°C,直到准备分析。
注:此处提供的数据是在精确质量的四极杆飞行时间仪器上通过流式进样TOF-MS分析生成的。 - 在注入分析仪器之前,根据根新鲜重量,用收集培养基重新配制冻干渗出物或稀释未处理的根系渗出物。
注意:选择的收集介质与质谱仪兼容。然而,根据分析方法的不同,在进样前可能需要脱盐步骤。
结果
这里介绍的实验系统可以控制改变根部渗出剖面的实验和环境因素。我们比较了两个不同实验室在不同光照条件下、植物年龄和植物密度下的拟南芥生长情况(图3)。植物在实验室中看起来很健康(图3A,B)。与长日照条件相比,短日照条件(10小时光照与16小时光照,图3)导致更高的根质量(图3C,D)。同样,在长日照条件下生长的所有植物的总根质量都小于短日照(图3C)。总体而言,不同实验室罐内和罐子之间的生长变异性较低。
玻璃罐系统与各种植物物种和发育阶段兼容。根系渗出物分析的终点通常为21天,因为在我们的实验条件下,许多植物物种在过渡到生殖阶段之前处于成熟的营养阶段(图4A-E)。植物可以很容易地从实验系统中移除,而不会对根系造成明显的损害。因此,确定组织重量或使用组织进行下游分析非常简单。小麦的枝条重量最高,其次是高粱和番茄。高粱的根重最高,其次是小麦和蒺藜。根与芽的比例因物种而异。总体而言,组织重量在 100 毫克和 800 毫克之间变化。
允许根系分泌物收集的实验系统的一个核心方面是用微生物进行受控接种,以研究特定环境中的植物-微生物相互作用。即使重复操作,所展示的实验系统也可以保持无菌状态(参见图5中的"对照"条件),并且可以添加细菌并长时间维持。当用OD600 0.004的共生细菌混合物接种33天龄的拟南芥植物时,细菌持续了12天,这是实验的整个持续时间(图5)。菌落形成单位在生长培养基中甚至增加了100倍,并且还定植在根部(图5C)。接种植物的表型与不育植物的表型没有区别(图5A,B)。
所提出的实验系统允许在许多实验条件下收集渗出液。在这里,我们展示了在醋酸铵或来自同一植物的水中连续收集的 拟南芥 Col-0的渗出曲线(图6A)。将渗出液储存在-80°C直至分析,按根重归一化,并通过质谱分析。根据实验对照(不含植物的罐子)过滤含有植物的罐子样品。在 2,163 种代谢物中,436 种显示出高于背景的信号 (20.16%),并被保留用于分析。其中,416或95%的化合物在实验条件下显示出明显的丰度。然而,26种代谢物不能归因于任何种类的化合物,因此没有定义。大多数代谢物(406或98%)在水收集的渗出物中更丰富。渗出物首先在醋酸铵中连续收集,然后在水中收集可能会影响渗出曲线,因为代谢信号可能会随着时间的推移而稀释。然而,作为第二个时间点收集的水中几乎完全较高的渗出信号并不支持这一假设:纯水中的渗出物收集可能会对植物产生渗透冲击,这会导致代谢物丰度增加与收集溶液的溶剂等摩尔相比(20 mM乙酸铵与0.5x MS培养基等摩尔)。对两种生长条件的已鉴定化合物的化学类别的调查表明,大多数化合物是有机酸及其衍生物(28.6%),其次是有机氧化合物(18%)、有机杂环化合物(14.2%)和脂质(13.2%)。只有一小部分代谢物属于苯丙素类化合物和聚酮类化合物(8.7%)和苯类化合物(6%)。有机氮化合物、核苷、有机硫化合物、生物碱、木脂素和相关化合物占分类化合物的 2% 至 0.5%(图 6B)。此处描述的代谢物分布对应于使用其他类型的根分泌物收集系统24的已发布数据。

图 1:玻璃罐设置。 (A) 装有玻璃珠的罐子。(B) 装有玻璃珠的罐子,准备高压灭菌。(C) 罐子里的幼苗(俯视图)。(D) 用 1.25 厘米微孔胶带装在罐子里(俯视图)中的幼苗。(E) 用 1.25 厘米微孔胶带装在罐子里的幼苗(侧视图)。(F) 装在罐子里的幼苗(侧视图),有 1.25 厘米的微孔胶带和盖子。(G) 完整的罐子设置,将幼苗装在罐子里(侧视图),带有 1.25 厘米微孔胶带、盖子和 2.5 厘米微孔胶带。(H) 完成罐子设置(顶视图)。(I) 植物 21 天大,准备收获(俯视图)。罐子尺寸 147 毫米高 x 100 毫米直径。 请点击这里查看此图的较大版本.
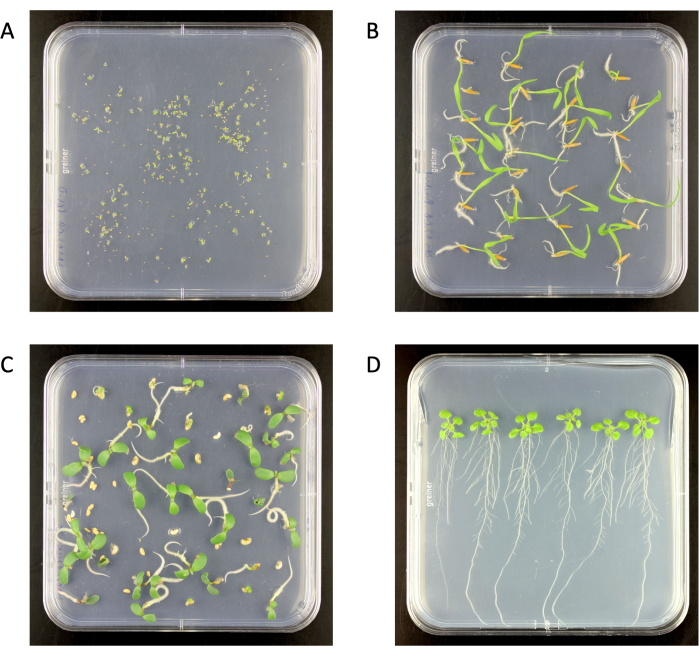
图 2:生长室中 0.5x Murashige 和 Skoog 培养基琼脂平板上的表面灭菌幼苗。 (A) 拟南芥 (6日龄),(B) 短足( 6日龄),(C) 蒺藜 (6日龄),(D) 拟南 芥(18日龄)。琼脂板尺寸 120 mm x 120 mm. 请点击这里查看此图的较大版本.
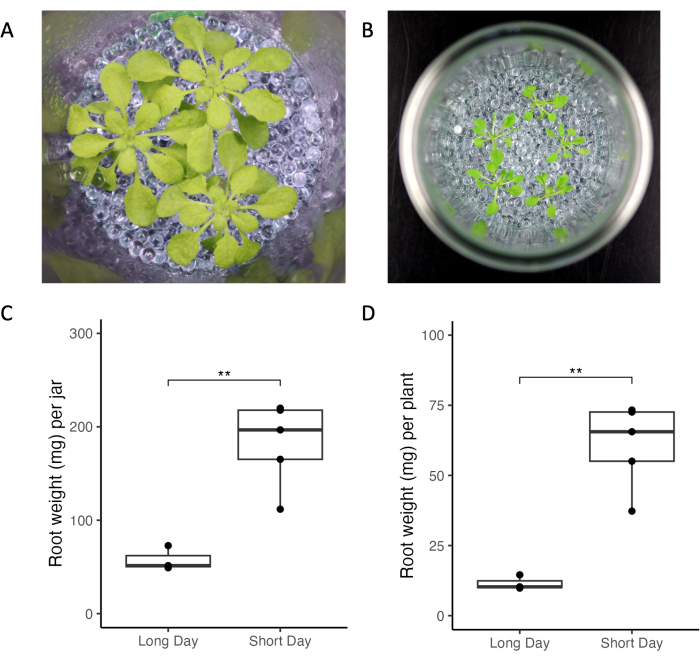
图3:拟南芥Col-0植物在短日照和长日照条件下生长在罐子中。 (A)在短日照条件下生长的三株33天龄植物的罐子(10小时光照/14小时黑暗,220μmolm-2 s-1光强度,21°C白天/18°C夜晚)和(B)罐子,其中有五株21天龄的植物在长日照条件下生长(16小时光照/8小时黑暗, 150-160μmolm-2 s-1光强,22°C白天/18°C夜间)。(C)一罐所有植物和(D)单株植物的根重。** 表示 t 检验的显著性值 (p < 0.05)。请点击这里查看此图的较大版本.
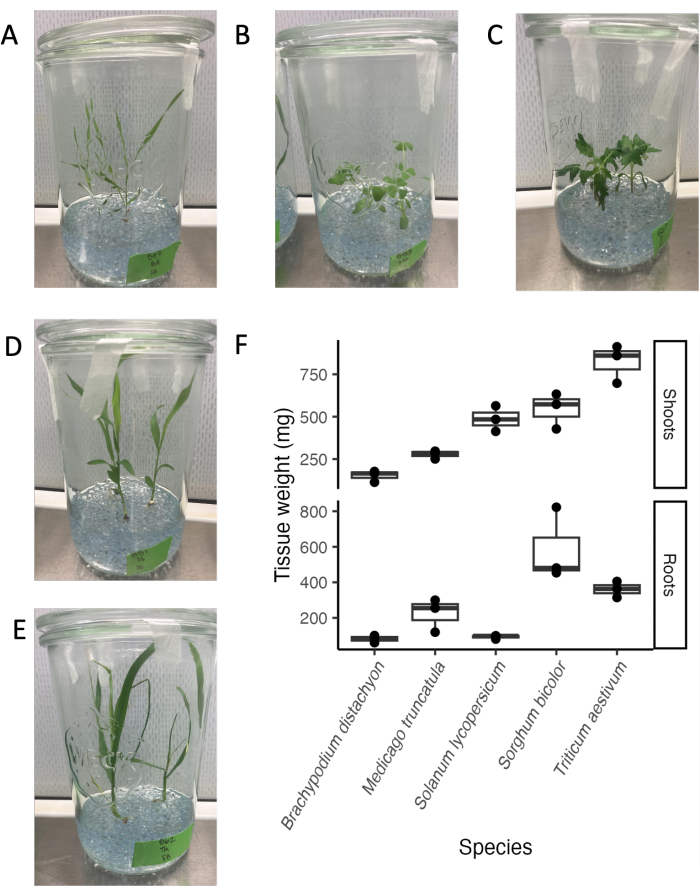
图 4:无菌玻璃罐系统设置中第 21 天的五个系统发育不同的物种。(A)模式单子叶植物 Brachypodium distachyon,(B)模式豆科植物 Medicago truncatula,(C)双子叶植物 Solanum lycopersicum (番茄),(D)双 子叶植物高粱,(E)单子叶植物 Triticum aestivum (小麦)。(F) 在玻璃罐中生长的物种的根和芽的鲜重。 请点击这里查看此图的较大版本.
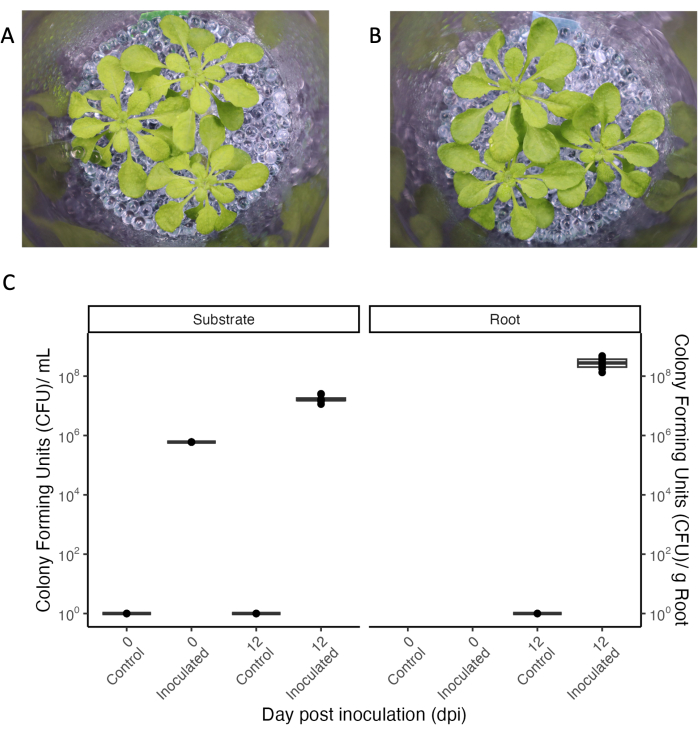
图5:拟 南芥 Col-0(33日龄)在短日照条件下生长。 (A) 在无菌环境中或 (B) 用共生细菌联盟接种 12 天。(C)用于生长基质(左)和根(右)的无菌(对照)和接种罐的菌落形成单元。N = 4 罐用于无菌控制条件,n = 8 罐用于接种条件。 请点击这里查看此图的较大版本.
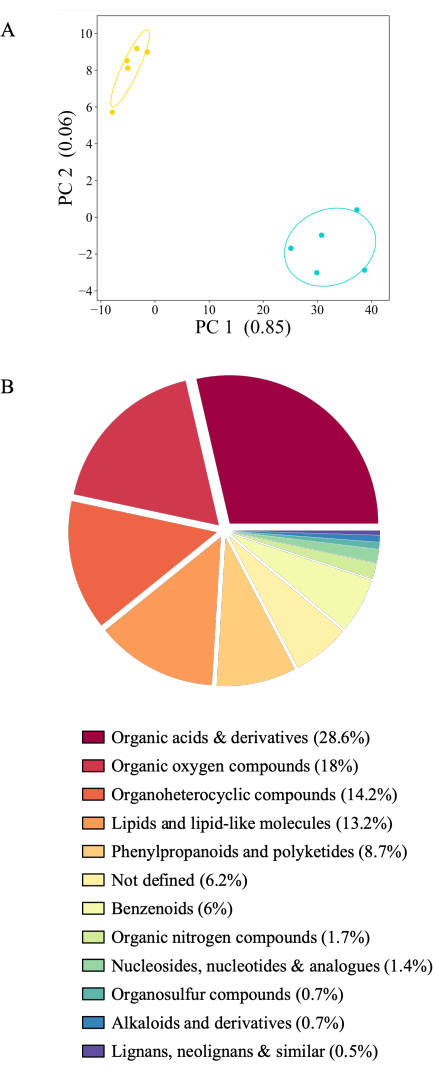
图 6:21 日龄拟 南芥 Col-0 的不同根系渗出物谱。 在无菌的20mM醋酸铵(pH 5.7)中收集渗出物2小时,然后在无菌过滤去离子水中收集2小时。代谢物采用质谱法直接进样检测。(A) 对高于背景水平检测到的436种代谢物进行主成分分析(有植物的罐子与没有植物的罐子的比较)。PC:主成分,并说明方差量。蓝色:水收集的渗出物,黄色:醋酸铵收集的渗出物。(B)根据超类(https://cfb.fiehnlab.ucdavis.edu/)着色的416种代谢物在实验条件下显着不同的饼图(Tukey测试)。 请点击这里查看此图的较大版本.
| 物种 | 种子制备 | 70%乙醇溶液时间(分钟) | 次氯酸钠 (NaClO) 浓度 (v/v % 漂白剂) | 漂白时间(分钟) | ||
| 拟南芥 | 15 | 没有;100%乙醇 | 15 | |||
| Brachypodium distachyon* | 德胡斯克 | 0.5 | 6 | 5 | ||
| 蒺藜*a | 30 | 6 | 30 | |||
| 茄属(Solanum lycopersicum)* | 0.5 | 6 | 5 | |||
| 双色高粱* | 德胡斯克 | 0.5 | 6 | 30 | ||
| 小麦 aestivum* | 德胡斯克 | 0.5 | 12 | 20 | ||
表1:多种物种的表面种子灭菌方法。*在乙醇和漂白剂之间用过滤后的去离子水洗涤 4-5 次,最后洗涤;漂白后孵育3-6小时,每30分钟用过滤的去离子水代替。
| 物种 | 日到罐子 | 工厂数量 |
| Brachypodium distachyon | 4 到 5 | 3 |
| 双色高粱 | 4 到 5 | 3 |
| 小麦 | 4 到 5 | 2 |
| 蒺藜 | 5 到 6 | 3 |
| 茄属(Solanum lycopersicum) | 7 到 8 | 3 |
| 拟南芥 | 17 | 3 至 5 |
表2:各种植物物种的幼苗龄(以天为单位)和每个罐子的植物数量。
讨论
这里介绍的实验系统基于玻璃罐和玻璃珠,因此提供了一个简单、低维护和多功能的半水培系统来研究各种情况下的根部渗出。它已被用于研究不同植物物种的渗出剖面25,渗出对不同生长条件的响应25,以及土壤理化性质对渗出的影响22。该系统适用于在这里测试的所有植物物种,生长期从数周到数月不等。无菌条件的维持很简单,细菌接种也很简单,细菌在分析的 2 周生长期内持续存在。因此,该实验系统不仅允许在无菌条件下受控收集根系分泌物,而且还可用于研究植物与微生物的相互作用。此外,植物生长培养基可以变化以研究对不同营养水平的代谢反应,并且可以通过适应光照条件或使用不同尺寸的罐子来调整生长期。
在水培或半水培条件下研究根系渗出物仍然是该领域的标准,这主要是因为低浓度代谢物的分辨率提高11。许多水培方法依赖于培养皿、多孔板或其他小容器,这些容器允许无菌和高通量,但将实验限制在高湿度环境中生长的小植物或幼苗17,18,26,27。在所展示的玻璃罐设置中,相对较大的罐子提供了足够的顶部空间,从而延长了生长期。微孔带条可确保空气交换,同时保持无菌。因此,即使是大麦和玉米等高大的单子叶植物也可以在玻璃罐中生长数周。拟南芥和三叶草等小型植物在发芽后可以研究 4-5 周,包括营养和生殖阶段。
大型工厂也可以使用替代的水培装置,但这些装置通常需要定制的盒子和入口,这些盒子和入口由网、泡沫板和用于植物支撑的植入篮制成 15,28,29,30。此外,这些设备通常不是无菌的,或者它们需要具有挑战性的设置和维护程序才能使它们免受微生物和/或化学污染。在所提出的实验系统中设置和维持无菌性很简单。此外,玻璃用于罐子和珠子可以减少从塑料中浸出的污染物的存在,并节省资源,因为它可以很容易地清洗和重复使用。
以前已经应用玻璃珠来模拟土壤颗粒。它们在根系渗出采样装置(如渗出阱31)或其他半水培系统19中诱导根系的自然发育。玻璃罐装置利用了这一发展,并将珠子作为微生物的定植表面引入。在土壤中,植物根部周围的微生物组在半固体环境中进化,具有致密的颗粒和充满空气或水的空间。尽管玻璃罐的设置不包括生长培养基的主动曝气,因此较低的液相可能不包含最佳的氧气水平,但较大的珠体积与较小的生长介质体积的结合会产生潮湿但通气的上层相,微生物可以在含氧条件下生长。其他人提议摇晃生长容器26,28或使用与空气泵19,29耦合的管道来维持水培生长系统中的空气供应。然而,这些系统要么被设置为非无菌,要么需要专门的材料和持续的监测来保持无菌。此外,在摇晃的情况下,要注意避免枝条淹没在生长溶液中并损坏根系。然而,如果需要,可以用额外的曝气材料来调整所提出的实验装置。
在所有研究新陈代谢的植物-微生物相互作用研究中要考虑的一个关键方面是微生物降解植物来源的化合物并自行产生代谢物。如果没有专门的无菌实验装置,就不可能区分植物和微生物衍生的代谢物。为了抑制微生物活性并富集植物来源的化合物,Oburger等人提出对根系渗出物取样溶液进行化学灭菌以抑制细菌降解32。可以在所提出的实验系统中研究化学抑制剂的作用,比较用或不用抑制剂处理的无菌植物与非无菌植物的渗出曲线。
所展示的玻璃罐设置的一个主要限制是,与土壤相比,生长条件仍然非常人工。土壤种植植物的渗出物通常从渗滤系统13收集,其中溶剂流过收集在生长容器的底部,或土壤-水培混合系统,其中植物最初在土壤中生长,然后转移到水培条件16,33。与玻璃罐设置相比,这些程序通常是破坏性的,不允许在不断变化的生长环境中随着时间的推移进行多次收集。此外,在渗滤系统中,土壤背景与渗出物一起取样,而在土壤-水培混合系统中,通过转移到水培条件进行渗出物收集,可以规避土壤代谢背景高的问题。尽管已经实施了恢复时间以减少通过受伤根系的代谢物泄漏11,但植物转移非常具有破坏性,伤口可能会持续存在,并且植物代谢可能会因转移到水培条件而改变。此外,在许多情况下,渗透冲击是通过将植物转移到水中而不是合适的生长溶液中而引起的16,33。在所提出的方案中,生长溶液与等摩尔溶液交换以保持渗透平衡,仍然允许在短时间内捕获渗出物。在许多已发表的研究中,生长溶液的改变是常见的做法,并且可以在水培装置中轻松实现,而不会造成根部损伤12,16,26,34。由于其多功能性,所提出的实验系统可以很容易地适应模拟更多的自然条件,例如,通过使用无菌或非无菌土壤提取物作为生长溶液,无论是否存在固体土壤颗粒。向自然条件的逐渐变化允许研究不同理化土壤性质和微生物存在对植物新陈代谢和生理学的影响。在科学界对各种环境中的渗出有很好的了解之前,最好同时使用土壤和水培系统,因为这两种设置都有其优点和局限性13.
总之,所提出的半水培、玻璃基实验装置因其简单性和应用的高度通用性而脱颖而出。它提供了一种可行、低成本的方法来收集和研究无菌条件下的渗出物,或结合微生物和植物-微生物相互作用。
披露声明
作者没有需要披露的利益冲突。
致谢
我们感谢来自瑞士苏黎世联邦理工学院的 Nicola Zamboni 教授和 Uwe Sauer 教授通过直接注射确定根部渗出曲线,并感谢巴塞尔大学的 Klaus Schläppi 教授对 拟南芥 共生细菌的研究。此外,我们还感谢瑞士国家科学基金会(PR00P3_185831 J.S.,支持 S.M.、A.S.、E.M.S.)和 PSC-先正达奖学金计划(授予 Klaus Schläppi 教授和 J.S.,支持 C.J.)。
材料
| Name | Company | Catalog Number | Comments |
| Agar powder for bacteriology | VWR | 20767.298 | |
| Aluminum foil | FORA GmbH | ||
| Ammonium acetate | Sigma-Aldrich | 32301-1KG | ACS reagent, Eur >- 98% |
| Autoclave VX-150 | Systec | 1150 | |
| Balance | Sartorius | QUINTIX64-1S | |
| Centrifuge | Hermle Labortechnik GmbH | 305.00 V05 | |
| Cuvettes | Greiner Bio-One | 613101 | |
| Difco LB Broth, Lennox | BD | 240210 | |
| Ethanol | Reuss-Chemie AG | RC-A15-A-005L | |
| Filtered deionized water | Merck Millipore | Milli-Q IQ7000 | |
| Glass beads | Carl Roth | HH56.1 | 5 mm |
| Hydrochloric acid | Merk | 1.00317.1000 | |
| Inoculation loop | Karl Hammacher GmbH | HWO_070-21 | |
| Jars | Weck | 105741 | 850 mL |
| Lyophilizer | Christ | Alpha 2-4 LSCplus | |
| Magnesium chloride hexahydrate | Carl Roth | 2189.1 | |
| Matrix Orbital thermoshaker | IKA | 10006248 | |
| Microcentrifuge tube | Sarstedt AG & Co. KG | 72.695.500 | SafeSeal reaction tube, 2 mL, PP |
| Micropore tape | 3M | 1530-0 | 1.25 cm x 9.1 m |
| Micropore tape | 3M | 1530-1 | 2.5 cm x 9.1 m |
| Murashige & Skoog Medium (MS) | Duchefa Biochemie | M0221.0050 | |
| Growth chamber | Percival | SE41-TLCU4 | 16 hour light/8 dark. 22 °C day/18 night |
| Phyto agar | Duchefa Biochemie | P1003.1000 | |
| Potassium hydroxide | Sigma-Aldrich | 8.14353.0100 | |
| SmartSpec Plus Spectrophotometer | Bio-Rad | 170-2525 | |
| Sodium hypochlorite solution, 12% Cl | Carl Roth | 9062.4 | |
| Square petri dish | Greiner Bio-One | 688102 | 120x120x17 mm, with vents |
| Stericup Quick release | Millipore | S2GPU05RE | 0.22 µm PES, 500 mL |
| Sterile bench | FASTER S.r.l. | FlowFast H 18 |
参考文献
- Sasse, J., Martinoia, E., Northen, T. Feed your friends: do plant exudates shape the root microbiome. Trends in Plant Science. 23 (1), 25-41 (2018).
- Lundberg, D. S., et al. Defining the core Arabidopsis thaliana root microbiome. Nature. 488 (7409), 86-90 (2012).
- Lopez, J. L., et al. Growth rate is a dominant factor predicting the rhizosphere effect. The ISME Journal. 17 (9), 1396-1405 (2023).
- Hu, L., et al. Root exudate metabolites drive plant-soil feedbacks on growth and defense by shaping the rhizosphere microbiota. Nature Communications. 9 (1), 2738(2018).
- Edwards, J., et al. Structure, variation, and assembly of the root-associated microbiomes of rice. Proceedings of the National Academy of Sciences. 112 (8), 911-920 (2015).
- Bulgarelli, D., et al. Structure and function of the bacterial root microbiota in wild and domesticated barley. Cell Host Microbe. 17 (3), 392-403 (2015).
- Li, J., Wang, J., Liu, H., Macdonald, C. A., Singh, B. K. Application of microbial inoculants significantly enhances crop productivity: A meta-analysis of studies from 2010 to 2020. Journal of Sustainable Agriculture and Environment. 1 (3), 216-225 (2022).
- Escudero-Martinez, C., Bulgarelli, D. Engineering the crop microbiota through host genetics. Annual Review of Phytopathology. 61, 257-277 (2023).
- Poppeliers, S. W., Sanchez-Gil, J. J., de Jonge, R. Microbes to support plant health: understanding bioinoculant success in complex conditions. Current Opinion in Microbiology. 73, 102286(2023).
- O'Callaghan, M., Ballard, R. A., Wright, D. Soil microbial inoculants for sustainable agriculture: Limitations and opportunities. Soil Use and Management. 38 (3), 1340-1369 (2022).
- Oburger, E., Jones, D. L. Sampling root exudates - Mission impossible. Rhizosphere. 6, 116-133 (2018).
- Yuan, J., et al. Root exudates drive the soil-borne legacy of aboveground pathogen infection. Microbiome. 6 (1), 156(2018).
- Vismans, G., et al. Coumarin biosynthesis genes are required after foliar pathogen infection for the creation of a microbial soil-borne legacy that primes plants for SA-dependent defenses. Scientific Reports. 12 (1), 22473(2022).
- Strehmel, N., Böttcher, C., Schmidt, S., Scheel, D. Profiling of secondary metabolites in root exudates of Arabidopsis thaliana. Phytochemistry. 108, 35-46 (2014).
- Song, Y., Pieterse, C. M. J., Bakker, P., Berendsen, R. L. Collection of sterile root exudates from foliar pathogen-inoculated plants. Methods in Molecular Biology. 2232, 305-317 (2021).
- Oburger, E., et al. A quick and simple spectrophotometric method to determine total carbon concentrations in root exudate samples of grass species. Plant Soil. 478 (1-2), 273-281 (2022).
- Koprivova, A., et al. Root-specific camalexin biosynthesis controls the plant growth-promoting effects of multiple bacterial strains. Proceedings of the National Academy of Sciences of the United States of America. 116 (31), 15735-15744 (2019).
- Gao, J., et al. Ecosystem fabrication (EcoFAB) protocols for the construction of laboratory ecosystems designed to study plant-microbe interactions. Journal of Visualized Experiments. (134), e57170(2018).
- Lopez-Guerrero, M. G., et al. A glass bead semi-hydroponic system for intact maize root exudate analysis and phenotyping. Plant Methods. 18 (1), 25(2022).
- Boeuf-Tremblay, V., Plantureux, S., Guckert, A. Influence of mechanical impedance on root exudation of maize seedlings at two development stages. Plant and Soil. 172, 279-287 (1995).
- Groleau-Renaud, V., Plantureux, S., Guckert, A. Influence of plant morphology on root exudation of maize subjected to mechanical impedance in hydroponic conditions. Plant and Soil. 201, 231-239 (1998).
- Sasse, J., et al. Root morphology and exudate availability are shaped by particle size and chemistry in Brachypodium distachyon. Plant Direct. 4 (7), 00207(2020).
- Katagiri, F., Thilmony, R., He, S. Y. The Arabidopsis thaliana-Pseudomonas syringae interaction. Arabidopsis Book. 1, 0039(2002).
- Monchgesang, S., et al. Natural variation of root exudates in Arabidopsis thaliana-linking metabolomic and genomic data. Scientific Reports. 6, 29033(2016).
- McLaughlin, S., Zhalnina, K., Kosina, S., Northen, T. R., Sasse, J. The core metabolome and root exudation dynamics of three phylogenetically distinct plant species. Nature Communications. 14 (1), 1649(2023).
- Badri, D. V., Chaparro, J. M., Zhang, R., Shen, Q., Vivanco, J. M. Application of natural blends of phytochemicals derived from the root exudates of Arabidopsis to the soil reveal that phenolic-related compounds predominantly modulate the soil microbiome. Journal of Biological Chemistry. 288 (7), 4502-4512 (2013).
- Massalha, H., Korenblum, E., Malitsky, S., Shapiro, O. H., Aharoni, A. Live imaging of root-bacteria interactions in a microfluidics setup. Proceedings of the National Academy of Sciences of the United States of America. 114 (17), 4549-4554 (2017).
- Nathoo, N., Bernards, M. A., MacDonald, J., Yuan, Z. C. A hydroponic co-cultivation system for simultaneous and systematic analysis of plant/microbe molecular interactions and signaling. Journal of Visualized Experiments. (125), e55955(2017).
- Nguyen, N. T., McInturf, S. A., Mendoza-Cozatl, D. G. Hydroponics: a versatile system to study nutrient allocation and plant responses to nutrient availability and exposure to toxic elements. Journal of Visualized Experiments. (113), e54317(2016).
- Yi, Y., Li, Z., Kuipers, O. P. Plant-microbe interaction: transcriptional response of Bacillus Mycoides to potato root exudates. Journal of Visualized Experiments. (137), e57606(2018).
- Phillips, R. P., Erlitz, Y., Bier, R., Bernhardt, E. S. New approach for capturing soluble root exudates in forest soils. Functional Ecology. 22 (6), 990-999 (2008).
- Oburger, E., et al. Root exudation of phytosiderophores from soil-grown wheat. New Phytologist. 203 (4), 1161-1174 (2014).
- Neal, A. L., Ahmad, S., Gordon-Weeks, R., Ton, J. Benzoxazinoids in root exudates of maize attract Pseudomonas putida to the rhizosphere. PLoS One. 7 (4), e35498(2012).
- Miao, Y., et al. Exogenous salicylic acid alleviates salt stress by improving leaf photosynthesis and root system architecture in cucumber seedlings. Scientia Horticulturae. 272, 109577(2020).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。