Method Article
Un sistema versátil de frascos de vidrio para el perfilado de exudado de raíces semihidropónico
En este artículo
Resumen
Presentamos un protocolo para un sistema experimental semihidropónico basado en vidrio que apoya el crecimiento de una variedad de plantas filogenéticamente distintas con o sin microbios. El sistema es compatible con diferentes medios de cultivo y permite el muestreo no destructivo del exudado de la raíz para el análisis posterior.
Resumen
Los exudados de las raíces dan forma a la interfaz planta-suelo, participan en el ciclo de nutrientes y modulan las interacciones con los organismos del suelo. Los exudados de las raíces son dinámicos y están moldeados por condiciones biológicas, ambientales y experimentales. Debido a su amplia diversidad y bajas concentraciones, los perfiles precisos de exudado son difíciles de determinar, más aún en entornos naturales donde otros organismos están presentes, transformando compuestos derivados de plantas y produciendo compuestos adicionales ellos mismos. El sistema experimental de frascos de vidrio semihidropónicos que se presenta aquí permite controlar los factores biológicos, ambientales y experimentales. Permite el crecimiento de varias especies de plantas filogenéticamente distintas durante un máximo de varios meses con o sin microbios, en una variedad de medios de crecimiento diferentes. El diseño a base de vidrio ofrece un fondo de metabolitos bajos para una alta sensibilidad y un bajo impacto ambiental, ya que se puede reutilizar. Los exudados se pueden muestrear de forma no destructiva, y las condiciones pueden modificarse en el transcurso de un experimento si se desea. La configuración es compatible con el análisis de espectrometría de masas y otros procedimientos analíticos posteriores. En resumen, presentamos un sistema de crecimiento versátil adecuado para el análisis sensible del exudado radicular en una variedad de condiciones.
Introducción
Dentro de suelos densamente poblados, la rizosfera presenta un nicho rico en carbono. Está formado por las raíces de las plantas a través de la exudación de hasta un 20% de carbono asimilado y alberga comunidades microbianas que son distintas del microbioma residente del suelo 1,2,3,4,5,6. A medida que los investigadores están aprovechando las funciones beneficiosas de los microbios asociados a las raíces y el potencial para la agricultura sostenibleque lo acompaña, esta observación, a menudo denominada efecto rizosfera, ha sido el foco de crecientes esfuerzos científicos. Sin embargo, hasta ahora, el diálogo químico entre microorganismos y plantas, que se propone como el impulsor del efecto rizosfera, sigue siendo poco conocido y, por lo tanto, la comprensión mecanicista para el desarrollo de soluciones microbianas confiables en la agricultura es limitada 8,9,10.
Descifrar los exudados de las raíces en ambientes de suelo donde los metabolitos son fácilmente absorbidos por las partículas del suelo y rápidamente renovados por las comunidades microbianas no es sencillo, especialmente para las especies de plantas con sistemas de raíces finas, como la planta modelo Arabidopsis thaliana11. Esta es la razón por la que, en la mayoría de los estudios, los exudados de las raíces se muestrean de sistemas hidropónicos. En estos microcosmos, las partes aéreas de las plantas se mantienen en su lugar mediante soportes de plantas personalizados o materiales más discretos como malla, agar y perlas de vidrio. Los contenedores utilizados van desde placas de Petri hasta placas de pocillos múltiples hasta varias cajas personalizadas y comerciales con o sin filtros de aireación 12,13,14,15,16,17,18,19. Dependiendo del sistema, las condiciones de crecimiento de las plantas variarán mucho y reflejarán las condiciones naturales en mayor o menor medida.
Aquí, presentamos un sistema semihidropónico a base de vidrio que es experimentalmente susceptible y produce resultados altamente reproducibles. Es fácil de ensamblar y usar y se basa en materiales comúnmente disponibles. El sistema se basa en un frasco de vidrio lleno de perlas de vidrio, aprovechando la naturaleza reutilizable y las propiedades de baja ligereza de la cristalería (Figura 1). Las perlas proporcionan soporte físico para la planta en crecimiento y simulan la impedancia mecánica, lo que contribuye a una arquitectura radicular más parecida a la del suelo en comparación con las configuraciones hidropónicas 19,20,21. Si se inoculan con microbios, las perlas de vidrio presentan superficies a las que se adhieren las bacterias.
El frasco de vidrio se puede cerrar para mantener la esterilidad y el sistema está diseñado para permitir suficiente espacio libre y circulación de aire, evitando un ambiente saturado de humedad. Los frascos son adecuados para el crecimiento prolongado de diferentes especies de plantas y se pueden escalar hacia arriba y hacia abajo utilizando frascos de diferentes tamaños. Aquí se muestran las aplicaciones de seis especies de plantas, que abarcan gramíneas C3 y C4, dicotiledóneas y leguminosas. Entre ellas se encuentran las especies modelo A. thaliana (dicotiledónea), Brachypodium distachyon (monocotiledónea C3), Medicago truncatula (leguminosa), así como especies de cultivos como Solanum lycopersicum (tomate, dicotiledónea), Triticum aestivum (trigo, monocotiledónea C3) y Sorghum bicolor (sorgo, monocotiledónea C4). El protocolo presentado incluye la configuración experimental del sistema, la esterilización de semillas y la germinación de seis especies de plantas, el trasplante de plántulas a frascos, diferentes medios de crecimiento, la inoculación de microbios, el muestreo de exudado de raíces y el procesamiento de exudado para análisis.
Protocolo
1. Preparación de plántulas: Esterilización superficial de semillas
NOTA: La esterilización de la superficie de las semillas y todos los pasos siguientes deben realizarse en condiciones estériles, a menos que se indique lo contrario. Los pasos 1.1 a 1.4 son específicos para la esterilización superficial de semillas de A. thaliana . Otras especies de plantas tienen variaciones alternativas en el tamaño del tubo (dependiendo del número de semillas y el tamaño de la semilla), el tiempo en las soluciones y las soluciones de esterilización (Tabla 1).
- Agregue las semillas a un tubo de microcentrífuga (máximo 20 mg de semillas) y cubra las semillas con etanol al 70%.
PRECAUCIÓN: El etanol es inflamable. No lo use cerca de llamas abiertas. - Mueva los tubos cerrados de la microcentrífuga a una coctelera durante 15 minutos y ajuste la rotación de modo que las semillas se agiten suavemente.
- Retire con cuidado el etanol al 70% con una pipeta y reemplácelo con etanol al 100%. Repita el paso 1.2.
- Retire el etanol al 100% y seque las semillas dejando las tapas de los tubos de microcentrífuga abiertas en un flujo de aire estéril.
- Una vez que las semillas estén secas, extiéndalas uniformemente en un medio Murashige and Skoog (MS) 0,5x con fito agar al 0,7% moviendo el tubo o usando pinzas estériles. Cierre las placas de agar y séllelas con cinta de microporos de 1,25 cm.
- Coloque las placas horizontalmente en un estante de la cámara de crecimiento (16 h luz/8 h oscuridad, 22 °C día/18 °C noche, 150-160 μmol m-2 s-1).
2. Preparación de plántulas: Transferencia de semillas germinadas a platos frescos
NOTA: Los siguientes pasos son específicos para A. thaliana y no son necesarios para otras especies.
- Después de la germinación, transfiera de 5 a 6 plántulas a nuevas placas de fito agar al 0,7% con medio MS 0,5x colocando las plántulas linealmente, aproximadamente a 3 cm de la parte superior (vea la posición de la roseta en la Figura 2D).
- Selle las placas de agar con cinta de microporos de 1,25 cm y crezca verticalmente en la cámara de crecimiento (Figura 2D) hasta que las plántulas estén listas para ser transferidas a frascos a los 15-18 días después de la germinación (Tabla 2).
3. Preparación del sistema hidropónico: configuración del frasco
- Agregue 150 ml de perlas de vidrio limpias de 5 mm a cada frasco limpio y cierre con la tapa (Figura 1A).
NOTA: En este protocolo, las cuentas de vidrio de 5 mm son adecuadas para la mayoría de las especies22, pero el tamaño de la cuenta se puede ajustar si se desea. - Coloque suficiente papel de aluminio sobre los frascos cerrados para cubrir la unión de la tapa al frasco y el autoclave (121 °C durante 20 min) (Figura 1B).
- Mantenga los frascos preparados tapados hasta que las plantas estén listas para ser transferidas (Tabla 2).
4. Preparación del sistema hidropónico: Adición de plántulas
- Cuando las plántulas estén listas para ser transferidas a frascos (Tabla 2), retire el papel de aluminio y las tapas de los frascos en el banco estéril.
- Si los frascos se van a inocular con bacterias, realice los siguientes pasos antes de pasar al paso 4.3; de lo contrario, omita el paso 4.2.
- Utilizando un asa de inoculación estéril, recoja colonias individuales de cultivos bacterianos puros en placas de agar y suspenda en 750 μL de MgCl estéril de 10 mM2. Repita hasta que la solución esté turbia.
- Opcional: Lavar la suspensión 3 veces con 750 μL de MgClestéril de 10 mM 2 por centrifugación de 5 min a 1.000 × g y temperatura ambiente, seguido de la eliminación del sobrenadante y la resuspensión del pellet en 750 μL de 10 mM MgCl2.
- Opcional: Si se inoculan varias especies bacterianas diferentes, mezcle las suspensiones de cepas individuales preparadas en los pasos 4.2.1-4.2.2 en proporciones iguales antes de continuar.
- Ajuste la densidad óptica en la longitud de onda de 600 nm (OD600) a 0,2-0,4 en un medio MS de 0,5x (pH de 5,7 a 5,9, ajustado con KOH) u otro medio de crecimiento de elección (consulte el paso 4.3). Mida de nuevo el OD600 para comprobar si la solución se ha diluido correctamente.
PRECAUCIÓN: El KOH es corrosivo; Use guantes y bata de laboratorio. - Diluir la suspensión hasta OD600 0,002-0,004 en el mismo medio (dilución 1:100).
NOTA: Las densidades celulares finales dependerán de la cepa bacteriana utilizada, pero en nuestra experiencia, este inóculo corresponde aproximadamente a 3-6 × 105 células mL-1. - Agregue 35 ml de la dilución final por frasco. Agregue 35 ml de medio de crecimiento estéril a los frascos de control. Revuelva las cuentas para cubrir uniformemente con medios MS 0.5x antes de transferir la planta para que las raíces no se sequen. Continúe con el paso 4.4.
- Agregue 35 ml de medio MS 0.5x a cada frasco (pH 5.7 a 5.9, ajuste con KOH). Revuelva las perlas para cubrir uniformemente con medios MS 0.5x antes de transferir la planta para que las raíces no se sequen.
NOTA: El medio de cultivo puede modificarse, por ejemplo, mediante la eliminación de nutrientes, la adición de osmolitos para inducir estrés salino o el uso de diferentes valores de pH o medios de crecimiento. PRECAUCIÓN: El KOH es corrosivo; Use guantes y bata de laboratorio. - Coloque de 3 a 5 plantas de A. thaliana en un frasco colocando los sistemas de raíces entre las cuentas de vidrio.
NOTA: El número de plantas por frasco es diferente para otras especies (Tabla 2). - Mueva las cuentas con pinzas o cucharas estériles para cubrir las raíces y levante las hojas del medio (Figura 1C).
NOTA: Mueva con cuidado las plantas y las cuentas para evitar romper las raíces y estresar las plantas. - Agregue 2 tiras de cinta de microporos de 1,25 cm en la parte superior de los frascos y coloque suavemente la tapa en la parte superior (Figura 1D-F).
NOTA: No presione la tapa hacia abajo para evitar obstruir el intercambio de aire. - Cubra el espacio entre la tapa y el frasco con cinta de microporos de 2,5 cm para mantener la esterilidad y permitir el intercambio de aire, y coloque los frascos en una cámara de crecimiento (Figura 1G, H).
- Coloque de 4 a 8 frascos por condición experimental, dependiendo de la cuestión biológica y la variabilidad esperada.
- Asegúrese de incluir controles biológicos negativos (por ejemplo, frascos sin plantas) para tener en cuenta el fondo de metabolitos del sistema experimental. Establezca el mismo número de réplicas para los controles negativos que para los tratamientos experimentales (p. ej., cuadruplicados).
- Para períodos de crecimiento prolongados, reemplace el medio de crecimiento semanalmente: retire el resto del medio de crecimiento con una pipeta volumétrica de 25 ml y agregue 35 ml de medio fresco.
5. Recolección de exudados radiculares
- Cuando las plantas alcancen la edad deseada, retire la cinta de microporos de 2,5 cm y la tapa en el banco estéril.
NOTA: Para A. thaliana en nuestras condiciones de crecimiento, 21 días después de la germinación representa una etapa vegetativa madura antes del inicio de la floración. La etapa de desarrollo vegetativo es específica de la especie vegetal, y el momento del período de crecimiento cambia con las especies vegetales; Este tiempo puede modificarse dependiendo de la pregunta de investigación. - Para las pruebas de esterilidad, alícuota 20 μL de medio de crecimiento y pipetear en placas de agar LB.
- En el caso de los frascos inoculados, alícuota 100 μL de medio de crecimiento para utilizar en los recuentos de unidades formadoras de colonias (UFC) (p. ej., en una serie de diluciones23).
NOTA: En nuestra experiencia, las densidades bacterianas oscilan entre 105-10 8 células vivas mL-1 del medio de crecimiento.
- En el caso de los frascos inoculados, alícuota 100 μL de medio de crecimiento para utilizar en los recuentos de unidades formadoras de colonias (UFC) (p. ej., en una serie de diluciones23).
- Retire la mayor cantidad posible de medio de cultivo con una pipeta volumétrica de 25 ml, evitando dañar las raíces.
- Agregue 50 ml de medio de recolección (por ejemplo, 20 mM de acetato de amonio; pH 5.7-5.9 ajustado con HCl) pipeteando a lo largo de las paredes del frasco para evitar mojar las hojas. Cerrar los frascos con tapa e incubarlos en condiciones estériles durante el tiempo deseado de recolección del exudado. Para experimentos urgentes, 2 h es una buena ventana de recolección.
PRECAUCIÓN: El HCl es corrosivo; Use guantes y bata de laboratorio. Para tiempos de recolección de exudado de raíces más largos, envuelva las tapas nuevamente con cinta adhesiva y mueva los frascos a la cámara de crecimiento. - Después de 2 h, retire la cantidad deseada de medios de recolección en tubos (p. ej., 50 ml para ensayos o análisis con exudados concentrados, o 2 ml para uso directo). Almacenar los exudados de raíz recogidos a -80 °C hasta su posterior procesamiento o análisis.
- Cuando se trabaja con frascos inoculados, centrifugar los exudados recolectados durante 10 min a 5.000 × g y 4 °C y utilizar solo sobrenadantes para el análisis. Alternativamente, filtre y esterilice los exudados con un filtro de 0,22 μm o 0,45 μm.
- Si el experimento forma parte de una serie temporal, retire todo el medio de recolección restante de los frascos y agregue 35 ml de medio MS 0.5x. Vuelva a colocar la tapa y la cinta adhesiva de 2,5 cm antes de devolver los frascos a la cámara de crecimiento.
- Mida el peso fresco de la raíz y el brote de todas las plantas en un frasco para luego normalizar los exudados de las raíces por el peso de la planta.
NOTA: Los tejidos vegetales se pueden muestrear además si se desea.
6. Procesamiento de exudados de raíz para espectrometría de masas
- Dependiendo del método analítico, liofilizar los exudados de la raíz para concentrarlos y eliminar el medio de recolección (-80 °C a 0,37 mbar hasta que no haya líquido). Almacenar a -80 °C hasta que esté listo para analizar.
NOTA: Los datos presentados aquí se generaron con un análisis TOF-MS de inyección de flujo en un instrumento de tiempo de vuelo cuadrupolar de masa precisa. - Antes de la inyección en el instrumento analítico, reconstituya los exudados liofilizados o diluya los exudados de raíz sin procesar con el medio de recolección de acuerdo con el peso fresco de la raíz.
NOTA: El medio de recolección se eligió para que fuera compatible con el espectrómetro de masas. Sin embargo, dependiendo del método analítico, pueden ser necesarios pasos de desalinización antes de la inyección.
Resultados
El sistema experimental aquí presentado permite el control de los factores experimentales y ambientales que alteran los perfiles de exudación radicular. Comparamos el crecimiento de A. thaliana bajo diferentes condiciones de iluminación, edad de planta y densidades de plantas en dos laboratorios diferentes (Figura 3). Las plantas se veían sanas en todos los laboratorios (Figura 3A, B). Las condiciones de día corto (luces de 10 h frente a luz de 16 h, Figura 3) dieron como resultado una mayor masa radicular en comparación con las condiciones de día largo (Figura 3C, D). De manera similar, la masa radicular total de todas las plantas cultivadas en condiciones de día largo fue menor que en condiciones de día corto (Figura 3C). En general, la variabilidad del crecimiento dentro y entre frascos fue baja en todos los laboratorios.
El sistema de frascos de vidrio es compatible con una variedad de especies de plantas y etapas de desarrollo. El criterio de valoración para el análisis del exudado radicular suele ser de 21 días, ya que en nuestras condiciones experimentales, muchas especies de plantas se encuentran en una etapa vegetativa madura antes de pasar a la etapa reproductiva (Figura 4A-E). Las plantas se pueden retirar fácilmente del sistema experimental sin daños visibles en el sistema radicular. Por lo tanto, determinar el peso de los tejidos o utilizar los tejidos para el análisis posterior es sencillo. Los mayores pesos de los brotes se encontraron para el trigo, seguido del sorgo y el tomate. Los pesos de raíz más altos se encontraron para el sorgo, seguido por el trigo y M. truncatula. La relación raíz:brote difiere entre especies. En general, el peso de los tejidos varió entre 100 mg y 800 mg.
Un aspecto central de los sistemas experimentales que permiten la recolección de exudado radicular es la inoculación controlada con microbios para estudiar las interacciones planta-microbio en un ambiente definido. El sistema experimental presentado puede mantenerse estéril incluso con una manipulación repetida (véase la condición de "control" en la Figura 5), y las bacterias pueden añadirse y mantenerse durante períodos prolongados. Cuando se inocularon plantas de A. thaliana de 33 días de edad con una mezcla de bacterias comensales a DO600 0,004, las bacterias persistieron durante 12 días, que fue la duración completa del experimento (Figura 5). Las unidades formadoras de colonias incluso aumentaron 100 veces en el medio de crecimiento y también colonizaron las raíces (Figura 5C). Los fenotipos de las plantas inoculadas fueron indistinguibles de los de las plantas estériles (Figura 5A,B).
El sistema experimental presentado permite la recolección de exudado en muchas condiciones experimentales. Aquí, presentamos los perfiles de exudación de A. thaliana Col-0 recolectados en acetato de amonio o en agua de las mismas plantas consecutivamente (Figura 6A). Los exudados se almacenaron a -80 °C hasta el análisis, se normalizaron por el peso de la raíz y se analizaron por espectrometría de masas. Las muestras de frascos que contenían plantas se filtraron contra controles experimentales (frascos sin plantas). De los 2.163 metabolitos, 436 mostraron una señal por encima del fondo (20,16%) y se conservaron para su análisis. De estos, 416 o el 95% de los compuestos mostraron una clara abundancia entre las condiciones experimentales. Sin embargo, 26 metabolitos no pudieron atribuirse a ningún tipo de compuesto y, por lo tanto, no están definidos. La mayoría de los metabolitos (406 o 98%) fueron más abundantes en los exudados recolectados en agua. La acumulación consecutiva de exudados, primero en acetato de amonio y luego en agua, podría afectar el perfil de exudación, ya que las señales metabólicas podrían diluirse con el tiempo. Sin embargo, la señal de exudación casi exclusivamente más alta en el agua recolectada como segundo punto de tiempo no apoya esta hipótesis: la recolección de exudado en agua pura probablemente crea un choque osmótico para las plantas, lo que causa el aumento de la abundancia de metabolitos en comparación con un solvente de recolección equivalente a la solución de crecimiento (20 mM de acetato de amonio es equimolar a 0.5x medio MS). La investigación de las clases químicas de los compuestos identificados en ambas condiciones de crecimiento mostró que la mayoría de los compuestos son ácidos orgánicos y derivados (28,6%), seguidos de compuestos orgánicos de oxígeno (18%), compuestos organoheterocíclicos (14,2%) y lípidos (13,2%). Solo un pequeño subconjunto de metabolitos pertenece a fenilpropanoides y policétidos (8,7%) y bencenoides, (6%). Los compuestos orgánicos nitrogenados, nucleósidos, compuestos organosulfurados, alcaloides, lignanos y compuestos relacionados representan entre el 2% y el 0,5% de los compuestos clasificados (Figura 6B). La distribución de los metabolitos aquí representada corresponde a datos ya publicados utilizando otros tipos de sistemas de recolección de exudados radiculares24.

Figura 1: Configuración del frasco de vidrio. (A) Frasco con cuentas de vidrio. (B) Frasco con cuentas de vidrio listo para ser esterilizado en autoclave. (C) Plántulas en frascos (vista superior). (D) Plántulas en un frasco (vista superior) con cinta de microporos de 1,25 cm. (E) Plántulas en frascos (vista lateral) con cinta de microporos de 1,25 cm. (F) Plántulas en frascos (vista lateral) con cinta de microporos de 1,25 cm y tapa. (G) Completa la configuración del frasco con plántulas en frascos (vista lateral) con cinta de microporos de 1,25 cm, tapa y cinta de microporos de 2,5 cm. (H) Configuración completa del frasco (vista superior). (I) Plantas de 21 días de edad y listas para la cosecha (vista superior). Tamaño del frasco 147 mm de altura x 100 mm de diámetro. Haga clic aquí para ver una versión más grande de esta figura.
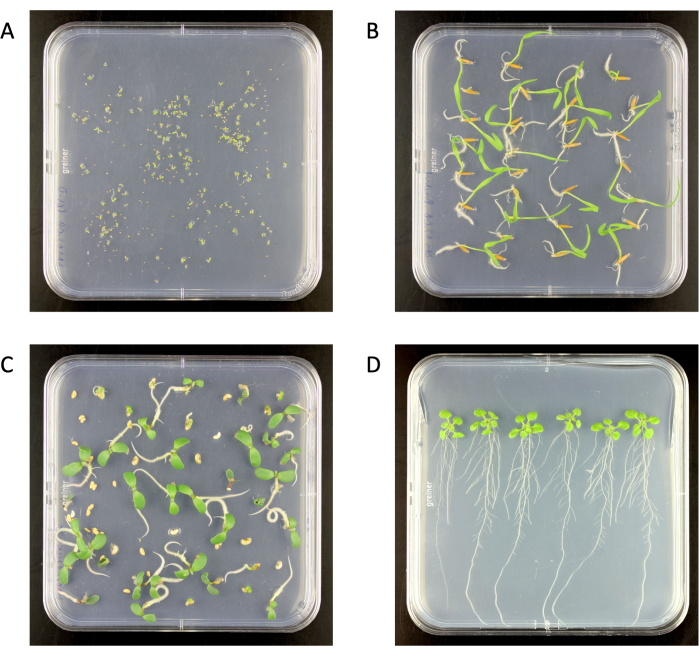
Figura 2: Plántulas esterilizadas en superficie en placas de agar mediano Murashige y Skoog 0,5x en una cámara de crecimiento. (A) Arabidopsis thaliana (6 días de edad), (B) Brachypodium distachyon (6 días de edad), (C) Medicago truncatula (6 días de edad), (D) A. thaliana (18 días de edad). Placa de agar tamaño 120 mm x 120 mm. Haga clic aquí para ver una versión más grande de esta figura.
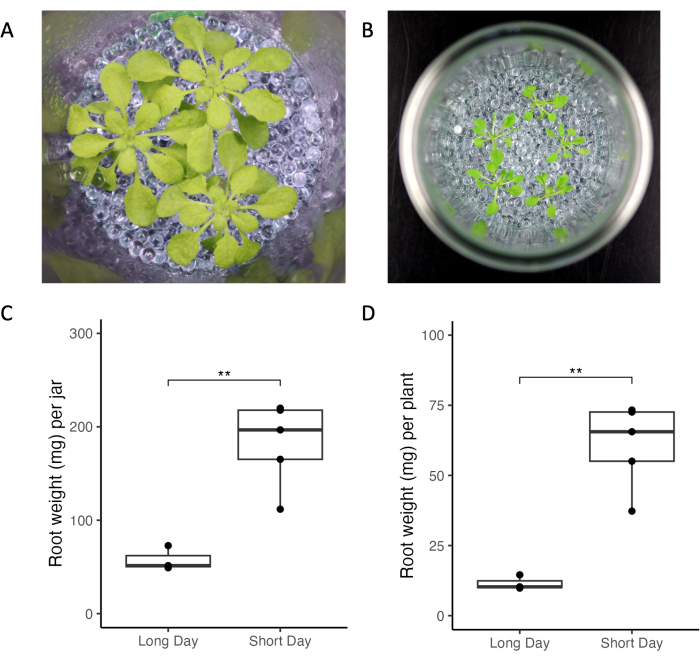
Figura 3: Plantas de Arabidopsis thaliana Col-0 cultivadas en frascos en condiciones de luz de día corto y largo. (A) Frasco con tres plantas de 33 días cultivadas en condiciones de día corto (10 h de luz/14 h de oscuridad, 220 μmol m-2 s-1 de intensidad de luz, 21 °C de día/18 °C de noche) y (B) frasco con cinco plantas de 21 días de edad cultivadas en condiciones de día largo (16 h de luz/8 h de oscuridad, 150-160 μmol m-2 s-1 intensidad lumínica, 22 °C día/18 °C noche). Peso de la raíz de (C) todas las plantas de un frasco y (D) de plantas individuales. ** representan los valores de significación de la prueba t (p < 0,05). Haga clic aquí para ver una versión más grande de esta figura.
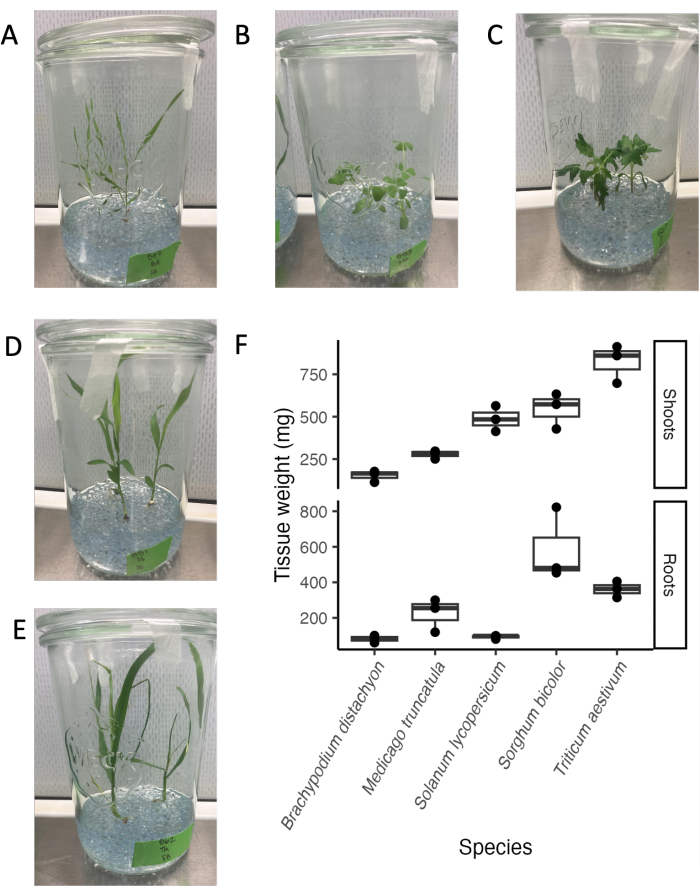
Figura 4: Cinco especies filogenéticamente distintas en el día 21 en la configuración del sistema de frasco de vidrio estéril. (A) monocotiledónea modelo Brachypodium distachyon, (B) leguminosa modelo Medicago truncatula, (C) dicotiledónea Solanum lycopersicum (tomate), (D) dicotiledónea Sorghum bicolor, (E) monocotiledónea Triticum aestivum (trigo). (F) Peso fresco de raíces y brotes de las especies cultivadas en frascos de vidrio. Haga clic aquí para ver una versión más grande de esta figura.
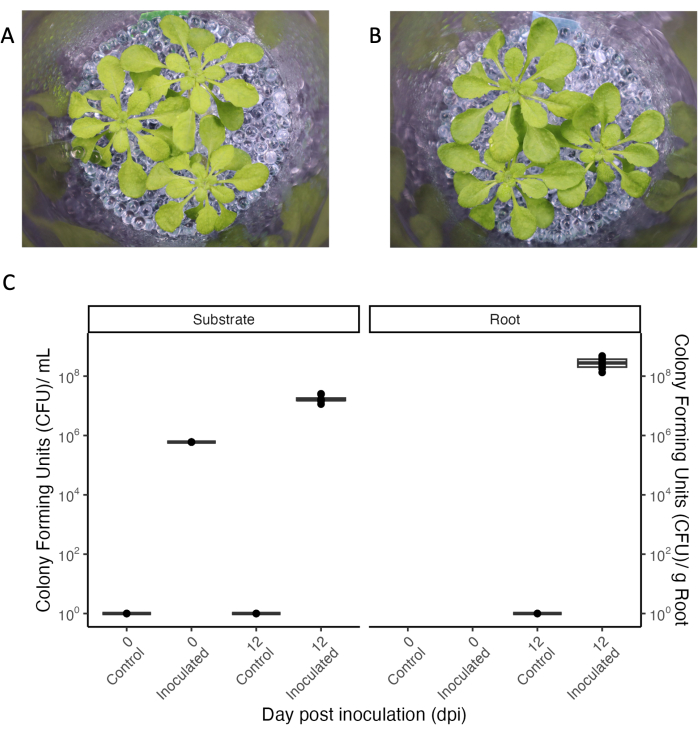
Figura 5: Arabidopsis thaliana Col-0 (33 días de edad) cultivada en condiciones de días cortos. (A) En un entorno estéril o (B) inoculado durante 12 días con un consorcio de bacterias comensales. (C) Unidades formadoras de colonias para frascos estériles (control) e inoculados del sustrato de crecimiento (izquierda) y de la raíz (derecha). N = 4 frascos para la condición de control estéril y n = 8 frascos para la condición inoculada. Haga clic aquí para ver una versión más grande de esta figura.
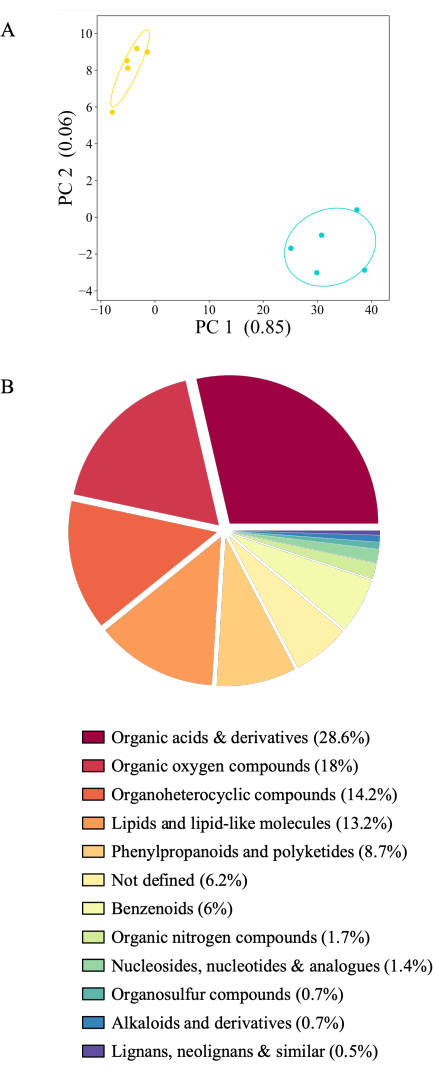
Figura 6: Perfiles distintos de exudado radicular para A. thaliana Col-0 de 21 días de edad. Los exudados se recogieron durante 2 h en acetato de amonio estéril de 20 mM (pH 5,7) seguido de 2 h en agua desionizada filtrada estéril. Los metabolitos se detectaron mediante espectrometría de masas mediante inyección directa. (A) Análisis de componentes principales de 436 metabolitos detectados por encima del nivel de fondo (comparación de frascos con plantas frente a frascos sin plantas). PC: componente principal con la cantidad de varianza explicada. Azul: exudados recogidos en agua, amarillo: exudados recogidos en acetato de amonio. (B) Gráfico circular de 416 metabolitos significativamente diferentes entre condiciones experimentales (prueba de Tukey) coloreado según la superclase (https://cfb.fiehnlab.ucdavis.edu/). Haga clic aquí para ver una versión más grande de esta figura.
| Especie | Preparación de semillas | Tiempo en etanol al 70% (min) | Concentración de hipoclorito de sodio (NaClO) (v/v % lejía) | Tiempo en lejía (min) | ||
| Arabidopsis thaliana | 15 | Ninguno; 100% etanol | 15 | |||
| Brachypodium distachyon* | Descascarillar | 0.5 | 6 | 5 | ||
| Medicago truncatula*a | 30 | 6 | 30 | |||
| Solanum lycopersicum* | 0.5 | 6 | 5 | |||
| Sorgo bicolor* | Descascarillar | 0.5 | 6 | 30 | ||
| Triticum aestivum* | Descascarillar | 0.5 | 12 | 20 | ||
Tabla 1: Métodos de esterilización de semillas superficiales para múltiples especies. * Lavado 4-5 veces con agua desionizada filtrada entre etanol y lejía y al final; Unaincubación durante 3-6 h después de la lejía, reemplazando con agua desionizada filtrada cada 30 min.
| Especie | Día a los frascos | Número de plantas |
| Brachypodium distachyon | De 4 a 5 | 3 |
| Sorgo bicolor | De 4 a 5 | 3 |
| Triticum aestivum | De 4 a 5 | 2 |
| Medicago truncatula | De 5 a 6 | 3 |
| Solanum lycopersicum | De 7 a 8 | 3 |
| Arabidopsis thaliana | 17 | De 3 a 5 |
Tabla 2: Edad de las plántulas en días para su transferencia a frascos y número de plantas por frasco para varias especies de plantas.
Discusión
El sistema experimental que aquí se presenta se basa en frascos de vidrio y cuentas de vidrio y, por lo tanto, proporciona un sistema semihidropónico simple, de bajo mantenimiento y versátil para estudiar la exudación de raíces en diversos contextos. Se ha utilizado en estudios que investigan los perfiles de exudación de diferentes especies de plantas25, las respuestas de exudación a diferentes condiciones de crecimiento25, así como la influencia de las propiedades fisicoquímicas del suelo en la exudación22. El sistema es adecuado para todas las especies de plantas probadas aquí durante períodos de crecimiento prolongados, que van desde semanas hasta meses. El mantenimiento de las condiciones estériles es sencillo, al igual que la inoculación con bacterias, que persisten durante el período de crecimiento analizado de 2 semanas. De este modo, el sistema experimental no solo permite una recogida controlada de exudados radiculares en condiciones estériles, sino que también puede utilizarse para estudiar las interacciones planta-microbio. Además, los medios de crecimiento de las plantas se pueden variar para estudiar las respuestas metabólicas a diferentes niveles de nutrientes, y los períodos de crecimiento se pueden ajustar adaptando las condiciones de luz o utilizando frascos de diferentes tamaños.
El estudio de los exudados de las raíces en condiciones hidropónicas o semihidropónicas sigue siendo estándar en el campo, principalmente debido a la resolución mejorada de los metabolitos de baja concentración11. Muchos enfoques hidropónicos se basan en placas de Petri, placas de pocillos múltiples u otros recipientes pequeños que permiten la esterilidad y un alto rendimiento, pero restringen la experimentación a plantas pequeñas o plántulas cultivadas en ambientes de alta humedad 17,18,26,27. En la configuración de frasco de vidrio presentada, los frascos comparativamente grandes proporcionan suficiente espacio para la cabeza, lo que permite períodos de crecimiento prolongados. Las tiras de cinta de microporos aseguran el intercambio de aire mientras mantienen la esterilidad. Por lo tanto, incluso las monocotiledóneas altas, como la cebada y el maíz, se pueden cultivar en frascos de vidrio durante varias semanas. Las plantas pequeñas como A. thaliana y el trébol se pueden estudiar durante 4-5 semanas después de la germinación, incluidas las etapas vegetativa y reproductiva.
También hay configuraciones hidropónicas alternativas disponibles para plantas más grandes, pero a menudo requieren cajas y entradas hechas a medida con malla, tableros de espuma y cestas de injerto para el soporte de la planta 15,28,29,30. Además, estos dispositivos generalmente no están configurados para ser estériles, o requieren procedimientos de configuración y mantenimiento desafiantes para mantenerlos libres de contaminaciones microbianas y/o químicas. La configuración y el mantenimiento de la esterilidad en el sistema experimental presentado son sencillos. Además, el uso de vidrio para frascos y cuentas reduce la presencia de contaminantes que se filtran de los plásticos y ahorra recursos, ya que se puede lavar y reutilizar fácilmente.
Las perlas de vidrio se han aplicado anteriormente para imitar las partículas del suelo. Inducen el desarrollo natural de las raíces en dispositivos de muestreo de exudación de raíces, como trampas de exudación31 u otros sistemas semihidropónicos19. La configuración del frasco de vidrio aprovecha este desarrollo e introduce las perlas como una superficie de colonización para los microbios. En el suelo, el microbioma alrededor de las raíces de las plantas evoluciona en un entorno semisólido, con partículas compactas y espacios llenos de aire o agua. A pesar de que la configuración del frasco de vidrio no incluye la aireación activa del medio de crecimiento, por lo que es probable que la fase líquida inferior no contenga niveles óptimos de oxígeno, la combinación de un volumen de perlas más grande con un volumen de medio de crecimiento más pequeño crea una fase superior húmeda pero aireada donde los microbios pueden crecer en condiciones óxicas. Otros han propuesto sacudir los recipientesde crecimiento 26,28 o utilizar tubos acoplados a bombas de aire19,29 para mantener el suministro de aire en los sistemas de crecimiento hidropónico. Sin embargo, esos sistemas están configurados para no ser estériles, o requieren material especializado y vigilancia constante para mantener la esterilidad. Además, en el caso de sacudidas, mucho cuidado para evitar la inmersión de los brotes en soluciones de crecimiento y daños en los sistemas radiculares. Sin embargo, si se desea, la configuración experimental presentada podría adaptarse con material adicional para la aireación.
Un aspecto crucial a tener en cuenta en todos los estudios de interacción planta-microbio que investigan el metabolismo es que los microbios degradan los compuestos derivados de las plantas y producen metabolitos por sí mismos. Sin una configuración experimental estéril especializada, no es posible distinguir entre metabolitos derivados de plantas y microbios. Para inhibir la actividad microbiana y enriquecer los compuestos derivados de plantas, Oburger et al. propusieron esterilizar químicamente la solución de muestreo de exudado de la raíz para inhibir la degradación bacteriana32. El efecto de los inhibidores químicos pudo ser estudiado en el sistema experimental presentado, comparando los perfiles de exudación de plantas estériles versus no estériles tratadas con o sin el inhibidor.
Una de las principales limitaciones de la configuración del frasco de vidrio presentado es que las condiciones de crecimiento siguen siendo muy artificiales en comparación con el suelo. Los exudados de las plantas cultivadas en el suelo a menudo se recolectan de los sistemas de percolación13, donde los flujos de solventes se recogen en la base de los contenedores de crecimiento, o de los sistemas híbridos de suelo e hidroponía, donde las plantas se cultivan inicialmente en el suelo y luego se transfieren a condiciones hidropónicas 16,33. A diferencia de la configuración de frascos de vidrio, estos procedimientos suelen ser destructivos, ya que no permiten múltiples recolecciones a lo largo del tiempo en entornos de crecimiento cambiantes. Además, mientras que en los sistemas de percolación, el fondo del suelo se muestrea junto con los exudados, en los sistemas híbridos suelo-hidropónico se elude el problema del alto fondo metabólico del suelo con la transferencia a condiciones hidropónicas para la recolección de exudados. Aunque se han implementado tiempos de recuperación para reducir la fuga de metabolitos a través de las raíces heridas11, la transferencia de la planta es muy perturbadora y es probable que las heridas persistan, y el metabolismo de la planta puede cambiar en respuesta a la transferencia a condiciones hidropónicas. Además, en muchos casos, se induce un choque osmótico al transferir las plantas al agua en lugar de a una solución de crecimiento adecuada16,33. En el protocolo presentado, la solución de crecimiento se intercambia con una solución equimolar para mantener el equilibrio osmótico, lo que permite capturar la exudación dentro de una ventana de tiempo corta y definida. El cambio de solución de crecimiento es una práctica común en muchos estudios publicados y se puede lograr fácilmente en instalaciones hidropónicas sin herir la raíz 12,16,26,34. Debido a su versatilidad, el sistema experimental presentado puede adaptarse fácilmente para imitar condiciones más naturales, por ejemplo, mediante el uso de extracto de suelo estéril o no estéril como solución de crecimiento con o sin la presencia de partículas sólidas del suelo. El cambio gradual hacia las condiciones naturales permite estudiar el impacto de las diferentes propiedades fisicoquímicas del suelo y la presencia microbiana en el metabolismo y la fisiología de las plantas. Antes de que la comunidad científica tenga una buena comprensión de la exudación en diversos ambientes, es deseable emplear sistemas basados en el suelo y sistemas hidropónicos en paralelo, ya que ambas configuraciones tienen sus ventajas y limitaciones13.
En conclusión, la configuración experimental semihidropónica a base de vidrio presentada se destaca por su simplicidad combinada con una alta versatilidad de aplicaciones. Presenta una forma accesible y de bajo costo de recolectar y estudiar la exudación en condiciones estériles, o en combinación con microbios e interacciones planta-microbio.
Divulgaciones
Los autores no tienen conflictos de intereses que revelar.
Agradecimientos
Agradecemos al Prof. Dr. Nicola Zamboni y al Prof. Dr. Uwe Sauer de ETH Zürich, Suiza, por determinar los perfiles de exudación de la raíz con inyección directa y al Prof. Dr. Klaus Schläppi de la Universidad de Basilea por la bacteria comensal A. thaliana . Además, agradecemos a la Fundación Nacional Suiza para la Ciencia (PR00P3_185831 a J.S., que apoya a S.M., A.S., E.M.S.) y al programa de becas PSC-Syngenta (otorgado al Prof. Dr. Klaus Schläppi y J.S., que apoya a C.J.).
Materiales
| Name | Company | Catalog Number | Comments |
| Agar powder for bacteriology | VWR | 20767.298 | |
| Aluminum foil | FORA GmbH | ||
| Ammonium acetate | Sigma-Aldrich | 32301-1KG | ACS reagent, Eur >- 98% |
| Autoclave VX-150 | Systec | 1150 | |
| Balance | Sartorius | QUINTIX64-1S | |
| Centrifuge | Hermle Labortechnik GmbH | 305.00 V05 | |
| Cuvettes | Greiner Bio-One | 613101 | |
| Difco LB Broth, Lennox | BD | 240210 | |
| Ethanol | Reuss-Chemie AG | RC-A15-A-005L | |
| Filtered deionized water | Merck Millipore | Milli-Q IQ7000 | |
| Glass beads | Carl Roth | HH56.1 | 5 mm |
| Hydrochloric acid | Merk | 1.00317.1000 | |
| Inoculation loop | Karl Hammacher GmbH | HWO_070-21 | |
| Jars | Weck | 105741 | 850 mL |
| Lyophilizer | Christ | Alpha 2-4 LSCplus | |
| Magnesium chloride hexahydrate | Carl Roth | 2189.1 | |
| Matrix Orbital thermoshaker | IKA | 10006248 | |
| Microcentrifuge tube | Sarstedt AG & Co. KG | 72.695.500 | SafeSeal reaction tube, 2 mL, PP |
| Micropore tape | 3M | 1530-0 | 1.25 cm x 9.1 m |
| Micropore tape | 3M | 1530-1 | 2.5 cm x 9.1 m |
| Murashige & Skoog Medium (MS) | Duchefa Biochemie | M0221.0050 | |
| Growth chamber | Percival | SE41-TLCU4 | 16 hour light/8 dark. 22 °C day/18 night |
| Phyto agar | Duchefa Biochemie | P1003.1000 | |
| Potassium hydroxide | Sigma-Aldrich | 8.14353.0100 | |
| SmartSpec Plus Spectrophotometer | Bio-Rad | 170-2525 | |
| Sodium hypochlorite solution, 12% Cl | Carl Roth | 9062.4 | |
| Square petri dish | Greiner Bio-One | 688102 | 120x120x17 mm, with vents |
| Stericup Quick release | Millipore | S2GPU05RE | 0.22 µm PES, 500 mL |
| Sterile bench | FASTER S.r.l. | FlowFast H 18 |
Referencias
- Sasse, J., Martinoia, E., Northen, T. Feed your friends: do plant exudates shape the root microbiome. Trends in Plant Science. 23 (1), 25-41 (2018).
- Lundberg, D. S., et al. Defining the core Arabidopsis thaliana root microbiome. Nature. 488 (7409), 86-90 (2012).
- Lopez, J. L., et al. Growth rate is a dominant factor predicting the rhizosphere effect. The ISME Journal. 17 (9), 1396-1405 (2023).
- Hu, L., et al. Root exudate metabolites drive plant-soil feedbacks on growth and defense by shaping the rhizosphere microbiota. Nature Communications. 9 (1), 2738(2018).
- Edwards, J., et al. Structure, variation, and assembly of the root-associated microbiomes of rice. Proceedings of the National Academy of Sciences. 112 (8), 911-920 (2015).
- Bulgarelli, D., et al. Structure and function of the bacterial root microbiota in wild and domesticated barley. Cell Host Microbe. 17 (3), 392-403 (2015).
- Li, J., Wang, J., Liu, H., Macdonald, C. A., Singh, B. K. Application of microbial inoculants significantly enhances crop productivity: A meta-analysis of studies from 2010 to 2020. Journal of Sustainable Agriculture and Environment. 1 (3), 216-225 (2022).
- Escudero-Martinez, C., Bulgarelli, D. Engineering the crop microbiota through host genetics. Annual Review of Phytopathology. 61, 257-277 (2023).
- Poppeliers, S. W., Sanchez-Gil, J. J., de Jonge, R. Microbes to support plant health: understanding bioinoculant success in complex conditions. Current Opinion in Microbiology. 73, 102286(2023).
- O'Callaghan, M., Ballard, R. A., Wright, D. Soil microbial inoculants for sustainable agriculture: Limitations and opportunities. Soil Use and Management. 38 (3), 1340-1369 (2022).
- Oburger, E., Jones, D. L. Sampling root exudates - Mission impossible. Rhizosphere. 6, 116-133 (2018).
- Yuan, J., et al. Root exudates drive the soil-borne legacy of aboveground pathogen infection. Microbiome. 6 (1), 156(2018).
- Vismans, G., et al. Coumarin biosynthesis genes are required after foliar pathogen infection for the creation of a microbial soil-borne legacy that primes plants for SA-dependent defenses. Scientific Reports. 12 (1), 22473(2022).
- Strehmel, N., Böttcher, C., Schmidt, S., Scheel, D. Profiling of secondary metabolites in root exudates of Arabidopsis thaliana. Phytochemistry. 108, 35-46 (2014).
- Song, Y., Pieterse, C. M. J., Bakker, P., Berendsen, R. L. Collection of sterile root exudates from foliar pathogen-inoculated plants. Methods in Molecular Biology. 2232, 305-317 (2021).
- Oburger, E., et al. A quick and simple spectrophotometric method to determine total carbon concentrations in root exudate samples of grass species. Plant Soil. 478 (1-2), 273-281 (2022).
- Koprivova, A., et al. Root-specific camalexin biosynthesis controls the plant growth-promoting effects of multiple bacterial strains. Proceedings of the National Academy of Sciences of the United States of America. 116 (31), 15735-15744 (2019).
- Gao, J., et al. Ecosystem fabrication (EcoFAB) protocols for the construction of laboratory ecosystems designed to study plant-microbe interactions. Journal of Visualized Experiments. (134), e57170(2018).
- Lopez-Guerrero, M. G., et al. A glass bead semi-hydroponic system for intact maize root exudate analysis and phenotyping. Plant Methods. 18 (1), 25(2022).
- Boeuf-Tremblay, V., Plantureux, S., Guckert, A. Influence of mechanical impedance on root exudation of maize seedlings at two development stages. Plant and Soil. 172, 279-287 (1995).
- Groleau-Renaud, V., Plantureux, S., Guckert, A. Influence of plant morphology on root exudation of maize subjected to mechanical impedance in hydroponic conditions. Plant and Soil. 201, 231-239 (1998).
- Sasse, J., et al. Root morphology and exudate availability are shaped by particle size and chemistry in Brachypodium distachyon. Plant Direct. 4 (7), 00207(2020).
- Katagiri, F., Thilmony, R., He, S. Y. The Arabidopsis thaliana-Pseudomonas syringae interaction. Arabidopsis Book. 1, 0039(2002).
- Monchgesang, S., et al. Natural variation of root exudates in Arabidopsis thaliana-linking metabolomic and genomic data. Scientific Reports. 6, 29033(2016).
- McLaughlin, S., Zhalnina, K., Kosina, S., Northen, T. R., Sasse, J. The core metabolome and root exudation dynamics of three phylogenetically distinct plant species. Nature Communications. 14 (1), 1649(2023).
- Badri, D. V., Chaparro, J. M., Zhang, R., Shen, Q., Vivanco, J. M. Application of natural blends of phytochemicals derived from the root exudates of Arabidopsis to the soil reveal that phenolic-related compounds predominantly modulate the soil microbiome. Journal of Biological Chemistry. 288 (7), 4502-4512 (2013).
- Massalha, H., Korenblum, E., Malitsky, S., Shapiro, O. H., Aharoni, A. Live imaging of root-bacteria interactions in a microfluidics setup. Proceedings of the National Academy of Sciences of the United States of America. 114 (17), 4549-4554 (2017).
- Nathoo, N., Bernards, M. A., MacDonald, J., Yuan, Z. C. A hydroponic co-cultivation system for simultaneous and systematic analysis of plant/microbe molecular interactions and signaling. Journal of Visualized Experiments. (125), e55955(2017).
- Nguyen, N. T., McInturf, S. A., Mendoza-Cozatl, D. G. Hydroponics: a versatile system to study nutrient allocation and plant responses to nutrient availability and exposure to toxic elements. Journal of Visualized Experiments. (113), e54317(2016).
- Yi, Y., Li, Z., Kuipers, O. P. Plant-microbe interaction: transcriptional response of Bacillus Mycoides to potato root exudates. Journal of Visualized Experiments. (137), e57606(2018).
- Phillips, R. P., Erlitz, Y., Bier, R., Bernhardt, E. S. New approach for capturing soluble root exudates in forest soils. Functional Ecology. 22 (6), 990-999 (2008).
- Oburger, E., et al. Root exudation of phytosiderophores from soil-grown wheat. New Phytologist. 203 (4), 1161-1174 (2014).
- Neal, A. L., Ahmad, S., Gordon-Weeks, R., Ton, J. Benzoxazinoids in root exudates of maize attract Pseudomonas putida to the rhizosphere. PLoS One. 7 (4), e35498(2012).
- Miao, Y., et al. Exogenous salicylic acid alleviates salt stress by improving leaf photosynthesis and root system architecture in cucumber seedlings. Scientia Horticulturae. 272, 109577(2020).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoExplorar más artículos
This article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados