Method Article
半水耕栽培の根滲出液プロファイリングのための汎用性の高いガラスジャーシステム
要約
微生物の有無にかかわらず、系統発生的に異なるさまざまな植物の成長をサポートするガラスベースの半水耕栽培実験システムのプロトコルを提示します。このシステムは、さまざまな増殖培地と互換性があり、下流分析のための非破壊的な根滲出液サンプリングを可能にします。
要約
根の滲出液は、植物と土壌の界面を形成し、栄養循環に関与し、土壌生物との相互作用を調節します。根の滲出液は動的であり、生物学的、環境的、および実験的条件によって形作られます。滲出液の多様性が広く、濃度が低いため、他の生物が存在する自然環境では、植物由来の化合物がひっくり返って追加の化合物が生成されるため、正確な滲出液プロファイルを決定することは困難です。ここで紹介する半水耕栽培のガラス瓶実験システムは、生物学的、環境的、実験的要因を制御することができます。これにより、さまざまな異なる増殖培地で、微生物の有無にかかわらず、系統発生的に異なるさまざまな植物種を最大数か月間成長させることができます。ガラスベースの設計により、代謝物のバックグラウンドが低く、再利用できるため、高感度で環境への影響が少なくなります。滲出液は非破壊的にサンプリングでき、必要に応じて実験の過程で条件を変更することができます。このセットアップは、質量分析やその他のダウンストリーム分析手順と互換性があります。要約すると、さまざまな条件での敏感な根滲出液分析に適した汎用性の高い増殖システムを紹介します。
概要
人口密度の高い土壌の中では、根圏は炭素が豊富なニッチを提示します。植物の根は、最大20%の同化炭素の滲出によって形成され、常在する土壌微生物叢とは異なる微生物群集を保有しています1,2,3,4,5,6。研究者が根関連微生物の有益な機能とそれに伴う持続可能な農業の可能性を活用するにつれて7、根圏効果と呼ばれることが多いこの観察は、ますます科学的な取り組みの焦点となっています。しかし、これまでのところ、根圏効果の原動力であると提案されている微生物と植物の間の化学的対話は十分に理解されていないままであり、したがって、農業における信頼性の高い微生物ソリューションの開発のためのメカニズムの理解は限られています8,9,10。
代謝産物が土壌粒子に容易に吸収され、微生物群集によって急速に転覆する土壌環境における根の滲出液の解読は、特にモデル植物のシロイヌナズナ11のような細かい根系を持つ植物種では簡単ではありません。 これが、ほとんどの研究で、根の滲出液が水耕栽培システムからサンプリングされる理由です。これらの小宇宙では、植物の地上部は、カスタマイズされた植物ホルダーや、メッシュ、寒天、ガラスビーズなどのより控えめな素材によって所定の位置に保持されます。使用される容器は、マルチウェルプレート上のペトリ皿から、曝気フィルター付きまたはエアレーションフィルターなしのさまざまなカスタムおよび業務用ボックスまで多岐にわたります12、13、14、15、16、17、18、19。システムによって、植物の成長条件は大きく異なり、多かれ少なかれ自然条件を反映します。
ここでは、実験的に適応性があり、再現性の高い結果を生み出すガラスベースの半水耕栽培システムを紹介します。組み立てと使用は簡単で、一般的に入手可能な材料に基づいています。このシステムは、ガラスビーズを充填したガラス瓶をベースにしており、ガラス器具の再利用可能な性質と低結合性を利用しています(図1)。ビーズは、成長する植物を物理的にサポートし、機械的インピーダンスをシミュレートし、水耕栽培のセットアップ19,20,21と比較して、より土壌のような根の構造に貢献します。微生物を接種すると、ガラスビーズはバクテリアが付着する表面になります。
ガラス瓶は無菌状態を維持するために閉じることができ、システムは十分なヘッドスペースと空気循環を可能にするように設計されており、湿度が飽和した環境を回避します。瓶は、さまざまな植物種の長期成長に適しており、さまざまなサイズの瓶を使用してスケールアップおよびスケールダウンできます。ここでは、C3およびC4の草、双子葉植物、およびマメ科植物をカバーする6つの植物種のアプリケーションが示されています。その中には、モデル種 A.thaliana (双子葉植物)、 Brachypodium distachyon (C3単子葉植物)、 Medicago truncatula (マメ科植物)、 およびSolanum lycopersicum (トマト、双子葉植物)、 Triticum aestivum (小麦、C3単子葉植物)、 およびSorghum bicolor (ソルガム、C4単子葉植物)などの作物種があります。提示されたプロトコルには、システムの実験セットアップ、6つの植物種の種子滅菌と発芽、瓶への苗の移植、さまざまな成長培地、微生物の接種、根の滲出液サンプリング、および分析のための滲出液処理が含まれます。
プロトコル
1.苗の準備:種子の表面殺菌
注:種子の表面滅菌とそれに続くすべてのステップは、特に断りのない限り、無菌状態で行う必要があります。ステップ1.1から1.4は、 A.thaliana 種子の表面殺菌に特有です。他の植物種では、チューブサイズ(種子の数と種子サイズに応じて)、溶液中の時間、および滅菌溶液に別のバリエーションがあります(表1)。
- 微量遠心チューブ(最大20mgの種子)に種子を加え、種子を70%エタノールで覆います。
注意: エタノールは可燃性です。直火の近くで使用しないでください。 - 閉じた微量遠心チューブをシェーカーに15分間移動させ、種子が穏やかに攪拌されるように回転を設定します。
- ピペットで70%エタノールを慎重に除去し、100%エタノールと交換します。手順 1.2 を繰り返します。
- 100%エタノールを除去し、微量遠心チューブの蓋を無菌空気流で開いたままにして種子を乾燥させます。
- 種子が乾いたら、チューブをはじくか、滅菌鉗子を使用して、0.7%の植物寒天を含む0.5x Murashige and Skoog(MS)培地に均等に広げます。寒天プレートを閉じ、1.25cmのマイクロポアテープで密封します。
- プレートを増殖チャンバーの棚に水平に置きます(16時間明るい/8時間暗い、22°C昼/18°C夜、150-160μmol m-2 s-1)。
2.苗の準備:発芽した種子を新鮮なプレートに移す
注:次の手順は A.thaliana に固有であり、他の種には必要ありません。
- 発芽後、苗木を上から約3 cmのところに直線的に配置して、5〜6本の苗木を0.5x MS培地で新しい0.7%植物寒天プレートに移します( 図2Dのロゼットの位置を参照)。
- 寒天プレートを1.25cmのミクロポアテープで密封し、発芽後15〜18日で苗木を瓶に移す準備が整うまで、成長チャンバー内で垂直に成長させます(図2D)。
3.水耕栽培システムの準備:ジャーのセットアップ
- 清潔なジャーごとに150 mLの清潔な5 mmガラスビーズを加え、蓋をして閉じます(図1A)。
注:このプロトコルでは、5mmのガラスビーズがほとんどの種22に適していますが、ビーズのサイズは必要に応じて調整できます。 - 蓋とジャーの接合部とオートクレーブを覆うのに十分な量のアルミホイルを密閉瓶の上に置きます(121°Cで20分間)(図1B)。
- 植物を移す準備ができるまで、準備した瓶に蓋をしておきます(表2)。
4.水耕栽培システムの準備:苗の追加
- 苗木を瓶に移す準備ができたら(表2)、滅菌ベンチで瓶のアルミホイルと蓋を取り外します。
- 瓶にバクテリアを接種する場合は、手順4.3に進む前に次の手順を実行します。それ以外の場合は、手順 4.2 をスキップします。
- 滅菌接種ループを使用して、寒天プレート上の純粋な細菌培養物から単一コロニーをピックし、750 μLの滅菌10 mM MgCl2に懸濁します。溶液が濁るまで繰り返します。
- オプション:懸濁液を750 μLの滅菌10 mM MgCl2 で1,000 × g および室温で5分間遠心分離して3回洗浄し、続いて上清を除去し、750 μLの10 mM MgCl2でペレットを再懸濁します。
- オプション:複数の異なる細菌種を接種する場合は、先に進む前に、ステップ4.2.1〜4.2.2で調製した単一菌株の懸濁液を等しい比率で混合します。
- 0.5x MS培地(pH 5.7〜5.9、KOHで調整)または別の増殖培地(ステップ4.3を参照)で、波長600 nm(OD600)での光学濃度を0.2〜0.4に調整します。OD600 を再度測定し、溶液が正しく希釈されたかどうかを確認します。
注意:KOHは腐食性です。手袋と白衣を着用してください。 - 懸濁液をさらに同じ培地でOD600 0.002-0.004に希釈します(1:100希釈)。
注:最終的な細胞密度は、使用する細菌株によって異なりますが、私たちの経験では、この接種物は約3〜6〜105 細胞mL-1×対応します。 - 瓶あたり35 mLの最終希釈液を加えます。35 mLの滅菌増殖培地をコントロールジャーに加えます。根が乾燥しないように、植物を移す前にビーズをかき混ぜて0.5倍のMS培地で均一にコーティングします。手順 4.4 に進みます。
- 各瓶に 35 mL の 0.5x MS 培地を加えます(pH 5.7 〜 5.9、KOH で調整)。根が乾燥しないように、植物を移す前にビーズをかき混ぜて0.5倍のMS培地で均一にコーティングします。
注:増殖培地は、例えば、栄養素の除去、塩ストレスを誘発するための浸透圧物質の添加、または異なるpH値または増殖培地の使用によって変更することができる。注意:KOHは腐食性です。手袋と白衣を着用してください。 - ガラスビーズの間に根系を置いて、3〜5本の A.thaliana 植物を瓶に入れます。
注:瓶あたりの植物の数は、他の種では異なります(表2)。 - 滅菌鉗子またはスプーンでビーズを動かして根を覆い、葉を培地から持ち上げます(図1C)。
注意: 根を壊したり、植物にストレスを与えたりしないように、植物とビーズを慎重に動かしてください。 - ジャーの上部に1.25cmのマイクロポアテープを2枚貼り、蓋をそっと上に置きます(図1D-F)。
注意: 空気交換を妨げないように、蓋を押し下げないでください。 - 蓋とジャーの間の隙間を2.5cmのマイクロポアテープで覆い、空気交換を可能にしながら無菌性を維持し、ジャーを増殖チャンバーに入れます(図1G、H)。
- 実験条件ごとに4〜8個の瓶を、生物学的な問題と予想される変動性に応じて設定します。
- 実験系の代謝物の背景を説明するために、生物学的ネガティブコントロール(植物のない瓶など)を必ず含めてください。ネガティブコントロールには、実験的処理(例:四重化)と同じ反復数を設定します。
- 増殖期間を延長する場合は、増殖培地を毎週交換します:残りの増殖培地を25 mLの容量式ピペットで取り出し、35 mLの新しい培地を加えます。
5.根の滲出液の収集
- 植物が希望の年齢に達したら、滅菌ベンチの2.5cmのマイクロポアテープと蓋をはがします。
注:私たちの成長条件における A.thaliana の場合、発芽後21日は開花開始前の成熟した栄養段階を表します。栄養発達の段階は植物種に固有であり、成長期間のタイミングは植物種によって異なります。このタイミングは、リサーチクエスチョンに応じて変更できます。 - 無菌試験では、20 μLの増殖培地を分注し、LB寒天プレートにピペットで移します。
- 接種したジャーの場合、100 μLの増殖培地を分注して、コロニー形成ユニット(CFU)カウントに使用します(例:希釈系列23)。
注:私たちの経験では、細菌密度は増殖培地の105-10 8 生細胞mL-1の範囲です。
- 接種したジャーの場合、100 μLの増殖培地を分注して、コロニー形成ユニット(CFU)カウントに使用します(例:希釈系列23)。
- 根の損傷を避けるために、25 mLの容量測定用ピペットでできるだけ多くの増殖培地を除去します。
- 葉が濡れないように、瓶の壁に沿ってピペッティングして50 mLの収集培地(例:20 mM酢酸アンモニウム、HClで調整したpH 5.7-5.9)を加えます。蓋付きの瓶を閉じ、滲出液の収集の所望の時間、無菌状態でインキュベートします。時間的制約のある実験では、2 時間が適切な収集ウィンドウです。
注意:HClは腐食性です。手袋と白衣を着用してください。根滲出液の収集時間が長い場合は、蓋をテープで再度包み、ジャーを成長チャンバーに移動します。 - 2時間後、所望の量の収集培地をチューブに移します(例:濃縮滲出液を用いたアッセイまたは分析の場合は50 mL、直接使用の場合は2 mL)。採取した根滲出液は、さらなる処理または分析が行われるまで-80°Cで保存してください。
- 接種済みジャーを使用する場合は、採取した滲出液を5,000 × g 、4°Cで10分間遠心分離し、分析には上清のみを使用します。あるいは、0.22 μmまたは0.45 μmのフィルターで滲出液をフィルター滅菌します。
- 実験が時系列の一部である場合は、瓶から残りのすべての収集培地を取り除き、35 mL の 0.5 x MS 培地を追加します。瓶を成長チャンバーに戻す前に、蓋と2.5cmのテープを交換してください。
- 根を測定し、1つの瓶にすべての植物の新しい重量を撃ち、後で根の滲出液を植物の重量で正規化します。
注:必要に応じて、植物組織を追加でサンプリングできます。
6. 質量分析のための根滲出液の処理
- 分析方法に応じて、根の滲出液を凍結乾燥して濃縮し、収集培地を除去します(液体がなくなるまで0.37 mbarで-80°C)。分析の準備が整うまで-80°Cで保存してください。
注:ここに示すデータは、精密質量四重極飛行時間型装置でのフローインジェクション TOF-MS 分析で生成したものです。 - 分析装置に注入する前に、凍結乾燥した滲出液を再構成するか、未処理の根滲出液を根の新鮮な重量に応じて収集培地で希釈します。
注:収集媒体は、質量分析計と互換性があるように選択されました。ただし、分析方法によっては、注入前に脱塩ステップが必要になる場合があります。
結果
ここで紹介する実験系は、根の滲出プロファイルを変化させる実験的および環境的要因の制御を可能にします。A . thaliana の生育を、異なる照明条件、植物の年齢、植物密度を2つの異なる実験室で比較しました(図3)。植物は実験室全体で健康に見えました(図3A、B)。短日条件(10時間光 vs 16時間光、 図3)では、長日条件と比較して根の質量が多くなりました(図3C、D)。同様に、長日条件で栽培されたすべての植物の総根量は、短日条件よりも小さかった(図3C)。全体として、瓶内および瓶間の増殖のばらつきは、実験室間で低かった。
ガラス瓶システムは、さまざまな植物種や発達段階に対応しています。根滲出液分析のエンドポイントは通常21日であり、実験条件では、多くの植物種は繁殖段階に移行する前に成熟した栄養段階にあります(図4A-E)。植物は、根系に目に見える損傷を与えることなく、実験システムから簡単に取り除くことができます。したがって、組織の重量を決定したり、下流の分析に組織を使用したりすることは簡単です。シュートの重さが最も高かったのは小麦で、次いでソルガムとトマトでした。根の重さが最も高かったのはソルガムで、次いで小麦とM. truncatulaでした。根とシュートの比率は種によって異なります。全体として、組織重量は100mgから800mgの間で変化した。
根滲出液の採取を可能にする実験システムの中心的な側面は、定義された環境で植物と微生物の相互作用を研究するための微生物の制御された接種です。提示された実験系は、繰り返し操作しても無菌状態を保つことができ( 図5の「コントロール」条件を参照)、バクテリアを添加して長期間維持することができます。33日齢の A. thaliana にOD600 0.004の共生細菌の混合物を接種したところ、細菌は実験の全期間である12日間持続しました(図5)。コロニー形成単位は、成長培地中で100倍に増加し、根にもコロニーを形成しました(図5C)。接種した植物の表現型は、不妊植物の表現型と区別がつかなかった(図5A、B)。
提示された実験システムは、多くの実験条件で滲出液の収集を可能にします。ここでは、酢酸アンモニウムまたは同じ植物から水中で連続して採取した A. thaliana Col-0 の滲出プロファイルを示します(図 6A)。滲出液は分析まで-80°Cで保存し、根元重量で正規化し、質量分析で分析しました。植物を含む瓶のサンプルを、実験対照(植物を含まない瓶)に対してろ過しました。2,163 の代謝物のうち、436 の代謝物はバックグラウンドより上のシグナルを示し(20.16%)、分析のために保持されました。これらのうち、416(95%)の化合物は、実験条件間で明確な存在量を示しました。しかし、26の代謝産物はいかなる種類の化合物にも起因することができず、したがって定義されていません。.ほとんどの代謝物(406または98%)は、水で採取された滲出液でより豊富でした。.最初に酢酸アンモニウムで、後で水中で滲出液を連続的に収集すると、代謝シグナルが時間の経過とともに希釈される可能性があるため、滲出液プロファイルに影響を与える可能性があります。しかし、第2の時点として採取された水中の滲出シグナルがほぼ独占的に高いことは、この仮説を支持しません:純水中での滲出液の収集は、植物に浸透圧ショックを引き起こす可能性が高く、増殖溶液と等モルの収集溶媒と比較して代謝物の存在量が増加します(20 mM酢酸アンモニウムは0.5倍MS培地に対して等モルです)。両方の増殖条件で同定された化合物の化学クラスを調査したところ、化合物の大部分は有機酸および誘導体(28.6%)であり、次いで有機酸素化合物(18%)、有機複素環式化合物(14.2%)、脂質(13.2%)であることが示されました。代謝産物のごく一部のみがフェニルプロパノイドとポリケチド(8.7%)およびベンゼノイド(6%)に属しています。.有機窒素化合物、ヌクレオシド、有機硫黄化合物、アルカロイド、リグナン、および関連化合物は、分類された化合物の2%から0.5%を占めています(図6B)。ここに描かれる代謝産物の分布は、他のタイプの根滲出液収集システム24を用いて既に公表されているデータに対応する。

図1:ガラス瓶のセットアップ。 (A)ガラスビーズの入った瓶。(B)オートクレーブ滅菌の準備ができているガラスビーズの入った瓶。(C)瓶の中の苗木(上面図)。(D)1.25cmのマイクロポアテープを貼った瓶(上面図)の中の苗。(E)1.25cmのマイクロポアテープを貼った瓶の中の苗木(側面図)。(F)1.25cmのミクロポアテープと蓋付きの瓶に入った苗木(側面図)。(G)1.25cmのマイクロポアテープ、蓋、および2.5cmのマイクロポアテープを備えた瓶(側面図)に苗木を入れた完全なジャーセットアップ。(H)ジャーのセットアップを完了します(上面図)。(I)生後21日で収穫の準備ができている植物(上面図)。ジャーサイズ:高さ147mm×直径100mm。 この図の拡大版をご覧になるには、ここをクリックしてください。
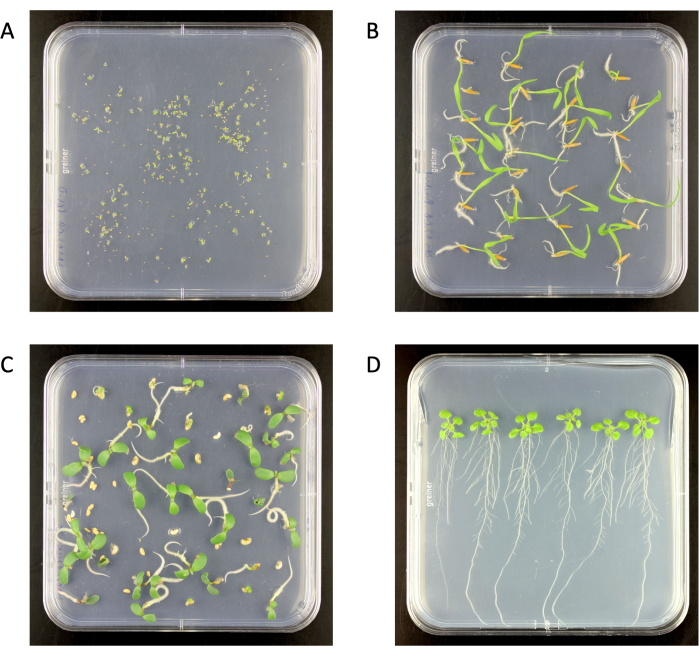
図2:0.5x MurashigeおよびSkoog培地寒天プレートの表面滅菌した苗木を、成長チャンバーで 。 (A) シロイヌナズ ナ(6日齢)、(B) Brachypodium distachyon (6日齢)、(C) Medicago truncatula (6日齢)、(D) A. thaliana (18日齢)。寒天プレートサイズ 120 mm x 120 mm. この図の拡大版をご覧になるには、ここをクリックしてください。
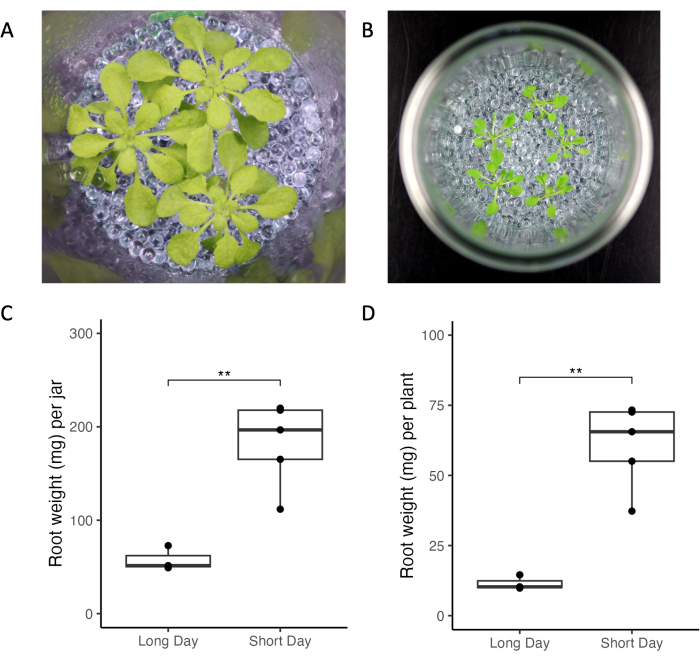
図3:シ ロイヌナズ ナCol-0植物を瓶で短日光および長日光条件下で栽培。 (A)短日条件(10時間光/14時間暗、220μmol m-2 s-1 光強度、21°C昼/18°C夜)で栽培された33日齢の植物3本が入った瓶、および(B)長日条件(16時間明るい/8時間の暗時間、 150-160 μmol m-2 s-1 光強度、昼22°C/夜間18°C)。(C)1つの瓶のすべての植物と(D)単一の植物の根の重さ。** t検定の有意値(p < 0.05)を表します。 この図の拡大版をご覧になるには、ここをクリックしてください。
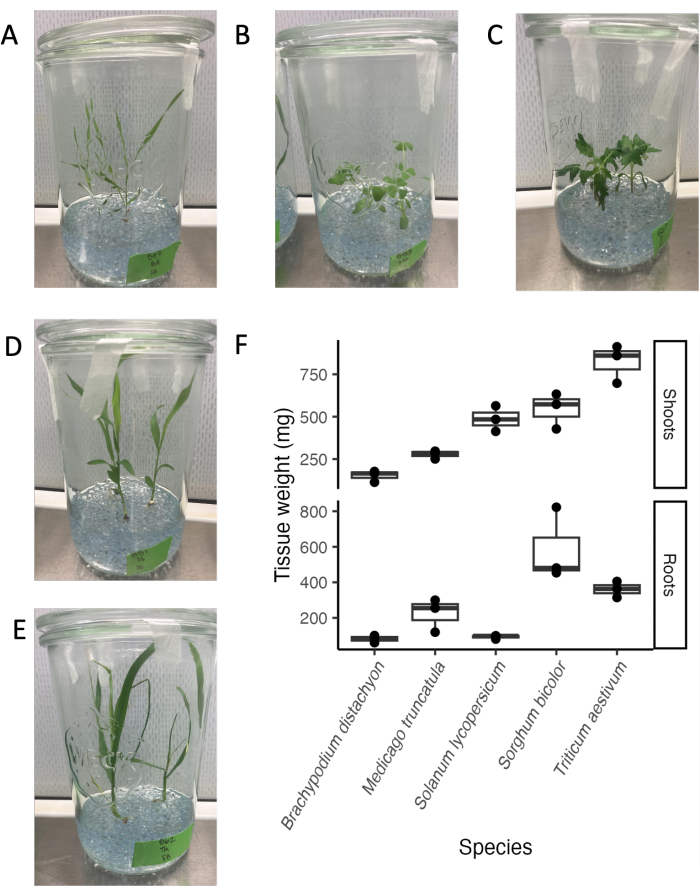
図4:無菌ガラス瓶システムのセットアップにおける21日目の系統発生的に異なる5種。(A)モデル単子葉植物 Brachypodium distachyon、(B)モデルマメ科植物 Medicago truncatula、(C)ダイコット Solanum lycopersicum (トマト)、(D)ダイコ ットソルガムバイカラー、(E)単子葉植物 Triticum aestivum (コムギ)。(F)ガラス瓶で栽培された種の根と新芽の新鮮な重量。 この図の拡大版をご覧になるには、ここをクリックしてください。
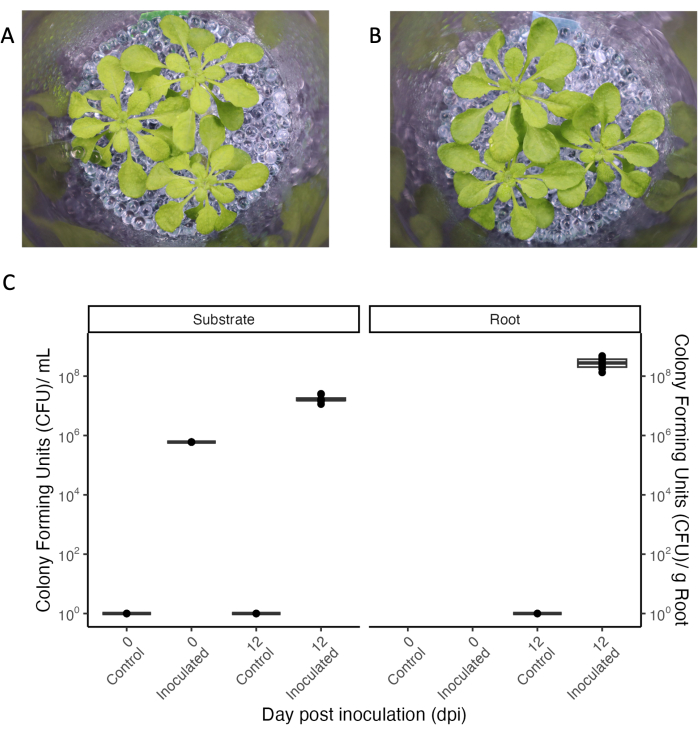
図5:シ ロイヌナズナ Col-0(33日齢)を短日条件で増殖させたもの。 (A)無菌セットアップで、または(B)共生細菌のコンソーシアムを12日間接種します。(C)増殖基質(左)および根(右)の無菌(対照)および接種瓶用のコロニー形成ユニット。無菌対照条件ではN = 4瓶、接種条件ではn = 8瓶。 この図の拡大版をご覧になるには、ここをクリックしてください。
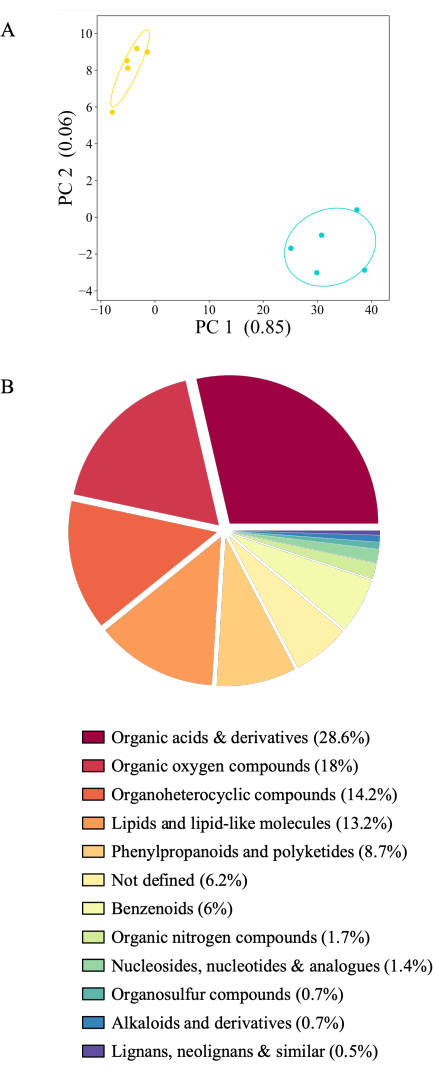
図6:21日齢の A. thaliana Col-0の明確な根滲出液プロファイル。 滲出液を滅菌 20 mM 酢酸アンモニウム(pH 5.7)で 2 時間回収し、続いて滅菌ろ過脱イオン水で 2 時間回収しました。代謝物は、直接注入を用いた質量分析によって検出しました。(A)バックグラウンドレベル以上で検出された 436 の代謝物の主成分分析(植物のある瓶と植物のない瓶の比較)。PC: 分散量が説明された主成分。青:水で採取した滲出液、黄色:酢酸アンモニウムで採取した滲出液。(B)実験条件(テューキー検定)で有意に異なる416の代謝物の円グラフを、スーパークラス(https://cfb.fiehnlab.ucdavis.edu/)に従って色付けした。 この図の拡大版をご覧になるには、ここをクリックしてください。
| 種 | 種子の準備 | 70%エタノール中での時間(分) | 次亜塩素酸ナトリウム(NaClO)濃度(v/v %漂白剤) | 漂白剤の時間(分) | ||
| シロイヌナズナ | 15 | 何一つ;100%エタノール | 15 | |||
| ブラキポディウム・ディスタキオン* | 殻剥き | 0.5 | 6 | 5 | ||
| メディカゴ・トルンカチュラ*a | 30 | 6 | 30 | |||
| Solanum lycopersicum(ナス・リコペルシカム)* | 0.5 | 6 | 5 | |||
| ソルガムバイカラー* | 殻剥き | 0.5 | 6 | 30 | ||
| Triticum aestivum(トリティクム・アエスチバム)* | 殻剥き | 0.5 | 12 | 20 | ||
表1:複数種の表面種子滅菌方法。*エタノールと漂白剤の間と最後にろ過された脱イオン水で4〜5回洗浄します。漂白後3〜6時間インキュベートし、30分ごとにろ過された脱イオン水と交換します。
| 種 | 瓶までの日 | 工場数 |
| ブラキポディウム・ディスタキオン | 4 から 5 | 3 |
| ソルガムバイカラー | 4 から 5 | 3 |
| Triticumのaestivum | 4 から 5 | 2 |
| メディカゴ・トルンカチュラ | 5 から 6 | 3 |
| Solanum lycopersicum(ナス・リコペルシクム) | 7 から 8 | 3 |
| シロイヌナズナ | 17 | 3 から 5 |
表2:さまざまな植物種の瓶に移すための苗木の年齢(日数)と瓶あたりの植物の数。
ディスカッション
ここで紹介する実験システムは、ガラス瓶とガラスビーズに基づいているため、さまざまな状況で根の滲出を研究するためのシンプルでメンテナンスの少ない、用途の広い半水耕栽培システムを提供します。これは、さまざまな植物種の滲出プロファイル25、さまざまな生育条件に対する滲出の応答25、および滲出に対する土壌の物理化学的特性の影響を調査する研究に使用されています22。このシステムは、数週間から数ヶ月の長期生育期間でここでテストされたすべての植物種に適しています。無菌状態の維持は簡単で、細菌の接種も簡単で、細菌は分析された2週間の増殖期間にわたって持続します。したがって、この実験システムは、無菌状態で根の滲出液の制御された収集を可能にするだけでなく、植物と微生物の相互作用の研究にも使用できます。さらに、植物成長培地を変化させて、さまざまな栄養素レベルに対する代謝反応を研究したり、光条件を適応させたり、さまざまなサイズの瓶を使用したりして、成長期間を調整することができます。
水耕栽培または半水耕栽培条件での根滲出液の研究は、主に低濃度代謝産物の分解能の向上により、現場では標準的なままです11。多くの水耕栽培アプローチは、ペトリ皿、マルチウェルプレート、またはその他の小さな容器に依存しており、無菌性とハイスループットを可能にしますが、実験は高湿度環境で栽培された小さな植物や苗に限定されています17,18,26,27。提示されたガラス瓶のセットアップでは、比較的大きな瓶によって十分なヘッドスペースが提供され、成長期間を延長することができます。マイクロポアテープストライプは、無菌性を維持しながら空気交換を確保します。したがって、大麦やトウモロコシなどの背の高い単子葉植物でさえ、ガラス瓶のセットアップで数週間育てることができます。A. thalianaやクローバーなどの小さな植物は、栄養段階と生殖段階を含め、発芽後4〜5週間研究できます。
代わりとなるhydroponicセットアップはより大きい植物のためにまた利用できるが、これらは頻繁に網、泡板および植物サポート15,28,29,30のための着木のバスケットからなされる顧客用箱そして入口を要求する。さらに、これらの機器は通常、無菌状態に設定されていないか、微生物や化学物質の汚染から守るために困難なセットアップとメンテナンス手順が必要です。提示された実験システムにおける無菌性のセットアップと維持は簡単です。さらに、瓶やビーズにガラスを使用することで、プラスチックから浸出する汚染物質の存在を減らし、簡単に洗浄して再利用できるため、資源を節約できます。
ガラスビーズは、土壌粒子を模倣するために以前に適用されました。それらは、滲出トラップ31または他の半水耕栽培システム19などの根滲出サンプリング装置において自然な根の発達を誘導する。ガラス瓶のセットアップは、この開発を利用して、ビーズを微生物のコロニー形成面として導入します。土壌中では、植物の根の周りのマイクロバイオームは、空気や水で満たされたコンパクトな粒子と空間を持つ半固体環境で進化します。ガラス瓶のセットアップには、下部液相が最適な酸素レベルを含まない可能性が高いため、増殖培地の積極的な曝気は含まれていませんが、ビーズの体積が大きく、培地の体積が小さい場合、微生物が酸素条件下で増殖できる、湿度が高く、通気された上相が作成されます。他の人は、水耕栽培システムにおける空気供給を維持するために、成長容器26,28を振るか、またはエアポンプ19,29に結合されたチューブを使用することを提案している。しかし、これらのシステムは無菌ではないか、無菌性を維持するために特殊な材料と絶え間ない監視を必要とします。さらに、振盪の場合は、芽が成長液に浸かったり、根系に損傷を与えたりしないように細心の注意を払ってください。それにもかかわらず、必要に応じて、提示された実験セットアップを曝気のための追加の材料で適合させることができます。
代謝を研究するすべての植物と微生物の相互作用研究で考慮すべき重要な側面は、微生物が植物由来の化合物を分解し、それ自体で代謝産物を生成することです。特殊な無菌実験装置がなければ、植物由来の代謝物と微生物由来の代謝物を区別することはできません。微生物の活動を阻害し、植物由来の化合物を濃縮するために、Oburgerらは、根の滲出液サンプリング溶液を化学的に滅菌して細菌の分解を阻害することを提案した32。化学的阻害剤の効果は、阻害剤の有無にかかわらず処理された無菌植物と非無菌植物の滲出プロファイルを比較して、提示された実験系で研究することができました。
提示されたガラス瓶のセットアップの主な制限は、成長条件が土壌と比較して非常に人工的なままであることです。土壌で栽培された植物からの滲出液は、多くの場合、溶媒フロースルーが成長容器の基部に集められる浸透システム13、または植物が最初に土壌で栽培され、次に水耕栽培条件に移される土壌水耕栽培ハイブリッドシステムのいずれかから収集されます16,33。ガラス瓶のセットアップとは対照的に、これらの手順は通常破壊的であり、成長する環境が変化する中で時間の経過とともに複数の収集を行うことはできません。さらに、浸透システムでは、土壌バックグラウンドが滲出液とともにサンプリングされますが、土壌水耕ハイブリッドシステムでは、高い土壌代謝バックグラウンドの問題は、滲出液収集のための水耕栽培条件への移行で回避されます。傷ついた根11を介した代謝産物の漏出を減らすために回復時間が実施されているが、植物の転移は非常に破壊的であり、創傷は持続する可能性が高く、植物の代謝は水耕栽培条件への転移に応答して変化する可能性がある。さらに、多くの場合、浸透圧ショックは、植物を適切な成長溶液の代わりに水に移すことによって誘発される16,33。提示されたプロトコルでは、増殖溶液を等モル溶液と交換して浸透圧バランスを維持しながら、短い定義された時間枠内で滲出液を捕捉できるようにします。成長の解決の変更は多くの出版された調査の共通の方法であり、根の傷12,16,26,34なしで水耕栽培の組み立てで容易に達成することができる。その汎用性により、提示された実験システムは、例えば、固体土壌粒子の存在の有無にかかわらず、無菌または非無菌土壌抽出物を成長溶液として使用することにより、より自然な条件を模倣するように容易に適合させることができる。自然条件への漸進的な変化により、さまざまな物理化学的土壌特性と微生物の存在が植物の代謝と生理学に与える影響を研究することができます。科学界がさまざまな環境での滲出液を十分に理解する前に、土壌ベースのシステムと水耕栽培システムの両方に利点と制限があるため、並行して採用することが望ましいです13。
結論として、提示された半水耕栽培のガラスベースの実験セットアップは、そのシンプルさとアプリケーションの高い汎用性が組み合わされているため、際立っています。これは、無菌状態で、または微生物や植物と微生物の相互作用と組み合わせて、滲出液を収集して研究するためのアクセス可能で低コストの方法を提供します。
開示事項
著者には開示すべき利益相反はありません。
謝辞
スイス連邦工科大学チューリッヒ校のNicola Zamboni教授とUwe Sauer教授には、直接注射による根の滲出プロファイルを決定し、バーゼル大学のKlaus Schläppi教授には、 A. thaliana 共生細菌について感謝します。さらに、スイス国立科学財団PR00P3_185831(S.M.、A.S.、E.M.S.を支援)およびPSC-Syngenta Fellowshipプログラム(Klaus Schläppi教授に付与され、J.S.はC.J.を支援)に感謝します。
資料
| Name | Company | Catalog Number | Comments |
| Agar powder for bacteriology | VWR | 20767.298 | |
| Aluminum foil | FORA GmbH | ||
| Ammonium acetate | Sigma-Aldrich | 32301-1KG | ACS reagent, Eur >- 98% |
| Autoclave VX-150 | Systec | 1150 | |
| Balance | Sartorius | QUINTIX64-1S | |
| Centrifuge | Hermle Labortechnik GmbH | 305.00 V05 | |
| Cuvettes | Greiner Bio-One | 613101 | |
| Difco LB Broth, Lennox | BD | 240210 | |
| Ethanol | Reuss-Chemie AG | RC-A15-A-005L | |
| Filtered deionized water | Merck Millipore | Milli-Q IQ7000 | |
| Glass beads | Carl Roth | HH56.1 | 5 mm |
| Hydrochloric acid | Merk | 1.00317.1000 | |
| Inoculation loop | Karl Hammacher GmbH | HWO_070-21 | |
| Jars | Weck | 105741 | 850 mL |
| Lyophilizer | Christ | Alpha 2-4 LSCplus | |
| Magnesium chloride hexahydrate | Carl Roth | 2189.1 | |
| Matrix Orbital thermoshaker | IKA | 10006248 | |
| Microcentrifuge tube | Sarstedt AG & Co. KG | 72.695.500 | SafeSeal reaction tube, 2 mL, PP |
| Micropore tape | 3M | 1530-0 | 1.25 cm x 9.1 m |
| Micropore tape | 3M | 1530-1 | 2.5 cm x 9.1 m |
| Murashige & Skoog Medium (MS) | Duchefa Biochemie | M0221.0050 | |
| Growth chamber | Percival | SE41-TLCU4 | 16 hour light/8 dark. 22 °C day/18 night |
| Phyto agar | Duchefa Biochemie | P1003.1000 | |
| Potassium hydroxide | Sigma-Aldrich | 8.14353.0100 | |
| SmartSpec Plus Spectrophotometer | Bio-Rad | 170-2525 | |
| Sodium hypochlorite solution, 12% Cl | Carl Roth | 9062.4 | |
| Square petri dish | Greiner Bio-One | 688102 | 120x120x17 mm, with vents |
| Stericup Quick release | Millipore | S2GPU05RE | 0.22 µm PES, 500 mL |
| Sterile bench | FASTER S.r.l. | FlowFast H 18 |
参考文献
- Sasse, J., Martinoia, E., Northen, T. Feed your friends: do plant exudates shape the root microbiome. Trends in Plant Science. 23 (1), 25-41 (2018).
- Lundberg, D. S., et al. Defining the core Arabidopsis thaliana root microbiome. Nature. 488 (7409), 86-90 (2012).
- Lopez, J. L., et al. Growth rate is a dominant factor predicting the rhizosphere effect. The ISME Journal. 17 (9), 1396-1405 (2023).
- Hu, L., et al. Root exudate metabolites drive plant-soil feedbacks on growth and defense by shaping the rhizosphere microbiota. Nature Communications. 9 (1), 2738(2018).
- Edwards, J., et al. Structure, variation, and assembly of the root-associated microbiomes of rice. Proceedings of the National Academy of Sciences. 112 (8), 911-920 (2015).
- Bulgarelli, D., et al. Structure and function of the bacterial root microbiota in wild and domesticated barley. Cell Host Microbe. 17 (3), 392-403 (2015).
- Li, J., Wang, J., Liu, H., Macdonald, C. A., Singh, B. K. Application of microbial inoculants significantly enhances crop productivity: A meta-analysis of studies from 2010 to 2020. Journal of Sustainable Agriculture and Environment. 1 (3), 216-225 (2022).
- Escudero-Martinez, C., Bulgarelli, D. Engineering the crop microbiota through host genetics. Annual Review of Phytopathology. 61, 257-277 (2023).
- Poppeliers, S. W., Sanchez-Gil, J. J., de Jonge, R. Microbes to support plant health: understanding bioinoculant success in complex conditions. Current Opinion in Microbiology. 73, 102286(2023).
- O'Callaghan, M., Ballard, R. A., Wright, D. Soil microbial inoculants for sustainable agriculture: Limitations and opportunities. Soil Use and Management. 38 (3), 1340-1369 (2022).
- Oburger, E., Jones, D. L. Sampling root exudates - Mission impossible. Rhizosphere. 6, 116-133 (2018).
- Yuan, J., et al. Root exudates drive the soil-borne legacy of aboveground pathogen infection. Microbiome. 6 (1), 156(2018).
- Vismans, G., et al. Coumarin biosynthesis genes are required after foliar pathogen infection for the creation of a microbial soil-borne legacy that primes plants for SA-dependent defenses. Scientific Reports. 12 (1), 22473(2022).
- Strehmel, N., Böttcher, C., Schmidt, S., Scheel, D. Profiling of secondary metabolites in root exudates of Arabidopsis thaliana. Phytochemistry. 108, 35-46 (2014).
- Song, Y., Pieterse, C. M. J., Bakker, P., Berendsen, R. L. Collection of sterile root exudates from foliar pathogen-inoculated plants. Methods in Molecular Biology. 2232, 305-317 (2021).
- Oburger, E., et al. A quick and simple spectrophotometric method to determine total carbon concentrations in root exudate samples of grass species. Plant Soil. 478 (1-2), 273-281 (2022).
- Koprivova, A., et al. Root-specific camalexin biosynthesis controls the plant growth-promoting effects of multiple bacterial strains. Proceedings of the National Academy of Sciences of the United States of America. 116 (31), 15735-15744 (2019).
- Gao, J., et al. Ecosystem fabrication (EcoFAB) protocols for the construction of laboratory ecosystems designed to study plant-microbe interactions. Journal of Visualized Experiments. (134), e57170(2018).
- Lopez-Guerrero, M. G., et al. A glass bead semi-hydroponic system for intact maize root exudate analysis and phenotyping. Plant Methods. 18 (1), 25(2022).
- Boeuf-Tremblay, V., Plantureux, S., Guckert, A. Influence of mechanical impedance on root exudation of maize seedlings at two development stages. Plant and Soil. 172, 279-287 (1995).
- Groleau-Renaud, V., Plantureux, S., Guckert, A. Influence of plant morphology on root exudation of maize subjected to mechanical impedance in hydroponic conditions. Plant and Soil. 201, 231-239 (1998).
- Sasse, J., et al. Root morphology and exudate availability are shaped by particle size and chemistry in Brachypodium distachyon. Plant Direct. 4 (7), 00207(2020).
- Katagiri, F., Thilmony, R., He, S. Y. The Arabidopsis thaliana-Pseudomonas syringae interaction. Arabidopsis Book. 1, 0039(2002).
- Monchgesang, S., et al. Natural variation of root exudates in Arabidopsis thaliana-linking metabolomic and genomic data. Scientific Reports. 6, 29033(2016).
- McLaughlin, S., Zhalnina, K., Kosina, S., Northen, T. R., Sasse, J. The core metabolome and root exudation dynamics of three phylogenetically distinct plant species. Nature Communications. 14 (1), 1649(2023).
- Badri, D. V., Chaparro, J. M., Zhang, R., Shen, Q., Vivanco, J. M. Application of natural blends of phytochemicals derived from the root exudates of Arabidopsis to the soil reveal that phenolic-related compounds predominantly modulate the soil microbiome. Journal of Biological Chemistry. 288 (7), 4502-4512 (2013).
- Massalha, H., Korenblum, E., Malitsky, S., Shapiro, O. H., Aharoni, A. Live imaging of root-bacteria interactions in a microfluidics setup. Proceedings of the National Academy of Sciences of the United States of America. 114 (17), 4549-4554 (2017).
- Nathoo, N., Bernards, M. A., MacDonald, J., Yuan, Z. C. A hydroponic co-cultivation system for simultaneous and systematic analysis of plant/microbe molecular interactions and signaling. Journal of Visualized Experiments. (125), e55955(2017).
- Nguyen, N. T., McInturf, S. A., Mendoza-Cozatl, D. G. Hydroponics: a versatile system to study nutrient allocation and plant responses to nutrient availability and exposure to toxic elements. Journal of Visualized Experiments. (113), e54317(2016).
- Yi, Y., Li, Z., Kuipers, O. P. Plant-microbe interaction: transcriptional response of Bacillus Mycoides to potato root exudates. Journal of Visualized Experiments. (137), e57606(2018).
- Phillips, R. P., Erlitz, Y., Bier, R., Bernhardt, E. S. New approach for capturing soluble root exudates in forest soils. Functional Ecology. 22 (6), 990-999 (2008).
- Oburger, E., et al. Root exudation of phytosiderophores from soil-grown wheat. New Phytologist. 203 (4), 1161-1174 (2014).
- Neal, A. L., Ahmad, S., Gordon-Weeks, R., Ton, J. Benzoxazinoids in root exudates of maize attract Pseudomonas putida to the rhizosphere. PLoS One. 7 (4), e35498(2012).
- Miao, Y., et al. Exogenous salicylic acid alleviates salt stress by improving leaf photosynthesis and root system architecture in cucumber seedlings. Scientia Horticulturae. 272, 109577(2020).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved